-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Analýza povrchu magnetických mikročástic prostřednictvím mikroskopie atomárních sil
Analysis of magnetic micro particles surface using the atomic force microscopy
Although the magnetic nano and micro particles are studied since seventies, they have gained significant attention in biochemical and medicine applications in last ten years. The main benefit of use magnetic particles lies in spatial manipulation through external magnetic field and selective surface modification of large surface area. Our study is focused on microscopic analysis of four magnetic carriers used for DNA isolation visualised by atomic force microscopy and optical microscopy. Based on our results was approved rough and porous particle surface and determined the particle size distribution. The AFM imaging of DNA adsorbed on rough surface of magnetic carrier is discussed.
Keywords:
magnetic porous glass particles, atomic force microscopy, magnetic microspheres
Autoři: Hana Zapletalová 1; Klára Pížová 1; Jakub Malohlava 1; Milan Vůjtek 2; Hana Kolářová 1
Působiště autorů: Ústav lékařské biofyziky, Lékařská fakulta, Univerzita Palackého v Olomouci, ČR 1; Katedra experimentální fyziky, Přírodovědecká fakulta, Univerzita Palackého v Olomouci, ČR 2
Vyšlo v časopise: Lékař a technika - Clinician and Technology No. 2, 2014, 44, 34-41
Kategorie: Původní práce
Souhrn
Přesto, že se magnetické mikročástice začaly zkoumat již od 70ých let 20. století, hromadného rozšíření v nejrůznějších biochemických i lékařských aplikacích dosáhly zejména v posledním desetiletí. Hlavní výhodou použití těchto částic v laboratorní praxi je snadná manipulace prostřednictvím vnějších magnetických polí a možnost selektivní modifikace žádoucí funkční skupinou jejich relativně velkého povrchu. Tato studie analyzuje velikost a povrch čtyř odlišných typů magnetických mikročástic používaných k selektivní izolaci bakteriální DNA z reálných vzorků. Zkoumané částice byly zobrazeny mikroskopem atomárních sil a optickým mikroskopem. Z analyzovaných AFM snímků magnetických nosičů vyplynulo, že všechny čtyři nosiče vykazují značně nerovný povrch, hodnocena byla také distribuce velikosti studovaných částic. Diskutována je možnost AFM zobrazení adsorbované DNA na značně nerovném povrchu magnetického nosiče.
Klíčová slova:
magnetické porézní skleněné částice, mikroskopie atomárních sil, magnetické nosičeÚvod
Využití magnetických mikro či nano částic se v posledních deseti letech značně rozšířilo do běžné praxe v různých biologických disciplínách, jako jsou biotechnologie, environmentální technologie či analytické aplikace.
Široké uplatnění nacházejí magnetické částice v lékařství, například v roli kontrastní či značící látky při zobrazení tkání magnetickou rezonancí [1, 2], jako nosiče pro cílený transport léčiv [3, 4], při magnetofekci v roli nosiče DNA v genové terapii [5,6], či jako zdroje tepla při cílené terapii nádorů hypertermií [4, 7-9]. Zapojení magnetických částic ve vývoji nových biosenzorů, ať už biokatalytických nebo bioafinitních [10-14], je velkou výzvou v rozvoji nových analytic-kých a diagnostických metod.
Mezi nejrozšířenější in vitro aplikace v biotechnologiích a biomedicíně patří izolace nukleových kyselin (DNA/RNA) ze složitých biologických systémů, jako jsou buněčné suspenze, homogenáty a fermentační média [15-18], selektivní izolace vybraných proteinů [19, 20], mikroorganismů, buněčných organel či celých buněk [21].
Princip jednoduché a rychlé separace či směrování v médiích spočívá v navázání cílové složky ze vzorku na magnetický nosič, který je po vhodné inkubační době ze vzorku separován společně s cílovou složkou pomocí vnějšího magnetického pole.
Magnetické nosiče musí být chemicky stabilní při různých hodnotách pH, vykazovat minimální agregaci a být biokompatibilní, jsou-li dále určeny pro lékařské účely. Měly by obsahovat vysoký obsah magnetického plniva, které je superparamagnetické a není toxické.
Právě unikátní magnetické vlastnosti magnetických nosičů pak spolu s možností vazby nejrůznějších biologicky aktivních látek na relativně velký povrch částice, řádově 100 m2 až 1000 m2/g u částic s mikroporézním povrchem a póry pod 2 nm, umožňují efektivní vazbu a následnou selektivní separaci či transport působením vnějšího magnetického pole [18].
Magnetické mikročástice mají většinou charakter kompozitních materiálů, které jsou složeny z vlastní fero - nebo ferimagnetické složky zodpovědné za interakci s vnějším magnetickým polem (tzv. magnetické jádro) a složky diamagnetické, umožňující interakci s biologickým systémem, tvořeným nejčastěji z polymerních materiálů (tzv. obal).
Metody syntézy magnetických částic se zaměřují na přípravu práškových materiálů obsahujících mikročástice či nanočástice maghemitu, magnetitu, směsných oxidů železa nebo feritů, na přípravu tzv. magnetických kapalin a na syntézu magnetických částic přímo v prostředí obalového („bio“) polymerního materiálu. Obal magnetického nosiče slouží ke stabilizaci, dispergaci a funkcionalizaci povrchu nosiče, brání agregaci či precipitaci magnetických částic a minimalizuje nežádoucí interakce v biologickém prostředí. Konečná velikost a tvar distribuce velikosti syntetizovaných částic závisí na způsobu přípravy, reakční teplotě, pH, iontové síle, použitém obalovém materiálu apod. [22, 23].
Jednodoménové magnetické nanočástice však mohou syntetizovat také magnetotaktické bakterie, které produkují intracelulární krystaly magnetitu (Fe3O4), greigitu (Fe3S4) či pyrrhotitu (Fe7S8). Tyto biologicky syntetizované magnetické částice, magnetosomy, jsou v těle bakterie uspořádány do podélného řetězce (celkový magnetický moment cca. 1x10-15A.m2) a slouží bakteriím k orientaci v prostoru podél geomagnetického pole. Výhodou magnetosomů oproti laboratorně syntetizovaným jednodoménovým částicím je jejich velikost (cca 50 nm), úzká velikostní distribuce a přítomnost biokompatibilní lipidové membrány [24-26].
V současné době je dostupné široké spektrum ko-merčně dodávaných magnetických mikro a nanočástic, určených k MRI značení, separaci či značení buněk, organel a mikroorganismů a biologických molekul. Tím, že obal magnetického nosiče může nést funkční skupiny či specifické molekuly komplementárně intera-gující s biologickými funkčními molekulami (např. protilátky, afinitní ligandy, léčiva či značky) rozšiřuje se značně spektrum použití magnetických nosičů [18, 20-23, 27].
K imobilizaci méně častých ligandů je možno při-márně využít funkčních skupin exprimovaných na povrchu nosiče, a to v závislosti na typu obalového polymerního materiálu magnetického nosiče. Nejčastěji se jedná o následující skupiny – OH (silikagel, porézní borosilikátové sklo), – NH2 (např. silanizované částice), – COOH, apod.
Mezi největší dodavatele vyrábějící magnetické nosi-če patří Invitrogen (PureBiotech), Advacned Magnetics (USA) a Miltenyi Biotec (Německo) [28].
Praktická aplikace magnetických nosičů při izolaci genetického materiálu z komplexních vzorků (buněčná suspenze, homogenát, fermentační médium apod.) či přímo z hrubého lyzátu buněk je velmi jednoduchá a časově nenáročná. Princip separace spočívá v reverzibilní adsorpci nukleové kyseliny na povrch magnetického nosiče v přítomnosti vysoké koncentrace chaotropních činidel nebo PEG. S pomocí vnějšího magnetického pole vyvolaného silným magnetem, přiloženým ke stěně nádobky obsahující roztok s mag-netickými nosiči, dochází k efektivní a účinné separaci částic s navázanou DNA. Po separaci následuje promývací a eluční krok. Vzhledem k velké vizkozitě roztoku, v němž se odehrává adsorpce DNA na magnetický nosič, je žádoucí, aby magnetické částice nesly silné magnetické vlastnosti. Je zřejmé, že magne-tická separace zcela obchází použití centrifugy nebo porézní filtrace, čímž minimalizuje mechanický stres.
V našich experimentech byla studována povrchová topografie čtyř odlišných magnetických nosičů, dva komerčně dostupné nosiče pod označením MPG (magnetic porous glass, Invitrogen, resp. PurBiotech, USA) [29] a dva laboratorně syntetizované nosiče.
Materiál a metody
Magnetické nosiče
Každý ze studovaných nosičů vykazoval odlišné funkční skupiny na svém povrchu a reprezentoval tedy odlišný typ povrchové modifikace. Magnetické nosiče, jejichž polymerní obal je tvořen porézním borosilikátovým sklem a jádro superparamagnetickým oxidem železa, byly zakoupeny od firmy PurBiotech, a to ve dvou modifikacích: a) dále neupravené („uncoated“) magnetické nosiče s převažující -OH funkční skupinou exprimovanou na povrchu částic, MPG uncoated; a b) částice pokryté streptavidinem, MPG – STV coated.
Laboratorně připravené částice byly připraveny Ing. Danielem Horákem, CSc. (Ústav makromolekulární chemie AV ČR, Praha). Jednalo se o magnetické poly(glycidyl methakrylátové) mikročástice pokryté –COOH funkčními skupinami - PGMA-COOH (c) viz [30] a – magnetické poly(2-hydroxyethyl-co-glycidylmethakrylátové)mikročástice pokryté -NH2 funkčními skupinami - P(HEMA-GMA)-NH2(d).
Všechny zobrazované magnetické nosiče byly laboratorně ověřeny bioseparační metodou – izolací DNA z komplexních biologických vzorků [31].
Imobilizace studovaných magnetických nosičů
Jako substrát k uchycení magnetických nosičů byla použita krycí skla. Ta byla před nanesením agarózy očištěna inkubací v 10% HCl (P-lab, ČR), 2 x 5 min, následoval 2 x oplach deionizovanou vodou a sušení. Takto očištěná skla byla potažena 0,5% agarózou (Serva, Německo). Pro podporu zanoření magnetických částic do hladké agarózové vrstvy byl vlastní imobilizační krok podpořen neodymovým magnetem uchyceným na spodní straně krycího sklíčka, viz Obr. 1. Na krycí sklo potažené agarózou bylo napipetováno 20 μl suspenze magnetických nosičů o koncentraci 30 ng/ml (částice suspendované v deionizované vodě). Po inkubaci (5 min) následoval jemný oplach skla s částicemi (2x 1ml deionizované vody), poté byla skla nechána volně uschnout (RT). Měření mikroskopem atomárních sil (AFM) a zobrazení optickým mikroskopem proběhlo vždy týž den, jako příprava vzorků.
Obr. 1. Schéma zajištění imobilizačního kroku magnetických nosičů v agarové vrstvě neodymovým magnetem (tmavě modrá). 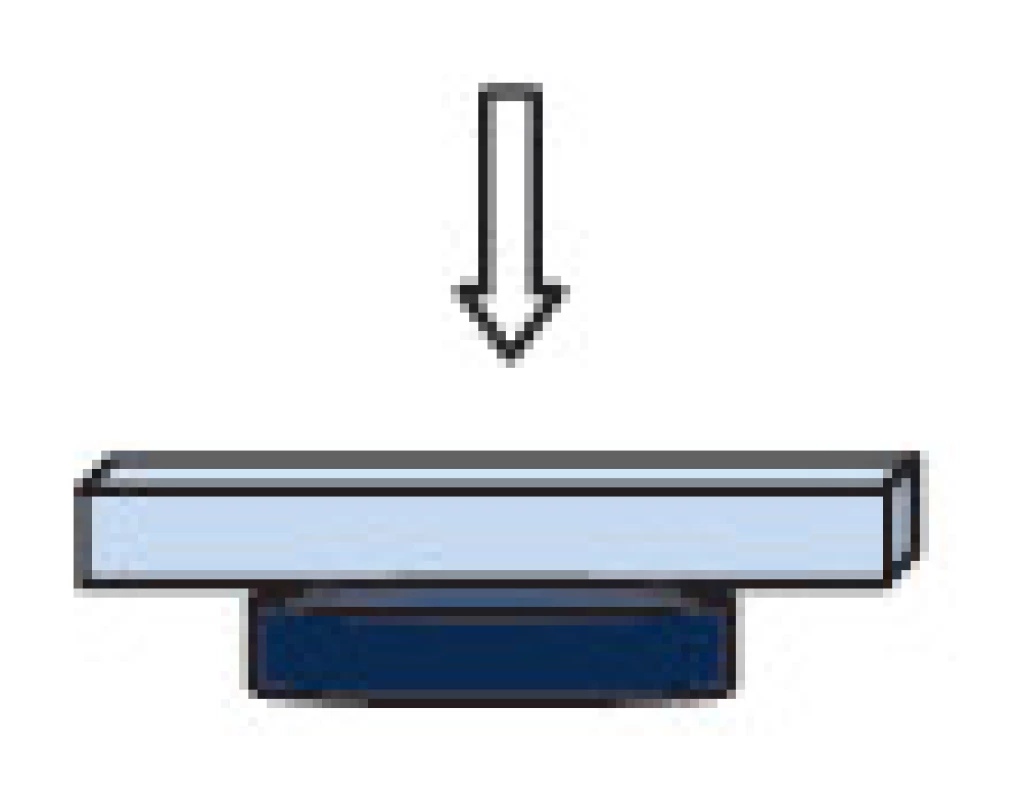
Lokace a analýza velikosti částic
K prvotní charakterizaci velikosti magnetických částic a jejich lokaci pro následné AFM měření byl použit inverzní optický mikroskop Olympus XI81 s DSU jednotkou (Olympus, Japonsko), propojený s AFM měřícím systémem, jak je zřejmé z Obr. 2. Protože optický mikroskop poskytuje pouze dvourozměrnou informaci, k rozlišení detailní povrchové struktury analyzovaných částic byl použit mikroskop atomárních sil Bioscope Catalyst (Bruker, USA).
Obr. 2. AFM nosník se skenujícím hrotem a zobrazovanými magnetickými nosiči, Olympus XI81, BF, zvětšení 600x, (a) MPG – STV coated, (b) částice PGMA-COOH. 
AFM zobrazení
Všechny AFM snímky magnetických nosičů uvedené v této studii byly nasnímány mikroskopem atomárních sil Bioscope Catalyst, v pracovním režimu Scan Asyst. Tento moderní AFM režim je založen na proměření takzvané F-d křivky (viz Obr. 3) v každém bodu rastru a následné rekonstrukci obrazu z naměřených topografických či elastických dat.
Obr. 3. F-d křivka sloužící k vyhodnocení optimální silové interakce mezi zobrazovaným vzorkem a zobrazujícím hrotem v ScanAsyst režimu. Osa X reprezentuje vzdálenost mezi hrotem a povrchem vzorku (Z [nm]), osa Y reprezentuje síly působící mezi hrotem a povrchem vzorku, resp. odchylku nosníku (defflection error δ [nm]. ![F-d křivka sloužící k vyhodnocení optimální silové interakce mezi zobrazovaným vzorkem a zobrazujícím hrotem v ScanAsyst režimu. Osa X reprezentuje vzdálenost mezi hrotem a povrchem vzorku (Z [nm]), osa Y reprezentuje síly působící mezi hrotem a povrchem vzorku, resp. odchylku nosníku (defflection error δ [nm].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/be7a244f778096c48d1f57f72655eb19.jpg)
Vyhodnocením F-d křivky a následnou aktualizací parametrů skenování v každém bodě rastru AFM systém umožňuje precizní kontrolu silových interakcí mezi zobrazujícím hrotem a zobrazovaným povrchem, a to v každém skenovaném bodě.
Použitím ScanAsyst pracovního režimu byla zajištěna minimalizace laterálního pohybu zkoumaného vzorku, vyvolaná působením skenujících sil v průběhu vlastního měření a znemožňující vlastní AFM měření.
Skenující sondou byl u všech měření hrot Scan Asyst (Bruker) s nominální konstantou tuhosti ~0,7 N/m, skenovací frekvence 1 kHz při rozlišení 512 pixelů. Všechny prezentované AFM snímky jsou proloženy rovinou druhého řádu bez dalších grafických úprav.
Analýza obrazu
K vyhodnocení distribuce velikosti studovaných magnetických nosičů byly vyhodnoceny snímky z optického mikroskopu Olympus XI81, a to v software excellence rt (Olympus, Japonsko).
Výsledky a diskuze
Distribuce velikosti analyzovaných částic
Graf 1. Distribuce velikosti studovaných porézních borosilikátových magnetických částic MPG, a) MPG – uncoated, b) MPG – STV coated. 
Graf 2. Distribuce velikosti syntetizovaných magne-tických nosičů, a) syntetizované PGMA-COOH částice, b) syntetizované P(HEMA-GMA)-NH<sub>2</sub>částice. 
Zjištěná distribuce velikosti studovaných částic je ve shodě s údaji dostupnými v literatuře [17, 22, 23, 29], viz Graf 1 a Graf 2. Pro komerční částice MPG je v manuálu výrobce uváděna nominální hodnota velikosti částice 5 μm, pro laboratorně syntetizované částice P(HEMA-GMA)-NH2 je uváděná nominální velikost částic 2,9 μm. Pro částice PGMA-COOH byla nezávislým měřením stanovena velikost částice 1,2 μm (nepublikovaná data, Daniel Horák, Ústav makromole-kulární chemie AV ČR). Nejširší distribuci velikosti vykazovaly komerční nosiče MPG a nejužší distribuci velikostí vykazovaly částice PGMA-COOH.
Právě jednotná velikost částic zajišťuje stejné fyzikální, chemické i biologické vlastnosti materiálu a je jedním z hlavních cílů syntézy magnetických nosičů.
AFM snímky zobrazovaných částic
Obr. 4. Trojrozměrné zobrazení AFM skenu magnetického nosiče MPG-uncoated zanořeného v agarové vrstvě. Z obrázku je zřejmé, že jde o topografii celé částice, režim zobrazení: výškový profil, skenovaná oblast 17x17μm<sup>2</sup>, Z – rozsah 1,8 μm. 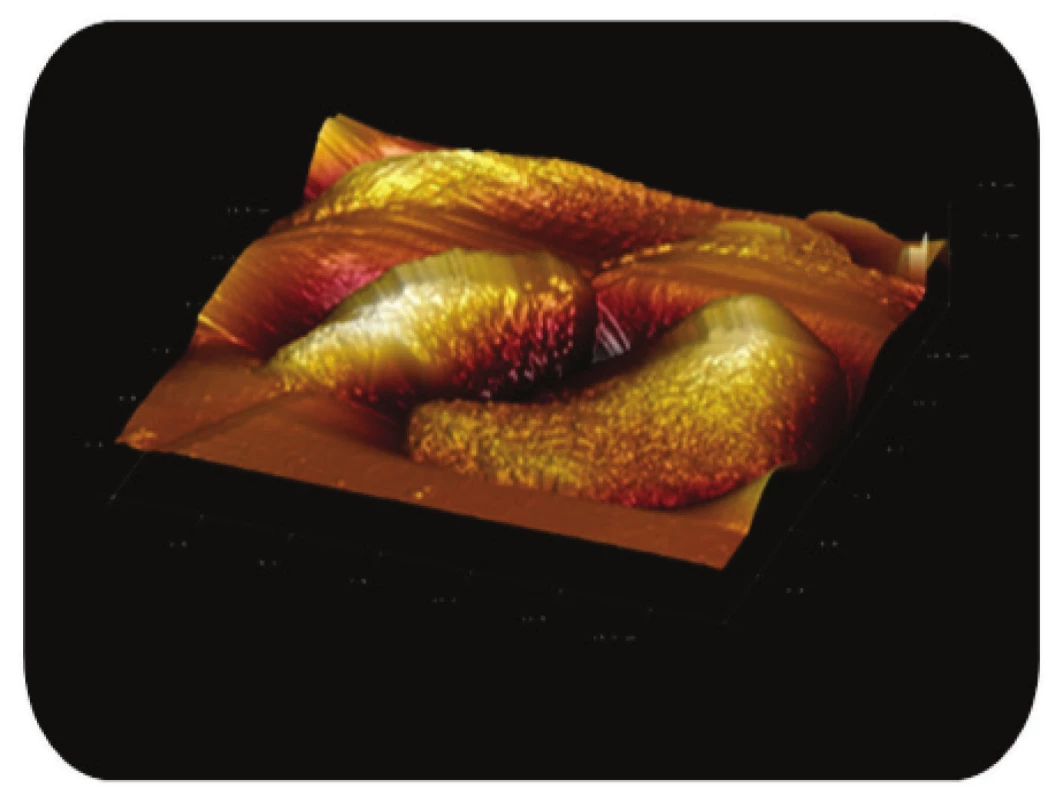
AFM snímky potvrdily nepravidelný tvar sféroidu u obou studovaných komerčních borosilikátových mag-netických nosičů (Obr. 4 a Obr. 6). Z detailního skenu povrchu nosiče je zřejmá výrazná členitost částicového povrchu (Obr. 5 a Obr. 7), která výrazně zvyšuje aktivní povrch částice.
Obr. 5. Trojrozměrné zobrazení AFM skenu detailu povrchu magnetického nosiče MPG-uncoated, režim zobrazení: výškový profil, skenovaná oblast 2x2 μm<sup>2</sup>, Z – rozsah 100 nm. 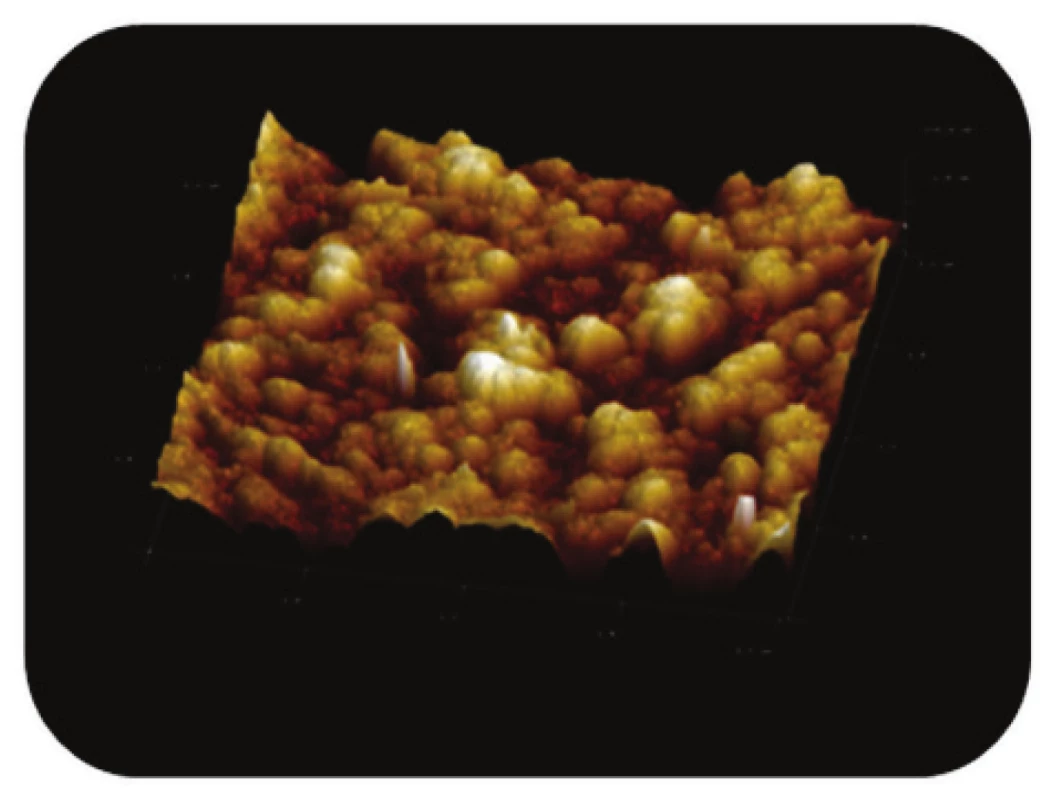
Obr. 6. Trojrozměrné zobrazení AFM skenu magne-tického nosiče MPG-STV-coated zanořeného v agarové vrstvě. Scan celé částice, režim zobrazení: výškový profil, skenovaná oblast 10x10 μm<sup>2</sup>, Z –rozsah 0,6 μm. 
Obr. 7. Trojrozměrné zobrazení AFM skenu detailu povrchu magnetického nosiče MPG – STV – coated, režim zobrazení: výškový profil, skenovaná oblast 2x2 μm<sup>2</sup>, Z – rozsah 80 nm. 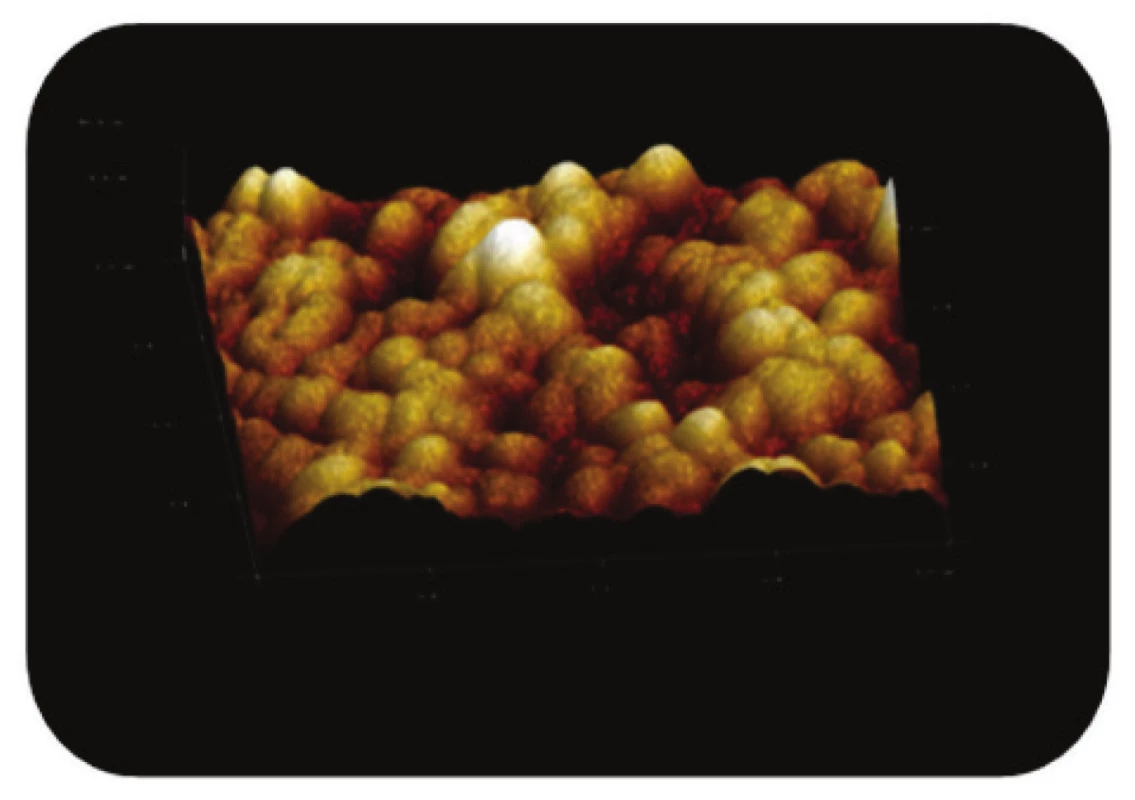
Na povrchu nemodifikovaných částic (Obr. 5) byly rozlišeny oblasti prohlubní a žlábků s nepravidelným tvarem a plochou cca 200 nm2 až 600 nm2. Obdobné závěry můžeme učinit i pro porézní magnetické nosiče modifikované streptavidinem (Obr. 6 a Obr. 7).
Z AFM snímků magnetických částic modifikovaných streptavidinem (Obr. 7) je taktéž zřejmá členitost povrchu nosiče, kdy výskyt žlábků a prohlubní zahrnuje plochy cca 300 nm2 až 600 nm2.
Syntetizované částice PGMA-COOH (Obr. 8 a Obr. 9), nesoucí na svém povrchu funkční skupiny – COOH, vykazovaly na AFM snímcích mnohem více symetrický, kulovitý tvar ve srovnání s komerčními magnetickými nosiči MPG. Z AFM snímků detailního povrchu částic (Obr. 9) je zřejmé, že jemný povrch částic PGMA-COOH je strukturován.
Obr. 8. Trojrozměrné zobrazení AFM skenu magnetického nosiče PGMA-COOH zanořeného v agarové vrstvě. Z obrázku je zřejmé, že jde o topografii celé částice, zobrazení: výškový profil, skenovaná oblast 8x8 μm<sup>2</sup>, Z-rozsah 1,1 μm. 
Obr. 9. Trojrozměrné zobrazení AFM skenu detailu povrchu magnetického nosiče PGMA-COOH, režim zobrazení: výškový profil, skenovaná oblast 0,5x0,5 μm<sup>2</sup>, Z-rozsah 14 nm. 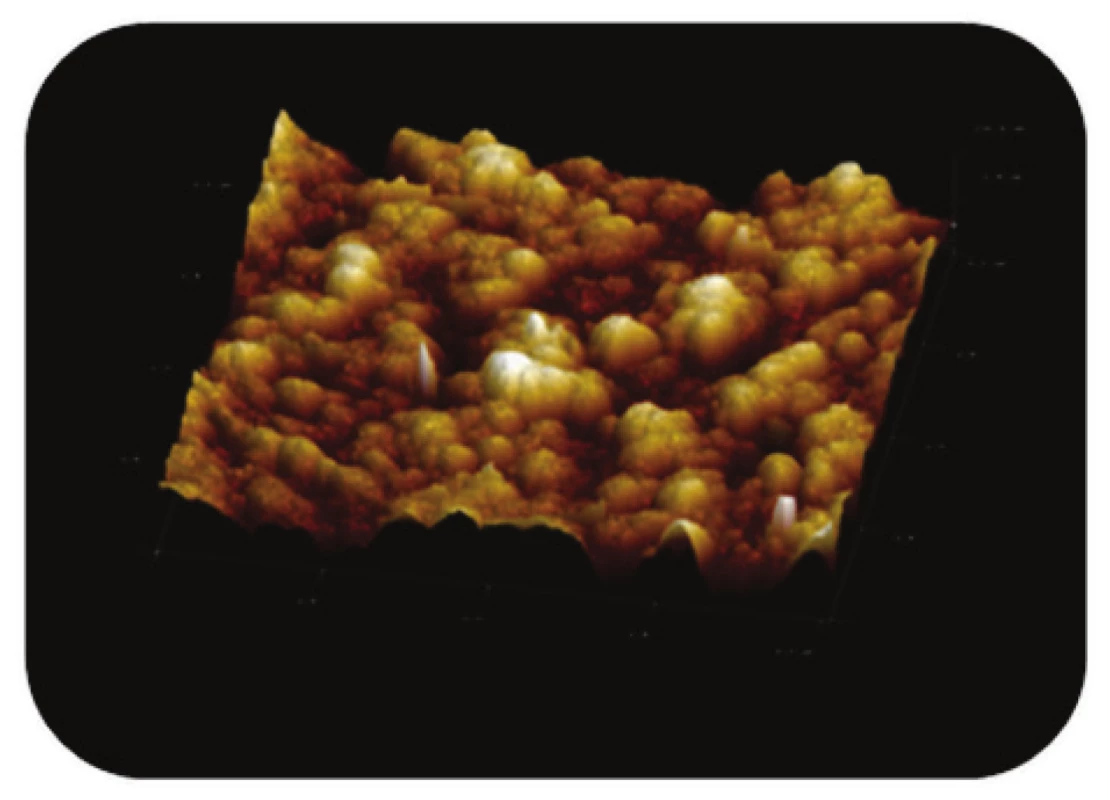
Poslední ze studovaných částic, P(HEMA-GMA)-NH2, připravená chemickou koprecipitací železnatých a železitých solí obalených v polymerní matrix, vykazovala na AFM snímcích převážně sférický tvar. Povrch těchto částic, nesoucích -NH2 funkční skupiny, byl však zřetelně méně členitý (Obr. 10 a Obr. 11).
Obr. 10. Trojrozměrné zobrazení AFM skenu magne-tického nosiče P(HEMA-GMA)-NH<sub>2</sub> zanořeného v aga-rové vrstvě. Z obrázku je zřejmé, že jde o topografii celé částice, zobrazení: výškový profil, skenovaná oblast 3,3x3,3 μm<sup>2</sup>, Z-rozsah 0,7 μm. 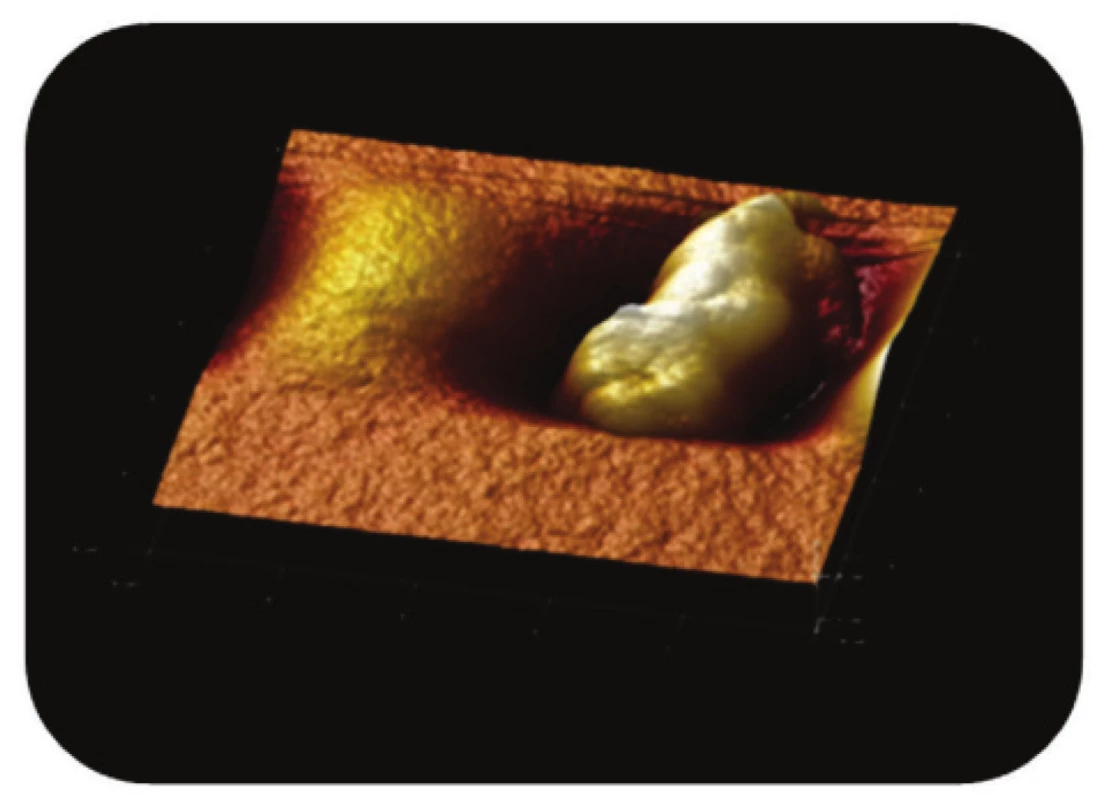
Obr. 11. Trojrozměrné zobrazení AFM skenu detailu povrchu magnetického nosiče P(HEMA-GMA)-NH<sub>2</sub>,režim zobrazení: výškový profil, skenovaná oblast 0,86x0,86 μm<sup>2</sup>, Z-rozsah 20 nm. 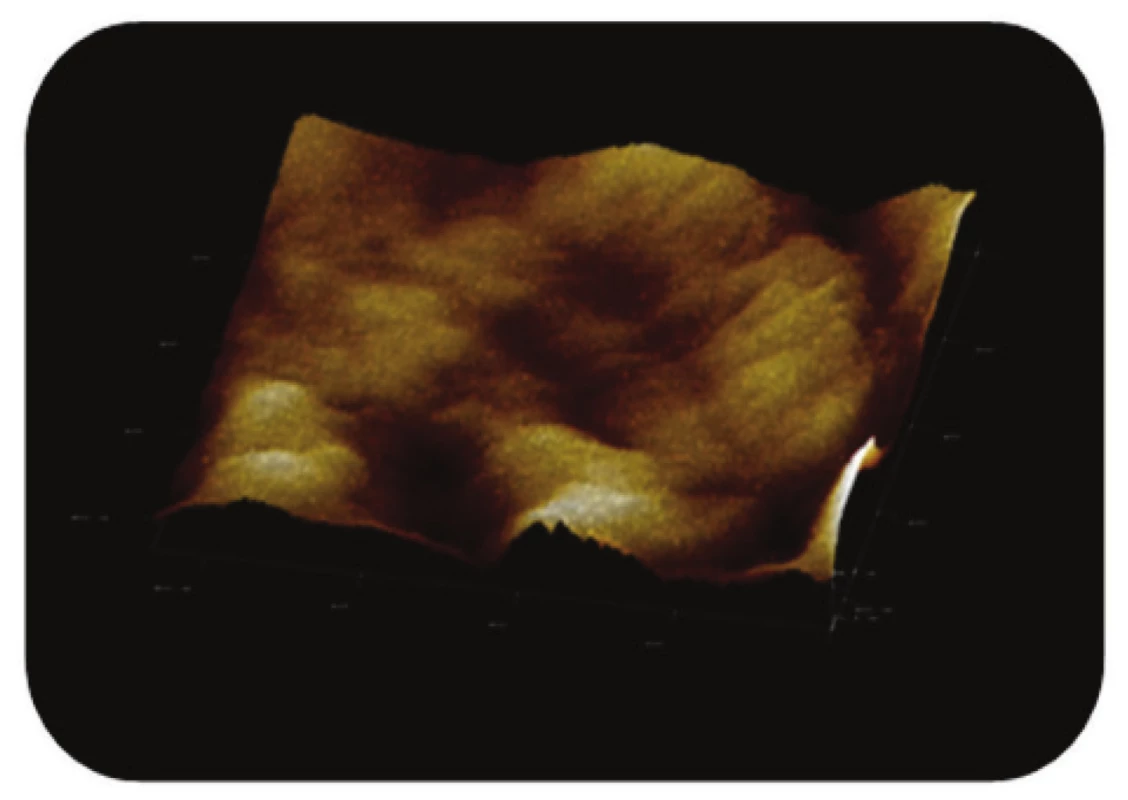
Vyhodnocení porozity a RMS studovaných magnetických nosičů
Většina materiálů vykazuje určitou porozitu, případně nerovnost povrchu. Ovlivňování porozity je významný úkol při výrobě např. katalyzátorů, průmyslových adsorbentů, atd. Navíc je porozita jedním z fak-torů, který ovlivňuje chemickou reaktivitu pevných látek a fyzikální interakci látek s plyny a tekutinami.
Porozita povrchu může být definována jako poměr objemu pórů a objemu vzorku. Mezinárodní společnos-tí pro čistou a užitou chemii (IUPAC) byly póry rozděleny dle své velikosti do tří skupin: 1. mikropóry < 2 nm, 2. Mezopóry v rozmezí 2-50 nm, 3. makropóry > 50 nm.
Protože AFM rozlišení bývá běžně stanoveno z nejjemnějších detailů rozlišených na zobrazované struktuře, byly vyvinuty jiné, objektivní parametry, kterými lze charakterizovat zkoumané povrchy. Jedním z nejčastěji používaných parametrů pro posouzení drstnosti povrchu je RMS, střední kvadratická hodnota odchylky vůči střední rovině v obrazu. Pomocí této statistické veličiny jsou běžně klasifikovány materiálové plochy např. k posouzení vhodnosti při uchycení biologických vzorků či při posouzení výškové homogennosti zobrazovaných povrchů. Je třeba zmínit, že hodnota RMS je ovlivněna geometrií hrotu, zejména poloměrem zakřivení a oblastí kontaktu ze vzorkem a geometrií výškových nerovností na povrchu vzorku.
Obr. 12. Trojrozměrné zobrazení jemného detailu povrchové struktury magnetického nosiče MPG – uncoated. Vložené měřítko odpovídá 50 nm. Skenovaná oblast 300x300 nm<sup>2</sup>, Z – rozsah 33 nm. 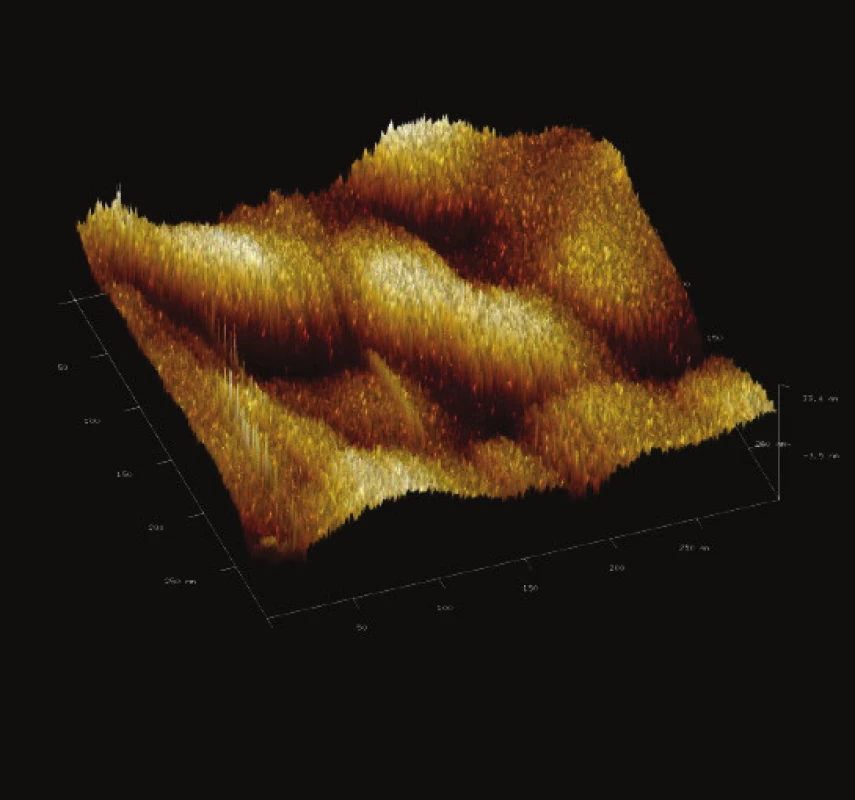
Obr. 13. 3-D zobrazení jemného detailu povrchové struktury magnetického nosiče MPG – STV coated. Vložené měřítko odpovídá 50 nm. Skenovaná oblast 500x500 nm<sup>2</sup>, Z – rozsah 27 nm. 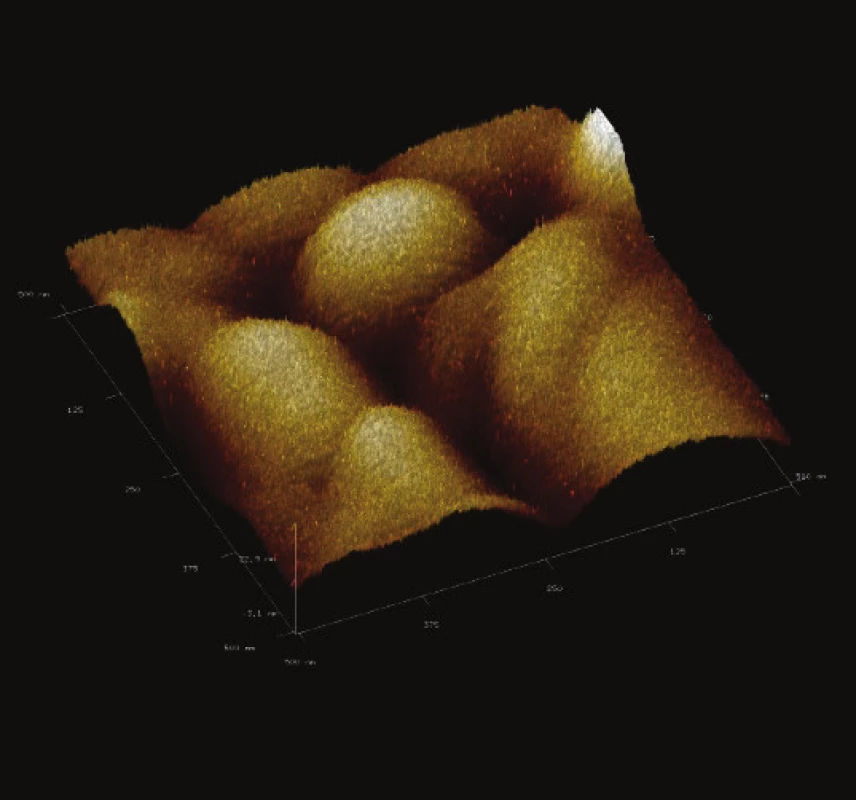
Z jemného detailu povrchu studovaných částic (Obr. 12 až Obr. 15) je zřejmá prostorová členitost povrchu všech studovaných magnetických nosičů. Dle IUPAC komerční nosiče vykazovaly porozitu druhé a třetí třídy. Tento údaj je ve shodě s údaji poskytnutými výrobcem, kdy uvedená nominální hodnota pórů je 50 nm [29].
Syntetizovaný magnetický nosič PGMA-COOH vy-kazoval převážně porozitu třetí třídy, tedy makropóry o průměru větším než 50 nm (Obr. 14 a Obr. 15). Syntetizovaný magnetický nosič P(HEMA-GMA)-NH2 vykazoval sice zvrásněný povrch, hloubka rýh a žlábků však byla menšího rozsahu než průměr vyvýšených oblastí.
Obr. 14. 3-D zobrazení jemného detailu povrchové struktury magnetického nosiče PGMA-COOH. Vložené měřítko odpovídá 100 nm. Skenovaná oblast 500x500 nm<sup>2</sup>, Z – rozsah 14 nm. 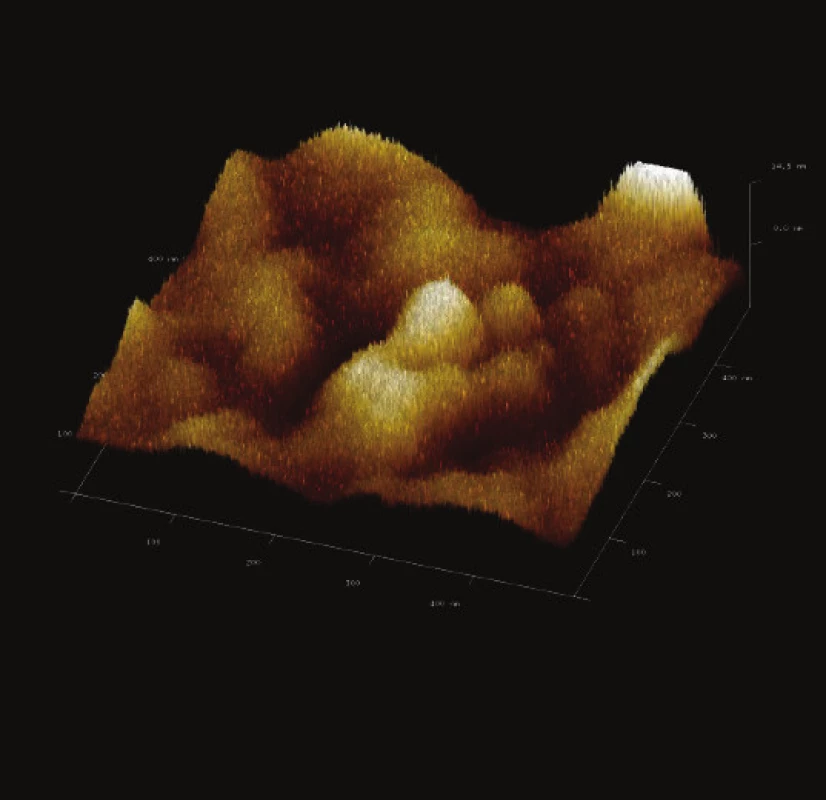
Obr. 15. 3-D zobrazení jemného detailu povrchové struktury magnetického nosiče P(HEMA-GMA)-NH<sub>2</sub>. Vložené měřítko odpovídá 100 nm. Skenovaná oblast 860x860 nm<sup>2</sup>, Z – rozsah 28 nm. 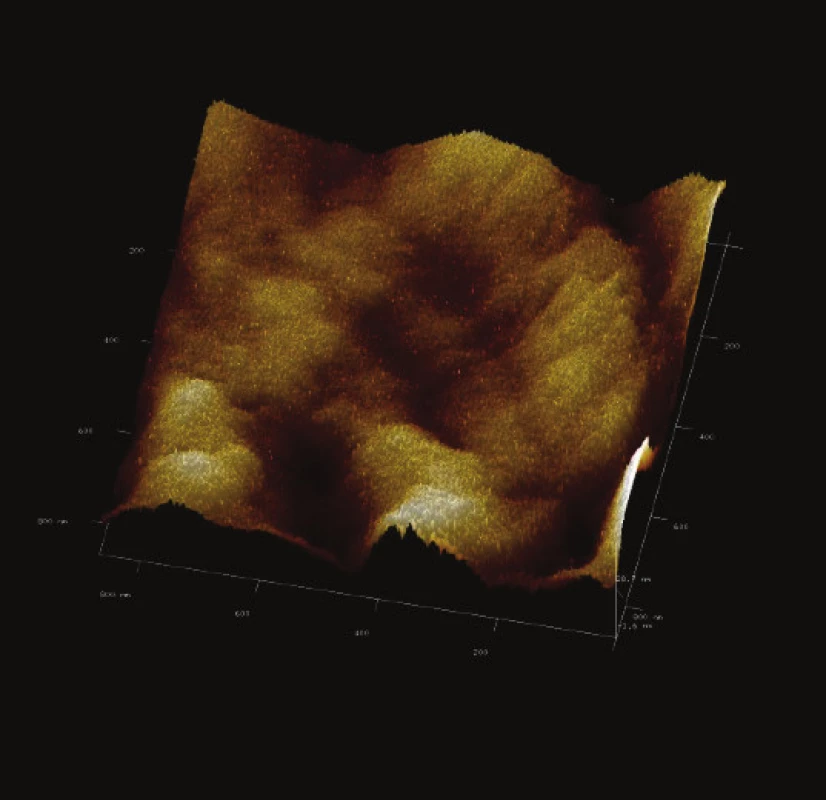
RMS částic zobrazených v této studii, vztažená k plo-še 50x50 nm2, vykazovala hodnoty (18,4 ± 6,2) nm pro MPG – uncoated a (17,2 ± 8,1) nm pro MPG – STV coated. Pro částice PGMA-COOH povrch částice vykazoval hodnoty RMS (7,2 ± 4,1) nm a pro částice P(HEMA-GMA)-NH2 (13,2 ± 6,1) nm (stanoveno pro deset nezávislých oblastí).
Závěr
Magnetické nosiče nacházejí uplatnění v mnoha oborech přírodních věd, při analytických aplikacích, v medicíně a biotechnologiích. Je zřejmé, že techniky založené na separaci magnetickými nosiči mají obrovský potenciál. Je tedy nutné hledat a rozvíjet nové možnosti syntéz magnetických nosičů tak, aby tyto pokryly současnou širokou a různorodou poptávku.
U nově syntetizovaných magnetických nosičů je nezbytné popsat nejen magnetické vlastnosti a toxicitu částic, ale i morfologii a detailní strukturu povrchu. Z tohoto důvodu je právě mikroskopie atomárních sil unikátním nástrojem, poskytujícím bohaté informace o detailní struktuře zkoumaných povrchů a přispívá tak kvalitativně k získání nových informací, nezbytných k charakterizaci nově vyvíjených nosičů.
V naší studii bylo prokázáno, že všechny studované nosiče vykazují značně nerovný povrch. Tento jev znemožňuje AFM zobrazení magnetického nosiče současně s adsorbovanou DNA tak, aby byla molekula DNA odlišena od pozadí tvořeného prostorově strukturovaným povrchem nosiče.
Lze předpokládat, že kombinace mikroskopie atomár-ních sil a simultánní optické fluorescenční mikroskopie by mohla tento problém obejít a rozlišit adsorbovanou DNA. Také AFM režim mapování elasticity, obecně pak plošné AFM snímání mechanických vlastností, může být jednou z dalších alternativ, jak prostřednictvím mikroskopie atomárních sil rozlišit adsorbované molekuly DNA na nerovném povrchu magnetického nosiče.
Je zřejmé, že mikroskopie atomárních sil je moderní mikroskopický nástroj s velmi bohatým a různorodým aplikačním potenciálem.
Poděkování
Autoři děkují Ing. D. Horákovi, CSc. (Ústav makro-molekulární chemie AV ČR, Praha) za poskytnutí magnetických částic, doc. RNDr. Španové, CSc. a doc. Ing. B. Rittichovi, CSc. (Ústav chemie potravin a bio technologií, Fakulta chemická, Vysoké učení technické v Brně) za cenné připomínky k rukopisu.
Tato práce byla podpořena projekty LF_2012_019, LF_2013_006 a Ústavem Molekulární a Translační Medicíny CZ.1.05/2.1.00/01.0030.
Mgr. Hana Zapletalová
Ústav lékařské biofyziky
Lékařská fakulta
Univerzita Palackého v Olomouci
Hněvotínská 3,CZ-775 15 Olomouc
E-mail: hana.zapletalova@upol.cz
Tel: +420 585 632 110
Zdroje
[1] Hartung, A., Lisy, M. R., Herrmann, H.-H., Hilger, I., Schuler, D., Clang C., Bellemann, M. E., Kaiser W. A., Reichenbach J. R., Labeling of macrophages using bacterial magnetosomes and their characterization by magnetic resonance imaging, Journal of Magnetism and Magnetic Materials, 311, vol. 2007, p. 454-459.
[2] Pankhurst, Q. A., Connoly, J., Jones, S. K. Applications of magnetic nanoparticles in biomedicine J Phys D, 36, 2003, p. 67-84.
[3] Babincova, M., Čičmanec, P., Altanerová, V., Altaner, Č., Babinec, P., AC-magnetic field controlled drug release from magnetoliposomes: design of a method for site specific chemotherapy, Bioelectrochemistry, vol. 55, 2002, p. 17-19.
[4] Bucak, S., Yavuztürk, B., Sezer, A. D., Magnetic Nanoparticles: Synthesis, Surface Modifications and Application in Drug Delivery, 7. Kapitola v knize: Recent Advances in Novel Drug Carrier System, ISBN 978-953-51-0810-8, p. 165-200.
[5] Schillinger, U., Brill, T., Rudolph, C., Huth, S., Gersting, S., Krötz, F., Hirschberger, J., Bergemann, C., Plank, C., Advances in magnetofection-magnetically guided nucleic acid delivery, Journal of Magnetism and Magnetic Materials, Volume 293, vol. 1, May 2005, p. 501-508.
[6] Plank, C., Zelphati, O., Mykhaylyk, O., Magnetically enhanced nucleic acid delivery. Ten years of magnetofection-Progress and prospects, Advanced Drug Delivery Reviews, vol. 63, 2011, p. 1300-1331.
[7] Hegrt, R., Dutz, S., Magnetic particle hypertherima – biophysical limitations of a visionary tumour therapy, Journal of magnetism and magnetic materials, 311, 2007, p. 187-192.
[8] Deatsch, A. E., Evans, B. A., Heating efficiency in magnetic nanoparticle hyperthermia, Journal of Magnetism and Magnetic Materials, vol. 354, 2014, p. 163-172.
[9] Cui, Z. G., Piao, J.-L., Rehman, M. U. R., Ogawa, R., Li, P., Zhao, Q. L., Kondo, T., Inadera, H., Molecular mechanisms of hyperthermia-induced apoptosis enhanced by withaferin A, European Journal of Pharmacology, vol. 723, 2014, p. 99-107.
[10] Xu, Y., Wang, E., Electrochemical biosensors based on magnetic micro/nano particles, Electrochimica Acta, vol. 84, 2012, p. 62-73.
[11] Horák D, Svobodová Z, Autebert J, Coudert B, Plichta Z, Královec K, Bílková Z, Viovy J. L., Albumin-coated monodisperse magnetic poly(glycidyl methacrylate) microspheres with immobilized antibodies: application to the capture of epithelial cancer cells. J biomed Mater res Part A 2012.
[12] Veiseh, O., Gunn, J. W., Zhang, M., Design and fabrication of magnetic nanoparticles for targeted drug delivery and imaging, Advanced Drug Delivery Reviews 62, 2010, p. 284-304.
[13] McBain, S. C., Yiu, H. HP., Dobson, J., Magnetic nanoparticles for gene and drug delivery, International Journal of Nanomedicine, 3 (2), 2008, p. 169-180.
[14] Wacker, R., Ceyhan, B., Alhorn, P., Schueler, D., Lang, C., Niemeyer, C. M., Imagneto Immuno-PCR: A novel immunoassay based on biogenic magnetosome nanoparticles, Biochemical and Biophysical Research Communications 357, 2007, p. 391-396.
[15] Borlido, L., Azevedo, A. M., Roque, A. C. A., Aires-Barros, M. R., Magnetic separations in biotechnology, Biotechnology Advances, vol. 31, 2013, p. 1374-1385.
[16] Rahman, M. M., Elaissari A., Nucleic acid sample preparation for in vitro molecular diagnosis: from conventional techniques to biotechnology, Drug Discovery Today, vol. 17, 2012, p. 1199-1207.
[17] Horák, D., Španová, A., Tvrdíková, J., Rittich, B., Streptavidin-modified magnetic poly(2-hydroethyl methacrylate-coglycidyl methacrylate) microspheres for selective isolation of bacterial DNA, European Polymer Journal 47, 2011, p. 1090-1096.
[18] Berensmeier, S., Magnetic particles for the separation and purification of nucleic acids, Appl. Microbiol. Biotechnol., 2006, vol 73, p. 495-504.
[19] Pamme, N., On-chip bioanalysis with magnetic particles, Current Opinion in Chemical Biology, vol. 16, 2012, p. 436–443.
[20] Šafařík, I, Šafaříková, M., Magnetic techniques for the isolation and purification of proteins and peptides, BioMagnetic Research and Technology, vol. 2, 2004, p. 1-17.
[21] Šafařı́k, I., Šafařı́ková, M., Use of magnetic techniques for the isolation of cells, Journal of Chromatography B: Biomedical Sciences and Applications, vol. 722, 1999, p. 33-53.
[22] Horák, D., Babič, M., Macková, H., Beneš, M. J. Preparation and properties of magnetic nano - and microsized articles for iological and environmental separations. J. Sep. Sci. vol. 30, 2007, p. 1751 – 1772.
[23] Laurent, S., Forge, D., Port, M., Roch, A., Robic, C., Vander, E. L, Muller, R. N., Magnetic iron oxide nanoparticles: synthesis, stabilization, vectorization, physicochemical characterizations, and biological applications, Chemical reviews, vol. 108, 2008, p. 2064-2110.
[24] Greene, S. E, Komeili A., Biogenesis and subcellular organization of the magnetosome organelles of magnetotactic bacteria, Current Opinion in Cell Biology, Volume 24, Issue 4, 2012, p. 490-495.
[25] Klem, M. T., Young, M., Douglas, T., Biomimetic magnetic nanoparticles, MaterialsToday, 2005, p. 28-37.
[26] Philipse, A. P., Maas, D., Magnetic Colloids from Magnetotactic Bacteria: Chain Formation and Colloidal Stability, Langmuir, 2002, p. 9977-9984.
[27] Ma Z., Liu H., Synthesis and surface modification of magnetic particles for application in biotechnology and biomedicine, China Particuology 5, 2007, p. 1-10.
[28] http://www.magneticmicrosphere.com/suppliers ze dne 15. 1. 2014.
[29] http://www.purebiotechllc.com/mbpd/immob/immob.html ze dne 15. 1. 2014.
[30] Horák, D., Rittich, B., Španová, A.: Carboxyl-functionalized magnetic microparticle carrier for isolation and identification of DNA in dairy products. J. Magn. Magn. Mat. vol. 311, 2007, p. 249-254.
[31] Rittich, B., Španová, A. SPE and purification of DNA using magnetic particles. J. Sep. Sci. vol. 36, 2013, p. 2472 -2485.
Štítky
Biomedicína
Článok vyšiel v časopiseLékař a technika

2014 Číslo 2-
Všetky články tohto čísla
- Liposomy, jejich charakterizace, příprava a inkorporace do nanovlákenných nosičů
- Deconvolution-based Physiological Signal Simplification for Periodical Parameter Estimation
- Respiratory Rate Estimation in Postoperative Care-State of the Art and Perspectives
- Technical solutions of semi-closed circuits for heliox administration in spontaneously breathing patients with severe airway obstruction
- Analýza povrchu magnetických mikročástic prostřednictvím mikroskopie atomárních sil
- Neparametrické statistické testy a jejich softwarová podpora
- Lékař a technika
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Liposomy, jejich charakterizace, příprava a inkorporace do nanovlákenných nosičů
- Neparametrické statistické testy a jejich softwarová podpora
- Analýza povrchu magnetických mikročástic prostřednictvím mikroskopie atomárních sil
- Technical solutions of semi-closed circuits for heliox administration in spontaneously breathing patients with severe airway obstruction
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy






