-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Difúzny veľkobunkový B-lymfóm ako najčastejší B-bunkový non-Hodgkinov lymfóm oblasti hlavy a krku
Diffuse Large B-cell Lymphoma as the Most Common Non-Hodgkin B-cell Lymphoma of the Head and Neck
Malignant lymphomas represent approximately 5% of all malignant neoplasms of the head and neck area (Head and Neck, H&N). This heterogeneous group of tumours is classically divided into two subgroups Hodgkin lymphomas (HL) and non-Hodgkin lymphomas (NHL). A correct biopsy diagnosis includes also the standardization of the lymphoma diagnosis and reporting leading to a correct typing, grading and staging of ML as well as to the identification of clinically relevant prognostic and predictive parameters of the tumour cells and of possible therapeutic targets. The majority of NHL H&N are of B-cell origin, the most common type of them is the diffuse large B-cell lymphoma (DLBCL). DLBCL is an aggressive B-lymphoproliferative neoplasm, which represents morphologically and biologically heterogeneous groups of tumors. Identification of individual parameters of heterogeneity DLBCL is important not only for the diagnostic recognition of its different subtypes, but also for definition of its prognostic and predictive parameters, which might play a role for indication of a correct adequate therapy of patients with DLBCL.
Keywords:
malignant lymphomas, head & neck, biopsy diagnosis, diffuse large B-cell lymphoma, heterogeneity, prognostic factors
Autoři: J. Mičák 1; T. Balhárek 1,2; P. Szépe 1,2; A. Farkašová 1,2; L. Plank 1,2
Působiště autorů: Ústav patologickej anatómie JLF UK a Univerzitnej nemocnice Martin, prednosta prof. MUDr. L. Plank, CSc., primár MUDr. P. Szépe, CSc. 1; Konzultačné centrum bioptickej diagnostiky ochorení krvotvorby JLF UK a Univerzitnej nemocnice Martin 2
Vyšlo v časopise: Otorinolaryngol Foniatr, 64, 2015, No. 1, pp. 56-62.
Kategorie: Přehledový článek
Souhrn
Malígne lymfómy (ML) tvoria približne 5 % všetkých malígnych nádorov v oblasti hlavy a krku (Head and Neck, H&N). Táto heterogénna skupina nádorov sa klasicky delí na dve podskupiny - Hodgkinove lymfómy (HL) a non-Hodgkinove lymfómy (NHL). Súčasťou správnej bioptickej diagnostiky sú štandardy písomného spracovania bioptického nálezu v zmysle určenia typu ML a stupňa jeho malignity, štádia ochorenia a identifikácie relevantných prognostických a prediktívnych faktorov nádorových buniek, ako aj možných terapeutických cieľov. Väčšina NHL H&N je B-bunkového pôvodu, pričom najčastejším typom je difúzny veľkobunkový B-lymfóm (DLBCL). DLBCL je agresívne B-lymfoproliferatívne ochorenie, ktoré predstavuje z morfologického a biologického hľadiska heterogénnu skupinu nádorov. Identifikácia jednotlivých parametrov heterogenity DLBCL je dôležitá pre diagnostické rozlíšenie jeho jednotlivých podtypov, ale aj z hľadiska prognostického a prediktívneho, vrátane hľadiska indikovania správnej adekvátnej liečby pacientov s DLBCL.
Klúčová slová:
malígne lymfómy, oblasť hlavy a krku, bioptická diagnostika, difúzny veľkobunkový B-lymfóm, heterogenita, prognostické faktoryÚVOD
Non-Hodgkinove lymfómy (NHL) sú po spinocelulárnom karcinóme druhým najčastejším diagnostikovaným nádorom oblasti hlavy a krku (z angl. head and neck - ďalej H&N), pričom NHL predstavujú približne 75 % všetkých malígnych lymfómov (ML) H&N (6, 19). Najčastejším typom NHL je tu difúzny veľkobunkový B-lymfóm (DLBCL). Medzi ďalšie patria iné B-bunkové NHL, a to B-lymfoblastová leukémia/lymfóm, chronická lymfocytová leukémia/malobunkový lymfocytový lymfóm, extranodálny B-lymfóm marginálnej zóny (MZBL) MALT-typu, folikulový lymfóm, lymfóm plášťových buniek a Burkittov lymfóm/leukémia. NHL NK-/T-bunkového pôvodu sú v našej populácii, podobne ako v iných regiónoch Európy a severnej Ameriky v tejto lokalizácii zriedkavé, naproti tomu sú relatívne časté v Ázii a v strednej a južnej Amerike (7). Najčastejším typom NK-/T-bunkových NHL H&N oblasti je extranodálny NK-/T - bunkový lymfóm nazálneho typu (12).
NHL H&N sa môžu deliť podľa miesta ich vzniku na nodálne (vznikajúce v lymfatických uzlinách) a extranodálne (EN). V tejto oblasti sú časté najmä EN NHL, ktoré tvoria približne 25-50 % všetkých ML, čo predstavuje druhé najčastejšie miesto výskytu EN NHL po gastrointestinálnom trakte (21). EN lymfatické tkanivo zahŕňa Waldeyerov lymfatický kruh, vrátane štruktúr ústnej dutiny, oro - a nazofaryngu, lymfatické tkanivo nosovej a prínosových dutín, hrtana a priedušnice, ako aj lymfatické tkanivo slinných a štítnej žľazy. Pôvod tohto EN tkaniva je rozdielny, môže ísť o:
- a) primárne EN lymfatické tkanivo – prítomné v danej štruktúre fyziologicky (napr. systém tonzíl orofaryngeálnej oblasti), preto viacerí autori zaraďujú NHL týchto štruktúr medzi „nodálne“, alebo
- b) sekundárne EN lymfatické tkanivo, fyziologicky (anatomicky) v danom orgáne neprítomné, vznikne tu až patologickou akumuláciou lymfocytov (napr. v slinných či štítnej žľaze), a to v dôsledku chronických infekčných alebo autoimúnnych zápalových procesov.
NHL lymfatických uzlín H&N oblasti sú vo väčšine prípadov súčasťou disseminácie systémového ochorenia - takýto systémový charakter sa vyskytuje u približne 40 až 60 % pacientov s NHL H&N.
Na rozdiel od NHL sa Hodgkinove lymfómy (HL) vyskytujú takmer výlučne v nodálnych štruktúrach a len zriedkavo extranodálne, a to buď len v uzlinách H&N oblasti, alebo súčasne aj v iných ako súčasť disseminovaného systémového nádorového ochorenia.
Nodálne ML
Najčastejšou klinickou manifestáciou HL aj NHL H&N oblasti je krčná lymfadenopatia, resp. lymfadenomegália. Postihnuté LU sú zvyčajne nebolestivé, mäkšej konzistencie, a na rozdiel od LU s metastázou spinocelulárneho karcinómu spravidla neadherujú ku koži ani k hlbokým štruktúram. Okrem krčných môžu byť postihnuté LU aj v iných lokalitách (axila, inguína, mediastinum, brušná a pod.), HL často postihujú jednu LU v dolnej krčnej alebo nadkľúčnicovej oblasti, pričom majú tendenciu propagovať sa aj do susedných LU. Pri prezentácii HL v tejto oblasti už bývajú obyčajne pozitívne aj mediastinálne a hilové LU, zatiaľ čo súčasný postih brušných LU, pokiaľ pacient nemá systémové symptómy, je zriedkavejší. Manifestácia NHL je opačná - zvyčajne sa nešíria do susedných LU, zriedkavo postihujú LU mediastína, ale postih brušných LU je častejší (22).
Extranodálne ML
Najčastejšie postihujú, a to až v 50-60 % prípadoch, Waldeyerov lymfatický kruh, najčastejším typom je tu DLBCL, ktorý tvorí až 70-80 % NHL tejto oblasti (10, 21).
Druhou najčastejšou lokalizáciou H&N oblasti sú lymfómy, vznikajúce v slinných žľazách (SŽ), najviac v príušnej žľaze (75 %). Najčastejším typom B-NHL v SŽ je (MZBL) MALT-typu, DLBCL tvorí asi 15 % NHL SŽ (5, 7).
Primárne lymfómy nosovej dutiny a prínosových dutín (PNS) tvoria asi 3-4 % EN lymfómov a 8-16 % lymfómov H&N (8). Väčšina lymfómov PNS postihuje čeľustné dutiny, zatiaľ čo izolovaný postih dutín čuchovej, klínovej a čelovej kosti je zriedkavý (15). DLBCL nosovej dutiny a PNS predstavuje približne 77 % B-NHL, zvyšných 18 % predstavuje MZBL MALT-typu a folikulový lymfóm (FL) a zostávajúcich 5 % Burkittov lymfóm (BL) a lymfóm plášťových buniek (8).
Lymfómy vznikajúce v ústnej dutine reprezentujú menej ako 10 % EN lymfómov H&N oblasti a 3,5 % všetkých malignít ústnej dutiny, pričom DLBCL je tu najčastejším typom s výskytom vo viac ako 50 % prípadov (9).
ML štítnej žľazy (ŠŽ) predstavujú menej ako 5 % jej neoplázií a ŠŽ, podobne ako SŽ býva postihnutá najčastejšie DLBCL a MALT lymfómom (3).
Lymfómy hrtanu sú zriedkavé, tvoria menej ako 1 % jeho primárnych zhubných nádorov s najčastejším výskytom DLBCL a MZBL MALT-typu (7). Rovnako extrémne zriedkavé sú aj primárne lymfómy priedušnice, pričom väčšinu prípadov reprezentuje MZBL MALT-typu (2).
V oblasti H&N sa môžu vyskytovať aj klinicky špecifické ML kože, ako je primárny kožný FL a primárny kožný MZBL MALT-typu, pričom kožné postihnutie DLBCL je zvyčajne manifestáciou systémového ochorenia (13).
HL sa častejšie diagnostikuje u pacientov vo veku 20-30 rokov, zatiaľ čo pri NHL ide vo väčšine prípadov o starších pacientov (nad 50 rokov) mužského pohlavia, s výnimkou lymfómov ŠŽ a SŽ, v ktorých prevláda ženské pohlavie. Pacienti s DLBCL H&N majú pri prezentácii ochorenia medián veku 63 rokov a pomer výskytu u mužov a žien je 1,2 : 1 (5). Na rozdiel od toho u detí a mladých dospelých je výskyt DLBCL v tejto oblasti zriedkavejší a častejšie sa tu vyskytuje BL (23).
Zdá sa, že rizikovými faktormi vzniku ML aj v H&N oblasti sú stavy primárnej alebo sekundárnej imunodeficiencie, ako sú ataxia - teleangiektázia, Wiskottov-Aldrichov syndróm, ťažká kombinovaná imunodeficiencia (SCID), dlhodobá imunosupresívna liečba a pod. Ďalšími faktormi sú infekcie, najmä EBV, HIV, a syndróm AIDS, Helicobacter pylori a HCV. Častým lymfómom HIV pozitívnych pacientov, ktorý postihuje typicky ústnu a nosovú dutinu, je plazmablastový lymfóm (podtyp/podjednotka DLBCL). MZBL MALT-typu vzniká u pacientov s autoimúnnymi ochoreniami, ktoré sú predisponujúcim faktorom ich vzniku - napr. pacientov so Sjögrenovým syndrómom a často v teréne lymfoepitelovej sialadenitídy (LESA), resp. Hashimotovej tyreoiditídy (5).
VŠEOBECNÉ ZÁSADY BIOPTICKEJ DIAGNOSTIKY ML
U pacienta s podozrením na ML je kľúčovým bodom diagnostiky bioptické vyšetrenie s presným určením histologického typu/podtypu ML. Určenie histologického typu ML („typizácia“) definuje priamo či nepriamo súčasne aj agresivitu ochorenia, t.j. vlastne stupeň malignity ML („grading“). Cieľom ďalších vyšetrení pacientov s ML je stanovenie klinického štádia („staging“), stanovenie výkonostného stavu („performance status“ - PS) a identifikácia rizikovej skupiny v rámci medzinárodných prognostických indexov IPI.
Bioptická diagnostika ML
Štandardy bioptickej diagnostiky ML možno stručne zhrnúť nasledovne:
Bioptická diagnostika ML pri dostatku tkaniva pre formalinovú fixáciu a následné zaliatie do parafínu zahŕňa histologickú, imunohistochemickú (IHC) analýzu, možnosť vyšetrenia fixovaného/nefixovaného tkaniva (buniek) aplikáciou metód molekulovej biológie v natívnom materiáli (napr. interfázová fluorescenčná in-situ hybridizácia-i-FISH), ako aj aplikáciu metód prietokovej cytometrie. V rámci bioptickej analýzy sa najčastejšie vyšetrujú lymfatické uzliny alebo extranodálne tkanivá a biopsia kostnej dreni (KD), pričom bioptická vzorka by mala byť dostatočne veľká a kvalitná, nepoškodená (reprezentatívna) (16).
Pre správnu bioptickú diagnostiku ML je nevyhnutné:
1. Dodržanie zásad voľby„miesta a veľkosti odberu“, ktoré závisia od klinického lekára indikujúceho biopsiu.
V prípade lymfadenopatie a biopsie LU:
- a) sa neodporúča odber tkaniva tenkou alebo hrubou ihlou, iba v prípadoch absencie povrchovej lymfadenopatie a kontraindikácie operačného zásahu je možné použiť punkčnú biopsiu hlbokých LU, ako prvý krok diagnostického algoritmu, pri odbere vzorky pomocou tenko ihlovej punkčnej aspiračnej biopsie (PAB) hrozí riziko nejednoznačnej diagnózy a riziko získania nedostatočného množstva materiálu,
- b) pri lokalizovanej lymfadenopatii je všeobecne vhodné uprednostniť odber najväčšej LU (bloková dissekcia LU, nie je na rozdiel od iných nádorov terapeuticky prínosná),
- c) pri generalizovanej lymfadenopatii treba dať prednosť odberu hlbokých axilárnych alebo krčných LU, neodpo-rúča sa indikovať extirpáciu malých a ľahko dostupných povrchových LU, ktoré obyčajne nie sú postihnuté, alebo sú postihnuté len ložiskovo s prevahou nešpecifických reaktívnych zmien.
V prípade ML, ktorý postihuje extranodálne lymfatické tkanivo, sa odber tohto tkaniva riadi všeobecne akceptovateľnými princípmi podľa jednotlivých lokalizácií. Pri chirurgickom odbere je žiaduce odobranie aj lemu tkaniva okolo makroskopicky viditeľného nádoru a súčasne aj postihnutých regionálnych LU.
V prípade trepanobioptického odberu KD sa miestom odberu stáva lopata bedrovej kosti, pre reprezentatívnosť materiálu na bioptickú analýzu sa požaduje odber súvislého kompaktného nefragmentovaného trepanobioptického „valca“ o minimálnej dĺžke 10-20 mm.
2. Dodržanie princípov odberu.
Tkanivo určené na bioptické vyšetrenie, získané chirurgickým zákrokom alebo endoskopickým odberom, sa okamžite ukladá do formalínu na fixáciu.
3. Dodržanie princípov zasielania a spracovania materiálu na bioptické vyšetrenie ML lymfómov.
Pravidlom bioptickej diagnostiky lymfoproliferatívnych ochorení je tzv.„second look opinion“, t.j. poskytnutie materiálu na diagnostické konzultačné posúdenie špecializovanému konzultačnému pracovisku.
DEFINÍCIA DLBCL PODĽA KLASIFIKÁCIE SVETOVEJ ZDRAVOTNÍCKEJ ORGANIZÁCIE (SZO, 2008)
Kategória DLBCL ako nádoru, ktorý je tvorený klonálnou proliferáciou blastických buniek B-pôvodu, sa v dôsledku morfologickej a biologickej heterogenity v súčasnej klasifikácii podľa SZO (20) „rozpadá“ na heterogénnu skupinu s rôznym pomenovaním a kódovaním. Spoločným znakom tejto skupiny nádorov je pozitivita aspoň jedného zo znakov príslušnosti nádorovej bunky k B-radu (CD19, CD20, CD22, CD79a a PAX5), pričom morfologicky ide o nádor zo stredne veľkých až veľkých blastov. SZO klasifikácia ďalej tieto nádory rozdeľuje na varianty/podskupiny a podtypy/jednotky, pričom rozlišuje špecifické podtypy (nádorové jednotky) a prípady, kde nie sú jasne akceptovateľné kritéria pre subklasifikáciu. Takéto prípady sa klasifikujú ako DLBCL, bližšie nešpecifikovaný (z angl. not otherwise specified, NOS).
K najdôležitejším prejavom heterogenity DLBCL patrí:
1. Heterogenita vzniku a patogenézy zahŕňa rozdelenie DLBCL: 1. podľa miesta vzniku na primárne nodálny (izolovaný alebo generalizovaný) a primárne extranodálny typ DLBCL (unifokálny alebo multifokálny), 2. podľa patogenézy na („primárny“) de novo vznikajúci DLBCL, na sekundárny DLBCL a na systémový (“sekundárny”) DLBCL. Sekundárny DLBCL vzniká blastickou transformáciou buď primárnych indolentných malobunkových B-NHL, alebo nodulárneho lymfocytovo predominantného Hodgkinovho lymfómu. V SŽ a ŠŽ vzniká často transformáciou MZBL MALT-typu. Indolentné malobunkové B-NHL (nízko agresívne) sú vo všeobecnosti asymptomatické a zostávajú lokalizované (pomaly rastú a pomaly generalizujú), naproti tomu sekundárny DLBCL má spočiatku tiež lokalizovaný charakter, neskôr však pomerne rýchlo generalizuje a stáva sa systémovým. Primárny extranodálny pôvod je pritom z klinicko-biologického hľadiska potrebné odlíšiť od postihu extranodálnej lokalizácie pri systémovej diseminácii pôvodne nodálneho DLBCL. Je známe, že DLBCL morfologicky a imunologicky identické vykazujú rozdielny priebeh, šírenie v organizme, vrátane postihu KD podľa toho či sa manifestujú ako primárne nodálne, alebo primárne EN. EN DLBCL majú častejšie prognostický nepriaznivý fenotyp a tiež nižšiu tendenciu k infiltrácii KD, pričom ak je KD infiltrovaná, ide zvyčajne o malobunkovú (diskordantnú) infiltráciu (18).
2. Morfologická heterogenita - rozlišujú sa 1. časté histopatologické varianty DLBCL, NOS (centroblastový, imunoblastový a anaplastický), pričom centroblastový býva najčastejší a 2. zriedkavé histopatologické varianty DLBCL, NOS (s myxoidnou strómou, s fibrilárnou matrix, s pseudorozetovými formáciami a pod.).
3. (Geno)-fenotypová heterogenita - analýzou profilu génovej expresie (GEP) možno rozlíšiť DLBCL z buniek podobných B-bunkám zárodočného centra (GC) lymfatického folikulu (LF), tzv. GCB podtyp (z angl. germinal center B-cell), DLBCL z buniek podobných aktivovaným B-bunkám, tzv. ABC podtyp (z angl. activated B-cell) a neklasifikovaný podtyp DLBCL (1). Fenotypová heterogenita sa týka najmä fenotypovej expresie, ktorá imunohistochemicky (IHC) umožňuje rozdeliť DLBCL na dva fenotypové podtypy: DLBCL z buniek podobných B-bunkám GC LF, tzv. GCB podtyp a DLBCL z buniek nepodobných B-bunkám GC LF, tzv. non-GCB podtyp (11). Imunofenotypická subtypizácia DLBCL na prognosticky významné podtypy (GCB a non-GCB) je založená na identifikácii rôznej kombinácii pozitívnej a negatívnej expresie znakov, ako sú znaky GCB podtypu (GCET1, CD10 a Bcl-6) a znaky non-GCB podtypu (MUM1/IRF-4 a FOXP1). Pre imunofenotypickú subtypizáciu DLBCL v súčasnosti existuje viacero IHC algoritmov navrhnutých podľa Hansovej a spol. (2004); Murisa a spol. (2006); Coloma a spol. (2003); Choia a spol. (2009) a iných (14). Všeobecne najuznávanejšími a v praxi najpoužívanejšími IHC algoritmami sú algoritmy navrhnuté Hansovou a spol. (2004) a Choiom a spol. (2009) (tab. 1).
Tab. 1. Najčastejšie používané IHC algoritmy pre fenotypovú subtypizáciu DLBCL. 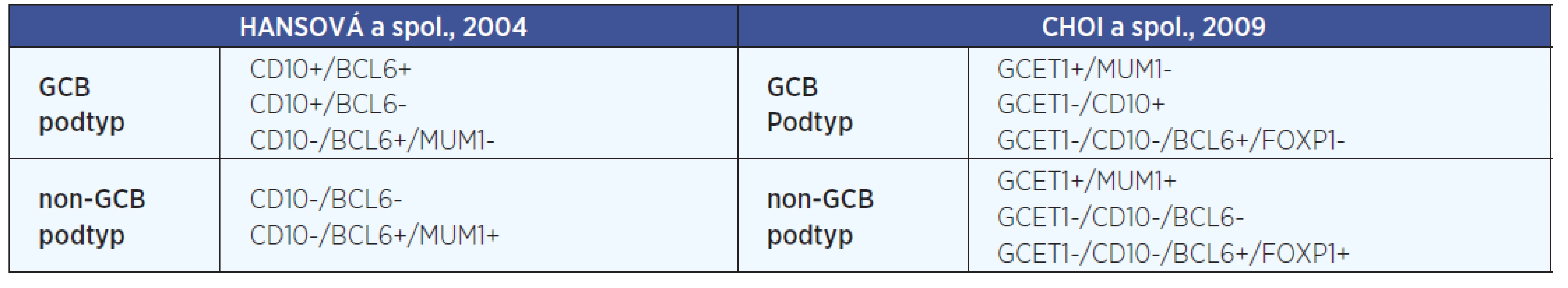
4. Heterogenita klinických prejavov a liečby zahŕňa rozdiely v prežívaní (rôzne údaje), rozdielne klinické štádia DLBCL (podľa Ann Arbor klasifikácie) a asociované prejavy, rozdiely v parametroch medzinárodného prognostického indexu a rozdiely v odpovedi na liečbu (kompletná remisia, parciálna remisia, stabilizované ochorenie či relaps/progresia ochorenia).
DLBCL sa môže klinicky prejaviť ako lokalizovaná nádorová masa (štádium I alebo IE) v približne 20 % prípadov, diseminované ochorenie (štádium IV) sa vyskytuje v približne v 40 % prípadov. Systémové B príznaky sa iniciálne vyskytujú približne u 30 % pacientov. KD býva infiltrovaná asi v 10-20 % prípadov, a to buď ako blastická (konkordantná) infiltrácia, alebo ako malobunková (diskordantná) infiltrácia.
Prognostické faktory DLBCL
Prognostické faktory v DLBCL môžu byť definované klinicky, histomorfologicky, geneticky a analýzou fenotypu.
1. Klinické prognostické faktory - dôležitým parametrom nádorového ochorenia je určenie klinického štádia („staging“) DLBCL, pri ktorom sa používa tzv. Cotswoldská modifikácia Ann Arbor stagingového systému. Samotné klinické štádium vo väčšine prípadov nie je dostatočným prognostickým ukazovateľom, preto pri stratifikácií pacientov využívame aj ďalšie parametre a určujeme tzv. prognostické indexy. Najznámejším a najčastejšie používaným je tzv. medzinárodný prognostický index (international prognostic index, IPI), používaný najmä pri agresívnych lymfómoch. IPI vyčleňuje 4 rizikové skupiny pacientov (s nízkym, nízkym intermediárnym, vysokým intermediárnym a vysokým rizikom) s dopadom na 5-ročné prežívanie na základe piatich nepriaznivých prognostických parametrov: vek nad 60 rokov, výkonnostný stav (PS) 2 a vyšší, hladina sérovej laktátovej dehydrogenázy (LDH) vyššia ako norma, postih dvoch a viac extranodálnych lokalizácií a klinické štádium Ann Arbor III alebo IV) (tab. 2). Pacienti, ktorí majú 60 alebo menej rokov, môžu byť hodnotení podľa tzv. indexu upraveného pre vek (age adjusted, aa-IPI), ktorý vyčleňuje rizikové skupiny na základe troch ne-priaznivých prognostických parametroch (PS 2-4, pokročilé štádium Ann Arbor a hladina sérovej LDH vyššia ako norma). Okrem IPI a aa-IPI, ktoré vznikli v ére pred zavedením rituximabu, sa môže používať aj tzv. revidovaný IPI, ktorý vznikol analýzou skupiny pacientov s DLBCL liečených aj rituximabom (tab. 3). Dlhotrvajúce výsledky sledovania pacientov s ML H&N ukázali, že prognózu tiež ovplyvňuje miesto prezentácie nádoru. Pomerne dobrú prognózu má primárne postihnutie tonzíl (10).
Tab. 2. Medzinárodný prognostický index (IPI) pre agresívne lymfómy. 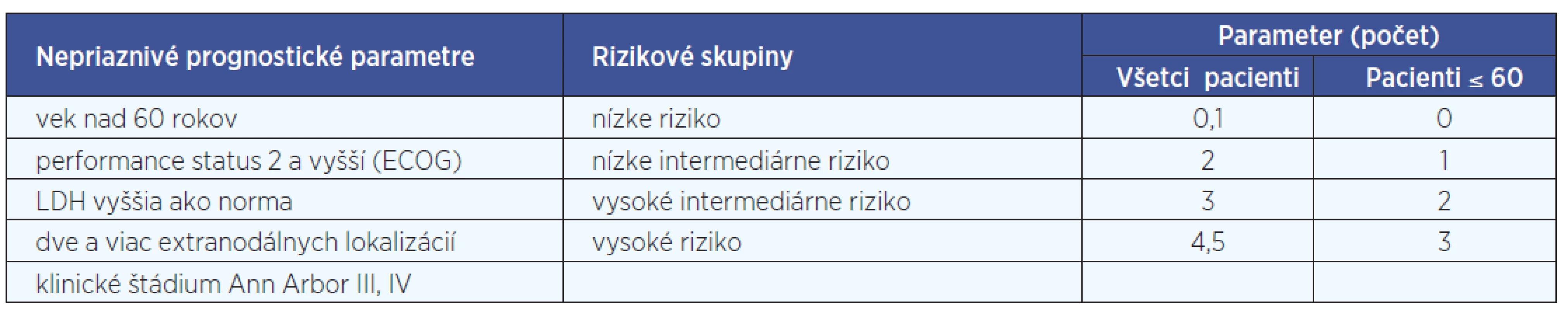
Tab. 3. Revidovaný IPI. Hodnotia sa identické klinické ukazovatele, ako pri IPI. Podľa počtu prítomných negatívnych prognostických faktorov sú pacienti stratifikovaní do troch skupín. 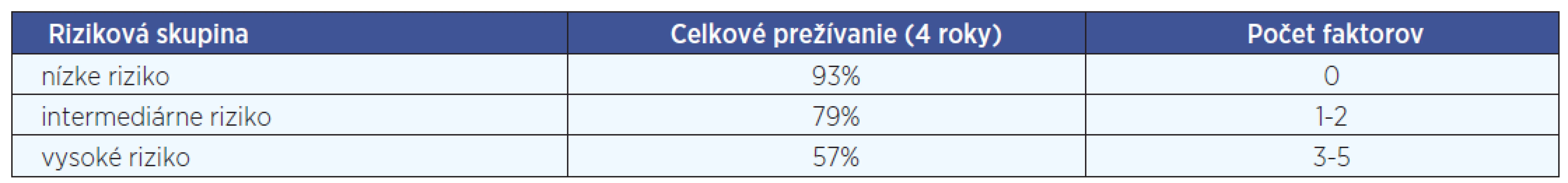
2. Histomorfologické prognostické faktory - v súčasnosti nie sú dostatočné dôkazy, ktoré by podporovali využitie morfologických variantov ako prognostických faktorov. Blastická (konkordantná) infiltrácia KD je nepriaznivý prognostický faktor v DLBCL, nezávislý od IPI, kým malobunková (diskordantná) infiltrácia KD nie je nepriaznivým prognostickým faktorom (18). Predmetom výskumu sa v súčasnosti stávajú aj nenádorové elementy – reaktívne bunky nádoru, najmä makrofágy, ako tzv. tumor asociované makrofágy (tumor associated macrophages, TAMs) a epiteloidne bunková reakcia. Podľa niektorých autorov možno TAMs deliť na dva prognosticky významné typy, na supresívny TAM1 typ (CD68+) a promočný TAM2 typ (CD163+), pričom sa zdá, že TAM2 typ na rozdiel od TAM1 typu a epiteloidne bunkovej reakcie je spojený u pacientov s DLBCL s nepriaznivejšou prognózou.
3. Prognostické faktory definované analýzou expresie génového profilu (GEP) a fenotypovou analýzou - GEP poskytuje prognostické faktory nezávislé na IPI. Podľa výsledkov GEP možno rozlišovať už uvedené „molekulové“ podtypy DLBCL. Pacienti, ktorí majú podtyp ABC, majú nepriaznivejšiu prognózu ako pacienti s GCB podtypom DLBCL (17). Viaceré práce poukazujú na fakt, že porovnanie výsledkov subtypizácie DLBCL analýzu GEP s výsledkami subtypizácie DLBCL pomocou IHC ukázalo, že DLBCL možno aj metódou IHC deliť na podtypy s podobnými výsledkami, aké sa dosiahnu analýzou GEP. Na rozdiel od analýzy GEP, pre IHC subtypizáciu DLBCL je možné použiť materiál rutinne spracovaný formolovou fixáciou a zaliatím do parafínového bločku, navyše pri IHC vyšetrení môže patológ aj priamo mikroskopicky hodnotiť nádorové i nenádorové bunky, čím znižuje nepresnosti vo výsledku (11). Súčasne je potrebné kriticky pripomenúť, že IHC analýzy sú zaťažené nízkou mierou redproducibility, a preto sa zatiaľ nepoužívajú pre klinický manažment pacienta.
Podľa viacerých autorov sa v GCB podtype DLBCL častejšie vyskytuje translokácia t (14;18) (IGH/BCL2), naproti tomu v ABC podtype DLBCL prevažuje amplifikácia chromozómu 18q21. Obe tieto štrukturálne chromozomálne aberácie vedú k expresii Bcl-2 proteínu.
Podľa niektorých štúdii je prognosticky relevantné odlíšiť nielen podtyp GCB od podtypu ABC, ale v rámci podtypu GCB aj prípady s pozitívnou expresiou Bcl-2 proteínu, resp. koexpresiou CD10 a Bcl-2 proteínu, ktorá je negatívnym prognostickým znakom (4, 24). O prediktívno-prognostickom význame podtypov DLBCL (GCB versus non-GCB) sa stále diskutuje, pretože niektorí autori tvrdia, že „v ére rituximabu“ uvedené prognostické rozdiely strácajú na význame.
Najvýznamnejšie histomorfologické a (geno) - fenotypové prognostické parametre DLBCL sú uvedené v tabuľke 4.
Tab. 4. Niektoré prognostické parametre DLBCL podľa viacerých zdrojov. 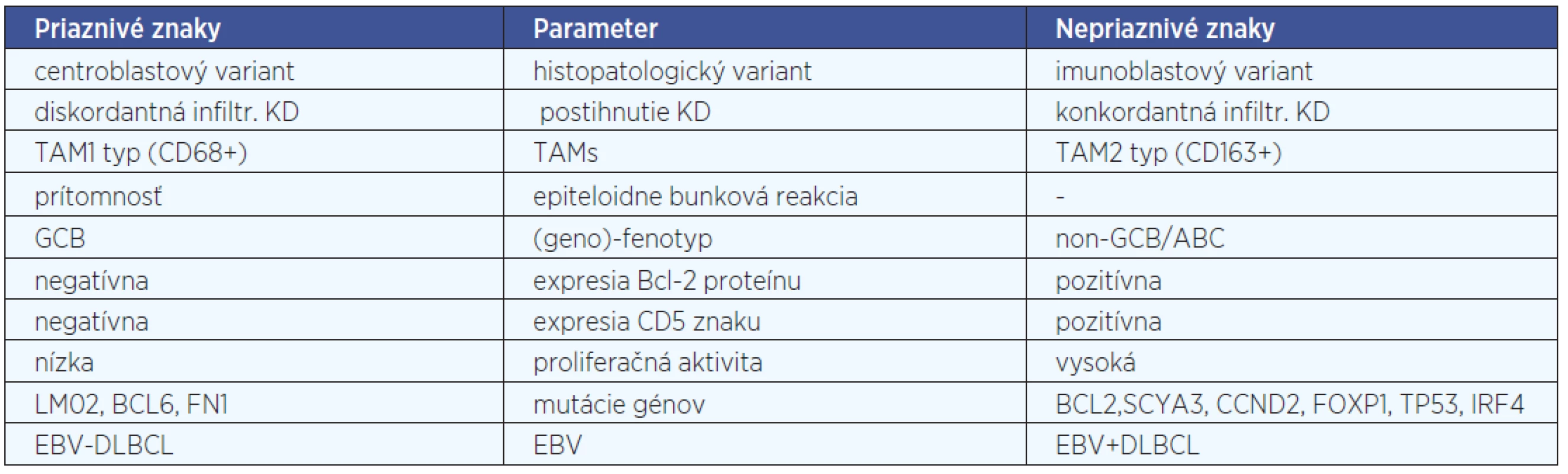
ZÁVER
Diagnostika ML je pomerne náročná, pretože sa nejedná iba o jedno nádorové ochorenie, ale o široké spektrum nádorov a klinických manifestácii. Problematika ML si preto vyžaduje dobrú klinicko-patologickú spoluprácu. Bioptická diagnostika ML by mala v súčasnosti poskytnúť všetky potrebné informácie na určenie diagnostických, prognostických a prediktívnych parametrov tohto typu nádorového ochorenia. Štandardné bioptické vyšetrenie je dnes založené na analýze histomorfologických a fenotypových (imunohistochemických) znakov nádorovej bunky (doplnené o bioptické vyšetrenie trepanobioptickej vzorky KD), ktoré sa opiera aj o znalosti výsledkov klinických vyšetrení a nálezov zobrazovacích metód. K ďalším metódam interpretácie biopticky vyšetrovaného tkaniva patria cytogenetické a molekulovo-biologické analýzy (najmä FISH), kedy ide jednak o dôkaz klónového preskupenia príslušného receptora, ako aj o dôkaz špecifických genetických zmien, príznačných pre daný typ ML. Všetky poskytnuté informácie častokrát vedú k efektívnejšiemu dosiahnutiu cieľa, ktorým je správna diagnóza vystihujúca typizáciu a subtypizáciu ML predovšetkým v záujme pacienta.
Podporené projektami Centier excelentnosti MBRK (ITMS kód 2622022113) a BioMed (ITMS kód 26220220187) na Jesseniovej lekárskej fakulte Univerzity Komenského v Martine, ktoré sú spolufinancované z prostriedkov EÚ.
Adresa ke korespondenci:
MUDr. Jozef Mičák
Ústav patologickej anatómie JLF UK a UNM
Kollárova 2
036 01 Martin
Slovenská republika
e-mail: jzf.micak@gmail.com
Zdroje
1. Alizadeh, A. A., Eisen, M. B., Davis, R. E., Ma, C., Lossos, I. S.,Rosenwald, A., Boldrick, J. C., Sabet, H., Trant, T., Yu, X., Powell, J. I., Yang, L., Marti, G. E., Moore, T., Hudson, J. R. J.,Lu, L., Lewis, D. B., Tibshirani, R., Sherlock, G., CHan, W. C., Greiner, T. C., Weisenburger, D. D., Armitage, J. O., Warn-ke, R., Levy, R., Wilsom, W., Grever, M. R., Byrd, J. C., Botstein, D.,Brown, P. O., Staudt, L. M.: Distinct types of diffuse large B-cell lymphoma identified by gene expression profiling. Nature, 403, 2000, s. 503-511.
2. Allen, M. S.: Malignant tracheal tumors. Mayo Clin. Proc., 68, 1993, 7, s. 680-684.
3. Ansell, S., Grant, C., Habermann, T.: Primary thyroid lymphoma. Semin Oncol., 26, 1999, s. 316-323.
4. Barrans, S. H., Carter, I., Owen, R. G., Davies, F. E., Patmo-re, R. D., Haynes, A. P., Morgan, G. J., Jacka, S.: Germinal center phenotype and bcl-2 expression combined with the international prognostic index improves patient risk stratification in diffuse large B-cell lymphoma. Blood, 99, 2002, s. 1136-1143.
5. Barnes, L., Eveson, J. W., Reichart, P., Sidransky, D.: World health organization classification of tumours. Pathology and genetics of head and neck tumours. In. IARC Press, Lyon, 2005, ISBN 92-832-2417-5, s. 430.
6. Boring, C. C., Squires, T. S., Tong, T.: Cancer statistics. CA Cancer J. Clin., 43, 1993, s. 7-26.
7. Cavalli, F., Stein, H., Zucca, E.: Extranodal lymphomas. Pathology and management. Primary extranodal head and neck lymphomas. In Informa UK Ltd, 2008, s. 265-276.
8. Cortelazzo, S., Rossi, A., Federico, M.: The stage modified IBI (MIPI), histology and combined treatment influence the clinical outcome of 401 patients with primary extranodal head and neck lymphomas (PHNBCL). Blood, 106 (S3), 2005, Abstract, s. 927.
9. Epstein, J. B., Epstein, J. D., Le, N. D., Gorsky, M.: Characteristics of oral and paraoral malignant lymphoma: a population-based review of 361 cases. Oral Surg., Oral Med., Oral Pathol., Oral Radiol. Endod., 92, 2001, 5, s. 519-525.
10. Ezzat, A. A., Ibrahim, E. M., El Weshi, A. N., Khafaga, Y. M.,Aljurf, M., Martin, J. M., Ajarim, D. S., Bazarbashi, S. N.,Stuart, R. K., Zucca, E.: Localized non-hodgkin´s lymphoma of waldeyer´s ring: clinical features, management and prognosis of 130 adult patients. Head Neck, 23, 2001,7, s. 547-558.
11. Hans, CH. P., Weisenburger, D. D., Greiner, T. C., Gascoyne, R. D., Delabie, J., Ott, G., Muller-Hermelink, K., Campo, E., Braziel, R. M., Jaffe, E. S., Pan, Z., Farinha, P., Smith, L. M., Falini, B., Banham, A. H., Rosenwald, A., Staudt, L. M., Con-nors, J. M., Armitage, J. O., CHan, W. C.: Confirmation of the molecular classification of diffuse large B-cell lymphoma by immunohistochemistry using a tissue microarray. In Blood, 1 January, 103, 2004, 1, s. 275-282.
12. Harris, N. L., Jaffe, E. S., Stein, H., Isaacson, P. G.: A revised european–american classification of lymphoid neoplasm: a proposal from the international lymphoma study group. Blood, 84, 1994, s. 1361-1392.
13. Li, S., Griffin, C. A., Mann, R. B., Borowitz. M. J.: Primary cutaneous T-cell-rich B-cell lymphoma: clinically distinct from its nodal counterpart? Mod. Pathol., 14, 2001, s. 10-13.
14. Meyer, P. N., Fu, K., Greiner, T. C., Smith, L. M., Delabie, J., Gascoyne, R. D., Ott, G., Rosenwald, A., Braziel, R. M., Campo, E., Vose, J. M., Lenz, G., Staudt, L. M., Chan, W. C., Weisenburger, D. D.: Immunohistochemical methods for predicting cell of origin and survival in patients with diffuse large B-Cell lymphoma treated with rituximab. J. Clin. Oncol., 29, 2010, 2, s. 200-207.
15. Neves, M. C., Lessa, M. M., Voegels, R. L., Butugan, O.: Primary non-Hodgkin´s lymphoma of the frontal sinus: case report and review of the literature. Ear. Nose Throat J. 84, 2005, 1, s. 47-51.
16. Plank, L., Vranovský, A., Lymfómová skupina SR.: Stratégia liečby malígnych lymfómov. Princípy klasifikácie, diagnostiky a liečby malígnych lymfómov. 2. vydanie, 2011, s. 133. ISBN: 978-80-970670-0-7, www.lymphoma.sk.
17. Rosenwald, A., Wright, G., Chan, W. C., Connors, J. M., Campo, E., Fisher, R. I., Gascoyne, R. D., Muller-Hermelink, H. K., Smeland, E. B., Staudt, L. M.: The use of molecular profiling to predict survival after chemotherapy for diffuse large B-cell lymphoma. N. Engl. J. Med., 346, 2002, 25, s. 1937-1947.
18. Sehn, L. H., Scott, D. W., Chhanabhai, M., Berry, B., Ruskova, A., Berkahn, L., Connors, J. M., Gascoyne, R. D.: Impact of concordant and discordant bone marrow involvement on outcome in diffuse large B-cell lymphoma treated with R-CHOP. J. Clin. Oncol., 29, 2011, 11, s. 1452-1457.
19. Suen, J. Y., Myers, E. N.: Cancer of the head and neck. New York, Churchill Livingstone, 1981, s. 669-719.
20. Swerdlow, S. H., Campo, E., Harris, N. L.: World health organization classification of tumours of haematopoietic and lymphoid tissues. In IARC Press, Lyon, 2008, s. 133. ISBN 978-92-832-2431-0, s. 439.
21. Vega, F., Lin, P., Medeiros, L. J.: Extranodal lymphomas of the head and neck. Annals of Diagnostic Pathology (Elsevier), 9, 2005, s. 340-350.
22. Weber, A., Rahemtullah, A., Ferry, J. A.: Hodgkin and non - Hodgkin lymphoma of the head and neck: clinical, pathologic, and imaging evaluation. Neuroimaging Clin. N. Am., 13, 2003, s. 371-392.
23. Wright, D., Mckeever, P., Carter, R.: Childhood non-Hodgkin lymphomas in the united kingdom: findings from the UKchildren´s cancer study group. J. Clin. Pathol., 50, 1997, s. 128-134.
24. Xu, Y., Mckenna, R. W., Molberg, K. H., Kroft, S. H.: Clinicopathologic analysis of CD10+ and CD10 – diffuse large B-cell lymphoma. Identification of a high-risk subset with coexpression of CD10 and bcl-2. Am. J. Clin. Pathol., 116, 2001, s. 183-190.
Štítky
Audiológia a foniatria Detská otorinolaryngológia Otorinolaryngológia
Článok vyšiel v časopiseOtorinolaryngologie a foniatrie
Najčítanejšie tento týždeň
2015 Číslo 1- Subkutánne vs. intravenózne imunoglobulíny u pacientov s CLL
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
-
Všetky články tohto čísla
- Stav screeningu sluchu novorozenců v ČR
- Screening sluchu fyziologických a rizikových novorozenců metodami OAE a AABR – zhodnocení výsledků
- Změna ve způsobu měření ztrát do drénů s aktivním sáním umožní jejich dřívější odstranění po operacích hlavy a krku
- První zkušenosti se zobrazením vnitřního ucha magnetickou rezonancí s využitím intratympanické aplikace kontrastní látky
- Věk jako rizikový faktor ototoxicity způsobené cisplatinou
- Podtlaková terapie v otorinolaryngologii
- Coganův syndrom
- Tornwaldtova choroba – endoskopický chirurgický prístup
- Vydechovaný oxid dusnatý jako bioindikátor zánětu horních dýchacích cest – literární přehled
- Difúzny veľkobunkový B-lymfóm ako najčastejší B-bunkový non-Hodgkinov lymfóm oblasti hlavy a krku
- KUTVIRTOVA CENA 2014 – PODMÍNKY SOUTĚŽE
- Stáž na ORL klinice ve Würzburgu
- POZVÁNKA
- Kurz „Základní principy chirurgie kůže hlavy a krku“
- Kurz chirurgie příušní žlázy
- 1. česká ORL akademie
- 27. mezinárodní kurz endoskopické endonazální chirurgie
- Preparační kurz ORL – chirurgie ucha a spánkové kosti
- Podíl Haemophilus influenzae b na akutních zánětech středouší a meningitidách otogenního původu u dětí po zavedení očkování antihemofilovou vakcínou
- Otorinolaryngologie a foniatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Vydechovaný oxid dusnatý jako bioindikátor zánětu horních dýchacích cest – literární přehled
- Coganův syndrom
- První zkušenosti se zobrazením vnitřního ucha magnetickou rezonancí s využitím intratympanické aplikace kontrastní látky
- Difúzny veľkobunkový B-lymfóm ako najčastejší B-bunkový non-Hodgkinov lymfóm oblasti hlavy a krku
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



