Nové léčebné postupy s využitím mezenchymálních kmenových buněk (MSC) v otorinolaryngologii
New Therapeutic Procedures in Otolaryngology Using Mesenchymal Stromal Cells
Multipotent mesenchymal stromal cells (MSC) are used for regeneration of injured mesenchymal tissue due to their self-renewal capacity and ability to differentiate into cells of mesenchymal tissue (bone, cartilage, muscle, fat, nerve or fibrous tissues). They regenerate various tissues through self-renewal, differentiation capacity, immune modulation and secretion of bioactive molecules. Authors present a review of MSC applications in otorhinolaryngology. The major interest is focused on phonosurgery, sensorineural deafness and reconstruction of large tissue defects with bone, cartilage or soft tissue replacement. The MSCs research in Czech otorhinolaryngology is focused on bone tissue replacement. Current point of interest is the temporal bone and treatment of bone defects after middle ear surgery.
KEYWORDS:
mesenchymal stromal cells, bone replacement, middle ear surgery
Autoři:
L. Školoudík 1; Viktor Chrobok 1
; D. Kalfeřt 1; Z. Kočí 2,3,4; E. Syková 2,3; S. Filip 5
Působiště autorů:
Klinika otorinolaryngologie a chirurgie hlavy a krku, Fakultní nemocnice Hradec Králové, Univerzita Karlova v Praze, Lékařská fakulta v Hradci Králové
1; Ústav experimentální medicíny Akademie věd České republiky, v. v. i.
2; Oddělení neurověd, 2. lékařská fakulta Univerzity Karlovy v Praze
3; Bioinova, s. r. o., Praha
4; Klinika onkologie a radioterapie, Fakultní nemocnice Hradec Králové, Univerzita Karlova v Praze, Lékařská fakulta v Hradci Králové
5
Vyšlo v časopise:
Otorinolaryngol Foniatr, 65, 2016, No. 2, pp. 97-101.
Kategorie:
Přehledový článek
Souhrn
Mezenchymálních kmenové buňky (MSC) jsou využívány k regeneraci poškozené mezenchymální tkáně. Jsou schopny se diferencovat ve zralé buňky kostní, chrupavčité, nervové, svalové či vazivové. Jejich účinek spočívá jednak v náhradě poškozené tkáně, ale také v parakrinním působení bioaktivních molekul. Autoři prezentují literární přehled recentního výzkumu MSC v oblasti otorinolaryngologie. V současnosti je výzkum zaměřen především na oblast fonochirurgie, percepční nedoslýchavosti a rekonstrukci rozsáhlých defektů kostních, chrupavčitých a měkkých tkání oblasti hlavy a krku. Také v České republice probíhá výzkum využití MSC v otorinolaryngologii. Prioritní oblastí je náhrada kostní tkáně, výzkum je zaměřen na terapii pooperačních defektů v oblasti spánkové kosti.
KLÍČOVÁ SLOVA:
mezenchymální kmenové buňky, kostní regenerace, středoušní chirurgie
ÚVOD
Při klinických aplikacích mezenchymálních kmenových buněk (MSC) v otorinolaryngologii je využíváno vysoké proliferační aktivity a schopnosti diferencovat se ve zralou mezenchymální tkáň jako je kost, chrupavka, vazivo, sval, tuková tkáň nebo nervová tkáň. MSC mají také imunomodulační vlastnosti. Produkují bioaktivní molekuly, které potlačují zánětlivou reakci a podporují regeneraci poraněné tkáně (1, 12, 27, 28). Proliferační aktivita a schopnost diferencovat se ve zralou mezenchymální tkáň jsou využívány k náhradě chybějící tkáně při ztrátových poraněních či operačních defektů. Parakrinní působení MSC cestou bioaktivních molekul je využíváno k regeneraci poškozené tkáně. MSC mohou být aplikovány do tkání samostatně injektáží buněčné kolonie k ovlivnění hojení a regenerace postižené tkáně, nebo mohou být navázány na příslušný nosič či decelulizovaný alogenní štěp k náhradě chybějící tkáně.
MEZENCHYMÁLNÍ KMENOVÉ BUŇKY
MSC představují heterogenní populaci buněk vyskytujících se v různých lidských tkáních a orgánech. Jedná se o multipotentní buňky schopné obnovovat poškozené mezenchymální tkáně. Mají schopnost se diferencovat na široké spektrum buněčných typů, jako jsou např. chondrocyty, adipocyty, osteocyty, myocyty, kardiomyocyty, neurony nebo buňky produkující inzulin (schéma 1). MSC jsou proto vhodnými kandidáty pro použití v regenerativní medicíně a buněčné terapii (7, 30).

Prvně byly MSC izolovány v šedesátých letech 20. století z kostní dřeně. V kostní dřeni tvoří 1/1000–1/100 buněk, tedy desetkrát méně, než je zde hematopoetických kmenových buněk (21). Později byly MSC izolovány také z dalších tkání. Velká pozornost byla věnována MSC získaných po porodu z placenty, amniové tekutiny, amniové membrány, pupečníkové tkáně a pupečníkové krve (18). Pro klinické účely jsou ale mnohem dostupnější MSC získané z tkání dospělého jedince, např. z tukové tkáně, ledvin, žaludeční sliznice, synoviální membrány nebo dolní nosní skořepy (25).
Pro klinické využití MSC byla stanovena minimální kritéria, která byla definována Mezinárodní společnosti pro buněčnou terapii (ISCT):
- MSC za standardních kultivačních podmínek jsou schopné přilnout k plastickému povrchu a vytvářet kolonie;
- MSC nesou povrchové markery CD105, CD73 a CD90, zatímco nenesou markery typické pro hematopoetické kmenové buňky CD34, CD45, CD11a, CD19 či CD79a, CD14 či CD11b ani antigen HLA-DR;
- MSC je možné (patřičnými způsoby) stimulovat k diferenciaci na osteocyty, adipocyty nebo chondrocyty.
Přestože základní kritéria pro MSC jsou jasně daná, buňky získané z různých tkání mohou mít některé povrchové molekuly odlišné, a tím i některé odlišné funkční projevy v poškozených tkáních. Například buňky získané z pupečníkové krve mají významně vyšší expresi markeru CD44 než buňky z kostní dřeně (29).
Dnes je obecně přijímán názor, že MSC vykazují tkáňově specifickou funkční biodiverzitu, která je zprostředkována přímou “cell-to-cell” buněčnou komunikací spojenou s aktivitou adhezivních molekul, cytokinů, růstových faktorů a signálních buněčných drah (15). S ohledem na kapacitu diferenciace bylo prokázáno, že MSC mohou získat určité funkce spojené s buňkami rezidentních tkání, jako např. chrupavka nebo kost (22). MSC touto kapacitou podporují místní tkáňové specifické buněčné prekurzory poškozených orgánů a účastní se reparačních procesů (7).
VYUŽITÍ MEZENCHYMÁLNÍCH KMENOVÝCH BUNĚK V OTORINOLARYNGOLOGII
Fonochirurgie
Významnou oblastí využití MSC v otorinolaryngologii je fonochirurgie. Injektáž MSC do hlasivek podporuje jejich remodelaci, zlepšuje prokrvení tkáně, snižuje fibrózu a tvorbu jizev. Růstové faktory a proteiny extracelulární matrix (ECM) produkované MSC podporují dlouhodobou regeneraci tkáně a zlepšují poddajnost (pliabilitu) podslizniční tkáně (lamina propria). Kmenové buňky získané z tukové tkáně (ASC) ovlivňují tvorbu jizev zvýšenou expresí kyseliny hyaluronové a hepatocytárního růstového faktoru a snížením sekrece kolagenu. Kmenové buňky získané z kostní dřeně (BM MSC) snižují expresi kolagenu typu I (6). V experimentu na zvířeti vedla injektáž BM MSC k úpravě viskoelastických vlastností a tloušťky bazální membrány dlaždicobuněčného epitelu mechanicky poraněné hlasivky na úroveň hlasivky neporaněné (33). MSC po injektáži v hlasivce nepřežívají, hojení je ovlivněno působením bioaktivních molekul. MSC tedy mají vliv jen krátkodobý, 3 měsíce po injektáži do hlasivky nebyly MSC v tkáni již prokázány. Byl publikován také přízniví efekt injektáže MSC izolovaných z laryngální sliznice (26).
Mnoho studií se věnuje biomechanickým vlastnostem směsi MSC a příslušného nosiče, jako je kolagen, fibrin nebo kyselina hyaluronová (8, 10, 24). Extenzivně jsou studovány MSC v hydrogelu kyseliny hyaluronové, které zvyšují regeneraci postižené tkáně ve srovnání s biomateriálem bez MSC (10). Dochází ke zvýšení produkce elastinu, což podporuje remodelaci postižené tkáně (24). Produkce bioaktivních molekul MSC a obnovení potřebného objemu lamina propria superficialis hydrogelem kyseliny hyaluronové se jeví jako optimální léčba povrchových hlasivkových lézí. MSC vázané na příslušný nosič jsou využívány také k augmentaci atrofických nedomykavých hlasivek (insuficience glotis).
In vitro je studována léčba i rozsáhlejších hlasivkových lézí. Byla úspěšně vytvořena náhrada epiteliální a ligamentózní části hlasivky dvěma liniemi MSC (17). Jako nosič byl použit fibrinový gel. Epiteliální vrstva byla tvořena ASC diferencovanými ve smyslu epiteliálního fenotypu s expresí E-cadherinu a keratinu 8. ASC uvnitř gelu se diferencovaly do mezenchymálního fenotypu s expresí vimentinu. Funkční studie prokázaly obdobné vlastnosti artificiálně vytvořeného povrchu hlasivky v porovnání s hrtanem na kadaveru (16).
Studie ukazují, že MSC jsou velkým příslibem pro léčbu hlasivkových lézí, ať už prevenci nežádoucích jizev či léčbu atrofie hlasivky. Výzkum se také zaměřil na možnost ovlivnění parézy n. laryngeus recurrens. Nejčastější příčinou jsou iatrogenní léze nervu po operacích štítné žlázy či příštítných tělísek. Využití neurogenně diferencovaných MSC v uvedené indikaci zatím publikované nebylo. V experimentálním modelu na zvířeti jsou studovány autologní svalové MSC (4). Bylo prokázáno přežívání MSC a jejich fůze s denervovanými myofibrilami. Nejlepší efekt má kombinace kmenových buněk s insulin-like growth faktor 1 (IGF-1) nebo ciliárním neurotrofickým faktorem (SNTF). MSC signifikantně snižují denervační atrofii myofibril hrtanových svalů.
Chirurgie průdušnice
Rozsáhlejší stenózy či defekty stěny průdušnice jsou velmi obtížně chirurgicky řešitelné. Nové možnosti náhrady části dýchacích cest přináší buněčná terapie. MSC jsou využívány k osídlení decelularizovaných alogenních štěpů, tvorbě arteficiální autologní chrupavky, snížení reakce štěpu vůči hostiteli u alogenní transplantace nebo osídlení artificiálně vytvořené tracheální náhrady (2, 6, 23, 32). Cílem využití MSC je vývoj biokompatibilního štěpu, který tvoří dostatečně pevnou stěnu trubice, jejíž lumen nekolabuje při negativním tlaku v inspiriu. Na animálním modelu byly publikovány transplantace decelularizovaných alogenních štěpů, které se osídlují v zevní vrstvě MSC diferencovaných v chondrocyty a epiteliálními buňkami v luminu trachey. Při použití artificiálních tracheálních náhrad bylo na zvířecích modelech prokázáno prodloužení životnosti a zlepšení funkce při osídlení trubice MSC. MSC jsou využívány na různých nosičích, např. kolagenní hydrogel (23), kolagen s polypropylenem (32). Metody náhrady průdušnice zatím zůstávají na úrovni experimentálního výzkumu, nebyly úspěšně zavedeny do humánní medicíny.
Otologie
Léčba percepční nedoslýchavosti je v současnosti stále velmi svízelná a výsledky léčby jsou neuspokojivé. Účinek MSC na oblast vnitřního ucha se stal předmětem zájmů mnoha studií. Přestože byl prokázán pozitivní efekt MSC na regeneraci buněk ganglion spirale (2), limitující je způsob aplikace buněk do vnitřního ucha. Na zvířecím modelu bylo prokázáno, že je nutné aplikovat MSC přímo do místa léze (11, 18). V případě poruchy neuronů ganglion spirale cochleae je nutno směřovat injektáž MSC přímo do modiolu. Po aplikaci do scala tympani nebyly MSC v modiolu vůbec prokázány. Pro léčbu senzorineurální nedoslýchavosti způsobenou lézí vláskových buněk vnitřního ucha je nutno MSC kultivovat ve smyslu percepčního epitelu. Zatímco diferenciace MSC v neuron je již známa a klinicky aplikovaná, diferenciace MSC ve vláskové buňky vnitřního ucha jsou pouze ve stadiu vývoje. Jednou z možností konverze MSC kostní dřeně ve vláskové buňky je kultivace s buňkami vyvinutého senzorického epitelu vnitřního ucha (9).
Zatímco ovlivnění funkce buněk vnitřního ucha nebyla doposud v žádné studii prokázána, mnohem dále je výzkum v oblasti osteoneogeneze. Schopnost MSC diferencovat se do kostních buněk, tzv. osteoblastů, vedlo k použití v biologicky orientovaných metodách kostní reparace. Buněčná odpověď realizovaná trombocyty, zánětlivými buňkami a makrofágy pronikajícími do oblasti poraněné kosti spouští vyplavení MSC, které se diferencují na osteoblasty (13).
Od roku 2012 probíhá v České republice experimentální výzkum s využitím MSC v chirurgii spánkové kosti. Výzkum je zaměřen na pacienty po operacích chronického středoušního zánětu s cholesteatomem otevřenou technikou. Pacienti s otevřenou trepanační dutinou jsou odkázáni na pravidelnou specializovanou lékařskou péči, jsou omezeni v koupání a nemohou využívat konvenční sluchadla ke korekci sluchu. Současné operační techniky obliterace trepanační dutiny mohou snížit obtíže pacientů, zmenšit velikost trepanační dutiny, ale nemohou obnovit normální anatomické parametry zevního zvukovodu a středního ucha. Cílem chirurgické techniky s využitím MSC je rekonstrukce pooperačních defektů spánkové kosti, která oddělí vzdušnou středoušní dutinu od zevního zvukovodu, obnoví fyziologické poměry v oblasti středního a zevního ucha a zajistí mechanickou bariéru proti přestupu infekce do středouší. Výzkumní pracovníci z Kliniky otorinolaryngologie a chirurgie hlavy a krku FN Hradec Králové a Ústavu experimentální medicíny Akademie věd České republiky vytvořili zvířecí modely pro implantaci MSC k rekonstrukci pooperačních defektů spánkové kosti, na kterých jsou zkoumány vlastnosti novotvořené kosti a možnosti využití této techniky v humánní medicíně (31). Jsou využívány xenogenní (lidské) MSC získané z kostní dřeně dárců. Za aseptických podmínek a v souladu se správnou výrobní praxí jsou buňky kultivovány a separovány na základě jejich morfologie a plastické adherence. Pro implantaci jsou buňky získány z třetí pasáže. Jejich identita je potvrzena analýzou povrchových markerů pomocí cytometrie (FACS). Před implantací jsou MSC navázány na osteokondukční nosič. Potřebná viskozita a adhezivita biomateriálu je zajištěna adekvátním množstvím tkáňového lepidla. Na zvířecím modelu morčete (obr. 1, obr. 2) je studován stupeň osteoneogeneze, angioneogeneze a zánětlivé reakce v biomateriálu. Výsledný efekt implantace na reálně velkém defektu kosti je studován na zvířecím modelu prasete (obr. 3). Využití této nové kostní reparace v humánní medicíně vyžaduje další výzkum efektu a bezpečnosti metody.
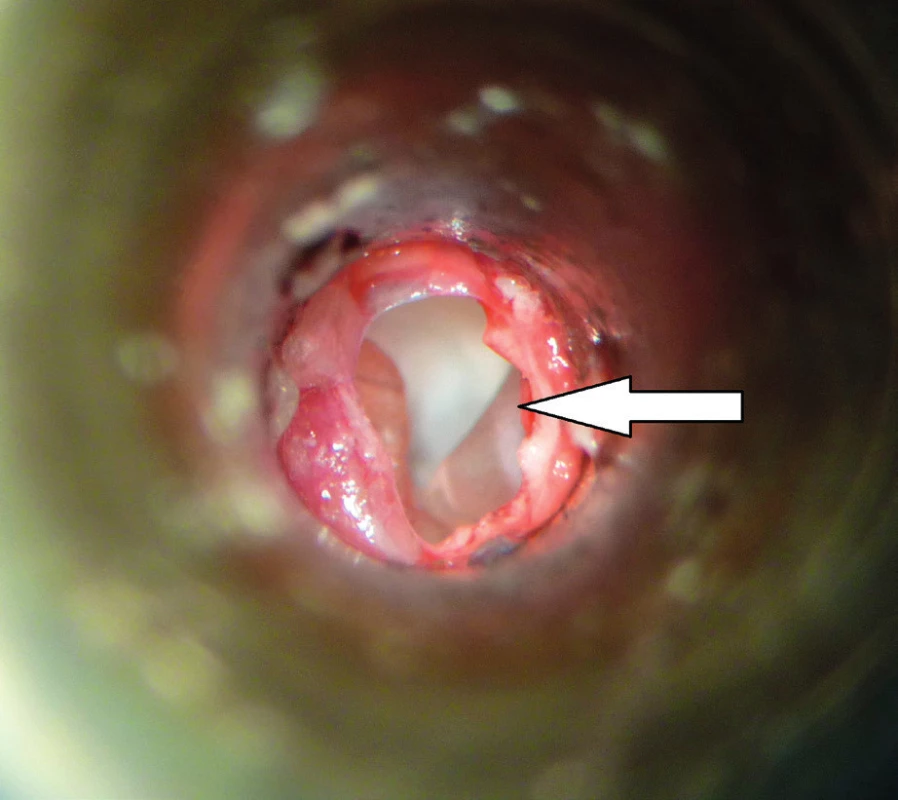
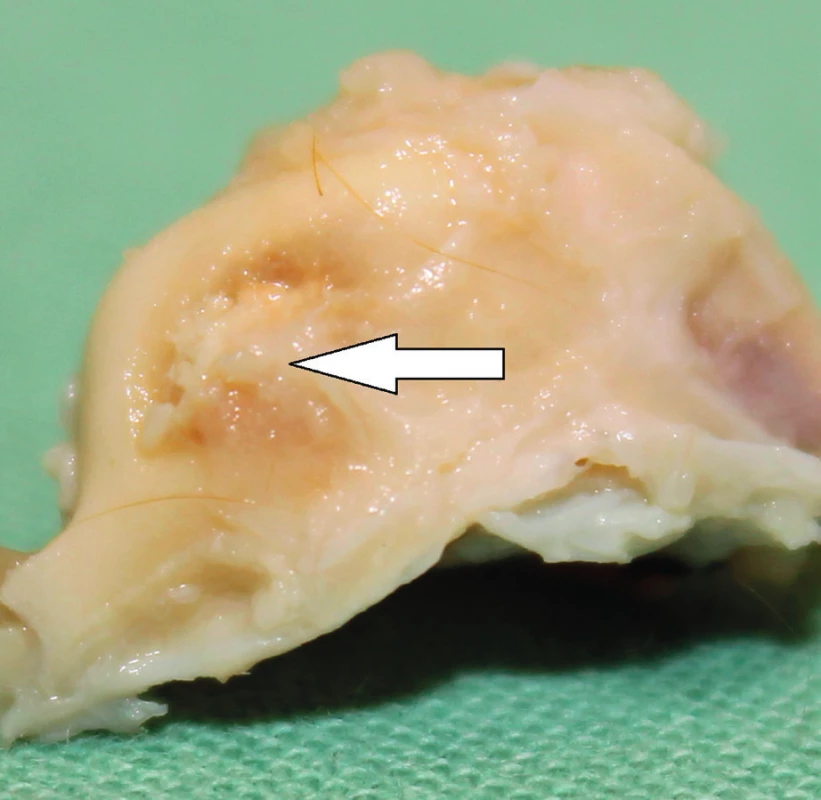
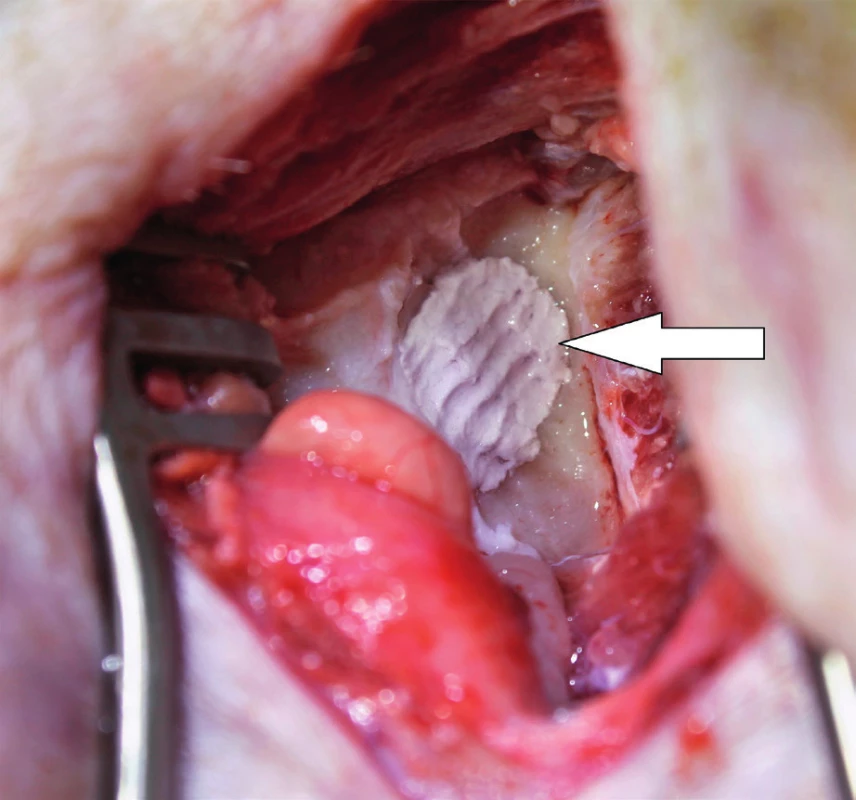
Terapie kožních defektů
MSC jsou využívány k hojení kožních defektů. Aplikací do kožní rány urychluje hojení díky parakranní produkcí bioaktivních molekul s podporou neovaskularizace (5). MSC stimulují tvorbu extracelulární matrix (ECM), angiogenezi a proliferaci buněk. Mohou být využity jak při rekonstrukci ztrátových kožních poranění či operačních defektů, tak k hojení kožních defektů po popálení či radiační terapii (14). Injekce MSC jsou využívány k podpoře hojení obvykle v kombinaci s dalšími chirurgickými i nechirurgickými technikami léčby (debridement, přenos volných kožních štěpů, lokální aplikace léků podporujících hojení rány).
MSC vázané na nosič mohou být využity ke krytí kožních defektů a svým objemem mohou redukovat potřebu autologních kožních přenosů. Avšak takové artificiální kožní štěpy v současnosti nejsou k dispozici pro klinickou praxi.
MSC jsou také využívány k augmentaci měkkých tkání. Při přenosu tukové tkáně příměs MSC snižuje zánětlivou reakci a zlepšuje dlouhodobé přežívání štěpu, snižuje pooperační atrofii a resorpci tukové tkáně (19).
ZÁVĚR
Rozvoj tkáňového inženýrství vede k hledání uplatnění MSC ve všech medicínských oborech. Také v oblasti otorinolaryngologie dochází k výzkumu aplikací MSC při hojení poraněné tkáně či náhradě tkáně při ztrátových poraněních. Mezi nejčastější indikace patří lokální injektáž do poraněné tkáně, kdy regeneraci postižené tkáně ovlivňují především uvolněné růstové faktory a není nutná inkorporace a dlouhodobé přežívání implantovaných MSC. V případě náhrady rozsáhlejších defektů je nutná náhrada viabilními MSC na příslušném nosiči, které jsou inkorporovány do místa implantace. Tato obtížnější procedura je v současnosti jen ve fázi studií na experimentálních zvířecích modelech. Také v České republice probíhá výzkum využití MSC v otorinolaryngologii. Od roku 2012 je výzkum zaměřen na chirurgii spánkové kosti. Byly vytvořeny zvířecí modely pro implantaci MSC na osteokondukčním nosiči k rekonstrukci pooperačních defektů spánkové kosti, na kterých jsou zkoumány vlastnosti novotvořené kosti.
V současné době stále dominuje výzkum MSC na úrovni preklinického výzkumu. Klinické využití v humánní medicíně čeká na další výsledky výzkumu, průkaz efektu a bezpečnosti léčby. Využití MSC v běžné léčebné praxi brání také vysoká cena biomateriálu.
Práce byla podpořena projektem MZ ČR – RVO (FNHK, 00179906) a programem PRVOUK 37/06 (LF UK).
Adresa ke korespondenci:
MUDr. Lukáš Školoudík, Ph.D.
Klinika ORL chirurgie hlavy a krku LF UK a FN
Sokolská 581
500 05 Hradec Králové
e-mail: skololuk@fnhk.cz
Zdroje
1. Aggarwal, S., Pittenger, M. F.: Human mesenchymal stem cells modulate allogeneic immune cell responses. Blood, 205, 2005, s. 1815-1822.
2. Bas, E., Van De Water, T. R., Lumbreras, V. et al.: Adult human nasal mesenchymal-like stem cells restore cochlear spiral ganglion neurons after experimental lesion. Stem Cells Dev., 23, 2014, s. 502-514.
3. Go, T., Jungebluth, P., Baiguero, S. et al.: Both epithelial cells and mesenchymal stem cell-derived chondrocytes contribute to the survival of tissue-engineered airway transplants in pigs. J. Thorac. Cardiovasc. Surg., 139, 2010, s. 437-443.
4. Halum, S. L., Hiatt, K. K., Naidu, M. et al.: Optimization of autologous muscle stem cell survival in the denervated hemilarynx. Laryngoscope, 118, 2008, s. 1308-1312.
5. Hanson, S. E., Bentz, M. L., Hematti, P.: Mesenchymal stem cell therapy for nonhealing cutaneous wounds. Plast. Reconstr. Surg., 125, 2010, s. 510-516.
6. Hertegard, S., Cedervall, J., Svensson, B. et al.: Viscoelastic and histologic properties in scarred rabbit vocal folds after mesenchymal stem cell injection. Laryngoskope, 116, 2006, s. 1248-1254.
7. Hilfiker, A., Kasper, C., Hass, R. et al.: Mesenchymal stem cells and progenitor cells in connective tissue engineering and regenerative medicine: is there a future for transplantation?, Langenbecks Arch. Surg., 396, 2011, s. 489-497.
8. Chen, X., Thibeault, S. L. et al.: Biocompatibility of a synthetic extracellular matrix on immortalized vocal fold fibroblasts in 3-D culture. Acta Biomater., 6, 2010, s. 2940-2948.
9. Jeon, S. J., Oshima, K., Heller, S. et al.: Bone marrow mesenchymal stem cells are progenitors in vitro for inner ear hair cells. Mol. Cell Neurosci., 34, 2007, s. 59-68.
10. Johnson, B. Q., Fox, R., Chen, X. et al.: Tissue regeneration of the vocal fold using bone marrow mesenchymal stem cells and synthetic extracellular matrix injections in rats. Laryngoscope, 120, 2010, s. 537-545.
11. Kasagi, H., Kuhara, T., Okada, H. et al.: Mesenchymal stem cell transplantation to the mouse cochlea as a treatment for childhood sensorineural hearing loss. Int. J. Pediatr. Otorhinolaryngol., 77, 2013, s. 936-942.
12. King, S. N., Hanson, S. E., Hematti, P. et al.: Current applications of mesenchymal stem cells for tissue replacement in otolaryngology-head and neck surgery. Am. J. Stem Cells, 30, 2012, s. 225-238.
13. Kon, E., Muraglia, A., Cosi, A. et al.: Autologous bone marrow stroma cells loaded onot porous hydroxyapatite ceramic accelerate bone repair in critical-size defects of sheep long bones, J. Biomed. Mat. Res., 49, 2000, s. 328-337.
14. Lataillade, J. J., Doucet, C., Bey, E. et al.: New approach to radiation burn treatment by dosimetry-guided surgery combined with autologous mesenchymal stem cell therapy. Regen. Med., 2, 2007, s. 785-794.
15. Lin, G., Liu, G., Banie, L. et al.: Tissue distribution of mesenchymal stem cell marker Stro-1, Stem Cells Dev., 20, 2011, s. 1747-1752.
16. Long, J. L., Neubauer, J., Zhang, Z. et al.: Functional testing of a tissueengineered vocal fold cover replacement. Otolaryngol. Head Neck Surg., 142, 2010, s. 438-440.
17. Long, J. L., Zuk, P., Berke, G. S. et al.: Epithelial differentiation of adipose-derived stem cells for laryngeal tissue engineering. Laryngoskope, 120, 2010, s. 125-131.
18. Majore, I., Moretti, P., Stahl, F. et al.: Growth and differentiation properties of mesenchymal stromal cell populations derived from whole human umbilical cord, Stem Cell Rev. Rep., 7, 2011, s. 17-31.
19. Matsumoto, D., Sato, K., Gonda, K. et al.: Cell-assisted lipotransfer: Supportive use of human adiposederived cells for soft tissue augmentation with lipoinjection. Tissue Eng, 12, 2006, s. 3375-3382.
20. Matsuoka, A. J., Kondo, T., Miyamoto, R. T. et al.: Enhanced survival of bone-marrow-derived pluripotent stem cells in an animal model of auditory neuropathy. Laryngoscope, 117, 2007, s. 1629-1635.
21. Méndez-Ferrer, S., Michurina, T. V., Ferraro, F. et al.: Mesenchymal and haematopoietic stem cells form a unique bone marrow niche, Nature, 466, 2010, s. 829-834.
22. Mobasheri, A., Csaki, C., Clutterbuck, A. L. et al.: Mesenchymal stem cells in connective tissue engineering and regenerative medicine: applications in cartilage repair and osteoarthritis therapy, Histol. Histopathol., 24, 2009, s. 347-366.
23. Naito, H., Tojo, T., Kimura, M. et al.: Engineering bioartificial tracheal tissue using hybrid fibroblast-mesenchymal stem cell cultures in collagen hydrogels. Interact. Cardiovasc. Thorac Surg., 12, 2011, s. 156-161.
24. Park, H., Karajanagi, S., Wolak, K. et al.: Three-dimensional hydrogel model using adipose-derived stem cells for vocal fold augmentation. Tissue Eng. Part A, 16, 2010, s. 535-543.
25. Peng, L., Jia, Z., Yin, X. et al.: Comparative analysis of mesenchymal stem cells from bone marrow, cartilage, and adipose tissue, Stem Cells Dev., 17, 2008, s. 761-773.
26. Peng, H., Ming, L., Yang, R. et al.: The use of laryngeal mucosa mesenchymal stem cells for the repair the vocal fold injury. Biomaterials, 34, 2013, s. 9026-9035.
27. Phinney, D. G., Prockop, D. J.: Concise review: Mesenchymal stem/multipotent stromal cells: The state of transdifferentiation and modes of tissue repair--current views. Stem Cells, 25, 2007, s. 2896-2902.
28. Prockop, D. J., Oh, J. Y.: Mesenchymal stem stromal cells (MSCs): Role as guardians of inflammation. Mol. Ther., 20, 2012, s. 14-20.
29. Qian, H., Le Blanc, K., Sigvardsson, M. et al.: Primary mesenchymal Stem and progenitor cells from bone marrow lack expression of CD44 protein. J. Biol. Chem., 287, 2012, s. 25795-25807.
30. Skoloudik, L., Chrobok, V., Kalfert, D. et al.: Multipotent mesenchymal stromal cells in otorhinolaryngology. Med. Hypotheses, 82, 2014, s. 769-773.
31. Skoloudik, L., Chrobok, V., Kalfert, D. et al.: Human multipotent mesenchymal stromal 4. cells in the treatment of postoperative temporal bone defect: an animal model. Cell Transplant., oct 22, 2015, PubMed PMID: 26497735
32. Suzuki, T., Kobayashi, K., Tada, Y. et al.: Regeneration of the trachea using a bioengineered scaffold with adipose-derived stem cells. Ann. Otol. Rhinol. Laryngol, 117, 2008, s. 453-463.
33. Svensson, B., Nagubothu, R. S., Cedervall, J. et al.: Injection of human mesenchymal stem cells improves healing of scarred vocal folds: Analysis using a xenograft model. Laryngoscope, 120, 2010, s. 1370-1375.
34. Viateau, V., Guillemin, G., Bousson, V. et al.: Long-bone critical-size defects treated with tissue-engineered grafts: A study on Wheel. J. Orthop. Res., 25, 2007, s. 741-749.
35. Warren, S., Nacamuli, R. K., Song, H. J. et al.: Tissue-engineered bone using mesenchymal stem cells and a biodegradable scaffold. J. Craniofac. Surg., 15, 2004, s. 34-37.
Štítky
Audiológia a foniatria Detská otorinolaryngológia OtorinolaryngológiaČlánok vyšiel v časopise
Otorinolaryngologie a foniatrie

2016 Číslo 2
- Aktuálne možnosti terapie chronickej zápalovej demyelinizačnej polyradikuloneuropatie (CIDP)
- Odporúčania na liečbu sekundárnej imunodeficiencie v hematoonkológii
- Sekundárna imunodeficiencia z pohľadu hematoonkológa
Najčítanejšie v tomto čísle
- Aspiračná cytológia versus peroperačná histológia v diagnostike uzlov štítnej žľazy
- Volná sdělení (VS)
- Adultní xantogranulom supraklavikulární oblasti
- Postery (P)
