-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Neuromonitoring zvratného nervu během operace štítné žlázy – výsledky a zkušenosti
Neuromonitoring of the recurrent laryngeal nerve in thyroid gland surgery – results and experiences
Paresis of the recurrent laryngeal nerve (RLN) is one of the serious complications of thyroid and parathyroid gland surgery. The intraoperative neural monitoring (IONM) enables to verify the functionality of RLN. The aim of this study is to compare the incidence of postoperative RLN palsy in patients who underwent surgery with and without the use of IONM RLN and to evaluate the positive and negative predictive values, sensitivity, specifi city and accuracy of the method. Methods: Retrospective analysis of thyroid gland surgeries performed within the period from 1. 7. 2016 to 1. 7. 2018. A total of 467 operations were performed (780 nerves exposed). One hundred and thirty procedures (215 nerves) were carried out without IONM (group A). In total, 337 procedures (565 nerves) were performed with IONM (group B). Results: In group A, unilateral postoperative RLN paresis occurred in 7 cases (3.26%); 6 of them were temporary (2.79%) and 1 was permanent (0.47%). In group B, unilateral postoperative RLN paresis occurred in 33 cases (5.84%); 32 of them were temporary (5.66%) and 1 was permanent (0.18%). The incidence of postoperative RLN paresis related to the use of IONM was not considered statistically signifi cant. (Chi-square test: P = 0.146; Fisher‘s exact test: P = 0.2015, P = 0.4715). The sensitivity, specifi city, positive predictive value, negative predictive value and accuracy were 78.79%, 99.25%, 86.67%, 98.69%, and 98.05%, respectively. There was no case of bilateral postoperative RLN paresis. Conclusion: There was no statistically significant diff erence in the incidence of postoperative RLN palsy in patients who underwent surgery with IONM compared to the group without IONM. The high negative predictive value, specifi city and accuracy indicate high reliability of the method. The IONM provides the surgeon with valuable information regarding the functional status of the nerve. This knowledge allows for changing the operative strategy during the procedure.
Keywords:
intraoperative neural monitoring – IONM – recurrent laryngeal nerve injury – recurrent laryngeal nerve – thyroid surgery
Autori: Hložek J.; Rotnágl J.; Astl J.
Pôsobisko autorov: Klinika otorinolaryngologie a maxilofaciální chirurgie 3. LF UK a ÚVN Praha
Vyšlo v časopise: Otorinolaryngol Foniatr, 70, 2021, No. 2, pp. 89-96.
Kategória: Původní práce
doi: https://doi.org/10.48095/ccorl202189Súhrn
Jedna ze závažných komplikací chirurgie štítné žlázy a příštítných tělísek je pooperační paréza nervus laryngeus recurrens (NLR). Intraoperační neuromonitoring (IONM) umožňuje ověření funkčního stavu NLR. Cílem práce je porovnat výskyt pooperační parézy NLR u pacientů operovaných pro onemocnění štítné žlázy bez IONM NLR a s IONM NLR a zhodnotit pozitivní a negativní prediktivní hodnotu, senzitivitu a specifi citu metody. Metodika: Retrospektivně hodnocený soubor operací štítné žlázy v období 1. 7. 2016–1. 7. 2018. Celkem bylo provedeno 467 operací (780 nervů exponováno). Bez použití IONM (skupina A) bylo provedeno 130 výkonů (215 nervů). S použitím IONM (skupina B) bylo provedeno 337 výkonů (565 nervů). Výsledky: Ve skupině A se vyskytla jednostranná pooperační paréza NLR v 7 případech (3,26 %), z toho 6x dočasná (2,79 %) a 1x trvalá (0,47 %). Ve skupině B se vyskytla jednostranná pooperační paréza NLR v 33 případech (5,84 %), z toho 32x dočasná (5,66 %) a 1x trvalá (0,18 %). Výskyt pooperační parézy NLR vzhledem k použití IONM nebyl hodnocen jako statisticky signifi kantní (Chi-square test: p = 0,146; Fisherův exaktní test: p = 0,2015, p = 0,4715). Senzitivita IONM byla 78,79 %, specifi cita 99,25 %, pozitivní prediktivní hodnota 86,67 %, negativní prediktivní hodnota 98,69 %, přesnost metody 98,05 %. Oboustranná pooperační paréza NLR se v daném souboru nevyskytla. Závěr: V souboru nebyl zjištěn statisticky významný rozdíl výskytu pooperační parézy NLR u pacientů operovaných s IONM ve srovnání se skupinou bez IONM. Vysoká specifi cita, negativní prediktivní hodnota a přesnost poukazuje na vysokou spolehlivost metody. IONM dává operatérovi cennou informaci ohledně funkčního stavu nervu. Tato skutečnost umožňuje peroperačně měnit strategii léčby.
Klíčová slova:
intraoperační neuromonitoring – IONM – poranění zvratného nervu – nervus laryngeus recurrens – chirurgie štítné žlázy
Úvod
Chirurgická léčba onemocnění štítné žlázy (ŠŽ) patří mezi časté výkony v chirurgii hlavy a krku. Mezi komplikace chirurgie ŠŽ patří krvácení, infekce v operační ráně, hypoparatyreóza a postižení zvratného nervu (NLR – nervus laryngeus recurrens) [1]. Omezená funkce NLR může snižovat kvalitu života jak po stránce zdravotní, tak po stránce společenské pro dysfonické obtíže či zátěžovou až klidovou dušnost [2]. Mezi nejobávanější komplikace se řadí oboustranná paréza NLR s rizikem asfyxie vyžadující urgentní (mnohdy trvalé) zajištění dýchacích cest [1, 3].
Zavedení vizualizace zvratného nervu během operace ŠŽ významně snížilo výskyt pooperační parézy NLR [4–6]. Vizualizace se stala doporučeným postupem označovaným za zlatý standard chirurgie ŠŽ [7]. Samotnou vizualizací však operatér nezískává informaci o funkčním stavu nervu, který nemusí být vždy shodný s nálezem anatomickým [5, 6, 8, 9].
Intraoperační neuromonitoring (IONM) je neurofyziologická metoda umožňující intermitentní či kontinuální ově - nejedření funkce a anatomickou identifi kaci NLR [8]. Principem IONM je kontakt stimulační elektrody s motorickým nervem. Elektrický stimul je veden eferentní nervovou dráhou k inervované skupině svalů, kde je akční potenciál (AP) zachycen snímající elektrodou (schéma 1). Výsledkem je grafický záznam AP (schéma 2). Při IONM chirurgie ŠŽ přikládáme stimulační elektrodu (intenzita do 1,5 mA) na NLR či nervus vagus (NV). Snímající elektroda je v kontaktu s hlasovými svaly přímo (intubační rourka s elektrodami) či nepřímo (translaryngeální jehličkové elektrody). Výsledkem stimulace je záznam AP, kde sledujeme hodnoty latence (ms), amplitudy (μV) a doby trvání AP (ms) [10]. Latenci definujeme jako čas potřebný k přenosu elektrického signálu z místa stimulace k vyvolání AP. Hodnota amplitudy informuje o elektrické energii zachycené snímající elektrodou. Primárně naměřené hodnoty se mohou lišit v případě nedokonalého kontaktu snímající elektrody s hlasivkami (např. luxace jehličkové elektrody, rotovaná intubační rourka...), v případě nedokonalé či nepřímé stimulace nervu (např. ze vzdáleného pole, přes okolní tkáně, krevní sraženinu...) či v případě stimulace odlišného místa, resp. vzdálenosti od hlasových vazů (např. rozdílná hodnota latence při stimulaci NLR, NV vpravo a NV vlevo) [8, 10, 11]. Dochází - li však během výkonu v porovnání s primárním měřením k náhlým změnám hodnot AP (pokles amplitudy o více než 50 %, prodloužení latence o více než 10 %), získáváme po předchozím vyloučení technické chyby informaci o změně funkčního stavu nervu a riziku jeho dočasného či trvalého postižení [10–12]. V poslední době je snaha o určení „normálních“ kvantitativních parametrů AP jakožto možné prediktivní hodnoty stran pooperační funkce NLR. Lorenz a German Neuromonitoring Study Group [10] prezentuje v prospektivní multicentrické studii mediány hodnot latence a amplitudy (latence, ms: levý NV 5,9, pravý NV 3,91, levý NLR 2,73, pravý NLR 2,73; amplituda, μV: levý NV 460, pravý NV 511, levý NLR 719, pravý NLR 622,5).
Schéma 1. Schéma IONM.
Scheme 1. IONM scheme.
Schéma 2. Schéma AP, latence, amplituda.
Scheme 2. Scheme AP, latency, amplitude.
Největším limitem hodnocení parametrů AP a jejich potenciálního jednotného využití pracovišti se zdá být nejed notnost monitorujících přístrojů, typů stimulačních a snímajících elektrod a nejednotnost lokality stimulace, tedy vzdálenosti od hlasových vazů, či nedokonalý převod elektrického stimulu na nervovou tkáň.
Rozlišujeme neurostimulaci intermitentní a kontinuální (APS – automatic pulse stimulation, C-IONM – continous intraoperative neuromonitoring). V případě intermitentní stimulace je ověřena funkce nervové struktury jednotlivými stimuly v daný moment na určitém místě (NLR, NV, NLS – nervus laryngeus superior). C-IONM ověřuje nervovou funkci opakovanými stimuly pomocí elektrody přiložené na NV, a minimalizuje tak riziko vzniku nervové léze v mezidobí intermitentní stimulace. V případě podezření na postupně se vyvíjející nervovou lézi má operatér možnost v reálném čase upravit chirurgický postup, a to i v době, kdy prozatím nebyl NLR vizualizován. Pilotní studie C-IONM nepoukazují na významné nepříznivé kardiogenní, pulmonální či gastrointestinální vedlejší účinky [9, 12, 13].
Cíl práce
Cílem práce je porovnat výskyt jednostranné, oboustranné, dočasné a trvalé pooperační parézy u pacientů operovaných technikou „prosté vizualizace“ a technikou „vizualizace + neuromonitorace“ NLR a zhodnotit spolehlivost, resp. senzitivitu, specifi citu, pozitivní a negativní prediktivní hodnotu a přesnost metody IONM.
Metodika a popis souboru
Retrospektivně hodnocený soubor operací pro benigní i maligní onemocnění ŠŽ na pracovišti ORL kliniky 3. LF UK a ÚVN v období 1. 7. 2016–1. 7. 2018. Operace byly provedeny zevním přístupem dvěma zkušenými chirurgy, každý s odoperovaným více než 1 000 výkonů na ŠŽ. NLR byl standardně vizualizován nad křížením s a. thyreoidea inferior v oblasti kaudálně od ligamenta Berry metodou transpozice Wangova bodu [1]. U ka - hodždého pacienta byla provedena předoperačně a pooperačně (do 24 hodin po výkonu) zvětšovací laryngoskopie. V případě pooperační parézy NLR byla zahájena antiedematózní léčba, vitaminoterapie B a foniatrická péče. Jako trvalé postižení NLR jsme hodnotili parézu trvající déle než 12 měsíců.
V případě IONM byla v úvodu anestezie použita krátko - či střednědobě působící myorelaxancia (Suxamethonium, Mivacurium, Rocuronium). Snímající invazivní jehličkové elektrody byly transkonicky aplikovány do m. vocalis. Neinvazivní na orotracheální tubě přítomné elektrody byly pod kontrolou přímé laryngoskopie uloženy mezi hlasové vazy. Stimulační elektroda byla použita monopolární (intenzita stimulu 0,5–1 mA). Jako adekvátní odpověď funkčního nervu jsme hodnotili AP o amplitudě více než 100 μV s odpovídající latencí místu stimulace. Elektromyografický záznam byl proveden na přístroji MEDTRONIC NIM-NEURO 3.0. Jako správně pozitivní výsledek (true positive – TP) hodnotíme stav, kdy IONM předpokládá parézu NLR, která se pooperačně potvrdí. Falešně pozitivní výsledek (false positive – FP) hodnotíme jako stav, kdy i přes IONM předpokládanou parézu NLR je hlasivka pooperačně hybná. Jako správně negativní výsledek (true negative – TN) hodnotíme stav, kdy IONM předpokládá zachovanou funkčnost NLR, která se pooperačně potvrdí. Falešně negativní výsledek (false negative – FN) hodnotíme jako stav, kdy i přes IONM předpokládanou zachovanou funkčnost NLR se pooperačně vyskytuje paréza.
Celkem bylo provedeno 467 operací ŠŽ, z toho 318x totální tyroidektomie (TTE) a 149x hemityroidektomie (HTE), kdy v 73 případech bylo operováno na straně pravé a v 76 případech na straně levé. V 431 případech (299 TTE, 132 HTE) byl zvolen klasický chirurgický přístup, v 36 (19 TTE, 17 HTE) případech byl zvolen miniinvazivní přístup (délka řezu na krku do 3 cm). V souboru byla v 5 případech zaznamenána předoperační paréza NLR. Celkem bylo exponováno 780 zvratných nervů v riziku. 374 pacientů byly ženy s věkovým průměrem 50,55 (20–88 let). Třiadevadesát pacientů byli muži s věkovým průměrem 54,45 (27–87 let). Definitivní histologické dia gnózy byly: 259x nodózní struma (55,46 %), 70x GB toxická struma (14,99 %), 38x Hashimotova tyreoiditida (8,14 %), 80x papilární karcinom (17,13 %), 8x medulární karcinom (1,71 %), 6x folikulární karcinom (1,28 %), 1x nediferencovaný karcinom ŠŽ (0,21 %), 3x maligní B lymfom (0,64 %), 1× metastáza karcinomu mléčné žlázy (0,21 %), 1x metastáza karcinomu ledviny (0,21 %) (graf 1).
Graf 1. Procentuální zastoupení podle definitivní histologie.
Graph 1. Percentage according to definitive histology.
Metodou standardní vizualizace NLR (skupina A) bylo provedeno 130 výkonů, z toho 85x TTE a 45x HTE. Celkový počet exponovaných nervů v riziku ve skupině A byl 215. Metodou vizualizace NLR + IONM NLR (skupina B) bylo provedeno 337 výkonů, z toho 233x TTE a 104x HTE. V 5 případech byla zaznamenána předoperační paréza NLR. Celkový počet exponovaných nervů v riziku ve skupině B byl 565.
Pravděpodobnost výskytu pooperační parézy NLR ve skupině A a B byla hod - všeonocena Chi Square (X²) a Fisherovým exaktním testem na hladině spolehlivosti alfa = 0,05.
Výsledky
Jednostranná pooperační paréza se vyskytla v 40 případech (5,13 %), z toho 38x dočasná (4,87 %) a 2x trvalá (0,26 %). Oboustranná paréza se v daném souboru nevyskytla. V 10 případech byla původně plánovaná TTE ukončena ve stadiu HTE pro IONM neadekvátní odpověď NLR. Ve druhé době následně endokrinolog indikoval totalizaci u 6 pacientů. Ve 2 případech se jednalo histologicky o nález papilárního karcinomu ŠŽ.
Ve skupině A bylo vizualizováno celkem 215 zvratných nervů. Jednostranná pooperační paréza NLR se vyskytla v 7 případech (3,26 %), z toho byla 6x hodnocena jako paréza dočasná (2,79 %) a 1x paréza trvalá (0,47 %). Oboustranná paréza NLR se v dané skupině nevyskytla (tab. 1, 2).
Tab. 1. Výskyt pooperační parézy celkem (dočasná + trvalá).
Tab. 1. Occurrence of postoperative paresis total (temporary + permanent).
Tab. 2. Výskyt pooperační parézy (trvalá).
Tab. 2. Occurrence of postoperative paresis (permanent).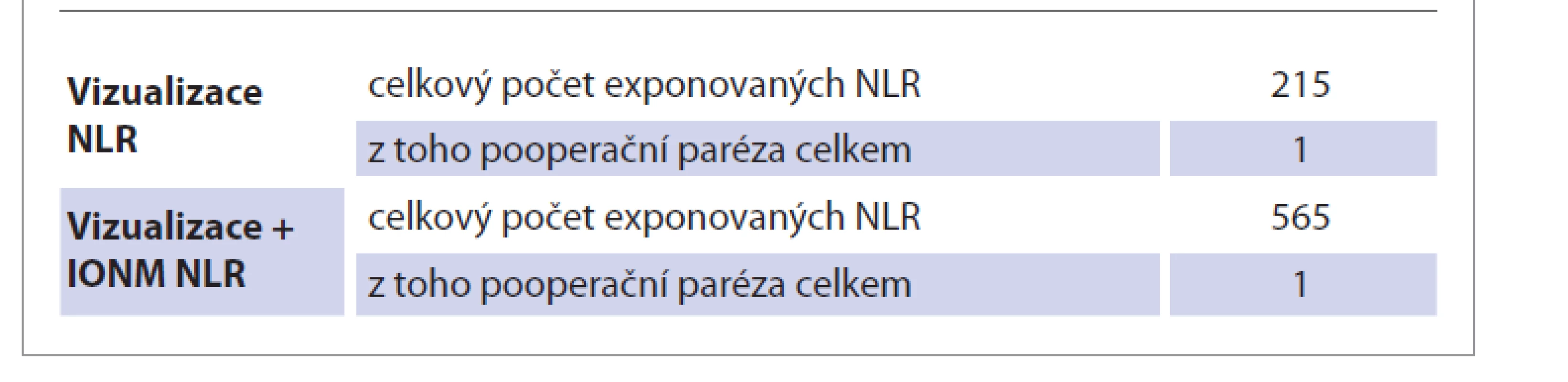
Výskyt pooperační parézy celkem
Ve skupině B bylo vizualizováno a monitorováno celkem 565 zvratných nervů. Jednostranná pooperační paréza NLR se vyskytla v 33 případech (5,84 %), z toho byla 32x hodnocena jako paréza dočasná (5,66 %) a 1x paréza trvalá (0,18 %). Oboustranná paréza NLR se v dané skupině nevyskytla (tab. 1, 2).
Na základě získaných dat nelze tvrdit, že by pravděpodobnost výskytu pooperační parézy NLR byla ve skupině A jiná než ve skupině B (Chi Square test: p = 0,146; Fisherův exaktní test: p = 0,2015). Zároveň nelze tvrdit, že existuje statisticky signifikantní rozdíl mezi výskytem trvalé pooperační parézy NLR ve skupině A a skupině B (Fisherův exaktní test: p = 0,4715) (graf 2).
Graf 2. Procentuální výskyt pooperační parézy NLR v souboru celkem, při vizualizaci NLR, při vizualizaci NLR + IONM.
Graph 2. Percentage incidence of postoperative NLR paresis in the group in total, during NLR visualization, during NLR + IONM visualization.
Ve skupině B bylo 26 správně pozitivních (TP), 4 falešně pozitivní (FP), 528 správně negativních (TN) a 7 falešně negativních případů (FN). Senzitivita IONM byla 78,79 %, specificita 99,25 %, pozitivní prediktivní hodnota 86,67 %, negativní prediktivní hodnota 98,69 % a přesnost metody 98,05 % (tab. 3, 4).
Tab. 3. Hodnocení funkce NLR (počet) podle odpovědi IONM a pooperačního laryngoskopického nálezu.
Tab. 3. Evaluation of NLR function (number) according to IONM response and postoperative laryngoscopic findings.
Tab. 4. Charakteristiky metody IONM, 95% CI značí 95% interval spolehlivosti (tj. s 95% pravděpodobností leží skutečná hodnota v tomto intervalu).
Tab. 4. Characteristics of the IONM method, 95% CI means a 95% confidence interval (ie with 95% probability the actual value lies in this interval).
V přímé souvislosti s neurostimulací NLR a NV jsme u operovaných pacientů nepozorovali zdravotní komplikace.
Diskuze
V chirurgii ŠŽ se výskyt pooperační parézy zvratného nervu udává od méně než 0,5 % do 20 % v závislosti na druhu onemocnění, typu chirurgického zákroku a operační technice [4, 8, 14, 15]. Pracoviště zabývající se problematikou chirurgie ŠŽ (označovaná za centra) udávají výskyt pooperační parézy NLR cca 0–5 % [8].
IONM je přijímán mnohými chirurgy jako „pomocná“ či „doplňková“ metoda ke standardu – vizualizaci NLR [4, 16, 17]. Randolph et al. uvádějí, že cca 53 % všeo - becných chirurgů a 65 % otorinolaryngologů v USA a více než 92 % endokrinochirurgů ŠŽ v Německu využívá IONM při vybraných či všech operacích ŠŽ [17]. German Practice Guidelines a International Neural Monitoring Study Group navrhuje zvážení použití IONM během každé operace ŠŽ. American Academy of Otolaryngology and Head and Neck Surgery navrhují IONM během TTE, revizního výkonu na ŠŽ a operaci na straně „jediného funkčního nervu“. American Head and Neck Society guidelines pro invazivní karcinom štítné žlázy pokládá IONM za nezbytný pro peroperační a pooperační znalost funkce NLR k plánování strategie léčby (totalizace, event. tracheostomie) a doporučuje jej při všech výkonech na maligních onemocněních ŠŽ [17].
Dralle et al. prezentují výsledky prospektivních nerandomizovaných studií porovnávajících výskyt pooperační parézy NLR za použití IONM (1 929 nervů v riziku) a samotnou vizualizací (6 671 nervů v riziku) [8]. Tato metaanalýza uvádí nižší výskyt pooperační parézy NLR ve skupině s IONM (dočasná 1,1–12,5 %, trvalá 0–1,4 %) oproti skupině bez IONM (dočasná 2,6–10,1 %, trvalá 0,3–2,5 %) [8].
Caló et al. prezentují na souboru 2 034 pacientů procentuálně nižší výskyt pooperační parézy NLR při použití IONM (dočasná 1,63 %, trvalá 0,58 %) oproti pacientům operovaným prostou vizualizací (dočasná 2,11 %, trvalá 0,7 %) [18]. Caló et al. uvádějí vysokou přesnost (99,23 %), specifi citu (99,41 %) a negativní prediktivní hodnotu (99,8 %) IONM [18].
Mirallie et al. prezentují v prospektivní multicentrické studii na souboru 1 328 pacientů výskyt pooperační parézy NLR ve skupině IONM 8,6 % a bez IONM 12,1 % [15]. Podle autorů byly výsledky statisticky nesignifikantní a IONM nesnižuje výskyt pooperační parézy NLR. IONM je ale užitečnou metodou k predikci funkčního stavu zvratného nervu [15].
Wojtczak et al. popisují IONM jako „hodnotnou“ metodu pro trénink a získání dovedností během chirurgie štítné žlázy za účelem identifi kace NLR a kompletního odstranění tkáně ŠŽ [2]. V prospektivní studii 632 pacientů udává výskyt pooperační parézy NLR před zavedením IONM 6,8 %. Po tříměsíčním operování s IONM a následným opětovným operováním bez IONM klesl výskyt pooperační parézy NLR ve třech po sobě jdoucích letech na 3,61 %, 2,65 % a 1,45 % [2].
Wu et al. porovnávají ve skupině 380 pacientů operovaných pro karcinom ŠŽ, zda IONM NLR umožní radikálnější odstranění tkáně ŠŽ, resp. je-li pooperačně kumulace Technecium-99m, hladina tyreoglobulinu a výskyt pooperační parézy NLR nižší oproti skupině bez IONM během 3 období (1. bez IONM, 2. časné zavedení IONM, 3. pozdní zavedení IONM) [19]. Výskyt pooperační parézy NLR měl klesající trend se zavedením IONM (7,9 %, 4,2 %,3,2 %), trvalá pooperační paréza NLR se vyskytovala pouze v 1. období (2,8 %), ve 2. a 3. období již pozorována nebyla. Jako statisticky signifikantní byl hodnocen pooperační pokles vychytávání Tc-99m, pokles hladiny tyreoglobulinu a zkrácení času operace po zavedení rutinní IONM [19].
Barczynski et al. udávají v prospektivní randomizované studii o souboru 1 000 pacientů plánovaných k TTE (1 000 exponovaných nervů v každé skupině) statisticky významně nižší výskyt dočasné pooperační parézy NLR ve skupině „monitorovaných“ oproti operacím bez IONM u výkonů s vyšším rizikem poranění NLR, jako např. maligní onemocnění ŠŽ, GB toxická struma, revizní výkon po operaci ŠŽ či jiné krční operaci s rizikem jizvení v oblasti NLR a NV [4]. Stran oboustranné parézy NLR je považována za rizikový výkon operace ŠŽ na straně „jediného“ funkčního zvratného nervu [4].
Melin et al. prezentují na souboru 2 546 pacientů v 64 případech ukončení plánované TTE ve stadiu HTE pro neadekvátní odpověď IONM NLR na „první“ operované straně s eventuální totalizací výkonu ve druhé době za účelem minimalizace výskytu oboustranné parézy (two stage surgery) [20]. Ve skupině, kde bylo operováno na straně druhé i přes předchozí ztrátu odezvy IONM, byl výskyt oboustranné pooperační parézy ve 4 případech. Ve skupině operované ve druhé době (totalizace po předchozí HTE) byl výskyt oboustranné parézy 0. Autoři hodnotí výsledky práce jako statisticky významné. V případě plánované TTE je doporučeno začít operovat na straně dominantní patologie z důvodů eventuálního ukončení výkonu a provedení totalizace ve druhé době [6, 11, 16, 20].
V mnoha publikacích [8, 14, 18, 21] se udává poměrně široké rozmezí hod - not senzitivity (23–100 %), specificity (94–99,7 %), negativní prediktivní hodnoty (91–100 %) a pozitivní prediktivní hodnoty (10–92,1 %). Tyto hodnoty jsou ovlivněny zejména mírou výskytu falešně negativních a falešně pozitivních odpovědí a udávají, do jaké míry se lze na metodu „spolehnout“. V prezentovaném souboru senzitivita udává, jaké procento z IONM označených paréz NLR je skutečně paretických (78,79 %). Specificita udává, jaké procento z IONM označených funkčních NLR je skutečně funkčních (99,25 %). Pozitivní prediktivní hodnota udává pravděpodobnost, že paréza je, když IONM „řekne“, že je (86,67 %). Negativní prediktivní hodnota udává pravděpodobnost, že paréza není, když IONM „řekne“, že není (98,69 %). Falešné „odpovědi“ jsou ve většině případů způsobeny technickými (chybná snímající či stimulující elektroda, nedokonalé nitrohrtanové uložení elektrody, chybné nastavení režimu stimulace atd.), anatomickými (stimulace dorzální větve NLR, stimulace přes okolní tkáně, přímá stimulace hrtanové elektrody, stimulace distálního pahýlu postiženého NLR atd.), anesteziologickými (přetrvávající myorelaxace, nedostatečně působící anestezie) či vyhodnocujícími nedostatky (špatné vyhodnocení elektromyografické křivky, záměna odpovědi za artefakt atd.) [11, 21, 22]. Falešně negativní odpovědi (IONM udává paréza není – pooperačně paréza je) lze vysvětlit zejména nesprávným vyhodnocením EMG křivky operačním týmem (artefakt vyhodnocen jako adekvátní odpověď, přímá stimulace nitrohrtanových elektrod, stimulace distálního pahýlu postiženého NLR) anebo s časovým odstupem postupně vznikající parézou (např. neuroapraxie, poranění vasa nervorum, edém NLR), kdy částečná funkce NLR byla během stimulace prozatím zachována. Dralle et al. doporučují provést více než 100 operací s přístrojem pro neuromonitoring [8]. Rutinním a správným používáním IONM tak lze na základě tréninku, seznámení se s metodou a schopnosti správně vyhodnotit signál snížit výskyt „falešných“ odpovědí na minimum.
V námi prezentovaném souboru sledujeme u „monitorovaných“ pacientů vyšší výskyt dočasné (5,66 %) a nižší výskyt trvalé (0,18 %) jednostranné pooperační parézy NLR oproti „nemonitorovaným“. Rozdílný výskyt nebyl hodnocen jako statisticky významný. I přes statistickou nevýznamnost si vysvětlujeme procentuální vyšší výskyt pooperační parézy v „monitorované skupině“ převažujícími operacemi ŠŽ se zvýšeným rizikem poranění NLR (revizní výkon, malignita, toxická struma, struma magna atd.). Další příčinou může být snaha o co nejdokonalejší odstranění tkáně ŠŽ, jež je po identifi kaci a funkčním ověření NLR umocněna. Tento stav může vést k nadměrnému tahu v oblasti Berryho ligamenta či jiné mikrotraumatizaci NLR, a může se tak stát příčinou jeho dočasně omezené funkce.
Nehomogenita souborů předkládaných různými autory častokrát neumožňuje porovnání publikovaných údajů incidence paréz zvratných nervů. Pro praxi navrhuje Astl [1] parametr index of recurrent injury (IRI), který zohledňuje rozsah onemocnění, náročnost operace a výskyt jednostranné či oboustranné parézy NLR. IRI = p × (M/ N) + H (p – počet jednostranných trvalých pooperačních paréz NLR, M – počet provedených operací ŠŽ, N – počet exponovaných NLR, H – počet oboustranných trvalých pooperačních paréz NLR). Aplikací IRI na výsledky této práce jsou hodnoty 0,60 (skupina A) a 0,59 (skupina B).
Recentní publikace popisují neurostimulaci i neuromonitoraci zevní větve NLS, kde je za pomocí IONM snadněji lokalizován než samostatnou vizualizací [23, 24].
Podstatné aspekty IONM jsou medicínsko-legální a medicínsko-ekonomické. Ty dále nediskutujeme, jelikož nejsou předmětem této práce.
Závěr
Pro vysokou specificitu a negativní prediktivní hodnotu (IONM udává, že není paréza NLR – ve skutečnosti není paréza NLR) hodnotíme IONM jako metodu dostatečně spolehlivou k ověření funkčního stavu nervu. Rozdílný výskyt pooperační parézy NLR ve skupině při použití IONM a bez použití IONM hodnotíme jako statisticky nevýznamný.
IONM nenahrazuje anatomické znalosti či zkušenosti operatéra, je ale vhodnou metodou pro získání dovedností během chirurgie ŠŽ za účelem identifi kace či eventuálního mapování místa léze NLR a kompletního odstranění tkáně ŠŽ. Po správně provedené a vyhodnocené IONM NLR získává operatér jistotu, že se jedná o tkáň zvratného nervu.
Nejvyšší přínos IONM shledáváme v ověření funkčního stavu nervu, který nemusí být vždy v souladu s nálezem anatomickým. Na základě neadekvátní odpovědi IONM má chirurg možnost změny strategie léčby: 1. provedení revize NLR v jedné době, 2. ukončení operace ve stadiu HTE s úmyslem eventuální totalizace výkonu ve druhé době. V případě obnovení funkce NLR je tak riziko jeho oboustranné parézy výrazně minimalizováno (téměř vyloučeno).
Na pracovišti autora je IONM využíván během většiny operací ŠŽ a příštítných tělísek, zejména pak při „high-risk“ operacích (revizní výkon, malignita, toxická struma, struma magna) a plánovaném oboustranném výkonu. Absolutní indikací je operace na straně „jediného“ funkčního NLR a revizní výkon, resp. operace po předchozím chirurgickém zákroku v oblasti NLR. Stran snížení výskytu falešně negativních a falešně pozitivních odpovědí monitorujeme nervové struktury podle schématu: NV před disekcí, NLR před disekcí, NLR po disekci, NV po disekci.
Prohlášení o střetu zájmů
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Grantová podpora
Práce byla podpořena projektem Ministerstva obrany ČR MO 1012.
Přijetí k recenzi: 3. 11. 2020
Přijetí k tisku: 5. 3. 2021
MUDr. Jiří Hložek
Klinika otorinolaryngologie a maxilofaciální chirurgie 3. LF UK a ÚVN Praha
U Vojenské nemocnice 1200
169 02 Praha 6
Zdroje
1. Astl J. Chirurgická léčba nemocí štítné žlázy. 2. rozšíř. vyd. Praha: Maxdorf Jessenius 2013.
2. Wojtczak B, Sutkowski K, Kaliszewski K et al. Experience with intraoperative neuromonitoring of the recurrent laryngeal nerve improves surgical skills and outcomes of non-monitored thyroidectomy. Langenbecks Arch Surg 2017; 402(4): 709–717. Doi: 10.1007/ s004 23-016-1449-5.
3. Minuto MN, Reina S, Monti E et al. Morbidity following thyroid surgery: acceptable rates and how to manage complicated patients. J Endocrinol Invest 2019; 42(11): 1291–1297. Doi: 10.1007/ s40618-019-01064-z.
4. Barczynski M, Konturek A, Cichon S. Randomized clinical trial of visualization versus neuromonitoring of recurrent laryngeal nerves during thyroidectomy. Br J Surg 2009; 96(3): 240–246. Doi: 10.1002/ bjs.6417.
5. Chiang FY, Lu IC, Kuo WR et al. The mechanism of recurrent laryngeal nerve injury during thyroid surgery--the application of intraoperative neuromonitoring. Surgery 2008; 143(6): 743–749. Doi: 10.1016/ j.surg.2008.02.006.
6. Sadowski SM, Soardo P, Leuchter I et al. Systematic use of recurrent laryngeal nerve neuromonitoring changes the operative strategy in planned bilateral thyroidectomy. Thyroid 2013; 23(3): 329–333. Doi: 10.1089/ thy.2012.0368.
7. Dralle H, Sekulla C, Haerting J et al. Risk factors of paralysis and functional outcome after recurrent laryngeal nerve monitoring in thyroid surgery. Surgery 2004; 136(6): 1310–1322. Doi: 10.1016/ j.surg.2004.07.018.
8. Dralle H, Sekulla C, Lorenz K et al. Intraoperative monitoring of the recurrent laryngeal nerve in thyroid surgery. World J Surg 2008; 32(7): 1358–1366. Doi: 10.1007/ s00268-008-9 483-2.
9. Scott AR, Chong PS, Hartnick CJ et al. Spontaneous and evoked laryngeal electromyography of the thyroarytenoid muscles: a canine model for intraoperative recurrent laryngeal nerve monitoring. Ann Otol Rhinol Laryngol 2010; 119(1): 54–63. Doi: 10.1177/ 000348941011900111.
10. Lorenz K, Sekulla C, Schelle J et al. What are normal quantitative parameters of intraoperative neuromonitoring (IONM) in thyroid surgery? Langenbecks Arch Surg 2010; 395(7): 901 – 909. Doi: 10.1007/ s00423-010-0691-5.
11. Schneider R, Randolph GW, Dionigi G et al. International neural monitoring study group guideline 2018 part I: Staging bilateral thyroid surgery with monitoring loss of signal. Laryngoscope 2018; 128 Suppl 3: S1–S17. Doi: 10.1002/ lary.27359.
12. Phelan E, Schneider R, Lorenz K et al. Continuous vagal IONM prevents recurrent laryngeal nerve paralysis by revealing initial EMG changes of impending neuropraxic injury: a prospective, multicenter study. Laryngoscope 2014; 124(6): 1498–1505. Doi: 10.1002/ lary.24550.
13. Ulmer C, Friedrich C, Kohler A et al. Impact of continuous intraoperative neuromonitoring on autonomic nervous system during thyroid surgery. Head Neck 2011; 33(7): 976–984. Doi: 10.1002/ hed.21564.
14. Alesina PF, Rolfs T, Hommeltenberg S et al. Intraoperative neuromonitoring does not reduce the incidence of recurrent laryngeal nerve palsy in thyroid reoperations: results of a retrospective comparative analysis. World J Surg 2012; 36(6): 1348–1353. Doi: 10.1007/ s00268-012 - 1548-6.
15. Mirallie E, Caillard C, Pattou F et al. Does intraoperative neuromonitoring of recurrent nerves have an impact on the postoperative palsy rate? Results of a prospective multicenter study. Surgery 2018; 163(1): 124–129. Doi: 10.1016/ j. surg.2017.03.029.
16. Dionigi G, Frattini F. Staged thyroidectomy: time to consider intraoperative neuromonitoring as standard of care. Thyroid 2013; 23(7): 906–908. Doi: 10.1089/ thy.2013.0004.
17. Randolph GW, Kamani D. Intraoperative neural monitoring in thyroid cancer surgery. Langenbecks Arch Surg 2014; 399(2): 199–207. Doi: 10.1007/ s00423-013-1141-y.
18. Calo PG, Pisano G, Medas F et al. Identifi - cation alone versus intraoperative neuromonitoring of the recurrent laryngeal nerve during thyroid surgery: experience of 2034 consecutive patients. J Otolaryngol Head Neck Surg 2014; 43 : 16. Doi: 10.1186/ 1916-0216 - 43-16.
19. Wu SY, Shen HY, Duh QY et al. Routine intraoperative neuromonitoring of the recurrent laryngeal nerve to facilitate complete resection and ensure safety in thyroid cancer surgery. Am Surg 2018; 84(12): 1882–1888.
20. Melin M, Schwarz K, Lammers BJ et al. IONM - -guided goiter surgery leading to two-stage thyroidectomy indication and results. Langenbecks Arch Surg 2013; 398(3): 411–418. Doi: 10.1007/ s00423-012-1032-7.
21. Stopa M, Barczynski M. Prognostic value of intraoperative neural monitoring of the recurrent laryngeal nerve in thyroid surgery. Langenbecks Arch Surg 2017; 402(6): 957–964. Doi: 10.1007/ s00423-016-1441-0.
22. Randolph GW, Dralle H, International Intraoperative Monitoring Study G et al. Electrophysiologic recurrent laryngeal nerve monitoring during thyroid and parathyroid surgery: international stan - dards guideline statement. Laryngoscope 2011; 121 Suppl 1: S1–16. Doi: 10.1002/ lary.21119.
23. Potenza AS, Phelan EA, Cernea CR et al. Normative intra-operative electrophysiologic waveform analysis of superior laryngeal nerve external branch and recurrent laryngeal nerve in patients undergoing thyroid surgery. World J Surg 2013; 37(10): 2336–2342. Doi: 10.1007/ s00268-013-2148-9.
24. Uludag M, Aygun N, Kartal K et al. Contribution of intraoperative neural monitoring to preservation of the external branch of the superior laryngeal nerve: a randomized prospective clinical trial. Langenbecks Arch Surg 2017; 402(6): 965–976. Doi: 10.1007/ s00423-016-1544-7.
Štítky
Audiológia a foniatria Detská otorinolaryngológia Otorinolaryngológia
Článok vyšiel v časopiseOtorinolaryngologie a foniatrie
Najčítanejšie tento týždeň
2021 Číslo 2- Subkutánne vs. intravenózne imunoglobulíny u pacientov s CLL
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
-
Všetky články tohto čísla
- Rehabilitace jednostranné hluchoty pomocí implantabilního systému pro přímé kostní vedení – Bonebridge
- Význam screeningových dotazníků v detekci závažnosti obstrukční spánkové apnoe
- Chirurgická léčba benigních nádorů příušní žlázy na ORL oddělení Nemocnice České Budějovice, a.s., v letech 2014–2018
- Neuromonitoring zvratného nervu během operace štítné žlázy – výsledky a zkušenosti
- Griselův syndrom – kazuistika
- Prvé skúsenosti s implantátom pre kostné vedenie zvuku Sophono
- Biologická léčba chronické rinosinusitidy
- Ušní chirurgie v České republice
- Otorinolaryngologie a foniatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Biologická léčba chronické rinosinusitidy
- Griselův syndrom – kazuistika
- Chirurgická léčba benigních nádorů příušní žlázy na ORL oddělení Nemocnice České Budějovice, a.s., v letech 2014–2018
- Neuromonitoring zvratného nervu během operace štítné žlázy – výsledky a zkušenosti
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



