-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Kombinovaný účinok keramických vlákien a fajčenia z hľadiska vybraných zápalových a cytotoxických parametrov bronchoalveolárnej laváže a histologických nálezov v experimente
The combined effect of refractory ceramic fibres and cigarette smoke in terms of selected inflammatory and cytotoxic parameters of bronchoalveolar lavage and histologic findings in the experiment
Refractory ceramic fibers (RCF) are used as one kind of asbestos substitutes. Since RCF are relatively stable in the organism and some RCF are respirable, they may represent a potential health hazard by inhalation. The increased risk of lung diseases including lung cancer of asbestos-exposed workers is further increased by tobacco smoking. Some epidemiological studies suggest that the risk from combined exposure is more than additive (in many cases combined exposure induces synergistic effect). From this reason we wanted to know if the similar effect is seen after combined exposure to RCF + cigrette smoke, as is described after combined exposure to asbestos and cigarette smoke. The aim of the study was: 1. to find out and compare the effects of subchronic exposure to RCF, cigarette smoke (CS) and combined exposure to RCF+CS by inflammatory and cytotoxic parameters of bronchoalveolar lavage (BAL); 2. to find out if smoking amplifies the possible adverse effect of RCF as it is known after combined exposure to asbestos + CS. Wistar rats were: 1. intratracheally instilled (i. t.) by saline solution (0.4 ml) – control group; 2. i. t. instilled by 4 mg of RCF; 3. exposed only to cigarette smoke (CS); 4. exposed to RCF+CS. After 6 months BAL was perfomed. Following BAL parameters were examined: The differential cell count (% of alveolar macrophages – AM, % of polymorphonuclears – PMN, % of lymphocytes – LY); the proportion of immature AM; the percentage of binucleate cells; the viability, the phagocytic activity of AM and histology of lung tissue. The results of our work suggest: 1. the high biopersistence of the RCF; 2. serious inflammatory and cytotoxic changes in lung parameters after subchronic exposure to RCF or cigarette smoke and 3. amplification of RCF effect by cigarettte smoke; 4. histological findings of lung tissue evaluated using the Wagner scale showed that exposure to RCF as well as the combined effect of smoking caused the fibrosis stage; 5. the mere inhalation of cigarette smoke did not induce fibrotic changes in lung tissue.
Key words:
lung diseases, smoking impact, RCF exposure, Wistar rats
Autoři: M. Hurbánková 1; S. Černá 1; M. Beňo 1; E. Tátrai 2; S. Wimmerová 1
; Z. Kováčiková 1
Působiště autorů: Slovenská zdravotnícka univerzita v Bratislave, Laboratórium respiračnej toxikológie, Bratislava, Slovenská republika, vedúca pracoviska doc. MUDr. Marta Hurbánková, PhD., 2National Institute of Environmental Health, Budapest, Hungary 1
Vyšlo v časopise: Pracov. Lék., 62, 2010, No. 3, s. 102-108.
Kategorie: Původní práce
Souhrn
Keramické vlákna (RCF – refractory ceramic fibres) sú používané ako jedna z možností náhrady za azbest. RCF sú v organizme relatívne stále (majú pomerne vysokú bioperzistenciu), mnohé sú respirabilné, a preto môžu predstavovať potenciálne zdravotné riziko. Cieľom tejto štúdie je: 1. vyšetrením zápalových a cytotoxických parametrov a histológie pľúcneho tkaniva zistiť účinok subchronickej expozície RCF, cigaretového fajčenia (CF) a kombinovanej expozície RCF + CF na respiračný systém; 2. zistiť, či fajčenie zosilňuje možný škodlivý účinok expozície RCF tak, ako je to popisované v literatúre po expozícii azbestu. Kontrolnej skupine zvierat sa intratracheálne (i. t.) instilovali 0,4 ml fyziologického roztoku/zviera. Druhej skupine sa i. t. instilovali 4 mg RCF v 0,4 ml fyziologického roztoku/zviera. Tretia skupina zvierat inhalovala iba cigaretový dym (cca 8 štandardných cigariet 1R1) počas dennej dvojhodinovej expozície (6 mesiacov, okrem soboty a nedele). Štvrtej skupine zvierat sa instilovali 4 mg RCF a súčasne zvieratá inhalovali cca 8 štandardných cigariet denne. Po 6 mesiacoch sa zvieratá utratili (pod i. p. thiopentalovou narkózou – 150 mg/1 kg), urobil sa im výplach pľúc (BAL) a stanovili sa vybrané zápalové a cytotoxické parametre broncho-alveolárnej laváže (BAL): diferenciálny obraz buniek BAL (percentá PMNL – polymorfonukleárnych leukocytov, AM – alveolárnych makrofágov, Ly – lymfocytov), percentá nezrelých foriem AM, percentá dvojjadrových buniek BAL, fagocytová aktivita AM, viabilita AM a histológia pľúcneho tkaniva. Uvedené výsledky poukazujú na: a) významné zmeny u mnohých vyšetrených zápalových a cytotoxických parametrov po i. t. instilácii RCF, inhalácii cigaretového dymu, najmä však na zosilňujúci účinok RCF fajčením (pri kombinovanej expozícii); b) pretrvávanie pľúcnych zápalových procesov a vystupňovanie celulárnej imunity aj po 6 mesiacoch od instilácie RCF môže poukazovať na ich vysokú bioperzistenciu, a teda aj ich možný škodlivý účinok; c) histologické nálezy pľúcneho tkaniva hodnotené podľa Wagnerovej stupnice poukázali, že expozícia RCF ako aj kombinovaného účinku s fajčením spôsobila stupeň fibrózy 5, samotná inhalácia cigaretového dymu fibrotické zmeny v pľúcnom tkanive nevyvolala.
Kľúčové slová:
choroby pľúc, vplyv fajčenia, expozícia RCF, potkani WistarÚvod
Choroby pľúc (obštrukčné, fibrotické, nádorové), ktoré vznikajú aj dôsledkom znečistenia ovzdušia (pevné aerosóly vrátane mnohých prachov vláknitého aj nevláknitého pôvodu) ako aj fajčenia, majú vzostupný trend. Podľa Medzinárodnej agentúry na výskum rakoviny (IARC) sú keramické vlákna (RCF) zaradené do skupiny 2B – ako možný humánny karcinogén. Azbest a tabakový dym ako dokázaný humánny karcinogén sú zaradené do skupiny 1 [16, 17].
Spomínané ochorenia majú nesmierne závažný dopad na ekonomiku tým, že sa zvyšujú náklady na zdravotnú a sociálnu starostlivosť. Navyše vysoký výskyt spomínaných ochorení znižuje dĺžku života nášho obyvateľstva. Z toho dôvodu je dôležité prispieť k poznaniu vplyvu konkrétnych faktorov životného prostredia na výskyt pľúcnych ochorení aj v dôsledku pevných aerosólov, ako sú priemyselné prachy a aj ich kombinovaná expozícia s fajčením.
Vplyvu priemyselných vláknitých prachov na respiračný trakt sa dlhodobo venuje pozornosť výskumníkov, či už z experimentálneho hľadiska, alebo epidemiologických sledovaní. Nakoľko sa používajú v mnohých odvetviach priemyslu (stavebnom, chemickom, lodiarskom, automobilovom, leteckom, textilnom atď.), spôsobujú rozsiahlu profesionálnu i environmentálnu expozíciu. Ich hlavným predstaviteľom sú azbestové vlákna, ktoré po dlhodobej expozícii spôsobujú azbestózu, pleurálne plaky, bronchiálny karcinóm a mezotelióm. V súlade so smernicami WHO, ILO a IARC sa presadzuje tendencia zakázať používanie azbestu, hoci USA, Austrália, Japonsko a všetky štáty Európskej únie pristúpili k úplnému zákazu jeho výroby a použitia. Krajiny, ktoré naďalej presadzujú a realizujú jeho ťažbu a spotrebu, sú najmä Kanada, Rusko, Brazília, India a Čína [3, 6].
Zistenia, že azbestové vlákna majú škodlivé účinky na organizmus dali podnet k rôznym bezpečnostným a preventívnym opatreniam v pracovnom procese, použití a tiež k hľadaniu náhradných materiálov za azbest. Tieto by mali mať vhodné kvalitatívne a technologické vlastnosti, bez škodlivých účinkov. Vláknitý tvar náhradných látok viedol k domnienke, že by pri vyšších koncentráciách a dlhšej expozícii mohli nepriaznivo pôsobiť na zdravie, podobne ako azbest.
Z toho dôvodu bolo nutné prešetriť veľké skupiny ľudí exponovaných náhradným vláknam za azbest, zachytiť prípadné zmeny ich zdravotného stavu v priebehu rokov a porovnať ich s kontrolnou skupinou, alebo skupinou exponovanou azbestovým vláknam. Keramické vlákna (RCF – refractory ceramic fibres) sú amorfné alumínium silikáty, používané ako jedna z možností náhrad za azbest. Ich biologické účinky nie sú ešte v dostatočnej miere preverené, nakoľko sa používajú len niekoľko rokov, čo neumožnilo dôsledne zmapovať zdravotný stav exponovaných zamestnancov. Bolo by potrebné získať oveľa viac výsledkov z experimentálnych ale hlavne z epidemiologických štúdií, z čoho aj vyplýva dôležitá požiadavka pre výskum. Experimentálne štúdie využívajú in vivo a in vitro modelové systémy, na základe ktorých sa snažia definovať mechanizmy vláknami navodených pľúcnych ochorení aj na molekulovej úrovni. Výsledkom týchto výskumov sú dôkazy o dôležitej úlohe cytokínov: monokínov, lymfokínov a rastových faktorov, pričom zdrojom rôznych biologicky aktívnych mediátorov (najmä zápalových) a reaktívnych kyslíkových intermediátov (ROI – Reactive oxigen intermediates) sú hlavne alveolárne makrofágy (AM) [4, 9, 11, 16].
Významné faktory, ktoré určujú akútnu a chronickú reakciu pľúc na prašnú expozíciu, sú koncentrácia prachu vo vzduchu, fyzikálno-chemické vlastnosti prachu (aerodynamický diameter, tvar, povrchová plocha, reaktívne skupiny a na povrchu adherované kontaminanty), pretrvávanie prachových častíc v pľúcach a stupeň individuálnych odpovedí [9, 12].
Veľmi dôležitá vlastnosť vláknitých prachov, podľa čoho sa najmä hodnotia ich biologické účinky, je ich bioperzistencia – čo je pretrvávanie vlákien v pľúcach. Bioperzistencia je závislá od druhu vlákien, povrchovej chémie, chemického zloženia, povrchovej plochy a ďalších fyzikálnych vlastností vlákien. Pri teplotách vyšších ako 1200 °C sa môže kryštalický kremeň tvarovať. Použité v peciach – môžu byť RCF v stave kryštalickom aj amorfnom [19].
Cieľom práce bolo:
- Vyšetrením zápalových, cytotoxických ukazovateľov BAL a histológie pľúcneho tkaniva zistiť a porovnať účinok 6-mesačnej subchronickej expozície RCF, cigaretového dymu a kombinovanej expozície RCF + cigaretovému dymu na respiračný trakt.
- Zistiť, či fajčenie zosilňuje účinok expozície RCF, ako je to známe u kombinovanej expozície azbest aj cigaretové fajčenie (synergický účinok).
Súbor a metodika
V experimente sme použili Wistar potkanov, samcov zakúpených z chovnej stanice Velaz Praha. Pred začatím experimentu mali zvieratá 2-týždňovú karanténu. Ich priemerná počiatočná hmotnosť a hmotnosť pri ukončení experimentu sú uvedené v tabuľke 1.
Tab. 1. Hmotnosť zvierat na začiatku a na konci experimentu 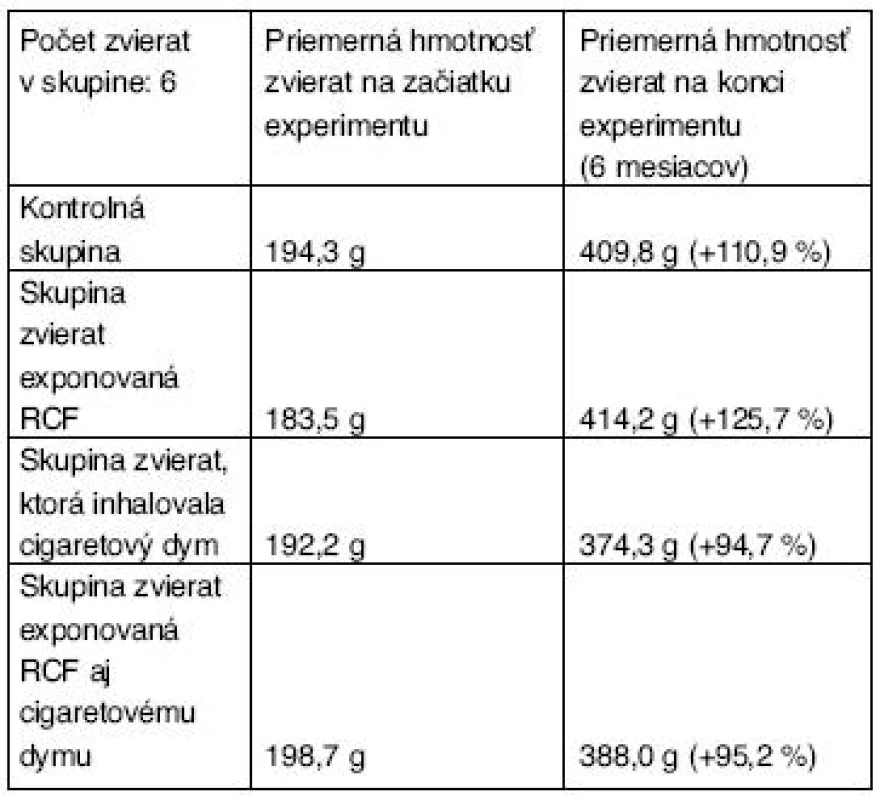
Vo zverinci boli všetky zvieratá randomizované, uskladnené v klietkach (rozmerov: 35 x 55 x 19 cm) a držané za konvenčných podmienok, pri 22 + 2 °C, 45 % relatívnej vlhkosti, prírodnom osvetlení a normálnej svetlo/tma periodicite, s klimatizačným zariadením WOLF KG 100 (WOLF-Clima Technic, GmbH, Mainburg, Germany). Dostávali komerčnú diétu ST 1 (TOP-Dovo, Horné Dubové, Slovensko) a vodovodnú vodu ad libitum. Potkany (Wistar) boli rozdelené do štyroch skupín po 6 zvieratách. Kontrolnej skupine zvierat sa intratracheálne instilovali 0,4 ml fyziologického roztoku/zviera – prvá skupina. Druhej skupine sa intratracheálne instilovali 4 mg RCF v 0,4 ml fyziologického roztoku/zviera (celkovú dávku 4 mg sme podávali v dvoch častiach po 2 mg/zviera počas 2 týždňov). Tretia skupina zvierat inhalovala cigaretový dym v koncentrácii 85 mg TPM/m3 (total particulate matter) vzduchu počas dennej dvojhodinovej expozície v inhalačnej komore – cca 8 štandardných cigariet 1R1 (6 mesiacov okrem soboty a nedele). Štvrtej skupine zvierat sa instilovali 4 mg RCF v 0,4 ml fyziologického roztoku/zviera a súčasne zvieratá inhalovali cca 8 štandardných cigariet denne (6 mesiacov okrem soboty a nedele). V našom experimente sme použili RCF (Carbolane fibres – Saint Gobain Ceramiques Industrielles, Nanterre, France), ktoré sme získali od p. dr. E. Tátraia, Dept. Pathology, National Institute of Environmental Health, Budapest. Veľkosť vlákien bola meraná na elektrónovom mikroanalyzátore JXA 840A za podmienok: urýchlovacie napätie 20 kV, prúd elektrónov 600 pikoampér, zväčšenie 1000 x, jedno meranie zodpovedá ploche 200 x 200 μm2,celková meraná plocha 8000 x 8000 μm2. Chemické zloženie CRF: SIO2 45–60 %; Al2O3 55–40 %, rozmery RCF sú v tabuľke 2.
Tab. 2. Rozmery keramických vlákien (RCF) 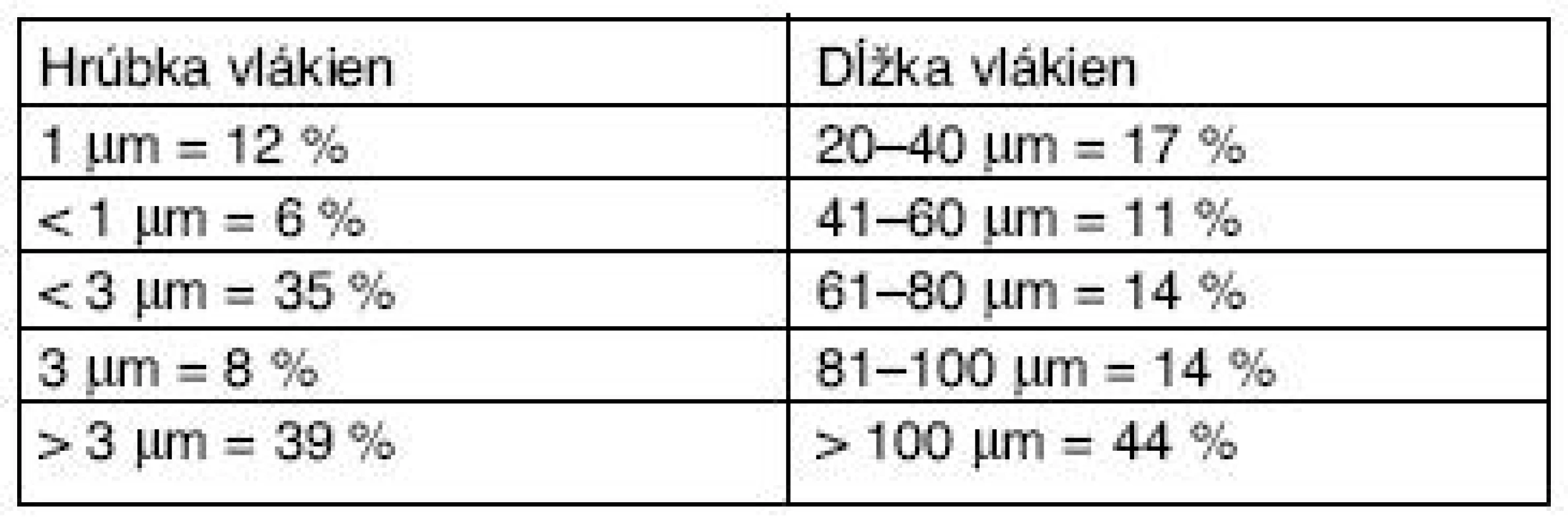
Pri inhalácii cigaretového dymu boli zvieratá umiestnené v špeciálnej celotelovej inhalačnej komore (Tobacco and Health Research Institute – THRI, Lexington, KY, USA), do ktorej sa čerpadlom vháňa hlavný prúd cigaretového dymu z cigariet typu 1R1 (THRI, Lexington, KY, USA). Množstvo prečerpaného dymu sme kontrolovali na základe váženia častíc (TPM) zachytených na filtri typu Cambridge (THRI, Lexington, KY, USA). Zvieratá inhalovali tabakový dym denne okrem soboty a nedele po dobu 6 mesiacov dve hodiny denne (85 mg TPM/m3 vzduchu, približne 8 cigariet).
Po 6 mesiacoch sa urobil výplach pľúc pod i. p. thiopentalovou narkózou – 150 mg /kg. Pri BAL sme použili 5 x 5 ml výplachového roztoku a stanovili sa vybrané parametre nešpecifickej celulárnej imunity BAL:
- diferenciálny obraz BAL (% PMNL, AM, Ly),
- percentá nezrelých foriem AM,
- percentá dvojjadrových buniek BAL,
- fagocytová aktivita,
- viabilita AM,
- histológia pľúc.
Morfológia
Odobraté nevypláchnuté pľúca zo všetkých skupín zvierat boli fixované 8% formalínom v PBS (pH 7,4) a vpravené do Paraplastu (Sigma, P3559). Pľúcne laloky boli vyšetrené týmito metódami: HE (hematoxilin – farbí jadrá a eosin cytoplazmu pri sveteľnej mikroskopii), elasticita membrán (Elastic van Giesonovým farbením), kolagénové vlákna farbením van Giesonom), bunková analýza a obsah vlákien impregnáciou Gömöriho striebornej, membrány buniek typu I boli detegované s Ricinus communis aglutinínom (RCA I, Sigma) a bunky typu II s Maclura pomifera aglutinínom (MPA, Sigma). Tieto lektíny reagujú s -galaktózou/galaktózaminom (RCA) a -D-galaktózou/galaktozaminom (MPA), ktoré sú charakteristické oligosacharidovými komponentmi v membránach pneumocytov.
Transmisná elektrónová mikroskopia
Časti pľúc zo všetkých skupín zvierat boli fixované v 2% glutaraldehyde v PBS (pH 7,4). Po dehydratácii s etanolom a propylen oxidom následne fixované v 1% kyseline osmičelej a vložené do Durcupan ACM Fluky (materiál z epoxidovej živice). Pripravené ultratenké rezy (rezané Ultracutom Reichert-Jungom) boli zafarbené uranylacetátom a citrátom olovnatým a hodnotené transmisným elektrónovým mikroskopom (JEOL JEM 100C, 44610-1EA)).
Štúdia bola pred začatím schválená Etickou komisiou Vedecko-výskumnej základne SZU a zvieratá boli udržiavané a chované podľa Guidelines of European Convention for the Protection of Vertebrate Animals Used for Experimental Purposes. Zverinec SZU má certifikát Správnej laboratórnej praxe.
Výsledky
Expozícia RCF v porovnaní s kontrolnou skupinou:
- Štatisticky významné zvýšenie percenta PMNL, percenta LY, percenta nezrelých foriem AM a percenta fagocytovej aktivity AM.
- Štatisticky významné zníženie viability AM a percenta AM z diferenciálneho obrazu BAL.
- Šesť mesiacov od instilácie RCF neovplyvnili percento dvojjadrových buniek v BAL. V porovnaní s kontrolnou skupinou boli uvedené parametre zvýšené, ale nie štatisticky významne (dvojjadrové bunky: o 38,1 %).
Inhalácia fajčenia v porovnaní s kontrolnou skupinou:
- Štatisticky významné zvýšenie percenta PMNL, percenta LY a percenta nezrelých foriem AM.
- Štatisticky významné zníženie percenta AM z diferenciálneho obrazu buniek, percenta fagocytovej aktivity AM a percenta viability.
- 6-mesačná inhalácia cigaretového dymu významne neovplyvnila percento dvojjadrových buniek v BAL.
Kombinovaný účinok RCF + F v porovnaní s kontrolnou skupinou:
- Štatisticky významné zvýšenie percenta PMNL, percenta LY, percenta nezrelých foriem AM a percenta dvojjadrových buniek.
- Štatisticky významné zníženie percenta AM z diferenciálneho obrazu buniek a percenta viability AM.
- Šesť mesiacov od instilácie kombinovaný účinok RCF + F neovplyvnil percento fagocytovej aktivity. V porovnaní s kontrolnou skupinou bolo percento fagocytovej aktivity zvýšené, ale nie štatisticky významne.
Výsledky sme vyhodnotili Mannovým-Whitneovým testom.
Dosiahnuté výsledky – vplyv keramických vlákien, fajčenia a kombinovaného účinku RCF + F na vybrané zápalové a cytotoxické parametre BAL, v porovnaní s kontrolnou skupinou popisuje tabuľka 3.
Tab. 3. BAL parametre bunkovej obrany* 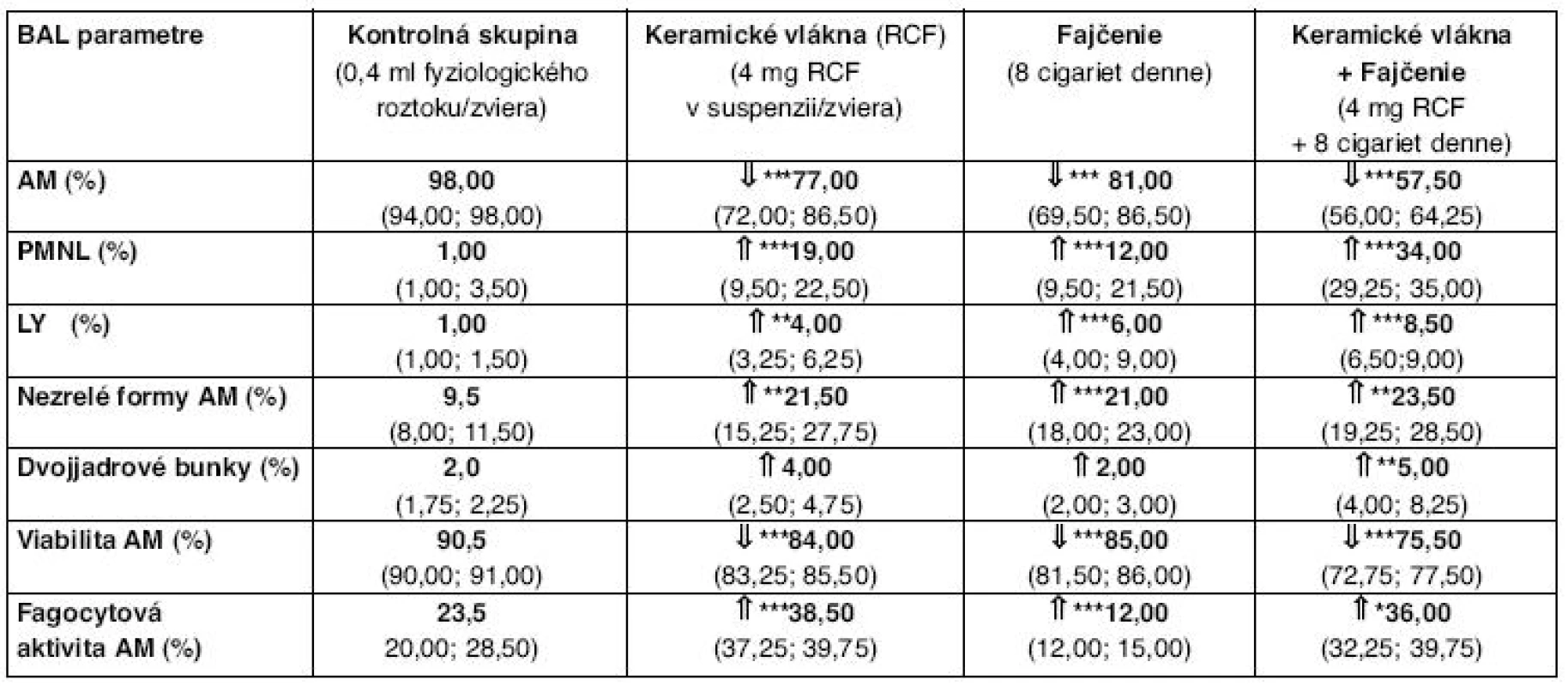
*6 mesiacov od poslednej instilácie RCF (4 mg/zviera), po 6-mesačnom fajčení a po 6-mesačnom kombinovanom účinku RCF + fajčenie. Hodnoty predstavujú mediány a 25. a 75. percentil; **p < 0,05; ***p < 0,01; ⇓ zníženie alebo ⇑ zvýšenie hodnôt oproti kontrole. Zmeny pľúcneho tkaniva po 6-mesačnej expozícii keramickým vláknam (4 mg/02 ml fyziologického roztoku/zviera), cigaretovému dymu (8 cigariet denne, 6 mesiacov) a kombinovanej expozícii RCF aj cigaretovému dymu v porovnaní s kontrolnou (0,2 ml fyziologického roztoku/zviera). Stupeň podľa Wagnera – tabuľka 4.
Tab. 4. Histologické nálezy – stupeň poškodenia podľa Wagnera 
Skupina exponovaná len cigaretovému dymu (8 cigariet dennne/6-mesačná expozícia): Histologické nálezy sa nelíšia od kontroly. Nebola zistená alveolitída s infiltráciou makrofágmi ani depozícia lipofuscínového pigmentu v epiteli alveolov.
Skupina exponovaná RCF (4 mg/6-mesačná expozícia): V interstíciu sa nachádza rozsiahly chronický zápal s rozšírenými interalveolárnymi septami. Väčšina alveolov je vyplnená makrofágmi alebo aj lymfocytmi. Lumina alveolov sú obliterované zápalovým tkanivom. V intersticiu sa nachádza zvýšené množstvo kolagénových vlákien.
Skupina exponovaná RCF aj cigaretovému dymu: Histologické nálezy sú veľmi podobné ako v skupine zvierat exponovaných len RCF.
Diskusia
Počet a typ buniek získaných BAL ako aj ich viabilita, fagocytová aktivita a stav aktivácie AM dávajú možnosť pochopiť potenciálny škodlivý účinok inhalovaných časticových alebo vláknitých materiálov. Zvýšený počet leukocytov v BAL po expozícii azbestu ako aj iným vláknitým prachom – ako výsledok zápalovej odpovede je opísaný mnohými autormi [4, 7, 18, 20]. Inhalované častice ako aj ich depozit v pľúcach sú prevažne vychytávané a eliminované z organizmu alveolárnymi makrofágmi. Pretože AM sú prvými bunkami, ktoré prichádzajú do styku s inhalovanou noxou, sú prioritne používané v in vivo a in vitro experimentoch na zistenie cytotoxicity vláknitých a nevláknitých prachov. Zohrávajú významnú úlohu v mechanizme, ktorý reguluje odpoveď po expozícii vláknitým prachom. Vedľa ich prioritnej schopnosti fagocytovať sú tiež významné imuno-regulačné a sekréčne bunky, zahrnuté do obranného mechanizmu ako aj patogenézy mnohých pľúcnych ochorení. Vo fáze aktivácie uvoľňujú mnohé cytokíny, reaktívne kyslíkové intermediáty ako aj rôzne mediátory zápalovej odpovede – významné modulátory bunkového rastu a diferenciácie [4, 11, 13, 14, 20, 21].
AM sú predominantné bunky prítomné v BAL a zmena v ich počte alebo funkcii určuje pľúcne poškodenie a charakterizuje patogenitu ako odpoveď k expozícii vláknitým prachom. V porovnaní s kontrolou sme zistili významne zvýšené percentá nezrelých foriem AM u skupiny zvierat exponovaných RCF aj cigaretovému fajčeniu ako aj u kombinovanej expozície RCF+CF. Zvýšenie nezrelých monocytových foriem AM môže byť pri odpovedi na invazívny alebo zápalový stimul, ako následok patologickej reakcie po expozícii anorganickým vláknam, intenzívnemu cigaretovému fajčeniu atď., ako aj pri určitých intersticiálnych pľúcnych ochoreniach (sarkoidózy, silikózy, azbestózy) [15].
Čo sa týka dvojjadrových buniek v BAL, tieto sa v BAL vyskytli vo zvýšenom počte (o 38,1 % viac) u skupiny exponovanej RCF v porovnaní s kontrolnou skupinou, ale zvýšenie nebolo štatisticky významné. Fajčenie percento dvojjadrových buniek neovplyvnilo, ale významne boli zvýšené dvojjadrové bunky u kombinovanej expozície. Beňo et al. vo svojej práci takisto dokázali, že dvoj - a viacjadrové bunky sú vhodným biomarkerom pľúcneho zápalu. Môžu vzniknúť fúziou makrofágov, ktoré „čistia cudzie teleso“ v pľúcnom tkanive [2].
Diferenciálny obraz buniek ako aj celkový počet buniek sú dôležitými ukazovateľmi bunkovej analýzy v BAL. Expozícia škodlivým substanciám spôsobuje zmenu v diferenciálnom počte buniek BAL, a to proporcionálnym zvýšením zápalových buniek PMN a Ly. Zvýšenie zápalových buniek môže tiež navodiť aj redukcia absolutného počtu AM [1, 4, 8, 20]. Expozícia RCF, fajčeniu aj RCF + fajčeniu v našom prípade významne znížila percento AM a významne zvýšila percento PMNL a LY (diferenciálny obraz BAL buniek). PMNL tvoria dôležitú časť diferenciálneho obrazu buniek, najmä v akútnej fáze – ako odpoveď k expozícii vláknitým prachom [4]. Mnohí autori popisujú zvýšené množstvo polymorfonukleárov v tekutine BAL po expozícii azbestu a iným vláknitým prachom, najmä v skorších štádiách [4, 10, 20].
Froudarakis et al. vyšetrili zamestnancov exponovaných RCF. BAL analýza u nefajčiarov vykazovala normálne hodnoty až na mierny vzostup neutrofilov. Naopak, u fajčiarov zistili významné zvýšenie neutrofilov. Na základe výsledkov ich štúdie uzatvárajú, že pľúcna toxicita RCF môže byť vyššia u fajčiarov [5]. Podľa Dziedzica et al., Morimota a Tanaku dlhodobá perzistencia týchto vlákien a tým navodené zvýšenie PMN môže byť akýmsi prediktorom vývoja metaplastických procesov v pľúcach [4, 18].
Zníženie počtu makrofágov, viability a fagocytovej kapacity môže vyústiť do oslabeného clearance inhalovaných materiálov, čo môže následne viesť k zvýšeniu účinnej dávky potenciálnej škodliviny [4, 20]. Naša štúdia poukázala na štatisticky významne zníženú viabilitu AM u všetkých troch exponovaných skupín a významne zníženú fagocytovú aktivitu AM u fajčiarov a naopak, významne zvýšenú fagocytovú aktivitu AM po expozícii RCF aj RCF + fajčenie.
Záver
Uvedené výsledky poukazujú na významné zmeny vyšetrených parametrov respiračnej cytotoxicity po intratracheálnej instilácii keramických vlákien (RCF), inhalácii cigaretového dymu, najmä však po kombinovanej expozícii RCF a fajčenia u experimentálnych zvierat v porovnaní s kontrolnou skupinou.
Pretrvávanie pľúcnych zápalových procesov a vystupňovanie nešpecifickej celulárnej imunity aj po 6 mesiacoch od instilácie RCF, fajčenia a ich kombinovanej expozícii môže poukazovať na:
- vysokú bioperzistenciu uvedených RCF,
- významné zápalové a cytotoxické zmeny v BAL parametroch po subchronickej expozícii RCF alebo cigaretovému fajčeniu,
- na zosilňujúci účinok fajčenia v kombinovanej expozícii RCF.
V tomto štádiu a za uvedených podmienok má RCF podobné vlastnosti ako azbestové vlákna. Rozdiel je v tom, že:
- a) azbestové vlákna (dlhšie ako 8–10 μm) zostávajú v organizme a postupne „rozohrávajú“ obranné reakcie na humorálnej, bunkovej a molekulovej úrovni, ktoré v neskorších fázach prechádzajú do vzniku mnohých pľúcnych ochorení (pleurálne plaky, azbestózy, bronchiálne karcinómy a mezoteliómy;
- b) RCF majú nižšiu bioperzistenciu než azbest, postupne sa v organizme rozpúšťajú, priečne lámu a sú alveolárnymi makrofágmi z organizmu eliminované. Presný polčas eliminácie RCF nie je dostatočne známy, pravdepodobne viac ako pol roka. Z toho dôvodu RCF spomínané pľúcne ochorenia nevyvolávajú (iba zníženie niektorých pľúcnych funkcií, najmä u fajčiarov a v malej miere pleurálne plaky).
Práca bola finančne podporená Ministerstvom zdravotníctva SR (19-10-07) a Agentúrou na podporu vedy a výzkumu SR (APVT-21-011104)
Došlo dne 8. 4. 2010.
Přijato do tisku dne 1. 7. 2010.Kontaktná adresa:
Doc. MUDr. Marta Hurbánková, PhD.
Laboratórium respiračnej toxikológie
Slovenská zdravotnícka univerzita v Bratislave
Limbová 12
833 03 Bratislava
Slovenská republika
e-mail: marta.hurbankova@szu.sk
Zdroje
1. Beňo, M., Hurbánková, M., Dušinská, M., Volkovová, K., Staruchová, M. et al. Some lung cellular parameters reflecting inflammation of amosite dust with cigarette smoke by rats. Cent. Eur. J. Publ. Health, 2004, 12 Suppl, s. S11–S13.
2. Beňo, M., Hurbánková, M., Černá, S., Dušinská, M., Volkovová, M. et al. Multinucleate cells (MNC) as sensitive semiquantitative biomarkers of the toxic effect after experimental fibrous dust and cigarette smoke inhalation by rats. Exp. Toxicol. Pathol., 2005, 57, 1, s. 77–87.
3. Buchancová, J. Choroby pľúc a pleury z azbestu. In Buchancová, J. et al. Pracovné lekárstvo a toxikológia. 1. vyd., Martin: Osveta, 2003, 1133 s., ISBN 80-8063-113-1.
4. Dziedzic, D., Wheeler, C. S., Gross, K. B. Bronchoalveolar lavage: detecting markers of lung injury. In Corn, M. (Ed.) Handbook of Hazardous Materials. Academic Press: New York, 1993, s. 99–111, ISBN 0-12-189410-X.
5. Froudarakis, M. E., Fournel, P., Costes, F., Perrin-Cottier, M., Blanchard, O. et al. Metabolism of ceramic fibers in humans. In Abstract Book from 6th International Conference On Bronchoalveolar Lavage. Corfu, 1998, s. 33.
6. Gergelová, P., Šulcová, M., Hurbánková, M. Používanie azbestu a výskyt mezoteliómov. Čes. pracov. Lék., 2005, 3, s. 169–172.
7. Henderson, R. F., Driscoll, K. E., Harkema, J. R., Lindeschmidt, R. C., Chang, I. Y. et al. A comparison of the inflammatory response of the lung to inhaled versus instilled particles in F344 rats. Fund. Appl. Toxicol., 1995, 24, s. 183–197.
8. Hurbánková, M., Kovaciková, Z., Kaiglová, A, Ginter, E. BAL and antioxidant state parameters in the process of the lung pathogenesis after exposure to long fibrous dusts. In Adv. in the Prev. of Occup. Respir. Diseases. Chiyotani, K., Hosoda, Y. Aizawa, M. D. Amsterdam, Lausanne, New York, Oxford, Shannon, Singapore, Tokyo, Elsevier, 1998, s. 648–652, ISBN 0444-827919.
9. Hurbánková, M. Niektoré nové poznatky v oblasti profesionálnej prašnej expozície a pľúcnych ochorení – I. Vláknité prachy. Stud. Pneumol. Phtiseol., 1999, 59, 3, s. 99–103.
10. Hurbánková, M., Kaiglová, A. Compared effects of asbestos and wollastonite fibrous dusts on various biological parameters measured in bronchoalveolar lavage fluid. J. Trace and Micropr. Techniq., 1999, 17, S. 233–243.
11. Hurbánková, M., Kaiglová, A., Buchancová, J. Cytokines – the important biomarkers of lung injury after exposure to industrial fibrous dusts. Acta Medica Martiniana, 2001, 1, 1, s. 19–24.
12. Hurbánková, M. Poškodenia dýchacieho systému umelými minerálnymi vláknami. In Buchancová, J. a kol. Pracovné lekárstvo a toxikológia. 1. slovenské vyd. Martin: Vydavateľstvo OSVETA, spol. s. r. o. 2003, 1133 s. ISBN 80--8063-113-1.
13. Hurbánková, M. Keramické vlákna – vlastnosti, použitie a vplyv na respiračný trakt. Čes. pracov. Lék., 2006, 4, s. 206–211.
14. Hurbánková, M., Beňo, M., Černá, S., Wimmerová, S. Combined effect of selected industrial fibrous dusts and tobacco smoke on the respiratory tract. In Environmental Health in Central and Eastern Europe. Donelly, K. C., Cizmas, Leslie, H., U.S.A.: Springer 2006, 270 s., IBSN 1-4020-4844-0.
15. Chlap, Z., Kopinski, P., Gil, K. Proposal of new cytological entity: Macrophagic alveolotis (Alveolitis Macrophagica) in bronchoalveolar lavage analysis. Abstr. Book from 6th Intern. Conf. on Bronchoalv. Lavage, Corfu, 24.–27. June 1998, s. 31.
16. IARC Monographs on the Evaluation of Carcinogenic Risks to Humans. Man-Made Vitreous Fibres. WHO, Lyon, France, 2002, 81, 403 p., ISBN 92-832-1281-9.
17. IARC Tobacco smoke and involuntary smoking. In IARC Monographs on the evaluation of carcinogenic risks to humans. Lyon, France, 2004, Vol. 83, ISBN 92-832-1283-5.
18. Morimoto, Y., Tanaka, I. In vivo studies of Man-Made Mineral Fibres – Fibrosis – Related Factors. Industrial Health, 2001, 39, s. 106–113.
19. Muhle, H., Bellman, B. Biopersistence of man-made vitreous finers. Ann. Occup. Hyg., 1995, 39, s. 655–660.
20. Pittet, J. F., Mackersie, R. C., Martin, T. R., Matthay, M. A. Biological Markers of Acute Lung Injury: Prognostic and Pathogenetic Significance. Am. J. Respir. Crit. Care Med., 1997, 155, p. 1187–1205.
21. Tarkowski, M., Gorski, P. Macrophage activity in asbestos related diseases. Polish Occup. Med. Environ. Health, 1991, 4, s. 115–125.
Štítky
Hygiena a epidemiológia Hyperbarická medicína Pracovné lekárstvo
Článek Zprávy
Článok vyšiel v časopisePracovní lékařství
Najčítanejšie tento týždeň
2010 Číslo 3- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- V ČR chybí specializovaná péče o pacienty s nervosvalovým onemocněním
-
Všetky články tohto čísla
- Kombinovaný účinok keramických vlákien a fajčenia z hľadiska vybraných zápalových a cytotoxických parametrov bronchoalveolárnej laváže a histologických nálezov v experimente
- A longterm follow-up of occurrence of professional malignant tumours of the respiratory tract in Slovakia – 1st part
- Adenokarcinom laryngu jako nemoc z povolání – kazuistika
- I. SYMPOZIUM NEMOCÍ Z POVOLÁNÍ S MEZINÁRODNÍ ÚČASTÍ
- Zprávy
- Lze uznat za nemoc z povolání patologický zdravotní stav, který existoval již před nástupem do zaměstnání jako obecné onemocnění?
- Pracovní lékařství
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- A longterm follow-up of occurrence of professional malignant tumours of the respiratory tract in Slovakia – 1st part
- I. SYMPOZIUM NEMOCÍ Z POVOLÁNÍ S MEZINÁRODNÍ ÚČASTÍ
- Lze uznat za nemoc z povolání patologický zdravotní stav, který existoval již před nástupem do zaměstnání jako obecné onemocnění?
- Adenokarcinom laryngu jako nemoc z povolání – kazuistika
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



