-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Nepřítomnost sekvenčních změn v HIF responzivním elementu promotoru leptinového genu u českých žen s hypotrofií plodu
The absence of sequential changes in HIF response element of leptine gene promotor in Czech women with fetal hypotrophy
The object of the study:
was to associate the eventual sequential changes of leptin gene promotor in the segment of HIF (hypoxia inducible factor) response element with occurence of fetal hypotrophy.Material and methodology:
The peripheral blood was withdrawn from 7 pregnant women, at whom the US (ultrasound) had proved IUGR (intrauterine growth retardation) of the fetuses. After the isolation and amplification of leptin gene promotor segment carrying HIF response element, we made capillary sequenation of PCR product.Results:
in HIF response segment of leptin gene promotor, at any of 7 examined women there had not been found a sequential alliteration, which would allow to explain the changes of plasmatic level of leptin in relation to IUGR, described in literature. Conclusion: We did not find in literature a comparable analysis of sequention of leptine gene in mothers of fetuses with IUGR, although the plasmatic levels of leptin had been repeatedly proved to be higher in comparison with physiologic pregnancies. According to our results the increase of leptin level is not associated with the change of DNA sequence in HIF response element of leptin gene promotor.Key words:
fetal hypotrophy – leptin – HIF – gene – pregnancy
Autoři: Z. Dostálová 1; J. A.vašků 2; P. Bienert 2; A. Vašků 2; V. Unzeitig 1
Působiště autorů: Gynekologicko-porodnická klinika LF MU a FN Brno 1; Institut patologické fyziologie LF MU, Brno 2
Vyšlo v časopise: Prakt Gyn 2005; 9(3): 6-8
Souhrn
Cíl studie:
Cílem bylo asociovat eventuální sekvenční změny promotoru leptinového genu v oblasti HIF (hypoxia inducible factor) responzivního elementu s výskytem hypotrofie plodu.Materiála metodika:
Odebrali jsme 7 těhotným ženám, u jejichž plodů byla pomocí USG (ultrasonografie) prokázána IUGR (intrauterinní růstová retardace), periferní krev. Po izolaci a amplifikaci úseku promotoru leptinového genu nesoucího HIF–responzivní element jsme provedli kapilární sekvenaci PCR–produktu.Výsledky:
V HIF–responzivní oblasti promotoru genu pro leptin jsme nezjistili u žádné ze 7 zkoumaných žen sekvenční alteraci, kterou by bylo možno vysvětlit v literatuře popsané změny plazmatické hladiny leptinu ve vztahu k IUGR.Závěr:
V literatuře jsme nenašli srovnatelnou analýzu sekvence leptinového genu u matek plodů s IUGR, přestože plazmatické hladiny leptinu u nich byli opakovaně prokázány jako vyšší ve srovnání s fyziologickými graviditami. Dle našich výsledků není nárůst hladiny leptinu asociován se změnou DNA sekvence v HIF–responzivním elementu promotoru genu pro leptin.Klíčová slova:
hypotrofie plodu – leptin – HIF –leptinový gen – graviditaÚvod
Hypotrofie plodu se v české populaci vyskytuje v 2–5 %, jedná se o velmi závažnou komplikaci průběhu těhotenství.
Všechny plody/novorozenci s hmotností, která je o 10 % nižší než standardní hmotnost gestačního stáří, jsou plody/novorozenci nedostatečného růstu (fetal growth restriction – FGR).
70 % těchto plodů/novorozenců je konstitučně malých (small for gestation age – SGA), tato skutečnost je dána rasovými faktory, paritou těhotné, její výškou, hmotností a dalšími faktory. Prognóza těchto novorozenců je dobrá.
Zhruba 30 % tvoří skupina plodů/novorozenců nitroděložně růstově retardovaných (intrauterine growth retardation – IUGR), z toho ve 20–30 % se jedná o proporcionální IUGR. Vyvolávající příčinou je nejčastěji porucha v chromozomální výbavě. Růstová restrikce se u těchto plodů projeví již v 1. polovině těhotenství.
Většinu, tj. 70–80 % intrauterinních růstových retardací ovšem tvoří disproporcionální IUGR, která se projevuje nejčastěji v 2. polovině těhotenství [7].
Schéma. Klasifikace nedostatečného růstu plodu [7]. ![Schéma. Klasifikace nedostatečného růstu plodu [7].](https://pl-master.mdcdn.cz/media/image/adab4563dd26a829f1b3364e315b6a90.jpeg?version=1537790336)
Příčiny IUGR jsou polyfaktoriální, uplatòují se jak faktory fetální, tak placentární nebo mateřské; jedná se o všechny stavy, které vedou k placentární insuficienci, a tím k nedostatečnému zásobení plodu kyslíkem a živinami.
- fetální faktory: chromozomální abnormality, infekce plodu, vícečetná těhotenství aj.
- placentární faktory: abnormální trofoblastická invaze, placenta praevia, vaskulární anomálie pupečníku aj.
- mateřské faktory: chronická vaskulární onemocnění vniklá na podkladě hypertenze, renálních onemocnění, IDDM, kolagenóz, hypoxické stavy, nutriční faktory, trombofilní stavy, abúzus drog aj.
Hledání patofyziologických souvislostí těhotenských patologií se v posledních letech stále více orientuje molekulárně–biologickým směrem. Stále větší důraz se klade na objevování souvislostí mezi patologickými stavy vznikajícími v graviditě a genetickou predispozicí matky pro tento stav.
Porucha fetální angiogeneze vede k narušení funkce fetoplacentární jednotky s následným rozvojem poruchy fetálního růstu. Jedním z významných regulátorů energetického hospodaření fetoplacentární jednotky je bílkovina leptin.
Obr. 1. Chromozom 7 s genem pro leptin. 
Cíl studie
Cílem naší studie bylo asociovat eventuální sekvenční změny promotoru leptinového genu v oblasti HIF 1–responzivního elementu s výskytem hypotrofie plodu.
Materiál a metodika
Vyšetřili jsme 7 těhotných žen hospitalizovaných na pracovišti Gynekologicko–porodnické kliniky FN Brno s diagnózou IUGR plodu a odebrali jsme jim 5 ml periferní krve. Vždy se jednalo o spontánní, jednočetnou graviditu. K těmto 7 ženám jsme způsobem case–control přiřadili kontroly – ženy s nekomplikovanou jednočetnou graviditou zakončenou v termínu.
Medián věku žen v souboru nemocných byl 30,8 let (26–33), BMI 22,7 (19,8–24,5), průměrná porodní váha plodu byla 1700 g (950–2250 g).
DNA z periferní krve byla izolována standardní technikou s využitím proteinázy K.
Prostřednictvím primerů:
5°–gggacatcaaggatttctcg,
3°–gttatcgggccgctataag
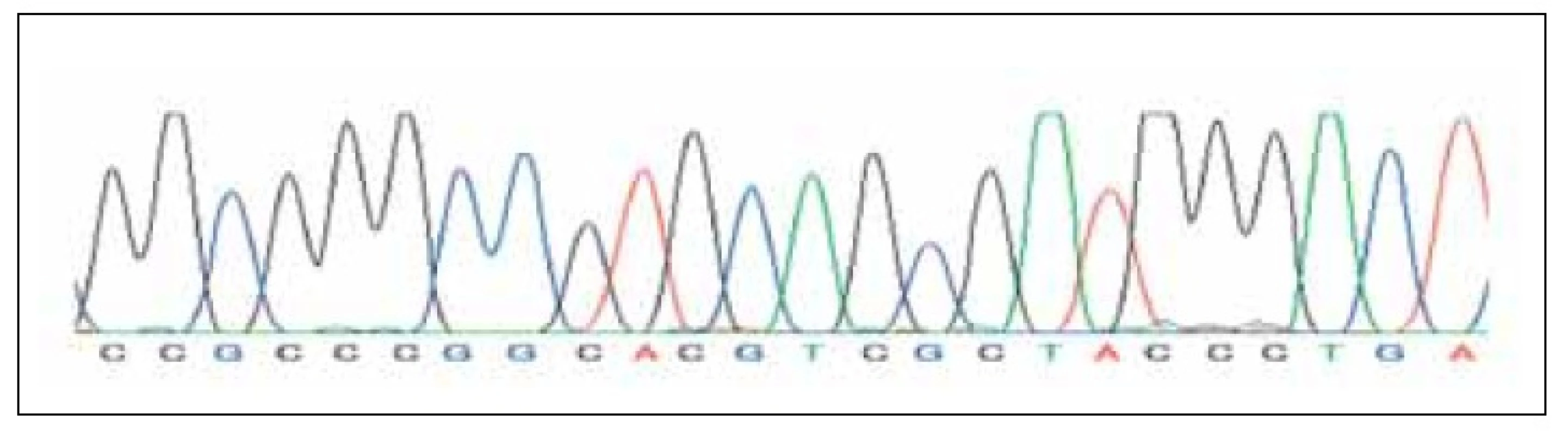
byl získán 340 bp dlouhý PCR produkt. Amplifikace tohoto produktu byla provedena standardním způsobem s užitím Tag polymerázy. Tento produkt byl následně sekvenován (kapilární sekvenátor BigDye kit). Sekvence získané z tohoto sekvenátoru byly zpracovány softwarem DNAgent (obr. 2, 3) s vyhodnocením 5’; 3’ sekvencí HIF responzivního elementu leptinového genu.
Výsledky
U žádné ze 7 žen s IUGR plodu jsme neprokázali sekvenční alteraci v oblasti HIF–responzivního elementu promotoru leptinového genu, kterou by bylo možno vysvětlit změny plazmatické hladiny leptinu u gravidit s IUGR plodu, popsané v literatuře.
Obr. 3. Kapilární sekvenace žen s plody s prokázanou IUGR. 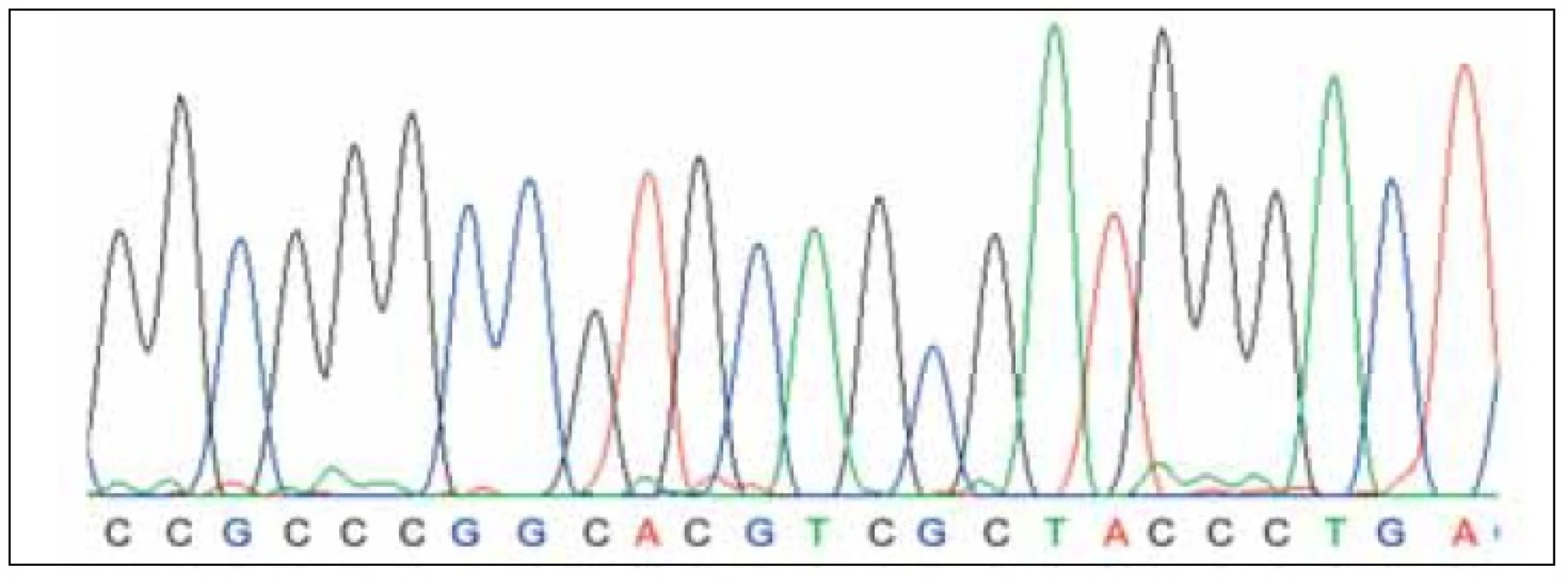
Diskuse
Málokterému proteinu je v současnosti věnována taková mediální i odborná pozornost jako leptinu. Původně byl považován za regulátor centra sytosti, v současnosti je však zřejmé, že jeho účinky jsou pleitropní, spojené zejména s udržováním homeostázy organizmu.
Leptin je 16 kDa těžký protein, skládající se z 167 aminokyselinových zbytků.
Poprvé byl popsán v roce 1994 jako signalizační molekula izolovaná z adipocytů. Jeho hlavní funkce spočívá v udržování energetické homeostázy organizmu [9].
U gravidních žen je leptin produkován vedle tukových buněk také placentou a významně ovlivòuje průběh gravidity a vývoj plodu. V průběhu fyziologické gravidity dochází ke kolísání hladiny leptinu v krvi matky, vrcholu dosahuje v průběhu 2. trimestru.
Řada studií přináší důkazy, že leptin hraje důležitou patofyziologickou úlohu v regulaci fetální a placentární angiogeneze, fetálního růstu a vývoje, embryonální hematopoézy a biosyntézy hormonů [5], přitom faktory vedoucí k nárůstu syntézy leptinu mohou být obecně dvojího původu, jednak lokální (hypoxie), jednak celkové (hyperinzulinemie).
Významným aktivátorem leptinového promotoru je hypoxie. Je známo, že v promotoru leptinového genu se nachází několik regulačních elementů, včetně cAMP a glukokortikoidů responzivních elementů, CCATT–enhancerů a SP 1–vazebného místa [1].
Již dříve se několik autorů zaměřilo na fakt, že hypoxie cestou hypoxia–inducibilního faktoru (HIF 1) indukuje transkripci leptinu v placentě [2]. Děje se tak cestou minimálně jednoho elementu responzivního na hypoxii lokalizovaného –120 bp až –116 bp v leptinovém promotoru.
HIF 1 je heterodimer složený ze dvou podjednotek: HIF 1á a ARNT (aryl hydrocarbon receptor nuclear translocator) podjednotek.
Biologická aktivita HIF–1 je určována expresí a aktivací HIF 1alfa podjednotky.
Exprese a aktivace podjednotky HIF 1á je těsně spjata s intracelulární koncentrací kyslíku. V normoxických podmínkách je HIF 1á konstitutivně degradována proteazómem 26S, naproti tomu při poklesu tkáòové koncentrace kyslíku je tato podjednotka stabilizována. Exprese HIF 1á se exponenciálně snižuje souběžně s tím, jak klesá koncentrace O2, a to determinuje úroveò HIF 1 aktivity [6,8]. Dá se tedy očekávat, že eventuální sekvenční alterace v oblasti vazného místa pro HIF v promotoru leptinového genu jak u matky, tak u plodu, může způsobit dysregulaci leptinového metabolizmu resultující ve vznik fetální restrikce růstu.
V průběhu fyziologické gravidity dochází ke kolísání hladiny leptinu v krvi matky, vrcholu dosahuje v průběhu 2. trimestru.
Onemocnění jako je preeklampsie a hypotrofie plodu jsou spojena se změnami krevní hladiny leptinu. Tyto stavy vedou ke zvýšení hladiny leptinu, z toho vyplývá, že leptinový gen je z hlediska růstu plodu pod vlivem hypoxických a hypoglykemických podnětů, které aktivují promotorovou oblast leptinového genu a následně dojde ke zvýšení hladiny leptinu.
Tato aktivace se děje prostřednictvím separátních responzivních oblastí HIF 1 (hypoxia inducible factor).
Nukleotidová sekvence části leptinového promotoru s oblastí HIF:
841 cgaggtgcac actgcgggcc cagggctagc agccgcccgg cacgtcgcta ccctgagggg
901 cggggcggga gctggcgcta gaaatgcgcc ggggcctgcg gggcagttgc gcaagttgtg
961 atcgggccgc tataagaggg gcgggcaggc atggagcccc
V literatuře jsme nenašli srovnatelnou analýzu sekvence leptinového genu u matek s prokázanou IUGR plodu. Dle našich výsledků není v literatuře popsaný nárůst hladiny leptinu asociován se změnou DNA–sekvence HIF–responzivního elementu promotoru genu pro leptin. Lze se domnívat, že dysregulace plazmatické hladiny leptinu v séru těhotných žen s IUGR je způsobena komplexní skupinou příčin, mezi jinými právě rozdílnou charakteristikou promotoru leptinového genu ve srovnání se ženami zdravými. Můžeme tedy spekulovat, zda upregulace plazmatického leptinu u žen s IUGR má svůj původ v sekvenční alteraci leptinového promotoru ve větší vzdálenosti od místa startu, nebo zda je nárůst plazmatických hladin leptinu u žen s IUGR způsoben jinými příčinami.
Závěr
V naší studii jsme neprokázali sekvenční alterace v oblasti vazebného místa pro HIF 1 v oblasti promotoru leptinového genu.
Předpokládáme tedy, že zvýšená plazmatická hladina leptinu v séru matek s prokázanou IUGR plodu není způsobena molekulární poruchou DNA v této oblasti.
Sekvenování představuje maximálně specifickou metodu určení nukleotidové sekvence DNA, bohužel rutinní použití této metody v klinické diagnostice je zatím limitováno její cenou.
Zdroje
1. Ahima RS, Fliers JS. Leptin. Annu Rev Physiol 2000; 62 : 413–437.
2. Grosfeld A, Andre J, Hauguel–De Mouzon S, Berra E, Pouyssegur J, Guerre–Millo M. Hypoxia–inducible factor 1 transactivates the human leptin gene promoter. J Biol Chem 2002; 277(45): 42953–42957.
3. Grosfeld A, Turban S, Andre J, Cauzac M, Challier JC, Hauguel–de Mouzon S, Guerre–Millo M. Transcriptional effect of hypoxia on placental leptin. FEBS Lett. 2001; 502(3): 122–126.
4. Henson MC, Castracane VD. Leptin: roles and regulation in primate pregnancy. Semin Reprod Med 2002; 20(2): 113–122.
5. Holness MJ, Munns MJ, Sugden MC. Current concepts concerning the role of leptin in reproductive function. Mol Cell Endocrinol 1999; 157(1–2): 11–20.
6. Michiels C, Minet E, Mottet D, Raes M. Regulation of gene expression by oxygen: NF–kappaB and HIF–1, two extremes. Free Radic Biol Med 2002; 33(9): 1231–1242.
7. Roztočil A. Hypotrofický plod. Moderní gynekologie a porodnictví 2002; 2 : 268–278.
8. Semenza GL. HIF–1 and mechanisms of hypoxia sensing. Curr Opin Cell Biol 2001; 13(2): 167–171.
9. Zhang Y, Proenca R, Maffei M, Barone M, Leopold L, Friedman JM. Positional cloning of the mouse obese gene and its human homologue. Nature 1994; 372(6505): 425–432.
Štítky
Detská gynekológia Gynekológia a pôrodníctvo Reprodukčná medicína
Článek Slovo úvodemČlánek VII. KONFERENCI O MENOPAUZE
Článok vyšiel v časopisePraktická gynekologie
Najčítanejšie tento týždeň
2005 Číslo 3- Ne každé mimoděložní těhotenství musí končit salpingektomií
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Mýty a fakta ohledně doporučení v těhotenství
- Gynekologické potíže pomáhá účinně zvládat benzydamin
-
Všetky články tohto čísla
- Úloha prokalcitoninu v diagnostice neonatální infekce
- Kojení stále nenahraditelné I.
- Vliv hormonální kontracepce na roztroušenou mozkomíšní sklerózu
- Klinický význam vlivu hormonální terapie na riziko vzniku kolorektálního karcinomu
- Problematika diagnostiky a léčby zhoubných nádorů vulvy
- Slovo úvodem
- XXV. doškolovací seminář Sdružení soukromých gynekologů ČR ve spolupráci s firmou Zentiva
- XXVI. doškolovací seminář Sdružení soukromých gynekologů ČR ve spolupráci s firmou Organon a Sekcí ambulantních gynekologů ČGPS ČLS JEP
- VII. KONFERENCI O MENOPAUZE
- Nepřítomnost sekvenčních změn v HIF responzivním elementu promotoru leptinového genu u českých žen s hypotrofií plodu
- Vrozené trombofilie a cytogenetické nálezy u pacientů s opakovanými fetálními ztrátami
- Praktická gynekologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Úloha prokalcitoninu v diagnostice neonatální infekce
- Problematika diagnostiky a léčby zhoubných nádorů vulvy
- Kojení stále nenahraditelné I.
- Vrozené trombofilie a cytogenetické nálezy u pacientů s opakovanými fetálními ztrátami
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy