-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Diferenciální diagnostika a terapie opakovaných těhotenských ztrát – 1. část
Differential diagnostic and therapy of recurrent pregnancy loss
The authors report back integrated review of recurrent pregnancy loss etiology, differential diagnostic and therapy. The article contains complex summary of recurrent miscarriage’s etiological factors. The imunological and genetic causes of recurrent miscarriage are the factors with recently growing epidemiological importance. The authors discuss hematologic disturbances and infections as cause of dysfertility. This article provides an overview of a recurrent pregnancy loss managment, describes conservative methods, assisted reproduction techniques, preimplantation genetic diagnostic and surgical interventions. The new trends of embryoprotective imunomodulation draw your attention in more details.
Key words:
Recurrent pregnancy loss – assisted reproduction techniques – endocrinology of reproduction – genetics of dysfertility – inherited thrombophilias – antroposoonosis – embryoprotective imunomodulation
Autoři: R. Krajčovičová; R. Hudeček; J. Kalvodová
Působiště autorů: Gynekologicko-porodnická klinika MU a FN Brno
Vyšlo v časopise: Prakt Gyn 2007; 11(4): 164-169
Souhrn
Autoři práce podávají ucelený přehled etiologie, diferenciální diagnostiky a terapie habituálního potrácení. Práce se zaměřuje především na ty etiologické faktory, jejichž epidemiologický význam v současnosti narůstá. Jedná se především o imunologické a genetické příčiny habituálního potrácení. Dále je diskutována dysfertilita podmíněná hematologickými poruchami a infekčními stavy. Práce shrnuje přehled možností terapeutického ovlivnění habituálního potrácení od konzervativních postupů, přes techniky asistované reprodukce a preimplantační genetické diagnostiky, po operační intervenci. Podrobněji jsou rozebrány nové léčebné trendy až na bázi embryoprotektivní imunomodulace.
Klíčová slova:
habituální potrácení – asistovaná reprodukce – endokrinologie reprodukce - genetika dysfertility – vrozené trombofilní stavy – antropozoonózy – embryoprotektivní imunomodulaceDefinice habituálního potrácení
Opakované (habituální) potrácení je charakterizováno 3 a více následnými samovolnými ztrátami plodu. Postihuje asi 1 % žen v reprodukčním věku [1]. Může jít o habituální potrácení primární (všechna těhotenství byla neúspěšná), nebo sekundární (mezi neúspěšnými graviditami proběhnou i těhotenství úspěšně zakončená porodem) [2,3]. Pro ženu, která potratila konzekutivně pouze 2krát, byl u nás používán termín dysfertilita, v anglosaské literatuře se pro tento stav v současnosti užívá termín recidivujíci potrat (recurrent miscarriage) [2].
Ke spontánním potratům dochází u 15–20 % těhotenství [6]. Ve skutečnosti bude toto číslo mnohem vyšší, protože více než 40 % koncepcí končí ještě v době před jejich diagnostikováním [4]. Frekvence samovolných potratů stoupá s věkem matky.
Etiologické faktory habituálního potrácení
Podmínkou úspěšné terapie opakovaných těhotenských ztrát je důsledné a individuální diagnostikování příčin habituálního potrácení. Mezi příčiny habituálního potrácení patří:
- anatomické
- genetické
- hematologické
- endokrinologické
- infekční
- imunologické
- environmentální
- psychologické
- idiopatické
První samovolný potrat je až v 90 % důsledkem chromozomální aneuploidie, většinou vzniklé de novo, přičemž riziko opakování stejné změny je minimální [3,5]. Při opakování těhotenských ztrát je nezbytné ženu podrobit komplexnímu vyšetření s cílem zjistit konkrétní příčinu habituálního potrácení.
Anatomické příčiny opakovaných fetálních ztrát
Anatomické abnormity genitálního traktu se vyskytují u 0,1 % ženské populace [3]. Bývají příčinou opakovaných fetálních ztrát především ve 2. trimestru. Jedná se o vrozené a získané anatomické abnormity dělohy.
Vrozené malformace genitálního traktu vznikají následkem poruch spojení Müllerových vývodů, mohou být symetrické nebo asymetrické. Často bývají spojeny s hypoplazií dělohy (obr. 1) [7]. Typickou abnormitou spojenou s opakovanými ztrátami ve 2. trimestru je děložní septum. Může dosahovat různé délky od fundu až k hrdlu děložnímu. Může mít charakter fibrózní, či vaskularizovaný, parciálně krytý vrstvou endometria. Dutina děložní nemusí být rozdělena tímto septem symetricky. Anatomické varianty děložního septa spolu s místem implantace embrya určují, dojde-li během těhotenství k spontánnímu abortu, k předčasnému porodu, či proběhne-li těhotenství bez komplikací [8].
Obr. 1. Vrozené děložní malformace – porucha spojení Müllerových vývodů. 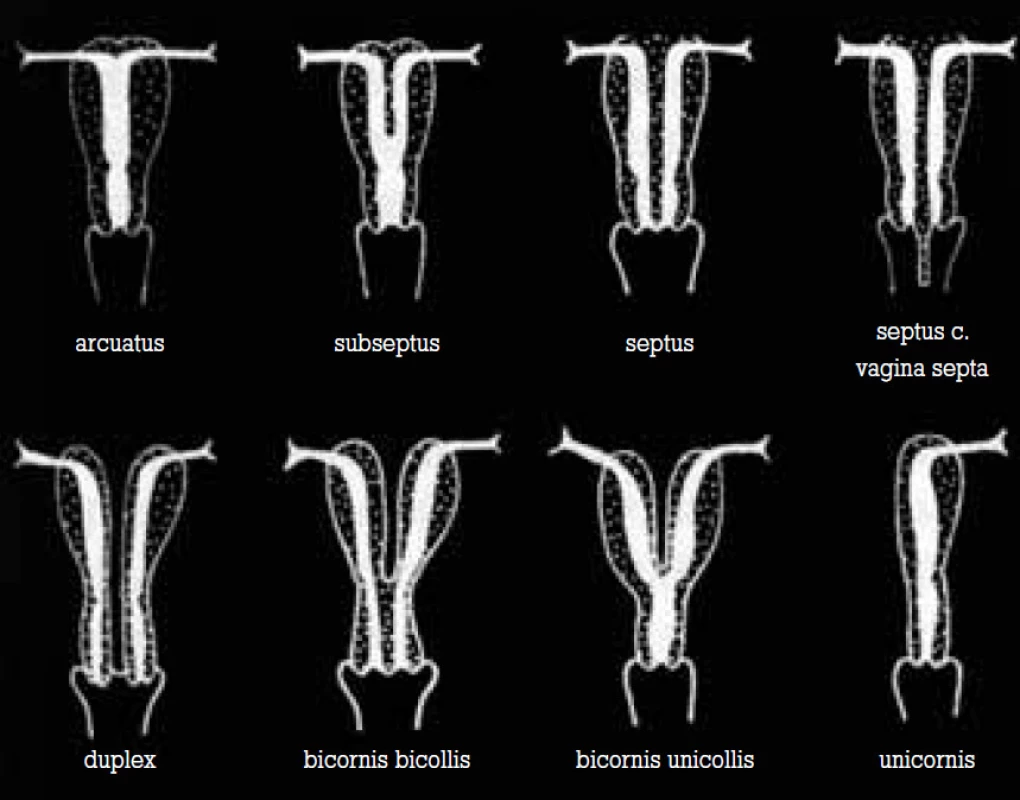
Mezi získané abnormity genitálního traktu, které zvyšují riziko těhotenské ztráty patří inkompetence děložního čípku, děložní myomatóza (obr. 2), přítomnost intrauterinních adhezí v rámci Ashermanova syndromu, dále také zaklínění těhotné dělohy v retroverzi-flexi v malé pánvi. V případě výskytu jednoho či více leiomyomů může probíhat u žen těhotenství bez komplikací. Spontánní abort zpravidla souvisí s velikostí myomu a jeho umístěním. Submukózní myomy prominující do dutiny děložní, či velké intramurální myomy snižující krevní zásobení v místě implantace mohou vést k potratu nebo předčasnému porodu [8].
Diagnostika
Anatomické abnormity je nutné diagnostikovat a léčit prekoncepčně. Diagnostika vrozených vývojových vad se opírá o hysterosalpingografii, ultrasonografii a laparoskopii. Laparoskopie rozliší, zda je vada vnitřního genitálu plášťová, či nikoliv [9].
V diagnostice myomů se uplatňuje ultrasonografie, hysteroskopie a laparoskopie. Intrauteriní synechie potvrdí hysterosalpingografie nebo hysteroskopie. Inkompetence hrdla děložního je diagnostikována na podkladě ultrazvukového a klinického posouzení délky děložního cervixu. Indikací k provedení cerkláže je nepříznivá cervikometrie kombinovaná s nepříznivou porodnickou anamnézou [9,10].
Terapie
U děložních abnormit s výhodou používáme metody endoskopické – operační hysteroskopii, laparoskopii. U vrozených vývojových vad dělohy je možná resekce děložního septa cestou operační hysteroskopie (obr. 3), která postupně nahrazuje dříve často prováděnou metroplastiku laparotomickou cestou [11] (obr. 4). Po výkonu je možno zavést IUD jako prevenci synechií. U větších myomů indikujeme operační řešení (podle velikosti a lokalizace laparoskopická, hysteroskopická, či laparotomická myomektomie), předoperačně je možná příprava GnRH-agonisty [12].
Obr. 3. Hysteroskopické odstranění děložního septa. 
Obr. 4. Laparotomická metroplastika. 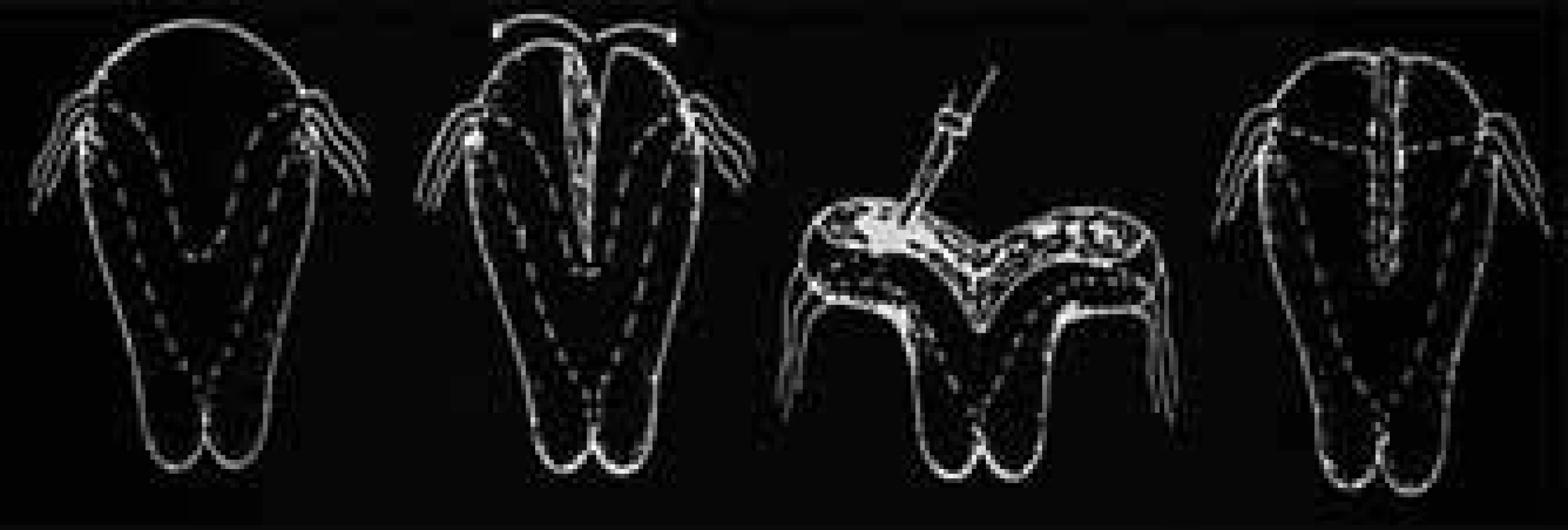
V případě inkompetence hrdla děložního indikujeme ve 2. trimestru při nepřítomnosti děložních kontrakcí cerkláže. V praxi provádíme jednoetážovou cerkláž dle McDonalda. Steh by měl být odstraněn ve 37. týdnu gravidity [9-11].
Genetické příčiny habituálního potrácení
Frekvence genetických abnormalit u spontánních abortů se udává asi 40-50 %, vyskytují se většinou u abortů v časných fázích těhotenství (74 % aberací u abortů v 9. týdnu gravidity oproti 33 % aberací v 19.-30. týdnu gravidity) [3]. Jeden abort s nálezem aneuploidie nezvyšuje riziko aneuploidie v dalším těhotenství. Není-li aberace u rodičů, je riziko rekurence nízké. Důležité je odhalit zdravé nosiče balancovaných chromozomálních aberací, u nichž jsou rizika opakování vzniku nebalancovaného karyotypu u potomků zvýšená [3].
Rizikovým faktorem opakovaných fetálních ztrát mohou být některá monogenně dědičná onemocnění. Dědí se autozomálně recesivně (např. cystická fibróza, autozomálně dominantně (myotonická dystrofie) nebo jsou X - vázaná (např. incontinentia pigmenti) [3].
Chromozomové aberace jsou numerické (triploidie, tetraploidie, trizomie – chromozomy 16,18,21), nebo strukturní (balancované či nebalancované), týkají se autozomů nebo gonozomů, dále rozlišujeme aberace vrozené a získané, vyskytují se mozaiky [2,3].
Celkově zjištěná incidence chromozomových abnormalit u novorozenců je asi 0,6 % [3]. Incidence chromozomálních aberací při koncepci není známá, předpokládá se vyšší než 30 % [3]. Převážná část autozomových abnormalit bývá zjištěna při porodu, aberace pohlavních chromozomů většinou až v období puberty, projevem bývají reprodukční obtíže. Chromozomové abnormity jednoho z partnerů zjišťujeme přibližně u 3-6 % [3] případů sterility nebo u párů s anamnézou 2 a více potratů. Právě reprodukční obtíže mohou upozornit na nosičství balancované aberace. Riziko narození dítěte s nebalancovanou aberací je asi 12 %, je –li nosičem balancované přestavby žena, a asi 5 %, nese-li ji muž [3].
Mezi nejčastější aberace gonozomů u živě narozených patří trizomie (47XXX, 47XXY, 47XYY). Trizomie jsou však vzácnou příčinou spontánních potratů. Naopak monozomie X (Turnerův syndrom) je méně častý u živě narozených (jen 1 % ze všech aberací), ale vyskytuje se velmi často u spontánních potratů (téměř 20 % potratů s aberací) [3]. Strukturní abnormity gonozomů jsou vzácnější.
Získané chromozomální aberace se objevují během života. Jsou vyvolány faktory zevního prostředí – mutageny (závisí na dávce, způsobu aplikace a délce působení mutagenu): např. ionizujícím záření, cytostatiky, imunosupresivy atd. [3,5].
Diagnostika
Prekoncepční vyšetření párů zahrnuje genetickou konzultaci, trojgenerační rodokmen, pracovní a osobní anamnézu, dále probíhá cytogenetické vyšetření partnerů (karyotypizace) s cílem diagnostikovat případy s vysokým rizikem nebalancované chromozomové translokace u potomků, vyhledávání monogenně podmíněných onemocnění pomocí DNA-analýzy, při podezření na získané aberace vyšetření periferních lymfocytů [3,14]. Kontrolní počet buněk s chromozomovými aberacemi v periferních lymfocytech je u člověka asi 1–2 %, za pozitivní označujeme nález 5 a více % aberantních buněk [3]. Důležité je i cytogenetické a patomorfologické vyšetření potraceného plodu.
Preimplantační diagnostika může probíhat prekoncepčně (vyšetření oocytů, spermatozoí), či postkoncepčně (vyšetření buněk embrya v době jeho rýhováni) [15,16]. Metody FISH a PCR používáme ke genetické analýze fetálních buněk z fetální krve (fetální lymfocyty, buňky trofoblastu a fetální erytrocyty) [15]. U těhotných dále provádíme standardní vyšetření v rámci prenatální diagnostiky (kombinovaný nebo integrovaný screening, či metody invazivní prenatální diagnostiky) [3,5,17,30].
Terapie
Vrozené chromozomové aberace jsou většinou závažným postižením s velmi malou možností terapeutického ovlivnění. Důležitá je prekoncepční příprava (vitaminová prevence – acidum folicum v dávce 1 mg jako prevence rozštěpových vad se doporučuje všem ženám plánujícím graviditu 3 měsíce před plánovanou koncepcí a do 12. týdne těhotenství) [3,18].
Novým terapeutickým přístupem je v současnosti využití metod preimplantační genetické diagnostiky (PGD), obr. 5. Jde o metody, které zásadně posouvají hranice možnosti asistované reprodukce a kvalitativně mění šance na početí a porod zdravého dítěte [19], a to i u žen s habituálním potrácením. PGD je metoda cílená a preventivní, která s sebou nenese žádný zásah do genomu a je zaměřena na testování a diagnózu dané geneticky dedičné nemoci [16]. Umožňuje volbu zdravého embrya ještě před implantací do dělohy, čímž výrazně snižuje výskyt potratů párů s anamnézou habituálního potrácení z genetické příčiny [20].
Obr. 5. Odběr buněk při preimplantačním genetickém vyšetření embryí. 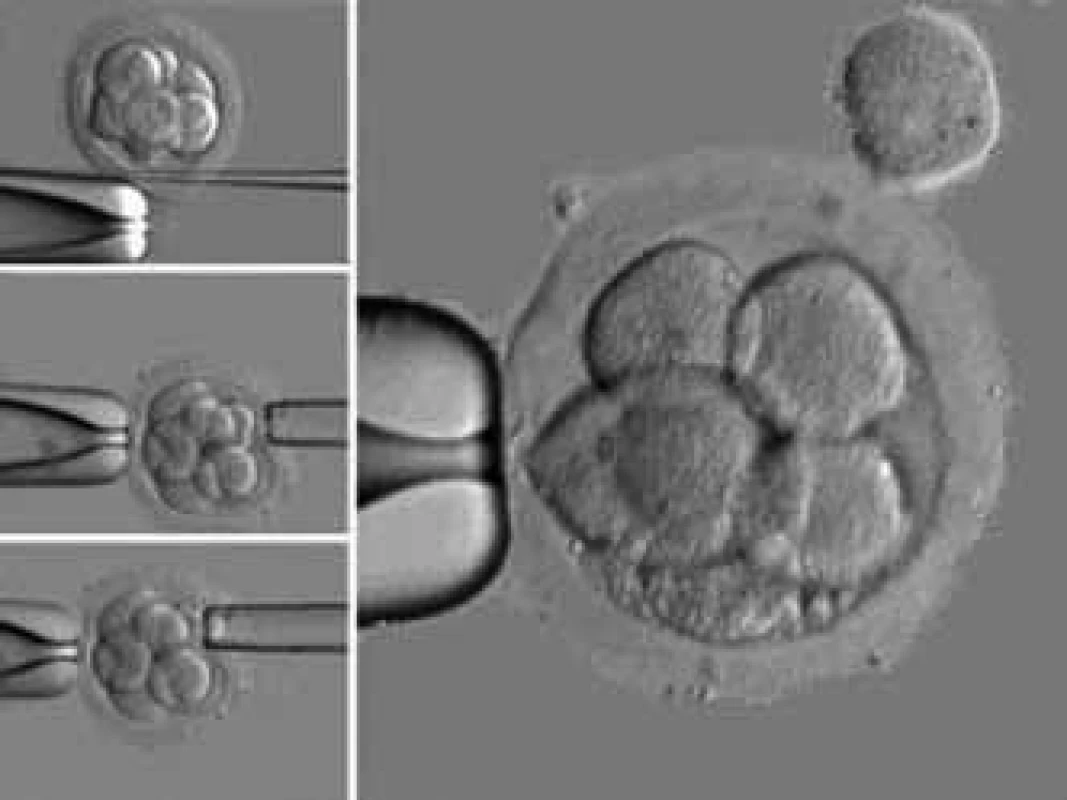
Habituální potrácení – hematologické příčiny
Zvýšené riziko předčasného ukončení gravidity představují stavy spojené se zvýšeným krvácením (vzácné) a stavy trombofilní, kdy se v patogenezi abortu uplatňuje trombotická okluze cév placenty [3]. Trombofilie mohou být vrozené, či získané.
Gravidita je fyziologicky hyperkoagulační stav, kdy jsou fyziologicky zvýšené hodnoty fibrinogenu, koagulačných faktorů VII, VIII, IX, X, XII, dále je snížená aktivita antifibrinolytických proteinů, antikoagulačních faktorů, Z těchto důvodů je zvýšené riziko trombembolické nemoci [3,13]. Vrozená či získaná trombofilie tento hyperkeagulační stav dále potencují a kromě zvýšení rizika trombembolické nemoci se uplatňují v patogenezi preeklampsie, intrauterinní růstové retardace, intrauterinního úmrtí, abrupce placenty a taktéž i v patogenezi recidivujících potratů [13,22]. V uteroplacentárních cévách dochází k tvorbě fibrinových depozit, trombózám, hypoxickým změnám endotelu a trofoblastu a trombózám uteroplacentárních cév. Je tedy pravděpodobné, že se v rámci těhotenství negativně uplatňují až po vytvoření placentárního oběhu (8. týden gravidity) a nejsou příčinou časných těhotenských ztrát, mohly by se podílet spíše na ztrátách na přelomu 1. a 2. trimestru a v 2. trimestru – zejména Leidenská mutace faktoru V, mutace genu pro protrombin, antifosfolipidový syndrom [13,21-25].
Mezi hereditární trombofilie patří rezistence na aktivovaný protein C (způsobená Leidenskou mutací genu pro faktor V) [13,21,25], mutace protrombinu 20210A, deficit antikoagulačních faktorů (protein C, protein S, Antitrombin III), dysfibrinogenemie, hyperhomocysteinemie (způsobená defektem v genu pro enzym methylen-tetrahydrofolát reduktázu - MTHFR). Ze získaných trombofilií je nejvýznamnější antifosfolipidový syndrom (více je zmíněn v odstavci Imunologické příčiny infertility v 2. části uveřejněné v příštím čísle), dále zvýšená hladina faktoru VIII, IX, hyperhomocysteinemie, zvýšená hladina fibrinogenu, trombofilie při myeloproliferativním onemocnění, malignitě, nefrotickém syndromu [22,24,25].
Dědičné trombofilie se liší rizikovostí, vyskytují se v heterozygotních, či homozygotních (závažnějších) formách, nebo se mohou kombinovat [13]. U defektu MTHFR se mohou klinické projevy zvýraznit při deficitu vitaminů B6, B12 a kyseliny listové [3].
Diagnostika
Základem je anamnéza (osobní, rodinná, gynekologická), hematologické vyšetření (základní laboratorní vyšetření: KO, APTT, PT, fibrinogen, dále protein C, protein S, lupus anticoagulans, ACLA (antikardiolipinové protilátky), protilátky proti beta2glykoproteinu, FVIII, FXII, hladina homocysteinu), genetické vyšetření ke zjištění hereditární trombofilie. Plošný screening hereditárních trombofilií se neprovádí, není efektivní [25]. Vyšetřeny by měly být u žen s anamnézou preeklampsie, HELLP syndromu, abrupce placenty, těžké formy intrauterinní růstové retardace plodu, intrauterinního úmrtí plodu, rekurentních abortů [25].
V průběhu těhotenství je nutné sledování těhotné pacientky na hematologické ambulanci, v rizikové poradně, pravidelná USG-vyšetření - biometrie, dopplerovská ultrasonografie
Terapie
Terapie je individuální, v praxi se setkáváme s různými přístupy. Liší se u jednotlivých trombofilií, s přihlédnutím k aktuálním laboratorním vyšetřením a anamnéze pacientky (např. anamnéza žilní trombózy). Dle doporučení hematologa podáváme kyselinu acetylsalicylovou a/nebo nízkomolekulární hepariny, u defektu MTHFR substituujeme vitaminy skupiny B. Antikoagulační léčbu monitorujeme v případě Leidenské mutace pomocí aktivity anti-Xa, při podávání nefrakcionovaného heparinu sledováním hladin APTT [26]. V léčbě antifosfolipidového syndromu se již ustoupilo od podávání kortikoidů [26]. Podrobnější doporučení a návrh antitrombotické profylaxe a péče o trombofilní stavy v gynekologii a porodnictví vydala v roce 2006 Sekce pro trombózu a hemostázu ČHS ČLS JEP [26].
Endokrinní příčiny opakovaných těhotenských ztrát
Endokrinopatie jsou častou a závažnou příčinou habituálního potrácení. Jedná se o primárně gynekologické endokrinopatie (z hypofunkce ovaria) nebo endokrinopatie negynekologického původu. Mezi endokrinopatie, které mají jednoznačný vliv na fertilitu, patří tyreotoxikóza, hypotyreóza, diabetes mellitus, hyperprolaktinemie. Porucha poměru FSH a LH a hyperandrogenizmus při syndromu polycystických ovarií jsou také považovány za faktory související se zvýšeným rizikem opakovaných reprodukčních ztrát. Počet potratů v 1. trimestru u žen se syndromem polycystických ovarii (PCOS) je o 30-50 % vyšší než u zdravých žen [27].
Novější studie poukazují na roli inzulinové rezistence v etiologii habituálního potrácení. Hyperinzulinemie se vyskytuje až u 27 % žen s anamnézou opakovaných abortů [28] a ovlivňuje funkci endometria redukcí hladin 2 hlavních endometriálních proteinů (glykodelin a inzulin – like growth factor binding protein). Přibližně 50-70 % žen se syndromem polycytických ovarií má určitý stupeň inzulinové rezistence [27].
Názorové rozdíly v příčinách opakovaných potratů jsou v otázce luteální insuficiencie tzv. faktoru implantačního či nidačního, při němž dochází k diskrepanci mezi adekvátní sekreční produkcí endometria a vysokou nutritivní potřebou rýhujícího se oplozeného vajíčka, buď ještě v době jeho tzv. volného putování dělohou či v období histiotrofé. Tato pak může vést opakovaně k zástavě vývoje embrya a těhotenství končí potratem v průběhu 1. trimestru [29].
Spontánní potrat častěji souvisí s dekompenzací diabetes mellitus (DM) na počátku těhotenství. Vyskytuje se častěji u špatně kompenzovaných pacientek s DM 1. typu, někdy u pacientek s DM 2. typu, který není diagnostikován před těhotenstvím. Těhotenství je považováno za diabetogenní stav a vznik gestačního diabetes mellitus souvisí s rostoucí inzulinovou rezistencí [30].
Diagnostika
Diagnostika diabetes mellitus v těhotenství se opírá o zjištění hladin glukózy v moči a krvi pacienta a o výsledek orálního glukozovího testu (oGTT). Prekoncepčně zjišťujeme aktuální metabolickou kompenzaci - kontrola glykemických profilů, vyšetření glykovaného hemoglobinu (HbA1c) a vyšetření na přítomnost diabetických komplikací. U žen se závažnými orgánovými komplikacemi by gravidity neměla být doporučena [30].
Na luteální insuficienci usuzujeme při překoncepčním stanovení velmi krátké sekreční fáze podle bazálních teplot, opakovaným zjištěním těžké retardace sekreční transformace endometria z mikroabraze, imunohistochemicky prokázaným inadekvátním charakterem jeho sekretu a významným snížením sérového progesteronu v sekreční fázi [2].
Při diagnostice poruch činnosti štítné žlázy stanovujeme hladiny hormonů T3, T4, TSH, dále hladinu thyreoidálních protilátek. Při diagnostikování jiných endokrinopatií stanovujeme hladiny příslušných hormonů [2].
Terapie
Důležitá je suplementace nebo blokování působení příslušných hormonů, důsledná kompenzace u diabetes mellitus (dietní režim, inzulinoterapie). Aplikace metforminu při zjištěné hyperinzulinemii a u žen s PCOS představuje terapeutické využití preparátu ze skupiny inzulinových senzitizátorů se slibnými účinky v oblasti anovulační sterility a dysfertility u těchto žen [31].
V případě zjištění luteální insuficience je indikována dlouhodobá hormonální terapie a podání gestagenů ještě v nasledujícím těhotenství, většinou v průběhu 1. trimestru [32].
Infekční příčiny habituálního potrácení
Vliv infekce reprodukčních orgánů na potrat plodového vejce je stále předmětem diskuze. Příčinný vztah mezi nahodilým samovolným potratem a akutně probíhající infekcí jejíž původcem je např. mycoplasma, ureoplasma ureolyticum, chlamydia trachomatis (obr. 6), neisseria gonorrhoe, treponema pallium, herpes simplex, cytomegalovirus, antropozoonózy a další je všeobecně uznáván [2]. Pokud však jde o chronické, latentní stavy onemocnění (např. latentní toxoplazmózu), nejsou výsledky, které by potvrzovaly tento příčinný vztah, dostatečně přesvědčivé [2].
Obr. 6. Chlamydia trachomatis. 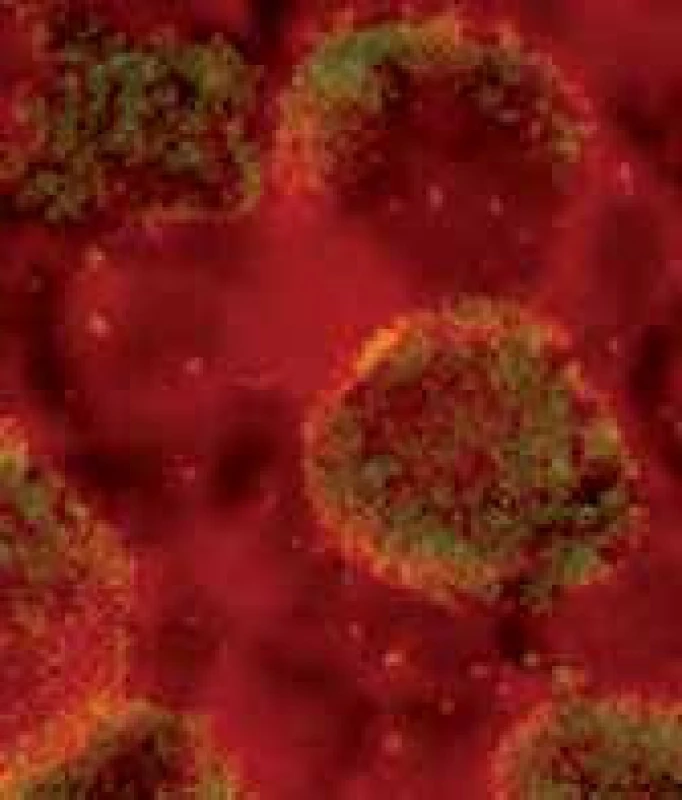
Diagnostika
U opakovaně potrácejících žen se doporučuje provedení kultivace sekretu z cervixu či kultivaci z dutiny děložní nebo provedení séroreakce (podle agens) [2]. Důležité je doplnit cílené sérologické vyšetření na chlamydie.
Terapie
Při pozitivním nálezu potvrzujícím akutní nebo chronickou infekci podáváme antibiotika dle zjištěné citlivosti původce infekce [2].
Pokračování článku bude uveřejněno v následujícím čísle Praktické gynekologie.
Doručeno do redakce: 2. 7. 2007
Přijato po recenzi: 30. 8. 2007
MUDr. Renáta Krajčovičová
as. MUDr. Robert Hudeček, Ph.D.
MUDr. Jana Kalvodová
Gynekologicko-porodnická klinika MU a FN Brno
Zdroje
1. Madar J, Nouza D, Nováková D. Imunologické aspekty habituálního potrácení. Moderni gynekologie a porodnictví. Sterilita a opakované potrácení 2002; 11(4): 621-627.
2. Zwinger A. Opakované potrácení. In: Zwinger A et al. Porodnictví. Praha: Galén 2004, 173-183.
3. Gaillyová R. Genetické příčiny poruch reprodukce. Brno 2006.
4. Kupferminc MJ, Roqué H, Binder T. Je nosičství trombofilie příčinou časných spontánních potratů v prvním trimestru? Gynekologie po promoci 2004; 4(3): 55-59.
5. Roztočil A. Poruchy délky trvání těhotenství. In: Roztočil A et al. Porodnictví. Brno 2001 : 157.
6. Šantavá A, Zapletalová J. Turnerov syndrom. Praha: Galén 2003.
7. Monteagudo A, Tsybal T. Sonografické známnky anomálií Müllerových vývodů. Gynekologie po promoci 2005; 5(3): 36.
8. Bick RL, Madden J, Heller KB et al. Recurrent miscarriage: causes, evaluation, and treatment. Medscape Women’s Health 1998; 3(3): 2.
9. Berghella V, Baxter J, Pereira L. Měli bychom cerclage provádět? Gynekologie po promoci 2006; 6(2): 24-33.
10. Čech E, Hájek Z, Maršál K et al. Porodnictví. Praha: Grada Publishing 2004 : 148-154.
11. Macků F et al. Kompendium gynekologických operací. Praha: Grada 1995 : 220-226, 305-314.
12. Arici A, Kelly SM, Tulandi T. Kontroverze: Měla by být u neplodných žen s itramurálními myomy prováděná myomectomie. Gynekologie po promoci 2005; 5(5): 56.
13. Lockwood CH J. Inherited Thrombophilias in Pregnant Patiens: Detection and Treatment Paradigma. Obstet Gynekol 2002; 99 : 333-341.
14. Guttenbach M, Engel W, Schmidt M. Analysis of structural and numerical chromosome abnormalities in sperm of normal men and carriers of constitutional chromosome aberrations. Hum Genet 1997; 100 : 1-21.
15. Alves C, Sousa M, Silva J, Barros A. Preimplanntation genetic diagnosis usány FISH for carriers of Robertsonial translocations: the Portuguese experience. Prenatal Diagnosis 2002; 22 : 1153-1162.
16. Žáková J, Ventruba P, Vojtíšková M et al. Aktuální otázky vztahující se k preimplantační diagnostice. 10. symposium Asistovaná reprodukce. Brno 2000.
17. Martius G, Breckwoldt M, Pfleiderer A et al. Gynekologie a porodnictví. Martin: Osveta 1997.
18. Binder T. Možnosti terapie opakovaného potrácení. Moderni gynekologie a porodnictví 2002; 11(4): 628-634.
19. Veselá K, Tauwinklová G, Trávník P et al. Preimplantační genetická diagnostika (PGD) numerických a strukturálních abnormit třídenních embryí v programu in vitro fertilizace u párů s opakovanými těhotenskými ztrátami či neúspěchy v předchozích IVF cyklech. 11. symposium Asistovaná reprodukce. Brno 2001.
20. Brachtlovová T, Hlinka D, Mardešić T. Preimplantační genetické vyšetření embryí – nový pohled na lidská embrya a léčbu neplodnosti. Sanquis 2005; 39 : 30.
21. Hashimoto K, Shizusawa Y, Shimoya K et al. The factor V Leiden mutation in Japanese couples with recurrent spontaneous abortion. Hum Reprod 1999; 14(7): 1872-1874.
22. James AH, Brancazio LR, Prenatal. Screening for Trombophilia: The Background and the Approach. Gynecol Obstet Invest 2005; 60 : 47-57.
23. Kupferminc MJ, Roqué H, Binder T. Je nosičství trombofilie příčinou časných spontánních potratů v prvním trimestru? Gynekologie po promoci 2004; 4(3): 55-59.
24. Pisák M. Fosfolipidový syndrome a reprodukčné straty. Slovenská gynekológia a Porodnictvo 2004 : 11(4): 64-68.
25. Murphy RP, Donoghue C, Nallen RJ et al. Prospective Evaluation of the Risk Conferred by Factor V Leiden and Thermolabile Methylenetetrahydrofolate Reductase Polymorphisms in Pregnancy. American Heart Association 2000; 20(1): 266.
26. Dulíček P, Penka M, Binder T et al. Návrh antitrombotické profylaxe a péče o trombofilní stavy v gynekologii a porodnictví (Doporučení Sekce pro trombózu a hemostázu ČHS ČLS JEP).
27. Kauffman RP, Castracane D, Kosasa T. Syndrom polycystických ovarií. Gynekologie po promoci 2003, 3(6): 39-47.
28. Carrington B, Sacks G, Regan L et al. Recurrent miscarriage: pathophysiology and outcome. Curr Opin Obst Gynecol 2005; 17(6): 591-597.
29. Erlebacher A, Zhang D, Parlow AF et al. Ovarian insuficiency and early pregnancy loss. J Clin Inves 2004; 114(1): 39-48.
30. Hájek Z. Rizikové a patologické těhotenství. Praha: Grada 2004.
31. Višňová H, Ventruba P, Crha I. Metformin v léčbě sterility u žen s PCOS. 13. symposium Asistovaná reprodukce. Brno 2003 : 12 .
32. Armstrong J, Nageotte M. Může progesteron zabránit předčasnému porodu? Gynekologie po promoci 2006; 6(1): 18-24.
33. Nouza K, Nouza M, Madar J. Prevence a léčba imunologicky podmíněného opakovaného potrácení. Medicína 2000; 6(7): 21.
34. Bulíková A, Crha I. Antifofolipidové protilátky a antifosfolipidový syndrom v porodnictví. Prakt gynekol 2004; 1, 6-9.
35. Ventruba P, Višňová H, Crha I. Embryoprotektivní imunomodulace. 12. symposium Asistované reprodukce. Brno 2002 : 8.
36. Višňová H, Ventruba P, Hruban L. Využití dydrogesteronu v reprodukční gynekologii. 12. sypozium Asistované reprodukce. Brno 2002 : 11.
37. Dittmar F. Systémová enzymoterapie – úspěšná imunoterapie imunologicky podmíněných habituálních potratů. Medicína 2001; 7(8): 15.
38. Uhrová E, Brandejská M, Nováková D. Enzymoterapie a infertilita. 12. sypozium Asistované reprodukce. Brno 2002 : 20.
39. Hrubá D. Kouření je největší preventabilní riziko poruch reprodukce. Prakt gynekol 2001; 2 : 35-41.
40. Korytová D. Psychosomatika sterility. Moderni gynekologie a porodnictví. Sterilita a opakované potrácení 2002; 11(4): 635-636.
Štítky
Detská gynekológia Gynekológia a pôrodníctvo Reprodukčná medicína
Článek Edukační kazuistikyČlánek Předčasné ovariální selháníČlánek Digitální obrazový archivČlánek Odborné akce
Článok vyšiel v časopisePraktická gynekologie
Najčítanejšie tento týždeň
2007 Číslo 4- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Ne každé mimoděložní těhotenství musí končit salpingektomií
- Gynekologické potíže pomáhá účinně zvládat benzydamin
- Mýty a fakta ohledně doporučení v těhotenství
-
Všetky články tohto čísla
- Pater semper incertus, sed nonnumquam etiam mater incerta est
-
Autorská soutěž praktické gynekologie
O nejlepší článek v roce 2007 - Edukační kazuistiky
- Štítna žľaza z pohľadu gynekológa
- Diferenciální diagnostika a terapie opakovaných těhotenských ztrát – 1. část
- Předčasné ovariální selhání
- Legální anonymní odložení novorozence – současné možnosti v ČR
- Digitální obrazový archiv
- In vitro maturácia oocytov: naše skúsenosti s prevenciou OHSS u rizikových pacientok
- Odborné akce
- Praktická gynekologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Předčasné ovariální selhání
- Legální anonymní odložení novorozence – současné možnosti v ČR
- Diferenciální diagnostika a terapie opakovaných těhotenských ztrát – 1. část
- In vitro maturácia oocytov: naše skúsenosti s prevenciou OHSS u rizikových pacientok
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy