-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Imunoprofylaxe RhD erytrocytární aloimunizace
Immunoprophylaxis of RhD erythrocyte alloimmunization
The erythrocyte alloimmunization (isoimmunization, hemolytic disease of the fetus and newborn – HON) occurs sporadically at present, thanks to routine immunoprophylaxis with anti-D immunoglobulin. The occurrence of atypical alloimmunizations related to non-RhD-antigens remains unchanged, as there is no prophylaxis known and even the prevention does not provide one hundred percent efficiency. When anti-D immunoglobulin immunoprophylaxis is not undertaken or fails, the threat of hemolytic disease of the fetus and newborn arises. Every case is then unique (specificity and type of antibody, blocking antibodies in maternal serum, antigenic make-up of fetal erythrocytes, gestational age at the disease onset etc). The advancements in genetic diagnostics, immunohematology and Doppler ultrasonography significantly reduce the frequency of necessary invasive interventions in the diagnostics and treatment of sensibilized pregnancy. Intraumbilical strictly intravenous transfusion under ultrasound guidance is the first-line method of therapy for cases of severe fetal anemia as well as advanced hydrops. Consultations and treatment are provided in the centres for comprehensive obstetrical and neonatal care with continuous intervention preparedness.
Key words:
anti-D immunoglobulin – erythrocyte alloimmunization – hemolytic disease of the fetus and newborn – anti-D immunoglobulin immunoprophylaxis – intraumbilical intravenous transfusion
Autoři: Zdeněk Žižka
Působiště autorů: Gynekologicko-porodnická klinika 1. LF UK a VFN Praha, přednosta prof. MUDr. Alois Martan, DrSc.
Vyšlo v časopise: Prakt Gyn 2014; 18(3): 198-203
Kategorie: Perinatologie: Přehledový článek
Souhrn
Erytrocytární aloimunizace (izoimunizace, hemolytické onemocnění plodu a novorozence – HON) se v současnosti díky rutinní imunoprofylaxi anti-D imunoglobulinem vyskytuje sporadicky. Výskyt atypických aloimunizací non-RhD-antigeny zůstává neměnný, poněvadž není známa profylaxe a ani prevence nezajišťuje stoprocentní účinnost. Pokud se imunoprofylaxe anti-D imunoglobulinem neprovede nebo selže, hrozí vznik hemolytického onemocnění plodu a novorozence. Každý případ je potom unikátní (specifita a typ protilátky, blokující protilátky v séru matky, antigenní výbava erytrocytů plodu, gestační stáří při začátku onemocnění atd). Pokroky v genové diagnostice, imunohematologii a dopplerovské ultrasonografii významně snižují frekvenci nutných invazivních zákroků v diagnostice a léčbě senzibilizovaného těhotenství. Intraumbilikální přísně intravenózní transfuze pod ultrasonografickou kontrolou je první metodou volby léčby případů s těžkou anémií plodu i při rozvinutém hydropsu. Konzultace a léčba se soustřeďují do center s perfektní porodnickou a neonatologickou péčí a nepřetržitou operační pohotovostí.
Klíčová slova:
anti-D-imunoglobulin – erytrocytární aloimunizace – hemolytické onemocnění plodu a novorozence – imunoprofylaxe anti-D-imunoglobulinem – intraumbilikální intravenózní transfuzeÚvod
Erytrocytární aloimunizace (izoimunizace, hemolytické onemocnění plodu a novorozence – HON) je dnes onemocnění se sporadickým výskytem díky úspěšné a všeobecně prováděné imunoprofylaxi anti-D-imunoglobulinem [1]. Ani důsledně prováděná prevence nemá ovšem stoprocentní účinnost. Také výskyt atypických aloimunizací non-RhD-antigeny zůstává stále stejný, poněvadž u tohoto onemocnění není známá profylaxe. Fetální erytrocyty Rh-pozitivního plodu přestupují placentou během těhotenství, nejčastěji ovšem při porodu nebo potratu. Malé množství těchto krevních elementů je postačující k primární produkci protilátek v mateřském oběhu RhD-negativní ženy. V další graviditě, je-li plod RhD-pozitivní, pak sekundární silnou imunitní reakcí vzniklé anti-D-protilátky (IgG) přestupují placentou a komplex antigen-protilátka způsobuje hemolýzu fetálních erytrocytů. Výsledkem je hemolytická nemoc plodu a novorozence. Vzhledem k celkově nízké perinatální mortalitě a morbiditě relativně vzrůstá význam těžkých stupňů onemocnění vedoucích bez léčby k povšechnému hydropsu plodu s velice špatnými perinatálními výsledky. Lehčí formy onemocnění jsou bez problémů zvládnuty neonatology fototerapií nebo výměnnou transfuzí po porodu. Problémem zůstává identifikace, sledování a léčba plodů středně anemických bez hydropsu a dále řešení rychle a velmi časně (před 20. týdnem) probíhajících aloimunizací s agresivní protilátkou. Erytrocytární aloimunizace ohrožuje plod těžkou prenatální hemolýzou – anémií (povšechným hydropsem) a později významnou bilirubinemií po porodu (poškození CNS novorozence – jádrový ikterus).
Sledování senzibilizovaného těhotenství
Detekce a měření mateřských protilátek
Plod je ohrožen anémií, pokud je u matky pozitivní nepřímý antiglobulinový (Coombsův) test pro jednu nebo několik protilátek asociovaných s hemolytickým onemocněním plodu a novorozence (HON). Sekundární imunitní reakce s mohutnou produkcí IgG-protilátek procházejících přes placentu ohrožuje plod hemolýzou a těžkou anémií. Nejvýznamnější anti-D-protilátky mohou být měřeny a po porovnání se standardem jejich množství vyjádřeno v mezinárodních jednotkách v mililitru (IU/ml). Kritické hladiny jsou stanoveny dle zvyklostí perinatologických center obvykle na 4 IU/ml a titr 1/16. Při hodnotách vyšších, než jsou tyto uvedené, se obvykle provádí neinvazivní DNA-analýza RhD-statusu plodu z periferní krve matky nebo později invazivní diagnostika pomocí kordocentézy. Těmto invazivním postupům stanovení v současnosti vždy předchází neinvazivní měření maximální rychlosti toku v arteria cerebri media (PSV MCA). Sledování dynamiky titru protilátek se provádí obvykle ve 2 až 4týdenních intervalech. Samotný titr protilátky neinformuje dostatečně o jejím hemolytickém potenciálu. Ten závisí na těchto parametrech:
- specifitě, koncentraci, aviditě a IgG-podtřídě protilátky
- síle exprese cílového antigenu na krvinkách plodu
- gestačním stáří plodu v období, v němž hladina protilátek dosáhne kritických hodnot
- (ne)přítomnosti „blokujících“ protilátek v séru matky
- schopnosti retikuloendotelového systému destruovat senzibilizované erytrocyty
Zjišťování fetálních antigenů
Pokud je u matky zjištěna přítomnost klinicky významné protilátky, je vhodné exaktně vyšetřit krevní skupinu plodu. V dnešní době se využívají metody molekulárně biologické. RhD-status plodu lze zjistit neinvazivně vyšetřením volné DNA z periferní krve matky. Ve velkých perinatologických centrech toto vyšetření téměř vytlačilo invazivní postupy. Kordocentéza se dnes vždy provádí současně s následnou intraumbilikální transfuzí v situaci předpokládané střední nebo těžké anémie plodu. Asi v 0,6 % případů není exprese RhD-pozitivity zcela jasně vyjádřena. Jedná se o tzv. D-varianty. V praxi to znamená, že např. matka může být laboratorně označena za RhD-pozitivní, ale přesto může být senzibilizována, a tvořit protilátky proti RhD-pozitivním erytrocytům plodu. Vzácně potom může vzniknout hemolytická nemoc plodu i závažného stupně. Z ostatních antigenů Rh krevní skupiny mají největší význam antigeny C,c a E. Zvláště varianta Cw je odpovědná za největší počet non-D Rh-izoimunizací [2].
Schéma. Znázornění moderních diagnostických postupů při RhD-aloimunizaci 
Krevní skupina systému AB0
Inkompatibilita v systému AB0 je přítomna přibližně ve 30 % všech gravidit. Tato inkompatibilita může částečně chránit RhD-negativní matku před senzibilizací RhD-pozitivními erytrocyty plodu. Z našich sledování vyplývá, že těžké RhD-senzibilizace v průběhu první gravidity u primigravid byly vždy v situaci, v níž těhotná nosila plod s ní AB0-kompatibilní. Ochranný efekt platí pro inkompatibilitu D-antigenu, a nikoli nonRh-antigenů, u níž k senzibilizaci dochází nejčastěji transfuzí inkompatibilní krve (typické pro skupinu Kell).
Imunoprofylaxe RhD-aloimunizace
Zavedení profylaxe anti-D-imunoglobulinem dramaticky snížilo výskyt erytrocytární aloimunizace [3].
Indikace v 1. trimestru
- operační umělé ukončení těhotenství (od 44. dne po PM)
- spontánní potrat s instrumentální revizí dutiny děložní (od 44. dne po PM)
- operace mimoděložního těhotenství
- biopsie choria
- evakuace molární gravidity
- fetální redukce vícečetné gravidity
Indikace v průběhu 2. a 3. trimestru
- amniocentéza, kordocentéza
- jiné invazivní metody prenatální diagnostiky a fetální terapie
- indukovaný abort
- intrauterinní úmrtí plodu
- zevní obrat plodu z konce pánevního
- břišní trauma
- porodnické krvácení při předčasném odlučování placenty
- prokázané fetomaternální krvácení (FMH), fetomaternální transfuze (FMT)
Před 20. týdnem gravidity je doporučeno podat minimálně 50 µg (250 IU) IgG anti-D. Po 20. týdnu je minimální dávka 100 µg (500 IU) IgG anti-D.
Plošně je v současnosti doporučeno aplikovat IgG anti-D všem RhD-negativním ženám ve 28. týdnu těhotenství, a to v dávce 250 µg. A dále po porodu RhD-pozitivního plodu v dávce 100 µg IgG anti-D. Aplikace je nutná do 72 hodin po události, ale má smysl i později při opomenutí (až do 28 dní). Při krvácení (odlučování placenty, fetomaternální krvácení, manuální lýza placenty) nebo odumření plodu ve 3. trimestru je vhodné upřesnit a eventuálně navýšit dávku v závislosti na objemu fetálních erytrocytů proniklých do oběhu matky (dnes obvykle kvantifikací fetomaternální hemoragie průtokovou cytometrií). Je indikováno podání IgG anti-D-imunoglobulinu intramuskulárně v dávce 10 µg na 0,5 ml fetálních erytrocytů nebo 1ml plné fetální krve.
Rizika a kontroverze imunoprofylaxe
Vážnější mateřské komplikace při podávání anti-D-imunoglobulinu v prenatálním i postnatálním období nejsou popsány. Potencionálním rizikem pro plod je možnost vyvolání fetální hemolytické anémie podobným mechanizmem jako u senzibilizované pacientky. Imunoglobulin prochází fetoplacentární bariérou a po navázání na membrány erytrocytů je může destruovat. V praxi je většinou terapeutická dávka imunoglobulinu nízká vzhledem k počtu erytrocytů plodu a riziko iatrogenního poškození je nízké. Vzácně může nastat situace, při níž je potřeba pokrýt anti-D-imunoglobulinem masivní fetomaternální krvácení, a vysoká dávka imunoglobulinu potom může potencovat preexistující fetální anémii.
Kontraindikací profylaxe je pouze prokázaná hypersenzitivita na anti-D-imunoglobulin.
Bezpečnost dále zvyšuje jeho moderní výroba pomocí rekombinantní technologie. Senzibilizací již v průběhu prvního těhotenství jsou významně více ohroženy těhotné s AB0-kompatibilním plodem. Při pochybnosti, zda podat, nebo nepodat imunoprofylaxi, je vhodné profylaxi provést. Úskalím plošně aplikované imunoprofylaxe ve 28. týdnu dosud neimunizované gravidity může být „zbytečné“ a potenciálně rizikové podání těhotné s RhD-negativním plodem. Pokud je otec jistý a RhD-negativní nebo známe RhD-status plodu z analýzy DNA, pak není imunoprofylaxe v průběhu gravidity indikována. Pokud již byla imunoprofylaxe ve 28. týdnu aplikována, pak obvykle perzistuje slabá nepravidelná protilátka až do konce těhotenství. Tato slabá pozitivita je obvykle detekována při 3. standardním závěrečném odběru protilátek ve 35.–36. týdnu těhotenství. Tyto těhotné jsou někdy konzultovány na specializovaných pracovištích fetální medicíny a zbytečně dále sledovány, vyšetřovány a iatrogenně stresovány. Naproti tomu plošné zavedení imunoprofylaxe ve 28. týdnu vedlo v USA k dalšímu snížení senzibilizovaných těhotných z 1,8 % na 0,1 % [4]. Největší váhu/sílu doporučení (ověřeno randomizovanými studiemi) má provádění profylaxe klasicky po porodu RhD-pozitivního plodu a rutinní profylaxe ve 28. týdnu gravidity (s výjimkami viz výše). Diskutuje se ekonomická zátěž a přínos dalšího rozšíření imunoprofylaxe. Těžkých případů erytrocytární aloimunizace s nutností intrauterinní léčby se vyskytuje v ČR pouze přibližně 30 ročně.
Diagnostika fetální anémie
V současnosti jsou využívány 3 základní postupy a jejich kombinace [5]. Nejméně invazivní je opakované ultrasonografické vyšetření s využitím dopplerovských metod (měření maximální rychlosti/peak systolic velocity/arteria cerebri media – PSV MCA, obr. 1 a obr. 2) a zjišťováním eventuálních časných známek hydropsu. Princip metody spočívá v nižší viskozitě krve plodu při anémii a kompenzatorně větším srdečním výdeji. Toto vše způsobuje urychlení toku v MCA. Toto měření je považováno za dobrý marker fetální anémie s téměř 100% senzitivitou a nízkou falešnou pozitivitou. Při rychlosti toku nad 1,5 MOM je obvykle indikována kordocentéza spolu s následnou intraumbilikální transfuzí při jednom výkonu. Někdy může na těžkou anémii plodu upozornit kardiotokogram (CTG – cardiotocography) s typicky sinusoidálním záznamem při absenci pohybů plodu (obr. 3). Taková překvapivá subakutní anémie plodu bývá způsobena závažnou fetomaternální hemoragií a transfuzí (FMH a FMT). Tato subklinická transplacentární hemoragie je nejčastějším zdrojem a příčinou imunizace.
Obr. 1. Praktické provádění měření PSV MCA 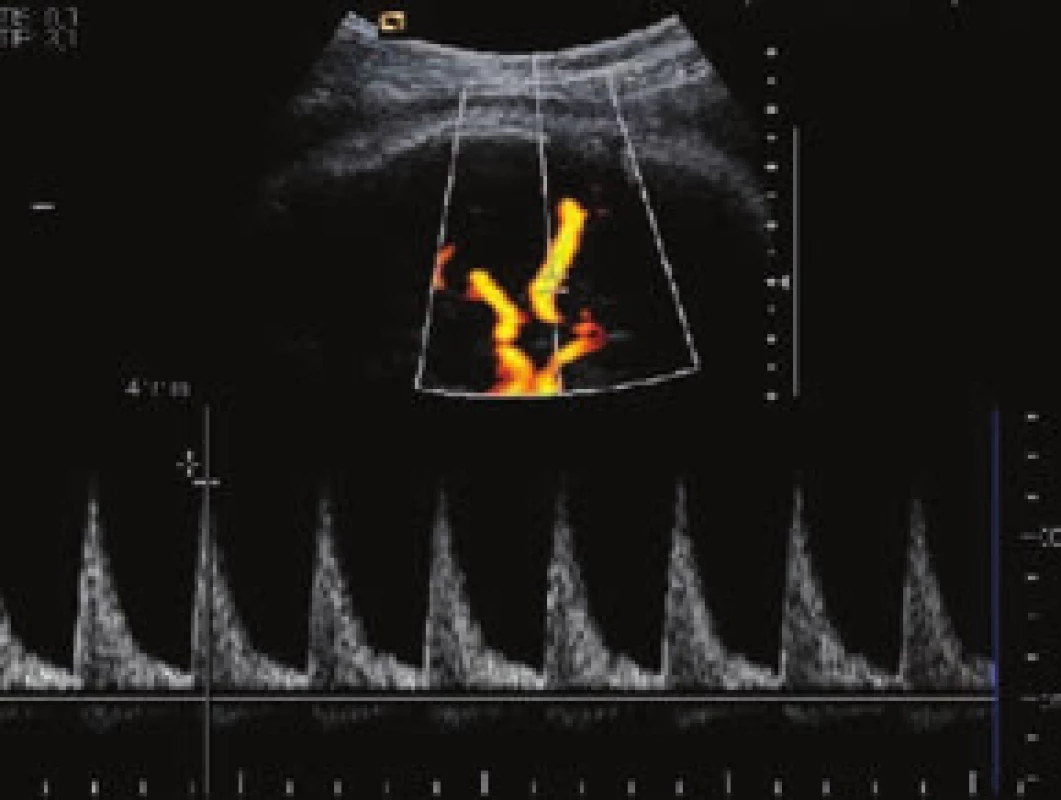
Obr. 2. Dopplerovské sledování senzibilizovaného těhotenství v porodnické databázi ASTRAIA. Upraveno podle [6]. ![Dopplerovské sledování senzibilizovaného těhotenství v porodnické databázi ASTRAIA. Upraveno podle [6].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/066846d2bfe8e1cff0452f134e3c0571.jpg)
Obr. 3. Typický kardiotokografický (CTG) záznam těžce anemického plodu ve 3. trimestru 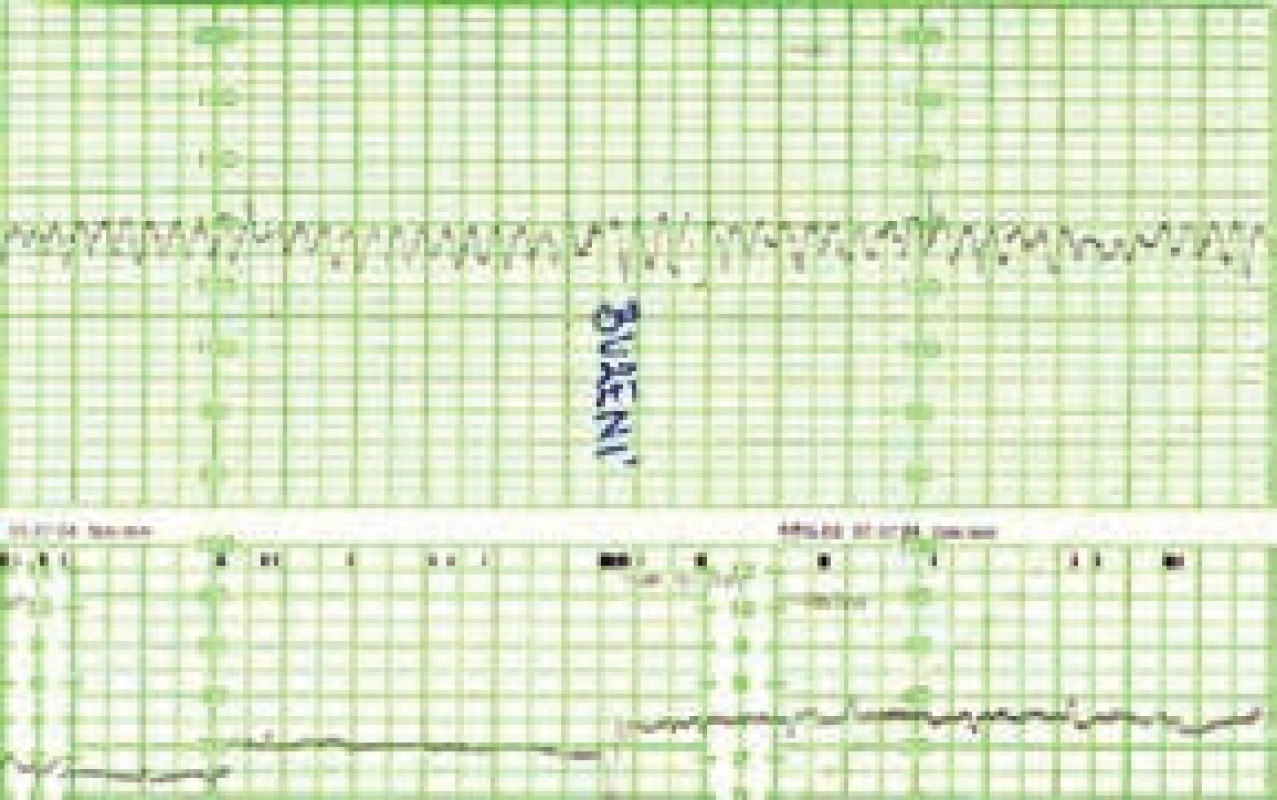
Optimální je snižovat invazivitu léčebného procesu pozdějším prováděním první kordocentézy vždy spolu s první intraumbilikální transfuzí a zvětšením intervalů mezi opakovanými diagnostickými a léčebnými zákroky. Po 34. týdnu těhotenství je vhodné neohrožovat plod invazivními zákroky a těhotenství sledovat neinvazivně až do porodu.
Léčba anemického plodu
Intrauterinní intraumbilikální transfuze
První úspěšná antenatální léčba hemolytické nemoci novorozence se zdařila v roce 1963. V tomto roce Liley publikoval techniku intraperitoneální transfuze. V roce 1982 se dánské skupině (Bang) podařilo aplikovat intraumbilikálně transfuzi (IUT) za ultrasonografické asistence. V současnosti se aplikuje převážně transfuze doplňovací. V českých perinatologických centrech se používají pro transfuzi erytrocytové transfuzní přípravky s Hct 0,80–0,85 a doplňuje se na Hct plodu 0,40–0,45. Preventivní podávání antibiotik matce se nedoporučuje, ale je vhodné při každé intrauterinní intervenci odebrat plodovou vodu k mikrobiologickému vyšetření.
Indikace k fetální terapii
- PSV MCA > 1,5 MOM = významná fetální anémie + event. CTG-známky fetální anémie ve 3. trimestru
- ultrasonografické známky ascitu (s povšechným hydropsem nebo bez)
Hlavní změny v organizmu plodu po začátku transfuzní léčby
- zvýšení intravaskulárního objemu
- zvýšení viskozity krve
- zvýšení umbilikálního venózního tlaku
- snížení srdečního výdeje (přibližně o 25 %)
- generalizovaná fetoplacentární vazodilatace
- přechodná acidóza
- zvýšený uteroplacentární průtok
- suprese hematopoezy
Komplikace intraumbilikální transfuze
Velice častou komplikací bývá přechodná těžká bradykardie plodu na začátku výkonu, která se obvykle spontánně upravuje. Někdy může dojít k akutní srdeční zástavě plodu, která vyžaduje, aby byl proveden pokus o resuscitaci plodu in utero.
Komplikacím při syndromu dolní duté žíly se předchází polohováním pacientky před začátkem výkonu. V literatuře jsou popsány případy trombózy umbilikální vény nebo akutní tamponády pupečníku po paravazálním podání a také embolizace trombu do oběhu plodu. K embolizaci do mozku plodu může dojít cestou foramen ovale a ductus arteriosus. Podávání vysoce koncentrované erymasy vyžaduje exaktní intraumbilikální intravenózní přístup za přísných aseptických kautel. Prokázali jsme, že těžké bradykardie a hypoxie plodu jsou téměř vždy způsobeny nechtěným intraarteriálním podáním koncentrované erymasy! Následný spazmus umbilikální arterie a celková reakce plodu vede někdy k fatálnímu hypoxickému poškození plodu nebo jeho úmrtí in utero. Těžká fulminantně probíhající chorioamniitis vyvolaná nozokomiálními kmeny může mít fatální důsledky pro plod a potažmo i pro matku. Léčba hydropického plodu s trombocytopenií je ohrožena vyšším rizikem krvácení po výkonu. Při uložení placenty na přední stěně je riziko krvácení vyšší (15–20%) oproti uložení placenty na zadní stěně (7–10%). Poranění placenty během výkonu může výjimečně vést až k akutní abrupci. Významná fetomaternální transfuze během diagnostické amniocentézy, kordocentézy nebo samotné IUT může způsobit dramatické zvýšení tvorby protilátek a rychlé prohloubení anémie plodu. Existuje též potenciální riziko iatrogenní vzduchové embolizace plodu.
Nejčastější závažné komplikace provázející léčbu intraumbilikální transfuzí
- těžká bradykardie plodu v průběhu výkonu
- akutní zástava srdce plodu během výkonu
- tamponáda pupečníku
- trombóza pupečníku
- tromboembolie plodu a novorozence
- protrahované krvácení z pupečníku – exsangvinace plodu
- chorioamniitis – předčasný porod
- vzduchová embolie
Poslední transfuze a ukončení těhotenství
Pro plánování možného předčasného ukončení těhotenství je nutno počítat s vyšší nezralostí novorozence (RDS – neonatal respiratory distress syndrome/novorozenecký syndrom respirační tísně), poporodní protrahovanou anemizací, hyperbilirubinemií, leukopenií a koagulopatií. Přetrvávající dřeňový útlum pro perzistující protilátky a prenatální poškození dřeně vyžaduje někdy dlouhodobou doplňovací transfuzní léčbu novorozence. V případech, v nichž to průběh Rh-aloimunizace a výsledky léčby dovolí, je snaha prodloužit těhotenství až do doby, kdy plod není ohrožen prematuritou. Poslední transfuze se provádí nejpozději v běžném 35. týdnu těhotenství a rodí se obvykle mezi 37. a 38. týdnem nejčastěji operativně císařským řezem. Platí, že resuscitace těžce anemického hydropického plodu je účinnější in utero, než jeho léčba po urgentním předčasném porodu.
Obr. 4. CTG-záznam hydropického plodu před a po transfuzní léčbě 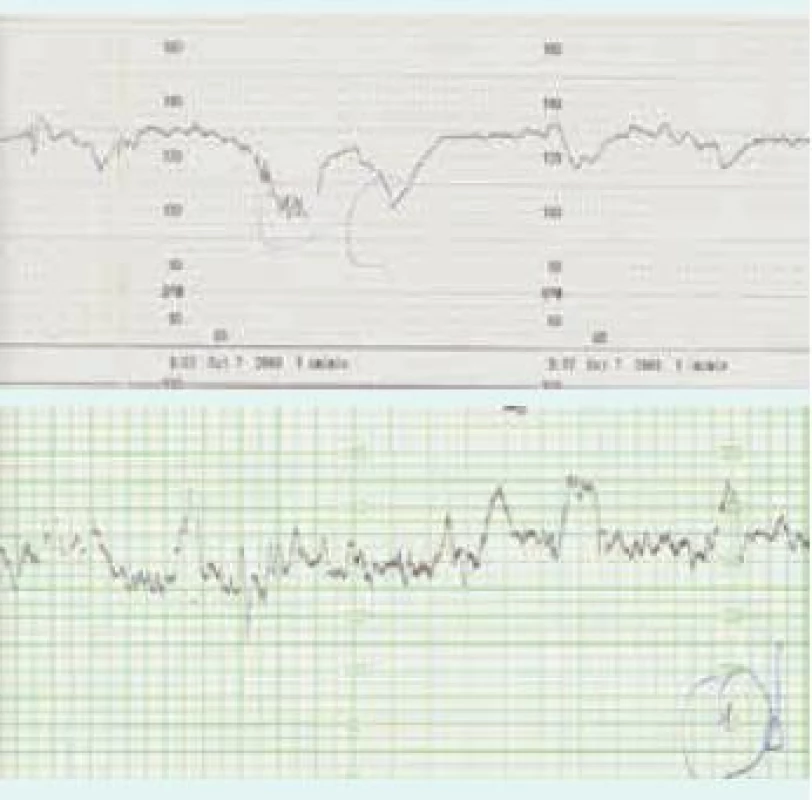
Obr. 5. USG-obraz břicha plodu s ascitem před léčbou a po léčbě 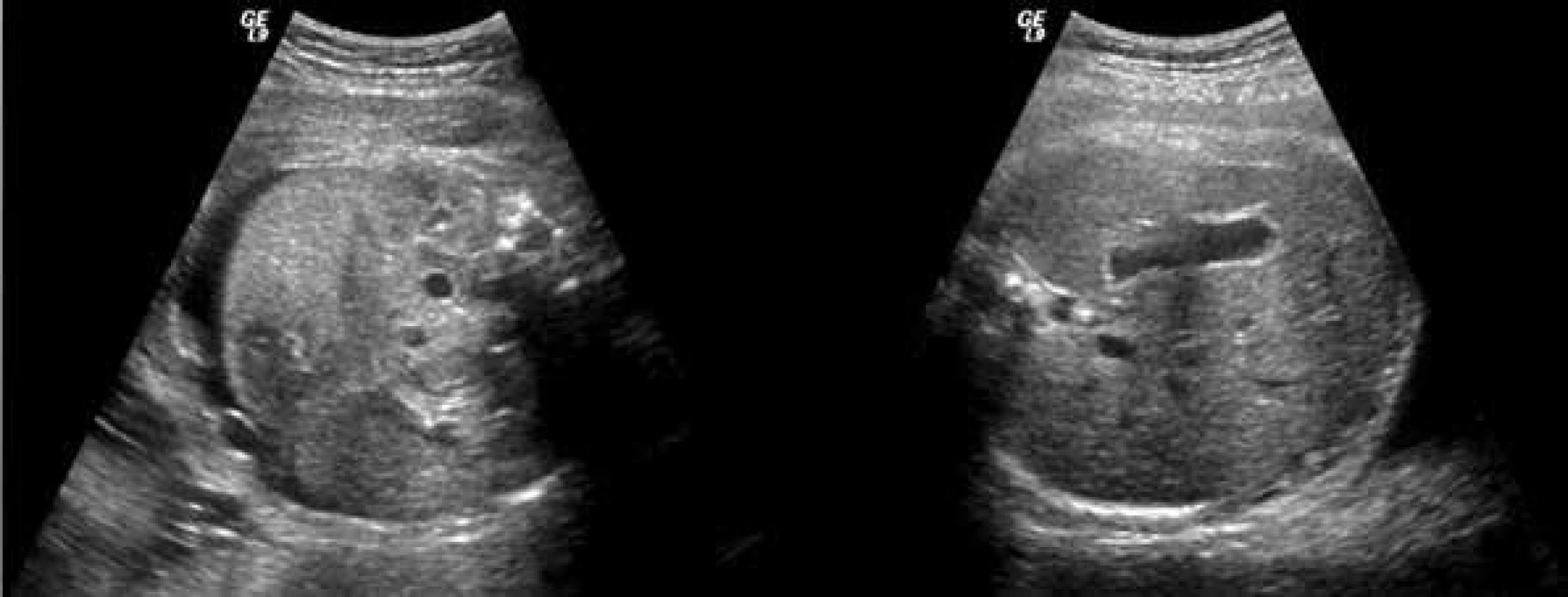
Poporodní neonatologická péče
Stav novorozence a jeho postnatální adaptace závisí také na gestačním stáří. Novorozenec je více ohrožen nezralostí (opožděné vyzrávání plic, intrakraniální krvácení, infekční komplikace při leukopenii) než srovnatelně starý novorozenec z neimunizovaného těhotenství. IUT snižuje vystupňovanou tvorbu fetálních erytrocytů úpravou anémie (hodnoty erytropoetinu rostou při poklesu Hb pod 60 g/l), a tím nepřímo snižuje hemolýzu erytrocytů. Po opakovaných IUT mívá novorozenec jen mírnou až střední anémii, ikterus lze často zvládnout fototerapií bez výměnné transfuze. V dalších týdnech po porodu přetrvává a prohlubuje se anémie, která je charakteristická nepřítomností, nebo velice nízkou hodnotou retikulocytů a relativně nízkou hladinou erytropoetinu vzhledem ke stupni anémie. Léčba pozdní anémie spočívá v opakovaných převodech resuspendovaného, ozářeného a filtrovaného erytrocytového transfuzního přípravku. Naprostá většina vyléčených hydropických plodů, které přežívají, má normální postnatální neurologický vývoj.
Závěr
Erytrocytární aloimunizace je dnes onemocnění se sporadickým výskytem díky úspěšné a všeobecně prováděné imunoprofylaxi anti-D-imunoglobulinem. Tuto imunoprofylaxi ovšem nelze nikdy přerušit nebo ji opustit. Při jejím neprovedení nebo selhání hrozí hemolytické onemocnění plodu a novorozence. Každý případ je potom unikátní (specifita a typ protilátky, blokující protilátky v séru matky, antigenní výbava erytrocytů plodu, gestační stáří při začátku onemocnění atd).
Pokroky v genové diagnostice, imunohematologii a dopplerovské ultrasonografii významně snižují frekvenci nutných invazivních zákroků v diagnostice a léčbě senzibilizovaného těhotenství. Intraumbilikální přísně intravenózní transfuze pod ultrasonografickou kontrolou je první metodou volby léčby případů s těžkou anémií plodu i v situaci rozvinutého hydropsu. Konzultace a léčba imunizovaných těhotných se koncentruje do center s perfektní porodnickou a neonatologickou péčí a nepřetržitou operační pohotovostí.
Doručeno do redakce dne 5. 7. 2014
Přijato po recenzi dne 20. 8. 2014
MUDr. Zdeněk Žižka, CSc.
zdenek.zizka@lf1.cuni.cz
Gynekologicko-porodnická klinika 1. LF UK a VFN, Praha
www.vfn.cz
Zdroje
1. Hájek Z et al. Rizikové a patologické těhotenství. Grada Publishing: Praha 2004. ISBN 978–80–247–7922–5.
2. Manning FA. Fetal medicine: principles and practice. Appleton & Lange: Norwalk (Conn) 1995. ISBN 978–08–385–2572–2.
3. Lubušký M et al. Doporučení k provádění prevence RhD aloimunizace u Rh negativních žen. Česka Gynekol 2013; 78(2): 132–133.
4. Bowman JM, Chown B, Lewis M et al. Rh isoimmunization during pregnancy: antenatal prophylaxis. Can Med Assos J 1978; 118(6): 623–627.
5. Calda P et al. Ultrazvuková diagnostika v těhotenství a gynekologii. Aprofema: Praha 2010. ISBN 978–80–903706–2-3.
6. Mari G, Deter RL, Carpenter RL et al. Noninvasive diagnosis by Doppler ultrasonography of fetal anemia due to maternal red-cell alloimmunization. Collaborative Group for Doppler Assessment of the Blood Velocity in Anemic Fetuses. N Engl J Med. 2000; 342(1): 9–14.
Štítky
Detská gynekológia Gynekológia a pôrodníctvo Reprodukčná medicína
Článek EditorialČlánek EMAS HRT Excellence Day
Článok vyšiel v časopisePraktická gynekologie
Najčítanejšie tento týždeň
2014 Číslo 3- Ne každé mimoděložní těhotenství musí končit salpingektomií
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Mýty a fakta ohledně doporučení v těhotenství
- Gynekologické potíže pomáhá účinně zvládat benzydamin
-
Všetky články tohto čísla
- Editorial
- Rozhovor s doc. MUDr. Pavlem Strnadem, CSc., předsedou senologické sekce ČGPS ČLS JEP, o roli a úkolech senologie v Česku a o jeho nejnovější publikaci Nemoci prsu v každodenní praxi
- Vulvovaginitis v dětském věku
- Přínosy norgestimátu v kombinované hormonální antikoncepci
- Specifika diabetes mellitus u žen
- Syndrom polycystických ovarií a diabetes mellitus
- Biologická terapie u pacientek s idiopatickými střevními záněty v graviditě
- Psychologie je servisní obor – slouží tam, kde je potřeba
- Imunoprofylaxe RhD erytrocytární aloimunizace
- Využití terapeutických materiálů při hojení ran v gynekologii
- Využití terapeutických materiálů při hojení ran v gynekologii
- Jestli jste si nevšimli, tak česká populace začíná vymírat
- EMAS HRT Excellence Day
- In memoriam profesora Evžena Čecha
- Jana Vrbíková, Michael Fanta, Dana Koryntová. Syndrom polycystických ovarií.
- Pavel Strnad. Nemoc prsu v každodenní praxi.
- Praktická gynekologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Vulvovaginitis v dětském věku
- Imunoprofylaxe RhD erytrocytární aloimunizace
- Syndrom polycystických ovarií a diabetes mellitus
- Přínosy norgestimátu v kombinované hormonální antikoncepci
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



