-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Doporučený postup České hepatologické společnosti a Společnosti infekčního lékařství České lékařské společnosti J. E. Purkyně Diagnostika a léčba chronické hepatitidy B
Autori: Koordinátoři:; Prof. MUDr. Petr Husa, CSc.; Klinika Infekčních Chorob Lf Mu; Fn Brno; fnbrno. Phusa@cz; MUDr. Stanislav Plíšek, Ph.D.; Infekční Klinika Fn Hradec Králové; lfhk.cuni. Pliseks@cz; MUDr. Jan Šperl, CSc.; Klinika Hepatogastroenterologie Ikem Praha; medicon. Jase@cz; prof. MUDr. Petr Urbánek, CSc.; Interní Klinika .lf Uk 1; Úvn; cesnet. Urbanek@cz; Další Autoři V Abecedním Pořadí:; MUDr. Jan Galský, Ph.D.; Infekční Oddělení Nemocnice Mělník; nspmelnik. Galsky@cz; Prof. MUDr. Petr Hůlek, CSc.; Interní Klinika Fn Hradec Králové; fnhk. Hulek@cz; MUDr. Petr Kümpel; Infekční Oddělení Slezské Nemocnice Opava; petr. nemocnice.opava. Kumpel@cz; RNDr. Vratislav Němeček, CSc.; Nrl Pro Virové Hepatitidy; Szú Praha; anet. Nemecek@cz; MUDr. Miroslava Volfová, CSc.; Soukromý Gastroenterolog; Hepatolog Hradec Králové; worldonline. Volfomir@cz
Vyšlo v časopise: Prakt. Lék. 2009; 89(4): 167-176
Kategória: Editorial
Preambule
Níže uvedená doporučení pro diagnostiku a terapii infekce virem hepatitidy B (HBV) byla vytvořena členy pracovních skupin pro virové hepatitidy České hepatologické společnosti (ČHS) České lékařské společnosti Jana Evangelisty Purkyně (ČLS JEP) a Společnosti infekčního lékařství (SIL) ČLS JEP.
Nová doporučení odrážejí obrovský nárůst poznatků, které byly publikovány od vydání předchozího doporučeného postupu ČHS a SIL v září 2007 (1, 2). Výsledky klinických studií jasně ukázaly, že je nutné změnit především doporučení týkající se léčby chronické infekce HBV nukleosidovými a nukleotidovými analogy. Základem pro napsání tohoto doporučeného postupu byla doporučení Evropské asociace pro studium jater (EASL) z roku 2009 (3). Maximální možné dodržování odborných doporučení je podmínkou dosažení efektivní péče o nemocné s virovou hepatitidou B v celostátním měřítku. Předkládaný dokument je oporou při jednání obou odborných společností se státními orgány a s plátci zdravotní péče.
1. Proč léčit chronickou infekci virem hepatitidy B?
Podle kvalifikovaných odhadů je celosvětově chronicky infikováno HBV asi 350 milionů lidí. Česká republika patří mezi státy s nízkou prevalencí infekce HBV. Podle posledních sérologických přehledů z roku 2001 je 0,56 % našich občanů chronicky infikováno HBV. Ročně je hlášeno 300–400 případů akutních virových hepatitid B. Do chronického stadia přejde méně než 5 % akutních hepatitid B u dospělých imunokompetentních pacientů. Imunokompromitovaní nemocní (pacienti v chronickém hemodialyzačním programu, pacienti podstupující protinádorovou či imunosupresivní léčbu, koinfikovaní virem lidského imunodeficitu – HIV) mají sníženou schopnost rozeznat a/nebo eliminovat infekci HBV, a proto u nich přechází infekce HBV do chronicity ve více než 50 %. Pravděpodobnost chronicity u novorozenců infikovaných HBV vertikálně od matky je vyšší než 90 %, při infikování dětí mladších 5 let je pravděpodobnost vzniku chronické infekce HBV 25–50 %.
Infekce novorozenců a malých dětí jsou v současné době v České republice naprosto výjimečné díky screeningu všech těhotných žen na přítomnost HBsAg a následné pasivní a aktivní imunizaci novorozenců HBsAg pozitivních matek. Navíc od roku 2001 je v naší republice prováděna plošná vakcinace dětí od 13. týdne věku a 12letých proti HBV.
Infekce HBV může vyvolat závažná, život ohrožující poškození jater – fulminantní hepatitidu, jaterní cirhózu a prokázaný je i příčinný vztah mezi HBV infekcí a hepatocelulárním karcinomem (HCC) – primární rakovinou jater. Jaterní cirhóza vyvolaná infekcí HBV patří mezi obecně uznávané indikace pro provedení transplantace jater.
V celosvětovém měřítku ročně umírá více než 1 milion osob na dekompenzovanou jaterní cirhózu a/nebo HCC, a tato konečná stadia infekce HBV reprezentují indikaci pro 5–10 % transplantací jater. Morbidita a mortalita spojená s chronickou infekcí HBV závisí na výši virové replikace a vývoji jaterní cirhózy nebo HCC.
Podle výsledků longitudinálních studií kolísá v době stanovení diagnózy chronické hepatitidy B pětiletá pravděpodobnost vzniku jaterní cirhózy mezi 8 % a 20 %. Pět let přežije 80–86 % původně kompenzovaných cirhotiků, ale u zhruba u 20 % cirhotiků dojde v tomto období k dekompenzaci cirhózy. Naproti tomu prognóza nemocných s dekompenzovanou jaterní cirhózou je špatná – pravděpodobnost pětiletého přežívání bez transplantace jater je pouze 14–35 %.
Celosvětově narůstá incidence HCC. V současnosti se jedná o pátý nejčastější karcinom, který představuje kolem 5 % všech karcinomů. Roční incidence vzniku HCC je u pacientů s cirhózou vzniklou na podkladě chronické infekce HBV mezi 2 % a 5 %.
V současnosti dostupné terapeutické možnosti mají jak krátkodobý, tak dlouhodobýpřínos. Léčba jednoznačně zvyšuje kvalitu života a je „cost effective“ tj. při splnění indikačních kriterií a při použití standardních postupů je terapie levnější, než léčba komplikací pokročilé jaterní cirhózy.
2. Přirozený průběh a klinický obraz HBV infekce
Infekce HBV je spojena s velmi heterogenním spektrem jaterních onemocnění:
I. Akutní hepatitida B
Většinou benigní onemocnění končící ve většině případů spontánním uzdravením, v 0,1–1 % případů probíhá onemocnění fulminantně s vysokou mortalitou.
II.Chronická hepatitida B
Infekce trvající déle než 6 měsíců. Jde o nesourodou skupinu nemocných, kterou lze rozdělit z hlediska přirozeného vývoje chronické HBV (respektive přítomnosti koinfekce jiným hepatotropním virem) infekce na následující podskupiny:
Fáze přirozeného vývoje chronické HBV infekce:
1. Fáze imunotolerance HBV
Přechodná fáze imunotolerance, trvající i roky, bývá v počáteční fází vývoje chronické hepatitidy B. Imunotolerance, trvající zpravidla 15–25 let, je typická pro nemocné, infikované vertikálně od matky. Pacienti ve fázi imunotolerance jsou charakterizování pozitivitou HBeAg, vysokou úrovní replikace HBV, jejíž odrazem je vysoká hladina HBV DNA v séru, normální nebo nízkou aktivitou ALT, mírnou nebo žádnou zánětlivě-nekrotickou aktivitou a žádnou nebo pomalou progresí jaterní fibrózy. Během této fáze je pravděpodobnost vzniku HBeAg/anti-HBe sérokonverze velmi nízká. Mechanismus poškození jater virem hepatitidy B je imunitně zprostředkovaný, replikace HBV sama nevede k destrukci hepatocytu. Vzhledem k vysoké virémii jsou pacienti během této fáze vysoce kontaginózní.
2. Chronická hepatitida B ve fázi replikační (imunoreaktivní), HBeAg pozitivní forma
Jedná se o HBsAg i HBeAg pozitivní pacienty s vysokou virémií (HBV DNA v séru > 20 000 IU/ml, což odpovídá přibližně 105 kopií/ml dle staršího způsobu vyjadřování virémie), aktivita ALT je obvykle zvýšena, často fluktuující, může však být i normální. V jaterní biopsii jsou prokazatelné středně nebo vysoce závažné zánětlivě-nekrotické změny a rychlejší progrese fibrózy. Tato fáze může vzniknout po několika letech trvání imunotolerance, je častější u osob infikovaných v dospělosti a může trvat od několika týdnů do několika let. Pravděpodobnost vzniku spontánní sérokonverze HBeAg/anti-HBe je ve srovnání s předchozí fází zvýšena.
(Pozn.: jedná se o infekci tzv. „wild“ typem HBV, tj. nemutovaným virem.)
3. Chronická hepatitida B, HBeAg negativní forma
Tato fáze může následovat HBeAg/anti-HBe sérokonverzi, ke které došlo během imunoreaktivní fáze chronické hepatitidy B a představují pozdní fázi přirozeného vývoje chronické hepatitidy B. Jedná se o HBsAg pozitivní, ale HBeAg negativní pacienty, s relativně vysokou virémií (HBV DNA v séru je většinou mezi 2 000–20 000 IU/ml, což odpovídá 104–105 kopií/ml), menší část nemocných má HBV DNA v séru > 20 000 IU/ml (105 kopií/ml). Aktivita ALT je obvykle alespoň intermitentně zvýšena, může však být i trvale normální. Typické je fluktuování hladiny HBV DNA a aktivity ALT. V jaterní biopsii jsou často prokazatelné středně nebo vysoce závažné zánětlivě-nekrotické změny. Pacienti jsou ve vysokém riziku progrese jaterního procesu do pokročilé fibrózy, jaterní cirhózy a HCC.
Pozn.: negativita HBeAg je podmíněna mutací v tzv. pre-core nebo v basal core promotor (BCP) oblasti genomu viru).
4. Chronická hepatitida B ve fázi nízké replikace, tzv. inaktivní nosiči HBsAg
HBsAg pozitivní a HBeAg negativní pacienti s velmi nízkou (< 2 000 IU/ml, tj. 104 kopií/ml) nebo nedetekovatelnou hladinou HBV DNA v séru a s normální aktivitou ALT. V jaterní biopsii nelze prokázat významné zánětlivé změny. Tento stav svědčí pro imunologickou kontrolu HBV infekce a má dobrou prognózu s velmi nízkým rizikem vzniku jaterní cirhózy nebo HCC u většiny pacientů. K sérokonverzi HBsAg/anti-HBs dochází spontánně u 1 až 3 % případů, obvykle po několika letech trvale nedetekovatelné HBV DNA v séru.
5. HBsAg negativní fáze infekce HBV
Po ztrátě HBsAg může replikace HBV na nízké úrovni perzistovat. HBsAg je negativní, celkové anti-HBc protilátky jsou pozitivní, anti-HBs protilátky mohou být detekovatelné, ale nemusí. Perzistence HBV v organismu i po dosažení HBsAg negativity je trvalá, u některých HBsAg negativních jedinců s izolovanou pozitivitou anti-HBc lze prokázat nízkou úroveň virémie (HBV DNA v rozmezí 2–20 IU/ml, tedy 101–102 kopií/ml), u jiných nelze HBV DNA v séru prokázat ani nejcitlivější polymerázovou řetězovou reakcí (PCR) v reálném čase. I u nich však lze většinou prokázat nízkou koncentraci HBV DNA v jaterní tkání. Klinický význam této „okultní“ infekce HBV je nejasný, ale imunosuprese může vést k reaktivaci infekce HBV. Ztráta HBsAg je spojena se snížením rizika vzniku jaterní cirhózy a její dekompenzace a vývoje HCC.
3. Diagnostika infekce HBV
Přehled sérologických a molekulárně genetických nálezů u infekce HBV a jejich význam je uveden v tabulce 1.
Tab. 1. Typické sérologické a molekulárně genetické nálezy jednotlivých stadií přirozeného vývoje infekce HBV 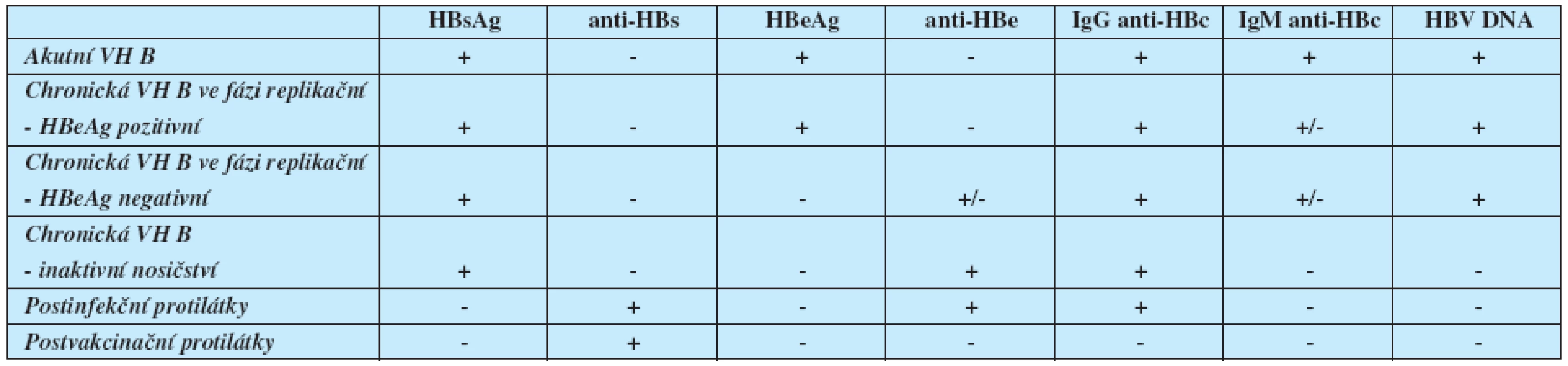
Pozn.: Uvedené nálezy představují nejčastější a nejjednodušší možné varianty. V případech různých mutací virového genomu se mohou sérologické nálezy významně lišit. Při nejasnostech je proto vhodné konzultovat specializované pracoviště. Jako klinicky významná úroveň replikace HBV se uvádí hladina > 20 000 IU/ml (105 kopií/ml) u HBeAg pozitivní chronické hepatitidy B. U HBeAg negativní chronické hepatitidy B se jako významná bere většinou hladina HBV DNA v séru > 2 000 IU/ml (104 kopií/ml), s přihlédnutím k aktivitě ALT, histologickému nálezu, věku a přítomnosti rizikových faktorů HCC. K průkazu HBV DNA v séru se používá vysoce senzitivní PCR v reálném čase. Výsledky získané touto metodou jsou udávány v mezinárodních jednotkách na mililitr (IU/ml). Dolní detekční limit této metody je 10–15 IU/ml. Hladinu HBV DNA vyjádřenou v IU/ml lze orientačně přepočítat na kopie na mililitr pomocí vzorce:
HBV DNA (IU/ml) × 5 = HBV DNA (kopie/ml).
Indikace kvantitativního stanovení HBV DNA v séru metodou PCR v reálném čase jsou uvedeny v kapitole 16.
4. Cíle léčby chronické infekce virem hepatitidy B
Cílem léčby je prodloužit délku života a zlepšit jeho kvalitu prostřednictvím zábrany progrese chronické hepatitidy do jaterní cirhózy, dekompenzace cirhózy a vzniku HCC. Předpokladem pro dosažení tohoto cíle je trvalá suprese virové replikace spojená s redukcí histologické aktivity, což snižuje riziko vzniku cirhózy a HCC u pacientů bez jaterní cirhózy, a pravděpodobně i u cirhotiků, i když na nižší úrovni. Infekce HBV nemůže být trvale eradikována vzhledem k perzistenci kovalentně vázané cirkulární deoxyribonukleové kyseliny (cccDNA) viru v jádrech infikovaných hepatocytů.
5. Výsledky úspěšné léčby chronické infekce HBV
Léčba musí redukovat hladinu HBV DNA v séru na co nejnižší úroveň, ideálně pod dolní limit citlivosti PCR v reálném čase (10–15 IU/ml). Ideální výsledek léčby představuje dosažení setrvalého vymizení HBsAg s/bez sérokonverze do anti-HBs. U HBeAg pozitivních pacientů se za uspokojivý výsledek léčby považuje dosažení trvalé sérokonverze HBeAg/anti-HBe. Pokud se léčbou nepodaří dosáhnout sérokonverze HBeAg/anti-HBe, považuje se během léčby nukleosidovými či nukleotidovými analogy za úspěch pokles hladiny HBV DNA v séru pod hranici detekovatelnosti metodou PCR v reálném čase nebo po skončení léčby IFN alfa (pegylovaným či konvenčním) setrvalý pokles HBV DNA v séru pod hranici detekovatelnosti. Dosažení těchto cílů je i známkou úspěšné léčby i u pacientů s HBeAg negativní chronickou hepatitidou B.
6. Obecné indikace k léčbě chronické hepatitidy B
Pro HBeAg pozitivní i HBeAg negativní formu chronické hepatitidy jsou obecně platné stejné indikace. O léčbě by mělo být uvažováno, pokud je hladina HBV DNA v séru > 2 000 IU/ml a/nebo ALT > horní hranice normy (upper limit of normal – ULN) a výsledek jaterní biopsie ukazuje na střední až těžký zánětlivě-nekrotický proces a/nebo fibrózu při použití standardního skórovacího systému (např. aktivita ≥ A2 nebo fibróza ≥ F2 dle systému METAVIR). Při rozhodování o léčbě je nutné vzít do úvahy věk, zdravotní stav a aktuální dostupnost vhodných léků.
7. Indikace k léčbě chronické hepatitidy B u zvláštních skupin pacientů
7.1. Pacienti v imunotolerantní fázi infekce HBV
Většina pacientů v imunotolerantní fázi infekce HBV je < 30 let věku, mají perzistentně normální ALT, vysokou hladinu HBV DNA v séru (obvykle > 107 IU/ml), jsou bez projevů jaterního onemocnění, bez rodinné anamnézy jaterní cirhózy či HCC. U těchto pacientů není nutné okamžitě provést jaterní biopsii ani je začít léčit. Jejich pravidelné a dlouhodobé sledování je však nezbytné.
7.2. Pacienti s mírnou chronickou hepatitidou B
Za takové pacienty se považují osoby s mírnou elevací ALT (< 2 × ULN) a mírnými histologickými změnami (< A2, F2 – METAVIR). Tito nemusí být léčeni, ale jejich sledování je nutné.
7.3. Pacienti s kompenzovanou jaterní cirhózou
Pokud lze u nich detekovat HBV DNA v séru metodou PCR v reálném čase, mají být léčení, i když je ALT normální a/nebo HBV DNA < 2 000 IU/ml.
7.4. Pacienti s dekompenzovanou jaterní cirhózou
Tito nemocní s pokročilým jaterním onemocněním vyžadují antivirovou léčbu, protože suprese virové replikace může u nich vést ke klinickému zlepšení. U velmi pokročilé jaterní cirhózy nemusí být léčba úspěšná a je nutná transplantace jater.
8. Léky pro léčbu chronické infekce HBV
Pro léčbu chronické infekce HBV lze obecně použít následující léky:
- pegylovaný interferon alfa-2a (PEG-IFN),
- interferon alfa (IFN), tzv. konvenční, klasický nebo standardní,
- lamivudin (LAM),
- adefovir dipivoxil (ADV),
- entecavir (ETV),
- tenofovir (TDV),
- tenofovir a emtricitabin v kombinaci (lék Truvada),
- telbivudin (TBV).
Pegylovaný IFN alfa-2a se podává v dávce 180 μg jednou týdně podkožně. Doba léčby je 48 týdnů u pacientů HBeAg pozitivních i negativních. Je nejúčinnějším lékem ve smyslu dosahování sérokonverzí HBeAg/anti-HBe, HBsAg/anti-HBs či setrvalých virologických odpovědí (u HBeAg negativní formy).
Doporučená dávka konvenčního IFN alfa je 5–10 milionů mezinárodních jednotek (IU) třikrát týdně subkutánně po dobu 4–6 měsíců, nebo denně po dobu 4 měsíců u HBeAg pozitivních nemocných. U infekce HBeAg-mínus mutantním virem je doporučována delší doba léčby, zpravidla 12 měsíců.
Dobu léčby analogy nukleosidovými (LAM, ETV, TBV) u nukleotidovými (ADV, TDV) nelze předem stanovit a řídí se pravidly uvedenými v kapitole 11. Pro zjednodušení se v dalším textu používá pro nukleosidová i nukleotidová analoga zkratka NA.
Při léčbě lamivudinem u dospělých, s kreatininovou clearancí > 50 ml/min, se denně podává 100 mg přípravku v jedné dávce. Léčba LAM je často provázena vznikem mutant HBV, které jsou na LAM částečně nebo úplně rezistentní. Frekvence výskytu těchto rezistentních mutant HBV s délkou léčby narůstá (24 % po 1 roce léčby, 38 % po 2 letech, 49 % po 3 letech, 67 % po 4 letech a 70 % po 5 letech léčby). Vzhledem k vysoké frekvenci vzniku rezistentních mutant HBV nemá být léčba naivních pacientů zahajována LAM. LAM v monoterapii je určen k profylaxi rekurence a reaktivace hepatitidy B u imunosuprimovaných pacientů a indikován i pro léčbu akutní hepatitidy B s těžkým průběhem. LAM může být v léčbě chronické hepatitidy B použit v kombinaci s jinými NA nejčastěji s ADV.
Doporučená dávka adefoviru dipivoxilu je 10 mg denně. Obecně není v současnosti ADV doporučován pro léčbu dosud neléčených (naivních) pacientů, protože je dražší než TDV, méně účinný, a léčba ADV je provázena vznikem mutant HBV, které jsou na ADV částečně nebo úplně rezistentní. Frekvence výskytu těchto rezistentních mutant HBV s délkou léčby narůstá (0 % po 1 roce léčby, 3 % po 2 letech, 11 % po 3 letech, 18 % po 4 letech a 29 % po 5 letech léčby).
Entecavir je účinným inhibitorem replikace HBV a má vysokou genetickou bariéru pro vznik rezistence. Dle výsledků klinických studií je účinnější než LAM nebo ADV. Je účinný i na mutanty viru rezistentní na LAM, i když méně než na divoký (wild) typ viru. Podává se jednou denně perorálně v dávce 0,5 mg pacientům dosud neléčeným LAM a v dávce 1 mg denně při infekci mutantou HBV rezistentní na LAM. Frekvence výskytu mutant HBV rezistentních na ETV je při léčbě naivních pacientů velmi nízká a významně s délkou léčby nenarůstá (0,2 % po 1 roce léčby, 0,5 % po 2 letech, 1,2 % po 3, 4 i 5 letech léčby).
Tenofovir je nukleotidový analog strukturálně podobný ADV. Protože je méně nefrotoxický než ADV, je možné jej bezpečně podávat v mnohem vyšší dávce než ADV (300 mg versus 10 mg denně). Je účinným inhibitorem replikace HBV a má vysokou genetickou bariéru pro vznik rezistence. Je účinný i na mutanty viru rezistentní na LAM. Mutanty viru rezistentní na TDV nebyly dosud popsány.
Kombinovaný preparát Truvada, který obsahuje emtricitabin a TDV, se používá pro léčbu infekce HIV a je účinný i při chronické infekci HBV. V České republice není dosud pro léčbu chronické infekce HBV kategorizován.
Telbivudin je účinným inhibitorem replikace HBV, ale má nízkou genetickou bariéru pro vznik rezistence. Vysoká pravděpodobnost vzniku rezistence je zejména u pacientů s vysokou vstupní virémií a detekovatelnou HBV DNA v séru po 24 týdnech léčby. Denní dávka TBV je 600 mg per os. Do dvou let léčby vznikají mutanty rezistentní na TBV u 22 % léčených. Telbivudin nebyl v době vydání tohoto doporučeného postupu v České republice kategorizován pro léčbu chronické infekce HBV.
Srovnání četnosti vzniku rezistence při léčbě různými NA je uvedenov grafu 1.
Graf 1. Srovnání četnosti výskytu rezistence spojené s léčbou různými NA v závislosti na délce léčby (3) 
9. Předpovědní faktory úspěšné léčby chronické infekce HBV
9.1. Pro léčbu pegylovaným či konvenčním interferonem (IFN) alfa
Vyšší pravděpodobnost dosažení sérokonverze HBeAg/anti-HBe je u nemocných, kteří mají před léčbou relativně nízkou virémii (HBV DNA < 107 IU/ml), vysokou aktivitu ALT (> 3 × ULN) a histologicky vysokou zánětlivou aktivitu (≥ A2). Pacienti infikovaní genotypem A nebo B lépe odpovídají na léčbu IFN alfa než při infekci genotypy C nebo D. Obecně však má infekce určitým genotypem HBV malou individuální předpovědní hodnotu a sám genotyp nesmí ovlivnit rozhodnutí o léčbě.
Pokud ve 12. týdnu léčby poklesne HBV DNA < 20 000 IU/ml, je 50% pravděpodobnost dosažení sérokonverze HBeAg/anti-HBe u původně HBeAg pozitivních pacientů a 50% pravděpodobnost dosažení setrvalé virologické odpovědi na léčbu u HBeAg negativních.
9.2. Pro léčbu nukleosidovými či nukleotidovými analogy
Před léčbou jsou příznivé předpovědní faktory stejné jako u léčby IFN alfa (HBV DNA < 107 IU/ml, ALT > 3 × ULN, histologická aktivita ≥ A2). Úspěšnost léčby žádným NA není ovlivněna genotypem HBV.
Během léčby LAM, ADV nebo TBV je pokles hladiny HBV DNA v séru pod hranici detekovatelnosti metodou PCR v reálném čase v 24. nebo 48. týdnu léčby spojen s nižším nebezpečím vzniku rezistence, a tím s větší pravděpodobností dosažení sérokonverze HBeAg/anti-HBe (u HBeAg pozitivních) a setrvalé virologické odpovědi u HBeAg negativních.
10. Kontraindikace léčby chronické infekce virem hepatitidy B
10.1. Kontraindikace léčby interferonem alfa (konvenčním i pegylovaným)
- dekompenzovaná jaterní cirhóza Child-Pugh B nebo C,
- nekontrolované neurologické a psychiatrické onemocnění,
- klinicky významná periferní neutropenie (< 1,2 x 109/l),
- trombocytopenie (< 50 x 109/l),
- autoimunitní onemocnění (relativní kontraindikace),
- aktivní toxikomanie, alkoholismus,
- gravidita a laktace,
- dekompenzovaný nebo nestabilní diabetes mellitus,
- závažná kardiovaskulární onemocnění (infarkt myokardu, městnavé srdeční selhání, klinicky závažné arytmie, těžká hypertenze, chlopenní vady),
- orgánové transplantace s výjimkou jater,
- věk nad 70 let (relativní kontraindikace – závisí na celkovém stavu a motivaci pacienta).
10.2. Kontraindikace léčby lamivudinem
Léčba LAM prakticky nemá kontraindikace. Při jeho podání pacientům s renální insuficiencí (kreatininová clearance < 50 ml/min) je třeba redukovat dávky podle tabulky 2.
Tab. 2. Redukce dávky lamivudinu při renální nedostatečnosti 
10.3. Kontraindikace léčby adefovirem dipivoxilem
Rovněž léčba ADV nemá známé kontraindikace. Při jeho podání pacientům s renální insuficiencí (kreatininová clearance < 50 ml/min) je třeba prodlužovat intervaly mezi jednotlivými dávkami podle tabulky 3.
Tab. 3. Prodlužování intervalu mezi jednotlivými dávkami adefoviru dipivoxilu při renální nedostatečnosti 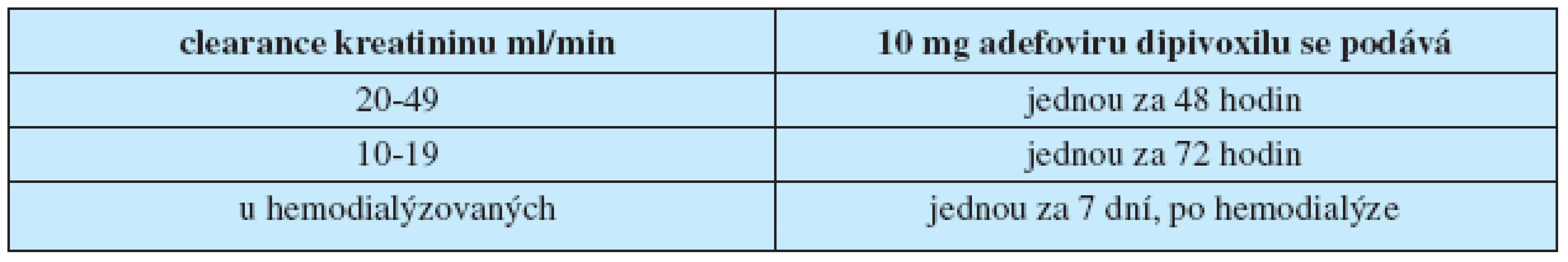
10.4. Kontraindikace entecaviru
Léčba ETV prakticky nemá kontraindikace. Při jeho podání pacientům s renální insuficiencí (kreatininová clearance < 50 ml/min) je třeba redukovat dávky podle tabulky 4.
Tab. 4. Redukce dávky entecaviru při renální nedostatečnosti 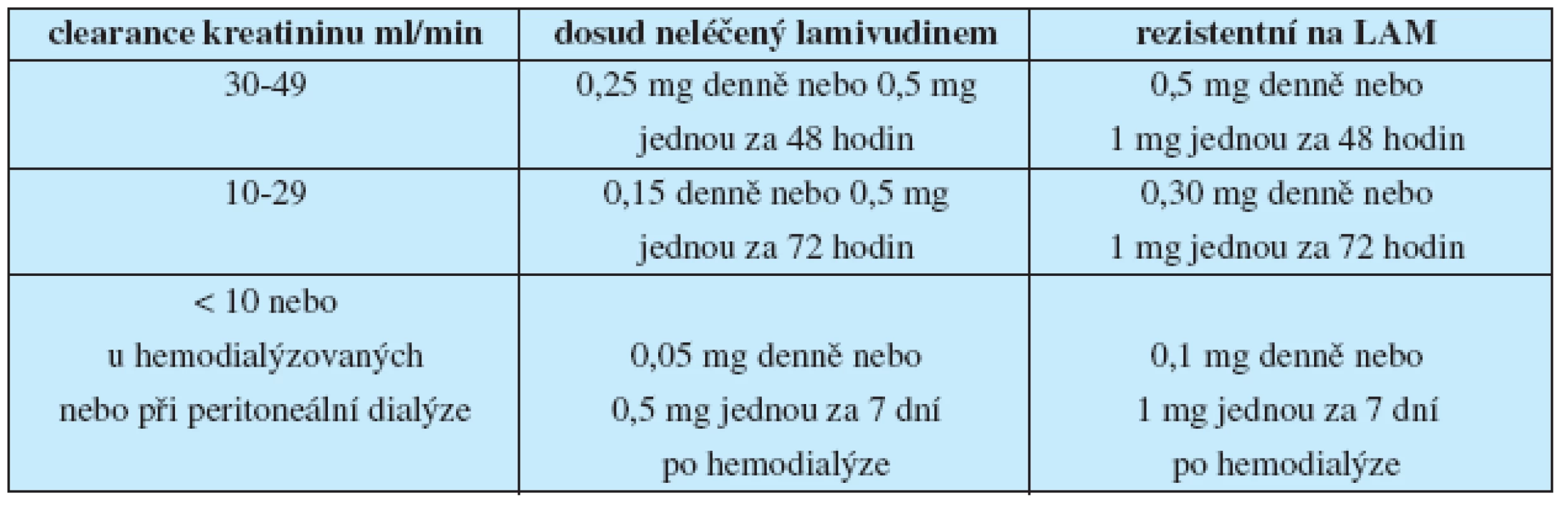
10.5. Kontraindikace telbivudinu
Rovněž léčba TBV nemá známé kontraindikace. Při jeho podání pacientům s renální insuficiencí (kreatininová clearance < 50 ml/min) je třeba prodlužovat intervaly mezi jednotlivými dávkami podle tabulky 5.
Tab. 5. Prodlužování intervalu mezi jednotlivými dávkami telbivudinu při renální nedostatečnosti 
Úspěšnost léčby chronické hepatitidy B
Srovnání úspěšnosti roční léčby různými léky používanými pro léčbu chronické hepatitidy B je patrné z grafu 2 (HBeAg pozitivní pacienti) a grafu 3 (HBeAg negativní pacienti). Obecně lze říci, že srovnání účinnosti jednotlivých preparátů je velmi obtížné, protože nejde o výsledky přímých head-to-head studií, ale o data z různých klinických studií, které se lišily svým designem a zejména citlivostí esejí použitých pro detekci HBV DNA v séru, což mohlo velmi významně ovlivnit dosažené výsledky.
Graf 2. Srovnání dosažení sérokonverze HBeAg/anti-HBe, nedetekovatelné HBV DNA v séru a normální aktivity ALT po 1 roce léčby u HBeAg pozitivních pacientů (v procentech) (3) 
Graf 3. Srovnání dosažení nedetekovatelné HBV DNA v séru a normální aktivity ALT po 1 roce léčby u HBeAg negativních pacientů (v procentech) (3) 
U HBeAg pozitivních pacientů došlo k vymizení HBsAg u 3–4 % léčených PEG-IFN a 3 % léčených TDV. Při léčbě ostatními léky nebyla po 1 roce léčby ztráta HBsAg zaznamenána.
U HBeAg negativních pacientů ke ztrátě HBsAg došlo u 3 % léčených PEG-IFN. Při léčbě ostatními léky nebyla po 1 roce léčby ztráta HBsAg zaznamenána.
11. Strategie léčby chronické hepatitidy B
Obecně jsou možné 2 strategie léčby chronické hepatitidy B – časově omezená a časově neomezená (dlouhodobá) léčba.
11.1. Časově omezená léčba chronické hepatitidy B
Přichází do úvahy u pacientů s nejlepšími předpoklady úspěšnosti:
ALT > 3 × ULN, HBV DNA < 2 miliony IU/ml.
Pro časově omezenou léčbu lze obecně použít:
- PEG-IFN alfa-2a. Doba léčby HBeAg pozitivních i HBeAg negativních pacientů je 48 týdnů.
- ETV nebo TDV. Pouze u HBeAg pozitivních. Potřebnou dobu léčby není možné před léčbou stanovit, stejně tak nelze předem stanovit, zda bude postačovat časově omezená léčba, nebo zda bude nutná dlouhodobá, časově neomezená léčba. Závisí to na tom, zda se podaří v průběhu léčby dosáhnout sérokonverze HBeAg/anti-HBe, či nikoliv. Doba léčby má pokračovat 6 měsíců, ale lépe 12 měsíců, po dosažení HBeAg/anti-HBe sérokonverze. Při splnění této podmínky lze očekávat trvalou sérokonverzi HBeAg/anti-HBe v 80 % případů.
- TBV. Pro léčbu TBV platí stejné principy jako pro léčbu ETV či TDV a navíc musí být negativní HBV DNA v séru po 24 týdnech léčby, jinak je vysoká pravděpodobnost vzniku rezistence na TBV a selhání léčby.
Pacient by měl být předem informován o nežádoucích účincích navržené léčby a měl by se podílet na rozhodnutí, zda chce být léčen PEG-IFN nebo NA
11.2. Časově neomezená (dlouhodobá) léčba chronické hepatitidy B
Tato léčba je indikována u následujících pacientů:
- HBeAg pozitivních, u kterých se nepodaří během léčby NA dosáhnout sérokonverze HBeAg/anti-HBe.
- u HBeAg negativních léčených NA.
- u cirhotiků bez ohledu na stav HBeAg.
Cílem dlouhodobé léčby je suprimovat replikaci HBV, tedy udržet HBV DNA v séru pod hranicí detekovatelnosti metodou PCR v reálném čase, a tím zastavit či zpomalit progresi jaterního onemocnění.
Léky použitelné pro dlouhodobou léčbu:
- ETV nebo TDV, a to vzhledem k jejich vysoké účinnosti a současně vysoké genetické bariéře pro vznik rezistence, což má při dlouhodobé léčbě mimořádný význam. V současné době nejsou k dispozici informace o úspěšnosti, bezpečnosti a snášenlivosti léčby trvající déle než 5 let.
- ADV je méně vhodný, protože je dražší než TDV, méně účinný, a existuje větší pravděpodobnost rezistence.
- LAM či TBV jsou pro dlouhodobou léčbu zcela nevhodné vzhledem s vysoké pravděpodobnosti vzniku rezistence.
12. Iniciální kombinovaná léčba chronické hepatitidy B
V současnosti není dostupný dostatek informací pro doporučení kombinované léčby NA dosud neléčeným, naivním, pacientům. Někteří autoři doporučují podávat kombinovanou léčbu pacientům s největším rizikem vzniku rezistence (extrémně vysoká HBV DNA v séru) nebo u cirhotiků, kde vznik rezistence během léčby NA může být život ohrožující. V úvahu přicházejí následující kombinace NA:
1. ETV+TDV.
Zatím není známa dlouhodobá bezpečnost léčby a překážkou může být i relativně vysoká cena této kombinace léků.
2. TDV+LAM
3. Truvada, tedy kombinace emtricitabinu a TDV v jedné tabletě.
V době vydání tohoto doporučení nebyla kombinovaná léčba naivních pacientů v ČR schválena.
13. Primární selhání léčby chronické hepatitidy B
13.1. Primární rezistence na IFN alfa (pegylovaný či konvenční)
Jako primární rezistence (non-response) na IFN alfa se označuje situace, kdy během prvních 12 týdnů léčby poklesne hladina HBV DNA v séru < 1 log10 IU/ml oproti výchozí (baseline) hodnotě. Reakcí je zastavení podávání IFN alfa a zahájení léčby NA.
13.2. Primární rezistence na NA
Jako primární rezistence (non-response) na NA se označuje situace, kdy během prvních 12 týdnů léčby poklesne hladina HBV DNA v séru < 1 log10 IU/ml oproti výchozí (baseline) hodnotě. Nejčastější je u ADV (10–20 %), protože se musí podávat v suboptimální denní dávce vzhledem k nefrotoxitě vyšších a účinnějších dávek ADV. Řešením je rychlý přechod na TDV nebo ETV. Primární rezistence je zřídkavá u LAM, TBV, ETV nebo TDV, proto je na místě nejdříve kontrola compliance pacienta. Pokud se in vitro prokáže přítomnost mutanty HBV rezistentní na některé z těchto NA, je nutný rychlý přechod na léčbu NA účinným na rezistentní mutantu viru.
13.3. Parciální virologická odpověď na léčbu NA
Tímto termínem se označuje pokles hladiny HBV DNA v séru > 1 log10 IU/ml oproti výchozí (baseline) hodnotě, ale pomocí velmi citlivé PCR v reálném čase lze HBV DNA v séru prokázat. Hodnotí se ve 24. týdnu léčby u léků s nízkou genetickou bariérou proti vzniku rezistence (LAM, TBV, ADV) a ve 48. týdnu léčby u léků s vysokou genetickou bariérou proti vzniku rezistence (ETV, TDV). Při zaznamenání parciální virologické odpovědi je nutné vždy nejprve zkontrolovat compliance pacienta s léčbou.
U pacientů dosud léčených LAM, TBV či ADV jsou možné 2 strategie následné léčby:
- přechod na účinnější lék (ETV nebo TDV),
- přidání účinnějšího léku bez zkřížené rezistence do kombinace (přidání TDV k LAM nebo TBV nebo přidání ETV k ADV).
U pacientů dosud léčených ETV nebo TDV je doporučeno některými autory přidání dalšího léku do kombinace (tedy TDV k ETV nebo naopak) pro oddálení rezistence v budoucnosti. Dlouhodobá bezpečnost kombinace ETV a TDV není dosud známa.
14. Rezistence vzniklá v průběhu léčby NA
V průběhu léčby naivních nemocných s chronickou infekcí HBV vzniká rezistence na podávaná NA zejména u léků s nízkou genetickou bariérou proti vzniku rezistence (LAM, TBV, ADV). Rezistence na ETV je při léčbě naivních pacientů velmi vzácná (1,2 % po 5 letech léčby), v případě léčby pacientů rezistentních na LAM mnohem častější (1 % po 1 roce, 11 % po 2 letech, 27 % po 3 letech a 41 % po 4 letech léčby). Rezistence na TDV nebyla dosud popsána. Termíny používané v souvislosti s rezistencí na NA jsou uvedeny v tabulce 6.
Tab. 6. Definice termínů týkajících se rezistence na nukleosidová či nukleotidová analoga používaná k léčbě chronické infekce HBV<sup>3</sup> 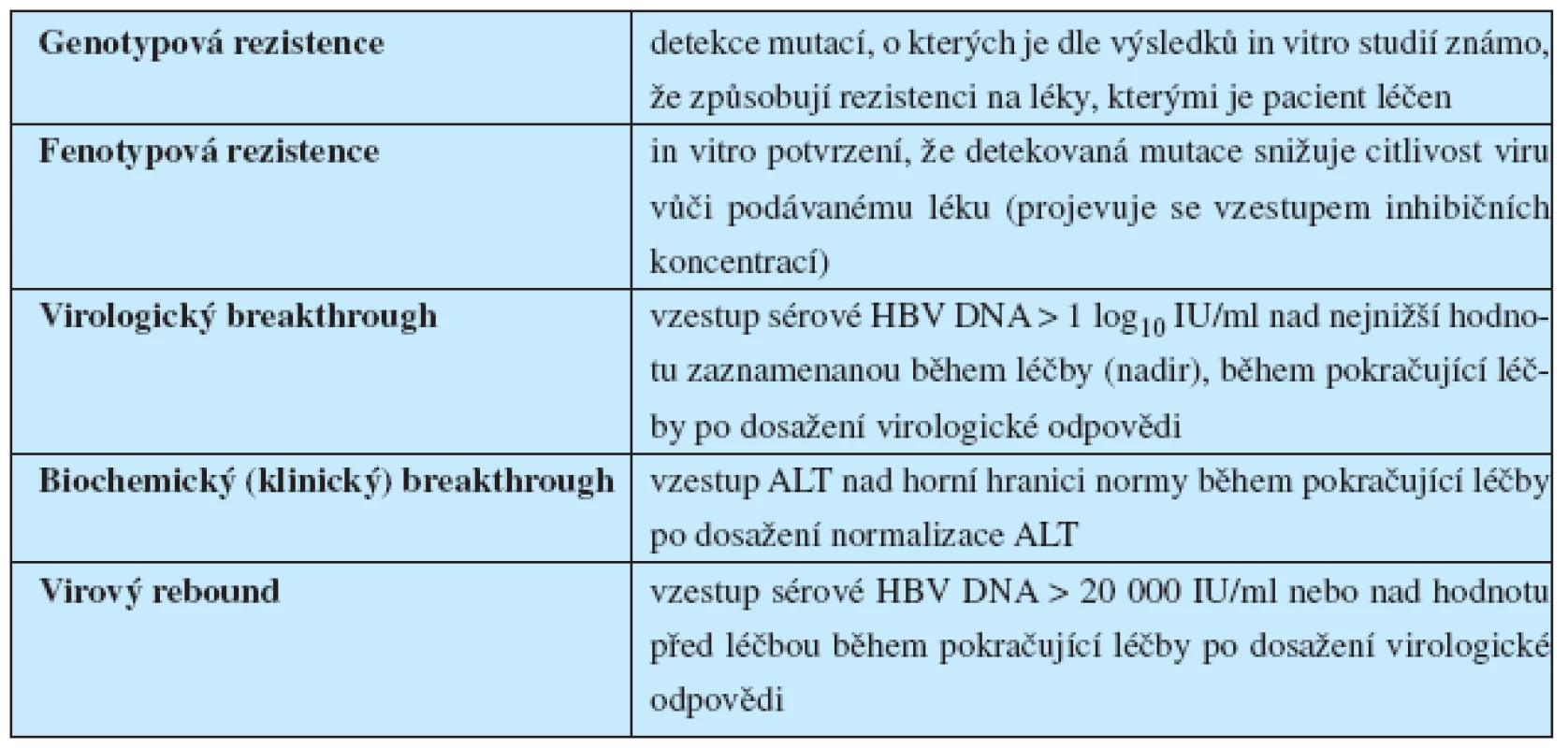
Rezistence by měla být detekována co nejdříve po svém vzniku, nejlépe před elevací ALT – biochemickým (klinickým) breakthrough. K tomu slouží monitorace hladiny HBV DNA v séru metodou PCR v reálném čase a dle možností i identifikace vzniku rezistentních mutant HBV (genotypové rezistence).
15. Léčba pacientů infikovaných mutantou HBV rezistentní na NA
Při volbě léků pro následnou terapii je nutné vzít do úvahy dosud známá data o zkřížené rezistenci mezi jednotlivými NA, která jsou uvedena v tabulce 7.
Tab. 7. Zkřížená rezistence mezi mutantami HBV, které vznikají při léčbě NA nejčastěji 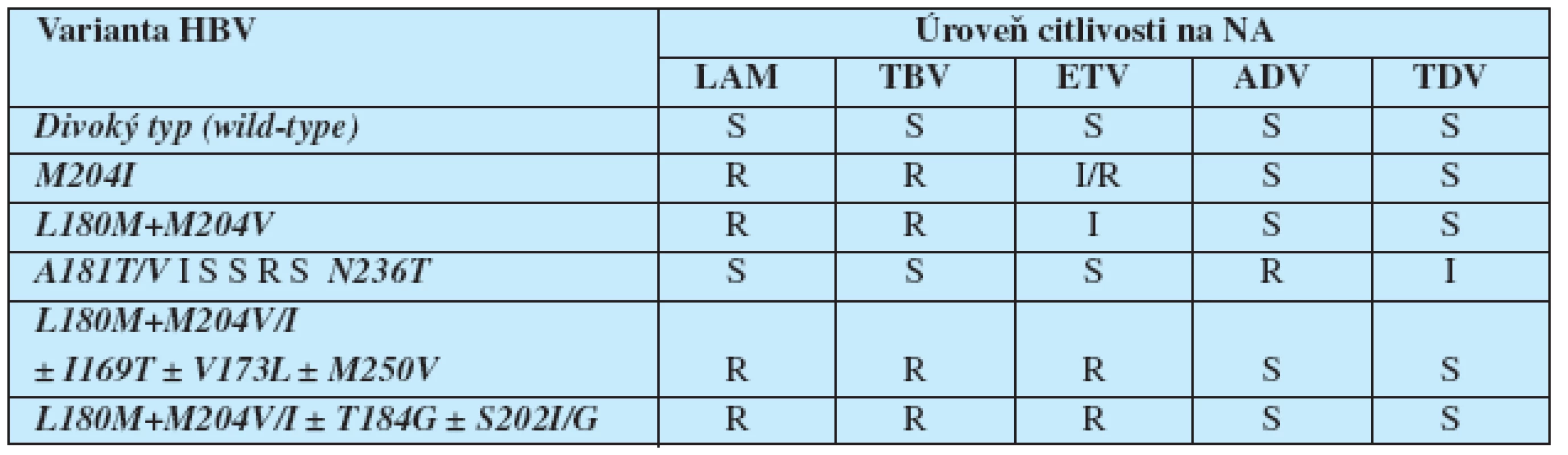
S=citlivost, R=rezistence, I=snížená citlivost V současnosti se za jedinou účinnou strategii považuje přidání druhého léku bez zkřížené rezistence do kombinace. Tím je zajištěna maximální antivirová účinnost následné terapie a minimalizuje se riziko vzniku mutant viru s rezistencí na několik NA. Také dlouhodobá bezpečnost kombinace TDV+ETV, TDV+TBV, ADV+TBV, TDV+LAM nebo kombinovaného léku Truvada nebyla v té době celosvětově známa.
15.1. Rezistence na lamivudin nebo telbivudin
V případě vzniku rezistentní mutanty na LAM (TBV) jsou obecně možné následující možnosti následné léčby:
- přidání TDV k LAM (TBV),
- přidání ADV k LAM (TBV), pokud není TDV dostupný
V době vydání tohoto Doporučeného postupu bylo v České republice možné přidání ADV k LAM a náhrada LAM entecavirem (tato strategie však není dle současných poznatků vhodná, vzhledem k vysoké pravděpodobnosti vzniku sekundární rezistence na ETV při již existující rezistenci na LAM). V této indikaci lze uvažovat i o podání PEG-IFN alfa-2a. Výsledky klinické studie s omezeným počtem pacientů ukazují dobrou účinnost a vysokou bezpečnost léčby PEG-IFN alfa-2a u těchto pacientů.
15.2. Rezistence na adefovir dipivoxil
V případě vzniku rezistentní mutanty na ADV je doporučeno nahradit ADV tenofovirem a přidat další lék bez zkřížené rezistence do kombinace. Při volbě druhého léku je nutné vzít do úvahy charakter mutace podmiňující rezistenci na ADV.
- při substituci N236T – kombinace TDV+LAM, ETV nebo TBV nebo kombinovaný lék Truvada,
- při substituci A181T/V – kombinace TDV+ETV nebo kombinovaný lék Truvada.
V době vydání tohoto doporučeného postupu nebyl lék Truvada pro tuto léčbu schválen. V této indikaci lze uvažovat i o podání PEG-IFN alfa-2a. Výsledky klinické studie s omezeným počtem pacientů ukazují dobrou účinnost a vysokou bezpečnost léčby PEG-IFN alfa-2a u těchto pacientů.
15.3. Rezistence na entecavir
V případě vzniku rezistentní mutanty na ETV se přidává TDV do kombinace.
15.4. Rezistence na tenofovir
Tato rezistence nebyla do doby vydání tohoto doporučení popsána. Pokud by vznikla, bylo by na místě její genotypové a fenotypové vyšetření potřebné pro určení zkřížené rezistence na NA. Do úvahy by připadala kombinovaná léčba TDV s ETV, TBV nebo LAM nebo náhrada TDV kombinovaným lékem Truvada.
16. Monitorování virologických a sérologických parametrů během léčby a po jejím skončení
16.1. Léčba interferonovými preparáty
Hladina HBV DNA v séru
Ke stanovení se používá PCR v reálném čase. Vyšetření se provádí:
- 1. před léčbou - stanovení vstupní (baseline) virémie,
- 2. ve 12. týdnu léčby.
a) Posouzení primární rezistence (non-response), definované jako pokles HBV DNA v séru < 1 log10 oproti baseline,
b) posouzení pravděpodobnosti úspěšnosti léčby, hodnota < 20 000 IU/ml je spojena 50% šancí dosažení HBeAg sérokonverze nebo setrvalé virologické odpovědi u HBeAg negativních.
- 3. ve 24. týdnu léčby – posouzení virologické odpovědi, tj. HBV DNA v séru < 2 000 IU/ml, která je většinou spojena s remisí onemocnění.
HBeAg a anti-HBe v séru
Tato vyšetření se provádějí pouze u pacientů před léčbou HBeAg pozitivních k posouzení dosažené sérokonverze HBeAg/anti-HBe. Vyšetření se provádí:
- ve 24. týdnu léčby,
- ve 48. týdnu léčby,
- 24. týden po skončení léčby.
Pacienti po sérokonverzi HBeAg/anti-HBe musí být dlouhodobě sledováni, protože je po skončení léčby možná séroreverze a může vzniknout HBeAg negativní forma chronické hepatitidy B.
Nedetekovatelná HBV DNA (metodou PCR v reálném čase) v období po skončení léčby je optimálním výsledkem léčby HBeAg pozitivní i HBeAg negativní formy chronické hepatitidy B, protože je spojena s velkou pravděpodobností ztráty HBsAg v budoucnosti. Proto je v případě HBV DNA negativity nutná kontrola HBsAg v 6ti měsíčních intervalech. Význam kvantifikace HBsAg je zatím předmětem výzkumu.
16.2. Léčba NA
Hladina HBV DNA v séru
Ke stanovení se používá PCR v reálném čase. Vyšetření se provádí:
- 1. ve 12. týdnu léčby – posouzení primární rezistence,
- 2. ve 24. týdnu léčby – posouzení parciální virologické odpovědi při léčbě LAM, TBV nebo ADV,
- 3. ve 48. týdnu léčby
a) posouzení parciální virologické odpovědi při léčbě ETV nebo TDV,
b) posouzení virologické odpovědi – negativní HBV DNA pomocí PCR v reálném čase,
- 4. dále každých 12–24 týdnů při časově neomezené léčbě,
- 5. po sérokonverzi HBeAg/anti-HBe každých 12 týdnů,
- 6. kdykoliv při podezření na selhání léčby, možný vznik rezistence.
HBeAg a anti-HBe v séru
Tato vyšetření se provádějí pouze u pacientů před léčbou HBeAg pozitivních k posouzení dosažené sérokonverze HBeAg/anti-HBe. Vyšetření se provádí každých 6–12 měsíců. Dosažení sérokonverze HBeAg/anti-HBe je podmínkou časové omezenosti léčby.
17. Monitorování nežádoucích účinků během léčby NA
Všechna NA jsou vylučována ledvinami, proto je nutná redukce dávek nebo prodlužování intervalů mezi jednotlivými dávkami při poklesu kreatininové clearance (viz kapitola 8). Vzácně byla popsána nefrotoxicita ADV a TDV u HIV pozitivních pacientů nebo nemocných léčených jinými nefrotoxickými léky. Je možná akutní exacerbace hepatitidy B u cirhotiků zejména v počátcích léčby, proto je nutné v prvních 3 měsících léčby sledování po 1 měsíci. Vzácně byly publikovány i případy osteoporózy u HIV pozitivních pacientů léčených TDV, myopatie při léčbě TBV a periferní neuropatie při léčbě TBV. Protože se neuropatie může objevit i při léčbě PEG-IFN, neměla by se používat kombinace PEG-IFN a TBV. Probíhají studie hodnotící možnou karcinogenitu ETV při dlouhodobém podávání.
18. Léčba pacientů s kompenzovanou jaterní cirhózou (Child A)
Pokud lze u těchto nemocných detekovat HBV DNA v séru metodou PCR v reálném čase, mají být léčení, i když je ALT normální a/nebo HBV DNA < 2 000 IU/ml. Dlouhodobá a účinná suprese HBV DNA může stabilizovat stav pacienta, oddálit nebo trvale odstranit potřebu transplantace jater. IFN alfa (pegylovaný či konvenční) lze použít jen u dobře kompenzovaných cirhotiků. Během léčby je nezbytně nutné pečlivé monitorování HBV DNA v séru. Pokud není ve 48. týdnu léčby HBV DNA v séru pod hranicí detekovatelnosti metodou PCR v reálném čase, je nutné přidání dalšího léku bez zkřížené rezistence.
V době vydání tohoto doporučeného postupu byl pro léčbu naivních cirhotiků kategorizován pouze LAM, který by však měl být podáván pouze v kombinaci s ADV, nebo lépe TDV, jinak je vysoké riziko vzniku rezistence. Vznik rezistentní mutanty HBV může vést k rychlé dekompenzaci jaterní cirhózy a s ní spojeným život ohrožujícím komplikacím.
19. Léčba pacientů s dekompenzovanou jaterní cirhózou (Child B a C)
Tito nemocní vyžadují okamžitou antivirovou léčbu ve specializovaných centrech s napojením na transplantační jednotky, a to i při nízké hodnotě HBV DNA, aby se zabránilo reaktivaci infekce HBV při imunosupresi. Lékem volby jsou NA s vysokou genetickou bariérou pro vznik rezistence, tedy ETV nebo TDV, i když.je zatím k dispozici málo dat o bezpečnosti léčby těmito léky u cirhotiků. Léčbou navozená suprese virové replikace může vést k pomalému zlepšování klinického stavu, a to v horizontu 3–6 měsíců, ale u velmi pokročilých cirhotiků nemusí být antivirová léčba vždy úspěšná a je nutná transplantace jater.
20. Léčba nemocných před a po transplantací jater pro konečná stadia chronické infekce virem hepatitidy B
Před transplantací je nutné u všech HBsAg pozitivních pacientů dosažení co nejnižší hladiny HBV DNA v séru. Lékem volby jsou NA s vysokou genetickou bariérou pro vznik rezistence, tedy ETV nebo TDV, i když.je zatím k dispozici málo dat o bezpečnosti léčby nemocných v terminálních fázích infekce HBV těmito léky. Podávání NA po transplantaci je s velkou pravděpodobností doživotní. V současnosti je nejvíce zkušeností s kombinací LAM a/nebo ADV a hyperimunního imunoglobulinu proti HBV (HBIg). Touto léčbou lze redukovat riziko infekce štěpu < 10%.
Mezi zatím jen studované postupy patří:
- možnost snížit dávky HBIg nebo zkrátit dobu podávání tohoto imunoglobulinu,
- kombinace LAM+ADV+ETV,
- kombinace ETV a TDV.
V době vydání tohoto doporučeného postupu nebyl TDV České republice kategorizován pro léčbu infekce HBV a ETV byl schválen jen pro léčbu pacientů s rezistencí na LAM. Proto bylo nutné podávat pacientům zařazeným na čekací listinu před transplantací jater LAM, ke kterému se v případě vzniku rezistence na LAM přidával ADV. Přidání ADV k LAM bylo rovněž vhodné v případě čekání na transplantaci jater delším než 6 měsíců.
U pacientů s vysokou vstupní virémií byla kombinovaná terapie LAM a ADV vhodná hned od zařazení na čekací listinu, protože se touto kombinací snižuje frekvence vzniku rezistentních mutant HBV a rychleji je dosaženo signifikantní suprese virové replikace. Po transplantaci jater bylo standardní profylaxí rekurence infekce HBV podávání kombinace LAM a HBIg. Při objevení rekurence infekce HBV, která představuje selhání profylaxe, se léčba HBIg ukončila, protože hrozil vznik sérové nemoci při jejím pokračování, a přidával se ADV k LAM. Při selhání účinnosti léčby kombinací LAM a ADV byla na místě léčba TDV či ETV.
21. Zábrana reaktivace a rekurence infekce HBV
Replikace HBV sama o sobě nevede k destrukci infikovaných hepatocytů, virus není ve většině případů cytopatogenní. Imunosupresivní léčba sice sníží imunitní reakci namířenou proti infikovaných hepatocytům, na druhou stranu oslabí imunitní kontrolu replikace viru. Zvyšuje se podíl infikovaných hepatocytů, replikace HBV výrazně stoupá a dosáhne úrovně, kdy již vede k přímému poškození infikovaných hepatocytů, a HBV se tím stává cytopatogenní.
Klinickým korelátem popsaných pochodů je rozvoj fibrotizující cholestatické hepatitidy, což je závažné život ohrožující onemocnění, během několika měsíců vede bez účinné léčby u většiny případů k selhání jater. Stav, kdy imunosupresivní léčba vede k výraznému nárůstu replikace HBV a vzplanutí hepatitidy u dosud inaktivního nosiče HBsAg, se označuje jako reaktivace chronické hepatitidy B. Rekurencí se rozumí stav, kdy se pacient, který prodělal hepatitidu B a vymizel u něj HBsAg ze séra, stane znovu HBsAg pozitivním a replikace HBV rychle roste. Virová nukleová kyselina totiž perzistuje trvale v hepatocytech ve formě tzv. cccDNA (covalently closed circular DNA), a to i u pacientů, kteří se stali HBsAg negativními. K úplné eliminaci HBV nikdy nedojde. Stav dříve nazývaný eliminací viru je jen účinnou imunitní kontrolou replikace s poklesem virémie pod hranici detekovatelnosti. Ztráta imunitní kontroly replikace viru vlivem imunosupresivní léčby tak vede k rekurenci hepatitidy B.
K reaktivaci replikace HBV dochází u 20–50 % inaktivních nosičů HBsAg podstupujících imunosupresivní či protinádorovou terapii. Reaktivace replikace HBV je častější, pokud chemoterapeutické režimy obsahují kortikosteroidy. Reaktivací hepatitidy B jsou ohroženi nejvíce pacienti s maligními lymfomy léčení rituximabem, ale i pacienti se solidními tumory, pacienti po transplantaci kostní dřeně, pacienti po orgánových transplantacích, dále pacienti s autoimunními chorobami léčení klasickými imunosupresivy a nově i anti-TNF a anti-CD20 protilátkami. Reaktivace byla popsána i po intraarteriální embolizaci HCC.
Reaktivace hepatitidy B obvykle přichází po 2–4 cyklech chemoterapie a klinický obraz kolísá od asymptomatického zvýšení aktivity aminotransferáz (50 %) k obrazu těžké akutní hepatitidy s ikterem (10 %), nejzávažnější variantou je fulminantní selhání jater (5 %).
V současné době je u pacientů HBsAg pozitivních preferována léčba preemptivní, která se zahajuje nejméně týden před chemoterapií nebo imunosupresí bez ohledu na výši hladiny HBV DNA v séru. U pacientů s nízkou vstupní virémií (HBV DNA v séru < 2 000 IU/ml) se doporučuje podávat protivirové léky ještě 12 měsíců po skončení imunosupresivní či protinádorové terapie. Toto ukončení léčby je však možné jen u pacientů, u kterých se nepředpokládá opakování chemoterapie. V opačném případě je nutná léčba celoživotní.
Léčba pacientů s vysokou vstupní virémií (> 2 000 IU/ml) musí pokračovat až do dosažení stejných cílových kritérií jako u imunokompetentních pacientů. V současnosti je v této indikaci nejvíce zkušeností s LAM, ale zejména u nemocných s vysokou vstupní virémií by měl mít přednost ETV nebo TDV kvůli nebezpečí rezistence
U pacientů s pozitivitou anti-HBc protilátek a negativitou HBsAg v séru, kteří jsou v riziku rekurence replikace HBV, není preemptivní protivirová léčba zatím jednoznačně doporučována, s výjimkou příjemců kostní dřeně, u kterých je nezbytná. V každém případě jsou nutné pravidelné kontroly během imunosupresivní léčby či chemoterapie a zahájení protivirové léčby okamžitě při průkazu rekurence, respektive prvním vzestupu ALT.
V době vydání tohoto doporučeného postupu bylo v České republice jedinou možností v indikaci zábrany reaktivace a rekurence infekce HBV podání LAM a přidání ADV v případě vzniku rezistence HBV na LAM.
22. Léčba zvláštních skupin pacientů s chronickou infekcí HBV
22.1. Děti
U většiny dětí má chronická hepatitida B benigní průběh. Do současné doby bylo prokázáno, že bezpečnost a účinnost konvenčního IFN alfa, LAM, ADV u dětí je srovnatelná s dospělými pacienty. Stále probíhají studie s jinými NA u dětí.
Obecně se doporučuje léčit děti ve věku ≥ 2 roky (ostatní indikační kritéria jsou stejná jako u dospělých). Doporučená dávka IFN alfa je dávku 6 MU/m2, maximálně 10 MU, třikrát týdně. Doba léčby je stejná jako u dospělých pacientů. Dávka LAM byla stanovena na 3 mg/kg/den, maximálně však 100 mg denně. V klinické studii bylo prokázáno, že denní dávka ADV 0,3 mg/kg u dětí ve věku 2–6 let a 10 mg u starších dětí vede ke stejným léčebným výsledkům jako dávka 10 mg denně u dospělých pacientů a je stejně dobře tolerována.
Lamivudin a ADV byly v České republice zatím registrovány pouze pro léčbu chronické hepatitidy B u dospělých pacientů a u dětí nad 16 let (LAM). Léčba mladších dětí přichází do úvahy jen v rámci klinických studií.
22.2. Těhotné ženy
Podle prestižní americké klasifikace US FDA Pharmaceutical Pregnancy Categories, která rozlišuje 5 kategorií léků (A, B, C, D, X) podle možného ovlivnění těhotenství, patří TBV a TDV do kategorie B (tedy s druhým nejnižším rizikem) a LAM, ADV, ETV do kategorie C. Nejvíce informací o bezpečnosti NA pochází od HIV pozitivních žen léčených léky účinnými proti infekci HIV i HBV. Podle literárních informací z posledních let může podání LAM v posledním trimestru u pacientek s vysokou HBV DNA v séru zvýšit účinnost pasivní a aktivní imunizace proti HBV. V těhotenství lze použít i TDV, lék Truvada a ETV. Po porodu může dojít k akutní exacerbaci chronické hepatitidy B, proto je nutné pečlivé monitorování žen po porodu.
22.3. Nemocní s renální nedostatečností a hemodialýzovaní nemocní
Léčba IFN alfa se u těchto nemocných neliší od doporučení platných pro ostatní pacienty s chronickou hepatitidou B. U pacientů s renální insuficiencí (kreatininová clearance < 50 ml/min) je nutné upravit denní dávky LAM, ADV, ETV a TBV v závislosti na hodnotách kreatininové clearance (tabulky 2–5).
U hemodialýzovaných pacientů nejsou zatím doporučení optimálních dávek lamivudinu jednoznačná. Dávkování ADV, ETV a TBV u hemodialýzovaných pacientů se řídí doporučeními uvedeným v tabulkách 3-5. PEG-IFN alfa-2a se podává u hemodialýzovaných pacientů v dávce 135 ∝g jednou týdně podkožně. V literatuře jsou zprávy o zhoršení funkce transplantované ledviny po ADV. ETV se zdá být optimální volbou pro pacienta podstupujícího transplantaci ledvin. TDV podávat s opatrností u nemocných s renálním poškozením.
22.4. Pacienti s koinfekcí HBV a HIV
Výrazným prodloužením délky života a zlepšením jeho kvality v důsledku kombinované antiretrovirové terapie (cART) u HIV pozitivních osob se stává léčba chronické infekce HBV u těchto nemocných plně indikovanou. U pacientů koinfikovaných HBV a HIV je větší riziko vzniku jaterní cirhózy. V důsledku restituce imunitního systému během cART může dojít k akutní exacerbaci chronické hepatitidy B. Indikace pro léčbu jsou u koinfikovaných stejné jako u HIV negativních. V souladu s doporučeními pro léčbu infekce HIV se doporučuje léčit u většiny pacientů infekci HIV i HBV de novo. Lékem volby je Truvada v kombinaci s dalším lékem účinným na HIV infekci. Pokud se lékař rozhodne léčit pouze infekci HBV (méně častý případ), je základním pravidlem nevolit léky účinné i na HIV (LAM, ETV, TDV) vzhledem k nebezpečí vzniku rezistence HIV při monoterapii. Léky volby jsou ADV nebo TBV, které nemají aktivitu vůči HIV. Pokud se pomocí těchto léků nedosáhne negativity HBV DNA v séru metodou PCR v reálném čase, je na místě začít léčit i infekci HIV stejným způsobem jako v případě de novo terapie koinfekce HBV a HIV.
22.5. Pacienti s koinfekcí HBV a HDV
Infekce HDV je zatím v podmínkách České republiky ojedinělá, i když se zdá, že z rostoucím počtem imigrantů incidence onemocnění narůstá, stejně jako v jiných rozvinutých zemích Evropy. K potvrzení aktivní koinfekce slouží průkaz HDV RNA v séru nebo protilátek anti-HDV IgM nebo HDAg imunohistochemicky.
Jedinými účinnými léky jsou PEG-IFN nebo konveční IFN alfa, NA jsou neúčinná. Cílem léčby je útlum replikace HDV (HBV DNA bývá většinou negativní i metodou PCR v reálném čase díky supresivnímu vlivu HDV na replikaci HBV), který je většinou spojen s normalizací ALT a histologickým zlepšením. Potřebná délka léčby je pravděpodobně delší než 1 rok. Pro kontrolu účinnosti léčby se doporučuje srovnat po 24 týdnech léčby hladinu HDV RNA v séru se vstupní virémií. Úspěšnost léčby není přesně známa, ale část pacientů se stane HDV RNA nebo dokonce HBsAg negativní a zlepší se jejich histologický nález.
22.6. Pacienti s koinfekcí HBV a HCV
U naprosté většiny nemocných replikace HCV utlumí replikaci HBV, proto je hladina HBV DNA v séru většinou nízká nebo nedetekovatelná metodou PCR v reálném čase. Lékem volby je kombinace PEG-IFN+RBV, stejně jako při infekci pouze HCV. Setrvalá virologická odpověď vzhledem k infekci HCV je zhruba stejně častá jako u pacientů s hepatitidou C bez koinfekce HBV. Existuje potenciální riziko reaktivace HBV po útlumu replikace HCV. V tomto případě je na místě zahájení léčby NA podle obecně platných pravidel.
22.7. Pacienti s extrahepatálními projevy infekce HBV
HBsAg pozitivní pacienti s aktivní replikací HBV a extrahepatálními projevy infekce HBV mohou odpovídat na antivirovou léčbu. V této indikaci je nejvíce zkušeností s LAM, ale předpokládá se, že ETV a TDV budou ještě účinnější. V některých indikacích může být účinná současně prováděná plazmaferéza.
23. Léčba nemocných s těžkým průběhem akutní hepatitidy B
Přibližně 95–99 % dospělých pacientů s akutní hepatitidou B se spontánně vyléčí a dojde u nich bez antivirové terapie k sérokonverzi HBsAg/anti-HBs. Někteří pacienti s fulminantní hepatitidou nebo těžkou protrahovanou subakutní jaterní nekrózou mohou profitovat z léčby NA. Nejvíce zkušenosti je v této indikaci zatím s LAM, ale lze předpokládat, že podání léků s vyšší genetickou bariérou k rezistenci (ETV, TDV) by bylo vhodnější. Délka léčby nebyla stanovena, ale doporučuje se pokračovat nejméně 3 měsíce po sérokonverzi HBsAg/anti-HBs, nebo 6 měsíců po sérokonverzi HBeAg/anti-HBe. Pokud nelze odlišit akutní hepatitidu B a akutní exacerbaci chronické hepatitidy B, je na místě léčba NA.
V ČR bylo v době vydání tohoto doporučení možné použít u těžké akutní hepatitidy B pouze LAM.
24. Význam jaterní biopsie a způsob provedení histologického hodnocení
Provedení jaterní biopsie je doporučeno pro stanovení stupně zánětlivě-nekrotické aktivity a fibrózy u pacientů se zvýšenou aktivitou ALT nebo hladinou HBV DNA v séru > 2 000 IU/ml (nebo oběma těmito parametry), protože histologické vyšetření může přispět k rozhodnutí o zahájení léčby. Jde zejména o pacienty s dlouhodobě normální aktivitou ALT, u kterých má význam kontinuální posuzování progrese fibrózy ve vzorcích, získaných s odstupem několika let. Biopsie může být rovněž užitečná pro posouzení přítomnosti jiných možných příčin jaterního onemocnění, jako jsou steatóza nebo steatohepatitida.
Jaterní biopsie není obvykle požadována u pacientů s jaterní cirhózou nebo u těch, u kterých je léčba indikována bez ohledu na stupeň aktivity a pokročilosti jaterního procesu. I když je jaterní biopsie invazivním zákrokem, riziko závažných komplikací je velmi nízké (1/4000–10 000 zákroků). Histologické hodnocení se provádí stejně jako u jiných chronických hepatitid (Knodell, Ishak, METAVIR). Odmítnutí jaterní biopsie pacientem či jeho neprovedení z důvodů nebezpečnosti zákroku u komplikovaného pacienta (hemofilie, trombocytopenie, koagulační poruchy, jaterní hemangiomy apod.) nesmí být důvodem k neposkytnutí léčby, pokud se jedná o klinicky a laboratorně jasně indikované případy.
25. Způsob dispenzarizace pacientů s infekcí virem hepatitidy B
V České republice je ze zákona nařízena povinná izolace nemocných s akutní hepatitidou na infekčních klinikách či odděleních. Dále jsou pacienti nejméně 12 měsíců kontrolováni v jaterních poradnách při těchto pracovištích. Pokud infekce přejde do chronicity, je nutná dlouhodobá, eventuálně celoživotní dispenzarizace v jaterní poradnách infekčních, gastroenterologických nebo interních pracovišťích. V případě vzniku HCC na gastroenterologii a onkologii. Oprávnění provádět antivirovou léčbu chronické hepatitidy B mají pouze pracoviště garantovaná Českou hepatologickou společností a Společností infekčního lékařství České lékařské společnosti J.E. Purkyně.
prof. MUDr. Petr Husa, CSc.
Klinika infekčních chorob LF MU a FN Brno
E-mail: phusa@fnbrno.cz
Zdroje
1. Husa, P., Plíšek, S., Šperl, J., Urbánek, P. (koordinátoři), Galský, J., Hůlek, P., Kümpel, P., Němeček, V., Volfová, M. (abecedně). Diagnostika a léčba chronické hepatitidy B. Doporučený postup ČHS a SIL ČLS JEP. Vnitř. Lék. 2007, 53, s. 1221-1230.
2. Husa, P., Plíšek, S., Šperl, J., Urbánek, P. (koordinátoři), Galský, J., Hůlek, P., Kümpel, P., Němeček, V., Volfová, M. (abecedně). Diagnostika a léčba chronické hepatitidy B. Doporučený postup ČHS a SIL ČLS JEP. Klin. Mikrobiol. Inf. Lék. 2008, 14, s. 35-43.
3. European Association for the Study of the Liver. EASL Clinical Practice Guidelines: Management of chronic hepatitis B. J. Hepatol. 2009, 50, p. 227-242.
Štítky
Praktické lekárstvo pre deti a dorast Praktické lekárstvo pre dospelých
Článek Prurigo actinicaČlánek Jubilea
Článok vyšiel v časopisePraktický lékař
Najčítanejšie tento týždeň
2009 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
- Vareniklin jako pomocník v léčbě nikotinismu i u psychiatrických pacientů
-
Všetky články tohto čísla
- Doporučený postup České hepatologické společnosti a Společnosti infekčního lékařství České lékařské společnosti J. E. Purkyně Diagnostika a léčba chronické hepatitidy B
- Současný pohled na diagnostiku a léčbu karcinomu žaludku
- Lichen sclerosus u ženy Pohled na etiopatogenezi a léčbu
- Neuronální podklady osobnosti a inteligence
- Krátkodobé sledování pacientů ve vysokém věku po kardiochirurgických operacích
- Prurigo actinica
- Rekonstrukce přední hrudní stěny pomocí transverzální dlahové fixace u komplikované sternotomické rány
- Detekce latentní tuberkulózy QuantiFERON-TB Gold test, možnosti a úskalí metody
- Mikrovaskulární dekomprese mozkových nervů – účinek a rizika léčby
- Příspěvek k terminologii léčby u terminálních stavů nevyléčitelných onemocnění
- Miniportréty slavných českých lékařů Legendární pražský profesor patologické fyziologie MUDr. Josef Hepner
- Chraňte děti před počítači a počítače před dětmi
- Profesor Václav Špičák pasován na Rytíře českého lékařského stavu
- Čestná medaile ČLS JEP udělena MUDr. Richardu Stejskalovi
- Bezkrevní medicicína – současný stav a perspektivy
- 35. výročie vzniku prvého klinického angiologického pracoviska v Slovenskej republike
- Jubilea
- Praktický lékař
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Lichen sclerosus u ženy Pohled na etiopatogenezi a léčbu
- Detekce latentní tuberkulózy QuantiFERON-TB Gold test, možnosti a úskalí metody
- Mikrovaskulární dekomprese mozkových nervů – účinek a rizika léčby
- Současný pohled na diagnostiku a léčbu karcinomu žaludku
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



