-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Nadměrná konzumace masa v etiopatogenezi kolorektálního karcinomu
Excessive consumption of meat in aetiology of colorectal cancer
Colorectal cancer is one of the most common malignant neoplasms in the Czech Republic. 7,801 new cases of colorectal cancer were diagnosed in the country in 2006. This means that Czech males are ranked 2nd, and Czech females ranked 5th in Europe for the incidence of this type of cancer. Moreover, colorectal cancer is one of the most common causes of death by cancer patients in the Czech Republic. Nutrition plays a key role in the aetiopathogenesis of sporadic colorectal cancer, mainly the excessive consumption of red and processed meat. Fish has a protective effect on the colon and the consumption of poultry is not associated with any change of risk assessment. Proteins in meat influence the level of endogenous nitrosocompounds which originate from the digestion of HEM iron or proteins, heterocyclic amines (HCAs) and polycyclic aromatic hydrocarbons (PAUs) formed in meat during food processing at high temperatures, or increase of polyamine levels (putrescine, spermidine, spermine). Gene polymorphism of enzymes is also involved in the metabolism of HCAs and PAUs. Meat is also the main source of one important amino acid in carcinogenesis, arginine. Arginine is a key amino acid in two pathways:
– one mediated by inducible NO-synthase II, and
– the second pathway leads to the formation of ornithine, a precursor for putrescine formation (first step in polyamine synthesis).
Polyamines regulate gene expression and modulate signal transduction. They can alter the regulation of cell proliferation resulting in development of colorectal cancer. In terms of primary prevention is very desirable to restrict consumption of red and processed meat, especially smoked or otherwise modified and increase the intake of fish, which is thought to have a protective effect.Key words:
colorectal cancer, meat, polyamines, arginine.
Autori: M. Vočka; V. Bencko
Pôsobisko autorov: Přednosta: doc. MUDr. Milan Tuček, CSc. ; Ústav hygieny a epidemiologie 1. lékařské fakulty Univerzity Karlovy a Všeobecné fakultní nemocnice v Praze
Vyšlo v časopise: Prakt. Lék. 2010; 90(1): 12-15
Kategória: Přehledy
Súhrn
Kolorektální karcinom je v České republice jedním z nejčastějších nádorových onemocnění. V roce 2006 bylo v naší republice diagnostikováno 7 801 nových případů kolorektálního karcinomu, což Českou republiku řadí v incidenci této diagnózy u mužů na druhém místo a u žen na páté místo v Evropě. Zároveň patří kolorektální karcinom i k nejčastějším příčinám úmrtí na maligní onemocnění u nás. Klíčovou roli v etiopatogenezi sporadicky se vyskytujícího kolorektálního karcinomu hraje výživa, zejména nadměrná konzumace červeného masa a masných výrobků. Rybí maso působí naopak protektivně a konzumace drůbeže není spojena se změnou míry rizika. Bílkoviny obsažené v mase působí cestou endogenních nitrosaminů, které vznikají při trávení HEMového Fe nebo proteinů, heterocyklických aminů (HCA), vznikajících v mase během tepelné úpravy masa, a polycyklických aromatických uhlovodíků (PAU), vznikajících během grilování, nebo zvýšením hladiny polyaminů (putrescin, spermidin, spermin). Zásadní význam má též polymorfismus genů kódujících enzymy metabolismu HCA and PAU. Maso je hlavním zdrojem argininu, aminokyseliny významné v procesu karcinogeneze. Arginin je klíčový substrát dvou cest karcinogeneze:
– jedna mediovaná inducibilní NO-syntázou 2, a
– druhá vedoucí ke vzniku ornithinu, substrátu pro vznik putrescinu (prvního kroku v syntéze polyaminů).
Polyaminy ovlivňují genovou expresi a modulují signální transdukci. Mohou vést k dysregulaci proliferace buněk, vedoucí ke vzniku kolorektálního karcinomu. Z hlediska primární prevence je žádoucí omezit konzumaci červeného masa a masných výrobků, zejména uzených či jinak nevhodně upravených, a zvýšit konzumaci rybího masa, u kterého se očekává protektivní vliv.Klíčová slova:
kolorektální karcinom, maso, polyaminy, arginin.Úvod
Kolorektální karcinom je v České republice jedním z nejčastějších nádorových onemocnění. V roce 2006 bylo v naší republice zachyceno 7 801 nových případů kolorektálního karcinomu, z toho 4 573 případů u mužů a 3 228 u žen. Ještě výraznější rozdíl mezi pohlavími je patrný při srovnání standardizovaných měr incidence, kdy standardizovaná incidence u mužů je téměř dvakrát vyšší než u žen. V celoevropském měřítku jsme byli v roce 2006 ve výskytu této diagnózy u mužů na druhém místě s 94,4 novými případů na100 tisíc obyvatel za Maďarskem (106/100 000 obyvatel) a u žen na pátém místě s incidencí 46,0 případů na 100 000 obyvatel; za Švýcarskem (55,6/100 000), Norskem (51,2/100 000), Maďarskem (50,6/100 000) a Dánskem (48,0/100 000).
Kolorektální karcinom patří i k nejčastějším příčinám úmrtí na maligní onemocnění u nás, u mužů je na druhém místě za zhoubnými nádory průdušek a plic a u žen na na třetím místě za zhoubnými nádory prsu a průdušek a plic. V roce 2006 na kolorektální karcinom zemřelo 3 548, z toho 2 086 mužů a 1 462 žen. V celoevropském měřítku nás to řadí v mortalitě mužů na druhé místo s relativní mortalitou 51 případů na 100 000 obyvatel za Maďarskem (54,4/100 000) a u žen na za třetí místo spolu s Dánskem a mortalitou 24,1 případů na 100 000 za Maďarsko (26,7/100.000) a Slovensko (24,4/100 000) (6, 37).
Na etiopatogenezi nádorů oblasti GIT se podílí výživa, kouření, infekce cagA-pozitivním Helikobakterem pylori (a to zejména v případě karcinomu žaludku, u ostatních nádorů GIT není vzájemný vztah prokázán) (3,10) a v neposlední řadě samozřejmě genetické pozadí. V případě karcinomu žaludku jsou predisponujícími genetickými faktory vedoucími k zvýšenému výskytu v některých rodinnách
- mutace tumor-supresorových genů p53 a APC (gen adenomatózní polypózy tlustého střeva),
- mutace adhezních molekul E-cadherinu/CDH1,
- a předpokládá se účast amplifikace a/nebo zvýšená exprese zatím neznámého trofického faktoru (17).
V případě genetických prediskopozic při familiárního výskytu tumorů tlustého střeva rozlišujeme čtyři jednotky:
- familiární adenomatózní polypóza (mutace genu tumor-supresorového proteinu APC),
- hereditární nepolypózní kolorektální karcinom, označovaný též Lynch I (mutace 7 různých genů učastnících se udržování stability genomu),
- juvenilní polypóza (defekt DPC4 genu),
- Peutz-Jeghersův syndrom (defekt genu pro LKB1 kinázu) (11).
Klíčovou roli v etiopatogenezi kolorektálního karcinomu a nádorů GIT obecně hraje výživa (4, 16, 24), zejména nadměrná konzumace červeného masa a masných výrobků. Rybí maso působí naopak protektivně, a konzumace drůbeže není spojena se změnou míry rizika. Kromě masa samozřejmě vstupují do procesu karcinogeneze i další faktory, které působí protektivně (flavonoidy a resveratrol (20), fyzická aktivita), nebo faktory, které naopak zvyšují hadinu rizika (alkohol, kouření, obezita, diabetes mellitus) (12).
Červené maso a masné výrobky
Norat et al. (2005) provedli velkou prospektivní studii na 478 040 mužích a ženách z 10 evropských zemí a zkoumali vztah mezi nadměrnou konzumací masa a rizikem kolorektálního karcinomu. Riziko vzniku kolorektální karcinom stoupalo s nadměrnou konzumací červeného masa a masných výrobků: nejvyšší (>160 g/den) versus nejnižší příjem (<20 g/den), RR = 1,35; 95 % CI = 1,13–2,17. Z výsledků studie vyplývá, že každých 100 g červeného masa a masných výrobků zvyšuje RR na 1,55 (95 % CI = 1,19–2,02).
U karcinomů levé části tračníku a rekta bylo vzájemné propojení s nadměrnou konzumací červeného masa a masných výrobků výraznější než u karcinomu pravé části tračníku, ale tento rozdíl nebyl statisticky významný. Pokud bychom se zaměřili pouze na červené maso, uvádí výše zmiňovaná studie vzestup rizika kolerektálního karcinomu, i když ne staticky významného (RR = 1,17; 95 % CI = 0,92–1,49).
Při analýze jednotlivých červených mas byla zjištěna statisticky významná asociace
- u vepřového masa (RR = 1,18; 95 % CI = 0.95–1,48), a
- skopového masa (HR = 1,22; 95% CI = 0,96–1,55),
- ale ne u masa hovězího a telecího (HR = 1,03; 95 % CI = 0,86–1,24).
Zatímco příjem masných výrobků je spojen se statistisky významným zvýšením rizika kolorektálního karcinomu (RR nejvyšší versus nejnižší příjem = 1,42; 95 % CI = 1,09–1,86), nadměrný přísun jednotlivých skupin masných výrobků nevede ke statisticky významnému zvýšení relativního rizika (šunka RR = 1,12; 95 % CI = 0,90–1,37; slanina RR = 0,96; 95 % CI = 0,79–1,17 a ostatní masné výrobky, hlavně klobásy, párky a salámy RR = 1,05; 95 % CI = 0,84–1,32) (23).
Pozitivní vztah mezi nadměrnou konzumací červeného masa a masných výrobků uvádí i Huxley et al. (2009), kteří zpracovali data 26 kohortových studií zkoumajících vztah konzumace masa a kolorektálního karcinomu. Jejich výsledky se zásadně neliší od předchozí studie. Tato analýza uvádí u červeného masa RR nejvyšší versus nejnižší příjem = 1,21 (95 % CI = 1,13–1,29) a taktéž potvrzuje statisticky nevýznamný rozdíl rizika pro tračník RR (1,14; 95 % CI = 1,02 –1,28) a rektum (RR 1,28; 95 % CI = 1,02–1,60).
V případě masných výrobků tato studie uvádí RR nejvyšší versus nejnižší příjem = 1,19 (95 % CI = 1,12–1,27), opět bez signifikantního rozdílu mezi karcinomy tračníku (RR 1,21; 95 % CI = 1,08 –1,35) a rekta (RR 1,18; 95 % CI = 0,99–1,41) [12].
Podobných výsledků dosáhla i Larsson et al (2007), kdy metaanalýzou 15 prospektivnách studií) došli u červeného masa k RR nejvyšší versus nejnižší příjem = 1,28 (95 % CI = 1,15–1,42) a metanalýzou 14-ti prospektivních studií zabývajích se vztahem masných výrobků a kolorektálního karcinomu došli k RR 1,20 (95 % CI = 1,11–1,31) (19).
Rybí maso
Inverzní vztah mezi konzumací rybího masa a rizikem kolorektálního karcinomu prokazuje Geelen et al. (2007) analýzou 16 nezávislých kohortových studií, kdy RR nejvyšší versus nejnižší příjem = 0,88 (95 % CI = 0,78–1,00) (7). Jedrychowski et al. (2008) uvádí o něco menší protektivní vliv rybího masa (RR nejvyšší versus nejnižší příjem = 0,89, 95 % CI = 0,81–0,89) (13) a Hall et al. (2008) uvádějí ještě výraznější pokles rizika s RR = 0,60 (95 % CI = 0,40–0,91) (9).
Huxley et al. (2009) nenacházejí signifikantní snížení rizika kolorektálního karcinomu v souvislosti se zvýšenou konzumací rybího masa (RR = 0,93, 95 % CI = 0,84–1,04) (12). Žádnou asociaci mezi změnou rizika vzniku kolerektálního karcinomu uvádí Sugawara et al. (2009), kteří analyzovali data 39 498 mužů a žen registrovaných v Ohsaki National Health Insurence Cohort Study a došli k závěru, že zvýšená konzumace rybího masa nevede ke změně rizika kolorektálního karcinomu (RR = 1,07, 95 % CI = 0,78–1,46 u mužů; RR = 0,96, 95 % CI = 0,61–1,53 u žen) (33). Je však důležité uvědomit si, že v Japonsku se zvýšeně konzumují solené ryby, přičemž je prokázán vztah mezi zvýšeným příjmem soli jako takové a rizika GIT tumorů, naprosto signifikantní zvýšení rizika nacházíme u karcinomu žaludku a zvýšení rizika se předpokládá i u dalších malignit oblasti GIT (36).
Drůbeží maso
Příliš mnoho studií se zatím vztahem drůbežího masa a rizika kolorektálního karcinomu nezabývalo, obecně se má za to, že nadměrná konzumace nevede k žádnému ovlivnění hladiny rizika, což potvrzují výsledky studie Joshi et al. (2009) s RR nejvyšší versus nejnižší příjem = 0,90 (95 % CI = 0,60–1,20) (15) a podobné výsledky uvádí i Huxleay et al. (2009) RR = 0,96 (95 % CI = 0,86–1,08) (12).
Mechanismus působení
Přesný mechanismus působení nadměrné konzumace červeného masa a masných výrobků není zcela vyjasněn. Studie ukazují na účast endogenních nitroso sloučenin (NOC), např. nitrosaminy, nitrosamidy a nitrosoguanidy, jejichž vznik je stimulován nadměrným přísunem hemu obsaženém v červeném mase a masných výrobcích, které navíc obsahují vysoké koncentrace preformovaných NOC (14, 18). Ve srovnání s masem drůbežím, které obsahuje 20 nmol hemu/g, obsahuje hovězí maso 500 nmol hemu/g (31). NOC působí jako alkylační činidla, buď přímo, nebo po metabolické aktivaci cestou cytochrom P450 monooxygenázového systému. Alkylace O6 – pozice guaninu se zdá být hlavním mechanismem mutagenního působením a vede ke změně guaninové báze na adeninovou (25). Právě tyto změny byly detekovány v buňkách kolorektálního karcinomu v kodonechech 12 a 13 genu kódujícího protein ki-Ras, regulačního proteinu s GTPázovou aktivitou (2).
Jedním z možným mechanismů působení nadměrné konzumace masa jsou také heterocyklické aminy (HCA) a polycyklické aromatické uhlovodíky (PAU), jejichž nadměrná přítomnost v potravě znamená vyšší riziko vzniku kolorektálního kacinomu.
HCA vznikají jako produkty reakcí v průběhu tepelné úpravy masa za vysokých teplot, jakými jsou smažení nebo grilování na dřevěném uhlí nebo plynovém grilu. PAU se vytvářejí v pečeném a grilovaném mase a v konzervovaných masných výrobcích (34). Důležitým faktorem je taktéž polymorfismus genů kódujích enzymy metabolismu HCAs a PAUs. Cytochtom-P450 monooxygenázová izoforma 1A1 (CYP1A1) přestavuje první fázi metabolismu HCA i PAU, v druhé fázi se pak uplatňují jednak
- N-acetyltransferáza 2 (NAT2) v detoxikaci a aktivaci HCA, a
- glutathion-S-transferáza M1 (GSTM1) v detoxikaci PAU.
U pacientů s alespoň jednou variantní alelou genu CYP1A1 vedoucí ke zvýšené aktivitě tohoto enzymu, chyběním nebo sníženou aktivitou GSTM1 a zvýšenou enzymatickou aktivitou NAT2, bylo nalezeno zvýšení hladiny rizika karcinomu tlutého střevam, nikoliv však rekta. Samostatná zvýšená aktivita NAT2 nebo snížená aktivita GSTM1 není asociována se signifikantním změnou rizika vzniku CRC [31,32].
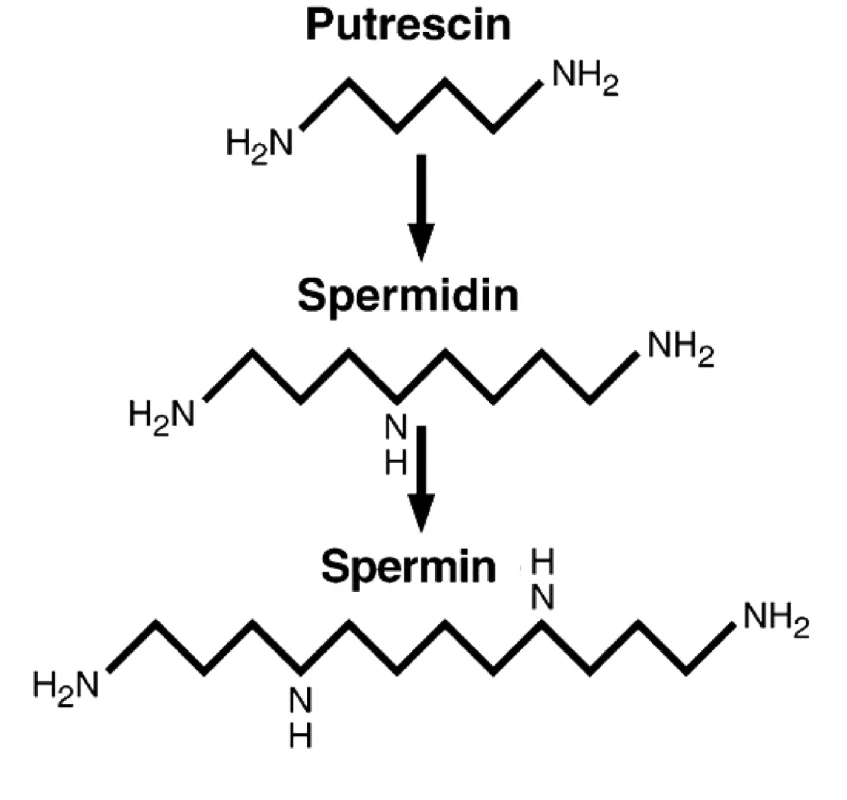
Dalším možným mechanismem působení nadměrné konzumace masa je zvýšená hladina polyaminů (putrescin, spermidin, spermin; (obr. 1). Polyaminy hrají klíčovou roli v hyperproliferaci a všech krocích vzniku CRC (20). Primární i sekundární amino skupiny polyaminů mají za fyzilogického pH kladný náboj a umožňují tak snadnou interakci s molekulamy DNA, RNA, proteinů, fosfolipidů a nukleotidtrifosfátů (35). Hlavní bilogickou funkcí těchto látek je regulace genové exprese a modulace signální transdukce (28). Pro optimální fungování buněk je důležitá přesná kontrola a regulace jejich hladin, tedy příjem z extracelulárního prostředí, syntéza, katabolismus a následné vyloučení. Nejdůležitější aminokyselinou v syntéze polymaminů je arginin (Arg), jehož hlavním zdrojem je právě maso, které představuje 37–38 % denního příjmu Arg (38).
Arginin je prekurzorem syntézy putrescinu, spermidinu a sperminu. V buňkách je Arg přeměňovan enzymem arginázou na L-ornitin, který je následně dekarboxylován enzymem ornitin-dekarboxylázou (ODC) za vzniku putrescinu. Putrescin může být za přítomnosti dekarboxylovaného S-adenosylmethioninu (DSAM) pomocí spermidin syntázy přeměněn na spermidin za současného vzniku methylthioadenosinu. Vzniklý spermidin může být dále metabolizován za přítomnosti DSAM na spermin. Spermin je pak odstraňován pomocí spermin/spermidin N1-acetyltrasferázy (SSAT) za vzniku N1-acetylsperminu, který může být následně exportován do extracelulárního prostředí, nebo může být metabolizován polyaminoxidázou za vzniku sperminu. Spermin může být metabolizován opět pomocí SSAT za vzniku N1-acetylu, který je buď odstraněn do extracelulárního prostředí, nebo opět pomocí polyaminoxidázy přeměněn na putrescin.
Schématické znázornění intracelulárního metabolismu polyaminů ukazuje obr. 2 (20).
Obr. 2. Metabolismus polyaminů (20) 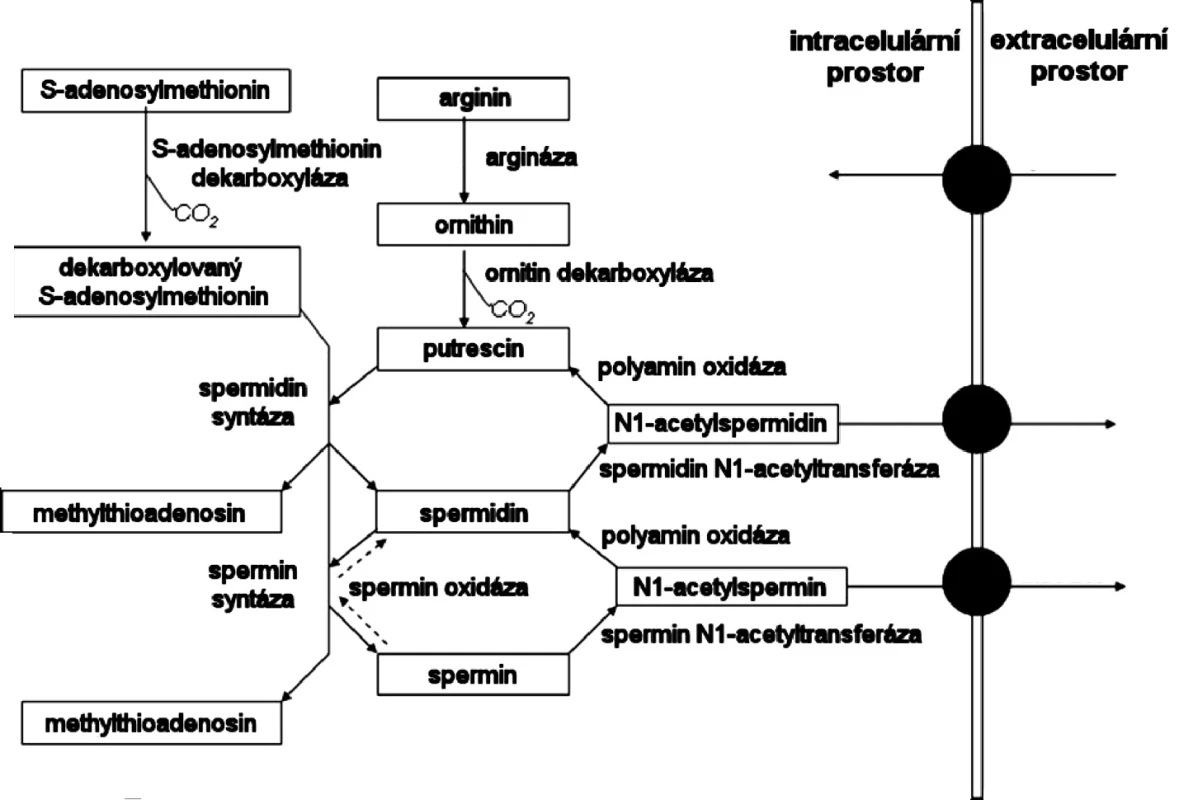
Kromě toho se u Arg ještě předpokládá karcinogenní působení cestou inducibilní NO-syntázy 2 a ostatních NO-syntáz za vzniku oxidu dusnatého (1). Na buněčných kulturách pěstovaných v arginin-deficientních médiích byla pozorována výrazná inhibice růstu transformovaných buněk, naopak využití médií obsahujících arginin vedlo ke stimulaci růstu nádorových buněk (39).
Existuje několik možných mechanismů vzestupu hladiny polyaminů v buňkách, které následně vedou k dysregulaci proliferace (8, 27).
Prvním z nich je nadměrný vstup Arg do intracelulárního prostředí.
Dalším mechanismem je upregulace syntézy polyaminů, kdy může být aktivita ODC, prvního enzymu v syntéze polyaminů, indukována nejrůznějšími onkogenetickýmy faktory, např. dysregulace GTPázy Ras a transkripčního faktoru myc vede ke konstitutivnímu zvýšení ODC aktivity (22).
V souvislosti se zvýšením aktivity ODC se jeví jako možné chemoterapeutikum jeho ireverzibilní inaktivátor difluoromethylornithin (DFMO) (29). Podobně pak může dojít k ovlivnění exprese spermin - a spermidinsyntázy a S-adenosylmethionin dekarboxylázy (enzymu zodpovědného za syntézu DSAM) (30).
Další možností vzestupu hladiny polyaminů v buňce je porucha funkce či exprese enzymů a jejich katabolismu (SSAT, PAO) a odstraňování produktů katabolismu z buněk do exracelulárního prostředí membránovými transportními proteiny (5).
Závěr
Vzhledem k prokázané souvislosti nadměrné konzumace červeného masa a masných výrobků a zvýšení míry rizika vzniku kolorektálního karcinomu, lze doporučit z hlediska primární prevence omezení konzumace červeného masa a masných výrobků, zejména uzených či jinak nevhodně tepelně upravených.
Ačkoliv existují i práce, které nepotvrzují snížení rizika v případě nadměrné konzumace rybího masa, řada studií potvrzuje snížení hladiny rizika výskytu kolorektálního karcinomu, a proto lze jeho zvýšenou konzumaci doporučit v rámci primární prevence s cílem snížení jeho nežádoucího výskytu v naší populaci.
Poděkování:
Souborné sdělení bylo vypracováno v rámci aktivit podporovaných grantem Ligy proti rakovině, Praha a výzkumným záměrem MSM 0021620808.
Michal Vočka
Ústav hygieny a epidemiologie
1. LF UK a VFN
Studničkova 7
128 00 Praha 2
E-mail: michal.vocka@lf1.cuni.cz
Zdroje
1. Ambs, S., Merriam, W.G., Bennett, W.P. et al. Frequent nitric oxide synthase-2 expression in human colon adenomas: implication for tumor angiogenesis and colon cancer progression. Cancer Res. 1998, 58, p. 334-341.
2. Bos, J.L. Ras oncogenes in human cancer: a review. Cancer Res. 1990, 50(4), p. 1352.
3. Catalano, V., Labianca, R., Beretta, G.D. et al. Gastric cancer. Crit. Rev. Oncol. Hematol. 2009, 71(2), p. 127-164.
4. Donaldson, M.S. Nutrition and cancer: a review of the evidence for an anti-cancer diet. Nutr. J. 2004, 3, p. 19.
5. Erdman, S.H., Ignatenko, N.A., Powell, M.B. et al. APC-dependent changes in expression of genes influencing polyamine metabolism, and consequences for gastrointestinal carcinogenesis, in the Min mouse. Carcinogenesis 1999, 20(9), p. 1709-1713.
6. Ferley, J., Autier, P., Boniol, M. Estimates of the cancer incidence and mortality in Europe in 2006. Ann. Oncol. 2007, 18(3), p. 581-592.
7. Geelen, A., Schouten, J.M., Kamphuis, C., et al. Fish consumption, n-3 fatty acids, and colorectal cancer: a meta-analysis of prospective cohort studies. Am. J. Epidemiol. 2007, 166(10), p. 1116-1125.
8. Gerner, E.W., Meyskens, F.L. Polyamines and cancer: old molecules, new understanding. Nat. Rev. Cancer. 2004, 4(10), p. 781-792.
9. Hall, M.N., Chavarro, J.E., Lee, I.M. et al. A 22-year prospective study of fish, n-3 fatty acid intake, and colorectal cancer risk in men. Cancer Epidemiol. Biomarkers Prev. 2008, 17(5), p. 1136-1143.
10. Hatakezama, M. Helicobacter pylori and gastric carcinogenesis. J. Gastroenterol. 2009, 44, p. 239-248.
11. Heinen, C.D. Genotype to phenotype: Analysing the effects of inherited mutations in colorectal cancer families. Mutat. Res., 2009 Sep 17. [Epub ahead of print]
12. Huxley, R.R., Ansary-Moghaddam, A., Clifton, P. et al. The impact of dietary and lifestyle risk factors on risk of colorectal cancer: A quantitative overview of the epidemiological evidence. Int. J. Cancer. 2009, 125(1), p. 171-180.
13. Jedrychowski, W., Maugeri, U., Pac, A. et al. Protective effect of fish consumption on colorectal cancer risk. Hospital-based case-control study in Eastern Europe. Ann. Nutr. Metab. 2008, 53, 3-4, p. 295-302.
14. Joosen, A.M., Kuhnle, G.G., Aspinall, S.M. et al. Effect of processed and red meat on endogenous nitrosation and DNA damage. Carcinogenesis 2009, 30, p. 1402-1407.
15. Joshi, A.D., Corral, R., Siegmund, K.D. et al. Red meat and poultry intake, polymorphisms in the nucleotide excision repair and mismatch repair pathways and colorectal cancer risk. Carcinogenesis 2009, 30(3), p. 472-479.
16. Key, T.J., Schatzkin, A., Willett, W.C. et al. Diet, nutrition and the prevention of cancer. Public Health Nutr. 2004, 7(1A), p. 187-200.
17. Khan, F.A., Shukla, A.N. Pathogenesis and treatment of gastric carcinoma: “an up-date with brief review”. J. Cancer Res. Ther. 2006, 2(4), p. 196-199.
18. Lakshmi, V.M., Nauseef, W.M., Zenser, T.V. Myeloperoxidase potentiates nitric oxide-mediated nitrosation. J. Biol. Chem. 2005, 280(3), p. 1746-1753.
19. Larsson, S.C., Wolk, A. Meat consumption and risk of colorectal cancer: a meta-analysis of prospective studies. Int. J. Cancer 2006, 119, p. 2657–2664.
20. Linsalata, M., Russo, F. Nutritional factors and polyamine metabolism in colorectal cancer. Nutrition 2008, 24(4), 382-389.
21. Murtaugh, M.A., Sweeney, C., Ma, K.N. et al. The CYP1A1 genotype may alter the association of meat consumption patterns and preparation with the risk of colorectal cancer in men and women. J. Nutr. 2005, 135, p. 179–186.
22. Nilsson, J.A., Keller, U.B., Baudino, T.A. et al. Targeting ornithine decarboxylase in Myc induced lymphomagenesis prevents tumor formation. Cancer Cell. 2005, 7, 5, p. 433-444.
23. Norat, T., Bingham, S., Ferrari, P. et al. Meat, fish, and colorectal cancer risk: the European Prospective Investigation into cancer and nutrition. J. Natl. Cancer Inst. 2005, 97(12), p. 906-916.
24. Novotný, L., Holcátová, I., Bencko V. Výživa, nádorová a kardiovaskulární onemocnění. Prakt. Lék. 2009, 89, 5, s. 230-237.
25. Safhill, R., Margison, G.P., O’Connor, P.J. Mechanisms of carcinogenesis induced by alkylating agents. Biochim. Biophys. Acta 1985, 823(2), p. 111-145.
26. Saunders, L.R., Verdin, E. Ornithine decarboxylase activity in tumor cell lines correlates with sensitivity to cell death induced by histone deacetylase inhibitors. Mol. Cancer Ther. 2006, 5(11), p. 2777-2785.
27. Seiler, N., Raul, F. Polyamines and apoptosis. J. Cell Mol. Med. 2005; 9(3), p. 623-642.
28. Shah, N., Thomas, T.J., Lewis, J.S. et al. Regulation of estrogenic and nuclear factor kappa B functions by polyamines and their role in polyamine analog-induced apoptosis of breast cancer cells. Oncogene 2001, 20(14), p. 1715-1729.
29. Shantz, L.M., Levin, V.A. Regulation of ornithine decarboxylase during oncogenic transformation: mechanisms and therapeutic potential. Amino Acids 2007, 33(2), p. 213-223.
30. Shantz, L.M., Pegg, A.E. Translational regulation of ornithine decarboxylase and other enzymes of the polyamine pathway. Int. J. Biochem. Cell Biol. 1999; 31(1), p. 107-122.
31. Schwartz, S., Ellefson, M. Quantitative fecal recovery of ingested hemoglobin-heme in blood: comparisons by HemoQuant assay with ingested meat and fish. Gastroenterology 1985, 89(1), p. 19-26.
32. Slattery, M., Samowitz, W., Ma, K. et al. Cyp1A1, cigarette smoking, and colon and rectal cancers. Am. J. Epidemiol. 2004, 160, p. 842-852.
33. Sugawara, Y., Kuriyama, S., Kakizaki, M. et al. Fish consumption and the risk of colorectal cancer: the Ohsaki Cohort Study, Br. J. Cancer 2009, 101(5), p. 849-854.
34. Sugimura, T. Nutrition and dietary carcinogens. Carcinogenesis 2000, 21, p. 387–395.
35. Thomas, T., Thomas, T.J. Polyamines in cell growth and cell death: molecular mechanisms and therapeutic applications. Cell Mol. Life Sci. 2001, 58(2), p. 244-258.
36. Tsugane, S., Sasazuki, S., Kobayashi, M., Sasaki, S. Salt and salted food intake and subsequent risk of gastric cancer among middle-aged Japanese men and women. Br. J. Cancer 2004, 90(1), p. 128-134.
37. ÚZIS. Zhoubné nádory v roce 2006 [on-line]. 2009-06 [citace 2009-11-06]. Dostupný na WWW: <http://www.uzis.cz/download.php?ctg=20&search_name=n%E1dor®ion=100&kind=21>
38. Venho, B., Voutilainen, S., Valkonen, V.P. et al. Arginine intake, blood pressure, and the incidence of acute coronary events in men: the Kuopio Ischaemic Heart Disease Risk Factor Study. Am. J. Clin. Nutr. 2002, 76, p. 359-364.
39. Yeatman, T.J, Risley, G.L., Brunson, M.E. Depletion of dietary arginine inhibits growth of metastatic tumor. Arch. Surg. 1991, 126, p. 1376-1382.
Štítky
Praktické lekárstvo pre deti a dorast Praktické lekárstvo pre dospelých
Článek Kladívkový prstČlánek Miniportréty slavných českých lékařů Profesor MUDr. František Lenoch – zakladatel naší revmatologieČlánek PROHLÁŠENÍČlánek Sence and simplicityČlánek JUBILEA
Článok vyšiel v časopisePraktický lékař
Najčítanejšie tento týždeň
2010 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Vareniklin jako pomocník v léčbě nikotinismu i u psychiatrických pacientů
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Nadměrná konzumace masa v etiopatogenezi kolorektálního karcinomu
-
Přehled vybraných vzdělávacích akcí pořádaných IPVZ v první polovině roku 2010
Informace pro účastníky – úvodní slovo ředitele IPVZ -
Evoluce a evoluční teorie pro lékaře
I. Fakt, teorie, metoda - Kladívkový prst
- Analýza studie BARI 2D – strategie revaskularizační a antidiabetické léčby nemocných s DM 2. typu a ICHS
- Karcinom prsu u žen v pokročilém věku
- Bažení po jídle: Dotazník neodolatelné chuti k jídlu
- Bakteriální kontaminace cigaret
- Zadluženost lidí s návykovými nemocemi je zdravotní i společenský problém
- Miniportréty slavných českých lékařů Profesor MUDr. František Lenoch – zakladatel naší revmatologie
- PROHLÁŠENÍ
- Populace, její zdraví a proměny
- Chůze – nejzdravější a nejpřirozenější pohyb
- Sence and simplicity
- Praktické využití léčby jasným světlem
- JUBILEA
- Praktický lékař
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Kladívkový prst
- JUBILEA
- Bažení po jídle: Dotazník neodolatelné chuti k jídlu
- Miniportréty slavných českých lékařů Profesor MUDr. František Lenoch – zakladatel naší revmatologie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy