-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Poruchy metabolismu a nutrice spojené s abúzem alkoholu
Metabolic and nutritional disorders associated with alcohol abuse
The question of nutrition in persons that abuse alcohol is very important particularly when treating diseases, whether associated with alcohol consumption or not. Factors such as absorption from the digestive tract, energetic reserves, metabolism, immunity can all influence treatment and all these factors may be influenced by food ingestion and associated habits. The importance of nutrition for patients with malignant diseases, patients requiring intensive care, for patients with impaired food intake (e.g. oesophagus stenoses, diverticles, etc.) or maladsorption (bowel resection, inflammatory bowel disease) has been known for a long time and its influence is increasingly recognised. This article outlines how alcohol abuse affects a person in terms of nutrition and physiology of digestive tract.
Keywords:
alcohol abuse – nutrition, metabolism of alcohol – endocrine effects of alcohol
Autori: I. Šmídová; J. Fiala
Pôsobisko autorov: Přednostka: prof. MUDr. Zuzana Derflerová Brázdová, DrSc. ; Lékařská fakulta ; Ústav preventivního lékařství ; Masarykova univerzita, Brno
Vyšlo v časopise: Prakt. Lék. 2013; 93(1): 26-30
Kategória: Z různých oborů
Súhrn
Problematika výživy u osob škodlivě užívajících alkohol je významná zejména při léčbě chorob ať již v přímé souvislosti s alkoholem, nebo bez souvislosti s alkoholem. Hrají zde roli takové faktory jako vstřebávání látek ze zažívacího traktu, energetické rezervy, stav metabolismu, imunita organismu. Všechny tyto aspekty mohou být ovlivněny příjmem potravy a zvyklostmi s ním spojenými. Velký význam výživy pro onkologicky nemocné, pro pacienty vyžadující intenzivní péči či pro nemocné s poruchou příjmu potravy (stenózy, divertikly jícnu apod.) nebo vstřebávání (resekce střev, zánětlivá onemocnění zažívacího ústrojí) je známý a začíná nabývat na významu. Tento článek má za úkol ukázat, jakým způsobem je ovlivněn organismus osob s abúzem alkoholu po stránce nutrice a fyziologie zažívacího traktu.
Klíčová slova:
abúzus alkoholu – výživa – metabolismus alkoholu – endokrinní působení alkoholuÚvod
Z obecného pohledu můžeme poruchy výživy rozdělit jednak na poruchy související přímo s dotčeným organismem, dalo by se říci patofyziologické, jednak na problémy vnější, mající souvislost s psychikou nebo s prostředím, v němž se organismus (pacient) nachází.
První skupinu můžeme rozdělit na poruchy pasáže, trávení a resorpce. Druhá skupina se dělí podle chybějícího substrátu v přijímané stravě na energetickou, proteinovou a smíšenou. Z hlediska závažnosti se dělí na prostou malnutrici, známou též jako podvýživa, kachexii – závažnější stav, provázený nedostatkem bílkovin – a marasmus, nejtěžší stupeň podvýživy in sensu lato (protože do těchto kategorií může spadat kterýkoliv druh podvýživy dle patofyziologického dělení, tedy například při poruše vstřebávání bílkovin může být pacient v této oblasti podvyživen, i když přísun je normální).
Způsoby diagnostiky malnutrice
Abychom mohli náležitě posoudit závažnost podvýživy, používáme nejčastěji následující vyšetření:
Klinické zhodnocení a anamnéza. Zde je cílem určení aktuálního nutričního a metabolického stavu pacienta a zjištění, zda je malnutrice způsobena snížením příjmu potravy (poruchou trávení a vstřebávání), zvýšenou energetickou potřebou nebo kombinací obojího. V anamnéze je důležitý krok určení zdravotních, dietních a sociálních rizikových faktorů. Významné klinické ukazatele vedoucí k malnutrici jsou:
- anorexie,
- dysfagie,
- průjem,
- zvracení,
- nauzea,
- změna charakteru stravy (tekutá, kašovitá, odpor k určitému druhu stravy),
- stupeň stresu (různá onemocnění, radioterapie či chemoterapie, trauma, infekce, bolest).
Pomocné metody, jejichž role je zejména v odhadu energetického příjmu, jsou semikvantitativní, založené na anamnestických údajích a patří k nim konzultace s pacientem, vážení jídla pacientem, či 24hodinový zápis příjmu potravy. Tyto metody je ovšem možné použít pouze u spolupracujícího pacienta a i tehdy jsou zatíženy nepřesností. Jejich význam pro stanovení nutričních hodnot u osob závislých na alkoholu je tedy jen ve velmi hrubých odhadech, když nelze použít žádný jiný způsob určení výživového stavu či rizikových faktorů (1).
Antropometrické metody. Využívají se k zjišťování dlouhodobého nutričního stavu, jsou vhodné ke zhodnocení účinnosti nutriční podpory či při dlouhodobém sledování pacientů s malnutricí. Nejčastěji používaná a nejsnáze zjistitelná je hmotnost pacienta. Snížení hmotnosti o více než 10 % v období 2–3 měsíců je známkou malnutrice, spojené v klinické praxi s větší morbiditou a mortalitou, zejména pooperační. Pokles o více než 25 % za totéž období má obvykle závažné klinické následky, jako jsou zvýšené riziko plicních infekcí, další zvýšení morbidity a mortality obecně, zhoršení kardiovaskulárních funkcí, nižší výkonnost dýchacích svalů. Tato rizika se samozřejmě odráží ve vyšších nákladech na zdravotní péči v případě hospitalizace. Body mass index (BMI) je další ukazatel, ale jeho význam je menší u stavů spojených s retencí tekutin, například při ascitu jakékoliv etiologie, renálním či kardiálním selhávání. Tloušťka kožní řasy a měření obvodu svalstva paže se užívají k určení tukové a svalové hmoty na nedominantní končetině. Z důvodu variability se měření provádí na několika místech. Při zadržování tekutin, poruše lymfodrenáže či výrazné obezitě jsou ovšem i tato měření jen přibližná (1). Určování svalové hmoty a extracelulární vody umožňuje měření takzvané bioimpedance. Tato metoda je založena na aproximaci buňky jako RLC článku (elektrického dipólu se složkou kapacitní, odporovou a indukční) a toho, že každý typ buňky (svalová, tuková, nervová) má jiné hodnoty jednotlivých složek. Stanovení svalové hmoty je důležité tehdy, když úbytek svalové hmoty může mít funkční důsledky (například již zmíněná výkonnost dýchacích svalů). Svalovou hmotu lze zjišťovat kromě bioimpedance také nukleární magnetickou rezonancí, CT, případně svalovou biopsií. Funkční testy – jako měření síly úchopu dynamometrem či rychlost nádechu a výdechu – jsou vhodné opět pro stanovení účinnosti nutriční podpory. Podle některých autorů (2, 3) je snížení svalové síly zjistitelné v době, kdy jsou jiné ukazatele nutričního stavu stále v mezích normy. Změny svalové funkce jsou důležité zejména pro prognózu průběhu zejména u chirurgicky ošetřovaných pacientů, pokles svalové hmoty má zase za následek obtížné odpojování od ventilátoru u pacientů s umělou plicní ventilací.
Podle National Academy of Science (World Food and Nutrition Study) je klasifikováno pět oblastí, které jsou postiženy malnutricí (4):
- kognitivní funkce,
- reakce na nemoc,
- fyzická aktivita,
- pracovní schopnost,
- reprodukční schopnost.
Biochemická vyšetření. Jedná se o sledování hladin kovů, resp. stopových prvků (Fe, P, Zn, Se, Cu, Mg) a vitaminů (A, B1, B2, B12, C, D, E), a to hlavně při dlouhodobé nutriční podpoře. Z iontů má význam hypo - a hypernatrémie, kdy snížená hladina může znamenat vyčerpání zásob energie, zvýšená hladina může signalizovat výrazný katabolismus. Hyperkalémie bývá nalézána u metabolické acidózy a současně katabolismu, hypokalémie mimo jiné při výrazném anabolismu, například urychlené krvetvorbě. Jedním z typických nálezů u malnutrice je hypokalcémie, která bývá vázána na nízkou hladinu albuminu. U pacientů s poruchami funkce jater bývá právě hypoalbuminémie a hypoproteinémie častá (5) a vyvolává otoky končetin, v souvislosti se sníženým onkotickým tlakem krve. Dalším bílkovinným ukazatelem nutričního stavu je prealbumin, protože každý stav provázený poklesem syntézy bílkovin je provázen poklesem hladin prealbuminu. Pro biologický poločas 16 hodin je vhodný pro sledování i při krátkodobé nutriční podpoře (5). Transferin je bílkovina syntetizovaná v játrech, s biologickým poločasem 8 dnů. Vzhledem k jeho malým zásobám je vhodným ukazatelem nedostatku takzvaných viscerálních bílkovin. Dalšími bílkovinami použitelnými pro posouzení nutričního stavu organismu jsou fibronektin a cholinesteráza, nicméně bývají vyšetřovány nepříliš často.
Ukazatele katabolismu bílkovin. Sem patří zejména plazmatické a močové koncentrace urey. Zvýšení plazmatické koncentrace bez poruchy renálních funkcí, případně zvýšení močového odpadu za 24 hodin, jsou známkami zvýšené katabolické aktivity. Z vyloučeného množství urey můžeme vypočítat přibližný příjem bílkovin. Přesáhne-li vyloučené množství dusíku 10 g za 24 hodin, jde o dosti jasnou známku malnutrice (5). Kritickým pro tato vyšetření je ovšem správný sběr moči, což by u nespolupracujících pacientů bez močového katétru mohl být problém. Určování dusíkové bilance je možné použít i při zjišťování nutričního stavu kriticky nemocných.
Hlavní somatické poruchy spojené s abúzem alkoholu
Somatická poškození vzniklá v důsledku abúzu alkoholu jsou nejčastěji lokalizována do zažívacího traktu, jako například karcinomy ústní dutiny, jícnu, žaludku, nádory kolorektální, zhoubné nádory jater. Dalšími následky mohou být neuropatie, alkoholická demence, která je již spíše psychiatrickou jednotkou, ale například Korsakovův syndrom je neurologické postižení, a tedy somatická porucha (1). K neurologickým postižením patří také alkoholická polyneuritida, alkoholický třes a možnost vyvolání epileptických záchvatů u disponovaných jedinců. Při opakovaném objemovém přetěžování oběhové soustavy, například u pijáků piva, může vznikat kardiomyopatie, obvykle dilatační. Ta může vyvolávat arytmie vlivem mechanických změn v převodním systému srdce. Vznik hypertenze při abúzu alkoholu je záležitost již poměrně dlouho známá, podobně jako celá paleta poruch a chorob při jaterní cirhóze. Sem patří zejména portální hypertenze způsobená v případě alkoholem vyvolané cirhózy malou uzlovou přestavbou jaterní tkáně. Portální hypertenze vyvolává jícnové varixy, podílí se i na vzniku hemoroidů. Protože většina koagulačních faktorů je syntetizována v játrech, vede těžké poškození jater také k poruše koagulace, což v kombinaci s jícnovými varixy vytváří vážné riziko vzniku krvácení do zažívacího traktu. V neposlední řadě vede jaterní cirhóza ke vzniku jaterní encefalopatie tvorbou takzvaných falešných neurotransmiterů (6). K dalším velmi vážným komplikacím patří hepatorenální syndrom, který vzniká na podkladě portální hypertenze při jaterní cirhóze. Jde o funkční selhávání ledvin, morfologicky intaktních, provázející jaterní onemocnění s portální hypertenzí. Základní příčina je farmakologicky neřešitelná, jedinou možností kurativní léčby je transplantace jater (7). Nadměrná konzumace alkoholu také zhoršuje psoriázu, může u disponovaných jedinců vyvolat porfyria cutanea tarda, a zhoršuje řadu dalších kožních chorob (8).
Alkohol a jeho metabolismus
Alkohol, etylalkohol či etanol, je bezbarvá kapalina ostré, ale ve zředění příjemné vůně, jeho páry dráždí ke kašli. Jeho molekula je polární, proto se velice špatně rozpouští v nepolárních rozpouštědlech, ale například s vodou jako polárním rozpouštědlem se mísí neomezeně. Působení etanolu závisí na předchozí expozici organismu, na tělesné hmotnosti a na pohlaví konzumenta. Po požití se absorbuje ze žaludku a poté z tenkého střeva v nezměněné podobě. Lidský organismus nedokáže etanol skladovat, a proto se všechen metabolizuje. V malých dávkách etanol krátkodobě způsobuje euforii a pocit uvolnění, ve větších může vyvolávat deprese, ztrátu koordinace balistických pohybů těla (působením na mozeček), snížení vnímavosti, prodloužení reakčního času a útlum rozumových schopností, případně i agresivitu (8). Mnohem významnější vliv na lidské tělo a psychiku má jeho metabolit, acetaldehyd, který v těle vzniká působením enzymu alkoholdehydrogenázy a který atakuje zejména proteiny obsahující thiolové skupiny (-SH). Teprve působením acetaldehyddehydrogenázy se acetaldehyd pomalu v těle odbourává až na neškodnou kyselinu octovou. Při dlouhodobém užívání alkoholu byl prokázán i karcinogenní účinek acetaldehydu (1).
Hlavní cesta metabolického zpracování alkoholu je přes enzym alkoholdehydrogenázu (ADH). Jde o cytoplazmatický enzym závislý na přítomnosti iontu Zn2+, který oxidací přeměňuje alkohol na výše zmíněný acetaldehyd. Tento enzymatický systém není inducibilní a jeho rychlost zpracování etanolu je konstantní, a to asi 4 mmol/h. Jedním z jeho omezení je nezbytnost přítomnosti nikotinamidadenindinukleotidu (NAD+) jakožto přenašeče elektronů, jehož nedostatek je jedním z hlavních omezení v průběhu této metabolické dráhy. Další metabolickou cestou je mikrozomální etanol oxidující systém (MEOS). Jde o adaptivní mechanismus, který se uplatňuje zejména u chronického užívání alkoholu a metabolizuje kolem 50 % požitého alkoholu., zatímco za normálního stavu se uplatňuje jen asi z 10–15 %. Ke své činnosti potřebuje MEOS kofaktor NADPH a je jedním z enzymů cytochromu P450. Účastní se metabolismu i řady jiných látek, například aromatických uhlovodíků (9). Protože je inducibilní, dochází u chronických konzumentů alkoholu ke zrychlené metabolizaci i u látek, které jsou pro organismus důležité, například vitaminu D či retinolu. Při časté aktivaci tohoto systému se zmnožuje endoplazmatické retikulum, v němž se cytochrom nachází. Tato metabolická cesta se uplatňuje při saturaci ADH, resp. depleci NAD+. Katalázové (CAT) odbourávání alkoholu je méně významná metabolická cesta, protože její kapacita je omezena malým množstvím peroxidu vodíku, který je pro ni nezbytný a k dispozici. Kataláza se nachází v peroxizomech, které jsou i v CNS. Neoxidativní odbourávání alkoholu je co do kapacity nejméně významná metabolická dráha, kterou alkohol v lidském těle prochází. Jde o reakci alkoholu s mastnými kyselinami, při níž vznikají etylované deriváty (estery) mastných kyselin, které poškozují slinivku a játra. Chemické rovnice prvních tří metabolických drah alkoholu ukazuje tabulka 1 (10).
Tab. 1. Oxidační cesty metabolismu etanolu 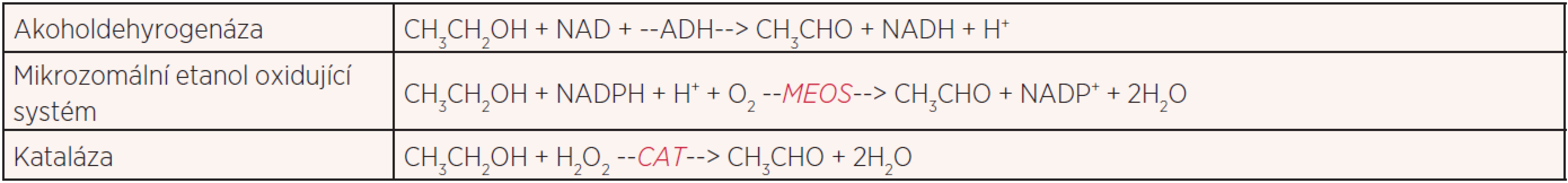
Jak je z tabulky 1 patrné, všechny metabolické dráhy kromě neoxidativní esterifikace oxidují alkohol na acetaldehyd. Tato látka je zodpovědná za většinu poškození buněk i tkání, které způsobuje požívání alkoholu a jeho metabolismus. Dalším krokem metabolické dráhy alkoholu je oxidace acetaldehydu na acetát – octan. Katalyzuje ji enzym aldehyddehyrogenáza. Tento enzym a jeho izoenzymy se vyskytují v játrech a v dalších tkáních, například v těch, které musí odbourávat exogenní i endogenní aldehydy. Výsledný metabolit, octan, je v organismu používán v řadě reakcí, například při syntéze cholesterolu či mastných kyselin.
Charakteristika poruch nutrice při abúzu alkoholu
Alkohol jako energetický substrát leží svou vydatností 29,3 kJ/g zhruba v polovině mezi sacharidy (kolem 17 kJ/g) a tuky (kolem 39 kJ/g). Nicméně, v případě alkoholu a drtivé většiny alkoholických nápojů postrádá tato nutriční komponenta ostatní složky – jako vitaminy, bílkoviny, většinou i minerály a tuky. Pivo i víno sice obsahují sacharidovou složku, pivo pak vitaminy kvasné řady (11), víno zase flavonoidy, ale například bílkovin je v pivě asi 3–5 g/l, což je velmi málo, jde-li o hlavní složku potravy. Je tedy zřejmé, že ani velké množství alkoholických nápojů nemůže pokrýt výživové požadavky lidského organismu, i když energetickou potřebu by pokrýt stačilo. Při metabolickém zpracovávání alkoholu cestou oxidativních reakcí vzniká jednak nadbytek acetaldehydu a při jeho dehydrogenaci, tedy také oxidativním odbouráváním, se vytváří množství NADH redukovaného NAD. Zvýšená hladina NADH inhibuje enzymy podílející se na glukoneogenezi. Tím vzniká přebytek laktátu, který je hlavním substrátem pro glukoneogenezi. To má dva následky:
- glukoneogeneze probíhá méně intenzivně, než je potřeba organismu,
- vzniká metabolická acidóza z přebytku laktátu.
Narušení fyziologického průběhu glukoneogeneze vede k náchylnosti k hypoglykémii. Je zmiňována i porucha mitochondriálního energetického metabolismu a snížení tvorby NAD+ (9). Inhibice glykolýzy vlivem nadměrné koncentrace NADH vede v konečném důsledku ke stimulaci ketogeneze a hromadění β-hydroxybutyrátu a acetacetátu. Zvýšená ketogeneze zhoršuje acidózu, kterou při hepatálním postižení dále prohlubuje snížená schopnost jater produkovat amoniak, a tím upravovat acidobázickou rovnováhu, jak je tomu u zdravých jedinců (12).
Oxidativní metabolismus alkoholu, vytvářející nejprve nadbytek acetaldehydu a následně, po oxidaci v mitochondriích na acetát, má jako následek nejprve spotřebu oxidovaného NAD+ za současného zvyšování podílu redukované formy, tedy NADH. Nepříznivý poměr NAD+/NADH má vliv na metabolismus pyruvátu, urátu a mastných kyselin. Klesá oxidace mastných kyselin, ty se pak v buňce hromadí a zvyšuje se tvorba triacylglycerolů jako projev zvýšené esterifikace mastných kyselin. Jako vedlejší produkt MEOS při jeho zvýšené aktivitě je vyšší produkce kyslíkových radikálů, která způsobuje narušování buněčné membrány peroxidací jejích lipidů (10). Narušením metabolismu pyruvátu je snížena také tvorba ATP jako hlavního energetického substrátu, protože citrátový cyklus, základní energetický cyklus buňky, neprobíhá tak, jak by bylo pro funkci buňky zapotřebí.
Specifickou roli v tomto procesu mají také tkáňové mikrofágy v játrech – Kupferovy buňky. Ve zdravých játrech pomáhají udržovat sníženou proliferaci jaterních perivaskulárních mezenchymálních buněk a snižují syntézu kolagenu. V poškozených játrech Kupferovy buňky produkují cytokiny, chemokiny a růstové faktory. Patří k nim zejména interleukin-1 a -6 (IL-1, IL-6), tumor necrosis faktor alfa (TNF-α) a onkostatin M (OSM). Kupferovy buňky se podílejí i na dalších procesech při alkoholickém poškození jater tím, že indukují enzym CYP2E1 v hepatocytech. Tento enzym metabolizuje etanol na aldehyd za tvorby škodlivých kyslíkových radikálů. Další významnou látkou vznikající v Kupferových buňkách je TGF-β1 (transforming growth factor beta 1) který je jedním z nejvýznamnějších profibrogenních cytokinů. Vysoké hladiny TGF-β1 jsou udržovány autokrinně a parakrinně. Jiné cytokiny jako IL-8, Colony Stimulating Factor 1, Monocyte Chemoatractant Protein 1 a látky ze skupiny leukotrienů, přitahují neutrofily a monocyty, jejichž produkty – cytokiny a růstové faktory – udržují fibrotický proces v chodu. I hepatocyty jsou významnými producenty kyslíkových radikálů, které parakrinním mechanismem stimulují jaterní perivaskulární mezenchymální buňky. Aktivita kyslíkových radikálů je tím větší, že v poškozených játrech je nedostatek antioxidantů, jako je například glutation (13). Oxidační stres je jedna z cest aktivace hlavního regulátoru zánětu – nukleárního faktoru kappa B. Ten pak vyvolává derepresi genů kódujících aktivátory imunitní reakce, jako jsou IL-1, IL-6 či (TNF-α). Vlivem těchto prozánětlivých cytokinů se aktivují i T - a B-lymfocyty, které mohou přispívat do celkového obrazu celkové zánětlivé odpovědi (14).
Je-li nadměrná konzumace alkoholu chronická, přecházejí do chronicity i ostatní zánětlivé procesy, a vzniká tak chronický systémový zánět, který je sám o sobě silným katabolickým impulzem. U systémové formy zánětu dochází díky zvýšené hladině (TNF-α) ke katabolismu bílkovin kosterního svalstva, i když jsou proteiny v dostatečné míře zastoupeny v potravě.
Kromě systémové formy zánětu vyvolává chronický abúzus alkoholu i záněty v gastrointestinálním traktu. Opakovaným drážděním žaludeční sliznice alkoholem, většinou po řadu let, přechází akutní gastritida do chronické formy (5). Kolonizace žaludeční sliznice bakterií Helicobacter pylori a chronická či atrofická gastritida jsou jedny z nejčastějších příčin vzniku karcinomu žaludku. Poškození slinivky břišní je u dlouhodobého abúzu alkoholu téměř kauzální (1). Alkohol jednak přímo poškozuje tkáň slinivky, ale hlavně zvyšuje výdej enzymů prostřednictvím chemoreceptorů, protože kyselý obsah žaludku zvyšuje tvorbu cholecystokininu a sekretinu, které dále stimulují vylučování pankreatických enzymů (lipáz) (5). V případě obstrukce žlučových cest nebo stagnace obsahu ve vývodných cestách pankreatických může dojít k předčasné aktivaci pankreatických enzymů, z nichž některé jsou aktivovány žlučí (pankreatická lipáza), jiné enterokinázou (trypsin, který pak aktivuje ostatní enzymy). Při karenci bílkovin klesá schopnost enterocytů vstřebávat bílkoviny, pravděpodobně jako reakce na nedostatek substrátu pro proteolytické enzymy (12). Také klesá aktivita kartáčového lemu na luminální straně enterocytů a výsledný efekt je snížené vstřebávání živin jednak z důvodu snížené aktivity povrchu enterocytů a jednak kvůli snížené možnosti pronikání větších bílkovin přes glykokalyx. Při abúzu alkoholu je tlusté střevo postiženo mimo jiné slizniční atrofií a dalším rizikem je několikanásobné zvýšení rizika vzniku nádorového onemocnění, většinou maligního. Za významné lze považovat to, že zvýšení rizika vzniku nádorového onemocnění je bezprahové, tzn., že prakticky jakákoliv konzumace alkoholu zvyšuje riziko nádorového onemocnění. Jde nejen o nádory tlustého střeva, ale i o nádory dutiny ústní, jícnu, konečníku a jater (1). Další nepřímý vliv abúzu alkoholu na vznik novotvarů spočívá v tom, že při stravě s nedostatkem vlákniny je větší riziko vzniku divertiklů, stagnace střevního obsahu, chronického dráždění střevní sliznice, a tím i vzniku karcinomů (16).
Dalším faktorem zhoršujícím celkovou nutriční situaci je nedostatek vitaminů, které jsou kofaktory mnoha enzymů (zejména vitaminy kvasné řady – B), případně působí jako antioxidanty (lipofilní vitaminy A, E a vitamin C) (11, 15). Mezi vitaminy patří i kyselina listová, která působí jako kofaktor enzymů přenášejících aktivovaný jednouhlíkový zbytek při tvorbě nukleotidů pro DNA spolu s vitaminem B12 (11). Její nedostatek může vyvolat i megaloblastickou anémii. Při atrofii žaludeční sliznice například při chronické gastritidě klesá tvorba takzvaného vnitřního faktoru, který umožňuje vstřebávání vitaminu B12 a pepsinogenu nezbytného pro vstřebávání železa. Nedostatek vitaminu B12 a kyseliny listové vede k poklesu mitotické aktivity všeobecně, což se projevuje mimo jiné na výstelce zažívacího traktu, kde dochází k oploštění slizničních řas (16).
Endokrinní působení alkoholu
Alkohol při akutní intoxikaci i při chronickém návykovém příjmu má výrazné endokrinní účinky zapadající do endokrinního obrazu stresových reakcí: Částečně jsou dány ovlivněním metabolismu hormonů v játrech, částečně přímými nebo nepřímými účinky na systém hypotalamo-hypofyzární, kůru nadledvin a zejména na varlata a CNS. Endokrinní účinky alkoholu mohou vést až k onemocněním jako pseudocushingovský syndrom u chronicky závislých na alkoholu, hypogonadismus a gynekomastie u mužů, poruchy cyklu až amenorea u žen, nebo hypotyreóza na podkladě chronické alkoholové intoxikace. Alkohol navíc působí v některých tkáních jako hormon: Alterací membrán může vyvolávat buněčné reakce (např. zvýšení obsahu cyklického adenosinmonofosfátu) bez aktivace příslušných receptorů. Jednou z charakteristik akutní i chronické intoxikace alkoholem je zvýšení hladiny prolaktinu (patrně inhibičním působením na hypotalamus), tedy jedna z typických stresových reakcí. Vztahy k endokrinnímu systému jsou patrné i z možnosti experimentálního ovlivnění spontánního příjmu alkoholu u zvířat hormonální cestou. Alkohol poškozuje endokrinní i spermatogenní funkci varlat, snižuje jejich hmotnost, zmenšuje průměr semenotvorných kanálků a objem zárodečného epitelu a způsobuje poruchy spermatogeneze. Hladina testosteronu není snížena vždy úměrně histologickým změnám, bývá však posunut poměr estrogenů k testosteronu, takže výsledkem je relativní nedostatek androgenů, a je tak dán předpoklad k rozvoji gynekomastie. Alkohol zasahuje do pulzního charakteru sekrece hypofyzárních hormonů a tento jev má zřejmý vztah k alterovanému spánkovému cyklu u osob závislých na alkoholu. Jejich mortalita při traumatech i chirurgických zákrocích je několikanásobně vyšší než u abstinentů a popsána byla i snížená adrenokortikální rezerva na chirurgický stres u těžkých chronicky závislých na alkoholu.
Při akutních intoxikacích i chronickém abúzu alkoholu vznikají poruchy v dopaminergních regulacích v centrální šedé kůře mozkové. Jejich projevem je zřejmě i výše uvedená hypersekrece prolaktinu. Alkohol dále stimuluje metabolismus noradrenalinu v mozku a jeho vliv na hypothalamus se podílí i na hypogonadismu. Abúzus alkoholu vede podle řady údajů k hyperkortikalismu. Etanol, kromě přímého ovlivnění funkcí membránových receptorů nervových buněk, může ovlivňovat i koncentrace neuroaktivních steroidů v mozku. Hypnotický účinek alkoholu je tedy zesilován zvýšenými hladinami steroidních aktivátorů GABA receptorů, což může mít přímou souvislost se závislostí účinku alkoholu na pohlaví a u žen pak ještě na fázi menstruačního cyklu (17).
Dlouhodobý příjem alkoholu vede také ke ztrátám vazopresinových a oxytocinových neuronů v hypotalamu, čímž lze vysvětlit zvýšenou potřebu tekutin i po relativně dlouhé abstinenci u některých osob závislých na alkoholu (18).
Závěr
Nutriční aspekty požívání alkoholu, zejména dlouhodobého a nadměrného, se nedotýkají jen bezprostředního stavu organismu po alkoholovém excesu nebo ztrát minerálů při zvracení, ale dotýkají se celé řady procesů v organismu až k dýchacímu řetězci v mitochondriích. Alkohol a jeho metabolity zasahují i do centrálního nervového systému, ovlivňují endokrinní systém, mohou vyvolat systémový zánět, poškodit funkci jater tak, že pak napomáhají dalšímu patologickému procesu.
Nepřímo, přes poškození žaludku vede abúzus alkoholu ke snižování mitotické aktivity v mnoha tkáních, nedostatek až chybění řady nutrietů ve stravě osob závislých na alkoholu vede k anémii, ke zvyšování oxidačního stresu buněk a v neposlední řadě k malignímu zvrhnutí.
Terapeutické možnosti jsou zejména v substituci chybějících látek. Buďto perorální, pokud to stav pacienta dovoluje, případně parenterální (19). Parenterální způsob podání je účinnější, ale je možné jej volit většinou jen při hospitalizaci ve zdravotnickém zařízení. Samozřejmě i ceny parenterálních přípravků jsou vyšší, podání vyžaduje žilní přístup a alespoň minimální zdravotní péči (20). V případě velmi vážné malnutrice a celkového oslabení organismu je možné podávání celkové parenterální výživy, která je ovšem finančně nejnáročnější. Méně nákladná je výživa nazogastrickou sondou. Tato varianta ovšem vyžaduje průchodný jícen a funkční zažívací trakt a výměnu sondy každé 3 týdny, což dále zvyšuje nákladnost péče.
Další funkce, která může být narušena dlouhodobou malnutricí, je koagulační schopnost krve. K syntéze koagulačních faktorů II, VII, IX a X je nezbytný vitamin K. Je-li srážlivost narušena pouze nedostatkem vitaminu K nebo méně závažným postižením jater, stačí dodávání vitaminu K perorálně. V případě zhoršení koagulačních funkcí krve vlivem těžké alkoholické hepatopatie může být nutná substituce koagulačních faktorů, které patří k nejnákladnějším krevním derivátům. V takových případech selhává rovněž proteosyntetická funkce jater, což vede k hypoproteinemickým otokům a ascitu.
Z hlediska nákladů tedy spektrum sahá od běžné substituce vitaminů a minerálů, většinou z oblasti volně prodejných léčiv a potravních doplňků, přes prostředky enterální výživy, ať již jako nápoje s definovaným složením, nebo tekutiny určené pro výživu sondou, až k substitučním přípravkům koagulačním či transfuzním přípravkům a směsím pro plnou parenterální výživu, jejichž cena je v řádech tisíců korun na jeden den aplikace.
Adresa pro korespondenci:
Ing. Bc. Iva Šmídová
Řípská 28, 130 00 Praha 3
e-mail: smidova.i@volny.cz
Zdroje
1. Kolektiv autorů. Merck Manual, kompendium klinické medicíny. Praha: X-Egem 1996.
2. Lüllmann H. Barevný atlas farmakologie. 2. vyd. Praha: Grada Publishing, 2001.
3. Klener P. a kol. Vnitřní lékařství. Praha: Galén 2006.
4. Fragakis AS, Thomson C. The health professional’s guide to popular dietary supplements. American Dietetic Association 2003; 526.
5. Schettler G. Repetitorium praktického lékaře, 1. čes. vyd. Praha: Galén 1995.
6. Nešpor K. Návykové chování a závislost. Praha: Portál 2000.
7. Brůha R. a kol. Jaterní encefalopatie – komplikace jaterní cirhózy. Praha: Medprint 2000.
8. Skála J. a kol. Závislost na alkoholu a jiných drogách. 1. vyd. Praha: Avicenum 1987.
9. Masopust J. Klinická biochemie. Praha: Karolinum 1998.
10. Chang R. Physical chemistry for the chemical and biological science. 3rd. ed. Sausalito, Ca: Univ. Science Books 2000.
11. Hlúbik P. Vitaminy – důležitý faktor ovlivňující zdraví, 2. část – metabolizmus hydrosolubilních vitaminů. Interní med., 2001; 3(12): 564–567.
12. Korbová L, Kohout J, Balaš V. Patofyziologie trávicího ústrojí. 1. vyd. Praha: Avicenum 1985.
13. Taimr P. Patogeneze fibrózy jater. Bulletin HPB chirurgie [online] 2002; 10(2–3) [cit. 19.3.2012]. Dostupný na: www.hpb.cz/index.php?pId=02-2-3-01
14. Heber DL. Nutritional Oncology. 2nd. ed. London: Elsevier 2006.
15. Hlúbik P. Vitaminy – důležitý faktor ovlivňující zdraví, 1. část – metabolizmus liposolubilních vitaminů. Interní med 2001; 3(11): 503–505.
16. Dolina J, Prokešová J, Kroupa R, Hep A. Prekancerózy jícnu a žaludku. Interní medicína 2007; 9(9): 392–393.
17. Hill M, Schreiber V, Stárka L. Hormony, zejména steroidní. Lékařské listy [online] 2012; 27 [cit. 23.2.2012]. Dostupný na: www.zdravi.e15.cz/clanek/priloha-lekarske-listy/hormony-zejmena-steroidni-137173
18. Nešpor K, Holeštová D, Zima T. Alkohol a poruchy minerálního a vodního hospodářství. Čes. a slov. psychiatrie 2005; 101(6): 331–332.
19. Mach I. Doplňky stravy na našem trhu. Praha: Svoboda Servis 2006.
20. Kalvach Z. a kol. Geriatrie a gerontologie. Praha: Grada Publishing 2004.
Štítky
Praktické lekárstvo pre deti a dorast Praktické lekárstvo pre dospelých
Článok vyšiel v časopisePraktický lékař
Najčítanejšie tento týždeň
2013 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
- Vareniklin jako pomocník v léčbě nikotinismu i u psychiatrických pacientů
-
Všetky články tohto čísla
- Základy kognitivní, afektivní a sociální neurovědy XXV. O štěstí – hédonický mozek
- Základní pravidla při provádění pracovnělékařských služeb ve světle zákona o specifických zdravotních službách
- Kolik dospívajících je v České republice ohroženo trvalým poškozením poznávacích funkcí v důsledku kouření marihuany?
- Přítomnost vybraných rizikových faktorů pádu u hospitalizovaných geriatrických pacientů
- Poruchy metabolismu a nutrice spojené s abúzem alkoholu
- Úvodník
- Jiří Duchoň – profesor biochemie pražské lékařské fakulty
-
Prof. MUDr. Miroslav Fára, DrSc.
*29. 7. 1923 †4. 1. 2013 - Jubilanti
- Projevy anémií v dutině ústní
- Praktický lékař
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Projevy anémií v dutině ústní
- Poruchy metabolismu a nutrice spojené s abúzem alkoholu
- Základní pravidla při provádění pracovnělékařských služeb ve světle zákona o specifických zdravotních službách
- Jubilanti
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



