-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Imunoglobulinová substituční léčba u nemocných s primárními imunodeficity
Immunoglobulin substitution therapy in patients with primary immunodeficiency
Immunoglobulin supplementation therapy represents a corner stone in the treatment of patients with disturbance of specific antibody production, which are sensitive to infectious diseases, mainly of bacterial origin. Specific treatment, way of administration, dosage and substitution interval is highly individual. The correctly guided treatment leads to significant decrease in the frequency of severe respiratory infections and probably also to deceleration of chronic changes in lung parenchyma. Numerous modulatory effects of substituted immunoglobulins on immunity and inflammatory response are proved. Nowadays the subcutaneous route of administration is often preferred to intravenous one. Either pumps ordirect rapid push method are used for immunoglobulin administration. Both methods of administration are comparable regarding their efficacy. Better comfort for patients is achieved with subcutaneous supplementation in their homes with low frequency of side effects in addition. The adverse events are only local and mild.
Keywords:
primary immunodeficiency – substitution – immunoglobulins
Autori: P. Králíčková; I. Krčmová; J. Krejsek
Pôsobisko autorov: Přednosta: prof. RNDr. Jan Krejsek, CSc. ; Lékařská fakulta a Fakultní nemocnice v Hradci Králové ; ÚSTAV KLINICKÉ IMUNOLOGIE A ALERGOLOGIE ; Univerzita Karlova v Praze
Vyšlo v časopise: Prakt. Lék. 2014; 94(1): 10-15
Kategória: Přehledy
Súhrn
Substituční léčba imunoglobuliny představuje základní léčebnou modalitu pro nemocné s poruchou tvorby specifických protilátek, kteří jsou nadměrně vnímaví k infekčním onemocněním, převážně bakteriálního původu. Konkrétní volba způsobu léčby, dávka i interval jednotlivých podání jsou vysoce individuální. Správně vedená léčba vede k významnému snížení frekvence závažných infekcí dýchacích cest a pravděpodobně i zpomaluje progresi chronických změn plicního parenchymu. Léčebně podávané imunoglobuliny vykazují řadu modulačních účinků na imunitní systém jako celek. Kromě klasického podávání intravenózního je stále více využíváno podávání podkožní, ať již pomocí infuzní pumpy, či přímou metodikou rapid push. Všechny tyto způsoby mají srovnatelnou účinnost. Subkutánní podávání je spojeno s komfortem domácího podávání za současné nízké frekvence nežádoucích účinků, prakticky pouze lokálního charakteru mírného stupně.
Klíčová slova:
primární imunodeficience – substituce – imunogobulinyÚVOD A HISTORICKÝ VÝVOJ SUBSTITUČNÍ IMUNOGLOBULINOVÉ LÉČBY
Jako imunodeficience se označují stavy charakterizované zvýšenou vnímavostí k infekcím. Podle příčiny se dělí na primární (vrozené) a sekundární, získané v průběhu života, způsobené onemocněním jiného orgánového systému či vnějšími vlivy, především terapeutickými zásahy. Jedná se o heterogenní skupinu onemocnění, které jsou často provázeny poruchou tvorby protilátek. Substituční léčba imunoglobuliny pak představuje základní léčebnou modalitu pro ty nemocné, u kterých byla prokázána porucha tvorby specifických protilátek, a jsou tak nadměrně vnímaví zejména k infekcím bakteriálního původu.
Historicky první podání imunoglobulinů se substitučním záměrem proběhlo v roce 1952 pod vedením C. O. Brutona. Zajímavostí je, že se jednalo o podkožní aplikaci. Osmiletý chlapec s agamaglobulinémií byl léčen dávkou 3,2 g imunoglobulinů měsíčně a po celý rok neprodělal závažnější infekci (6).
Od té doby substituční léčba imunoglobuliny prošla řadou radikálních změn. Intramuskulární podávání v padesátých až sedmdesátých letech 20. století bylo provázeno v řadě případů nežádoucími, místními i celkovými reakcemi, vznikajících mimo jiné i v důsledku zvýšené tvorby agregátů IgG. Aplikace byla významně limitována omezeným objemem, který bylo možné podat. Typická dávka činila 100 mg/kg každé 3 týdny.
Od osmdesátých let bylo možné začít využívat intravenózní imunoglobulinové infuze (IVIG), které byly provázeny významně nižším procentem nežádoucích reakcí. Původní doporučení substituční dávky imunoglobulinů 100 mg/kg/měsíc bylo na základě klinických studií navýšeno na více než 400 mg/kg/měsíc (9), což umožnilo dosáhnout vyšších sérových hladin IgG při současném dalším významném poklesu frekvence infekcí.
Myšlenka podkožního podávání imunoglobulinů byla rozvíjena od devadesátých let, kdy s dobrými výsledky Gardulf et al. podával v rychlé podkožní infúzi (17–20 ml/hodinu) 16 % preparát původně určený k intramuskulárnímu podání (13). Dokonce při dalším navýšení rychlosti na 40 ml/hodinu nebylo pozorováno zvýšení frekvence nežádoucích účinků (16). K zásadnímu zlomu došlo o 10 let později ve chvíli, kdy byl vyroben a klinicky úspěšně vyzkoušen imunoglobulinový preparát určený cíleně k podkožnímu podání (SCIG) v podobě, jaké používáme dnes v běžné klinické praxi. Těsně před uvedením do běžné klinické praxe stojí s.c. podání imunoglobulinů potencované využitím rekombinantní hyaluronidázy, a umožňující tak podkožní podání větších objemů zahrnující plánovanou dávku pro celý měsíc v jednom sezení (36).
FUNKCE A MECHANIsMUS ÚČINKU PROTILÁTEK
Mezi hlavní funkce protilátek v imunitním systému patří jejich schopnost neutralizační a opsonizační. Dále jsou schopny aktivovat komplement a spoluúčastnit se procesu indukce apoptózy. Hlavním účelem imunoglobulinové substituční terapie je prevence opakujících se infekčních onemocnění s následným zmírněním orgánového poškození, především pozánětlivých změn plicního parenchymu (21, 23, 25).
Efekt imunoglobulinů však nelze zúžit pouze na substituční. Cílové účinky jsou pak úzce spjaty s výší podané dávky. Podávané protilátky působí významně imunomodulačně. Jejich protizánětlivé účinky jsou způsobeny ovlivněním idiotypové-antiidiotypové sítě, inhibicí C3a složky komplementu a vychytáváním C3b složky komplementu. Dále modulují cytokinovou odpověď, neboť imunoglobuliny obsahují i protilátky proti cytokinům či silným buněčným aktivátorům – tzv. superantigenům (20). Toto je využíváno zejména v léčbě autoimunitních onemocnění, kde se přímo uplatňuje down regulace produkce autoprotilátek B-lymfocyty, kdy přemostění receptoru Fcγ RIIb a receptoru pro antigen na B-lymfocytech BCR inhibuje proliferaci a pravděpodobně indukuje i apoptózu B-lymfocytů. Přítomnost nadměrného množství protilátek v organismu, které se vážou na Fcγ receptory na různých buňkách, vede dále zpětnovazebně k indukci zvýšené exprese inhibičních receptorů (3). Jako modelové autoimunitní onemocnění, kde je metodou volby použití vysokých dávek imunoglobulinů, může sloužit např. idopatická trombocytopenická purpura či syndrom Guillaina-Barrého. Zde hovoříme o vysokých dávkách 1–2 g IgG na kg váhy (11).
U nemocných s poruchou tvorby specifických protilátek, zejména u nemocných s běžnou variabilní imunodeficiencí, byla popsána při použití běžného substitučního dávkování řada modulačních změn. IVIG indukuje proliferaci a syntézu protilátek B-lymfocyty, což poukazuje na možnost, že externě dodané imunoglobuliny napravují signalizační defekt B-lymfocytů, který běžně poskytují T-lymfocyty. Dále bylo popsáno zlepšení maturace dendritických buněk, aniž by převažoval jejich prozánětlivý fenotyp (10). K prozánětlivým účinkům IVIG přispívá i možnost snížené exprese TNF (31) a zvýšení podílu CD4+ T-lymfocytů a T-regulačních lymfocytů (19) (obr. 1).
Obr. 1. Modulační mechanismy i.v. podávání imunoglobulinů u nemocných s primárními imunodeficiencemi 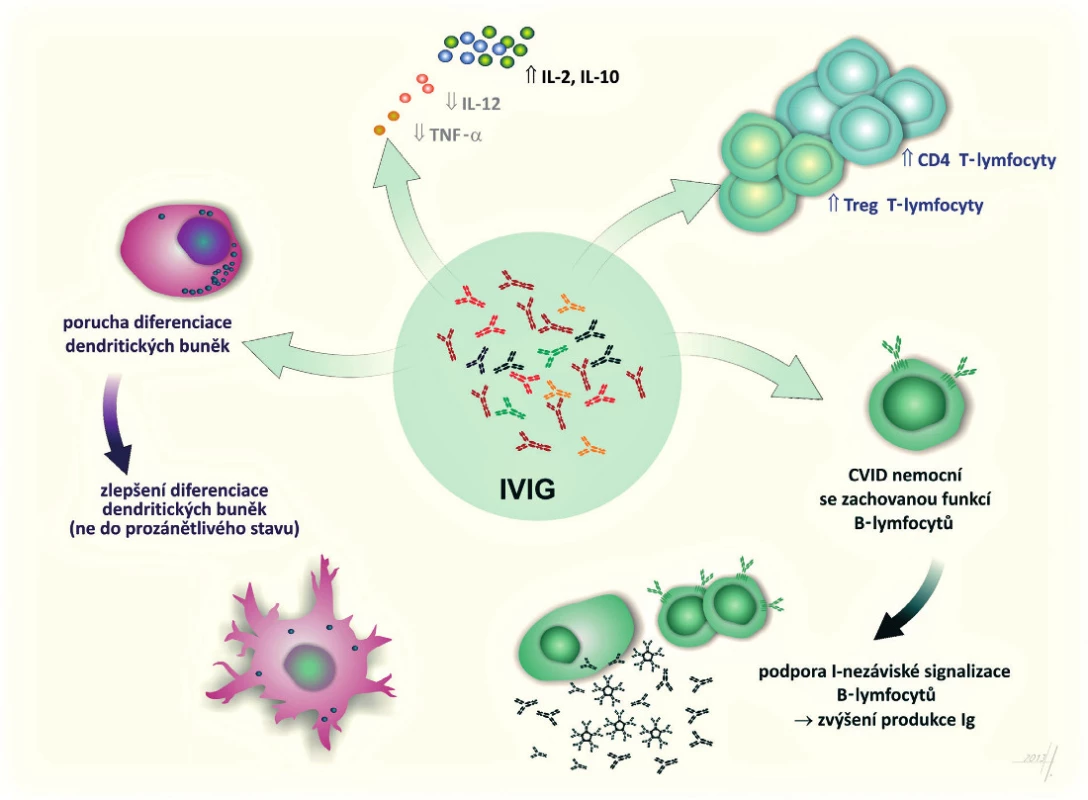
Substituční léčba primárních imunodeficiencí
Při substituční léčbě nemocných s primárními imunodeficiencemi je v současné době doporučován ryze individuální koncept optimalizace cesty, dávky i intervalu jednotlivých podání. Rozhodnutí lékaře o zahájení substituční léčby je pak výsledkem zohlednění nejen sérových hladin IgG, počtu a závažnosti jednotlivých infekcí, ale v neposlední řadě i ozřejmění schopnosti tvorby specifických protilátek. Tato schopnost je zjišťována pomocí očkování, nejčastěji za použití vakcíny proti tetanu a pneumokokům. Byť neexistují jednoznačné standardy jak danou odpověď hodnotit, je obecně doporučováno považovat za dostatečnou odpověď buď normalizaci původně nízkých sérových hladin specifických protilátek, či jejich čtyřnásobný vzestup, který dostatečně dlouho přetrvává.
Sledovat vytvořené protilátky je doporučováno nejen v třídě IgG, ale je možné stanovení i dalších tříd, zejména IgA či IgM, což může specificky poukazovat na zvýšenou rizikovost infekcí, především dýchacích cest (7).
Každý nemocný má tak svoji individuální optimální dávku a interval, který významně redukuje frekvenci závažných infekčních komplikací (21). Italská studie prokázala významný protektivní vliv před vznikem pneumonie při dosažení sérové hladiny minimálně 4 g/l s tím, že není jasná korelace mezi cílovými hladinami IgG a mírou rizika pneumonie (25). Metaanalýza zahrnující celkem 17 studií s celkovým počtem nemocných 676 a obdobím sledování 2127 pacientských let prokázala, že zvýšení hladiny IgG o 1,21 g/l (což přibližně odpovídá dávce i.v. 100 mg/kg/měsíc), vede ke snížení výskytu pneumonií o 27 %. Při cílové hladině IgG 10 g/l v porovnání s 5 g/l dochází k pětinásobnému poklesu výskytu zápalů plic (24). Zatím chybí dostatek informací ke zhodnocení SCIG. Nicméně, i zde první metaanalýza provedená J. S. Orangem et al., zahrnující celkem 13 studií, potvrzuje fakt, že i zvýšení subkutánně podané dávky Ig vede k dalšímu zlepšení léčebných výsledků. Zdá se však, že zejména v důsledku snížené biologické dostupnosti SCIG je zvýšení dávky Ig o 100 mg/kg/měsíc provázeno zvýšením sérové hladiny IgG pouze o 0,84 g/l. Nejsou dostatečně dostupná data, která by porovnávala mezi sebou preparáty o koncentraci 10, 16 a 20 % (23).
Substituční léčba má však i svoje limitace. Nepodařilo se zatím bohužel přesvědčivě dokázat, že významně snižuje i frekvenci infekcí horních cest dýchacích a že zabraňuje progresi funkčních a morfologických změn plicního parenchymu a dýchacích cest. Stejně tak nebyl prokázán u nemocných s běžnou variabilní imunodeficiencí pozitivní vliv na komplikace neinfekčního původu, především postižení zažívacího traktu, které může vést až k těžkému malabsorpčnímu syndromu či postižení plicního intersticia charakteru lymfocytárně-granulomatózní pneumonitidy vedoucí k respirační insuficienci. V obou případech je nezbytné sáhnout k imunosupresivní léčbě (2, 8).
IVIG – praktické aspekty
Při zahájení substituční léčby imunoglobuliny je obecně doporučována léčená dávka 400–800 mg/kg měsíčně. Nitrožilní podávání je prováděno v denních stacionářích nemocničních zařízení v intervalu obvykle 3–4 týdnů (tento interval vychází z biologického poločasu imunoglobulinů obecně).
Intravenózní podávání může být spojeno s řadou nežádoucích účinků. Jedná se o celé spektrum od lehkých projevů typu zimnice, bolestí hlavy, svalů, kloubů, únavy či horečky (obvykle mizejících maximálně do několika hodin po podání) až po vystupňovanou těžkou anafylaktoidní reakci provázenou těžkou hypotenzí. Většina nežádoucích reakcí je spojena s aktivací prozánětlivé odpovědi, především cestou komplementu. Jednoznačně rizikovou skupinou jsou nemocní s anti IgA protilátkami třídy IgG (17). Nicméně k závažné reakci může dojít i v jejich nepřítomnosti.
Za rizikové situace považujeme zahájení substituční léčby, prodloužený interval mezi infuzemi či situaci, kdy nemocný prodělává infekční epizodu. Velmi nepříznivě působí i změna podávaného preparátu. Již v roce 1999 vydala FDA závazné doporučení, kdy je nezbytné na jednotlivé imunoglobulinové preparáty pohlížet jako na originální přípravky, a nelze tedy s nimi zacházet jako s generiky a zaměňovat je bez závažného důvodu (12). Nemocný má tak svoji optimální individuální rychlost podání či toleruje pouze jeden konkrétní preparát. Pokud přes veškerá opatření nežádoucí reakce i nadále přetrvávají, je možná premedikace nesteroidními antirevmatiky, antihistaminiky či kortikoidy. V případě opakované intolerance i.v. preparátů je indikováno převedení na podkožní cestu substituce.
Vzácnější bývají závažné komplikace trombembolické, renální insuficience, zhoršení projevů kardiální dekompenzace, syndrom aseptické meningitidy či hemolytická anémie. Při léčbě moderními preparáty se s nimi setkáváme jen velmi výjimečně. První tři jmenované bývají spojeny s komplikujícími interními onemocněními. Renální insuficience bývá někdy spojována s pomocnými látkami v preparátu, např. sacharózou, maltózou. Syndrom aseptické meningitidy se objevuje v časovém rozmezí od několika hodin až po 2 dny po zahájení léčby IVIG. Vyšetření mozkomíšního moku často vykazuje pleiocytózu o hodnotách několik tisíc buněk na mm3, zejména z granulocytární řady a zvýšené hladiny proteinů až na několik set mg/dl. Tato komplikace byla četněji zaznamenána po použití vysokých dávek imunoglobulinů (2 g/kg).
Z ryze praktických důvodů je vhodné upozornit, že po aplikaci imunoglobulinů v krvi pacienta dochází k přechodnému vzestupu pasivně přenesených dárcovských protilátek, a tím ke vzniku zavádějících pozitivních výsledků u řady sérologických testů. Pasivní přenos protilátek proti erytrocytárním antigenům, např. A, B, D může vést k falešné pozitivitě přímého antiglobulinového testu (přímý Coombsův test).
Specifickou kapitolu pak představuje vakcinace nemocných s protilátkovými imunodeficiencemi léčených substituční léčbou obecně. Z povahy základního onemocnění vyplývá, že schopnost tvorby specifických protilátek u těchto nemocných je významně omezena. To znamená, že provedená vakcinace obvykle nevede k protektivní odpovědi organismu. V některých případech se sice jistá odpověď objeví, nicméně pouze na omezenou dobu či jen na některé typy vakcín (14, 27). Důležitou podmínkou, i když ne jedinou, pro řádnou odpověď je dostatečný počet IgM pozitivních paměťových B-lymfocytů (14). Limitujícím pro hodnocení vakcinační odpovědi u substituovaných nemocných je přítomnost dárcovských protilátek, která může v čase kolísat. Očkování tedy standardně využíváme v období diagnózy humorálního imunodeficitu. Pravidelné očkování nemocných je stále diskutováno, zejména pak očkování proti sezonní chřipce či hepatitidě B. Názory odborníků se různí. V České republice se tito nemocní obvykle pravidelně neočkují. I když nejsou dostupné validní údaje o množství specifických protilátek proti jednotlivým onemocněním v imunoglobulinových preparátech, je obecně přijímáno, že je ve většině případů dostatečné. Jejich koncentrace však závisí na spektru specifických protilátek dárců a výrobních postupech. Prakticky u všech nemocných s řádně vedenou substituční léčbou je dosažena zcela normální hladina protilátek proti tetanu. Pokud není porušena tvorba protilátek a imunoglobuliny jsou podávány z jiné indikace, pak platí, že snížení vakcinační odpovědi na živé vakcíny trvá obvykle po 3 měsíce od ukončení jejich aplikace. U spalniček tomu může být až 1 rok. Očkování živými vakcínami u nemocných s primárními humorálními imunodeficiencemi (nikoliv kombinovanými buněčnými a protilátkovými) není nebezpečné. Výjimku tvořilo očkování proti dětské obrně. V současné době při používání rekombinantní vakcíny již riziko rozvoje echovirové encefalitidy nehrozí.
SCIG – PRAKTICKÉ ASPEKTY
Dalším možným způsobem substituční léčby je podkožní podávání. U nových nemocných se i zde snažíme dodržet dávkovací schéma 400–800 mg/kg měsíc, kdy je dávka dle tolerance a ochoty nemocného podávaná v intervalech 1–3krát týdně. K rychlejšímu dosažení cílové hladiny IgG je v úvodu doporučována tzv. loading fáze, kdy je podáno minimálně 200 mg/kg rozděleně do několika dní.
Pokud nemocného převádíme z IVIG na SCIG, pak se evropská a americká doporučení vzájemně liší. Zatímco je v Evropě nejčastěji doporučováno zachovat poměr 1 : 1, americká doporučení vycházejí z doporučení FDA, zohledňující AUC bioekvivalenci (definováno jako celková expozice IgG měřeno plochou pod křivkou v čase), a naopak doporučují dávku navýšit 1,37krát pro 16% preparáty a 1,53krát pro 20% IgG produkty (4). Existují však i práce tento fakt nepotvrzující (35). Klinické zkušenosti ukazují na to, že poměrem 1 : 1 dosáhneme stejných či mírně vyšších sérových hladin IgG při současné klinicky významné redukci počtu a závažnosti infekcí, která se neliší od i.v. cesty substituce (1, 30, 32). Na možné důsledky nižší biologické dostupnosti je zatím nutné vyčkat.
Subkutánní substituce imunoglobulinů představuje pro naše nemocné možnost komfortního podávání v domácím prostředí, zatíženého významně nižším procentem nežádoucích reakcí v porovnání s nitrožilním při současném evidentním vzestupu kvality života (1, 22). Nižší výskyt nežádoucích reakcí může být vysvětlován pomalou difúzí z podkoží přes lymfatický systém do krevního řečiště. A tak často nemocní, kteří vyžadovali premedikaci před IVIG, nevyžadují žádných speciálních opatření před SCIG. Převažují zde pouze lokální reakce typu erytému, edému, indurace či bolestivosti, které ve většině případů odeznívají do 24 hodin a během týdnů obvykle mizí zcela (15, 18, 28). Celkové reakce hlášené po s.c. podání jsou velmi řídké. Závažné anafylaktické reakce nebyly doposud zaznamenány ani u nemocných s přítomným titrem anti-IgA protilátek a současnou anamnézou závažné reakce po IVIG.
Tento fakt potvrzuje i velmi zajímavá práce italských autorů, kteří se pokusili zahájit substituci subkutánními imunoglobuliny u 13 nemocných, u nichž musela být léčba IVIG ukončena pro závažnost nežádoucích reakcí, jimž nešlo předejít premedikací ani převedením na jiný preparát. Tito nemocní byli léčeni pouze dlouhodobou ATB profylaxí. U 11 z nich bylo subkutánní podání dobře tolerováno. Ve dvou případech musela být léčba přerušena pro hypotenzi a angioedém. V jednom případě se stav vyřešil záměnou komerčního preparátu (jednalo se o první podání) a ve druhém případě (po opakovaném bezproblémovém podání) nejprve snížením dávky a rychlosti podávání s postupným návratem k plánované cílové dávce. V obou případech nebyly reakce provázeny výskytem autoprotilátek třídy IgG proti IgA (26).
Na tomto místě je vhodné zdůraznit úlohu vyškolených sester, které edukují nemocné o způsobu aplikace. Úvodní obtíže lze často překonat změnou aplikačního místa či sklonem jehly tak, aby podání bylo striktně hluboko podkožně do hlubších vrstev (obr. 2).
Obr. 2. Způsob aplikace preparátu do podkoží (aplikace musí být provedena do hlubokých vrstev podkoží, ideálně do oblasti podkožního tuku) 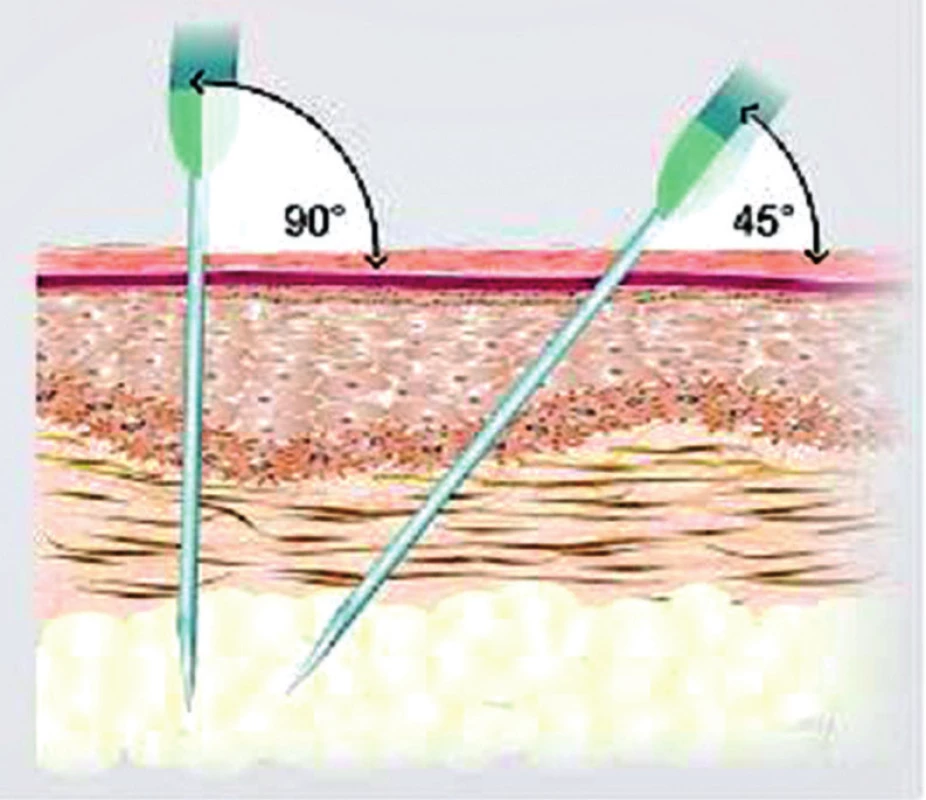
Subkutánní podávání je možné buď za pomocí infuzní pumpy či přímým podáním metodou rapid push, kdy si rychlost podávání řídí nemocný sám, dle své individuální tolerance (obr. 3, 4) (15, 29). Při podávání infuzní pumpou je doporučováno dodržovat počáteční aplikační rychlost 10 ml/hodinu, při každé následující infuzi lze rychlost zvýšit o 1 ml/hodinu. Doporučená maximální rychlost je 20 ml/hodinu na jednu pumpu. Lze použít i více pump najednou. V zahraničí jsou dostupné i vícecestné infuzní kanyly. Jednotlivá aplikační místa by měla být od sebe vzdálena minimálně 5 cm. Do jednoho místa vpichu se obvykle podává dle tolerance pacienta 5–20 ml. Aplikovat lze do podkoží břicha, stehen, paží či laterální části kyčle (obr. 5).
Obr. 3. Subkutánní podávání pomocí infuzního dávkovače 
Obr. 4. Přímé subkutánní podání metodou rapid push 
Obr. 5. Vhodná aplikační místa pro podkožní aplikaci 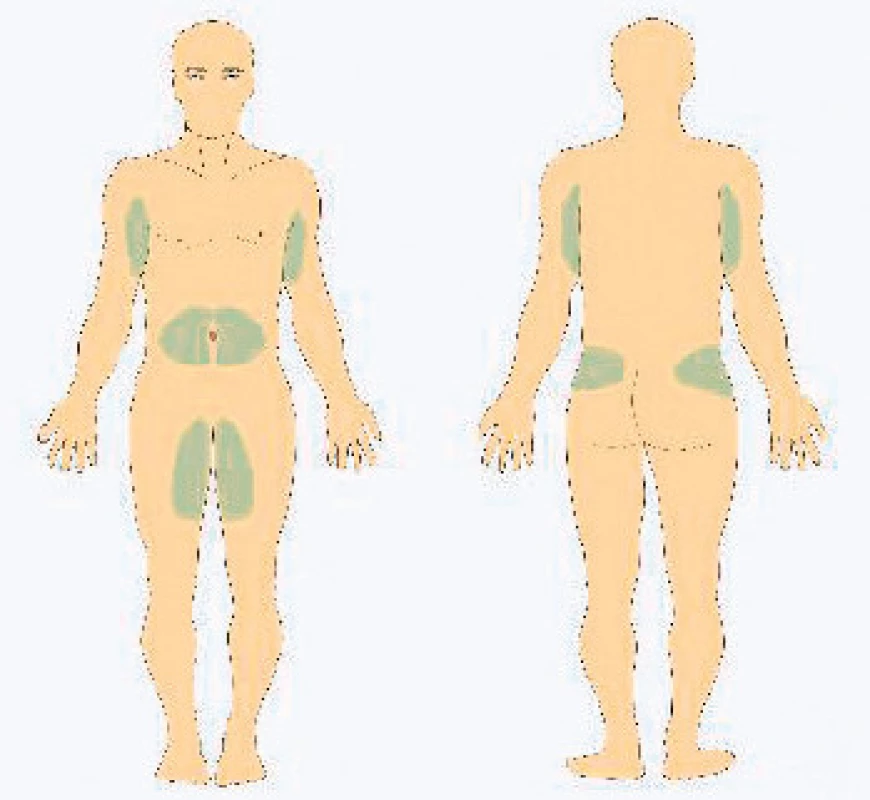
VOLBA MEZI IVIG A SCIG
Při volbě mezi i.v. a s.c. podáním je vhodné zohlednit kvalitu periferního žilního přístupu nemocného, anamnézu nežádoucích účinků po IVIG (bolesti hlavy, únava, myalgie), anamnézu aseptické meningitidy, trombembolické příhody renálního či kardiálního selhávání.
Domácí terapii často preferují mladší nemocní – studující či pracující, kteří tak mohou komfortněji cestovat, oceňují tak významnou dávku nezávislosti. Na druhé straně i.v. cestu volí častěji nemocní, kterým z různých důvodů nevyhovují časté aplikace, mající obavy z domácího podávání, z jehel obecně, nemocní s komplikovaným zdravotním stavem s vazbou na časté kontroly u svého ošetřujícího lékaře (30). IVIG je dále vhodný u nemocných s omezenou schopností spolupráce a v neposlední řadě i u nemocných s autoimunitními komplikacemi. Profit i.v. podávání podporuje v těchto případech skutečnost, že u několika nemocných po přechodu na s.c. cestu došlo k rozvoji např. trombocytopenické purpury a při opětovném přesmyku na i.v. podání bylo opětovně dosaženo remise onemocnění (34).
HYALURONIDÁZOU USNADNĚNÉ S.C. INFUZE
Podkožní extracelulární matrix (EM) představuje bariéru pro podkožně aplikované tekutiny při jejich průniku do nitrožilního prostoru. Při podkožním podání IgG je díky záchytu v EM redukována biologická dostupnost IgG do systémového oběhu minimálně o jednu třetinu. Ke kompenzaci tohoto nežádoucího jevu je zvyšována koncentrace s.c. preparátů, jsou podávány malé objemy v častých intervalech či je používáno více infuzních míst najednou. Další možností, která je v současné době zkoušena, je použití hyaluronidázy (33).
Podkožní matrix je viskózně-elastická, gelu podobná substance, která je tvořena převážně kolagenními vlákny, elastinem, keratinem a glykosaminoglykany. Posledně jmenované tvoří významnou část výše zmiňované bariéry. Přirozeným enzymem, který fragmentuje polymer kyseliny hyaluronové (základní stavební kámen glykosaminoglykanů) z gelu na tekutou formu je hyaluronidáza. Její léčebné použití umožňuje také fakt, že je velmi rychle metabolizována. Nemá tedy žádné systémové účinky a její efekt na podkoží trvá maximálně 48 hodin (5).
Aplikace probíhá prakticky tak, že je nejprve do podkoží aplikována hyaluronidáza, v zápětí pak běžný 10% imunoglobulinový preparát, který je používán k i.v. podání. Jednotlivá podání probíhají jedenkrát za 3 či 4 týdny, ve stejné dávce, jak je zvykem u klasické i.v. suplementace. Výsledky studií III. fáze prokazují vysoký stupeň bezpečnosti, tolerability a účinnosti. Bioekvivalence je srovnatelná s i.v. podáváním, doba s.c. infuze je paradoxně o něco kratší v porovnání s i.v. Celkové nežádoucí účinky byly méně četné než u i.v. a současně lokální nežádoucí účinky byly srovnatelné s klasickým s.c. podáním (36).
ZÁVĚR
Substituční léčba imunoglobuliny představuje základní léčbu nemocných s poruchou tvorby protilátek. Minimalizuje riziko pneumonie a zásadně snižuje i frekvenci infekcí obecně. Léčba musí být vysoce individualizována a vedena ve specializovaném centru. Správně vedená léčba významně zlepšuje kvalitu života a vrací řadu nemocných do plnohodnotného života.
ADRESA PRO KORESPONDENCI:
MUDr. Pavlína Králíčková
Ústav klinické imunologie a alergologie FN
Sokolská 581, 500 05 Hradec Králové
e-mail: pavlina.kralickova@fnhk.cz
Zdroje
1. Abolhassani H, Sadaghiani MS, Aghamohammadi A, et al. Home-based subcutaneous immunoglobulin versus hospital-based intravenous immunoglobulin in treatment of primary antibody deficiencies: systematic review and meta analysis. J Clin Immunol 2012; 32(6): 1180–1192.
2. Baris S, Ercan H, Cagan HH, et al. Efficacy of intravenous immunoglobulin treatment in children with common variable immunodeficiency. J Investig Allergol Clin Immunol 2011; 21(7): 514–521.
3. Bayary J, Dasgupta S, Misra N, et al. Intravenous immunoglobulin in autoimmune disorders: an insight into the immunoregulatory mechanisms. Int Immunopharmacol 2006; 6(4): 528–534.
4. Berger M. L-proline-stabilized human IgG: Privigen(R) 10% for intravenous use and Hizentra(R) 20 % for subcutaneous use. Immunotherapy 2011; 3(2): 163–176.
5. Bookbinder LH, Hofer A, Haller MF, et al. A recombinant human enzyme for enhanced interstitial transport of therapeutics. J Control Release 2006; 114(2): 230–241.
6. Bruton, OC, Apt L, Gitlin D, Janeway CA. Absence of serum gamma globulins. AMA Am J Dis Child 1952; 84(5): 632–636.
7. Cavaliere FM, Milito C, Martini H, et al. Quantification of IgM and IgA anti-pneumococcal capsular polysaccharides by a new ELISA assay: a valuable diagnostic and prognostic tool for common variable immunodeficiency. J Clin Immunol 2013; 33(4): 838–846.
8. de Gracia J, Vendrell M, Alvarez A, et al. Immunoglobulin therapy to control lung damage in patients with common variable immunodeficiency. Int Immunopharmacol 2004; 4(6): 745–753.
9. Eijkhout HW, van Der Meer JW, Kallenberg CG, et al. The effect of two different dosage of intravenous immunoglobulins on the incidence of recurrent infections in patients with primary hypogammaglobulinaemia – a randomized, double-blind, multicenter crossover trial. Ann Internal Med 2001; 135(3): 165–174.
10. Elluru SR, Vani J, Delignat S, et al. Modulation of human dendritic cell maturation and function by natural IgG antibodies. Autoimmun Rev 2008; 7(6): 487–490.
11. Elovaara I, Apostolski S, Van Doorn P, et al. EFNS guidelines for the use of intravenous immunoglobulin in treatment of neurological diseases: EFNS task force on the use of intravenous immunoglobulin in treatment of neurological diseases. Eur J Neurol 2008; 15(9): 893–908.
12. FDA Blood Products Advisory Commitee 62nd Meeting, Bethesda, Maryland, March 26, 1999. Transcript, Miller Reporting Company, Inc. [on-line]. Dostupné na: http://www.fda.gov/ohrms/docket(ac/99/transcpt/3504t2.pdf).
13. Gardulf A, Hammarstroem L, Smith CI. Home treatment of hypogammaglobulinaemia with subcutaneous gammaglobulin by rapid infusion. Lancet 1991; 338(8760): 162–166.
14. Goldacker S, Draeger R, Warnatz K, et al. Active vaccination in patients with common variable immunodeficiency (CVID). Clin Immunol 2007; 124(3): 294–303.
15. Hagan JB, Fasano HB, Spector S, et al. Efficacy and safety of a new 20% immunoglobulin preparation for subcutaneous administration, IgPro20, in patients with primary immunodeficiency. J Clin Immunol 2010; 30(5): 734–745.
16. Hansen S, Gustafson R, Smith CI, Gardulf A. Express subcutaneous IgG infusions: decreased time of delivery with maintained safety. Clin Immunol 2002; 104(3): 237–241.
17. Horn J, Thon V, Bartonkova D, Salzer U, et al. Anti-IgA antibodies in common variable immunodeficiency (CVID): diagnostic workup and therapeutic strategy. Clin Immunol 2007; 122(2): 156–162.
18. Jolles S, Sleasman JW. Subcutaneous immunoglobulin replacement therapy with Hizentra, the first 20% SCIG preparation: a practical approach. Adv Ther 2011; 28(7): 521–533.
19. Kasztalska K, Ciebiada M, Cebula-Obrzut B, Górski P. Intravenous immunoglobulin replacement therapy in the treatment of patients with common variable immunodeficiency disease: an open-label prospective study. Clin Drug Investig 2011; 31(5): 299–307.
20. Krejsek J, Kopecký O. Klinická imunologie. Hradec Králové: Nucleus 2004.
21. Lucas M, Lee M, Lortan J, et al. Infection outcomes in patients with common variable immunodeficiency disorders: relationship to immunoglobulin therapy over 22 years. J Allergy Clin Immunol 2010; 125(6): 1354–1360.
22. Nicolay U, Haag S, Eichman F, Herget S, et al. Measuring treatment satisfaction in patients with primary immunodeficiency diseases receiving lifelong immunoglobulin replacement therapy. Qual Life Res 2005; 14(7): 1683–1691.
23. Orange JS, Belohradsky BH, Berger M, et al. Evaluation of correlation between dose and clinical outcomes in subcutaneous immunoglobulin replacement therapy. Clin Exp Immunol 2012; 169(2): 172–181.
24. Orange JS, Grossmann WJ, Navickis RJ, Wilker MM. Impact of trough IgG on pneumonia incidence in primary immunodeficiency: A meta-analysis of clinical studies. Clin Immunol 2010; 137(3): 21–30.
25. Quinti I, Soresina A, Agostini C, et al. Prospective study on CVID patients with adverse reactions to intravenous or subcutaneous IgG administration. J Clin Immunol 2008; 28(3): 263–267.
26. Quinti I, Soresina A, Guerra A, et al. Effectiveness of immunoglobulin replacemnt therapy on clinical outcome in patients with primary antibody deficiencies: results from a muticenter prospective cohort study. J Clin Immunol 2011; 31(3): 315–322.
27. Rezaei N, Aghamohammadi A, Siadat SD, et al. Serum bactericidal antibody responses to meningococcal polysaccharide vaccination as a basis for clinical classification of common variable immunodeficiency. Clin Vaccine Immunol 2008; 15(4): 607–611.
28. Shapiro RS. Subcutaneous immunoglobulin therapy by rapid push is preferred to infusion by pump: a retrospective analysis. J Clin Immunol 2010; 30(4): 301–307.
29. Shapiro RS. Subcutaneous immunoglobulin: rapid push vs. infusion pump in pediatrics. Pediatr Allergy Immunol 2013; 24(1): 49–53.
30. Shapiro RS. Why I Use Subcutaneous Immunoglobulin (SCIG). J Clin Immunol 2013; 33(2): 95–98.
31. Siedlar M, Strach M, Bukowska-Strachova K, et al. Preparations of intravenous immunoglobulins diminish the number and proinflammatory response of CD14+CD16++ monocytes in common variable immunodeficiency (CVID) patients. Clin Immunol 2011; 139(2): 122–132.
32. Thepot S, Malphettes M, Gardeur A, et al. Immunoglobulin dosage and switch from intravenous to subcutaneous immunoglobulin replacement therapy in patients with primary hypogammaglobulinemia: decreasing dosage does not alter serum IgG levels. J Clin Immunol 2010; 30(4): 602–606.
33. Thomas JR, Yocum RC, Haller MF, von Gunten CF. Assessing the role of human recombinant hyaluronidase in gravity-driven subcutaneous hydration: the INFUSE-LR study. J Palliat Med 2007; 10(6): 1312–1320.
34. Torgerson TR, Bonagura VR, Shapiro RS. Clinical ambiguities-ongoing questions. J Clin Immunol 2013; 33(2): 99–103.
35. Wasserman R, Melamed I, Kobrynski L, et al. Efficacy, safety, and pharmacokinetics of a 10% liquid immune globulin preparation (GAMMAGARD LIQUID, 10%) administered subcutaneously in subjects with primary immunodeficiency disease. J Clin Immunol 2011; 31(3): 323–331.
36. Wasserman RL, Melamed I, Stein MR. Recombinant human hyaluronidase-facilitated subcutaneous infusion of human immunoglobulins for primary immunodeficiency. J Allergy Clin Immunol 2012; 130(4): 951–957.
Štítky
Praktické lekárstvo pre deti a dorast Praktické lekárstvo pre dospelých
Článok vyšiel v časopisePraktický lékař
Najčítanejšie tento týždeň
2014 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Imunoglobulinová substituční léčba u nemocných s primárními imunodeficity
- Je obezita rizikovým faktorem vybraných nádorových onemocnění?
- Problémy se zjišťováním kvality života seniorů
- Koncepce oboru všeobecné praktické lékařství
- Prozánětové složky nutrice jako jedna z příčin rostoucí incidence chronických nesdělných nemocí?
- Skákavý prst v dětském věku
- Solitární metastáza karcinomu prostaty do varlete manifestující se 10 let po radikální léčbě
- Neurolog Josef Kohout
- Albert Schweitzer, nemocnice v Lambaréné a varhany v Praze
- Zlatá pamětní medaile ČLS JEP prof. MUDr. Janu Kvasničkovi, DrSc.
- Jubilanti
- Odborná společnost praktických dětských lékařů ČLS JEP
- Praktický lékař
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Skákavý prst v dětském věku
- Problémy se zjišťováním kvality života seniorů
- Jubilanti
- Imunoglobulinová substituční léčba u nemocných s primárními imunodeficity
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



