-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Experimentální terapie nádoru pomocí intratumorózní aplikace dendritických buněk
Experimental Tumor Therapy Using Intratumoral Injection of Dendritic Cells
Aim of study:
After the treatment of tumors, we often encounter a minimal residual sickness. However, the elimination of these leftover tumor cells is crucial for the patient. In the past years one of the most discussed options for this treatment is Imunotherapy, mainly by Dendritic cells. Dendritic cells are the most efficient cells out of the antigen presenting cell group.Methods and results:
In the first part of the project, we perfected a technique of inducting a tumor on an experimental model. We inducted the tumor by the use of Carcinogenic substances or with the help of the Sarkom line imortalized fibroblasts. Another important part of the project was perfecting the method for the preparation of undeveloped dendritic cells from periphery blood monocytes. After these significant procedures were developed and perfected we moved onto the main part of the study. The Induction of a tumor by the carcenogenic substances Ethylennitrosamin and Phenobarbital was successful only in 20 % of the cases and therefore, was unusable for our experiment. We inducted the tumors with the Sarkom line method. After the application of dendritic cells into the tumor, a decrease in the development of the growth of the tumor was achieved.Conclusion:
Imunotherapy using dendritic cells as a basis for treatment is a perspective method for treatment of tumors.Key words:
dendritic cells – surgery – tumor induction
Autoři: A. Kučera; R. Škába; R. Spíšek 1; P. Pajer 2; M. Červinková 3
Působiště autorů: Klinika dětské chirurgie, UK 2. LF, Fakultní nemocnice Motol, přednosta: prof. MUDr. J. Šnajdauf, DrSc. ; Ústav imunologie, UK 2. LF, Fakultní nemocnice Motol, přednosta: prof. MUDr. J. Bartůňková, DrSc. 1; Oddělení molekulární virologie, Ústav molekulární genetiky AV ČR, RNDr. M. Dvořák, CSc. 2; Kardiochirurgická klinika FNKV, přednosta: prof. MUDr. Z. Straka, CSc. 3
Vyšlo v časopise: Rozhl. Chir., 2009, roč. 88, č. 7, s. 368-372.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Východiska a cíle studie:
Při léčbě nádorů se často setkáváme s minimální reziduální nemocí. Eliminace těchto zbylých nádorových buněk je však pro pacienta klíčová. V posledních letech je jednou z hodně diskutovaných možností léčba pomocí imunoterapie, především pomocí dendritických buněk. Dendritické buňky jsou nejúčinnějším představitelem skupiny antigen prezentujících buněk.Metody a výsledky:
V první části projektu jsme vypracovali techniku indukce tumoru na experimentálním modelu. Tumor jsme indukovali pomocí kancerogenních látek nebo pomocí sarkomové linie imortalizovaných fibroblastů. Další nezbytnou částí projektu bylo vypracování metodiky pro přípravu nezralých dendritických buněk z monocytů periferní krve. Nakonec jsme přistoupili k vlastní studii. Aplikovali jsme připravené dendritické buňky přímo do nádoru.
Indukce tumoru pomocí kancerogenních látek Ethylennitrosaminu a Phenobarbitalu byla úspěšná pouze ve 20 % a proto byla pro náš pokus nevhodná. Tumor jsme tedy indukovali pomocí sarkomové linie. Po podání dendritických buněk přímo do tumoru došlo k zpomalení růstu tumoru.Závěr:
U tumoru, kde po operaci zůstává reziduum, nebo je tumor zcela inoperabilní, by mohla být léčba pomocí imunoterapie v budoucnosti pro pacienta určitou nadějí.Klíčová slova:
dendritická buňka – chirurgie – indukce tumoruÚVOD
Chirurgická léčba je nejúčinnějším způsobem odstranění nádorové tkáně, má však své omezení. V některých případech není možné nádor odstranit, někdy zůstanou nádorové buňky po odstranění nádoru v hraniční tkáni, často také ještě nelze detekovat vzdálené metastatické postižení. Avšak eliminace této tzv. minimální reziduální nemoci (MRN) je pro přežití pacienta klíčová. K eliminaci MRN se používá chemoterapie, radioterapie. V posledních letech se jeví jedním ze slibných a velmi diskutovaných postupů imunoterapie. Zásadní význam imunitního systému v souvislosti s nádorovým bujením je znám již dlouho. Na konci 19. století americký chirurg W. Coley zaznamenal regresi nádoru po proběhlé bakteriální infekci. V roce 1957 byla formulována hypotéza o protinádorovém imunitním dohledu, která spočívá v tom, že imunitní systém včas rozpoznává změněné mutované buňky a odstraní je [1]. Základním předpokladem, aby mohl imunitní systém spustit účinnou reakci proti nádoru, musí nádorovou buňku nebo specifický povrchový antigen rozpoznat. Zásadní úlohu v tom hrají fagocytující buňky, zvláště buňky dendritické, které zpracovávají a prezentují antigen. V současnosti se jedním ze slibných, ale velmi diskutovaných postupů ovlivnění růstu nádoru jeví terapie pomocí dendritických buněk (DC).
Dendritické buňky jsou nejúčinnějším představitelem skupiny antigen prezentujících buněk (APC). V roce 1868 popsal Langerhans kožní dendritické buňky jako nervové buňky kůže, ale trvalo více než 100 let (1973), než Steinman a Cohn, objevitelé dendritických buněk ve slezině, určili, že se jedná o buňky odlišné od makrofágů, které se specializují na stimulaci naivních T-lymfocytů. Dendritické buňky představují spojující článek mezi antigenně nespecifickou a antigenně specifickou částí imunitního systému. Jako jediné jsou schopny aktivovat naivní T-lymfocyty, tedy lymfocyty, které se dosud nesetkaly s antigenem. DC vznikají z kmenových buněk v kostní dřeni, odkud jsou již jako nedělící se buňky vyplavovány do krevního oběhu. Dendritické buňky se vyskytují ve všech orgánech a tkáních a cestují mezi krví a lymfou. Nejvíce dendritických buněk je v kůži a ve sliznicích dýchacího a trávicího ústrojí [2]. Možnost získat dostatečné množství DC z periferních monocytů in vitro za přítomnosti Interleukin-4 (IL-4) a faktoru stimulujícího kolonie granulocytů a makrofágů (GM-CSF) umožnila jejich intenzivní studium a během posledních 5 let byl učiněn značný pokrok ve znalostech o jejich přesné funkci v organismu a jejich fyziologii.
V periferních tkáních se DC vyskytují v tzv. nezralém stavu a na svém povrchu nemají molekuly nezbytné pro aktivaci T-lymfocytů jako např. CD40, CD54, CD80, CD86 a znaky typické pro zralé DC. V tomto stadiu nestimulují T-lymfocyty, ale pohlcují okolní antigeny [3].
V nezralém stavu má dendritická buňka na svém povrchu soubor antigenů poskytující reprezentativní vzorek látek přítomných v jejím okolí. Pro efektivní aktivaci T-lymfocytů její výbava ovšem nedostačuje. Práce z poslední doby spíše naznačují, že funkcí nezralé DC in vivo je indukce specifické tolerance proti vlastním antigenům. DC se tedy významně podílejí v zachování tolerance vůči vlastním tkáním. DC průběžně pohlcují odumřelé molekuly vlastních tkání, fragmenty molekul zpracují a vystaví v komplexu s MHC proteiny na svém povrchu. T-lymfocyty autogeny poznají a jsou utlumeny, nebo reakci vůči antigenu aktivně potlačují a vytváří tzv. regulační T-lymfocyty. Tento mechanismus je pro organismus velmi důležitý. Kdyby docházelo ke stimulaci imunitní odpovědi i za klidového stavu, značně by se zvýšilo riziko vzniku autoreaktivních klonů T - i B-lymfocytů a z toho pramenící nebezpečí vzniku autoimunitních onemocnění [4].
Jiná situace ovšem nastává při narušení integrity organismu. Nebezpečí může být reprezentováno řadou situací. Klasicky jde o přítomnost infekčního patogenu a nebo velkého množství buněk hynoucích nekrotickou smrtí. Detekce těchto specifických signálů nastartuje proces maturace dendritické buňky, vedoucí k výrazné změně fenotypu a funkčních vlastností DC. Dendritická buňka přestane pohlcovat okolní antigeny a zpracovává fragmenty, které ji aktivovaly. Zvýšená transkripce genů pro hlavní histokompatibilní komplex MHC I. a II. třídy má za následek vyšší syntézu těchto molekul a jejich zvýšený transport na membránu. Během maturace dochází k přesmyku v expresi chemokinových receptorů a DC se přesunuje do lymfatických uzlin, kde aktivují antigen specifické T-lymfocyty. Zralé DC exprimují celou řadu kostimulačních molekul (CD 80, CD 86), adhezivních molekul, cytokinů (např. II-1, IL-6, TNF, IL-12), které jsou potřebné pro optimální stimulaci T-lymfocytů [5].
MATERIÁL A METODA
Náš výzkum měl několik částí. V první fázi jsme indukovali tumor pomocí kancerogenních látek a pomocí sarkomové linie. Další fází byla příprava dendritických buněk z monocytů periferní krve. Ve třetí fázi jsme přistoupili k vlastní studii, k aplikaci dendritických buněk přímo do nádoru.
Indukce tumoru Diethylennitrosaminem a Phenobarbitalem
V první fázi experimentu jsme se pokusili indukovat tumor jater pomocí kancerogenních látek. Použili jsme 15 potkanů (Wistar) vážících kolem 200 g rozdělených do dvou skupin. Potkani byli umístěni v klecích po třech zvířatech ve standardizovaných laboratorních podmínkách. Byly dodrženy stávající předpisy a směrnice pro chov a experimentální používání zvířat, experiment byl prováděn se souhlasem etické komise. Tumor jsme indukovali pomocí Diethylennitrosaminu (200 mg/kg/d), v kombinaci s podáváním Phenobarbitalu (500 ppm/rat). Diethylennitrosamin byl aplikován jednorázově injekčně intraperitoneálně, phenobarbital byl zvířatům podáván jako příměs ve stravě. Indukce trvala 5 měsíců.
Indukce tumoru pomocí sarkomové linie
Při této indukci jsme použili sarkomovou linii imortalizovaných fibroblastů (K2). Tento model nádorového onemocnění jsme používali ve spolupráci s Ústavem molekulární genetiky AV ČR. Označení kultury A 297, NbIII 2A (5 000 000 j/ml). Aplikovali jsme 0,2 ml tkáňové kultury subkutánně. Na tento experiment jsme použili skupinu 10 potkanů Lewis vážících kolem 250 g. Nádory se chovaly velice agresivně, rychle se zvětšovaly, prorůstaly do okolních tkání a metastazovaly do jater a plic.
Příprava dendritických buněk
Další nezbytnou částí projektu bylo vypracování metodiky pro přípravu nezralých DC z monocytů periferní krve potkanů Lewis. Monocyty jsme z periferní krve izolovali pomocí gradientové centrifugace a následné adherence na plastikový povrch. V přítomnosti krysích rekombinantních cytokinů IL-4 a GM-CSF se monocyty během 5 dnů diferencovaly do buněk s typickou morfologií DC (Obr. 1). Vlastnosti nezralých DC byly dále ověřeny řadou funkčních i fenotypických testů (schopnost fagocytozy, exprese povrchových molekul, konfokální mikroskopie). Připravené nezralé DC fagocytovaly fluorescenčně značený dextran, měly nízkou expresi kostimulačních molekul a měly typickou morfologii DC (Obr. 2). Nezralé DC připravené z krysích monocytů bylo možno aktivovat pomocí stimulů, které jsou známy dřívějších prací naší skupiny i dalších pracovišť. Nejúčinnějšími stimulátory byly bakteriální lipopolysacharid (LPS) a dvouvláknová RNA (Poly(I:C)). Charakteristiky zralých DC byly opět komplexně studovány. Stimulace pomocí LPS a Poly (I:C) vedla ke změnách ve funkci DC typickým pro zralé DC. Výrazně se zvýšila exprese kostimulačních molekul, DC ztratily schopnost fagocytózy (Obr. 3). Takto připravené DC byly tedy plně vybaveny pro účinnou indukci imunitní reakce proti prezentovanému antigenu.
Obr. 1. Typická morfologie DC při značení povrchovou protilátkou proti CD80 a pozorování v konfokálním mikroskopu Fig. 1. Typical DC morphology upon marking with anti- CD80 superficial antibody, observed using a confocal microscope 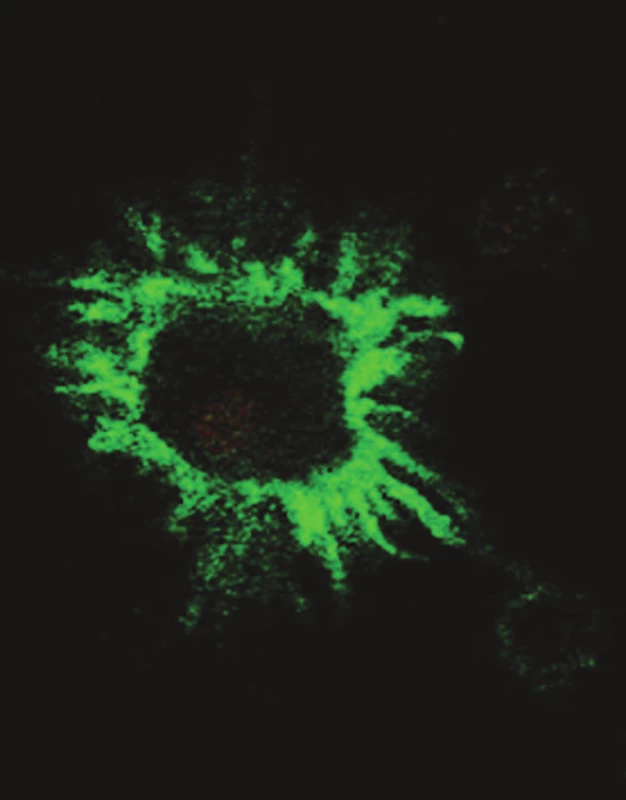
Obr. 2. Nezralá DC pohlcuje FITC značený dextran. Po 1 h je dobře znázorněn endocytární aparát buňky a je možno pozorovat polarizaci endosomů směrem k centru mikrotubulů v blízkosti jádra Fig. 2. Immature DCs absorb FITC- marked dextran. After 1 hour, the cellęs endocytic apparatus is well demonstrated and endosomal polarization towards the microtubular centre close to the nucleus can be observed 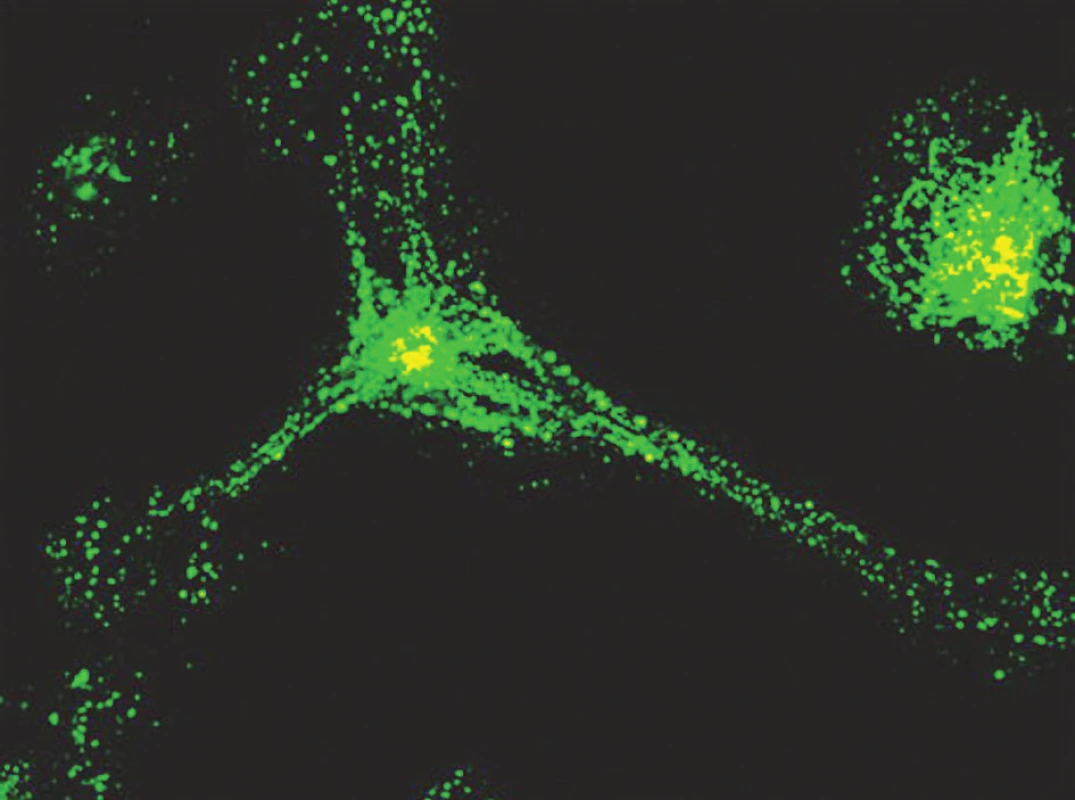
Obr. 3. Zvýšení exprese povrchových kostimulačních molekul na DC po stimulaci LPS a Poly (I:C) Fig. 3. Enhancement of the superficial co-stimulating molecules expression on DCs, following LPS and Poly (I:C) stimulation 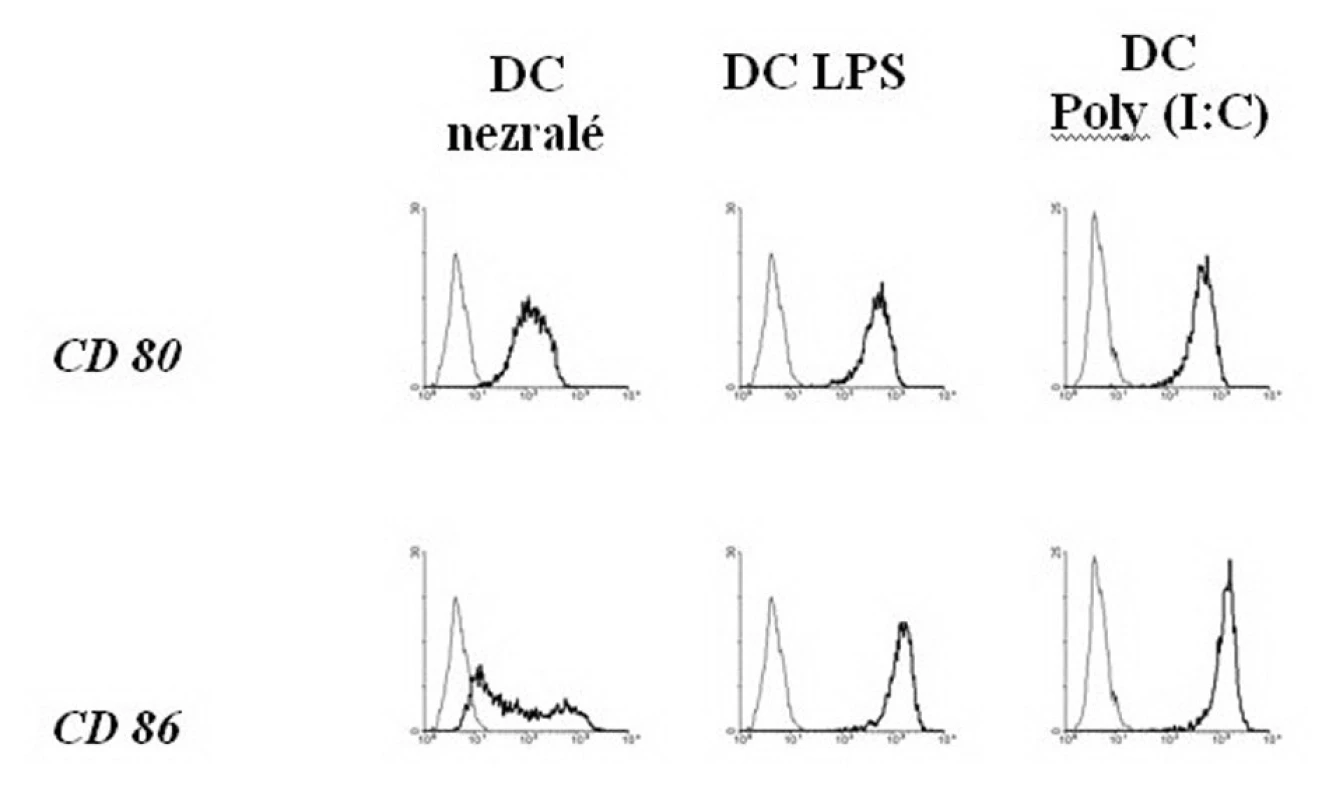
VÝSLEDKY
Indukce tumoru pomocí kancerogenních látek Diethylennitrosaminu a Phenobarbitalu byla málo úspěšná, protože se nám podařilo vyvolat kancerogenní efekt pouze u malé části zvířat. Podle odborných prací se pomocí diaminobenzidinu nebo nitrosaminu podaří průměrně u 80 % krmených zvířat tumor indukovat [6, 7, 8], v našem případě jsme tak úspěšní nebyli a kancerogenní efekt jsme zaznamenali pouze ve 20 %. Používali jsme Diethylennitrosamin (200 mikrogramů/kg a 1 den), v kombinaci s podáváním Phenobarbitalu (500 ppm/rat).
První studii jsme provedli na 10 potkanech (Wistar). Indukce trvala 5 měsíců. Histologicky byly přítomny ve 20 % kancerogenní změny v játrech, v 10 % atypie bez nádorových buněk, v 10 % steatóza, v 10 % chronické fibrotické změny. Bohužel jsme dosáhli pouze malé úspěšnosti v indukci tumoru. Nádory vzniklé přímo na zvířeti působením kancerogenu, by se více podobaly nádorům u našich pacientů, než nádory indukované již připravenou nádorovou linií. Tento model by měl větší přínos v hodnocení výsledků léčby pomocí dendritických buněk. Bohužel doba indukce byla dlouhá a tumor se nám nepodařilo u většiny zvířat indukovat. Proto jsme se rozhodli použít k indukci tumoru sarkomovou linii fibrobastů (K2). Systémové a intrahepatální podání suspenze nádorových buněk vedlo k rychlému růstu nádoru, tvorbě metastáz a následně ke smrti během 1 měsíce. Plicní metastatická ložiska a původní nádor v játrech u jednoho experimentálního zvířete jsou znázorněna na obrázku (Obr. 4). Pro experimenty s aplikací dendritických buněk jsme zvolili subkutánní podání, při kterém byl růst nádorů pomalejší, nedocházelo k rychlé tvorbě metastáz a velikost nádorů bylo možno objektivně měřit (Obr. 5).
Obr. 4. Pitevní nález po aplikaci nádorových buněk intrahepatálně. Patrno je původní ložisko v játrech a plicní metastázy Fig. 4. Sectional findings after intrahepatic injection of tumorous cells. Aformer hepatic focus and lung metastases are detectable 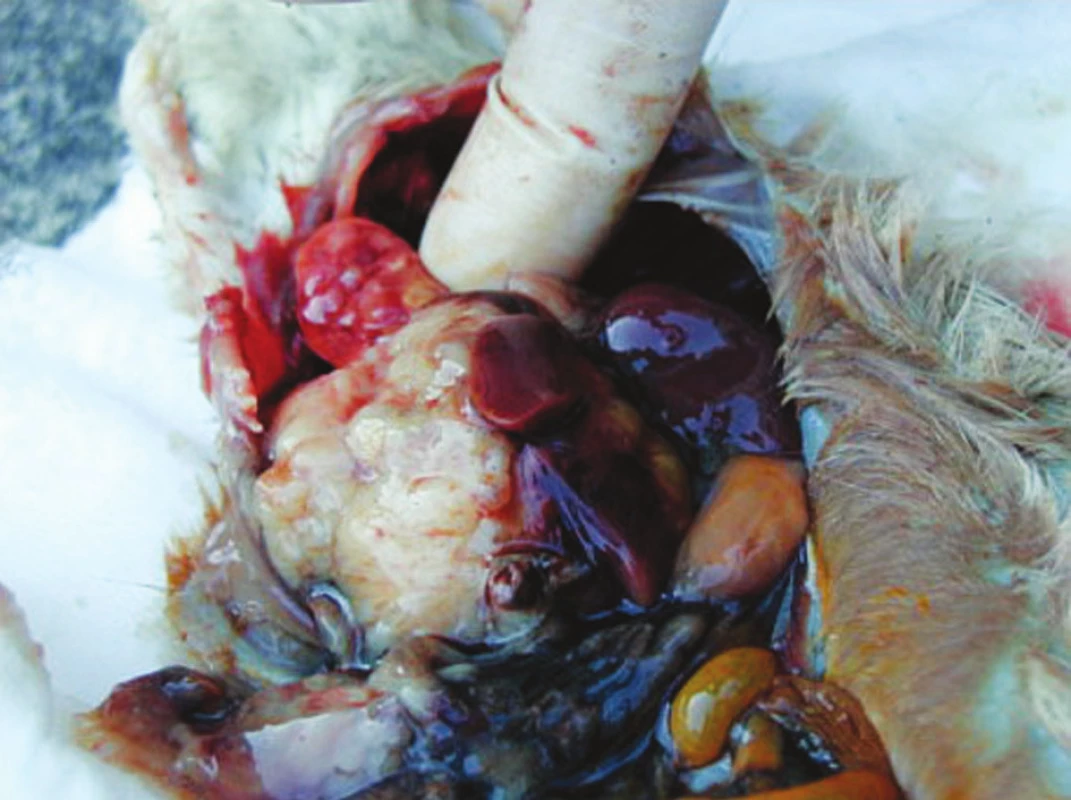
Obr. 5. Lokalizovaný růst nádoru po subkutánním podání nádorových buněk Fig. 5. Localized tumor growth following subcutaneous administration of the tumorous cells 
Tumor jsme tedy indukovali pomocí sarkomové linie K2. Použili jsme skupinu 10 potkanů Lewis, 6 zvířatům jsme aplikovali 0,2 ml tkáňové kultury, úspěšnost indukce byla 100%. Od zbylých 4 zvířat jsme odebrali krev a monocyty z periferní krve jsme použili na přípravu dendritických buněk. Po vyvinutí protokolu pro přípravu zralých DC jsme v případě sarkomu provedli první imunoterapeutickou studii.
Podávali jsme zralé DC potkanům s velmi pokročilým nádorovým onemocněním. Sledovali jsme dvě skupiny potkanů u nichž pouze jedné byly podány DC. Po podání lx 106 zralých DC nedošlo u žádného z potkanů z testované skupiny k systémové ani lokální reakci. Sledovali jsme růst nádoru jednak měřením velikosti a dále vzhledem k obrovskému nárůstu masy nádoru během několika dní také váhu zvířete (Tab. 1). Tyto výsledky byly poté statisticky zpracovány a porovnány s neléčenou skupinou. Jednostranným Mannovým-Whitneyovým testem se porovnávala procentní změna hmotnosti a velikosti v průběhu pokusu. I vzhledem k malému počtu byl rozdíl signifikantní (p = 0,05). Ve skupině potkanů léčených intratumorózní aplikací DC došlo ke zpomalení progrese nádoru oproti kontrolní skupině (Graf 1). První úmrtí bylo ve skupině neléčených zvířat. Ovlivnění růstu tumoru bylo jen krátkodobé, což by vysvětlovaly i dosavadní poznatky o dendritických buňkách. DC buňka dosáhne zralosti během cca 48 hodin, tento proces je ireverzibilní a ve zralém stadiu vydrží asi 2–3 dny. Během této doby aktivuje T-lymfocyty a poté hyne apoptickou smrtí.
Tab. 1. Procentuální změny velikosti a váhy tumoru Table 1. Percentage changes in the tumor size and weight 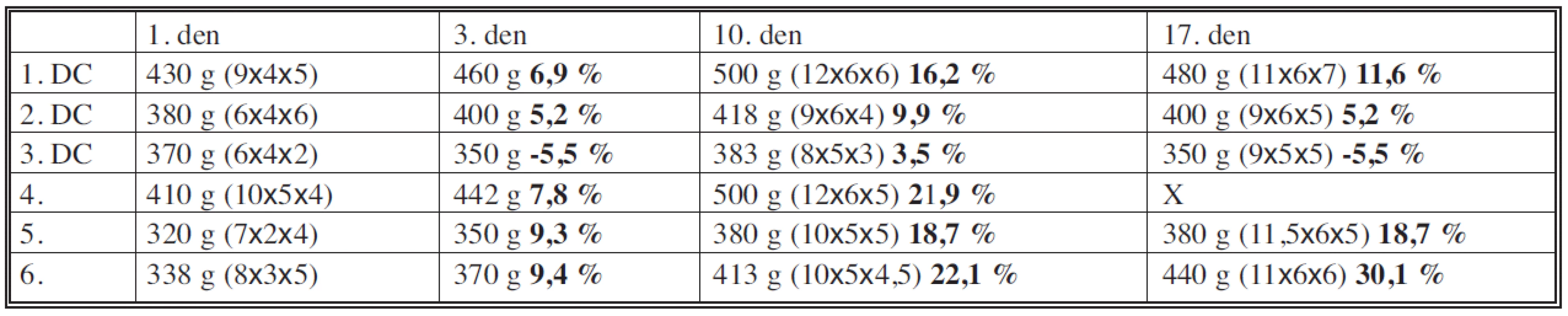
V tabulce jsou procentuální změny velikosti a váhy tumoru, experimentální zvířata kterým byly podány buňky jsou označeny DC. U 4. zvířete, kterému nebyly buňky podány není provedeno poslední měření z důvodu jeho úmrtí. Graf 1. Nárůst hmotnosti v % Graph 1. Weight gain in % Ve skupině potkanů, u kterých byly buňky aplikovány, došlo krátkodobě ke zpomalení růstu nádoru ve srovnání s neléčenou skupinou. 
Histologicky se jednalo o vysoce maligní sarkom, morfologicky blíže neurčený. Nádor byl značně buněčný, tvořený oválnými až vřetenitými buňkami, místy strukturalizovanými v proudech, ložiskově s náznaky epiteloidní koheze.
DISKUSE
Příští roky nepochybně přinesou další porozumění patofyziologie dendritických buněk. Již dnes je zřejmé, že imunita hraje významnou roli v boji s nádorovým onemocněním. Jednou ze základních funkcí imunitního systému je chránit organismus před změněnými imitovanými buňkami. V klinické praxi jsme se setkali se spontánní resorpcí nekompletně odstraněného lipoblastomu, nebo v evoluci liposarkomu v lipoblastom nebo ve vyzrálý lipom [9, 10]. V těchto případech je vliv imunitního sytému nesporný. V experimentu také proběhla řada úspěšných pokusů na zvířatech, kdy se pomocí indukované imunitní reakce podařilo ovlivnit růst tumoru, ale do klinické praxe se tyto úspěšné postupy ve větší míře převést nepodařilo. Podle současných názorů může imunitní reakce proti nádorové buňce vzniknout, jsou-li nádorové antigeny prezentovány T-lymfocytům dendritickými buňkami. Nádorové buňky se více méně liší od normálních buněk, ze kterých vznikly a teoreticky by měly být jednoduše rozpoznány imunitními mechanismy a eliminovány. Ve skutečnosti to však až tak jednoduché není. Odlišnosti bývají příliš malé, takže jsou imunitním systémem ignorovány. Některé nádory používají mechanismy, které jim umožňují paralyzovat zbraně imunitního systému (např. produkují faktory inaktivující T-lymfocyty). V posledních letech znalosti o funkci imunitního systému a především o dendritických buňkách rychle rostou, přesto mnoho otázek ještě zůstává nejasných. Pochopení imunobiologie DC buněk umožní terapeutickou manipulaci tímto systémem a zvětšení významu imunitní reakce v boji proti nádorům. Velké naděje jsou vkládány do použití DC připravených in vitro a exprimujících nádorové antigeny jako protinádorové vakcíny [11]. Experimenty in vitro i první klinické studie provedené u pacientů v terminálních stadiích maligního melanomu potvrdily schopnost takto připravené vakcíny indukovat detekovatelnou imunitní reakci i regresi nádorových ložisek.
ZÁVĚR
Při našem pokusu na experimentálním modelu se nám podařilo po přímé aplikaci dendritických buněk do tumoru prokázat zpomalení růstu tumoru. U tumoru kde po operaci zůstává reziduum, nebo je tumor zcela inoperabilní by mohla být léčba pomocí imunoterapie v budoucnosti pro pacienta určitou nadějí.
MUDr. Alexandr Kučera
Leopoldova 2044
148 00 Praha 4
e-mail: alexandr.kucera@lfmotol.cuni.cz
Zdroje
1. Fučíková, J., Kučera, A., Bartůňková, J., Špíšek, R. Role imunitního systému v obraně proti nádorům a strategie protinádorové imunoterapie, Alergie, 2008, 2, str. 119.
2. Banchereau, J., Briere, F., Caux, C., et al. Immunobiology of dendritic cells. Annu. Rev. Immunol., 2000, 18, s. 767–811.
3. Dhodapkar, M. V., Steinman, R. M., Krasovsky, J., Munz, C., Bharwaj, N. Antigen-specific inhibition of effector T cell function in humans after injection of immature dendritic cells. J. Exp. Med., 2001, 193(2), s. 233–238.
4. Spíšek, R., Bražová, J., Rožková, D., Zapletalová, K., Šedivá, A., Bartůňková, J.: Maturation of dendritic cells by bacterial immunomodulators. Vaccine, 2004, 22(21-22), s. 2761–2768.
5. Spíšek, R., Bougras, G., Ebstein, F., et al. Transient exposure of dendritic cells to maturation stimuli is sufficient to induce complete phenotypic maturation while preserving their capacity to respond to subsequent restimulation. Cancer Immunol. Immunother., 2003, 52(7), s. 445–454.
6. Meenakshi, V., Hideki, W., Nobuyasu, T., Yoshihisa, Y., Shuzo, O., Shinji, Y., Shoji, F. Inhibitory Effects of S-Methylcysteine and Cysteine on the Promoting Potential of Sodium Phenobarbital on Rat Liver Carcinogenesis. Jpn. J. Cancer Res., 2000, 91, 780–785.
7. Barbisan, L. F., Miyamoto, M, Scholastici, C, Salvadori, D. M. F., Ribeiro, L. R., Eira, A. F., Camargo, J. Influence of aqueous extract of Agaricus blazei on rat liver toxicity induced by different doses of diethylnitrosamine. Journal of Ethnopharmacology, 2002, 83, 25–32.
8. Rocha, N., Barbisan, L., Oliveira, M., Camargo, J. Effects of Fasting and Intermittent Fasting on rat Hepatocarcinogenesis Induced by Diethylnitrosamine. Teratogenesis, Carcinogenesis, and Mutagenesis, 2002, 22, 129–138.
9. Kučera, A., Šnajdauf, J., Vyhnánek, M, Morávek, J., Kodet, R., Stejskalová, E., Dvořáková, M. Lipoblastoma in Children: an Analysis of 5 Cases. Acta Chir. Belg., 2008, 108, 580–582.
10. Mognato, G., Cecchetto, G., Carlim, M. Is surgical treatment of lipo-blastoma always necessary? J. Pediatr. Surg., 2000, 35 : 1511–1513.
11. Spíšek, R., Bartůňková, J. Dendritická buňka v protinádorové imunitě. Vesmír, 2003, 82(5), s. 254–256.
Štítky
Chirurgia všeobecná Ortopédia Urgentná medicína
Článok vyšiel v časopiseRozhledy v chirurgii
Najčítanejšie tento týždeň
2009 Číslo 7- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Jaké jsou současné úkoly intenzivní péče v chirurgii?
- Infekce náhrad abdominální aorty
- Perioperační metabolická péče u diabetického pacienta – doporučení
- Antibiotická profylaxe v urologii
- Levostranné resekce pankreatu: indikace, chirurgická technika a komplikace
- Experimentální terapie nádoru pomocí intratumorózní aplikace dendritických buněk
- Minimalizace krevních ztrát v jaterní chirurgii
- Úloha klasickej chirurgie pri liečbe náhlych príhod brušných u onkologických pacientov
- Nekrotizující infekční komplikace u syndromu diabetické nohy a jejich řešení
- Moderní radioterapie v komplexní léčbě sarkomů měkkých tkání a kostí u dospělých – aktuální přehled a vlastní zkušenosti
- Komplikace IPOM plastiky – naše zkušenosti
- Septický šok u pacienta s Fourniérovou gangrénou s fatálním koncem
- Komplikace periproktálního abscesu – Fourniérova gangréna nebo nekrotizující fasciitida? Kazuistika
- Nutriční intervence v chirurgii
- The Occurrence of Gallbladder Carcinoma in Yemeni Patients Undergoing Cholecystectomy in Two Hospitals
- Rozhledy v chirurgii
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Septický šok u pacienta s Fourniérovou gangrénou s fatálním koncem
- Komplikace IPOM plastiky – naše zkušenosti
- Komplikace periproktálního abscesu – Fourniérova gangréna nebo nekrotizující fasciitida? Kazuistika
- Antibiotická profylaxe v urologii
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



