-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Kombinace dexmedetomidinu s ketaminem a opioidy významně potlačuje hemodynamické změny způsobené laparoskopickou cholecystektomií a prodlužuje trvání pooperační analgezie
A Combination of Dexmedetomidine with Ketamine and Opioids Results in Significant Inhibition of Hemodynamic Changes Associated with Laparoscopic Cholecystectomy and in Prolongation of Postoperative Analgesia
The aim of the study:
Recently, alpha2 sympathoadrenergic drugs are used in premedication to improve the perioperative course. The aim of our study was to compare a premedication with a new alpha2 sympathoadrenergic drug and standard premedication.Methods:
After ethic committee approval and written patient consent, in a randomised, double-blinded study, combination of dexmedetomidine 1.0 μg.kg-1 + ketamine 0.5 mg.kg-1 + fentanyl 1.0 μg.kg-1 + atropine 0.5 mg (group FNT), dexmedetomidine 1.0 μg.kg-1 + ketamine 0.5 mg.kg-1 + alfentanil 5.0 μg.kg-1 + atropine 0.5 mg (group ALFNT), or pethidine 1.0 mg.kg-1 + atropine 0.5 mg (group Dolsin) was administered to a deltoid muscle 15 min. before anaesthesia (GA) in patients elicited for laparoscopic cholecystectomy (LCHE). GA was performed in a standard way, ECG, NIBP, respiration rate, SpO2, onset of effect, Observers Assessment of Alertness Sedation Score (OAASS) before GA, circulatory reaction to intubation and capnoperitoneum, fentanyl consumption during GA, time to the first request for post-operative analgesia and postoperative nausea and vomiting were measured. The data were processed by Kruskal-Wallis and Fisher tests. P-value < 0.05 was considered significant.Results:
There were 16 patients in FNT and Dolsin and 15 patients in ALFNT with no differences in demography except for younger age in ALFNT. The main differences were in hypertension during capnoperitoneum: 0/16 FNT and 1/15 ALFNT vs. 11/16 Dolsin, both p < 0.001, per-operative fentanyl consumption: FNT 31.5 μg vs. Dolsin 165.0 μg, p < 0.001 and ALFNT 50.0 μg, p < 0.05 (ALFNT vs. Dolsin, p < 0.01) and request to the first analgesic post surgery: FNT 1.3 h. vs. Dolsin 0.45 h., p < 0.05 vs. ALFNT 0.8 h., p < 0.01. There were no differences in side effects except for bradycardia in ALFNT (p < 0.05).Conclusions:
Dexmedetomidine-ketamine-fentanyl-atropine combination is superior to pethidine-atropine combination in suppressing of adverse hemodynamic effects of capnoperitoneum, decreased need for analgesia during GA and prolonged postoperative analgesia.Key words:
surgery – hemodynamic changes – premedication – dexmedetomidine – ketamine – fentanyl – alfentanil
Autoři: J. Málek; F. Mareček; L. Hess *; A. Kurzová; M. Očadlík **; M. Votava ***
Působiště autorů: Klinika anesteziologie a resuscitace 3. LF UK a FNKV, přednosta: prof. MUDr. Jan Pachl, CSc. ; Pracoviště experimentální medicíny IKEM *; Chirurgická klinika 3. LF UK a FNKV, přednosta: prof. MUDr. Robert Gürlich, CSc. **; Ústav farmakologie 3. LF UK, přednosta ústavu: prof. MUDr. Miloslav Kršiak, DrSc. ***
Vyšlo v časopise: Rozhl. Chir., 2010, roč. 89, č. 5, s. 275-281.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Cíl:
Alfa-2 sympatomimetika se stále častěji používají v premedikaci k zlepšení perioperačního průběhu. Cílem práce bylo zhodnotit účinnost nového preparátu dexmedetomidinu v premedikaci před laparoskopickou cholecystektomií (LACHE) v porovnání s dosavadním postupem.Materiál a metodika:
Po souhlasu etické komise a pacientů byl zaslepeně a randomizovaně podán 15 min. před úvodem do anestezie do m. deltoideus atropin 0,5 mg + jedna ze 3 premedikací, a to skupina FNT: dexmedetomidin 1,0 μg.kg-1 + ketamin 0,5 mg.kg-1 + fentanyl 1,0 μg.kg-1, skupina Dolsin: petidin 1,5 mg.kg-1 a skupina ALFNT: dexmedetomidin 1,0 μg.kg-1 + ketamin 0,5 mg.kg-1 + alfentanil 5,0 μg.kg-1. Úvod a vedení anestezie byly standardní. Byly zaznamenávány hodnoty vitálních funkcí, nežádoucí reakce pacienta a doba do podání prvního analgetika po operaci. Výsledky byly zhodnoceny Kruskalovým-Wallisovým a Fisherovým testem.Výsledky:
Ve FNT a Dolsin bylo 16 a ALFNT 15 pacientů. Mezi skupinami nebyly s výjimkou nižšího věku v ALFNT rozdíly v demografii a trvání operace. Hlavní rozdíly byly ve výskytu hypertenzní reakce na kapnoperitoneum: 0/16 FNT a 1/15 ALFNT vs. 11/16 Dolsin, oboje p < 0,001, v peroperační spotřebě fentanylu: FNT 31,5 μg vs. Dolsin 165,0 μg, p < 0,001 a ALFNT 50,0 μg, p < 0,05 (ALFNT vs. Dolsin, p < 0,01) a době do žádosti o analgetikum: FNT 1,3 hod. vs. Dolsin 0,45 hod., p < 0,05 vs. ALFNT 0,8 hod., p < 0,01. Nežádoucí reakce se nelišily s výjimkou bradykardie u ALFNT (p < 0,05).Závěr:
Dexmedetomidin v kombinaci s fentanylem a ketaminem potlačí nežádoucí oběhové účinky kapnoperitonea, snižuje peroperační spotřebu fentanylu, prodlužuje dobu pooperační analgezie a nemá významné vedlejší účinky. Obě kombinace dexmedetomidinu s opioidem ve srovnání s petidinem poskytují hemodynamickou stabilitu během kapnoperitonea a celé operace.Klíčová slova:
operace – hemodynamické změny – premedikace – dexmedetomidin – ketamin – fentanyl – alfentanilÚVOD
Skupina alfa-2 sympatomimetik je v perioperačním období užívána stále častěji vzhledem ke svým jedinečným účinkům. Četné studie prokázaly, že snižují minimální alveolární koncentraci (MAC) inhalačních anestetik [1, 2]. Díky svým analgetickým vlastnostem rovněž snižují perioperační spotřebu opioidů a sedativ. Výhodou je, že ačkoliv kombinace alfa-2 mimetika a opioidů působí synergicky na analgezii, není potencována dechová deprese způsobená opioidy [3–6]. Druhou látkou s podobným účinkem je ketamin. V malých dávkách potencuje účinek opioidů, má vlastní analgetický efekt a potlačuje nežádoucí účinky opioidů i alfa-2 mimetik na oběh (bradykardii a hypotenzi) [7–10]. Jak dexmedetomidin, tak ketamin vedou ke snížení potřebné dávky anestetik a opioidů. To je velkou výhodou, protože opioidy s sebou nesou riziko poruch ventilace a vyššího výskytu pooperační nevolnosti a zvracení (PONV), retence moči a hypotenzi. Anestetický režim, který by vedl ke snížení koncentrace inhalačních anestetik a opioidů v perioperačním období, by mohl vést ke snížení všech jmenovaných nežádoucích příhod.
Pro studium nového typu premedikace jsme vybrali kombinaci alfa-2 sympatomimetika dexmedetomidinu, disociativního anestetika ketaminu a opioidů fentanylu a alfentanilu.
Dexmedetomidin je vysoce selektivní alfa-2 sympatomimetikum, které ačkoliv je registrováno zatím pouze ke krátkodobé intravenózní sedaci ventilovaných pacientů, je stále častěji používáno i mimo schválenou indikaci v perioperační péči. Dexmedetomidin inhibuje uvolňování noradrenalinu (NA). Výsledkem je sedace a analgezie. Dexmedetomidin rovněž svojí inhibicí NA potlačuje stresovou odpověď na operaci [11, 12]. K vedlejším účinkům, zejména při rychlém bolusovém podání, patří přechodná hypertenze a bradykardie. Mezi všemi látkami používanými k sedaci má dexmedetomidin jedinečné postavení, protože vyvolává sedaci, analgezii, potlačuje stresovou odpověď a nevyvolává depresi dechu [1, 2]. Tyto jeho účinky by měly být velmi příznivé pro potlačení nebo snížení celé řady perioperačních komplikací.
Fentanyl byl syntetizován v roce 1959 Janssenem. Je spolu se sufentanilem nejčastěji používaným opioidem v anesteziologii a resuscitační péči. Má 100x silnější analgetický účinek než morfin a narozdíl od něj je dobře rozpustný v tucích. Dávkování fentanylu je stanoveno individuálně podle věku, tělesné hmotnosti, fyzického stavu pacienta, typu operace a individuální reakce pacienta. Hluboká analgezie je doprovázená útlumem dýchání, který se může udržovat nebo znovu objevit v období po chirurgickém výkonu [13].
Alfentanil, tetrazolový derivát fentanylu, je krátce působící mí-opioidní agonista, který se používá k analgezii a sedaci. Jeho rychlý nástup účinku a index sensitive half-life ho činní odlišným od ostatních opioidů. Alfentanil je v ekvipotentních dávkách analgetickými účinky srovnatelný s fentanylem, morfinem nebo sufentanilem. Navíc umožňuje rychlou extubaci a je dobře tolerován [13]. Kromě i.v. podání bylo popsáno i podání do svalu.
Ketamin je disociativní celkové anestetikum, které působí na více receptorových systémech. Nový impuls pro výzkum jeho vlastností znamenal objev, že působí jako nekompetitivní antagonista na N-metyl-D-aspartátovém receptoru (NMDA), o kterém se předpokládá, že hraje klíčovou roli ve vzniku a udržování centrální senzitizace a patologické bolesti [9]. Akutní podání opioidů vede jak u zvířat, tak u lidí k rychlému vzniku tolerance. Opioidní analgetika dokonce mohou u pokusných zvířat vyvolat pozdní hyperalgezii (přemrštěnou nociceptivní odpověď na bolestivou stimulaci) jak při opakovaném podání opioidů, tak dokonce i po jediné dávce [14]. Významnou úlohu ve vzniku a udržování centrálního hyperaktivního stavu, který vede ke vzniku hyperalgezie, alodynie a spontánní bolesti, hraje právě NMDA receptor. Antagonisté NMDA receptoru mohou zabránit jak těmto jevům, tak i vzniku tolerance. Ketamin tak může mít velmi zajímavé účinky při potlačení bolesti a snížení spotřeby analgetik v průběhu operace.
SPECIFICKÉ PERIOPERAČNÍ PROBLÉMY
1. Bolest a úzkost
Jak lékaři, tak pacienti považují kontrolu bolesti za důležitou součást pooperační péče. Přes nové léky a techniky je pooperační analgezie často nedostatečná. Opioidy jsou základní léky pro léčbu pooperační bolesti. Přes účinný analgetický efekt mají řadu známých nežádoucích účinků jako je dechová deprese, pruritus, nauzea, zvracení, retence moči a hypotenze, což omezuje jejich účinné nasazení [15]. Dexmedetomidin podobně jako ketamin zlepšuje kvalitu analgezie a anestezie a snižuje spotřebu opioidů [3–6]. Postup, který umožní zmenšit dávky inhalačních anestetik i opioidů během operace, může vést v perioperačním období k významnému snížení všech jejich nežádoucích účinků.
2. Ventilační komplikace
Mezi nejzávažnější život ohrožující pooperační komplikace patří obstrukce dýchacích cest, hypoxemie a hyperkapnie. K poruchám ventilace přispívá výběr anestetické techniky, sedativa a analgetika používaná v pooperační péči, typ operace a faktory spojené s pacientem. Četné studie prokázaly, že dexmedetomidin vyvolává analgezii a sedaci bez dechové deprese [1]. Ve srovnání s placebem nebyl žádný rozdíl v dechové frekvenci, saturaci kyslíkem, arteriálním pH ani arteriálním parciálním tlaku oxidu uhličitého. Dokonce u skupin s dexmedetomidinem byl vyšší poměr mezi arteriálním parciálním tlakem kyslíku a vdechovaném procentu kyslíku. Vzhledem k tomu, že alfa-2-agonisté i ketamin vyvolávají sedaci a analgezii, snižují potřebu opioidů a anestetik a nevyvolávají dechovou depresi, tvoří mimořádně atraktivní skupinu látek pro použití v perioperační péči.
3. Hemodynamická stabilita
Hemodynamická instabilita je druhou nejčastější život ohrožující komplikací v pooperačním průběhu. Hypertenze a tachykardie vyvolané bolestí nebo zvýšenou aktivitou sympatiku při chirurgickém stresu zvyšují morbiditu a mortalitu. Dexmedetomidin snižuje tonus sympatiku inhibicí uvolnění noradrenalinu (NA) z presynaptických zakončení a potlačuje příznaky stresové odpovědi, jako je tachykardie a hypertenze, a to jak během operace, tak po ní [11, 16, 17]. Dexmedetomidin ve srovnání s placebem významně snižuje dávky thiopentalu a fentanylu během laryngoskopie a intubace a snižuje plazmatické hladiny noradrenalinu po celou dobu úvodu do celkové anestezie. Podobně bylo prokázáno, že u pacientů po cévních výkonech dexmedetomidin snižuje tepovou frekvenci a plazmatickou koncentraci NA při probouzení z anestezie [18]. Wijeysundera a kol. provedli metaanalýzu s cílem zjistit vliv alfa-2-agonistů na perioperační mortalitu a kardiovaskulární komplikace u dospělých operovaných pacientů. Bylo zahrnuto 23 studií s celkem 3 395 pacienty. U cévních výkonů došlo při použití alfa-2-agonistů ke snížení mortality a infarktu myokardu. U kardiochirurgických operací došlo ke snížení rizika ischemie a byl vykázán trend ke snížení mortality a infarktu myokardu. Dexmedetomidin snižuje navíc i perioperační spotřebu kyslíku. Všechny výše citované práce ukazují, že alfa-2-agonisté potlačují sympatickou odpověď v pooperační období, což vede ke zlepšení hemodynamiky a ochraně myokardu. Další komplikací je hypotenze. Ketamin, jako látka se sympatomimetickým účinkem, by v kombinaci s dexmedetomidinem měl zlepšit hemodynamickou stabilitu.
4. Delirium
Akutní stav zmatenosti (delirium) se vyskytuje u 10–60 % starších hospitalizovaných pacientů, přesto není správně rozpoznáno 32–66 % případů. O dexmedetomidinu je známo, že potlačuje nežádoucí účinky ketaminu včetně pooperačního deliria. Dále je známo, že jak klonidin, tak dexmedetomidin potlačují delirium po sevofluranové anestezii dětí [19]. Kardiochirurgičtí pacienti, kteří v okamžiku uzavírání sternotomie dostali sedaci dexmedetomidinem, měli po operaci delirium v 8 % oproti 50 % při sedaci propofolem nebo benzodiazepiny [20].
5. Třes
Pooperační třes vzniká poruchou termoregulace. Ta je zapříčiněna různou dobou zotavení excitačního a inhibičního centra z účinků inhalačních anestetik a výsledkem je podstatné zvýšení spotřeby kyslíku myokardem. Jen malé procento pooperačního třesu je způsobeno skutečně hypotermií. Terapeutické prostředky, kromě ohřívání pacienta, zahrnují léčbu petidinem [21]. Mezi další látky používané ke snížení výskytu třesu patří fentanyl, sufentanil, tramadol a fyzostigmin. Protože petidin má závažné vedlejší účinky, jako je ovlivnění ventilace, pooperační nevolnost, zvracení a křeče, je snaha najít nové prostředky. Bylo prokázáno, že za účinek petidinu proti stresu jsou zodpovědné alfa-2B receptory v páteřní míše. Použití selektivních alfa-2-receptorových agonistů potlačuje třes po anestezii bez vedlejších účinků typických pro opioidy [22–24].
6. Nevolnost a zvracení
Příčiny pooperační nevolnosti a zvracení (PONV) jsou multifaktoriální (charakteristika pacienta, použitá anestetika a typ operace). Samotní pacienti pokládají PONV za jeden z nejhorších zážitků po operaci [25]. Pro prevenci PONV byla přijata celá řada multimodálních opatření. Patří sem použití intravenózních anestetik, profylaktické podání antiemetik a snižování dávek opioidů. Studie týkajících se použití alfa-2-mimetik k potlačení PONV se objevují teprve nedávno [26–28]. Výzkum účinků alfa-2-mimetik na PONV je zajímavý, protože alfa-2-mimetika by mohla potlačit PONV nezávisle na snížení dávek analgetik a opioidů.
7. Ochrana proti ischemickému a hypoxickému poškození orgánů
Relativně nedávno bylo prokázáno, že dexmedetomidin má v případě ischemie a hypoxie neuroprotektivní, kardioprotektivní a renoprotektivní účinky [29].
Alfa-2-agonisté získávají v perioperačním období stále větší popularitu jako adjuvantní léky díky své schopnosti potlačit sympatickou stresovou odpověď, možnosti snížit dávky anestetik a analgetik, absencí účinku na dýchání a nízkým výskytem a předvídatelností vedlejších účinků. Kombinace s ketaminem, který potencuje opioidní analgezii a brání vzniku tolerance slibuje dlouhodobou účinnou analgezii.
CÍL STUDIE
Naše studie navázala na předchozí dobré zkušenosti s využitím klonidinu před laparoskopickou cholecystektomií [30]. Cílem této nové práce bylo ověřit bezpečnost a účinnost kombinace dexmedetomidinu s ketaminem a fentanylem, nebo alfentanilem v premedikaci před laparoskopickou cholecystektomií a srovnat ji s dosud používaným petidinem.
Primární sledované cíle studie byly hemodynamická stabilita během operace a v pooperačním období měřeno hodnotami tepové frekvence – P, neinvazivním měřením krevního tlaku – TK, neinvazivním měřením saturace arteriální krve kyslíkem – SpO2. Sekundární sledované cíle byly ovlivnění vědomí a míra sedace měřeno podle Observers Assessment of Alertness Sedation Score (Tab. 1), trvání a kvalita pooperační analgesie měřeno dobou do potřeby podání pooperačního analgetika – standardně petidinu a vizitou u pacienta den po operaci.
Tab. 1. OASS: Observers Assessment of Alertness Sedation Score (Chernik, D. A. et al.:, Validity and reliability of the observer’s assessment of alertness / sedation scale. J. Clin. Psychopharm. 1990; 10: 244–251.) 
MATERIÁL A METODA
Po souhlasu Státního ústavu pro kontrolu léčiv a institucionální etické komise byla podniknuta prospektivní randomizovaná otevřená studie u pacientů klasifikace ASA 1-2 indikovaných k plánované laparoskopické cholecystektomii (LACHE). LACHE je častá operace, o které je známo, že působením kapnoperitonea vzniká perioperačně významná hypertenzní reakce a pooperačně zvýšená incidence pooperační nauzey a zvracení (PONV). Vylučovací kritéria zařazení do studia byla neschopnost porozumět či vyplnit pooperační dotazník, známá alergie na studijní medikaci či jakékoli opioidy, psychiatrická medikace, pacienti s jakýmkoli souběžným onemocněním, které významně ovlivňuje funkci a výkonnost jakýchkoliv orgánových systémů (tj. klasifikace ASA 3 a více), těhotenství a laktace.
Po poučeném a písemném souhlasu byli pacienti náhodně rozděleni podle typu premedikace na 3 skupiny (viz dále). Po příjezdu pacienta na operační sál byla provedena kanylace periferní žíly a změřen P, TK, SpO2. Podle provedené randomizace byla aplikována premedikace. Pacienti ve všech skupinách dostali 15 minut před úvodem do celkové anestezie (CA) intramuskulárně do m. deltoideus atropin 0,5 mg a následující kombinace léků: skupina FNT dexmedetomidin 1,0 μg.kg-1 + ketamin 0,5 mg.kg-1 + fentanyl 1,0 μg.kg-1, skupina Dolsin petidin 1,5 mg.kg-1 (zaokrouhleno po 25 mg) a skupina ALFNT dexmedetomidin 1,0 μg.kg-1 + ketamin 0,5 mg.kg-1 + alfentanil 5,0 μg.kg-1. Po 15 minutách od aplikace premedikace byl proveden úvod do celkové anestezie. Úvod i vedení celkové anestezie byly standardní pro tento typ operace (propofol, atracurium, oxid dusný a kyslík v poměru 1 : 1 a isofluran). Pacient byl uveden do celkové anestezie, zaintubován a řízeně ventilován. Svalová relaxancia a další analgetika byla podávána dle potřeby, inhalační anestetika byla podávána v koncentraci jedné minimální alveolární koncentrace (MAC). Po skončení operace byl pacient předán na standardní oddělení po splnění kritérií České společnosti anesteziologie, resuscitace a intenzivní medicíny (ČSARIM), tj. stabilizované vitální funkce, bdělost. Pokud by nebyla tato kritéria splněna do 15 minut po operaci, pacient by byl předán na jednotku intenzivní péče k dalšímu sledování.
Sledované parametry
Kromě hodnot vitálních funkcí rutinně měřených od doby před podáním premedikace a během celkové anestezie byly zaznamenávány následující údaje: spotřeba fentanylu během operace, hemodynamické změny o více než 30 % původní hodnoty, PONV, třes, doba do podání prvního opioidu po operaci (maximálně 4 hodiny, pak byl podáván petidin v pravidelných intervalech) a případné další nežádoucí reakce pacienta. Hodnoty vitálních funkcí a hodnoty Observers Assessment of Alertness Sedation Score (OAASS) byly měřeny a zaznamenávány do standardního anesteziologického záznamu po 5 minutách až do zotavení po operaci.
Na oddělení bylo prováděno rutinní měření P a TK v hodinových intervalech po 4 hodiny po operaci. První analgetikum po operaci dostal pacient na žádost podle potřeby (petidin i.m.), nejpozději po 4 hodinách.
Následující den po operaci byla provedena vizita u pacienta s cílem získat údaje o amnézii, výskytu pooperační nevolnosti a zvracení, případně dalších komplikací v pooperačním průběhu, dále subjektivní hodnocení intenzity pooperační bolesti a byly získány hodnoty hemodynamických parametrů a doba aplikace petidinu z pacientova dekursu.
Statistické zpracování
Výsledky byly statisticky zpracovány Kruskalovým-Wallisovým testem a dále přesným testem podle Fishera. Hodnota p < 0,05 byla považována za statisticky významnou.
VÝSLEDKY
Ve studii bylo zařazeno celkem 47 pacientů. Demografická charakteristika souboru je uvedena v tabulce 2, mezi soubory nebyl statisticky významný rozdíl s výjimkou mladšího věku ve skupině ALFNT. Další výsledky jsou v tabulce 3.
Tab. 2. Demografická charakteristika souboru Tab. 2. Demographic characteristics of the patient group 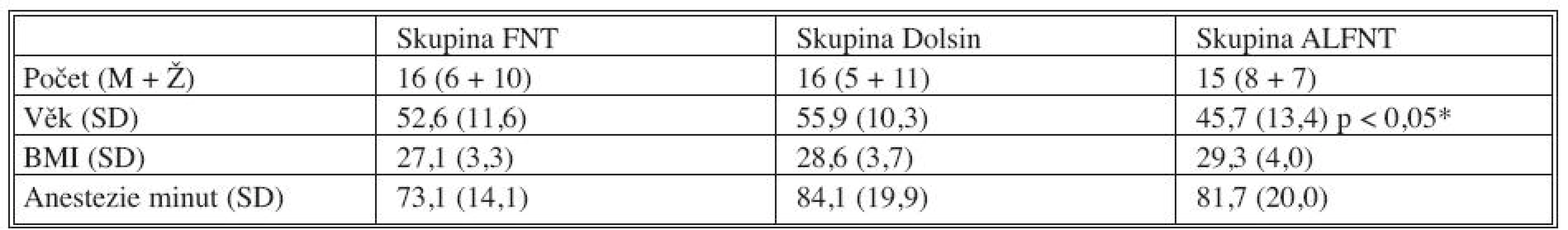
BMI – Body Mass Index, M – muži, Ž – ženy, SD – směrodatná odchylka Tab. 3. Výsledky Tab. 3. Results 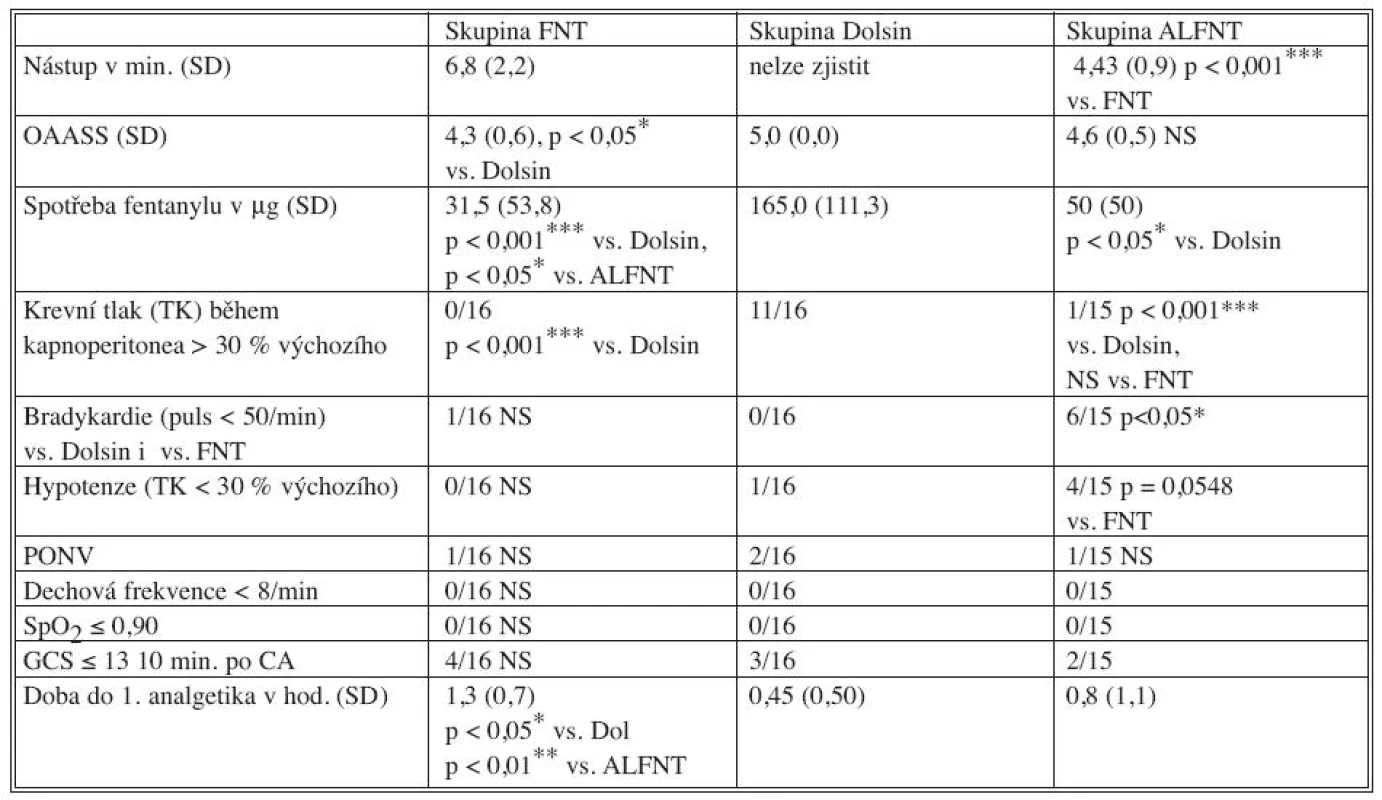
OASS – viz tabulka 1, GCS – Glasgow Coma Scale, CA – celková anestezie, NS – bez statistické významnosti, SD – směrodatná odchylka DISKUSE
Je dlouho známo, že kapnoperitoneum během laparoskopické cholecystektomie působí významné hemodynamické změny, především zvýšení středního arteriálního tlaku a srdeční práce [30–33]. Hlavním vyvolávajícím momentem je zřejmě zvýšené vyplavování katecholaminů, noradrenalinu, dopaminu, vasopresinu a adrenalinu [34]. Právě z tohoto důvodu jsme zvolili laparoskopickou cholecystektomii k ověření naší hypotézy, že dexmedetomidin povede k významné hemodynamické stabilitě.
Tato hypotéza se potvrdila. Trojkombinace alfa-2-agonista – ketamin – opioid + atropin v premedikaci ve srovnání se standardní premedikací na našem pracovišti (petidin + atropin) redukovala v průběhu operačního výkonu nežádoucí oběhové účinky kapnoperitonea a poskytla oběhovou stabilitu během celé operace. Přechodná bradykardie po úvodu do anestezie ve skupině ALFNT byla dána kombinací premedikace s propofolem, který sám působí pokles tlaku a reagovala promptně na podání 0,5 mg atropinu i.v. Bradykardizující účinek dexmedetomidinu, který jinak popisují ostatní autoři [8, 16, 35] jako častou komplikaci, byl v našem souboru vzácný, což mohlo být dáno jak preventivním podáním atropinu jak součást testované kombinace, tak i tachykardizujícím účinkem ketaminu [8].
Kombinace dexmedetomidinu s dalšími léky měla dále potencovat žádoucí účinky premedikace, což se nám rovněž podařilo potvrdit. Zejména kombinace dexmedetomidinu a ketaminu s fentanylem navodila mírnou až střední sedaci s amnézií, která byla výhodná u pacientů před indukcí anestezie, přičemž nedošlo ke klinicky významnému útlumu dechu s poklesem SpO2. Další výhodou byla kvalitní analgezie po operaci, která souvisí zřejmě nejen s účinkem dexmedetomidinu, ale i s antagonistickým účinkem ketaminu na N-metyl D-aspartátové (NMDA) receptory [9, 10]. Antagonizace NMDA receptorů vede k potlačení centrální senzitizace a působí jako prevence vzniku hyperalgezie a vzniku tolerance na analgetické účinky opioidů. Pacienti s dexmedetomidinem a ketaminem v premedikaci udávali velmi nízkou průměrnou intenzitu pooperační bolesti a vysokou spokojenost s pooperačním průběhem ve srovnání s kontrolní skupinou, protokol studie však neumožnil tento rozdíl detailně sledovat a statisticky hodnotit. Pouze u 1 pacientky ve skupině s ketaminem se vyskytly barevné sny, které lze přičíst psychomimetickým účinkům ketaminu, byly však tranzitorní na začátku nástupu účinku premedikace a druhý den měla pacientka na tento jev amnézii. Fentanyl má oproti alfentanilu významně delší pooperační analgezii a nemá riziko bradykardie. Je zřejmé, že klinické účinky obou opioidů se liší a zdá se, že fentanyl je v tomto ohledu výhodnější.
Jak již bylo uvedeno v úvodu, dexmedetomidin je registrován zatím pouze ke krátkodobé intravenózní sedaci ventilovaných pacientů, přesto v současnosti existuje nespočet prací, které popisují jeho bezpečné používání i v perioperační péči. Intramuskulární podání je narozdíl od kontinuální intravenózní aplikace relativně vzácné, přesto je popsáno již dlouhou dobu [35–39]. Naše práce potvrdila, že intramuskulární dexmedetomidin má rychlý nástup účinku, poskytuje setrvalý účinek po dobu operace a nemá významné vedlejší účinky. Výhodou je jednoduchost aplikace a spolehlivý efekt. Rozdíl v nástupu účinku mezi skupinami FNT a ALFNT byl sice statisticky významný, v praxi však zanedbatelný. Nástup účinku premedikace s petidinem pacienti nebyli většinou schopni určit, proto jsme ho nehodnotili.
ZÁVĚR
Dexmedetomidin v kombinaci s fentanylem, nebo alfentanilem a ketaminem potlačí nežádoucí oběhové účinky kapnoperitonea, snižuje peroperační spotřebu fentanylu a prodlužuje dobu pooperační analgezie, působí mírnou až střední sedaci, nemá významné vedlejší účinky. Obě kombinace dexmedetomidinu s opioidem ve srovnání s petidinem poskytují významnou hemodynamickou stabilitu během kapnoperitonea a během operace. Potvrdili jsme hypotézu, že dexmedetomidin přidaný ke ketaminu a opioidům působí potenciaci účinků anestetik a analgetik a stabilizaci oběhu během operace bez nežádoucích účinků na dýchání a pooperační zotavení.
Studie byla podporována grantem IGA MZ ČR NR 9168-3.
Doc. MUDr. Jiří Málek, CSc.
Pöslova 12
106 00 Praha 10
e-mail: malekj@fnkv.cz
Zdroje
1. Pandharipande, P., Ely, E. W., Maze, M. Alpha-2 agonists: can they modify the outcomes in the Postanesthesia Care Unit? Curr. Drug Targets, 2005; 6 : 749–754.
2. Carollo, D. S., Nossaman, B. D., Ramadhyani, U. Dexmedetomidine: a review of clinical applications. Curr. Opin. Anaesthesiol., 2008; 21 : 457–461.
3. Gurbet, A., Basagan-Mogol, E., Turker, G., Ugun, F., Kaya, F. N., Ozcan, B. Intraoperative infusion of dexmedetomidine reduces perioperative analgesic requirements. Can. J. Anaesth., 2006; 53 : 646–652.
4. Al-Zaben, K. R., Qudaisat, I. Y., Al-Ghanem, S. M., Massad, I. M., Al-Mustafa, M. M., Al-Oweidi, A. S., Abu-Halaweh, S. A., Abu-Ali, H. M., Saleem, M. M. Intraoperative administration of dexmedetomidine reduces the analgesic requirements for children undergoing hypospadius surgery. Eur. J. Anaesthesiol., 2009.
5. Unlugenc, H., Gunduz, M., Guler, T., Yagmur, O., Isik, G. The effect of pre-anaesthetic administration of intravenous dexmedetomidine on postoperative pain in patients receiving patient-controlled morphine. Eur. J. Anaesthesiol., 2005; 22 : 386–391.
6. Aantaa, R., Jalonen, J. Perioperative use of alpha2-adrenoceptor agonists and the cardiac patient. Eur. J. Anaesthesiol., 2006; 23 : 361–372.
7. Iravani, M., Wald, S. H: Dexmedetomidine and ketamine for fiberoptic intubation in a child with severe mandibular hypoplasia. J. Clin. Anesth., 2008; 20 : 455–457.
8. Levanen, J., Makela, M. L., Scheinin, H. Dexmedetomidine premedication attenuates ketamine-induced cardiostimulatory effects and postanesthetic delirium. Anesthesiology, 1995; 82 : 1117–1125.
9. Bell, R. F., Dahl, J. B., Moore, R. A., Kalso, E. Perioperative ketamine for acute postoperative pain. Cochrane Database Syst. Rev., 2006; CD004603.
10. Berti, M., Baciarello, M., Troglio, R., Fanelli, G. Clinical uses of low-dose ketamine in patients undergoing surgery. Curr. Drug Targets, 2009; 10 : 707–715.
11. Ebert, T. J., Hall, J. E., Barney, J. A., Uhrich, T. D., Colinco, M. D. The effects of increasing plasma concentrations of dexmedetomidine in humans. Anesthesiology, 2000; 93 : 382–394.
12. Khan, Z. P., Ferguson, C. N., Jones, R. M. Alpha-2 and imidazoline receptor agonists. Their pharmacology and therapeutic role. Anaesthesia, 1999; 54 : 146–165.
13. Databáze registrovaných léčivých přípravků. [on line, cit. 2010-11-01]. Dostupný na WWW: http://www.sukl.cz/modules/medication/search.php
14. Angst, M. S., Clark, J. D. Opioid-induced hyperalgesia: a qualitative systematic review. Anesthesiology, 2006; 104 : 570–587.
15. Málek, J., Ševčík, P., a kol. Léčba pooperační bolesti. Praha, Aeskulap Mladá Fronta, 2009.
16. Wijeysundera, D. N., Bender, J. S., Beattie, W. S. Alpha-2 adrenergic agonists for the prevention of cardiac complications among patients undergoing surgery. Cochrane Database Syst. Rev., 2009; CD004126.
17. Paris, A., Tonner, P. H. Dexmedetomidine in anaesthesia. Curr. Opin. Anaesthesiol., 2005; 18 : 412–418.
18. Wijeysundera, D. N., Naik, J. S., Beattie, W. S. Alpha-2 adrenergic agonists to prevent perioperative cardiovascular complications: a meta-analysis. Am. J. Med., 2003; 114 : 742–752.
19. Isik, B., Arslan, M., Tunga, A. D., Kurtipek, O. Dexmedetomidine decreases emergence agitation in pediatric patients after sevoflurane anesthesia without surgery. Paediatr. Anaesth., 2006;16 : 748–753.
20. Maldonado, J. R., Wysong, A., van der Starre, P. J., Block, T., Miller, C., Reitz, B. A. Dexmedetomidine and the reduction of postoperative delirium after cardiac surgery. Psychosomatics, 2009; 50 : 206–217.
21. Takada, K., Clark, D. J., Davies, M. F., Tonner, P. H., Krause, T. K., Bertaccini, E., Maze, M. Meperidine exerts agonist activity at the alpha(2B)-adrenoceptor subtype. Anesthesiology, 2002; 96 : 1420–1426.
22. Elvan, E. G., Oc, B., Uzun, S., Karabulut, E., Coskun, F., Aypar, U. Dexmedetomidine and postoperative shivering in patients undergoing elective abdominal hysterectomy. Eur. J. Anaesthesiol., 2008; 25 : 357–364.
23. Blaine Easley, R., Brady, K. M., Tobias, J. D. Dexmedetomidine for the treatment of postanesthesia shivering in children. Paediatr. Anaesth., 2007; 17 : 341–346.
24. Bicer, C., Esmaoglu, A., Akin, A., Boyaci, A. Dexmedetomidine and meperidine prevent postanaesthetic shivering. Eur. J. Anaesthesiol., 2006; 23 : 149–153.
25. Málek J., Čtrnáctá E., Kurzová A. Obavy a prožitky pacientů v perioperačním období. Rozhl. Chir., 2004; 83 : 406–410.
26. Massad, I. M., Mohsen, W. A., Basha, A. S., Al-Zaben, K. R., Al-Mustafa, M. M., Alghanem, S. M. A balanced anesthesia with dexmedetomidine decreases postoperative nausea and vomiting after laparoscopic surgery. Saudi Med. J., 2009; 30 : 1537–1541.
27. Lin, T. F., Yeh, Y. C., Lin, F. S., Wang, Y. P., Lin, C. J., Sun, W. Z., Fan, S. Z. Effect of combining dexmedetomidine and morphine for intravenous patient-controlled analgesia. Br. J. Anaesth., 2009; 102 : 117–122.
28. Tufanogullari, B., White, P. F., Peixoto, M. P., Kianpour, D., Lacour, T., Griffin, J., Skrivanek, G., Macaluso, A., Shah, M., Provost, D. A. Dexmedetomidine infusion during laparoscopic bariatric surgery: the effect on recovery outcome variables. Anesth. Analg., 2008; 106 : 1741–1748.
29. Panzer, O., Moitra, V., Sladen, R. N. Pharmacology of sedative-analgesic agents: dexmedetomidine, remifentanil, ketamine, volatile anesthetics, and the role of peripheral mu antagonists. Crit. Care Clin., 2009; 25 : 451–469
30. Málek J., Knor J.,Kurzová A., Lopourová M. Nežádoucí hemodynamické změny během laparoskopických cholecystektomií a možnost jejich potlačení clonidinem v premedikaci. Srovnání intravenózní a intramuskulární premedikace. Rozhl. Chir., 1999; 78 : 286–291.
31. Hirvonen, E. A., Poikolainen, E. O., Paakkonen, M. E., Nuutinen, L. S. The adverse hemodynamic effects of anesthesia, head-up tilt, and carbon dioxide pneumoperitoneum during laparoscopic cholecystectomy. Surg. Endosc., 2000; 14 : 272–277.
32. Dorsay, D. A., Greene, F. L., Baysinger, C. L. Hemodynamic changes during laparoscopic cholecystectomy monitored with transesophageal echocardiography. Surg. Endosc., 1995; 9 : 128–133.
33. McLaughlin, J. G., Scheeres, D. E., Dean, R. J., Bonnell, B. W. The adverse hemodynamic effects of laparoscopic cholecystectomy. Surg. Endosc., 1995; 9 : 121–124.
34. Joris, J. L., Chiche, J. D., Canivet, J. L., Jacquet, N. J., Legros, J. J., Lamy, M. L. Hemodynamic changes induced by laparoscopy and their endocrine correlates: effects of clonidine. J. Am. Coll. Cardiol., 1998; 32 : 1389–1396.
35. Erkola, O., Korttila, K., Aho, M., Haasio, J., Aantaa, R., Kallio, A. Comparison of intramuscular dexmedetomidine and midazolam premedication for elective abdominal hysterectomy. Anesth. Analg., 1994; 79 : 646–653.
36. Virkkila, M., Ali-Melkkila, T., Kanto, J., Turunen, J., Scheinin, H. Dexmedetomidine as intramuscular premedication in outpatient cataract surgery. A placebo-controlled dose-ranging study. Anaesthesia, 1993; 48 : 482–487.
37. Scheinin, H., Jaakola, M.L., Sjovall, S., Ali-Melkkila, T., Kaukinen, S., Turunen, J., Kanto, J. Intramuscular dexmedetomidine as premedication for general anesthesia. A comparative multicenter study. Anesthesiology, 1993; 78 : 1065–1075.
38. Aantaa, R., Jaakola, M. L., Kallio, A., Kanto, J., Scheinin, M., Vuorinen, J. A comparison of dexmedetomidine, and alpha 2-adrenoceptor agonist, and midazolam as i.m. premedication for minor gynaecological surgery. Br. J. Anaesth., 1991; 67 : 402–409.
39. Aantaa, R., Kanto, J., Scheinin, M. Intramuscular dexmedetomidine, a novel alpha 2-adrenoceptor agonist, as premedication for minor gynaecological surgery. Acta Anaesthesiol. Scand., 1991; 35 : 283–288.
Štítky
Chirurgia všeobecná Ortopédia Urgentná medicína
Článok vyšiel v časopiseRozhledy v chirurgii
Najčítanejšie tento týždeň
2010 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Výučba chirurgov v súčasnosti
- Kombinace dexmedetomidinu s ketaminem a opioidy významně potlačuje hemodynamické změny způsobené laparoskopickou cholecystektomií a prodlužuje trvání pooperační analgezie
- Komplikace hojení ran u kuřáků
- Přidružená poranění u zlomenin lopatky
- Úloha Hartmannovej operácie a možnosti jej rekonštrukcie v súčasnosti
- Buried bumper syndrom (BBS) jako komplikace perkutánní endoskopické gastrostomie
- Aneuryzma abdominální aorty – dlouhodobé výsledky léčby
- Současná strategie léčby neurogenního močového měchýře u pacientů s míšními dysrafismy
- Pneumochirurgie v řešení karcinomu kolorekta
- Perforace sigmatu vycestovalým duodenobilárním stentem
- Extragastrointestinální stromální tumor – diagnostická úskalí v kazuistice
- Lymfóm žalúdka ako príčina masívneho krvácania u pacienta s Castlemanovou chorobou
- 75. výročí narození doc. MUDr. Josefa Kopeckého, DrSc.
- Zápis z jednání schůze výboru ČCHS dne 11. 2. 2010
- Rozhledy v chirurgii
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Úloha Hartmannovej operácie a možnosti jej rekonštrukcie v súčasnosti
- Buried bumper syndrom (BBS) jako komplikace perkutánní endoskopické gastrostomie
- Komplikace hojení ran u kuřáků
- Současná strategie léčby neurogenního močového měchýře u pacientů s míšními dysrafismy
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



