Gastrointestinální stromální a jiné mezenchymální tumory žaludku – laparoskopické řešení?
Gastrointestinal Stromal and Other Mesenchymal Gastric Tumors – Laparoscopic Management?
Introduction:
This study was aimed to evaluate a set of gastrointestinal stromal tumors (GIST) of the stomach managed with a laparoscopic technique (GIST).
Materials and methods:
The study covers a period from January 1, 2007 until December 31, 2009 during which 12 patients underwent the laparoscopic removal of stomach tumors in the Regional Hospital in Pardubice. In all cases tumors were removed completely in a laparoscopic way, including the healthy border of the stomach tissue. The defect created in the stomach wall was sutured laparoscopically as well. On completion the sufficiency of the sutures was reviewed gastroscopically.
Results:
No death was observed in our study. Two patients suffered from wound infection (secondary healing), one of them requiring repeat surgery owing to the excessive narrowing of the distal part of the stomach. The dehiscence of the laparoscopic suture or other intraabdominal complications was not observed. 3 patients underwent chemotherapy by Imitinib. During surveillance all patients were free of signs of tumor progression or local recurrence.
Discussion:
Gastric GISTs are very rare tumors but their incidence is increasing. At this time the consensus about the necessity of preoperative unambiguous differentiation between malignant or less malignant variants is not available. The strict differentiation is very difficult and the determination to choose a more radical surgical approach for more malignant variants is not clear-cut.
Conclusion:
In case of gastric GIST the local removal of a tumor with the healthy border of the stomach tissue may be chosen as an adequate approach. Our results support this local surgical approach.
Key words:
GIST – stomach laparoscopy
Autoři:
L. Sákra; J. Šiller; P. Vyhnálek *; M. Hácová **
Působiště autorů:
Fakulta zdravotnických studií Univerzity Pardubice
Chirurgická klinika Krajské nemocnice Pardubice a. s., přednosta: doc. MUDr. J. Šiller, Ph. D.
; Interní klinika, přednosta MUDr. P. Vyhnálek, Ph. D.
*; Patologicko-anatomické oddělení a oddělení soudního lékařství, přednosta: MUDr. P. Rothrockel
**
Vyšlo v časopise:
Rozhl. Chir., 2010, roč. 89, č. 6, s. 352-355.
Kategorie:
Monotematický speciál - Původní práce
Souhrn
Úvod:
Cílem práce je zhodnotit soubor laparoskopicky řešených gastrointestinálních stromálních tumorů (dále GIST) žaludku.
Materiál a metodika:
Práce zpracovávám období od 1. 1. 2007 do 31. 12. 2009. V tomto časovém rozmezí byla v Krajské nemocnici Pardubice provedena laparoskopická excize tumorů žaludku u 12 pacientů. Vždy byla provedena kompletní laparoskopická excize útvaru se zdravým lemem žaludeční stěny. Defekt ve stěně žaludku byl uzavřen laparoskopickou suturou.V závěru operačního výkonu byla laparoskopická sutura kontrolována peroperační gastroskopií.
Výsledky:
V našem souboru se nevyskytlo žádné úmrtí, u dvou pacientů jsme zaznamenali sekundární hojení operační rány, v jednom případě jsme byli nuceni provést reoperaci pro přílišné zúžení vývodné části žaludku. Dehiscenci či poruchu hojení laparoskopické sutury jsem nezaznamenali ani jednou. Jiné komplikace se v našem souboru nevyskytly. Tři pacienti podstoupili chemoterapii Imitinibem. Během sledování jsme nezjistili žádnou lokální recidivu, ani jsme nezaznamenali celkovou progresi nádoru.
Diskuse:
GIST žaludku jsou tumory vzácné, ale jejich incidence se zvětšuje. Doposud nepanuje jednoznačná shoda, zda je nutné předoperačně tumory jednoznačně odlišit na maligní a méně maligní varianty. Toto striktní předoperační rozdělení je velmi obtížné a není zcela zřejmé, jestli je nutné u maligních variant volit více radikální chirurgický přístup než pouhou excizi.
Závěr:
V případě GIST žaludku lze jako vhodný a dostatečný chirurgický postup volit kompletní laparoskopickou excizi tumoru žaludeční stěny s bezpečnostním lemem zdravé tkáně. Tento lokální chirurgický přístup naše výsledky jednoznačně podporují.
Klíčová slova:
GIST – laparoskopie žaludku
ÚVOD
Cílem práce je zhodnotit soubor laparoskopicky řešených gastrointestinálních stromálních tumorů (dále GIST) žaludku. Vyhodnotit vhodný chirurgický přístup vzhledem k charakteru těchto tumorů.
Benigní tumory žaludku jsou poměrně vzácné. Patří mezi ně adenomy, které jsou jasnou prekarcenózou, lipomy, leiomyomy, neurogenní tumory (Schwannomy, gangliotické paragangliomy, paragangliomy) a GIST. Termín gastrointestinální stromální tumor byl zaveden jako neutrální název pro skupinu mezenchymálních nádorů trávicího ústrojí, které nemohou být řazeny mezi nádory původu neurogenního nebo z hladké svaloviny [1]. Všeobecně uznávaným diagnostickým kritériem pro zařazení daného mezenchymálního tumoru mezi GIST je imunohistochemický průkaz c-kit (CD 117) genové exprese [2, 3]. Incidence GIST v posledních 10 letech roste. GIST je většinou provázen mutací genu KIT a PDGFRA, které jsou zodpovědné za tvorbu receptorových tyrosin-kinas. Proto tyto nádory produkují růstový faktor receptoru s tyrosin-kinasovou aktivitou. Zvýšená až velmi vysoká tyrosin-kinasová aktivita v případě maligních variant tohoto nádoru vede k buněčné proliferaci a rezistenci k apoptóze. Právě vzhledem k různé tyrosin-kinasové aktivitě tyto nádory představují široké klinické spektrum tumorů od benigních až po maligní varianty. Imunohistochemický průkaz tyrosin-kinasy v klinické a patologické praxi odliší GIST od ostatních mezenchymálních nádorů. GIST žaludku vzniká z intersticiálních pacemakerových Cajalových buněk nebo málo diferencovaných prekurzorových buněk (z kterých Cajalovy buňky vznikají). Tyto buňky jsou lokalizovány mezi myenterickým nervovým plexem a vrstvou hladké svaloviny stěny trávicího ústrojí [4, 5]. Další charakteristikou těchto tumorů je jejich rezistence na chemoterapii vyjma Imatinib mesylate.
Tumory s nízkým maligním potenciálem mají velmi dobrou prognózu po pouhé chirurgické terapii (5 years survival rate > 90 %). Naproti tomu nádory s vysokým maligním potenciálem mají špatnou prognózu přes kombinaci chirurgické terapie a chemoterapie Imitinibem (median survival < 12 měsíců).
Vzhledem k popsanému chování a omezeným možnostem další terapie je u GIST doporučována kompletní resekce útvaru bez nutnosti lymfadenektomie a širokých resekčních okrajů [6, 7]. Pro odstranění GIST žaludku se jako velmi vhodná metoda jeví laparoskopie [8, 9, 10]. Základní diagnostika je prováděna pomocí gastroskopie s odběrem biopsií. Zde je nutné poznamenat, že biopsie odebrána při gastroskopii je až na výjimky negativní. Proto je zcela nezbytným krokem v diagnostickém algoritmu provedení endosonografie s odběrem biopsie z hlubších vrstev. Celkový obraz a předoperační staging doplňuje provedení CT, fakultativně magnetické rezonance a rentgenkontrastní vyšetření žaludku.
GIST tvoří 2–5 % všech nádorů trávicího ústrojí, metastazuje do jater, měkkých částí dutiny břišní (peritoneum, omentum) a do retroperitonea. Do kostí a plic metastazuje velmi vzácně. Průměrně 20–25 % žaludečních a 40–50 % intestinálních GIST je maligních 11. Více agresivněji a větší maligní potenciál mají GIST tenkého střeva než žaludku. Též v mladším věku jsou tyto tumory více agresivní [12, 13].
Mezi nejběžnější symptomy kterými se GIST projevují jsou: bolest, krvácení do trávicího ústrojí, anémie a dyspepsie. Průměrná doba přežití je literárně udávána v rozmezí od 40,8 do 130,8 měsíců a pětileté přežití je od 53,9 % do 74,7 % [14, 15, 16]. Incidence GIST byla v letech 2001 až 2005 v České republice 0,52 případů na 100 000 obyvatel. Průměrná doba přežití v České republice je 93,2 měsíce a pětileté přežití je 78,3 % [17].
CÍL
Cílem práce je zhodnotit soubor laparoskopicky řešených GIST žaludku. Vyhodnotit vhodný chirurgický přístup vzhledem k charakteru těchto tumorů.
MATERÁL A VÝSLEDKY
Práce zpracovávám období od 1. 1. 2007 do 31. 12. 2009. V tomto časovém rozmezí bylo v Krajské nemocnici Pardubice provedena laparoskopická excize tumorů žaludku u 12 pacientů (Tab. 1).
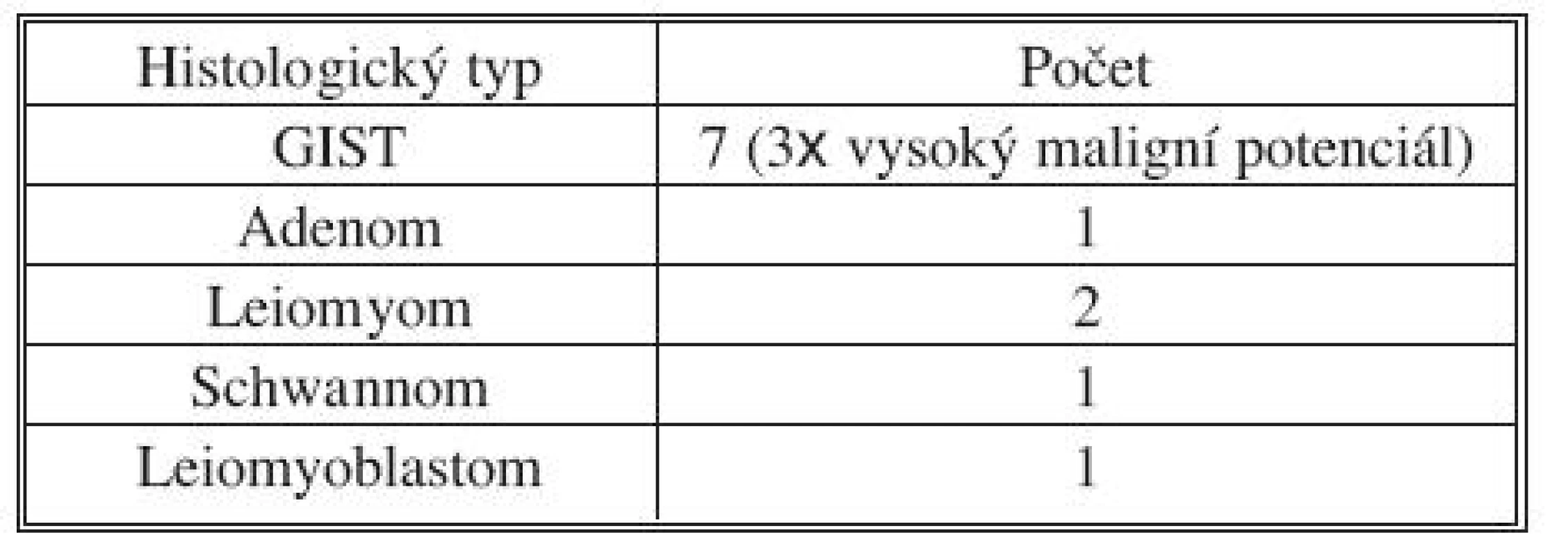
Předoperačně byla vždy prováděna endoskopická předoperační tetováž. V osmi případech bylo nutné provést peroperační gastroskopii k přesné lokalizaci hranic tumoru. K laparoskopickému přístupu byly použity 4 porty, ve dvou případech 5 portů. 10mm port pro kameru byl zaveden nad pupkem, 10mm a 5mm pracovní porty byly zavedeny vlevo a vpravo od pupku a další pomocný 5mm port byl zaveden v levém (event. i v pravém podžebří). Následovala laparoskopická excize tumoru pomocí harmonického skalpelu s laparoskopickou suturou vzniklého defektu stěny žaludku. Sutura byla prováděna ve dvou řadách nejprve pokračujícím a ve druhé řadě jednotlivými Vicrylovými stehy. Po dokončení sutury byla její suficientnost kontrolována gastroskopicky. Pouze v jednom případě lokalizace ložiska na hraně velké kurvatury dovolovala provést klínovitou excizi tumoru s použitím dvou nábojníků lineárního stapleru. Preparát byl vždy odstraňován z břišní dutiny v polyetylenovém sáčku mírně rozšířenou excizí nad pupkem.
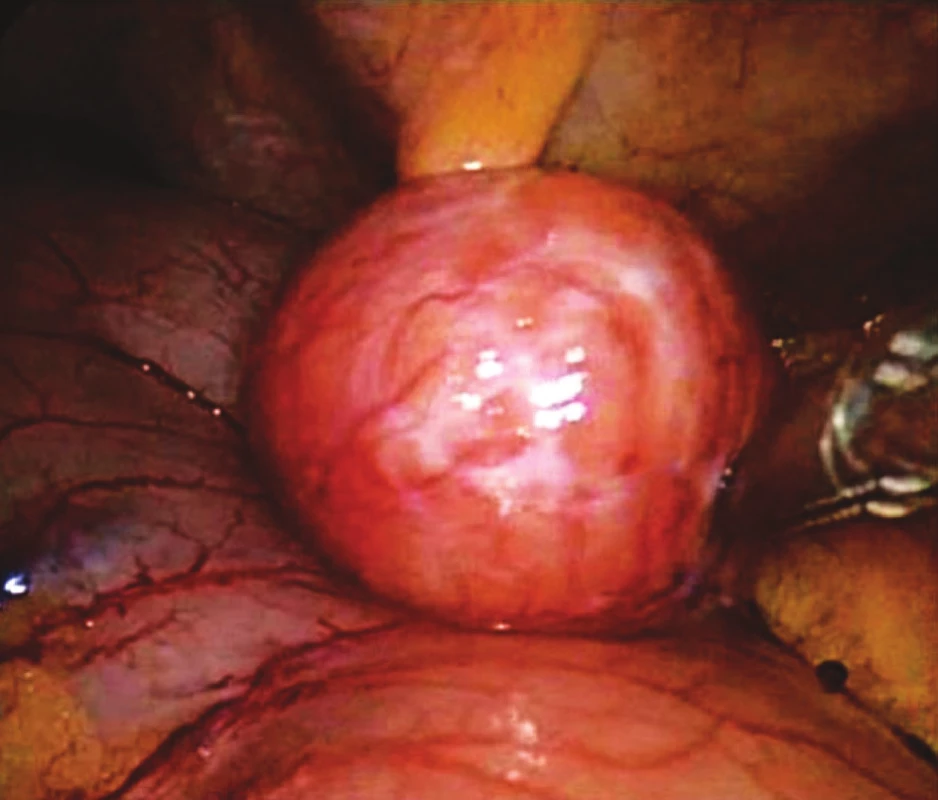
Nazogastrická sonda byla odstraňována 2–3. pooperační den, střevní pasáž byla obnovena též 2–3. pooperační den. Dimise pacientů byla vždy mezi 3–5. pooperačním dnem. Gastroskopická kontrola s odběrem biopsií a UZ kontrola byla prováděna s odstupem 2 měsíců, půl roku a dále jsou kontroly plánovány po půl roce. Endosonografická kontrola prováděna nebyla.
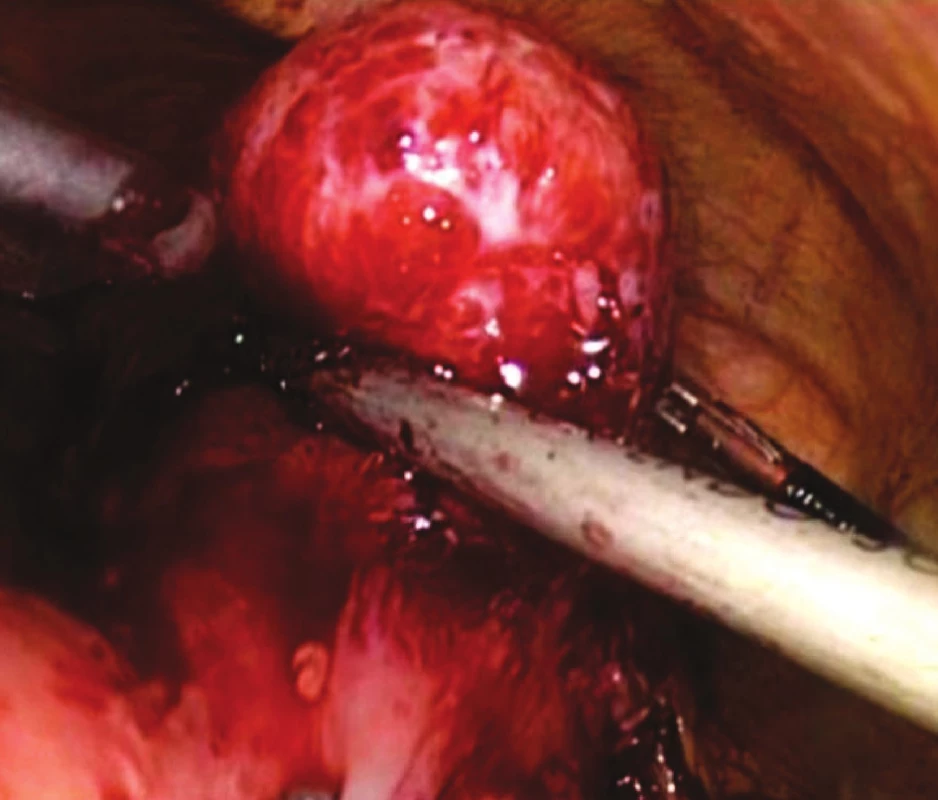
VÝSLEDKY
V našem souboru se nevyskytlo žádné úmrtí v přímé souvislosti s provedeným operačním výkonem. Vzhledem k maligní variantě GIST 3 pacienti podstoupili chemoterapii Imitinibem. U pacienta s leiomyoblastomem nebyla podle histologického gradingu chemoterapie nutná. U dvou pacientů jsme zaznamenali sekundární hojení operační rány nad pupkem, kterou byl odstraňován preparát. V jednom případě jsme byli nuceni provést reoperaci pro přílišné zúžení vývodné části žaludku suturou po provedené excizi tumoru lokalizovaného příliš blízko pyloru. Reoperaci (resekci žaludku typ BII v Rouxově modifikaci) jsme provedli otevřeným přístupem. Dehiscenci či poruchu hojení laparoskopické sutury jsem nezaznamenali ani jednou. Jiné komplikace se v našem souboru nevyskytly. Podle histologického zpracování ani v jednom případě nedosahoval tumor k okrajům excize.
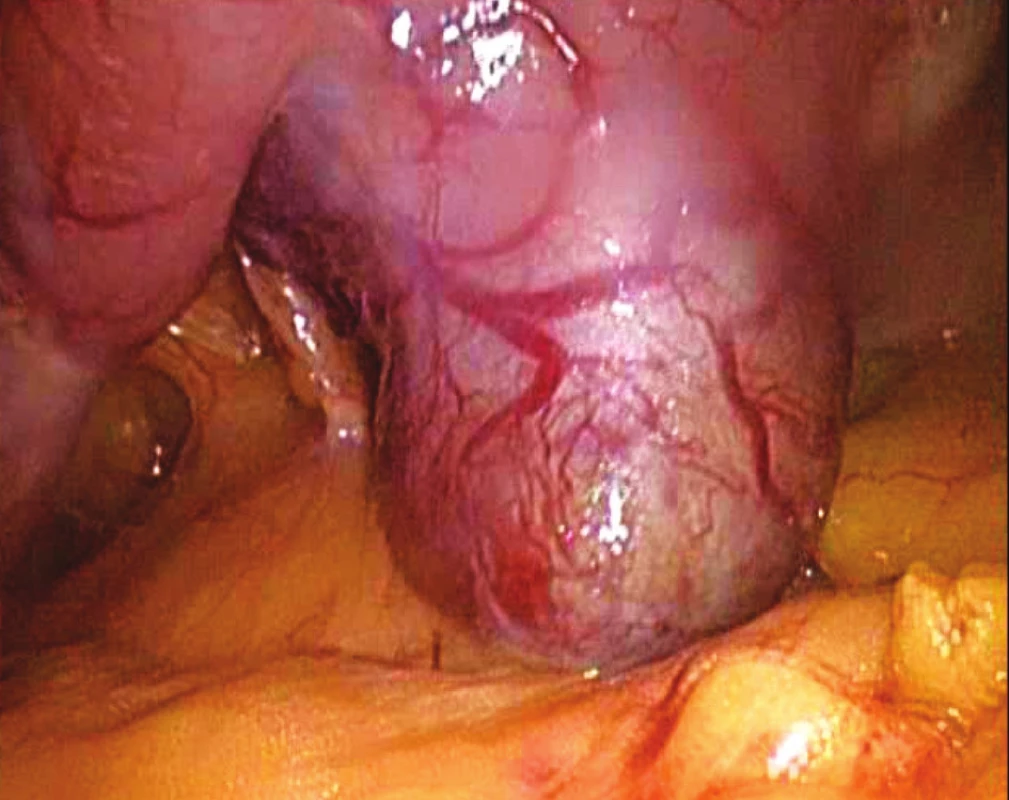
Během sledování jsme nezjistili žádnou lokální recidivu, ani jsme nezaznamenali celkovou progresi nádoru a to ani v případě maligních variant GIST.
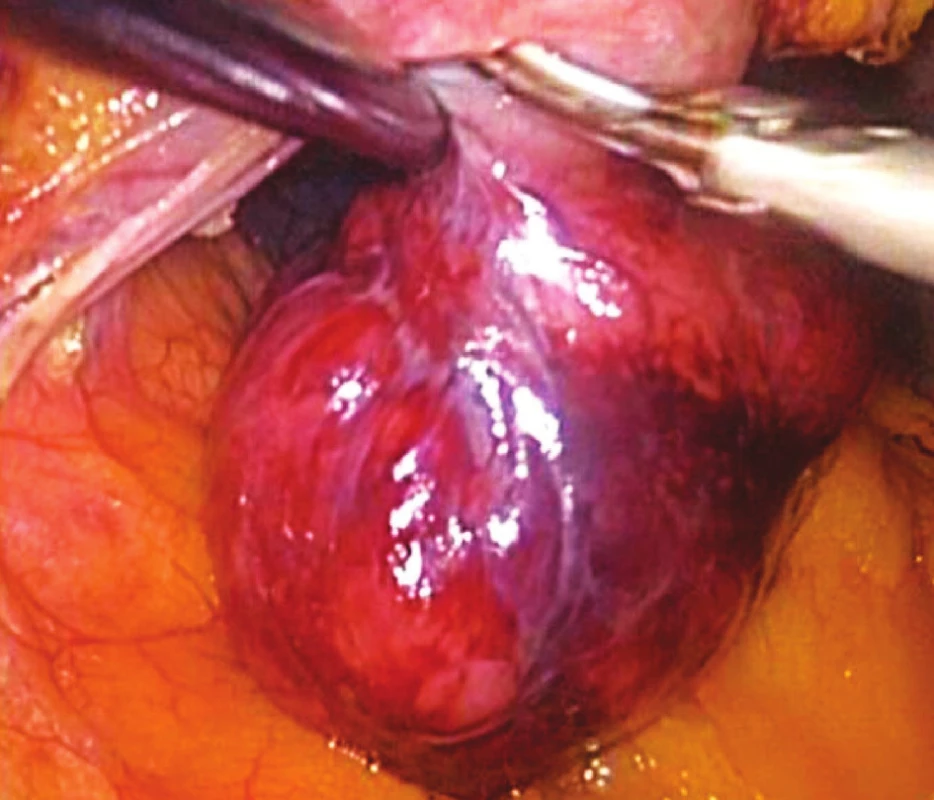
DISKUSE
Teoreticky by předoperační gastroskopická tetováž spolu s ostatními zobrazovacími technikami měla být dostatečná k lokalizaci tumoru a jeho okrajů pro laparoskopický přístup. Prakticky se nám potvrdilo, že tato tetováž nemá velký význam. V případě velkých tumorů ji není třeba a u tumorů nevelkých nebo plošných je nepřesná. Na rozdíl od tetováže střeva se barva vzhledem k vydatné lymfatické drenáži žaludeční stěny příliš „rozpije“ a není k určení okrajů tumoru užitečná. U lokalizačně nejasných nálezů se nám spíše osvědčila peroperační gastroskopická lokalizace za současného laparoskopického pohledu. Použití gastroskopu po dokončení výkonu je též vhodné k ověření suficietnosti sutury a průchodnosti žaludku.
Předoperační provedení endosonografie je naprosto nezbytné a je to základní a určující vyšetření. Nejenom že dobře zhodnotí ohraničení tumoru, ale pouze odběr biopsie při endosonografii je přínosný. Biopsie odebraná při gastroskopii je téměř ve všech případech vzhledem k intaktní sliznici žaludku negativní. Zkušený endosonografista je nezřídka již z pouhého sonografického obrazu schopen velmi přesně odhadnout povahu a typ tumoru.
Vlastní provedení laparoskopické excize je výkon pro pracoviště se zkušenostmi s laparoskopickou chirurgií horní části trávicí trubice standardní. Obtížněji se excidují tumory na zadní stěně žaludku. Transgastrický přístup s provedením gastrotomie přední stěny žaludku se nám zdá příliš komplikovaný. Po uvolnění přední kurvatury žaludku, otevření omentální burzy a vyzvednutí přední stěny žaludku lze excizi i ze zadní stěny žaludku provést bez větších obtíží [8, 9].
Podle literárních zdrojů by měla excize tumoru se širokými okraji (prováděná otevřeným nebo laparoskopickým přístupem) být dostatečnou terapií a to i při použití laparoskopického postupu. Toto jednoznačně platí u histologicky prokázaných adenomů, leomyomů a jiných benigních mezenchymálních nádorů [7, 10]. U GIST žaludku by mohla být situace poněkud komplikovanější. Vzhledem k nedostatečnému počtu pacientů v dříve provedených souborech a hlavně vzhledem k velmi obtížnému porovnávání jednotlivých pacientů při velmi různorodém histologickém složení nádorů je určení nejvhodnějšího chirurgického postupu stále obtížné a v současné době předoperačně těžko definovatelné. Právě podrobnější určení předoperačního gradingu představuje největší problém při plánování vhodného operačního výkonu. V odebraných slizničních vzorcích při gastroskopii jsou maligní elementy zastiženy ve velmi malém počtu pacientů. Vzorky odebrané při endosonografii jsou zpracovávány jako cytologické a stanovení tyrosin-kinasové aktivity je velmi problematické [2, 3, 12]. Proto jednoznačná identifikace, který z tumorů má vysoký maligní potenciál je předoperačně nejisté. Stejná situace je i u použití zmrazovacích peroperačních histologických technik. Pokud však připustíme možný vysoký maligní potenciál některých operovaných tumorů, není vhodné provést radikálnější výkon? Pokud bychom předoperačně dokázali jednoznačně a nepochybně prokázat vysoký maligní potenciál tumoru bylo by vhodné zvážit jako adekvátní výkon resekci žaludku. Vzhledem k výše uvedenému a vzhledem k výsledkům byť nevelkých studií se však ukazuje lokální excize jako vhodný a dostačující výkon. Naše vlastní výsledky toto podporují.
ZÁVĚR
Vzhledem ke zvyšující se incidenci GIST je nutné těmto typům nádorů věnovat cílenou pozornost. Laparoskopický přístup se zdá velmi výhodný pro většinu nemocných. V případě GIST žaludku lze kompletní laparoskopický přístup volit k excizi tumoru žaludeční stěny s bezpečnostním lemem zdravé tkáně. Tento lokální chirurgický přístup bez nutnosti přidružené lymfadenektomie se zdá z onkologického hlediska dostatečně radikální i u maligních variant GIST. Naše výsledky toto jednoznačně podporují.
MUDr. L. Sákra, Ph.D.
Fakulta
zdravotnických studií Univerzita Pardubice
Chirurgická
klinika, Krajská nemocnice Pardubice a.s.
Kyjevská
44
532
03 Pardubice
Zdroje
1. Mazur, M. T., Clark, H. B. Gastric stroma tumors: Reappraisal of histogenesi. Am. J. Surg. Pathos., 1983, č. 7, s. 507–519.
2. Sarlomo-Rikala, M., Kovatich, A., Barusevicius, A., et al. CD 117: A sensitive marker for gastrointestinal stroma tumors that is more specific than CD 34. Mod. Pathol., 1998, č. 11, s. 728–734.
3. Miettinen, M., Sarlomo-Rikala, M., Lasota, J. Recent advances in understanding of thein biology. Human Patology, 1999, roč. 30, č. 10, s. 1213–1218.
4. Mucciarini, C., Rossi, G., Bertolini, F., et al. Incidence and clinicopathologic features of gastrointestinal stroma tumors. A population-based study. BMC Cancer, 2007, roč. 7, č. 230, s. 1186.
5. Nilsson, B., Bumming, P., Meis-Kindblom, J. M., et al. Gastrointestinal stromal tumors: the incidence, prevalence, clinical course, and prognostication in the preimatinib mesylate era. A population based study in western Sweden. Cancer, 2005, č. 103, s. 821–829.
6. Wu, T., Lee, L., Yeh, Ch., Wu, P., Chao, T., et al. Surgical treatment and prognostic analysis for gastrointestinal stroma tumor sof the small intestine: efore era of imatinib mesylate. BMC Gastroenterol., 2006, roč. 6, č. 29, s. 323–341.
7. Wente, M., Buchler, M., Weitz, J. Gastrointestinal stromal tumors (GIST). Surgical therapy. Chirurg, 2008, roč. 79, č. 7, s. 638–643.
8. Warsi, A., Peyser, P. Laparoscopic resection of gastric GIST and benign gastric tumors: evolution of a new technique. Surg. Endosc., 2009, č. 9, s. 561–569.
9. Basso, N., Rosato, P., De Leo, A., Picconi, T., Trentino, P., Fantini, A., et al. Laparoscopic treatment of gastric stromal tumors. Surg. Endosc., 2000, roč. 14, č. 6, s. 524–526.
10. Everest, M., Gutman, H. Gastrointestinal stromal tumors. Surg. Oncol., 2008, r. 15, č. 8, s. 588–593.
11. Miettinen, M., Lasota, J. Gastrointestinal stroma tumors: review on morphology, molecular pathology, prognosis, and differential diagnosis. Arch. Pathol. Lab. Med., 2006, č. 130, s. 1466–1478.
12. Rabin, I., Chilkman, B., Lavy, R., Sandbank, J., Maklakovsky, M., Gold-deutch, R., Halpren, Z., Wassermann, I., Halevy, A. Gastrointestinal stromal tumors: A 19 year experience. IMAJ, 2009. č. 12, s. 98–102.
13. Rutkowski, P., Nowecki, Z. I., Michej, W., et al. Risk criteria and prognostic factors for predicting recurrences after resection of primary gastrointestinal stromal tumors. Ann. Surg. Oncol., 2007, č. 14, s. 2018–2027.
14. Rubió, J., Narcis-Gragera, R., Ortiz, M. R., et al. Population based incidence and survival of gastrointestinal stroma tumors (GIST) in Gerona, Spain. Eur. J. Cancer, 2007, č. 43, s. 144–148.
15. Brabec, P., Sufliarsky, J., Linke, Z., et al. A whole population study of gastrointestinal stroma tumors in the Czech Republic and Slovakia. Neoplasma, 2009, roč. 56, č. 5, s. 459–463.
16. Buchler, P., Morel, P. Rev Med Suisse. 2008, roč. 25, č. 4, s. 1567–1570.
17. Miettinen, M., Lasota, J. Gastrointestinal stromal tumors – definition, clinical, histological, imunohistochemical and molecular genetic features and differential diagnosis. Virchov. Arch., 2001, č. 438, s. 1–12.
Štítky
Chirurgia všeobecná Ortopédia Urgentná medicínaČlánok vyšiel v časopise
Rozhledy v chirurgii

2010 Číslo 6
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
Najčítanejšie v tomto čísle
- Náhrady medzistavcových platničiek v liečbe degeneratívnych ochorení krčnej chrbtice
- Laparoskopická hernioplastika TAPP v liečbe slabinovej prietrže – 10-ročné skúsenosti
- Abdominální katastrofa – pohled chirurga
- Kvalita života po gastrektomii
