Možnosti a výsledky chirurgického riešenia benígnej tracheoezofageálnej fistuly
Possibilities and Results of Surgical Treatment of Benign Tracheoesophageal Fistula
Aim:
Review of literature and a single-institution retrospective analysis of possibilities and results of various surgical techniques in treatment of benign tracheoesophageal fistula (TEF).
Material and methods:
Between 1995 and 2010, 26 patients with benign tracheoesophageal fistula of various etiology underwent surgical treatment at the Department of Thoracic Surgery of Slovak Medical University and Faculty Hospital in Bratislava. The majority of patients had a postintubation TEF (21 cases), two fistulas were of traumatic origin, one iatrogenic, one congenital with adulthood manifestation and one tracheo-neoesophageal (TNEF) following an esophagectomy for carcinoma via extended cervical approach with lymphadenectomy and sternal retraction adpoted from transcervical extended mediastinal lymphadenectomy. We review the possible means of surgical treatment of TEF, of which we most frequently used segmental tracheal resection with end-to-end anastomosis and a non-overlying suture of the esophageal defect without muscle flap interposition (16 patients), transsection of the fistula with muscular flap interposition via cervical (2 patients) or transthoracic (1 patient) approach; or a T-tube insertion with (1 patient) or without (5 patients) discision and suture of the TEF. The only tracheo-neoesophageal fistula in our experience had been treated by neoesophagectomy, covering of tracheal defect by intercostal muscle flap and cervical esophagostomy.
Results:
Short- and long-term results of TEF treatment in our institution have been favourable, with perioperative mortality of 3.8% (the patient with tracheo-neoesophageal fistula). Morbidity included 1 partial tracheal anastomotic dehiscence, 3 temporary left recurrent nerve palsies, temporary deglutition disorders (15 patients), tracheal anastomosis granulations in 1 patient and 2 wound infections. Out of 26 patients 15 (58%) are being followed-up on a regular basis, all with good (12 patients) or satisfactory (3 patients) functional results.
Conclusion:
In the paper we analyze the advantages and disadvantages of various techniques and their alternatives in the treatment of TEF. As the most reliable and suitable solution for patients with postintubation TEF, breathing spontaneously and with acceptable nutritional status, we favour segmental trachea resection with end-to-end anastomosis and esophageal suture without muscle interposition, regardless of presence of concomitant tracheal stenosis. Fistulae of other etiologies require diverse approaches, especially tailored with respect to their location. Management of tracheo-neoesophageal fistula following esophagectomy for carcinoma is extremely demanding. Therefore, it is crucial to adhere to basic rules of prevention of such benign but potentially fatal entities as TEF and TNEF.
Key words:
benign tracheoesophageal fistula – tracheo-neoesophageal fistula – surgical treatment
Autoři:
T. Krajč; M. Janík; M. Lučenič; R. Benej; S. Haruštiak
Působiště autorů:
Klinika hrudníkovej chirurgie SZU a FNsP Bratislava, Slovenská republika
prednosta prof. MUDr. Svetozár Haruštiak, CSc.
Vyšlo v časopise:
Rozhl. Chir., 2010, roč. 89, č. 8, s. 478-489.
Kategorie:
Monotematický speciál - Původní práce
Souhrn
Cieľ:
Retrospektívna analýza možností a výsledkov rôznych techník chirurgickej liečby benígnych tracheoezofageálnych fistúl (TEF) vo vlastnom súbore pacientov a literárny prehľad.
Materiál a metodika:
V rokoch 1995–2010 sme na Klinike hrudníkovej chirurgie SZU a FNsP Bratislava operačne riešili benígnu tracheoezofageálnu fistulu (TEF) u 26 pacientov s rôznorodou etiológiou fistuly. Najčastejšie išlo o postintubačné fistuly (21 prípadov), dve fistuly boli posttraumatické, 1 iatrogénna, 1 pravdepodobne kongenitálna a 1 tracheoneoezofageálna po ezofagektómii pre karcinóm z transcervikálneho prístupu s trakciou sterna. V práci uvádzame prehľad možností liečby TEF, z ktorých sme najčastejšie využili segmentálnu resekciu trachey s anastomózou end-to-end a sutúru pažeráka v rôznych úrovniach bez interpozície svalového flapu (16 pacientov), transekciu fistuly s muskulárnym interpozitom z krčného (2 pacienti) či transtorakálneho (1 pacient) prístupu alebo implantáciu T-kanyly s (1 pacient) či bez (5 pacienti) discízie a sutúry fistuly. Tracheoneoezofageálnu fistulu (TNEF) sme riešili resekciou neoezofagu, krytím defektu membranacey periostomuskulárnym lalokom a krčnou ezofagostómiou.
Výsledky:
Krátkodobé i dlhodobé výsledky liečby boli v našom súbore dobré, perioperačná mortalita 3,8 % (1 pacient s TNEF), morbidita zahŕňala 1 parciálnu dehiscenciu tracheálnej anastomózy, 3 prechodné parézy n. recurrens vľavo, prechodné poruchy prehĺtania (15 pacientov), granulácie v tracheálnej anastomóze u 1 pacienta a 2 infekcie v rane. Z 26 pacientov je dlhodobo sledovaných 15 (58 %), všetci s dobrým (12 pacientov) alebo uspokojivým (3 pacienti) efektom operácie.
Záver:
V práci analyzujeme výhody a nevýhody jednotlivých techník a ich alternatívy. Za najvhodnejšie riešenie u pacienta s postintubačnou TEF, ktorý je na spontánnej ventilácii a v primeranom nutričnom stave, považujeme segmentálnu resekciu trachey s anastomózou end-to-end a sutúrou pažeráka bez svalového interpozita, nezávisle na prítomnosti súčasnej tracheálnej stenózy. Fistuly inej etiológie si vyžadujú rôznorodé prístupy najmä v závislosti od ich lokalizácie. Veľmi náročná je liečba tracheoneoezofageálnej fistuly (TNEF) po resekcii pažeráke pre karcinóm. Prevencii benígnych ochorení s možnými fatálnymi následkami, akými sú TEF i TNEF je nevyhnutné venovať náležitú pozornosť.
Kľúčové slová:
benígna tracheoezofageálna fistula – tracheo-neoezofageálna fistula – chirurgická liečba
ÚVOD
Výskyt postintubačnej benígnej tracheoezofageálnej fistuly (TEF) v dôsledku zavedenia veľkoobjemových nízkotlakých balónikov výrazne poklesol [1]. Stále však nadmerná inflácia balónika, nevhodná veľkosť tracheostomickej kanyly, súčasná prítomnosť nazogastrickej sondy, nestabilita tracheostomickej kanyly s prílišnou voľnosťou pohybu, prítomnosť infekcie, nekontrolovaného gastroezofageálneho refluxu, prípadne nutnosť podávania steroidov a diabetes môžu byť príčinami jej vzniku [2–4]. Z historického hľadiska je zaujímavé, že spomedzi 36 pacientov ošetrených pre ezofagorespiračnú fistulu na Mayo Clinic v Rochestri v rokoch 1916–1965 nebol ani jeden s postintubačnou TEF [5].
Omnoho zriedkavejšie sa stretávame s kongenitálnou fistulou pretrvávajúcou s minimálnou symptomatológiou do dospelosti [6] alebo s jej recidívou po operácii v detskom veku [7].
Raritne bývajú opisované TEF po ingescii cudzieho telesa [8] alebo na podklade direktnej [9] či indirektnej traumy [10, 11]. V niektorých súboroch sa prechodne objavujú fistuly na podklade histoplazmózy [3] alebo poleptania pažeráka lúhom [12].
Medzi iatrogénne možno okrem fistúl po dilatáciách benígnej stenózy pažeráka zaradiť aj etiologicky odlišné fistuly medzi tracheou a tubulizovaným žalúdkom po ezofagektómii pre karcinóm [13–15].
Voľba stratégie radikálneho výkonu sa skôr než od etiológie fistuly odvíja od jej rozsahu a lokalizácie, závažnosti symptómov a celkového stavu pacienta [15]. V práci opisujeme vlastné skúsenosti s 26 TEF rôznorodej etiológie, ktorých liečbu sme sa snažili prispôsobiť uvedeným faktorom. Nie vždy bola radikálna intervencia možná; v takých prípadoch sme dosiahli uspokojivý výsledok s využitím T-kanyly.
MATERIÁL A METÓDA
Pacienti
V rokoch 1995–2010 sme na Klinike hrudníkovej chirurgie SZU a FNsP Bratislava operovali 26 pacientov s benígnou tracheoezofageálnou fistulou (Tab. 1). Takmer u všetkých našich pacientov bola tracheoezofageálna fistula dôsledkom dlhodobej umelej pľúcnej ventilácie cestou tracheostómie (19 pacientov) alebo orotracheálnej kanyly (2 pacienti). O súčasnom dlhodobom zavedení nazogastrickej sondy nemáme vierohodné informácie, nutritívnu gastrostómiu počas UPV však mali len dvaja z nich. Napriek všetkým preventívnym opatreniam jedna pacientka v našom súbore mala fistulu vzniknutú na našom pracovisku. Dĺžka dlhodobej UPV sa pohybovala od 10 do 62 dní (medián 21 dní). Medzi príčinami dlhodobej UPV boli polytraumatizmus s poranením hlavy, cerebrovaskulárne príhody, kardiálne zlyhanie po infarkte myokardu či respiračné zlyhanie po predchádzajúcom operačnom výkone.

Jedného pacienta sme operovali pre tracheoezofageálnu fistulu symptomatickú 7 mesiacov po ezofagoskopickom odstránení kuracej kosti zakliesnenej vysoko 20 cm od zuboradia.
Druhá posttraumatická fistula v našom súbore bola vlastne devastačným tupým poranením krku u 22-ročného motorkára, ktorý mal kompletnú ruptúru krčnej trachey 2 cm pod krikoidnou chrupkou so 7cm distrakciou koncov a subtotálnu ruptúru krčného pažeráka. U nás bol riešený rekonštrukciou až s odstupom 2 týždňov po iniciálnej terminálnej tracheostómii na pôvodnom pracovisku.
Iatrogénna fistula spôsobená uvoľnením osteosyntetického materiálu po prednej stabilizácii zlomeniny krčnej chrbtice vo výške C6 so sprievodným poranením miechy sa u nášho pacienta iniciálne diagnostikovala ako osteokutánna a ezofagokutánna fistula s hlbokou krčnou infekciou. Súčasnú tracheoezofageálnu fistulu sme zistili až po odstránení osteosyntetického materiálu a dvojtýždňovej sanácii sŕkavým drénom. Vzhľadom na pretrvávajúci ťažký neurologický deficit boli možnosti našej intervencie veľmi obmedzené.
Pravdepodobne kongenitálna bola široká suprakarinálna fistula u pacienta, ktorý k nám prišiel z Nemocnice pre odsúdených. V anamnéze však mal úmyselnú ingesciu žiletky s pasážou per vias naturales vo väzení pred 19 rokmi, čo mohlo k vzniku fistuly prispieť. Až na recidivujúce ľavostranné bronchopneumónie nemal pacient typické ťažkosti v zmysle kašľa po prehltnutí tekutín či tuhej potravy, čo vzhľadom na veľkosť fistuly 1 x 2 cm bolo prekvapujúce.
Do súboru sme zaradili tiež pacienta s tracheo-neoezofageálnou fistulou, manifestnou na 19. deň po ezofagektómii pre epidermoidný karcinóm strednej tretiny pažeráka. Po prevzatí techniky transcervikálneho prístupu do mediastína pri ezofagektómii s trakciou sterna od autorov transcervikálnej extendovanej mediastinálnej lymfadenektómie (TEMLA) [16] sme využili takýto krčný prístup u troch pacientov s karcinómom pažeráka (Obr. 6). Daňou za vynikajúcu expozíciu až pod úroveň bifurkácie trachey bola v jednom prípade extenzívna devaskularizácia trachey a hlavných bronchov, čo pravdepodobne v kombinácii s dehiscenciou ezofagogastro-anastomózy viedlo k rozvoju tracheo-neoezofageálnej fistuly 5 cm nad karinou.
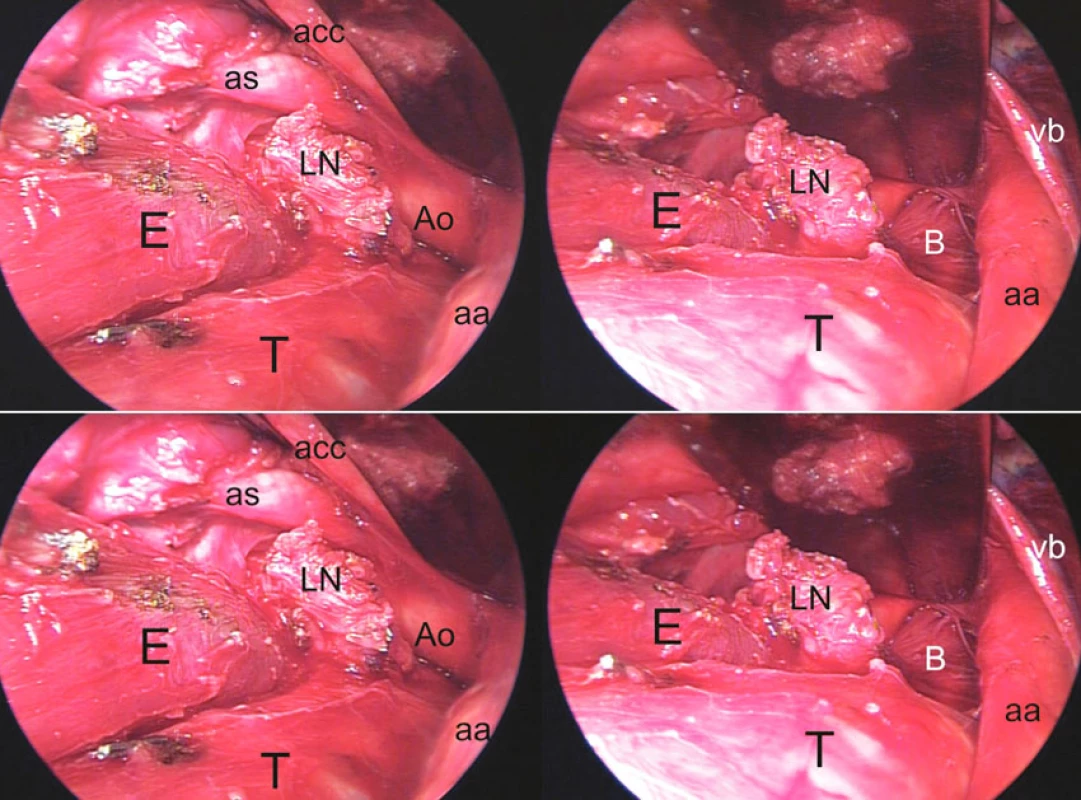
Symptómy a diagnóza fistuly
Najčastejšími známkami TEF retrospektívne zistenými z dokumentácie ventilovaných pacientov boli ťažkosti s utesnením dýchacích ciest balónikom endotracheálnej či tracheostomickej kanyly a odsávanie enterálnej výživy z dýchacích ciest. U jedinej pacientky v súbore pochádzajúcej z nášho pracoviska sme pozorovali tzv. breathing bag sign [17], periodické nafukovanie a spľasnutie sáčku nazogastrickej sondy. U pacientov bez takejto bezprostrednej anamnézy boli najčastejšími symptómami zabiehanie prehĺtaných tekutín či pevného sústa (Onov príznak), záchvatovitý kašeľ alebo opakujúce sa bronchopneumónie.
Okrem dvoch pacientov k nám boli všetci odoslaní z iných pracovísk, no len približne dve tretiny z nich mali fistulu jednoznačne verifikovanú. Prítomnosť kontrastu v dýchacích cestách považujeme len za nepriamy dôkaz fistuly, keďže tracheostomovaní pacienti často trpia poruchami prehĺtania a môže ísť o aspiráciu per vias naturales. CT vyšetrenie bez perorálneho kontrastu má v našej skúsenosti limitovanú presnosť a často falošnú pozitivitu. Jednoznačné potvrdenie fistuly prinesie bronchoskopia s prípadnou aplikáciou metylénovej modrej do pažeráka.
Operačné techniky (Tab. 2)

Predoperačná príprava
Nevyhnutnou podmienkou úspešného riešenia tracheoezofageálnej fistuly je spontánna ventilácia pacienta. Do odpojenia pacienta s TEF od ventilátora je potrebné zabrániť ďalšej kontaminácii dýchacích ciest žalúdočným obsahom alebo slinami zasunutím balonika tracheálnej kanyly distálne od fistuly a konštrukciou derivačnej gastrostómie a zabezpečiť nevyhnutný príjem cestou nutritívnej jejunostómie (Obr. 1). Samozrejmosťou by malo byť zvládnutie pľúcnej infekcie [18].
Anestézia
Spôsob intubácie je zväčša zhodný s intubáciou pred odpojením a ich spoločným znakom je umiestnenie balónika distálne od fistuly. Ideálna pre tento účel je asistencia bronchoskopistu. V prípade nízkej, suprakarinálnej fistuly, keď si plánované riešenie vyžaduje torakotómiu, je vhodná endobronchiálna intubácia s jednostrannou pľúcnou ventiláciou, či už dvojlumenovou alebo jednolumenovou kanylou. Intubácia distálneho konca otvorenej trachey v prípade segmentálnej resekcie je kvôli riziku aerodistenzie tráviaceho traktu spočiatku výhodnejšia než vysokofrekvenčná trysková ventilácia (HFJV), no po rozdelení fistuly a resekcii postihnutého úseku priedušnice umožní HFJV pohodlnejšiu konštrukciu anastomózy.
Segmentálna resekcia trachey a sutúra ezofagu (Obr. 2)
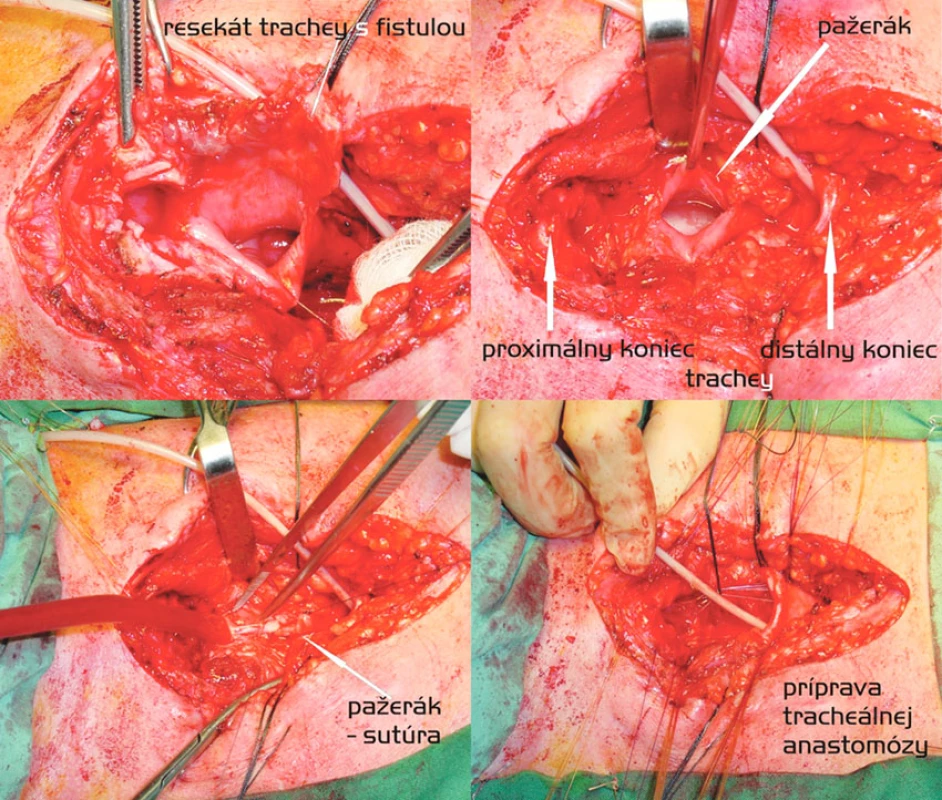
Z 15 našich pacientov bola u 3 nutná vysoká resekcia s Grillovou anastomózou a u 1 sme predĺžili operačný prístup na parciálnu sternotómiu. Ostatní 11 pacienti podstúpili výkon z pozdĺžnej incízie v strednej línii. Ani u jedného pacienta sa sutúra pažeráka neprekrývala s tracheálnou anastomózou, preto sme svalové interpozitum nikdy nepoužili. Dokonca ani u pacienta s traumatickou kompletnou ruptúrou trachey a subtotálnou ruptúrou pažeráka, ktorému sme egalizáciou okrajov trachey skrátili jej dĺžku len o 15 mm, ku kontaku sutúr nedošlo.
Pažerák sme po rozdelení fistuly vždy suturovali pokračujúcim monofilným vstrebateľným stehom (Maxon 4-0) v dvoch vrstvách, tracheálnu anastomózu jednotlivými Biosyn 3-0 resp. 2-0 (pri predpokladanom vyššom anastomotickom napätí) stehmi. Rekurentné nervy sme pri segmentálnej resekcii nikdy cielene nevizualizovali [18].
Sedem z resekovaných pacientov malo súčasnú zrejmú patológiu v zmysle extenzívnejšieho poškodenia trachey než bola samotná fistula, medzi nimi i traja, ktorí potrebovali resekciu krikoidnej chrupky. Ani v jednom prípade však samotná stenóza priedušnice nebola v čase intervencie závažná. Pri voľbe rozsahu tracheálnej resekcie rozhodovala kvalita okrajov i mobilita trachey. Medián dĺžky resekátu bol 40 mm (15–45 mm).
Transekcia fistuly a interpozícia svalového laloka (Obr. 3)
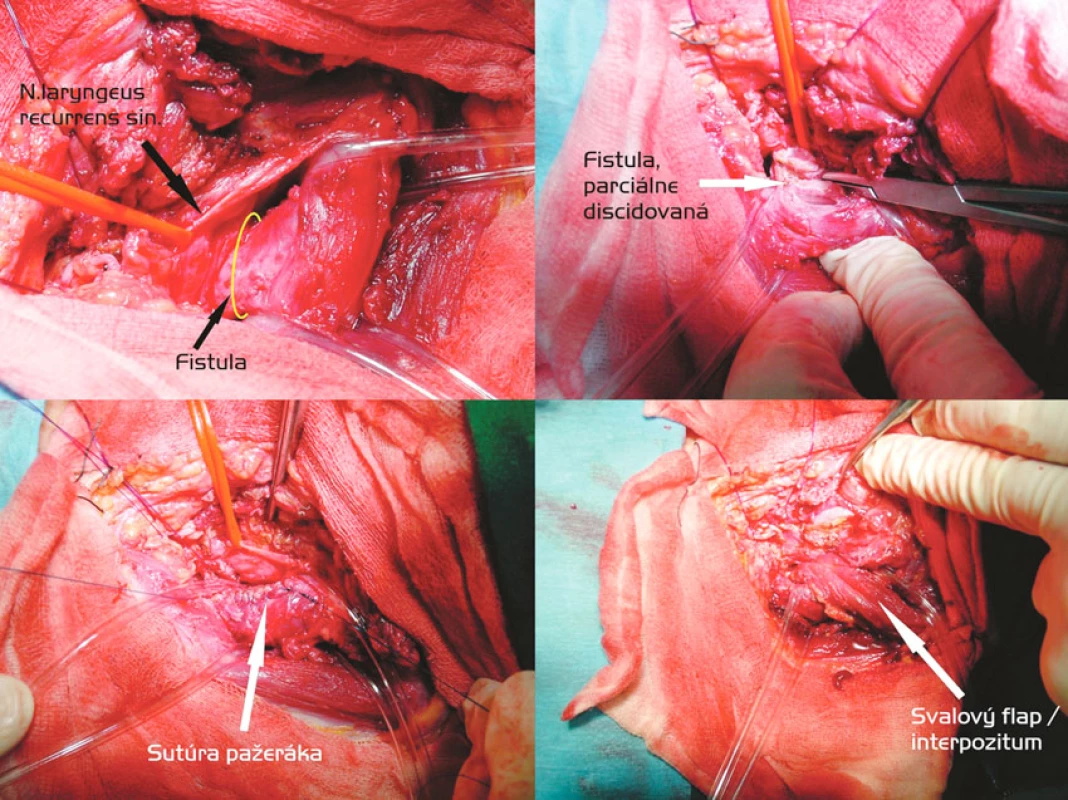
U 2 pacientov sme úspešne riešili TEF cestou presternokleidomastoidálnej incízie vľavo. Obaja boli po dlhodobej ventilácii a tracheostómii, jeden z nich aj po predchádzajúcich kardiochirurgických zákrokoch cestou sternotómie, čo viedlo k obavám o možnosť dostatočnej mobilizácie priedušnice. Druhým dôvodom pre uprednostnenie transekcie fistuly so separátnou sutúrou pažeráka a membranacey pred segmentálnou resekciou boli naše len počiatočné skúsenosti. V oboch prípadoch sme použili muskulárne interpozitum – časť ľavého m. sternocleidomastoideus alebo tzv. páskové svaly. Technicky sa však javila táto časť operácie pomerne obtiažnou vzhľadom na úzky priestor medzi tracheou a ezofágom a dojem určitej kompresie pažeráka. Šicie materiály boli identické a sutúra pažeráka vždy dvojvrstvová, bez jeho rotácie.
Transekcia nízkej H-fistuly staplerom a interpozícía pleurálneho laloka (Obr. 4)
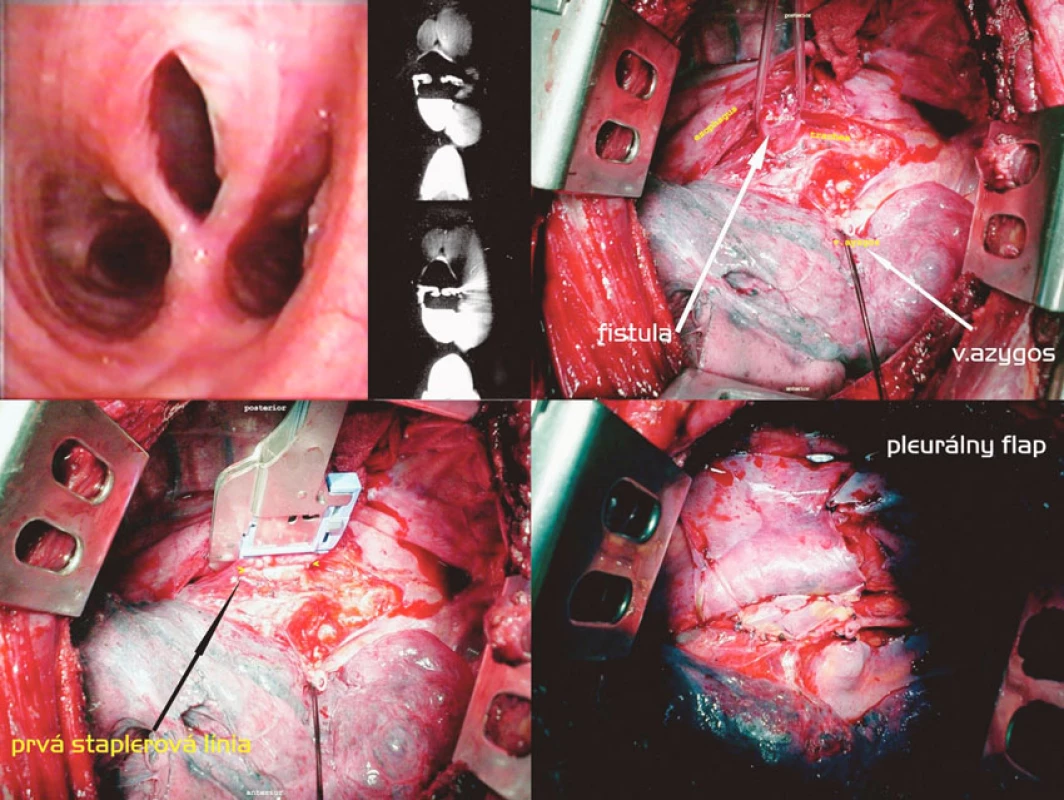
Nízka suprakarinálna fistula so širokou a dobre vyzretou komunikáciou u väzňa, ktorý 19 rokov pred operáciou v úmysle dostať sa do nemocničného zariadenia prehltol celú žiletku s následnou spontánnou pasážou per vias naturales, bola riešená jednoduchou staplerovou transekciou fistuly cestou pravostrannej posterolaterálnej torakotómie. Tkanivo fistuly bolo dobre separovateľné od okolia a nebola prítomná žiadna reakcia v zmysle lymfadenitídy, čo svedčí skôr pre kongenitálny pôvod fistuly. Použili sme dva pravouhlé 30mm staplery s bielym nábojom, ezofageálnu sutúru sme poistili pokračujúcim monofilným stehom a obe sutúry oddelili interpozíciou pleurálneho flapu.
Transtracheostomická transekcia fistuly so sutúrou pažeráka a zadnej steny trachey a T-kanylou (Obr. 5)
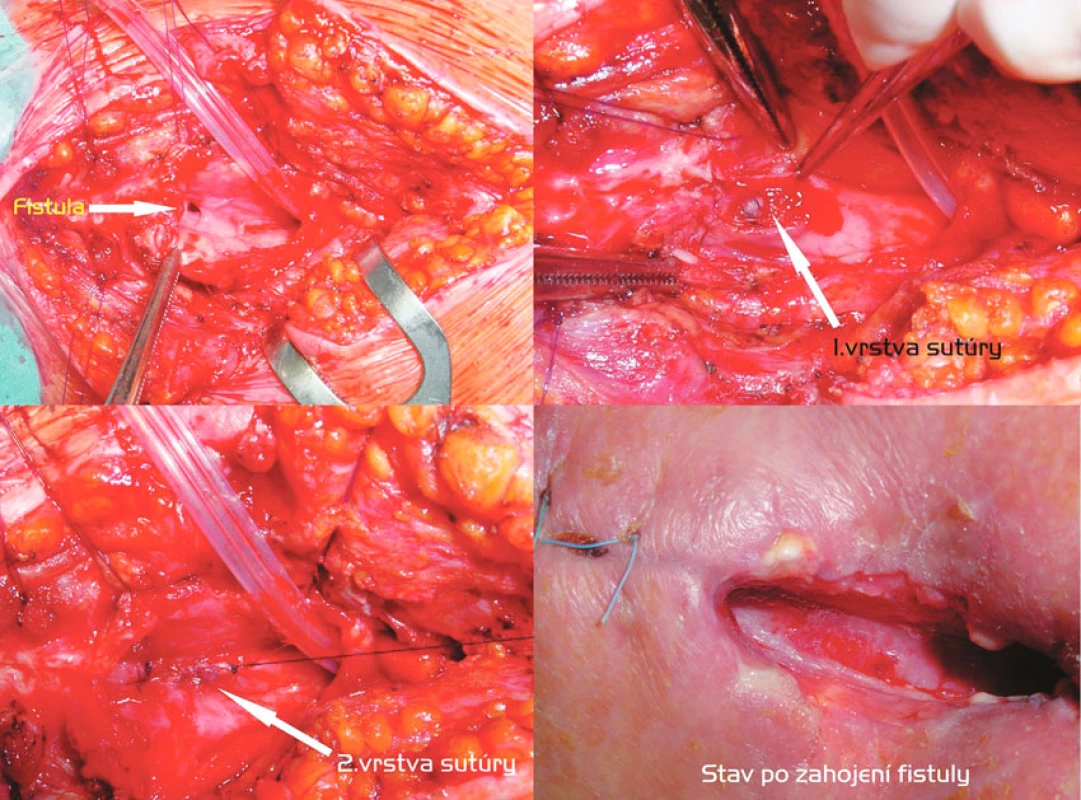
Relatívne malú TEF vzniknutú po dlhodobej UPV s tracheostómiou sme u pacienta na spontánnej ventilácii, ale s ťažkou kardiálnou komorbiditou, riešili transtracheostomickou excíziou fistuly, následnou sutúrou pažeráka v 2 vrstvách a konštrukciou tracheofisúry s implantáciou T-kanyly. Dôvodom bola okrem riskantnej mobilizácie trachey po koronárnych bypassoch i požiadavka na časovo limitovaný výkon. Transtracheálnou disekciou fistuly sme sa vyhli aj konfrontácii s rekurentnými nervami.
Tracheoneoezofageálna fistula
Na 19. pooperačný deň po kombinovanej ezofagektómii pre operabilný epidermoidný ca strednej tretiny pažeráka zahŕňajúcej rozsiahlu transcervikálnu preparáciu s lymfadenektómiou sa u nášho pacienta objavuje Onov príznak s bohatou expektoráciou žltohnedého spúta. Prítomná pravostranná bronchopneumónia, bronchoskopicky verifikovaná tracheoneoezofageálna fistula 4 cm nad tracheálnou karinou viac vpravo a nefunkčná jejunostómia nás vedú k plnej parenterálnej výžive a cielenej antibiotickej liečbe.
Po čiastočnom zvládnutí septického stavu pristupujeme k revízii cestou torakotómie. V teréne ohraničenej mediastinitídy nachádzame komunikáciu v úrovni ezofago-gastroanastomózy so strednou časťou intratorakálnej trachey. Prezervácia neoezofagu tak, aby ostala zachovaná jeho kontinuita, nie je možná, preto ho celý resekujeme. Defekt v trachee kryjeme periostomuskulárnym flapom a konštruujeme krčnú ezofagostómiu.
T-kanyla
Okrem pacienta s transtracheostomickou transekciou a sutúrou fistuly sme využili T-kanylu u ďalších 6 pacientov. Hoci spontánne ventilovali, ich celkový stav nedovoľoval v čase výkonu uvažovať o radikálnom riešení (neurologický nález, sprievodná nesúvisiaca malignita). Traja z nich sa stali trvalými nosičmi kanyly. Dvaja pacienti s postintubačnými fistulami (jeden bez predchádzajúcej tracheostómie) prišli 2 týždne resp. 6 mesiacov po implantácii T-kanyly na kontrolu s prekvapujúco zhojenými 4 a 5mm fistulami. Ďalší pacient mohol po 13 mesiacoch podstúpiť oklúziu tracheofisúry parastomicky implantovanými perforovanými autológnymi rebrovými chrupkami.
VÝSLEDKY
Perioperačná morbidita a mortalita (Tab. 3)
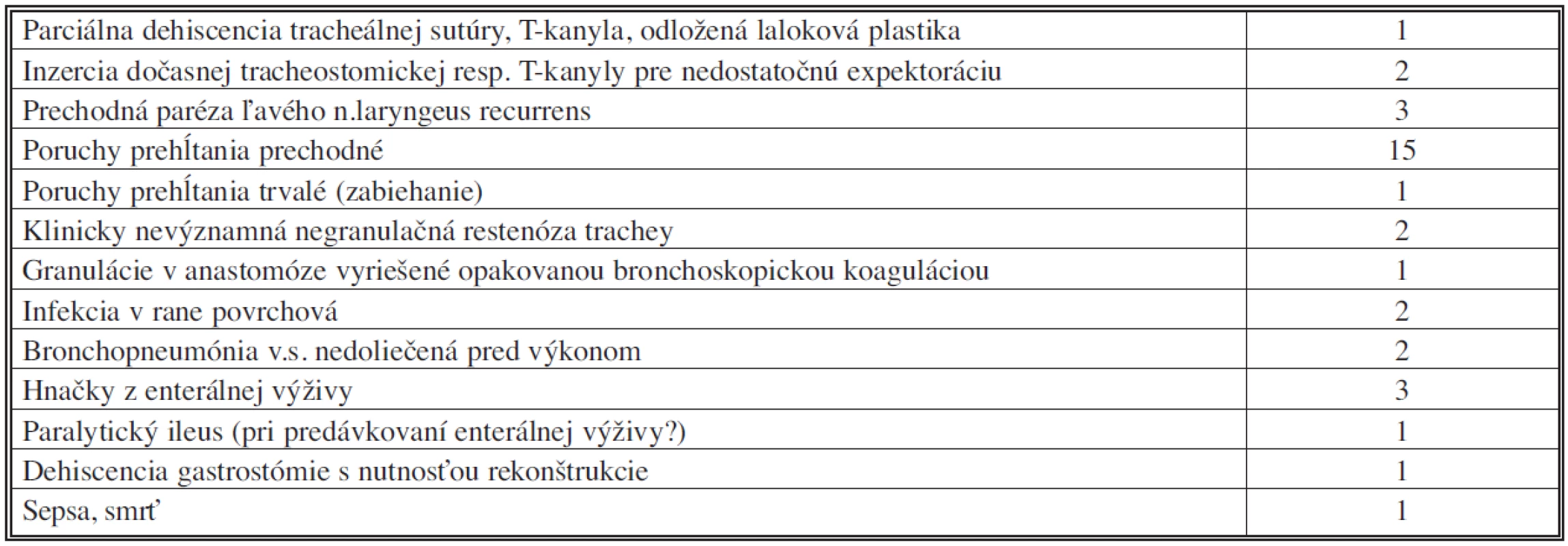
Pri ohraničení perioperačného obdobia na 30 dní sme u pacientov s TEF nezaznamenali žiadnu perioperačnú mortalitu; pravda, 79-ročný pacient po segmentálnej resekcii a sutúre pažeráka nám zomrel na JIS interného oddelenia na 31. poperačný deň na následky obojstrannej bronchopneumónie. Náš jediný pacient s tracheo-neoezofageálnou fistulou exitoval napriek zahojeniu defektu trachey na následky dlhotrvajúcej sepsy na 20. pooperačný deň.
Dvaja pacienti s neurologickou komorbiditou pre pooperačné problémy s expektoráciou museli mať za účelom toalety dýchacích ciest inzerovanú T-kanylu s okrúhlym horizontálnym ramenom, resp. bezbalónikovú tracheostomickú kanylu malého kalibru. V oboch prípadoch boli zavedené distálne od sutúry trachey a extrahované po 14, resp. 9 dňoch s následným spontánnym vyhojením tracheostómie.
Jednu parciálnu dehiscenciu tracheálnej anastomózy sme riešili implatáciou T-kanyly cez dehiscenciu. Po približne 8 a 11 mesiacoch podstúpil pacient parastomickú implantáciu rebrovej chrupky a oklúziu stómie.
U jednej pacientky sme v spolupráci s bronchoskopistami pristúpili k endoskopickej koagulačnej excízii asymptomatických chabých granulácií v úrovni anastomózy. Dve takéto intervencie boli dostačujúce pre uspokojivý výsledok. Negranulačné restenózy mierne limitujúce pacientov v ich fyzickej aktivite sme zaznamenali v dvoch prípadoch, vzhľadom na minimálne subjektívne ťažkosti nebolo ich riešenie indikované.
Väčšina (pätnásť) pacientov po radikálnom riešení TEF mala iniciálne ťažkosti s koordináciou prehĺtacieho aktu, ktoré pretrvávali u dvoch pacientov s reziduálnym neurologickým deficitom. Výborne sa nám osvedčil tzv. chin-tuck manéver, pri ktorom pacienti deglutinujú tekutiny v polohe brada na prsiach. Jeden pacient so svalovým interpozitom medzi tracheou a ezofágom udával dlhodobé pretrvávanie sťaženého prehĺtania bez tohto manévra.
Prechodnú parézu ľavého n. recurrens sme zaznamenali u 3 pacientov (2 segmentálne resekcie a 1 transekcia fistuly na krku) a prejavila sa dysfóniou.
U 2 pacientov sme jednoduchou toaletou riešili infekcie v rane limitované na podkožie. Ani jeden z nich nemal komplikácie hojenia tracheálnej anastomózy.
Pooperačná bronchopneumónia sa objavila okrem vyššie uvedeného fatálneho prípadu dvakrát a bola zvládnutá i.v. antibiotickou liečbou. Relatívne často (u 4 pacientov) chorých obťažovala intolerancia enterálnej výživy privádzanej jejunostomickým katétrom, či už vo forme hnačiek alebo paralytického ileu. U jedného obézneho pacienta sme dehiscenciu laparotómie a rozpadnutú gastrostómiu riešili vacuum-sealingom a rekonštrukciou gastrostómie s transparietálnou fixáciou žalúdka k brušnej stene.
Z dlhodobého hľadiska máme informácie len o 15 z 26 (58 %) našich pacientov. Časť nesledovaných pacientov je pravdepodobne v zariadeniach pre dlhodobo chorých. Pacienti s výnimkou 3 s už uvedenými ťažkosťami sú asymptomatickí (Tab. 4).

DISKUSIA
Voľba najvhodnejšieho výkonu
Škála výkonov reparujúcich tracheoezofageálnu fistulu a obnovujúcich kontinuitu priedušnice a pažeráka je pomerne široká a prešla svojím historickým vývojom.
TEF býva často diagnostikovaná u pacientov v ťažkom alebo po prekonanom ťažkom stave, s nutričným deficitom, s pretrvávajúcou dychovou nedostatočnosťou. Základné opatrenia zabraňujúce ďalšej kontaminácii dýchacích ciest slinným či žalúdočným obsahom a zabezpečujúce adekvátnu nutríciu zväčša postačia na vytvorenie podmienok na dostatočné zotavenie pred definitívnym radikálnym riešením.
Okrem voľby techniky výkonu na základe lokalizácie a rozsahu fistuly je dôležité i načasovanie výkonu. S výnimkou akútnych posttraumatických TEF napr. na podklade tupej traumy hrudníka alebo strelných či bodných poranení krku je vždy výhodný určitý časový odstup umožňujúci vyzretie fistuly. Náš pacient s traumatickou tupou transekciou trachey a takmer kompletnou priečnou ruptúrou pažeráka bol úspešne rekonštruovaný s minimálnou stratou dĺžky trachey aj v niekoľkotýždňovom časovom odstupe po primárnom provizórnom ošetrení poranenia tracheostómiou. Pacienti s postintubačnými poraneniami boli všetci adekvátne pripravovaní konštrukciou derivačnej gastrostómie a nutriívnej jejunostómie, a po odpojení od UPV podstúpili viac či menej úspešnú dychovú rehabilitáciu, čo poskytlo dostatočný časový priestor (týždne až mesiace) na vyzretie fistuly i prípadnej konkomitantnej stenózy trachey.
Všetci naši operovaní pacienti boli schopní spontánnej ventilácie a až na výnimky i samostatnej expektorácie. Preto nemáme skúsenosť s riešením TEF u ventilovaného pacienta, ako napríklad implantácia dočasnej goretexovej membrány medzi suturovaný pažerák a membranaceu s defektom [19], lepenie malej fistuly tkanivovým lepidlom [20] či exklúzia segmentu pažeráka a jeho využitie ako náhrady defektu membranacey s následnou odloženou rekonštrukciou proximálneho GIT [21–26]. Pri fistulách postihujúcich membranaceu v celej jej šírke (tzv. giant-fistuly) môže byť umiestnenie balónika pod fistulu a tým ventilácia pacienta problematické. Vytvorenie novej membranacey z časti pažeráka efektívne uzatvorí dýchacie cesty nielen u ventilovaných pacientov [27]. Diverzia pažeráka s krčnou ezofagostómiou je náročný výkon a u pacienta v kritickom stave môže znamenať neprimerané operačné riziko. U giant-fistúl možno vyriešiť situáciu aj alternatívnymi spôsobmi intubácie a ventilácie, napr. bibronchiálnou intubáciou cez formálnu tracheostómiu [10]. Uvedené techniky boli v niekoľkých literárne spracovaných prípadoch úspešné a treba ich zahrnúť do algoritmu riešenia komplikovaných TEF ako plnohodnotné možnosti.
Segmentálna resekcia trachey v rozsahu fistuly a následná sutúra pažeráka a anastomóza priedušnice sú vo väčšine prác považované za najlepšie radikálne riešenie. V našom súbore sme i my vo väčšine prípadov preferovali segmentálnu resekciu trachey so sutúrou pažeráka a anastomózou priedušnice v rôznych úrovniach s veľmi dobrými výsledkami. Súhlasíme s Macchiariniho [4] tvrdením o dobrej expozícii fistuly pri resekcii trachey a Camargovým [28] o nepotrebnosti vmedzerenia svalového laloka. Tvrdenie o dostatočnosti čistej transekcie a resutúry trachey však nevieme podporiť, keďže takýto výkon v našom repertoári zatiaľ chýba [4]. Pri segmentálnej resekcii trachey považujeme za najvýhodnejšiu kombináciu endotracheálnej intubácie a HFJV. Popísané boli i rôzne iné metodiky ventilácie, ktoré sme však nevyužili, napr. kontinuálna insuflácia kyslíka nad karinu zavedeným intratracheálnym katétrom u spontánne ventilujúceho pacienta v TIVA [29], intubácia cez fistulu [30] alebo intubácia oboch hlavných bronchov detskými endotracheálnymi kanylami zavedenými cez tracheostómiu [10].
Laterálny krčný prístup k fistule so sebou prináša nutnosť rozsiahlejšej disekcie v blízkosti ľavého n.recurrens a tým zvyšuje riziko jeho poškodenia [4]. Na druhej strane je jeho výhodou využitie v prípadoch, kedy nemožno predpokladať dobrú mobilizáciu trachey napr. po predchádzajúcej kardiochirurgickej intervencii, alebo u nespolupracujúcich pacientov, ktorí by neudržali anteflexiu krku potrebnú na odľahčenie tracheálnej anastomózy.
Transtracheostomická excízia fistuly bola v našom súbore najschodnejším riešením u pacienta vhodného len na krátky výkon, s veľkým rizikom pooperačnej ventilačnej podpory a anamnézou predchádzajúcich sternotómií. Minimalizáciou preparácie sme sa vyhli možnému kontaktu s rekurentnými nervami a následná implantácia T-kanyly s dlhodobým nosičstvom poskytla pacientovi čas na zotavenie pred prípadnou definitívnou parastomickou implantáciou rebrovej chrupky a oklúziou stómie.
Nemáme skúsenosti so stentovaním pažeráka či súčasným stentovaním pažeráka i trachey v indikácii benígnej TEF, hoci v dočasnej aplikácii možno vidieť výhody vytvorenia potrebnej mechanickej bariéry medzi orgánmi bez zaťaženia pacienta operáciou. Pri duálnom stentovaní by sme sa však obávali ďalšej ischemizácie stien s následnou nekrózou a zväčšením fistuly [24]. Naviac sú naše skúsenosti s implantáciou tracheálnych stentov pri stenóze trachey prevažne negatívne v zmysle migrácie silikónových stentov či torpídnych obturujúcich granulácií v okolí koncov metalických stentov [31].
Tracheoneoezofageálna fistula (TNEF)
Výška tracheoneoezofageálnej fistuly býva rôznorodá v závislosti od etiológie, rôznorodá je i intenzita príznakov od degutinačných ťažkostí typických pre chronické fistuly až po ťažkú mediastinitídu. Typický býva relatívne dlhý interval od ezofagektómie do objavenia fistuly, Buskens [15] uvádza medián až 30 dní.
Medzi najčastejšie uvádzané príčiny vzniku tracheoneoezofageálnej fistuly po totálnej ezofagektómii pre karcinóm patria devaskularizácia trachey pri extenzívnej preparácii a mediastinálnej lymfadenektómii, priame mechanické poškodenie trachey pri preparácii, anastomotický leak z neoezofagu alebo sekundárna fistulácia pri nekróze časti štepu či v kombinácii s tlakom nekrytej staplerovej línie [32]. Niekedy sa vyskytne i po dilatácii anastomotickej striktúry, alebo na podklade dekubitálnej nekrózy medzi balónikom tracheálnej kanyly a nazogastrickou sondou. Názory na zvýšené riziko vzniku TNEF po predchádzajúcej neoadjuvantej liečbe nie sú jednotné [14, 15]. Bol opísaný i prípad pacienta s TNEF na podklade peptických ulcerácií sliznice žalúdka [33]. Domnievame sa, že samotná insuficiencia ezofagogastrickej anastomózy alebo staplerovej línie neoezofagu nestačí na vznik fistuly a vždy zohráva úlohu v súčinnosti s mechanickým alebo ischemickým poškodením tracheálnej steny.
V našom prípade bola jednoznačným súčiniteľom vzniku TNEF devaskularizácia priedušnice jej cirkumferentnou mobilizáciou pri extenzívnej transcervikálnej lymfadenektómii. Potvrdzuje to i fakt, že počas 15 rokov sme túto komplikáciu nezaznamenali ani u jedného pacienta podstúpivšieho totálnu ezofagektómiu s náhradou ortotopicky uloženým žalúdkom. Išlo o výkony bez systematickej lymfadenektómie. Štúdia devaskularizácie trachey u psov [34] ukázala, že pri zachovaní pravostrannej bronchiálnej artérie nespôsobí devaskularizácia cervikálnej a mediastinálnej trachey jej nekrózu. Princípom prevencie TNEF pri transcervikálnej alebo transtorakálnej extenzívnej lymfadenektómii je teda zachovanie vaskularizácie trachey aspoň z jednej strany. Vzhľadom na uloženie pažeráka viac vľavo sme u ďalších 2 pacientov zachovali pravostrannú vaskularizáciu trachey a v jednom prípade viedli štep retrosternálne. TNEF u týchto pacientov nevznikla.
Liečba TNEF je náročná, ak fistula vznikla v pooperačnom období, keďže býva sprevádzaná sepsou na podklade bronchopneumónie alebo mediastinitídy u pacientov po náročnom výkone, často hyponutričných a vyžadujúcich ventilačnú podporu. Bez aktívneho prístupu však nemá liečba nádej na úspech. Treba vynaložiť maximum pre zachovanie štepu. Ak to nedostatočná vitalita tubulizovaného žalúdka neumožňuje, ostáva krčná ezofagostómia, neoezofagektómia, krytie defektu v stene trachey a sanácia mediastína. Náš pacient sa plánovanej rekonštrukčnej etapy nedočkal, napriek zhojeniu defektu v stene trachey.
Obnovenie kontinuity dýchacích ciest a neoezofagu dosiahli v jednotlivých kazuistikách ich autori rekonštrukciou anastomózy v hrudníku a interpozíciou perikardiálneho flapu [35], rekonštrukciou membranacey pomocou perikardiálneho patchu [32] či záplaty z fascia lata [36] s interpozíciou svalového materiálu, parciálnou resekciou tubulizovaného žalúdka a náhradou hrubým črevom vedeným v proximálnom mediastíne retrotracheálne a v distálnom retrosternálne [15] v jednom sedení, či drenážou mediastína a drenážou pažeráka T-drénom ústiacim na krku [37].
Všeobecne je mortalita TNEF v pooperačnom období po ezofagektómii pomene vysoká (až 33 %) [14], pri neskoršej manifestácii je perioperačný priebeh reintervencie zvyčajne menej komplikovaný [38].
Zaujímavým faktom je, že všetky popísané TNEF vznikali medzi tracheou a tubulizovaným žalúdkom; v literatúre sme sa s tracheokolickou fistulou nestretli.
Kongenitálne fistuly v dospelosti
Šikmý priebeh, spôsobený relatívne rýchlejším rastom pažeráka oproti priedušnici pri vývoji, je jednou z príčin diagnostiky kongenitálnej tracheoezofageálnej fistuly (N-fistula, [6]) až v dospelosti. Niektorí autori špekulujú o membránach či slizničných valoch spôsobujúcich jednosmernosť fistuly [39] a tým jej dlhodobú oligo- či asymptomatickosť, iní predpokladajú nástup príznakov v súvislosti s poklesom tonusu dolného ezofageálneho zvierača a gastroezofageálnym refluxom [40]. Príznaky často bývajú minimálne a nezvykne sa im venovať pozornosť, čo taktiež prispieva k neskorému odhaleniu [40]. Pri cielenej anamnéze často pacient spätne príznaky potvrdí.
Vrodený charakter fistuly možno predpokladať pri jej dobrej vyzretosti a neprítomnosti sprievodnej inflamacie a lymfadenopatie. Neprítomnosť zápalových zmien v okolí uľahčuje preparáciu a väčšinou zjednodušuje riešenie fistuly na jej transekciu a interpozíciu pleury, muskulárneho flapu či bovínneho perikardu [6, 40, 41], či už z krčného prístupu alebo pravostrannej torakotómie. Úspešné torakoskopické riešenie kongenitálnej TEF u novorodencov inšpirovalo autorov kazuistiky, ktorí u 79-ročnej pacientky ošetrili takúto fistulu cestou pravostrannej VATS staplerovou transekciou a interpozíciou bovínneho perikardu [41]. Iná pacientka v podobnom veku nevhodná na výkon v celkovej anestézii podstúpila úspešnú endoluminálnu obliteráciu fistuly zavedením samoexpandovateľného oklúderu komorového septálneho defektu [42].
Pre kongenitálny pôvod fistuly nášho pacienta svedčí jej dobrá vyzretosť bez výrazných jazvovitých zmien v okolí. Posttraumatickú etiológiu však nevieme vzhľadom na anamnézu úmyselného prehltnutia žiletky s úplnou istotou vylúčiť.
Spontánne zhojenie fistuly
Spontánne zhojenie tracheoezofageálnej fistuly je extrémne zriedkavé [4]. V našom súbore sme mali dvoch takýchto pacientov, ktorí neboli vhodní na radikálnejšie riešenie a mali implantovanú T-kanylu. Interval od implantácie po uzavretie bol rôzne dlhý (2 týždne – 6 mesiacov). Spoločným znakom týchto pacientov boli malé rozmery fistuly, relatívne krátkodobá anamnéza intubácie či tracheostómie, dobrý nutričný stav, dobrá spolupráca a neprítomnosť deglutinačných ťažkostí a aspirácie po zavedení kanyly. U oboch pacientov boli fistuly jednoznačne dokázané a vizualizované tracheoskopicky po prehltnutí metylénovej modrej, čo vylučuje diagnostický omyl. Skutočnú, reprodukovateľnú a prognosticky použiteľnú príčinu spontánneho uzáveru nepoznáme.
Traumatická fistula
Traumatické TEF po tupom poranení hrudníka bývajú asociované s inými vážnejšími poraneniami [23, 43, 44], čo môže viesť k neskoršej diagnostike, niekedy až roky po poranení [44]. S takouto fistulou sme sa nestretli. Direktná trauma môže byť spôsobená tupým alebo penetrujúcim strelným [9] či bodným poranením. Náš prípad súčasného dilaceračného poranenia trachey i pažeráka ukazuje, že i odložené riešenie v zmysle sutúry pažeráka a de facto krátkej segmentálnej resekcie trachey môže byť úspešné.
Použitie T-kanyly
T-kanyla má v porovnaní s endoluminálnymi stentami množstvo výhod aj u pacientov s TEF. Umožňuje bezprostredný prístup do dýchacích ciest, dá sa kedykoľvek vymeniť a upraviť a riziko jej migrácie je extrémne nízke. Nevýhodou oproti stentom sú otvorené dýchacie cesty, čo však po zhojení fistuly možno riešiť implantáciou perforovanej rebrovej chrupky a lalokovou plastikou. Či už ide o pacienta, ktorý je definitívnym nosičom, alebo má T-kanylu implantovanú dočasne po transtracheálnej excízii fistuly alebo dôjde k spontánnej oklúzii fistuly, T-kanyla je neoddeliteľnou súčasťou chirurgovho armamentária v liečbe TEF.
ZÁVER
Veľká väčšina tracheoezofageálnych fistúl v našom súbore bola dôsledkom nesprávneho ošetrovania ventilovaného pacienta. Na ich prevenciu nestačí len používanie adekvátneho vybavenia a materiálu. Sústavná edukácia intenzivistov a neustále dohliadanie na dodržiavanie zásad starostlivosti o tracheostómiu sú ešte dôležitejšie. Ani najdôslednejšia starostlivosť však niekedy vzniku fistuly nezabráni.
Ostatné prípady ilustrujú pestrosť etiológie fistúl i pestrosť dostupných možností chirurgickej intervencie, ktoré sme v našom relatívne malom súbore vonkoncom nevyčerpali. Hoci často ide o literárne kazuistiky, v budúcnosti môžu byť inšpiráciou pri hľadaní najvhodnejšieho riešenia pre konkrétneho pacienta s TEF.
Mementom bola pre nás fistula po resekcii pažeráka pre dobre operabilný karcinóm strednej tretiny. Pre pracovisko nové operačné postupy so sebou vždy prinášajú riziko nepoznaných nových či staronových komplikácií, ktorých príčiny je nevyhnutné presne identifikovať pre zvýšenie bezpečnosti výkonu u nasledujúceho pacienta. Nech už sa hrudníkový chirurg v individuálnom prípade TEF rozhodne akokoľvek, nikdy nesmie zabúdať na adekvátnu predoperačnú prípravu pacienta a vždy musí zohľadniť nielen celkové a lokálne pomery, ale i svoje technické možnosti.
MUDr. Tibor Krajč
Ružinovská 6
826 06 Bratislava
Slovenská republika
e-mail: tiborkrajc@gmail.com
Zdroje
1. Grillo, H. C. Acquired tracheoesophageal and bronchoesophageal fistula. In: H.C. Grillo (zostavovateľ) Surgery of the trachea and bronchi. Hamilton, Ontario, USA: BC Decker Inc, 2004, s. 341–356.
2. Fiala, P., Cernohorsky, S., Cermak, J., et al. Tracheal stenosis complicated with tracheoesophageal fistula. European Journal of Cardio-Thoracic Surgery, 25, 2004, č. 1, s. 127–130.
3. Harley, H. R. Ulcerative tracheo-oesophageal fistula during treatment by tracheostomy and intermittent positive pressure ventilation. Thorax, 27, 1972, č. 3, s. 338–352.
4. Macchiarini, P., Verhoye, J.-P., Chapelier, A., et al. Evaluation and outcome of different surgical techniques for postintubation tracheoesophageal fistulas. Journal of Thoracic and Cardiovascular Surgery, 119, 2000, č. 2, s. 268–276.
5. Wychulis, A. R., Ellis, F. H., Jr., Andersen, H. A. Acquired Nonmalignant Esophagotracheobronchial Fistula: Report of 36 Cases. JAMA: The Journal of the American Medical Association, 196, 1966, č. 2, s. 117–122.
6. Black, R. J. Congenital tracheo-oesophageal fistula in the adult. Thorax, 37, 1982, č. 1, s. 61–63.
7. Ashour, M. Recurrence of tracheo-oesophageal fistula 32 years after primary repair. Thorax, 41, 1986, č. 1, s. 76–77.
8. Rajesh, P. B., Goiti, J. J. Late onset tracheo-oesophageal fistula following a swallowed dental plate. Eur. J. Cardiothorac. Surg., 7, 1993, č. 12, s. 661–662.
9. Kanne, J. P., Stern, E. J., Pohlman, T. H. Tracheoesophageal Fistula from a Gunshot Wound to the Neck. American Journal of Roentgenology, 180, 2003, č. 1, s. 212.
10. O_ordan, J. M., Hickey, N., Ilinski, O., et al. Successful early repair of a traumatic tracheoesophageal fistula after blunt chest trauma. J. Thorac. Cardiovasc. Surg., 132, 2006, č. 6, s. 1495–1496.
11. Stanbridge, R. D. Tracheo-oesophageal fistula and bilateral recurrent laryngeal nerve palsies after blunt chest trauma. Thorax, 37, 1982, č. 7, s. 548–549.
12. Cherveniakov, A., Tzekov, C., Grigorov, G. E., et al. Acquired benign esophago-airway fistulas. European Journal of Cardio-Thoracic Surgery, 10, 1996, č. 9, s. 713–716.
13. Bartels, H. E., Stein, H. J., Siewert, J. R. Respiratory management and outcome of non-malignant tracheo-bronchial fistula following esophagectomy. Dis. Esophagus, 11, 1998, č. 2, s. 125–129.
14. Bartels, H. E., Stein, H. J., Siewert, J. R. Tracheobronchial lesions following oesophagectomy: prevalence, predisposing factors and outcome. Br. J. Surg., 85, 1998, č. 3, s. 403–406.
15. Buskens, C. J., Hulscher, J. B. F., Fockens, P., et al. Benign tracheo-neo-esophageal fistulas after subtotal esophagectomy. Annals of Thoracic Surgery, 72, 2001, č. 1, s. 221–224.
16. Zielinski, M. Transcervical extended mediastinal lymphadenectomy: results of staging in two hundred fifty-six patients with non-small cell lung cancer. J. Thorac. Oncol., 2, 2007, č. 4, s. 370–372.
17. Serrano, N., Mora, M. L. The breathing-bag sign in the diagnosis of tracheoesophageal fistula in patients receiving mechanical ventilation. Chest, 117, 2000, č. 4, s. 1217–1218.
18. Haruštiak, S. Zkušenosti s chirurgickou léčbou trachey. In: M. Hájek, J. Drábková, S. Haruštiak, M. Marel a J. Vomela (zostavovatelia), Kritická onemocnění průdušnice a jejich léčení. Praha: Grada Publishing, 2000, s. 97–109.
19. Bardini, R., Radicchi, V., Parimbelli, P., et al. Repair of a recurrent benign Tracheoesophageal fistula with a Gore-Tex membrane. Annals of Thoracic Surgery, 76, 2003, č. 1, s. 304–306.
20. Scappaticci, E., Ardissone, F., Baldi, S., et al. Closure of an iatrogenic tracheo-esophageal fistula with bronchoscopic gluing in a mechanically ventilated adult patient. Ann. Thorac. Surg., 77, 2004, č. 1, s. 328–329.
21. Bartlett, R. H. A procedure for management of acquired tracheoesophageal fistula in ventilator patients. J. Thorac. Cardiovasc. Surg., 71, 1976, č. 1, s. 89–95.
22. Galan, G., Tarrazona, V., Soliveres, J., et al. Tracheoplasty in a large tracheoesophageal fistula. Ann. Thorac. Surg., 68, 1999, č. 3, s. 1071–1072.
23. He, J., Chen, M., Shao, W., et al. Surgical management of huge tracheo-oesophageal fistula with oesophagus segment in situ as replacement of the posterior membranous wall of the trachea. European Journal of Cardio-Thoracic Surgery, 36, 2009, č. 3, s. 600–602.
24. Jougon, J., Couraud, L. Esophageal patching for an unsuturable tracheoesophageal fistula. European Journal of Cardio-Thoracic Surgery, 14, 1998, č. 4, s. 431–433.
25. Landreneau, R. J., Hazelrigg, S. R., Boley, T. M., et al. Management of an extensive tracheoesophageal fistula by cervical esophageal exclusion. Chest, 99, 1991, č. 3, s. 777–780.
26. Utley, J. E., Dillon, M. L., Todd, E. P., et al. Giant tracheoesophageal fistula: management by esophageal diversion. J. Thorac. Cardiovasc. Surg., 75, 1978, č. 3, s. 373–377.
27. Chappell, V. L., Heck, H. A. jr. Repair of large, iatrogenic, tracheo-esophageal fistulae. Ann. Thorac. Surg., 83, 2007, č. 2, s. 705–706.
28. Camargo, J. J., Machuca, T. N., Camargo, S. M., et al. Surgical treatment of benign tracheo-oesophageal fistulas with tracheal resection and oesophageal primary closure: is the muscle flap really necessary? European Journal of Cardio-Thoracic Surgery, 37, 2010, č. 3, s. 576–580.
29. Joynt, G. M., Chui, P. T., Mainland, P., et al. Total intravenous anesthesia and endotracheal oxygen insufflation for repair of tracheoesophageal fistula in an adult. Anesthesia & Analgesia, 82, 1996, č. 3, s. 661–663.
30. Maseda, E., Diaz-Agero, P., Suarez, L., et al. Tracheal intubation through tracheoesophageal fistula. Anesthesia & Analgesia, 80, 1995, č. 2, s. 422–423.
31. Krajc, T., Janik, M., Benej, R., et al. Urgent segmental resection as the primary strategy in management of benign tracheal stenosis. A single center experience in 164 consecutive cases. Interact Cardiovasc. Thorac. Surg., 9, 2009, č. 6, s. 983–989.
32. Kron, I. L., Johnson, A. M., Morgan, R. F.: Gastrotracheal fistula: a late complication after transhiatal esophagectomy. Ann. Thorac. Surg., 47, 1989, č. 5, s. 767–768.
33. Maruyama, K., Motoyama, S., Okuyama, M., et al. Esophagotracheal fistula caused by gastroesophageal reflux 9 years after esophagectomy. World J. Gastroenterol., 13, 2007, č. 5, s. 801–803.
34. Fujita, H., Kawahara, H., Hidaka, M., et al. An experimental study on viability of the devascularized trachea. Jpn. J. Surg., 18, 1988, č. 1, s. 77–83.
35. Song, S.-W., Lee, H.-S., Kim, M. S., et al. Repair of gastrotracheal fistula with a pedicled pericardial flap after Ivor Lewis esophagogastrectomy for esophageal cancer. J. Thorac. Cardiovasc. Surg., 132, 2006, č. 3, s. 716–717.
36. Kalmar, K., Molnar, T. F., Morgan, A., et al. Non-malignant tracheo-gastric fistula following esophagectomy for cancer. European Journal of Cardio-Thoracic Surgery, 18, 2000, č. 3, s. 363–365.
37. Buskens, C. J., van Coevorden, F., Obertop, H., et al. Disturbed anastomotic healing after esophagectomy: a novel treatment of a benign tracheo-neo-esophageal fistula. Dig. Surg., 19, 2002, č. 2, s. 88–91.
38. Devbhandari, M. P., Jain, R., Galloway, S., et al. Benign gastro-bronchial fistula – an uncommon complication of esophagectomy: case report. BMC Surg., 5, 2005, s. 16.
39. Vasquez, R. E., Landay, M., Kilman, W. J., et al. Benign esophagorespiratory fistulas in adults. Radiology, 167, 1988, č. 1, s. 93–96.
40. Zacharias, J., Genc, O., Goldstraw, P. Congenital tracheoesophageal fistulas presenting in adults: presentation of two cases and a synopsis of the literature. J. Thorac. Cardiovasc. Surg., 128, 2004, č. 2, s. 316–318.
41. Garand, S. A., Kareti, L. R., Dumont, T. M., et al. Thoracoscopic repair of tracheoesophageal fistula in a septuagenarian. Ann. Thorac. Surg., 81, 2006, č. 5, s. 1899–1901.
42. Rabenstein, T., Boosfeld, C., Henrich, R., et al. First use of ventricular septal defect occlusion device for endoscopic closure of an esophagorespiratory fistula using bronchoscopy and esophagoscopy. Chest, 130, 2006, č. 3, s. 906–909.
43. Reed, W. J., Doyle, S. E., Aprahamian, C. Tracheoesophageal Fistula After Blunt Chest Trauma. Annals of Thoracic Surgery, 59, 1995, č. 5, s. 1251–1256.
44. Weber, S. M., Schurr, M. J., Pellett, J. R. Delayed Presentation of a Tracheoesophageal Fistula After Blunt Chest Trauma. Annals of Thoracic Surgery, 62, 1996, č. 6, s. 1850–1852.
Štítky
Chirurgia všeobecná Ortopédia Urgentná medicínaČlánok vyšiel v časopise
Rozhledy v chirurgii

2010 Číslo 8
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
- Tramadol a paracetamol v tlumení poextrakční bolesti
Najčítanejšie v tomto čísle
- Syndroma caudae equinae zriedkavej etiológie
- Možnosti a výsledky chirurgického riešenia benígnej tracheoezofageálnej fistuly
- Ako dlho čakať s operáciou pre nekrotizujúcu pankreatitídu?
- Akutní tyroidektomie pro mechanický syndrom při toxické nodózní strumě – kazuistika
