-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Současné trendy v chirurgické léčbě výdutě torakoabdominální aorty
Current Trends in the Surgical Management of Thoracoabdominal Aortic Aneurysms
Introduction:
The authors present a group of patients, who underwent standard procedures on thoracic (TAA) and thoracoabdominal (TAAA) aortic aneurysms from 01-01-2009 to 15-09-2010.Material and Methods:
During the above time period, a total of 29 patients were operated. The authors employed as many known organ protection procedures as possible, including reduced heparinization, mild hypothermia (32–34 °C), sequential aortic clamping cerebrospinal drainage, left heart bypass (a biopump) with non-ischemic canylation of the femoral artery, selective visceral blood perfusion (superior mesenteric artery and coeliac trunk) and renal arteries perfusion using cold crystallic solution. For technical reasons, monitoring of somatosensory and motor evoked potentials was used only twice. In the majority of TAAA procedures, the thoracoretroperitoneal approach was used.Results:
During the studied period, the overall mortality rate was 24%. In 2009, a total of 16 patients were operated, out of which 14 subjects underwent elective procedures. Two subjects underwent urgent procedures for ruptures and both of them died. In 2009, the mortality rate was 21% for planned procedures. In the following year, from January to September 15, a total of 13 patients underwent surgery, out of whom 11 underwent elective and two urgent procedures. The group’s overall mortality rate was 15.4%, the moratlity rate in elective surgery patients was 9% . One patient undergoing urgent surgery survived and one exited. Postoperative paraplegia was reported in one subject (3,4%), postoperative dialysis due to postoperative renal insuficiency was used in 6.9% and other postoperative complications occurred in 10,3% of the subjects.Conclusion:
Mortality and morbidity rates in the surgical management of thoracoabdominal aortic aneurysms remain considerably high, although new procedures of organ protection help to reduce it. These highly specialized procedures require a multispecialty approach and a well - coordinated surgical team, specialized in this problematics.Key words:
thoracoabdominal aorta – surgical management – multispecialty approach – organ protection
Autoři: P. Štádler; P. Zdráhal; P. Šebesta; L. Dvořáček; P. Vitásek; M. Šlais
Působiště autorů: Oddělení cévní chirurgie, Nemocnice Na Homolce, Praha, primář: doc. MUDr. Petr Štádler, Ph. D.
Vyšlo v časopise: Rozhl. Chir., 2011, roč. 90, č. 1, s. 14-23.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Úvod:
Autoři představují sestavu pacientů, u kterých provedli v období od 1. 1. 2009 do 15. 9. 2010 klasickou operaci hrudní (TAA) nebo torakoabdominální aorty (TAAA).Materiál a metodika:
V uvedeném časovém úseku bylo operováno 29 pacientů. Snažili jsme se použít maximum známých postupů orgánové protekce, ke kterým patří redukovaná heparinizace, mírná celková hypotermie (32–34 °C), postupné nakládání aortální svorky, cerebrospinální drenáž, levostranný srdeční zkrat (biopumpa) s neischemickou kanylací femorální tepny, selektivní viscerální perfuze (arteria mesenterica superior a truncus coeliacus) krví a perfuze renálních tepen studeným krystalickým roztokem. Sledování somatosenzorických a motorických evokovaných potenciálů bylo z technických důvodů použito pouze dvakrát. Ve většině případů TAAA byl zvolen torakoretroperitoneální přístup.Výsledky:
Celková mortalita byla v uvedeném období 24 %, přičemž v roce 2009 bylo operováno 16 pacientů, z toho 14 elektivně a dva akutně pro rupturu, kteří oba zemřeli. U plánovaných výkonů pak byla mortalita v roce 2009 21 %. V roce následujícím bylo od ledna do 15. září 2010 operováno 13 pacientů, 11 elektivně a dva akutně. Celková mortalita je v této skupině 15,4 %, u elektivních pacientů to bylo 9 % a u akutních jeden pacient přežil a jeden zemřel. Výskyt pooperační paraplegie byl zaznamenán jedenkrát (3,4 %), pooperační dialýzu z důvodu pooperační renální insuficience jsme použili v 6,9 % a v 10,3 % se objevily další pooperační komplikace.Závěr:
Výskyt mortality i morbidity je při chirurgické léčbě torakoabdominální aorty stále poměrně vysoký, i když s použitím novým postupů orgánové ochrany se snižuje. K provádění těchto vysoce specializovaných operací je zcela nezbytný multioborový přístup a sehraný tým, který se touto problematikou zabývá.Klíčová slova:
torakoabdominální aorta – chirurgická léčba – multioborový přístup – orgánová protekceÚVOD
Ačkoliv chirurgická léčba torakoabdominální aorty představuje poměrně velké operační riziko, některá velká centra uvádějí zajímavé a příznivé výsledky chirurgické léčby tohoto onemocnění [1]. Výskyt výdutě torakoabdominální aorty (TAAA) je uváděn 10,4 případů na 100 tisíc obyvatel ročně [2]. Ve srovnání s výskytem výdutě břišní aorty (AAA), která se vyskytuje v rozsahu 2,3–10,7 % jsou počty TAAA nižší [3, 4, 5]. AAA se vyskytuje 3–7x častěji ve srovnání s TAAA [2, 3, 4, 6]. Střední věk pacientů s TAAA se pohybuje mezi 59–69 roky s větším výskytem u mužů v poměru 2–4 : 1 [6]. Studie ukazují, že riziko ruptury TAAA významně stoupá při velikosti nad 5 cm a dále se zvyšuje v závislosti na velikosti výdutě [6, 7,]. Aneuryzma větší než 8 cm má 80 % riziko ruptury do jednoho roku od doby, kdy bylo diagnostikováno [8].
HISTORIE
Koncem 19. století byl prostý podvaz aorty jediným možným zákrokem k prevenci ruptury aneuryzmatu. Tento krok měl obvykle katastrofální následky v důsledku následného výskytu gangrén, kdy pacienti umírali ve velkých bolestech. Dr. Etheredge provedl v San Francisku v roce 1954 první úspěšnou operaci TAAA s použitím homograftu [9]. V roce 1956 se Michael DeBakey se svým týmem podílel na vývoji polyesterové cévní protézy, která nahradila používání cévních štěpů a rozvinul i metodu operace TAAA. DeBakey našil nejprve tubulární protézu mezi infrarenální a hrudní aortou a posléze vytvořil samostatné bypassy na truncus coeliacus (TC), arteria mesenterica superior (AMS) a na obě renální tepny. V důsledku tohoto postupu mohla být vždy jen krátká orgánová ischemie, která se pohybovala mezi 10–15 minutami [10]. Dalším významným mezníkem v chirurgii TAAA byl rok 1965, kdy Crawford představil tři významné inovace, ke kterým patřilo použití inkluzní techniky, reimplantace viscerálních tepen na jednom terči a dále i reimplantace interkostálních tepen do cévní protézy [11].
Během zdokonalování techniky operace TAAA se postupně objevovala další zlepšení, která přispěla k zabránění multiorgánového poškození při delším čase naložené svorky. Crawford na základě své sestavy 1509 pacientů poukázal na skutečnost, že čas svorky nad 60 minut je při operaci TAAA spojen v 27 % s pooperační paraplegií a v případě časového intervalu do 30 minut tento výskyt prudce klesá k 8 % [12]. Od roku 1992 se na základě experimentálních prací začíná používat distální aortální perfuze, cerebrospinální drenáž a mírná pasivní hypotermie.
SOUČASNOST
V současné době je používána modifikovaná klasifikace TAAA podle Crawforda (Obr. 1). Jako typ I. je označována výduť, která zasahuje od levé podklíčkové tepny nad renální tepny, typ II. od podklíčkové tepny pod renální tepny, typ III. od úrovně 6. žebra pod renální tepny, typ IV. od 12. hrudního obratle pod renální tepny a typ V. s rozsahem od 6. žebra nad renální tepny.
Obr. 1. Modifikovaná klasifikace TAAA podle Crawforda Fig. 1. Modified TAAA classification according to Crawford 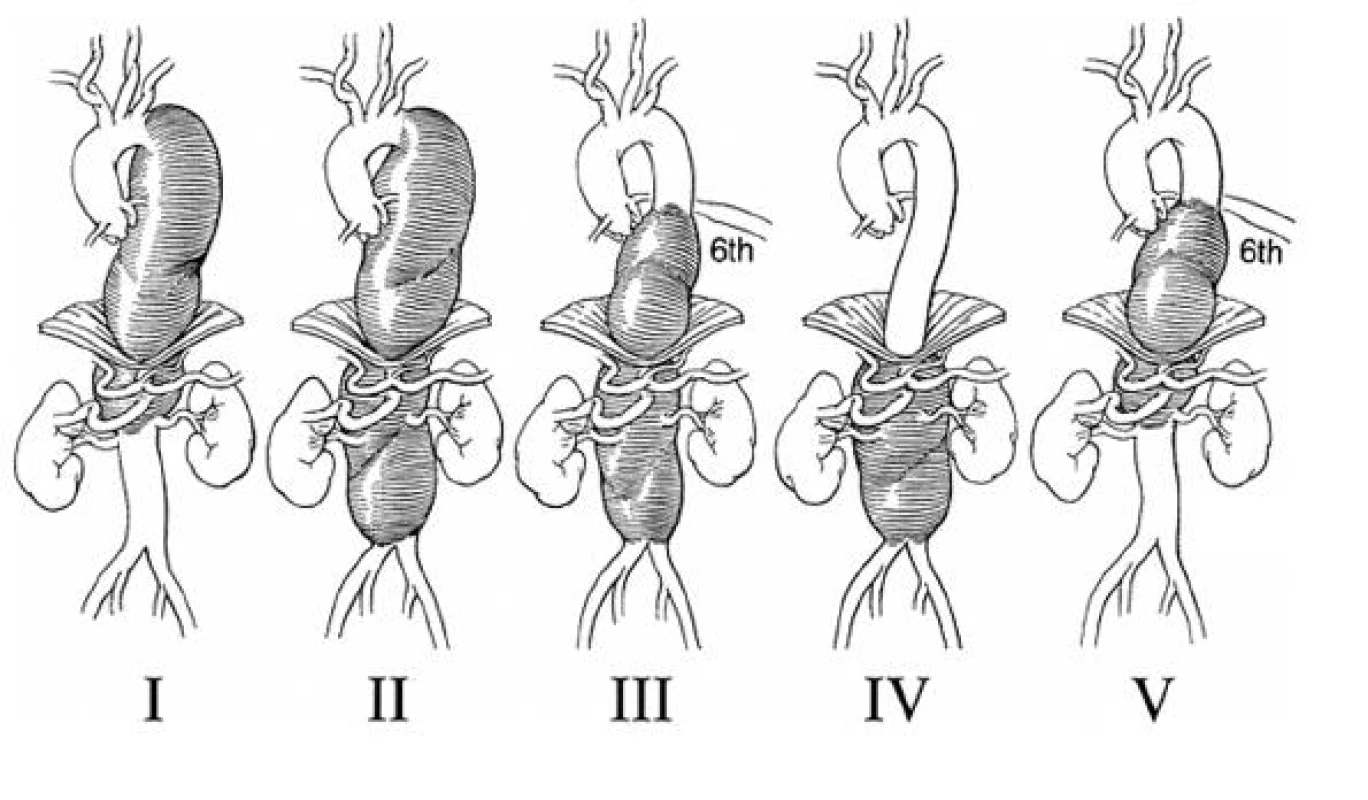
Chirurgická léčba TAAA bývá doprovázena řadou komplikací, které jsou způsobeny velkou peroperační krevní ztrátou, rozsáhlým chirurgickým přístupem, významnou hemodynamickou alterací a různou orgánovou intolerancí v důsledku dočasné ischemie. Hypoperfuze má vliv nejen na viscerální orgány, ale i na míchu. V současné době existuje několik kroků, které redukují trvání a rozsah ischemie u chirurgické léčby TAAA. V posledních dvaceti letech byly intenzivně vyvíjeny různé druhy orgánové protekce i specifický chirurgický postup, který u těchto výkonů redukuje mortalitu a morbiditu tak, že je možné tuto techniku používat běžně na specializovaných pracovištích. Rutinní chirurgické přístupy společně s nižší heparinizací, mírnou celkovou hypotermií a postupným nakládáním aortální svorky představují zásadní postup při chirurgické léčbě výdutí hrudní a torakoabdominální aorty.
Přes všechny novinky, které jsou v chirurgické léčbě TAAA používány jsou tyto výkony stále ještě velice náročné s výskytem významných per a pooperačních komplikací. Důkladné předoperační vyšetření může odhalit preexistující kardiovaskulární, plicní nebo renální rizikové faktory, které mohou mít zásadní vliv na strategii léčby. Například chronický nikotinismus představuje mimořádný rizikový faktor, který je spojen s pooperačními plicními komplikacemi. Obdobně relativně mladí pacienti s Marfanovým syndromem (MS) mívají suboptimální plicní funkci. Bránici šetřící technika může v pooperačním průběhu pomoci právě u pacientů s limitovanými plicními rezervami [13]. Nemocní s rozsáhlým postižením torakoabdominální aorty, kteří mají významné přidružené choroby jsou zatíženi vysokým rizikem pooperačních komplikací a zvláště u II. typu TAAA existuje vysoké riziko mortality, neurologického deficitu nebo renálního selhání [14]. S prodlužujícím se věkem, diagnostickými a technickými možnostmi jsou k léčbě TAAA indikování stále starší pacienti s omezenými fyziologickými rezervami. Tento fakt nás neustále nutí hledat, vyvíjet a zdokonalovat léčbu TAAA. V současné době je možné pouze v některých případech nabídnout pacientům alternativní endovaskulární léčbu, která je sice zatížena menší mortalitou a morbiditou, ale nejsou zcela jasné dlouhodobé výsledky.
OPERAČNÍ STRATEGIE
Při operaci TAAA je používána selektivní intubace biluminální kanylou z důvodu řízeného kolapsu levého plicního křídla při našívání centrální anastomózy a reimplantaci interkostálních tepen. Poloha pacienta je na jeho pravém boku s levou horní končetinou umístěnou na rámu operačního stolu a s pokrčenou pravou dolní končetinou tak, aby byl možný přístup k femorální tepně v levém třísle. S výhodou je možné použití pneumatické matrace, která pevně fixuje tělo pacienta v požadované poloze a omezuje vznik peroperačních dekubitů (Obr. 2). Standardním přístupem pro operace TAAA je šesté mezižebří. Incise je vedena od dolního okraje lopatky směrem k pupku s možností transperitoneálního nebo retroperitoneálního přístupu s částečným nebo cirkulárním přerušením svalové porce bránice a následnou mediální orgánovou rotací.
Obr. 2. Poloha pacienta při operaci TAAA Fig. 2. Patient position during TAAA procedure 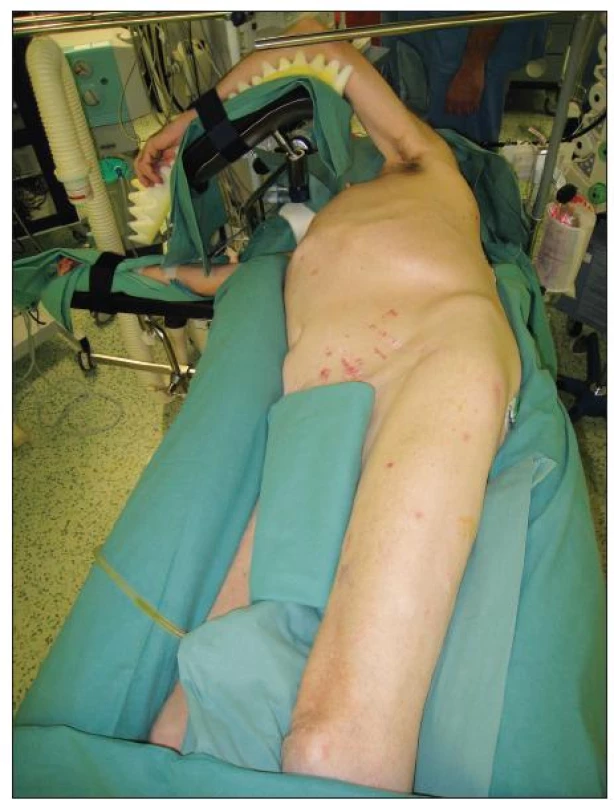
Redukovaná heparinizace
V současné době je nejčastěji používána před naložením aortální svorky mírná heparinizace v dávce 1 mg na kg hmotnosti pacienta. Ačkoliv používání heparinu při operaci TAAA zůstává podle některých autorů sporné, jeho podávání je obhajováno k prevenci možné trombózy interkostálních a lumbálních tepen s rizikem následné míšní ischemie. Potenciální komplikace včetně koagulopatie a krvácení se vyskytují jen vzácně [15]. K neutralizaci heparinu je podáván protamin sulfát.
Mírná hypotermie
Při terapii TAAA je používána mírná celková hypotermie v rozmezí 32–34 °C. Po dokončení implantace cévní náhrady a obnovení průtoku bývá teplota těla zvyšována jednoduše teplým roztokem umístěným do operačního pole nebo pomocí výměníku tepla a zevním ohříváním nemocného. Ačkoliv je chirurgická technika i velikost hypotermie různá v závislosti na zkušenostech jednotlivého centra, názor na vhodnost hypotermie k ochraně ledvin a míchy zůstává shodný [16].
Postupné nakládání aortální svorky
Hemodynamický efekt naložení a odstranění aortální svorky je znám a významně přispívá k rozvoji pooperační orgánové dysfunkce. Postupné nakládání aortální svorky zůstává efektivní strategií k redukci času ischemie u TAAA. Při tomto postupu je aorta nahrazována od její proximální části směrem distálním, svorka na aortě je posouvána postupně a ihned je obnovován průtok do oblastí, které byly aktuálně reimplantovány do cévní protézy [16].
Cerebrospinální drenáž (CSF)
Ischemie míchy s následnou paraplegií nebo paraparézou je považována za zásadní komplikaci, která je u chirurgické léčby TAAA popisována. Tento typ komplikace vzniká na základě vzájemného působení hypoperfuze, oxygenace, lokální metabolické reakce a reperfuze. Experimentální studie ukazují, že cerebrospinální tlak roste po naložení aortální svorky a cerebrospinální drenáž tento tlak redukuje a zlepšuje míšní perfuzi [17, 18]. CSF má významnou ochrannou roli míchy během a po operaci TAAA [19, 20]. Katétr je umístěn před začátkem chirurgického zákroku ve druhém nebo třetím bederním prostoru. Cerebrospinální tlak je udržován na hodnotách 10–12 mm Hg, který může být dále v pooperačním období zvýšen na 12–15 mm Hg. CSF je obvykle používána 48 hod. od operace. Před odstraněním katétru je doporučen jeho několikahodinový uzávěr s neurologickou kontrolou k vyloučení možného opožděného neurologického deficitu. CSF je doporučována hlavně u typů TAAA I. a II., u kterých je popisováno vyšší procento neurologických komplikací [21].
Úsekové reimplantace tepen
Reimplantace interkostálních tepen může předcházet míšní ischemii se všemi negativními důsledky, i když názor na tuto problematiku není zcela vyjasněn. Jsou známy práce, které popisují určitý nadbytek v krevním zásobení míchy a reimplantaci považují za zbytečnou [22]. Na druhou stranu řada prací upozorňuje na anatomické variace tohoto zásobení s nutností poměrně razantní reimplantace interkostálních tepen, zvláště variabilní Adamkiewiczovy tepny. Většina autorů preferuje reimplantovat jeden až tři páry interkostálních tepen v kritické zóně mezi Th 8 a L 1 (Obr. 3A). Při významném aterosklerotickém postižení aorty s obliterací odstupů interkostálních a lumbálních tepen někteří přistupují k endarterektomii s cílem jejich identifikace a následné reimplantace [16]. V dalším průběhu operace následuje reimplantace viscerálních větví aorty, které jsou obvykle našívány do cévní protézy na jednom terči. Levá renální tepna může být s ohledem na anatomické poměry implantována samostatně nebo jsou samostatně našity všechny viscerální tepny při použití větvené cévní protézy (Obr. 13)
Obr. 3A. Schéma reimplantace interkostálních tepen a selektivní perfuze viscerálních tepen Fig. 3A. A schematic diagram of intercostal arteries reimplantation and selective perfusion of visceral arteries 
Obr. 3. Větvená cévní protéza (A – truncus coeliacus, B – arteria mesenterica superior, C – arteria renalis dextra, D – arteria renalis sinistra) Fig. 13. Branched vascular prosthesis (A – truncus coeliacus, B – arteria mesenterica superior, C – arteria renalis dextra, D – arteria renalis sinistra) 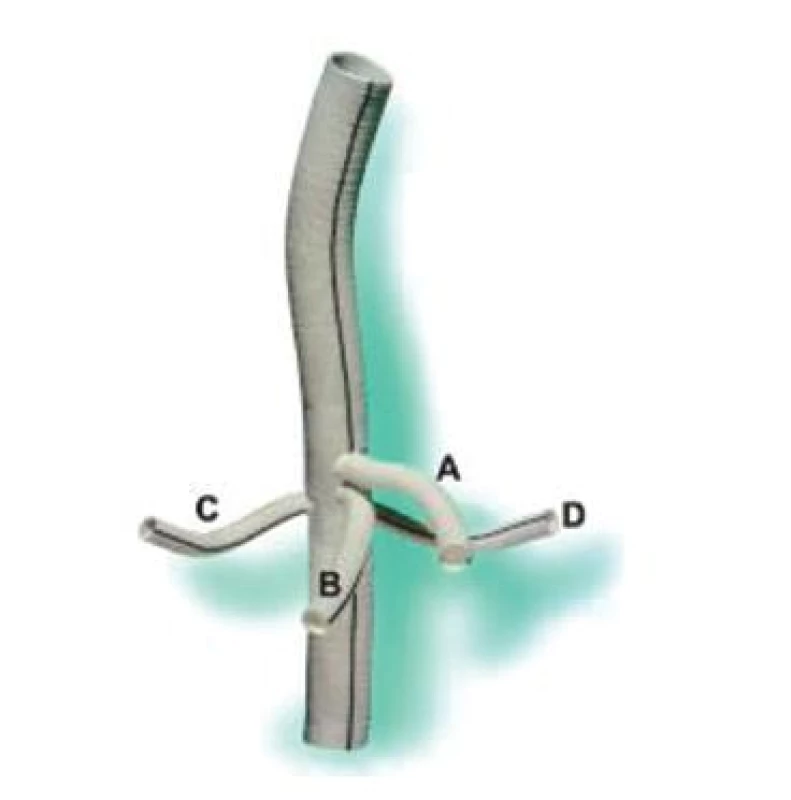
Levostranný srdeční bypass
Prolongované přerušení krevního toku do viscerálního segmentu aorty, interkostálních tepen a dolní poloviny těla může vést k významným komplikacím. K redukci míšní a viscerální ischemie je používán tzv. levostranný srdeční bypass (LHB), který prostřednictvím centrifugální pumpy udržuje distální aortální perfuzi během rekonstrukce TAAA. Zvláště u pacientů s I. a II. typem TAAA přináší LHB významný profit k ochraně míchy před ischemií a ani delší aortální svorka neznamená zvýšení výskytu paraplegie [15, 23]. Tato skutečnost naznačuje, že LHB poskytuje delší čas k provedení bezpečné centrální anastomózy, protože je tímto způsobem mícha ochráněná. Coselli uvádí sestavu 666 pacientů s I. a II. typem TAAA, kde při použití LHB byl výskyt paraparézy/paraplegie a renálního selhání 3,9 % respektive 5,3 % [15].
S rostoucím počtem dostupných retrospektivních dat je možné tvrdit, že LHB významně redukuje riziko ischemických komplikací [15, 20, 23, 24]. Dále je LHB s výhodou používán u pacientů s významnou poruchou srdeční funkce, protože velmi efektivně srdci při naložené aortální svorce odlehčuje. Centrální kanyla LHB je umístěna a stehem fixována nejčastěji přímo v dolní plicní žíle nebo u typu III. – V. v sestupné hrudní aortě. Okruh je dále veden přes biopumpu (Terumo Inc., Tokyo, Japan; Medtronic Biomedicus, USA) a výměník tepla do kanyly v levém třísle (Obr. 4).
Obr. 4. Levostranný srdeční bypass (schéma) Fig. 4. Left heart bypass (a schematic diagram) 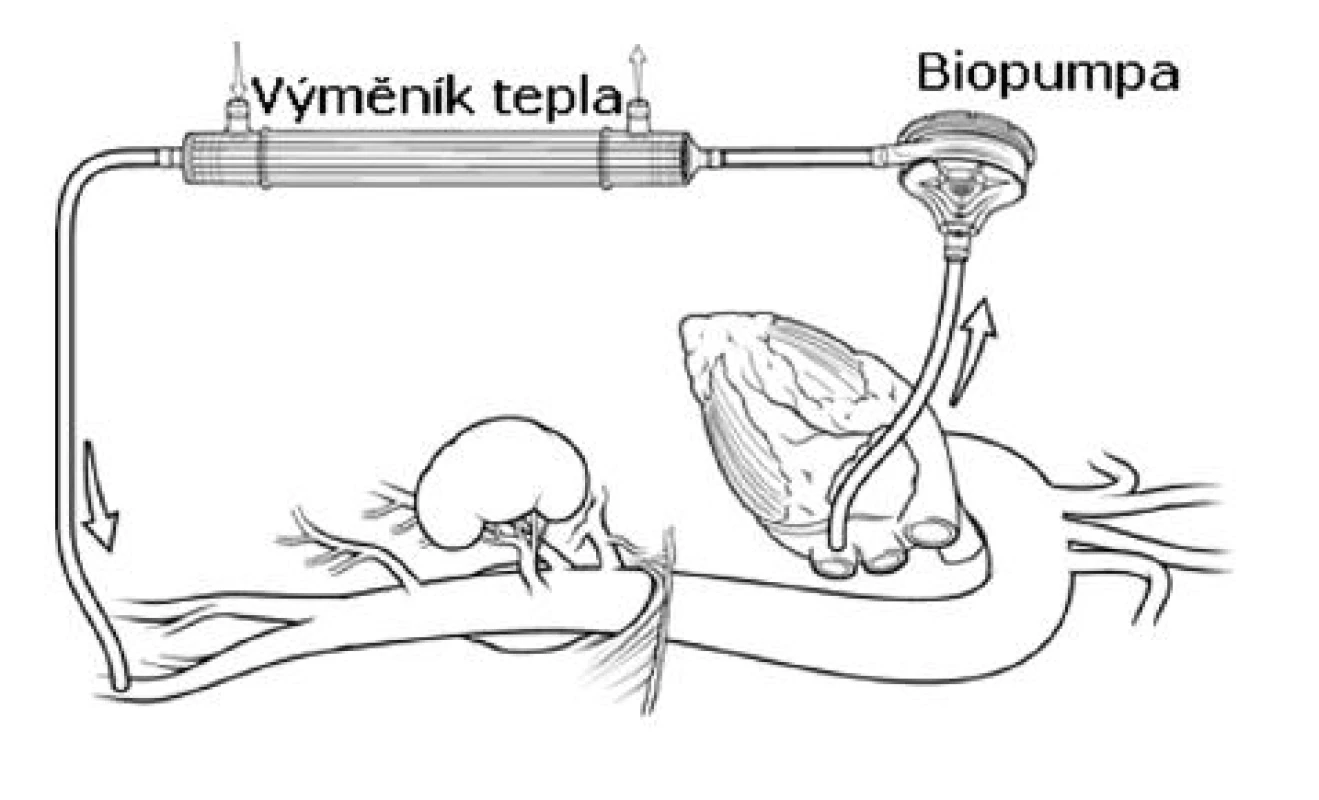
Perfuze ledvin studeným krystalickým roztokem
Navzdory zlepšení anestezie, chirurgické techniky i pooperační intenzivní péče zůstává renální selhání významným faktorem, který se zásadně podílí na morbiditě a mortalitě po operacích TAAA. Z literatury je známo, že se akutní renální selhání po těchto náročných operacích vyskytuje v 7–40 % [25, 26, 27]. Byla zkoušena řada technik zvrátit tento nepříznivý stav včetně intraoperační aplikace diuretik, minimalizace času ischemie ledvin, hypotermie ledvin, perfuze ledvin oxygenovanou krví atd. [25, 28, 29]. Selektivní perfuze ledvin krví sice příznivě ovlivňuje jejich ischemii během naložené aortální svorky, ale pooperační selhání ledvin se i v tomto případě objevuje v 8-29% [25, 26, 30]. [16]. V kontrastu s touto metodou vede použití studeného krystalického roztoku při perfuzi ledvin k jejich lokální hypotermii a redukci metabolismu s poklesem výskytu pooperačního renálního selhání na 3–11 % [25, 31]. Studený krystalický roztok s manitolem a methylprednisolonem (Solu-medrol®) představuje v současné době asi nejlepší možnost ochrany ledvin při operacích TAAA (Obr. 3A).
Selektivní viscerální perfuze
Distální aortální perfuze je prováděna ve fázi, kdy je našívána centrální anastomóza při operaci TAAA a eventuálně v průběhu reimplantace interkostálních tepen do cévní protézy. Během revaskularizace viscerálního segmentu aorty je pak dále používána selektivní viscerální perfuze, protože gastrointestinální komplikace (GI) po operaci TAAA mají vysokou morbiditu i mortalitu. Během této techniky proudí okysličená krev jednotlivými katetry do TC a AMS, abychom minimalizovali čas ischemie břišních orgánů (Obr. 3B). Doporučovaný tlak retrográdní perfuze by měl být udržován na hodnotách 60 mm Hg. Safi uvádí 7% výskyt GI komplikací ve svém souboru 1159 pacientů s mortalitou 39,5 % [32]. Při detailním hodnocení této závažné komplikace byla mortalita nejvyšší u biliárních komplikací (75 %) a u střevní ischemie (62 %) [32]. Technika selektivní viscerální perfuze efektivně redukuje čas ischemie na několik minut.
Obr. 3B. Selektivní perfuze viscerálních tepen – peroperační foto Fig. 3B. Selective perfusion of visceral arteries – intraopertive view 
Minimalizace času ischemie
V současné době je obecně známo, že výsledky operací TAAA jsou významně závislé na trvání peroperační orgánové ischemie. Kratší trvání aortální svorky tuto ischemii zkracuje a snižuje riziko renálních, viscerálních i neurologických komplikací. Tradiční technika „clamp-and-sew“ se ukázala jako velice efektivní již v minulosti v experimentální chirurgii [33]. Velice důležitou je sehranost a stabilita týmu, který se na těchto operacích podílí, kde vedle chirurgů působí anesteziologové, intenzivisté, perfuzionisté, specializované sestry atd.
Motorické a somatosenzorické evokované potenciály
Výskyt paraplegie při léčbě TAAA byl v minulosti vysoký až kolem 31 % [34]. I když se tento počet v posledních dvaceti letech významně snížil díky používání nových technik, zůstává i nadále přítomen. Tento fakt vede ke snahám předpovídat tuto nepříjemnou komplikaci s použitím neurologického peroperačního monitorování (Obr. 5). K monitorování míšních funkcí jsou používány motorické (MEP) a somatosenzorické (SSEP) evokované potenciály, které se v chirurgii hrudní a torakoabdominální aorty staly rutinní metodou [35, 36]. Jedna z posledních prací z roku 2009 zdůrazňuje, že při sledování změn MEP a SSEP u chirurgické léčby TAAA je významná korelace jen v případě, že došlo k pooperačnímu ireverzibilnímu neurologickému deficitu. Reverzibilní pooperační neurologické změny ani pozdní neurologické změny nebyly v korelaci s měřením MEP a SSEP. Tzn., že i v současné době zůstává monitorování MEP a SSEP během chirurgické léčby TAAA přinejmenším kontroverzní [37].
Obr. 5. Neurologické peroperační sledování – peroperační foto Fig. 5. Intraoperative neurological monitoring – intraoperative view 
DALŠÍ POMOCNÉ STRATEGICKÉ KROKY
Vedle zavedených postupů v chirurgické léčbě TAAA se objevují i další nová vylepšení a doporučení, která mohou dále přispívat ke zlepšování výsledků. K nejvýznamnějším patří neischemická kanylace femorální tepny. Při standardní přímé kanylaci femorální tepny během LHB dochází ke končetinové ischemii, která je spojována se zvýšeným výskytem pooperační renální insuficience. V současné době existuje modifikace této kanylace, při které je na femorální tepnu našita „end to side“ cévní protéza a kanyla je fixována do takto připravené cévní protézy (Obr. 6 A, B). Tato technika eliminuje končetinovou ischemii a podílí se na nižším výskytu pooperační renální insuficience [38]. V rámci předoperačního vyšetření můžeme pomocí CT nebo magnetické rezonance verifikovat odstup Adamkiewiczovy tepny, která má významný podíl v zásobování míchy (Obr. 7). Odstup této tepny je značně variabilní, odstupuje z aorty jako interkostální nebo lumbální tepna ve výši Th 8 až L 1 [39]. Detailní předoperační znázornění přispívá k zpřesnění místa reimplantace interkostálních nebo lumbálních tepen do cévní protézy. Před našitím centrální anastomózy je vhodné kompletní přerušení aorty s důkladnou vizualizací zadní stěny, abychom zabránily poranění jícnu a vytvoření píštěle mezi cévní protézou a jícnem. Peroperačně zavedená sonda jícnové echokardiografie pomáhá právě při verifikaci vlastního jícnu. Po dokončení anastomózy provádíme případné opravy zásadně pomocí stehů s podložkami. Při operacích aneuryzmatu na podkladě disekce odstraňujeme ostře nůžkami volnou intimu se snahou přesně ozřejmit viscerální větve aorty před jejich reimplantací do cévní protézy. U rozsáhlých nálezů typu II. lze k zlepšení přístupu a rozšíření operačního pole přerušit nebo vytnout příslušné žebro a pomocí speciálního retraktoru fixovat levou polovinu hrudního koše.
Obr. 6. A, B. Neischemická kanylace femorální tepny (A – schéma, B – peroperační foto) Fig. 6 A, B. Non-ischemic canylation of the femoral artery (A – diagram, B – intraoperative view) 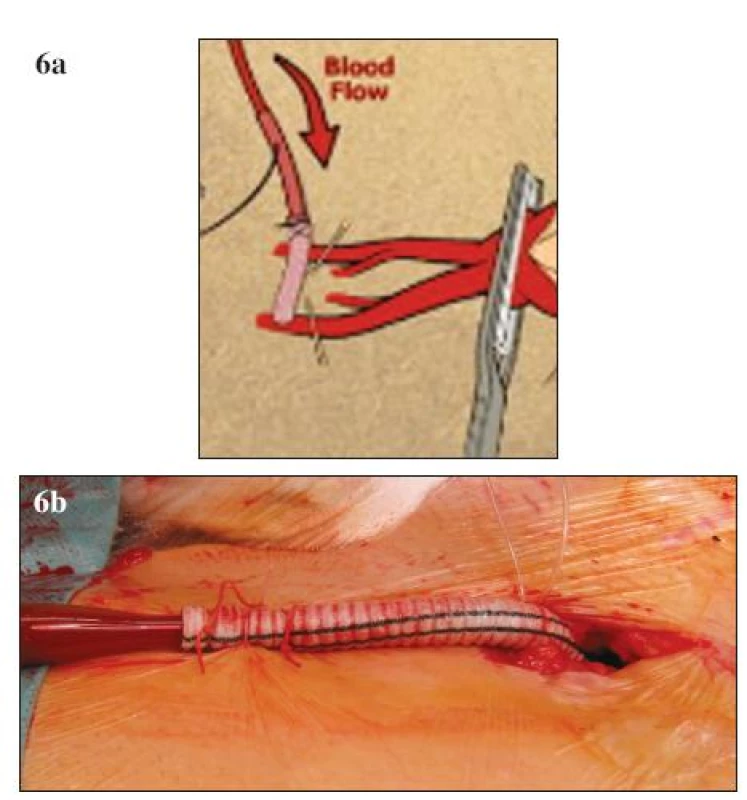
Obr. 7. Odstup Adamkiewiczovy tepny (magnetická rezonance, Ao – aorta) Fig. 7. Adamkiewicz artery branching (magnetic resonance, Ao – aorta) 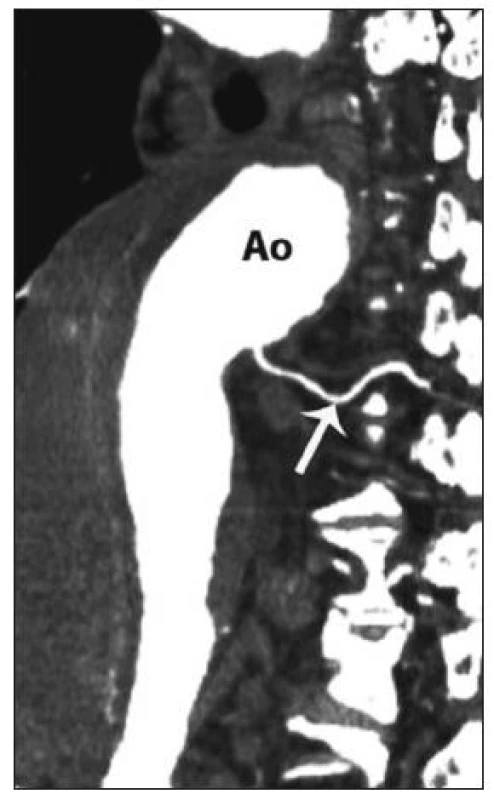
VLASTNÍ ZKUŠENOSTI
Autoři představují soubor 29 pacientů, které operovali od 1. 1. 2009 do 15. 9. 2010 (Graf 1). V tomto souboru byl nejčastěji zastoupen typ II. podle Crawforda (12x), typ I. (5x), následoval typ III. (3x), V. (2x), a IV. (1x). Dále jsme dvakrát reoperovali pacienty, u kterých byla původně provedena resekce hrudní aorty typu I. se šikmou anastomózou v oblasti viscerálního segmentu a v dalším průběhu došlo k aneuryzmatické dilataci právě v tomto místě. Další tři pacienti byli v minulosti ošetřeni endovaskulárně, dva v oblasti hrudní aorty (TVAR) a jeden absolvoval endovaskulární zákrok hrudní i břišní aorty (EVAR). V obou dvou případech došlo opět k aneuryzmatické dilataci viscerální části břišní aorty, která si vyžádala chirurgickou intervenci. Jednou byla provedena resekce hrudní aorty z důvodu podezření na angiosarkom, který nebyl histologicky potvrzen. Osm operovaných pacientů prodělalo v minulosti kardiochirurgickou operaci v oblasti ascendentní aorty, aortální chlopně nebo oblouku aorty. Ve třech případech byl u těchto pacientů použit tzv. „elephant trunk“, který jsme použili k našití centrální anastomózy. V uvedeném souboru byly zastoupeny čtyři akutní operace, třikrát se jednalo o rupturu TAAA (2x II. typ, jeden na podkladě disekce a druhý s Marfanovým syndromem, třetí pacient měl typ III.). Poslední čtvrtý akutní pacient, byl přijat se symptomatickou TAAA (II. typ), která se projevovala bolestí, paraplegií a zvýšenými hodnotami laktátu a zánětlivých markerů v laboratorním nálezu. U nejčastějšího II. typu jsme pozorovali 4x výskyt MS a 5x byla TAAA na podkladě chronické disekce typu „B“ (Obr. 8, 9, 10). V naprosté většině případů jsme se snažili použít při operacích TAAA maximum známých postupů orgánové protekce, jen sledování motorických evokovaných potenciálů bylo z technických důvodů použito pouze dvakrát. Ve většině případů TAAA byl zvolen torakoretroperitoneální přístup, kde vidíme výhodu uzavřené břišní dutiny a dále i ochrany sleziny, která bývá při transperitoneálním přístupu často iatrogenně poraněna a nezřídka je pak nutná splenektomie. Nevýhodou retroperitoneálního přístupu je omezení pohmatové kontroly pulzace periferie nitrobřišních orgánových tepen po našití viscerálního segmentu do cévní protézy.
Graf 1. Počty operací TAAA za posledních 5 let v Nemocnici Na Homolce, Praha (k 15. 9. 2010) Graph 1. A number of TAAA procedures performed in the Na Homolce Hospital (Nemocnice Na Homolce) in Prague, during the past five years (dated to 15-09-2010) 
(černá šipka ukazuje předpokládaný počet operací v roce 2010) (the black arrow shows an expected total number of operations in 2010) Obr. 8. TAAA II. typ podle Crawforda na podkladě chronické disekce (CT-AG) Fig. 8. TAAA, type II according to Crawford, in the presence of chronic dissection (CT-AG) 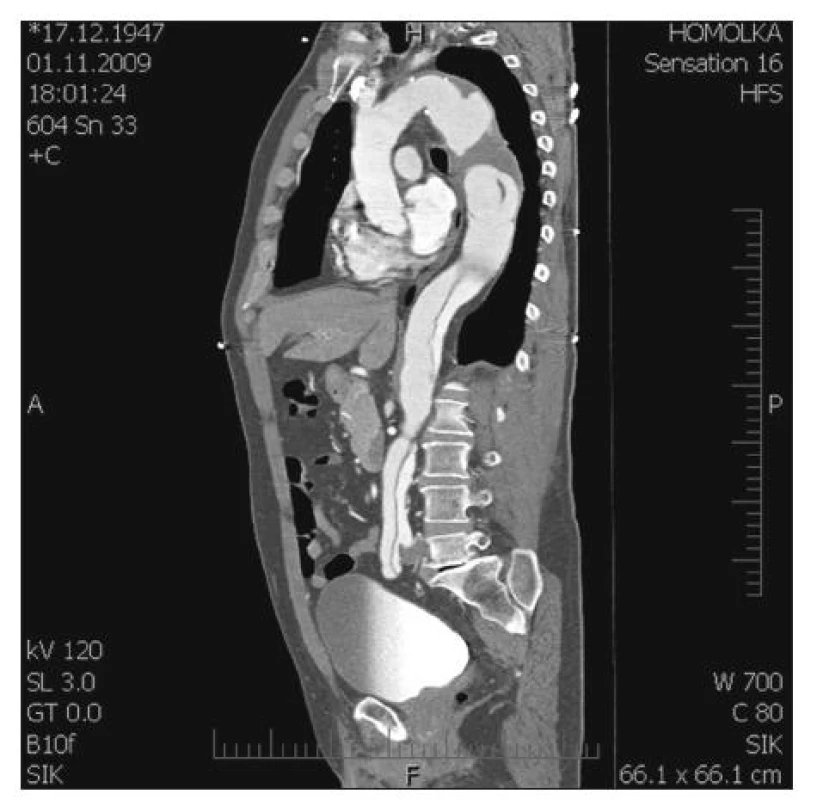
Obr. 9. Kontrolní CT-AG po operaci TAAA II. typu Fig. 9. Control CT-AG following TAAA (type II) surgery 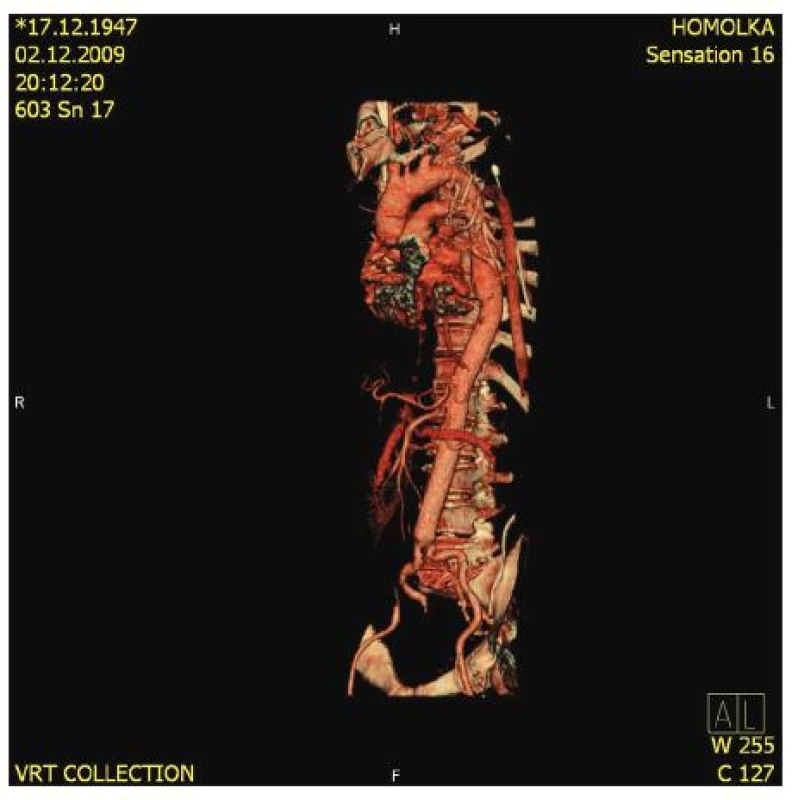
Obr. 10. Reimplantace interkostálních tepen (CT-AG pooperační kontrola) Fig. 10. Reimplantation of intercostal arteries (CT-AG postoperative assessment) 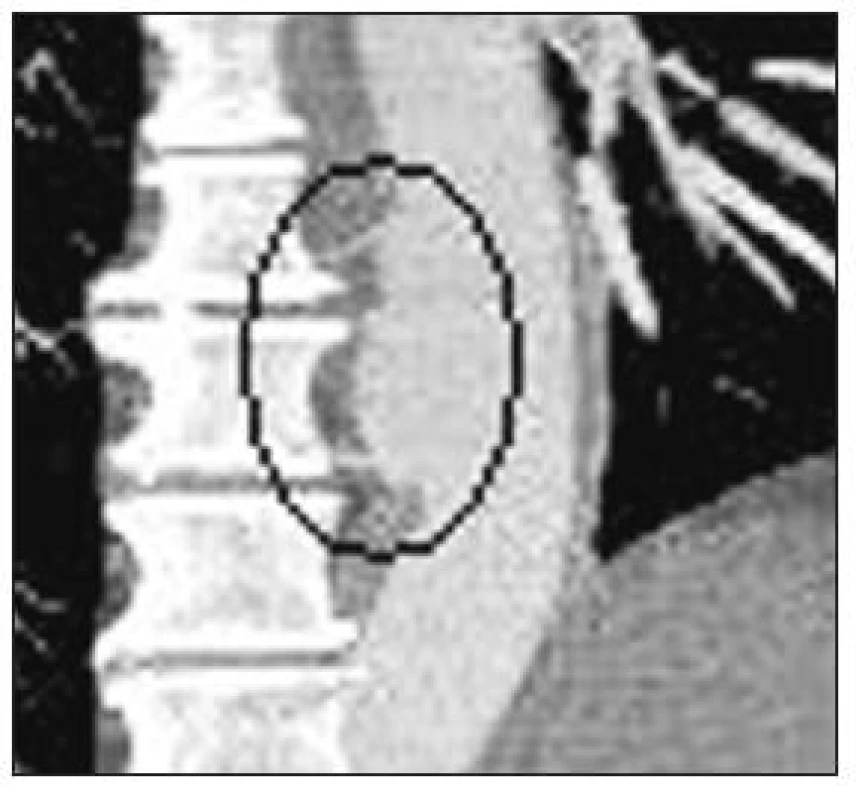
Celková mortalita byla v uvedeném období 24 %, přičemž v roce 2009 bylo operováno 16 pacientů, z toho 14 elektivně a dva akutně pro rupturu, kteří oba zemřeli v důsledku hemoragického šoku. U plánovaných výkonů pak byla mortalita v roce 2009 21%. V roce následujícím bylo od ledna do 15. září 2010 operováno 13 pacientů, 11 elektivně a dva akutně. Celková mortalita je v této skupině 15,4 %, u elektivních pacientů to bylo 9 % a u akutních jeden pacient přežil a jeden zemřel. Nejčastějším důvodem mortality u plánovaných operací a v jednom případě i u akutního výkonu bylo multiorgánové selhání.
V pooperačním sledování jsme jedenkrát zaznamenali paraplegii (3,4 %), pooperační dialýza byla nezbytná u dvou pacientů (6,9 %) a třikrát se vyskytla závažná pooperační komplikace (10,3 %). U dvou nemocných si nález chronického hematomu v dutině hrudní vyžádal torakotomii s evakuací hematomu a jednou byla první pooperační den zaznamenána enterorhagie v důsledku těsné stenózy AMS ošetřenou PTA, která si v dalším průběhu vyžádala opakovanou resekci tenkého střeva.
DISKUSE
Chirurgická léčba torakoabdominální aorty patří stále mezi nejsložitější výkony, které se v cévní chirurgii provádějí. V posledních letech došlo k velkému rozvoji endovaskulárních technik, které se také používají v určitých indikacích i v této oblasti. Ani vývoj moderních endovaskulárních technik neumí nahradit klasický chirurgický přístup, který je potřebný zvláště při postižení viscerálního segmentu aorty, nepříznivých anatomických poměrech nebo při selhání endovaskulárního zákroku. V současné době je endovaskulární léčba metodou volby pro izolované onemocnění hrudní aorty [40]. Komplikovanější bývá tato léčba u MS z důvodu další možné dilatace v důsledku poruchy pojivové tkáně. Do této problematiky patří i další genetické odchylky s možným výskytem dilatace aorty kam patří Ehlersův-Danlosův nebo Turnerův syndrom.
Proto jsou k endovaskulární léčbě u poruchy pojivové tkáně indikováni jen rizikoví pacienti, protože v důsledku desintegrace stěny aorty je vyšší pravděpodobnost retrográdní disekce nebo perforace aorty. Obecně platí, že k elektivním výkonům jsou u MS indikováni pacienti dřívěji s menším rozměrem velikosti výdutě aorty. V současné době existuje i zde endovaskulární zkušenost, ale vzhledem k tomu, že pacienti s MS jsou relativně mladí s malým výskytem dalších přidružených onemocnění, jsou výsledky klasické léčby velmi dobré [41]. V případě indikace k operaci u MS je doporučeno použít tzv. větvenou protézu, kdy jsou viscerální tepny břišní aorty jednotlivě anastomózovány s raménky protézy (Obr. 11). Hlavním důvodem tohoto postupu je riziko vzniku falešné výdutě při reimplantaci všech viscerálních tepen na jednom terči do cévní protézy nebo pokračující disekce do viscerálních tepen.
Obr. 11. Náhrada TAAAvětvenou protézou v kombinaci s náhradou pánevních tepen bifurkační protézou (A– 14 mm společné raménko pro AMS a TC, B – 10 mm raménko pro arteria renalis sinistra [arteria renalis dextra reimplantována samostatně na zadní straně protézy], C – bifurkační protéza) Fig. 11. TAAAreplacement using branched prosthesis, in combination with the pelvic arteries replacement using bifurcation prosthesis (A – 14 mm common arm for superior mesenteric artery and coeliac trunk, B – 10 mm arm for left renal artery [right renal artery, on its own, reimplanted to the back of the prosthesis], C – bifurcation prosthesis) ![Náhrada TAAAvětvenou protézou v kombinaci s náhradou pánevních tepen bifurkační protézou (A– 14 mm společné raménko pro AMS a TC, B – 10 mm raménko pro arteria renalis sinistra [arteria renalis dextra reimplantována samostatně na zadní straně protézy], C – bifurkační protéza)
Fig. 11. TAAAreplacement using branched prosthesis, in combination with the pelvic arteries replacement using bifurcation prosthesis (A – 14 mm common arm for superior mesenteric artery and coeliac trunk, B – 10 mm arm for left renal artery [right renal artery, on its own, reimplanted to the back of the prosthesis], C – bifurcation prosthesis)](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/273fdcc3434f3f89b27d21b5f0151b87.jpeg)
Obr. 12. Postupné nakládání aortální svorky Fig. 12. Gradual placement of the aortic clip 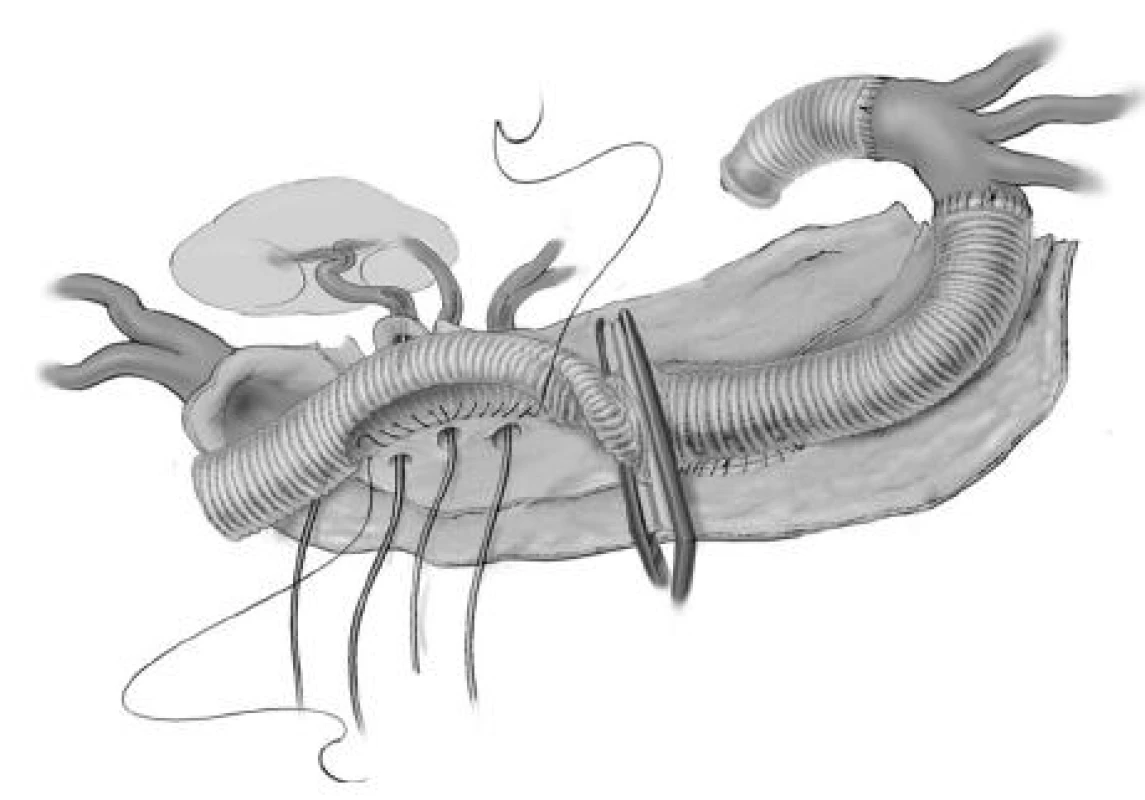
Hybridní operace představují další méně invazivní přístup k řešení problematiky TAAA, který se objevuje v posledních letech a jedná se o kombinaci extraanatomické retrográdní revaskularizace viscerálních tepen aorty s endovaskulární technikou. Tento typ chirurgické intervence je doporučen zvláště u rizikových pacientů, i když ani zde není morbidita a moralita zanedbatelná [42]. Asi poslední novinkou v minimálně invazivní chirurgii torakoabdominální aorty je použití fenestrovaných nebo větvených stentgraftů, které jsou ale zatím stále implantovány v rámci klinického experimentu a bývají publikovány jen jednotlivé případy. K širšímu využití je zcela jistě zapotřebí další vývoj této technologie a široké endovaskulární zkušenosti [43].
Z technického hlediska jsou nejkomplikovanější aneuryzmatické dilatace aorty na podkladě chronické disekce typu „B“. U tohoto nálezu je nezbytné ozřejmení pravého a falešného lumen, dokonalé odstranění odtržené intimy s verifikací ústí tepen viscerálního segmentu. Při nálezu chronické disekce bývá větší krvácení, která se objevují nejen z různých entry a reentry aortální stěny, ale i z rozvolněné stěny tepny. Za těchto okolností je velmi vhodné provádět veškeré opichy s použitím podložek, abychom zabránili prořezávání stěhů a pokračování krvácení. Při chirurgii TAAA používáme nejen autotransfuzní systém cell-saver, ale i rapid infusion system (Haemonetics, Inc., Braintree, MA, USA). Pomocí kterého je možné vracet zpět nejen odsátou a filtrovanou krev, ale i další infúzní roztoky rychlostí až 1500 ml/min.
V některých případech se jedná o pacienty po kardiochirurgické operaci pro disekci typu „A“, kteří jsou po zákroku na aortální chlopni nebo oblouku aorty a ve druhé době přicházejí k řešení nálezu na torakoabdominální aortě. U části nemocných po srdeční operaci bývá použit tzv. „elephant trunk“, který je při TAAA použit k našití centrální anastomózy pokračující cévní protézy. Na tomto místě je třeba upozornit na dokonalou kontrolu a ošetření krvácení z interkostálních tepen v blízkosti místa jeho fixace.
V souladu s literaturou jsme i v našem souboru nejčastěji pozorovali typ II. podle Crawforda. Celková mortalita byla v uvedeném souboru 24 % a je srovnatelná s publikovanými pracemi, kde je udávána od vynikajících 4,9 % až do 28 % [44, 45]. Toto číslo obsahuje samozřejmě i akutní zákroky, které jsou spjaty s extrémní mortalitou. Mortalita u elektivních operací byla v roce 2009 15,4 % a v roce 2010 byla 9 %. Paraplegie je v našem souboru 3,4 % ve srovnání s literaturou 4–15 %. V pooperačním období byla potřebná dialýza v 6,9 % (literatura: 10–15 %) a významnou pooperační komplikaci jsme zaznamenali v 10,3%.
ZÁVĚR
Pro úspěšné zvládnutí chirurgické léčby TAAA je nezbytný multioborový přístup. Chirurg intenzivně spolupracuje při řešení TAAA s anesteziologem, intenzivistou, perfuzionistou, neurologem nebo neurochirurgem (monitorace evokovaných potenciálů). Současná chirurgická strategie léčby TAAA vyžaduje moderní způsob orgánové ochrany, který významně přispívá k redukci morbidity a mortality a proto je žádoucí provádět tyto náročné chirurgické výkony pouze ve specializovaných centrech. Endovaskulární léčba nebo hybridní výkony představují nové trendy v léčení torakoabdominální aorty, ale vždy je třeba uvážlivé indikace k tomuto typu výkonu. Hybridní výkony jsou zatím vesměs doporučovány u pacientů s významnými přidruženými chorobami a u endovaskulární léčby, kde je hlavní předností nízká mortalita a morbidita, chybí dlouhodobé výsledky a vyskytují se komplikace ve smyslu endoleaku nebo dilatace nekrytých úseků aorty, nejčastěji viscerálního segmentu, které vyžadují další intervence. K léčbě torakoabdominální aorty a hlavně k její indikaci a zvolení vhodného postupu a typu výkonu je třeba přistupovat velice uvážlivě na základě zkušeností a možností pracoviště.
Doc. MUDr. Petr Štádler, Ph.D.
Nemocnice Na Homolce
Roentgenova 2
150 30 Praha 5
e-mail: petr.stadler@homolka.cz
Zdroje
1. Coselli, J. S., Bozinovski, J., Le Maire, S. A. Open surgical repair of 2286 thoracoabdominal aortic aneurysm. Ann. Thorac. Surg., 2007; 83 : 862–864.
2. Clouse, W. D., Hallett, J. W., Schaff, H. V., Gayari, M. M., Ilstrup, D. M., Melton, L. J. Improved prognosis of thoracic aortic aneurysms: a population-based study. JAMA, 1998; 280 : 1926–1929.
3. Wilmink, A. B., Quick, C. R. Epidemiology and potential for prevention of abdominal aortic aneurysm. Br. J. Surg., 1998; 85 : 155–162.
4. Bickerstaff, L. K., Hollier, L. H., van Peenen, H. J., Melton, L. J., Pairolero, P. C., Cherry, K. J. Abdominal aortic aneurysms: the changing natural history. J. Vasc. Surg., 1984; 1 : 6–12.
5. Wanhainen, A., Bjorck, M., Boman, K., Rutegard, J., Bergqvist, D. Influence of diagnostic criteria on the prevalence of abdominal aortic aneurysm. J. Vasc. Surg., 2001; 34 : 229–235.
6. Bickerstaff, L. K., Pairolero, P. C., Hollier, L. H., Melton, L. J., van Peenen, H. J., Cherry, K. J. Thoracic aortic aneurysms: a population-based study. Surgery, 1982; 92 : 1103–1108.
7. Perko, M. J., Norgaard, M., Herzog, T. M., Olsen, P. S., Schroeder, T. V., Petterson, G. Unoperated aortic aneurysm: a survey of 170 patients. Ann. Thorac. Surg., 1995; 59 : 1204–1209.
8. Dapunt, O. E., Galla, J. D., Sadeghi, A. M., Lansman, S. L., Mezrow, C. K., de Asla, R. A. The natural history of thoracic aortic aneurysms. J. Thorac. Cardiovasc. Surg., 1994; 107 : 1323–1332.
9. Etheredge, S. N., Yee, J., Smith, J. Successful resection of a large aneurysm of the upper abdominal aorta and replacement with homograft. Surgery, 1955; 38 : 1071–1081.
10. DeBakey, M. E., Cooley, D. A., Crawford, E. S. Clinical application of a new flexible knitted Dacron arterial substitute. Arch. Surg., 1957; 74 : 713–724.
11. Crawford, E. S. Thoraco-abdominal and abdominal aortic aneurysms involving renal, superior mesenteric, celiac arteries. Ann. Surg., 1974; 179 : 763–772.
12. Svensson, L. G., Crawford, E. S., Hess, K. R. Deep hypothermia with circulatory arrest. Determinants of stroke and early mortality in 656 patients. J. Thorac. Cardiovasc. Surg., 1993; 106 : 19–28.
13. Engle, J., Safi, H. J., Miller, C. C. III. The impact of diaphragm management on prolonged ventilator support after thoracoabdominal aortic repair. J. Vasc. Surg., 1999; 29 : 150–156.
14. Coselli, J. S., Le Maire, S. A., Conklin, L. D. Morbidity and mortality after extent II thoracoabdominal aortic aneurysm repair. Ann. Thorac. Surg.,2002; 73 : 1107–1115.
15. Coselli, J. S. The use of left heart bypass in the repair of thoracoabdominal aortic aneurysms: current techniques and results. Semin. Thorac. Cardiovasc. Surg., 2003; 15 : 326–332.
16. Coselli, J. S., Le Maire, S. A. Tips for successful outcomes for descending thoracic and thoracoabdominal aortic aneurysm procedures. Semin. Vasc. Surg., 2008; 21 : 13–20.
17. Blaisdell, F. W., Cooley, D. A. The mechanism of paraplegia after temporary thoracic aortic occlusion and its relationship to spinal fluid pressure. Surgery, 1962; 51 : 351–355.
18. Miyamoto, K., Ueno, A., Wada, T. A new and simple method of preventing spinal cord damage following temporary occlusion of the thoracic aorta by draining the cerebrospinal fluid. J. Cardiovasc. Surg., 1960; 16 : 188–197.
19. Coselli, J. S., LeMaire, S. A., Köksoy, C. Cerebrospinal fluid drainage reduces paraplegia after thoracoabdominal aortic aneurysm repair: results of a randomized clinical trial. J. Vasc. Surg., 2002; 35 : 631–639.
20. Safi, H. J., Hess, K. R., Randel, M. Cerebrospinal fluid drainage and distal aortic perfusion: reducing neurologic complications in repair of thoracoabdominalis aortic aneurysm types I and II. J. Vasc. Surg., 1996; 23 : 223–228.
21. Cheung, A. T., Pochettino, A., Guvakov, D. V. Safety of lumbar drains in thoracic aortic operations performed with extracorporal circulation. Ann. Thorac. Surg., 2003; 76 : 1190–1196.
22. Griepp, R. B., Grieb, E. B. Spinal cord perfusion and protection during descending thoracic and thoracoabdominalis aortic surgery: the collateral network concept. Ann. Thorac. Surg., 2007; 83 : 865–869.
23. Coselli, J. S., LeMaire, S. A. Left heart bypass reduces paraplegia rates after thoracoabdominalis aortic aneurysm repair. Ann. Thorac. Surg., 1999; 67 : 1931–1934.
24. Bavaria, J. E., Woo, Y. J., Hall, R. A. Retrograde cerebral and distal aortic perfusion during ascending and thoracoabdominal aortic operations. Ann. Thorac. Surg., 1995; 60 : 345–352.
25. Svensson, L. G., Coselli, J. S., Safi, H. J., Hess, K. R., Crawford, E. S. Appraisal of adjuncts to prevent acute renal failure after surgery on the thoracic of thoracoabdominalis aorta. J. Vasc. Surg., 1989; 10 : 230–239.
26. Safi, H. j., Harlin, S. A., Miller, C. C. Predictive factors for acute renal failure in thoracic and thoracoabdominalis aortic aneurysm surgery. J. Vasc. Surg., 1996; 24 : 338–345.
27. Schmidt, C. A., Wood, M. N., Gan, K. A., Razzouk, A. J. Surgery for thoracoabdominal aortic aneurysms. A. Surg., 1990; 56 : 745–748.
28. Levy, M. Oxygen consumption and blood flow in the hypothermic perfused kidney. Am. J. Physiol., 1959; 197 : 1111–1114.
29. Hanley, M. J., Davidson, K. Prior mannitol and furosemide infusion in a model of ischemic acute renal failure. Am. J. Physiol., 1981; 241 : 556–564.
30. Morishita, K., Yokoyama, H., Inoue, S., Koshino, T., Tamiya, Y., Abe, T. Selective visceral and renal perfusion in thoracoabdominal aneurysm repair. Eur. J. Cardiothorac. Surg., 1999; 15 : 502–507.
31. Kashyap, V. S., Cambria, R. P., Davison, K., LęItalien, G. J. Renal failure after thoracoabdominal aortic surgery. J. Vasc. Surg., 1997; 26 : 949–957.
32. Achouh, P. E., Madsen, K., Miller III, C. C., Estrera, A. L., Azizzadeh, A., Dhareshwar, J., Porat, E., Safi, H. J. Gastrointestinal complications after descending thoracic and thoracoabdominal aortic repairs: A 14-year experience. J. Vasc. Surg., 2006; 44 : 442–446.
33. Cambria, R. P., Davison, J. K., Zannetti, S. Thoracoabdominal aneurysm repair: prospectives over a decade with the clamp-and-sew technique. Ann. Surg., 1997; 226 : 294–303.
34. Svensson, L. G., Crawford, E. S., Hess, K. R., Coselli, J. S., Safi, H. J. Experience with 1509 patients undergoing thoracoabdominal aortic operations. J. Vasc. Surg., 1993; 17 : 357–368.
35. Jacobs, M. J., Mess, W., Mochtar, B., Nijenhuis, R. J., Statius, van Eps, R. G., Schurink, G. W. The value of motor evoked potentials in reducing paraplegia during thoracoabdominal aneurysm repair. J. Vasc. Surg, 2006; 43 : 239–246.
36. Kawanishi, Y., Munakata, H., Matsumori, M., Tanaka, H., Yamashita, T., Nakagiri, K. Usefulness of transcranial motor evoked potentials during thoracoabdominal aortic surgery. Ann. Thorac. Surg., 2007; 83 : 456–461.
37. Keyhani, K., Miller, C. C. III., Estrera, A. L., Wegryn, T., Sheinbaum, R., Safi, H. J. Analysis of motor and somatosensory evoked potentials during thoracic and thoracoabdominal aortic aneurysm repair. J. Vasc. Surg., 2009; 49 : 36–41.
38. Miller, C. C. III., Grimm, J. C., Estrera, A. L., Azizzadeh, A., Coogan, S. M., Walkes, J. C. M., Safi, H. J. Postoperative renal function preservation with nonischemic femoral arterial cannulation for thoracoabdominal aortic repair. J. Vasc. Surg., 2010; 51 : 38–42.
39. Melissano, G., Bertoglio, L., Civelli, V., Moraes Amato, A. C., Coppi, G., Civilini, E., Calori, G., De Cobelli, F., Del Maschio A., Chiesa, R. Demonstration of the Adamkiewicz artery by multidetector computed tomography angiography analysed with the open-source software osirix. Eur. J. Vasc. Endovasc. Surg., 2009; 37 : 395–400.
40. Lin, P. H., El Sayed, H. F., Kougias, P. Endovascular repair of thoracic aortic disease: overview of current devices and clinical results. Vascular, 2007; 15 : 179–190.
41. Mommertz, G., Sigala, F., Langer, S., Koeppel, T. A., Mess, W. H., Schurink, G. W. H., Jacobs, M. J. Thoracoabdominal aortic aneurysm repair in patients with Marfan syndrome. Eur. J. Vasc. Endovasc. Surg., 2008; 35 : 181–186.
42. Chiesa, R., Tshomba, Y., Melissano, G., Marone, E. M., Bertoglio, L., Setacci, F., Calliari, F. M. Hybrid approach to thoracoabdominal aortic aneurysms in patients with prior aortic surgery. J. Vasc. Surg., 2007; 45 : 1128–1135.
43. Anderson, J. L., Adam, D. J., Berce, M., Hartley, D. E. Repair of thoracoabdominal aortic aneurysms with fenestrated and branched endovascular stent grafts. J. Vasc. Surg., 2005; 42 : 600–607.
44. Chiesa, R., Melissano, G., de Moura, M. R. L., Civilini, E., Tshomba, Y., de Moura, M. R. L., Magrin, S., Carozzo, A. Surgical treatment of thoracic and thoracoabdominal aortic aneurysms: technical notes and the use of left heart bypass. J. Vasc. Br., 2002; 1 : 207–218.
45. Schlösser, F. J. V., Mojibian, H., Verhagen, H. J. M., Moll, F. L., Muhs, B. E. Open thoracic or thoracoabdominal aortic aneurysm repair after previous abdominal aortic aneurysm surgery. J. Vasc. Surg., 2008; 48 : 761–768.
Štítky
Chirurgia všeobecná Ortopédia Urgentná medicína
Článok vyšiel v časopiseRozhledy v chirurgii
Najčítanejšie tento týždeň
2011 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Současné trendy v chirurgické léčbě výdutě torakoabdominální aorty
- Změny velikosti pravého a falešného lumen ve viscerálním segmentu po endovaskulární léčbě disekcí aorty typu B
- Ischemická kolitída po operáciách pre AAA
- Plazmatické hladiny prozánětlivých cytokinů u aneuryzmatu abdominální aorty
- Radikální operace infekce cévní protézy v aortofemorální pozici s pomocí čerstvého tepenného allograftu: naše střednědobé zkušenosti
- Roboticky asistované cévní rekonstrukce aorto-ilické oblasti
- Vliv infrainguinálních bypassů na dlouhodobou průchodnost pánevních intervencí – význam hybridních výkonů
- Žilní interponát při řešení krvácení z distální anastomózy pedálního bypassu
- Peroperační intraarteriální trombolýza v terapii akutní končetinové ischemie
- Aneuryzma lienální tepny jako příčina bolesti břicha s hypotenzí
- Cytostatická hypertermická perfuze izolované končetiny (HILP) ve VFN
- Simultánní karotická endarterektomie a koronární revaskularizace: indikace a výsledky
- Jednoduchá metoda odstranění infikované cévní protézy
- Dva mylné mýty flebologické chirurgie 20. století
- Rozhledy v chirurgii
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Aneuryzma lienální tepny jako příčina bolesti břicha s hypotenzí
- Současné trendy v chirurgické léčbě výdutě torakoabdominální aorty
- Cytostatická hypertermická perfuze izolované končetiny (HILP) ve VFN
- Radikální operace infekce cévní protézy v aortofemorální pozici s pomocí čerstvého tepenného allograftu: naše střednědobé zkušenosti
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



