-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Divertikulární nemoc tračníku
Diverticular Disease of Colon
Diverticular disease of the colon is one from the most common diseases, especially in the Western world. This disease is symptomatic in only 20–30% patients, but it could be the cause of considerable morbidity and mortality. Pathogenesis is not entirely known. Presumably there are more causing factors – intestinal dysmotility, that is induced by abnormal regulation, structural changes of the colonic wall, genetic factors, diet. The aim of this article is to review the state of our nowadays knowledge in pathogenesis, symptomatology, diagnostic methods and treatment.
Key words:
diverticulosis – diverticulitis – enterorhagia
Autori: Z. Adamová
Pôsobisko autorov: Vsetínská nemocnice a. s., chirurgické oddělení, primář: MUDr. Jaroslav Sankot
Vyšlo v časopise: Rozhl. Chir., 2011, roč. 90, č. 8, s. 463-477.
Kategória: Monotematický speciál - Původní práce
Súhrn
Divertikulární nemoc tračníku (DNT) je poměrně široce rozšířená choroba, zejména v západním světě. Přestože je jen u 20–30 % pacientů symptomatická, může být příčinnou značné morbidity, mortality. Její patogeneze není zcela objasněna. Pravděpodobně se na vzniku divertiklů bude podílet více faktorů – střevní dysmotilita způsobená abnormální regulací, strukturální změny stěny střeva, genetické faktory, dieta. Tento článek si klade za cíl shrnout současné poznatky nejen o patogenezi, ale i o symptomatologii, diagnostických metodách a léčbě.
Klíčová slova:
divertikulóza – divertikulitida – enteroragieDEFINICE
Divertikulóza označuje nález mnohočetných divertiklů na tlustém střevě. Ty jsou následkem periodicky či trvale zvýšeného intraluminálního tlaku, který způsobuje vyhřezávání sliznice skrze střevní stěnu (jedná se o nepravé divertikly). Divertikly jsou tvořeny sliznicí, zbytky svaloviny a adventicií.
První zmínka o DNT pochází od francouzského chirurga Alexise Littreho ze 17. století. Autorem prvního přesného popisu divertikulózy byl další Francouz, patolog Jean Cruveilhier (rok 1849). Zánět těchto divertiklů a souvislost jejich vzniku s oslabením stěny střeva v místě vstupu vasa recta byly poprvé popsány v 90. letech 19. století Graserem. Beer v roce 1904 se ve své práci zabýval popisem souvislostí mezi histologickým nálezem a klinickým stavem.
EPIDEMIOLOGIE
Incidence divertikulózy se zvyšuje s narůstajícím věkem. Stejně tak se s přibývajícími léty zvyšuje četnost zánětu a zánětlivých komplikací. Současně, čím starší pacient, tím proximálněji bývá střevo postiženo.
Prevalence v západním světě se udává 5–10 % u populace mladší 50 let, 30 % u populace starší 50 let, 50 % u starších 70 let a přes 66 % u lidí starších 80 let. Divertikulitida se objeví u 10–30 % nemocných. Krvácení u 5–15 %, těžké u 3–5 %.
Pouze u 1–2 % případů divertikulózy je nutná hospitalizace. Operace asi u 0,5 % postižených.
V USA si DNT vynutí hospitalizaci u 130 000 pacientů za rok [1]. Náklady na léčbu divertikulózy ji činí pátou nejzávažnější chorobou GIT [2]. Z dvanáctiletého sledování, provedeném v Kalifornii, vyplynulo, že v období mezi lety 1995–2006 vzrostl počet hospitalizací pro divertikulózu o 2 %. Výskyt DNT u mladých pacientů do 34 let vzrostl až o 8,6 % [3].
Mortalita komplikované divertikulitidy se udává v rozmezí 6–17 %. Nejnebezpečnější je vždy první ataka potíží. Téměř u 90 % pacientů, kteří na divertikulitidu zemřeli, se jednalo o první ataku. Ve studii provedené na Mayo Clinic, do které bylo zařazeno 337 pacientů, byla signifikantně vyšší mortalita u žen (p = 0,01) [4].
Divertikulózu bychom mohli označit za civilizační chorobu, v západních zemích se vyskytuje daleko častěji, u přistěhovalců je její výskyt nižší, ale v relativně krátké době po usazení i u nich její výskyt narůstá [5].
Ještě v roce 1968 se udávalo, že v Africe divertikulóza prakticky neexistuje, nyní již i zde byla popsána, např. v Ugandě [6].
Závislost na stravě chudé na balastní látky byla dokumentována epidemiologickými studiemi, většina však byla retrospektivního charakteru. Hypotéza je postavena zejména na průkazu zvýšení incidence DNT během 20. století a současném trendu poklesu konzumace vlákniny. Prudký nárůst četnosti této choroby je zaznamenán asi 40 let po začátku průmyslové revoluce, tzn. u osob, které vyrostly na rafinovaném cukru a bílé mouce [7]. U vegetariánů je nižší výskyt DNT než u zbylé populace [8]. Vláknina z ovoce a zeleniny by měla mít vyšší protektivní účinek než z cereálií. Dříve někteří lékaři měli své pacienty k tomu, aby se vyhnuli ořechům a jiným potravinám bohatým na balastní látky. Toto doporučení vycházelo z představy, že příčinou tvorby divertiklů a krvácení je intraluminální poranění. Dnes však studie prokázaly opak [1].
Dietní vlivy byly studovány i v prospektivních studiích na zvířecích modelech. Na 1 800 krysách byl popsán inverzní poměr mezi příjmem vlákniny a incidencí DNT [9]. Wess popsal u krys s deficitem příjmu vlákniny vznik cross links mezi kolagenovými vlákny a současný vznik DNT [10]. Wess také prokázal vliv příjmu vlákniny u pregnantních krys na vývoj DNT u jejich potomků [11].
Někteří autoři průkaz protektivního působení vlákniny zpochybňují. Na zvýšeném výskytu DNT, choroby především starších lidí, se může podílet i delší průměrná délka života oproti minulosti, Evropanů a Američanů oproti Afričanům. Souvislost mezi DNT a vlákninou nemusí být přímá. Dá se předpokládat, že ti, kteří konzumují více vlákniny, budou mít nižší energetický příjem a menší výskyt obesity, která bývá taktéž zvažována jako rizikový faktor vzniku DNT. I studie na zvířatech jsou zpochybňovány. U krys se DNT spontánně nevyvine, jen při extrémních výživových omezeních, jejich střevo se od lidského anatomicky odlišuje (nemá taenie coli). Pokud se DNT u krys indukuje, je omezena na proximální část střeva, což by odpovídalo spíše postižení asiatů, než zakavkazské populace [12].
Za další rizikové faktory jsou dále považovány: alkoholismus a nikotinismus. Vyšší incidence divertikulózy u kuřáků sice nebyla prokázaná, ale popisuje se u nich více komplikací, pokud se u nich tato choroba vyskytne. Konkrétně tuto závislost popisuje jedna anglická studie zahrnující 80 pacientů. Udává trojnásobné riziko těžších komplikací u kuřáků (p = 0,028) [13]. Zkoumán byl i protektivní či kauzální vliv kofeinu, zde se však souvislost s DNT nepotvrdila [14, 15].
Dalším uváděným rizikovým faktorem je účinek farmakoterapie, kortikoidů, chemoterapeutik, nesteroidních antiflogistik, které se podílí zejména na komplikovaném průběhu divertikulitidy [16]. Nedostatek pohybu může taktéž přispět ke vzniku divertiklů [17]. Stejně tak genetické faktory mohou hrát určitou roli [18]. DNT bývá pravidelným nálezem u pacientů se vzácnými chorobami pojiva jako Marfanův syndrom, Ehlersův-Danlosův syndrom, Williamsův-Beurenův syndrom, syndrom polycystických ledvin, Coffinův-Lowryho syndrom atd. [19].
Rakovina tlustého střeva se nachází společně s DNT poměrně často. Názory jednotlivých autorů na procentuální výskyt obou chorob současně se však liší (5–30 %) [20]. Moroni v Itálii nalezl pouze vyšší riziko adenomu tlustého střeva u pacientů s DNT, nikoliv však karcinomu [21]. Je otázkou, zda současný výskyt je dán podobnými rizikovými faktory, či zda DNT zvyšuje pravděpodobnost vzniku nádorového onemocnění střeva. Jako prokancerogenní faktor by mohl působit zánět (který je u některých pacientů s DNT chronický), změny v extracelulární matrix a zvýšená proliferace buněk mukózy. Přesto neexistuje dostatek validních důkazů, které by zdůvodnily aktivnější prevenci kolorektálního karcinomu u pacientů s DNT. Negativní vliv přítomné DNT na prognózu či léčbu karcinomu tlustého střeva nebyl popsán [22].
Je poukazováno na současný výskyt civilizačních chorob jako diabetes mellitus, obezita, cholelitiáza, hypercholesterolemie, ateroskleróza. Jako Saintovo trias je nazýván současný výskyt axiální diafragmatické kýly, DNT a cholelitázy [23].
Rasové vlivy také hrají svou roli – levostranná forma (postižení sigmatu a c. descendens) je daleko častější u bílé a černé rasy než u žluté (v 95 % je divertikly u černých a bílých pacientů postiženo sigma). Výskyt divertiklů na příčném tračníku je u bílé populace vzácný, divertikly se nacházejí v pravém hemikolón pouze v 15 %. U žluté rasy je nejčastěji postiženo c. ascendens.
PATOFYZIOLOGIE
Pseudodivertikly vznikají působením vysokého intraluminálního tlaku. Ten vytlačuje sliznici skrze svalovinu tlustého střeva podél perforujících arterií. Stěna divertiklu je tvořena sliznicí, submukózou a zbytky svalových vláken. Při zvětšování divertiklu pak obě poslední vrstvy od apexu postupně mizí. Současně se také mění cévní zásobení, větve arteriae rectae vytvářejí pleteň kolem krčku a na apexu divertiklu. Nejčastěji se divertikly vyvíjejí na mezenterické hranici antimezenterické tenie.
Na vzniku vysokého tlaku se podílejí obě svalové vrstvy, cirkulární však výrazněji. Bazální tlak u nemocných s DNT se neliší od zdravých (normální peristaltická vlna vyvolá intraluminální tlak asi 10 mm Hg). Vlivem abnormální svalové aktivity nemocných dosahuje tlak občasně abnormálně vysokých hodnot (90 mm Hg) – jako reakce na farmakologický stimul (prostigmin, morfin) či postprandiálně [24]. Nejvyšší hodnoty byly naměřeny v oblasti sigmoideorektálního přechodu, kde se divertikly vyskytují nejčastěji (až 200 mm Hg před defekací) [25].
Dalším kauzálním faktorem je snížená pevnost střevní stěny. Bylo zdokumentováno ztluštění cirkulární svaloviny a zkrácení longitudinální vrstvy svaloviny. Zprvu se toto ztluštění považovalo za hypertrofii svalových vláken, histochemická měření však ukázala, že se jedná o akumulaci aberantní vazivové tkáně. Zvyšuje se zastoupení elastinu (až o 200 %), zejména v oblasti tenií. Elastin je uložen mezi buňkami longitudinální svaloviny. Ukládání do kontrahované formy tenií způsobí jejich zkrácení a rozšíření cirkulární svaloviny. Svalové ztluštění se ve větší míře projevuje jen na dvou třetinách obvodu střevního, a to mezi mezenteriální a antimezenteriální tenií. Tato oblast koreluje s nejvyšším výskytem divertiklů.
Histologové dále popisují u DNT tenčí kolagenová vlákna, sbalená do svazků. Ubývá kolagenu I ve prospěch kolagenu III. S věkem, zejména u nemocných s DNT, přibývá cross links, což omezuje ohebnost kolagenu. Snížením complience submukózy se tato původně elastická vrstva stane náchylnější k možnému poškození, natržení, jizevnatění. To následně umožní herniaci mukózy a tvorbu divertiklů [26]. (U nemocných s vrozenou poruchou tvorby kolagenu vznikají divertikly v dětském věku [18, 19, 27].) Urémie, imunosuprese a snad i diabetes potlačují aktivitu fibroblastů, ovlivňují tak tvorbu a ukládání kolagenu.
Změny jsou popisovány i v myoelektrické aktivitě střeva. U nemocných s divertikulózou dochází k diskoordinaci střevní aktivity, k retrográdním vlnám, k hypermotilitě (zejména v oblasti sigmatu a c. descendens), k prodloužení trvání kontrakcí a k nárůstu jejich počtu [28]. Pravidelné střevní kontrakce byly podle Bassotiho u pacientů s DNT frekventnější a prolongovanější než u kontrol, u symptomatických pacientů byly v 30 % spojeny s bolestivým vjemem. Manousos popsal zkrácený transit time u pacientů s DNT [29]. Shafik měřil transkutáně elektrofyziologickou aktivitu sigmatu. Zjistil, že se mění se stadii DNT – na počátku nemoci je aktivita zvýšená, naopak u pokročilé DNT je téměř vyhaslá [30]. Huizinga et al. zkoumal elektrickou aktivitu longitudinální a cirkulární svaloviny. Zaznamenal převahu pomalé aktivity a nedostatek periodických výbojů, které mají normálně za následek propulzní peristaltickou vlnu. To usnadňuje u nemocných vznik segmentálních kontrakcí a lokálního vysokého tlaku [31].
Důvodů abnormální střevní aktivity se uvádí více. Jednak porucha nervové regulace (je popsáno snížení nervových zakončení u longitudinální svaloviny, zkroucení a ztenčení nervových vláken, převaha sympatiku při hypoganglioze a hyperplazii nervových vláken (vzniklá sekundárně po jejich zničení zánětem) [32]. Jiní popsali snížení počtu Cajalových buněk (pacemakerových střevních buněk) [33]. Jsou popisovány změny na receptorech pro tachykininy, endokanabinoidy [34, 35]. Dále bývá udávána porucha humorální regulace, látky jako neurotenzin, neurotonin, gastrin, serotonin, prostaglandin, substance P, VIP, NO [36] a další mají účinky na svalovinu tlustého střeva, jejich komplexní působení a zejména role při vzniku DNT však nejsou jasné.
Změny byly pozorovány i v produkci cytokinů. U pacientů s divertikulitidou se zvyšuje v omentu exprese buněk produkujících TNF, interferon gama a interleukin-2. Naopak klesá sekrece protizánětlivých cytokinů – interleukinů IL-4, IL-10, IL-11.
Diskutuje se vliv metaloproteináz (MMP) a tkáňových inhibitorů metaloproteináz (TIMP) na vznik DNT. Metaloproteinázy jsou endopeptidy schopné degradace extracelulární matrix. V jedné menší studii, postavené na 22 vzorcích, zvýšená produkce TIMP korelovala se závažností divertikulózní nemoci [37]. V německé studii prokázali snížení MMP1 u DNT (studie se týkala 13 nemocných a 14 kontrol) [38]. V další studii, taktéž na 27 pacientech, však Rosemar popsal zvýšenou expresi nejen MMP2, TIMP1, ale i MMP1 [39]. Otázka je, zda změny v aktivitě metaloproteináz nemáme přičítat spíše zánětu doprovázejícímu komplikovanou DNT než samotné divertikulóze.
Transport iontů střevní sliznicí je u DNT beze změny. Často je zmiňován účinek střevního obsahu, zejména nedostatečná náplň tračníku. Diskutováno je působení střevní mikroflóry. Lokální zánětlivá reakce by mohla působit na střevní inervaci. Podle histologického vyšetření sliznice je i u asymptomatické formy divertikulózy přítomno více lymfocytů než u kontrol. Kealy popisuje vyšší počet lymfatických uzlin u nemocných s DNT oproti kontrolám [40].
Vzhledem k tomu, že antibiotika jsou často předepisována, je s podivem, že relativně málo byl zkoumán vliv bakterií. Přitom bakterie dokáží ovlivňovat diferenciaci epiteliálních buněk, morfologii střeva a vytvářet si tak pro sebe vhodné prostředí. Zda je dysbalance střevní mikroflóry kauzálním faktorem či jen následkem DNT je prozatím nejasné. Nejčastěji bývají izolované koliformní bakterie (E. coli), bacteroides (např. B. fragilis) a clostridia.
U symptomatické formy je stěna střevní citlivější na distenzi. Je zajímavé, že tato zvýšená senzitivita se nevztahuje pouze na divertikly postižené sigma, ale i na rektum. Tato hypersenzitivita je podobná jako u pacientů s dráždivým tračníkem. Podobnost potíží některých pacientů se syndromem dráždivého tračníku nastoluje hypotézu, že symptomatičtí pacienti s DNT jsou de facto pacienti se syndromem dráždivého tračníku, kteří mají současně DNT.
Důvod viscerální hypersenzitivity není zcela jasný, ale přibývá důkazů o interakci nervového a imunitního systému. Pokud dojde k poranění tkáně, rozvoji zánětu – uvolní se prozánětlivé mediátory, které zvyšují i senzitivitu aferentních nervů – jak v místě zánětu, tak i na vzdálenějších místech. Toto snížení nervového prahu může přetrvávat i po vyhojení zánětu.
Divertikly jsou zprvu drobné, když je stěna kontrahovaná a ztluštělá, nejsou na povrchu vůbec patrny. Postupně se však zvětšují a s tím se mění i jejich struktura, stěna se ztenčuje. U větších divertiklů se jednou při kontrakci proniklá stolice již nevrací zpět do střevního lumina, vytváří se koprolit. Ten třením a otlakem poškozuje sliznici, čímž je usnadněn průnik bakterií a vznik zánětu. Ischemizaci a poškození sliznice může způsobit i vysoký tlak v divertiklu či okluze zásobující arterie.
Vzácně dojde k vytvoření gigantického divertiklu. Těch bylo v literatuře popsáno asi 150, první popis pochází z roku 1946 (Bonvin a Bonte). Za gigantický divertikl je považován ten, který přesáhne 4 cm. Jsou však popsány i divertikly dosahující 40 cm. Rozlišují se 3 histologické typy.
Existují 2 hypotézy vzniku divertiklů typu I. První je považuje za kongenitální. Podle druhé je příčinou chlopeň v divertiklu, která umožňuje vstup vzduchu dovnitř divertiklu, ale nikoliv již ven, což zapříčiňuje neustálou distenzi a nárůst velikosti divertiklů.
Tab. 1. Histologické typy gigantického divertiklu [41] Tab. 1. Histological types of gigantic diverticles ![Histologické typy gigantického divertiklu [41]
Tab. 1. Histological types of gigantic diverticles](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/498d25cb20e005eaa963f98ccb6522ce.png)
KOMPLIKACE DIVERTIKULÁRNÍ NEMOCI TRAČNÍKU
Akutní divertikulitida
Zánět divertiklu vzniká poškozením sliznice a následným průnikem bakterií. Zánět se může šířit dál v subserózním vazivu. Edém a infiltrát vyvolá ztluštění stěny a zúžení lumina tlustého střeva, což se dá prokázat na CT. Méně spolehlivě sonografií či irigografií. Již první ataka může vážně omezit průchodnost střeva. Po opakovaných zánětech se mohou vytvářet stenózy a porucha hybnosti postiženého střevního úseku vedoucí až k ileóznímu stavu. Po 5 letech průběhu vznikne divertikulitida u 10 %, po 20 letech u 35 % sledovaných.
Segmentální kolitida asociovaná s divertikulózou
Zánětlivý proces postihující segment tlustého střeva asociovaný s DNT je některými považován za zvláštní klinickou jednotku. Postihuje starší dospělé. Nejčastěji se projevuje krvácením, ale mohou se objevit i křeče, průjem. Endoskopicky se dá nalézt lokální zánět sliznice, který nepřekračuje na rektum ani na proximální střevo. Biopsie prokáže nespecifický zánět sliznice. Dobře reaguje na léčbu aminosalicyláty, příp. ustupuje i bez léčby. Kontrolní kolonoskopická vyšetření doplněná o biopsii neprokázala žádný reziduální zánět [42].
Akutní divertikulitida s perforací
Zánět vytvořený průnikem bakterií přes sliznici divertiklu může perforovat skrze serózu.
Zánět se tak dostává do peritoneální dutiny. Podle velikosti komunikace mezi střevním luminem a peritoneální dutinou se vyvine buď purulentní nebo sterkorální peritonitida (s horší prognózou). Studie poukazují na to, že perforace je prvním projevem divertikulitidy v 50 % až 78 %. Při pomalejším průběhu (imunokompetentní, nižší virulence bakterie) může subserózní zánět vyvolat produkci fibrinu v okolních tkáních a jejich slepení. Tím se zánět ohraničí a při následné perforaci serózy se vytvoří parakolický absces. Vzácně může dojít k ruptuře tohoto abscesu a k purulentní peritonitidě či k penetraci do přilehlého orgánu a píštěli (vezikální, vaginální, kutánní…).
Komplikovaná divertikulitida je považována za nejčastější příčinu tvorby píštělí (před m. Crohn a nádorovým postižením střeva či močového měchýře). I při nekomplikovaném abscesu může mít jeho vytvoření pro pacienta trvalé následky v podobě adhezí, které mohou vést k mechanickému ileu.
Všechny typy zánětu se mohou šířit i do retroperitonea, a tak ložiska hnisu můžeme nalézt od perinea, malé pánve, až po bránici. Je zajímavé, že pacienti s delší anamnézou DNT mají větší tendenci k tvorbě abscesu či flegmony než k volné perforaci [4].
Krvácení z divertiklu
40 % krvácení z distální části gastrointestinálního traktu je způsobeno DNT. Kterékoliv stadium divertikulární nemoci může být provázeno krvácením. Nemusí bolet, pouze při silnějším krvácením se objevují tenezmy. Alespoň 1x v životě se krvácení objeví u 3–15 % nemocných, častěji u mužů. Až v 80 % se zastaví spontánně. Recidivy jsou časté (u 25–38 % postižených), čím silnější krvácení bylo, tím větší je pravděpodobnost jeho opakování. Krvácení se častěji vyskytne u pacientů s hyperurikemií (p = 0,004). Jeho incidence vzrůstá u pacientů užívajících steroidy (p = 0,01), nesteroidní antiflogistika (p = 0,042) a blokátory kalciových kanálů (p = 0,03) [43]. Vždy se jedná o arteriální krvácení. Častěji jsou zdrojem krvácení tepénky v oblasti apexu, které jsou růstem divertiklu natolik poškozeny, že mechanický inzult v podobě náhlého nárůstu intradivertikulárního tlaku, způsobí jejich rupturu. Krvácení z drobných tepének v okolí krčku se často spontánně zastaví a uniká tak pozornosti.
KLINICKÉ PROJEVY
Kolikovité bolesti, příp. křeče, v levém hypogastriu se nejtypičtěji objevují po jídle. Mohou se propagovat do zad, k symfýze, do perineální krajiny. S pohybem břišní stěny se nezhoršují, spíš se jejich intenzita může měnit v závislosti na defekaci, flatulenci. Při divertikulitidě se bolest mění v trvalou, zhoršovanou pohybem a kašlem. Současně bývá doprovázena vyšší teplotou a leukocytózou v krevním obraze.
Střevní dysmotilita může mít různé následky – zácpu, pocit nedostatečného vyprázdnění, intermitentní průjem, tenezmy, meteorismus, hlasité střevní zvuky, flatulenci. Tyto potíže se často kryjí se symptomy dráždivého tračníku.
Kontrahované sigma může být hmatné při palpaci v levém dolním kvadrantu. Zástava odchodu stolice a plynů, nauzea a vomitus jsou už známky komplikované divertikulitidy.
Enteroragie může unikat pozornosti, avšak dlouhodobé, ač mírné, krvácení z konečníku může vést k anemizaci pacienta.
Polakisurie, dysurie mohou být následkem dráždění močového měchýře přilehlým zánětlivým ložiskem, příp. kolovesikální píštěle. Ta může vést k rekurentním infekcím, pneumaturii, fecalurii.
Enterokolické píštěle mohou způsobit těžké průjmy. Vylučování stolice vaginou je nepochybným symptomem colovaginální píštěle. (Vznikne snadněji u žen po hysterektomii.)
V literatuře se dají najít i zmínky o asociaci kožních a kloubních potíží s divertikulózou, však zcela raritně [44].
Asi 80 % nemocných s náhodně objevenou DNT nemá žádné dlouhodobé potíže. I u nich je však riziko vzniku komplikací. Na subjektivních potížích pacienta se podílí i psychický stav pacienta.
Charakter potíží závisí na stadiu DNT. V predivertikulárním stadiu trpí někteří pacienti nespecifickými střevními potížemi – bolestmi a střevní dysmotolitou – bez příznaků zánětu. Při asymptomatické DNT pacienti nemají potíže žádné, divertikly jsou zjištěny náhodně při zobrazovacích vyšetřeních, peroperačně. Symptomatická DNT se projevuje většinou výraznějšími bolestmi, obtížemi se střevní pasáží, zvýšenou dráždivostí střeva. Nekomplikovaná akutní divertikulitida se projevuje trvalými bolestmi, které se zhoršují pohybem, zácpou, nauzeou. Jako komplikovaná divertikulitida je označována perforace, ileus, krvácení z divertiklů. Chronická divertikulitida je charakterizována opět bolestmi břicha, problematickou pasáží (nejčastěji střídání zácpy a průjmů), příp. subfebriliemi – chronickým zánětem po opakovaných atakách divertikulitidy.
Pro lepší porovnatelnost výsledků a snazší komunikaci mezi lékaři se vytvořilo několik klasifikací. Především v anglosaské literatuře je nejčastěji používáno Hinchyho skóre, které se užívá ke klasifikaci komplikované DNT. Stadium I. – perikolický zánět v mezokolon, stadium II. – absces v podbřišku mimo mezokolon, stadium III. – generalizovaná purulentní peritonitida po volné perforaci, stadium IV. – generalizovaná sterkorální peritonitida po volné perforaci.
V německy mluvících zemích je často upřednostňována klasifikace podle Hansena a Stocka. Stadium 0 – klinicky asymptomatická forma divertikulózy. Stadium I – nekomplikovaná akutní divertikulitida, projevující se bolestí, působenou zánětem ohraničeným na stěnu střevní. Stadium II – komplikovaná divertikulitida. Ta se dále dělí na: IIa – flegmonózní divertikulitidu projevující se bolestmi břicha, které mohou být doprovázeny lokálním peritoneálním drážděním. Zánět již překročil do perikolické tukové tkáně. IIb – divertikulitidu s abscesem. Klinický nález může být obdobný, ale zobrazovací vyšetření naleznou krytou perforaci, absces.
IIc – divertikulitidu komplikovanou otevřenou perforací, doprovázenou difuzním peritoneálním drážděním. RTG a UZ prokáží volnou tekutinu a plyn v dutině břišní. Stadium III – chronickou, recidivující divertikulitidu, pacienti mají chronické bolesti, nepravidelnou stolici. Stěna střevní je fibrotizovaná, mohou se vyskytovat píštěle, příp. stenosy. Mortalita je u IIa menší než 1 %, u IIb 1–3%, u IIc 12–24%.
Tab. 2. Akutní divertikulitida Tab. 2. Acute diverticulitis 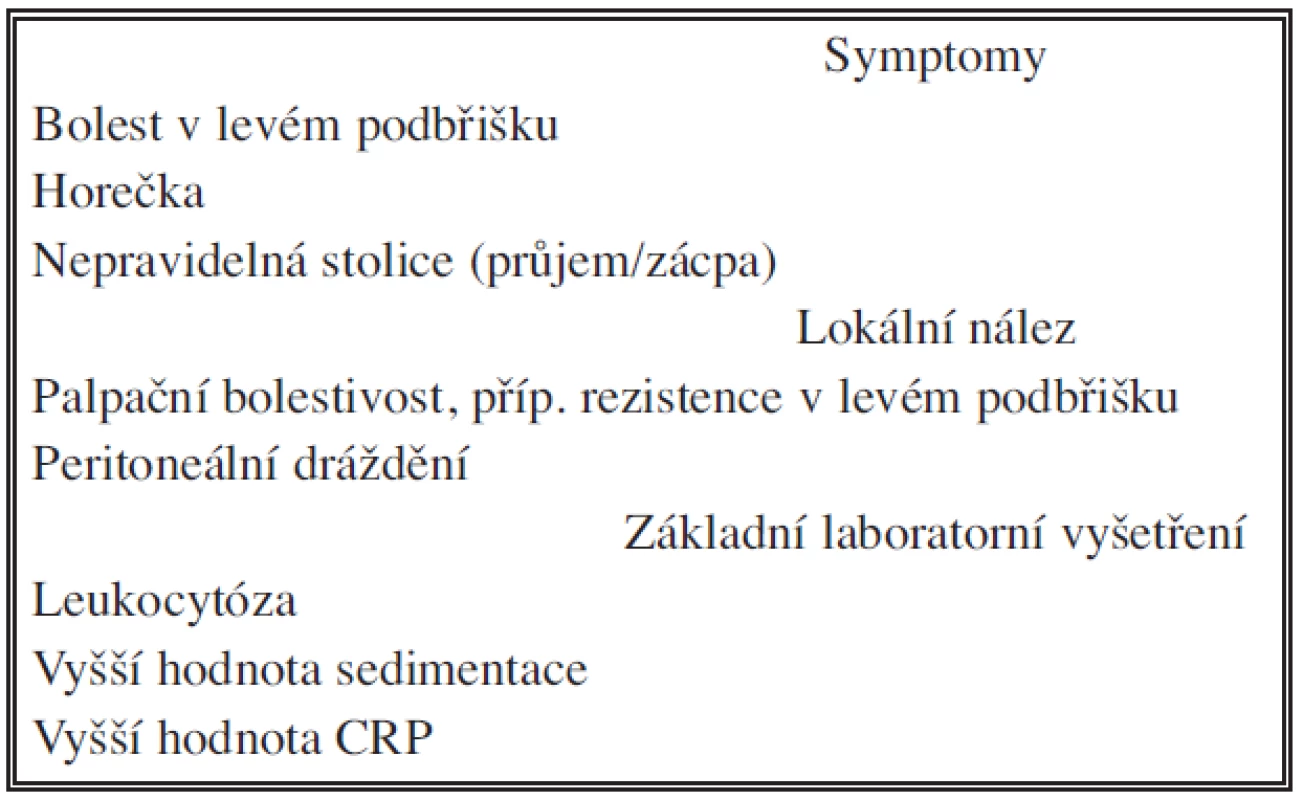
Tab. 3. Klasifikace komplikované divertikulitidy podle Hincheyho (1978) Tab. 3. Classification of complicated diverticulitis according to Hinchey (1978) 
Tab. 4. Klasifikace divertikulózní nemoci tračníku podle Hansena a Stocka (1999) Tab. 4. Classification of diverticular disease of the colon according to Hansen and Stoke (1999) 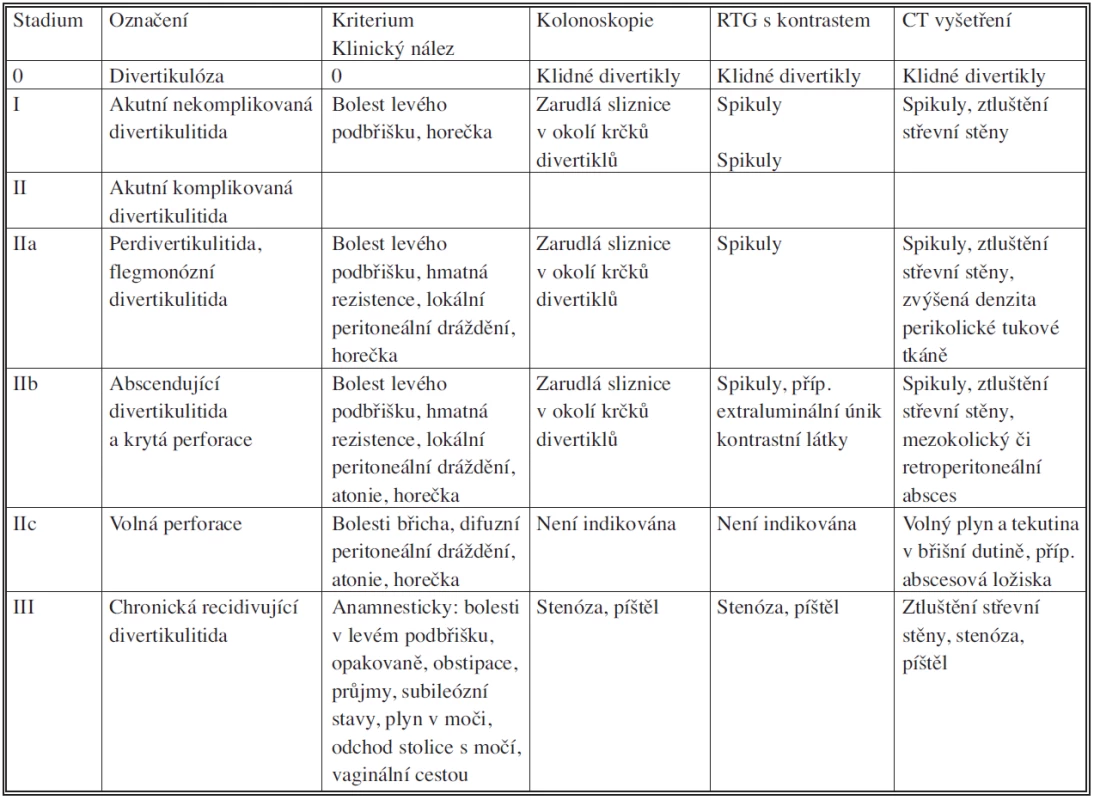
Tab. 5. Klasifikace komplikované divertikulitidy podle Huhgese [45] Tab. 5. Hughes classification of complicated diverticulitis (1963) ![Klasifikace komplikované divertikulitidy podle Huhgese [45]
Tab. 5. Hughes classification of complicated diverticulitis (1963)](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/17a703ba9c52b2d1d1c585ec67916de5.png)
DIAGNOSTIKA
Anamnéza, klinické vyšetření (bolesti při palpaci, nejčastěji lokalizované do levého podbřišku, příp. hmatná rezistence, často se vyskytující meteorismus, příp. lokální až difuzní peritoneální dráždění) a základní laboratorní nález (zejména leukocytóza) nás na možnost divertikulitidy upozorní.
Protože musí být však většinou současně pomýšleno na koloreklální neoplazie, specifické, infekční či ischemické kolitidy, dráždivý tračník, apendicitidu, apendagitidu (zánět epiploického přívěsku, který většinou spontánně během 5–7 dní odezní [46]), intraperitoneální adheze, nefrolitiázou a gynekologická onemocnění, doplňujeme další zobrazovací vyšetření.
Nejčastěji bývá prvním vyšetřením sono břicha, které má senzitivitu až 79–98 % a specificitu až 80–98 %, závisí však na kvalitě přístroje a zkušenosti vyšetřujícího. Sonografista může pozorovat hypoechogenní ztluštění střevní stěny, hypoechogenní lézi, nacházející se vedle střevní stěny. Peridivertikulitis vede k nárůstu echogenity perikolického tuku. Dobře patrné mohou být abscesy, příp. volná tekutina v břišní dutině. Ultrazvuk nám neposkytne dostatečné informace v diagnostice enterorhagie. Pokud je postižené dolní sigma je výhodné doplnit transabdominální sonografii ultrazvukem transrektálním.
Klasický rentgenový snímek břicha nás může informovat o komplikacích, ileu či perforaci. Je také první diagnostickou metodou při podezření na gigantický divertikl. (Zobrazí strukturu naplněnou vzduchem s hladinkou či bez.)
Kontrastní vyšetření je v diagnostice přínosnější, vyšetření dvojím kontrastem může poukázat i na predivertikulární stadium, kdy jsou nejčastěji na sigmatu patrná drobná spikula. Při divertikulóze jsou patrné divertikly, zvýrazněné haustrace, spastické střevo. Rozšíření střevních slizničních řas, edém stěny a stenóza jsou již příznaky divertikulitidy.
Více informací přinese CT vyšetření, které je metodou volby pro akutní divertikulitidu.
Zhodnotí itraluminální a extraluminální patologie. Může být doplněno virtuální kolonoskopií po vyprázdnění střeva.
Virtuální kolonoskopie je výhodnou variantou, pokud z nějakého důvodu nelze provést kolonoskopické vyšetření (u pacientů s antikoagulační terapií, u těch, kteří endoskopické vyšetření netolerují, či u kterých kolonoskopii nelze dokončit. To může být zapříčiněnou stenózou, adhezemi, abnormálně vinutým střevem, nedokonalou přípravou, herniemi.) Podle Lohrmannovy studie, srovnávající CT výsledky s peroperačním vyšetřením, je CT schopno správně stanovit stadium DNT ve více než 90 % případů. Ve srovnání s baryovým vyšetřením má CT tu výhodu, že dokáže popsat i intra - a extramurální patologie, stanovit alternativní diagnózy. Senzitivita a specificita je udávaná až 99%.
Pokud jsou na CT popsány abscesy a bublinky plynu mimo střeva větší než 5 mm, domnívá se Polleti et al., že konzervativní terapie nebude dostatečná [47].
Je zajímavé, že průkaz perforace únikem kontrastní látky se na CT podaří stanovit poměrně zřídka (cca 35 %). Jako důvod se předpokládá obstrukce krčku divertiklu fekolitem. Cystografie může prokázat kolovezikální píštěl.
Kolonoskopie umožňuje nejen aspekci střeva, ale odběr biopsie, příp. ošetření – při krvácení. V akutním zánětu je kolonoskopie neproveditelná, ale po odeznění potíží by měla být provedena u všech pacientů. Už jen proto, že u 3–5 % pacientů s klinicky stanovenou diagnózou akutní divertikulitidy se prokáže adenokarcinom tlustého střeva. Krvácení, které se nedaří lokalizovat kolposkopicky, můžeme lokalizovat angiografií, příp. scintigrafií.
Co se týká laboratorních vyšetření – experimentálně byla prokázána souvislost s fekálním calprotectinem, jehož koncentrace se zvyšovala u akutní divertikulitidy. Calprotectin je složka cytoplazmy neutrofilů, monocytů, makrofágů. Tento protein se uvolňuje při smrti buňky či její aktivaci. Ve stolici je stabilní a dá se prokázat i v odstupu několika dnů. Je užíván ke stanovení aktivity Crohnovy choroby a ulcerózní kolitidy [48].
Diagnostická laparoskopie je nejinvazivnější, a proto v pořadí až poslední vyšetřovací metodou.
Obr. 1. Divertikulóza CT Fig. 1. Divertikulosis on CT 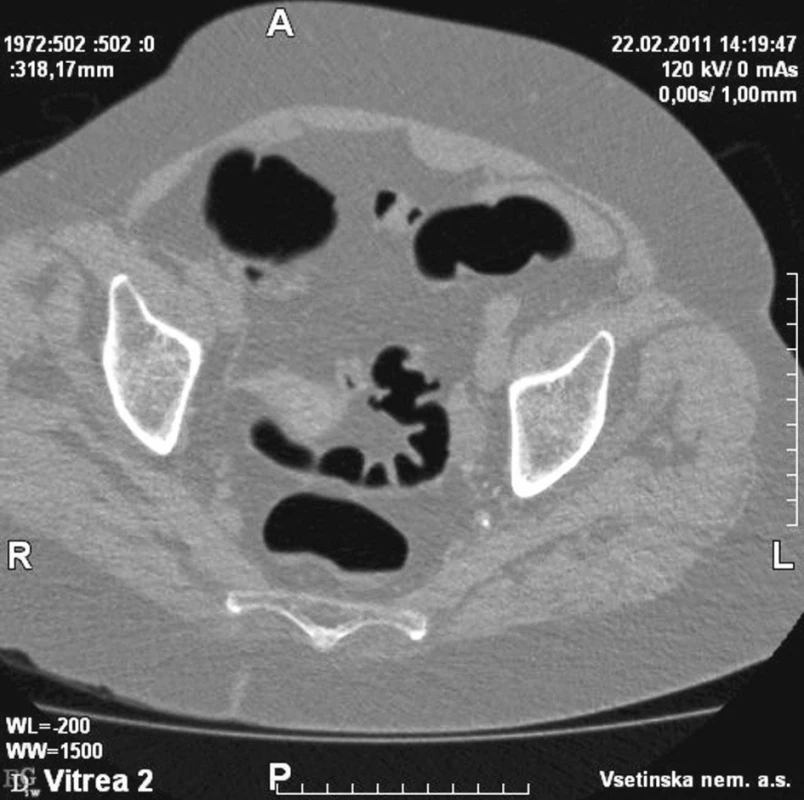
Obr. 2. Virtuální kolonoskopie Fig. 2. Virtual colonoscopy 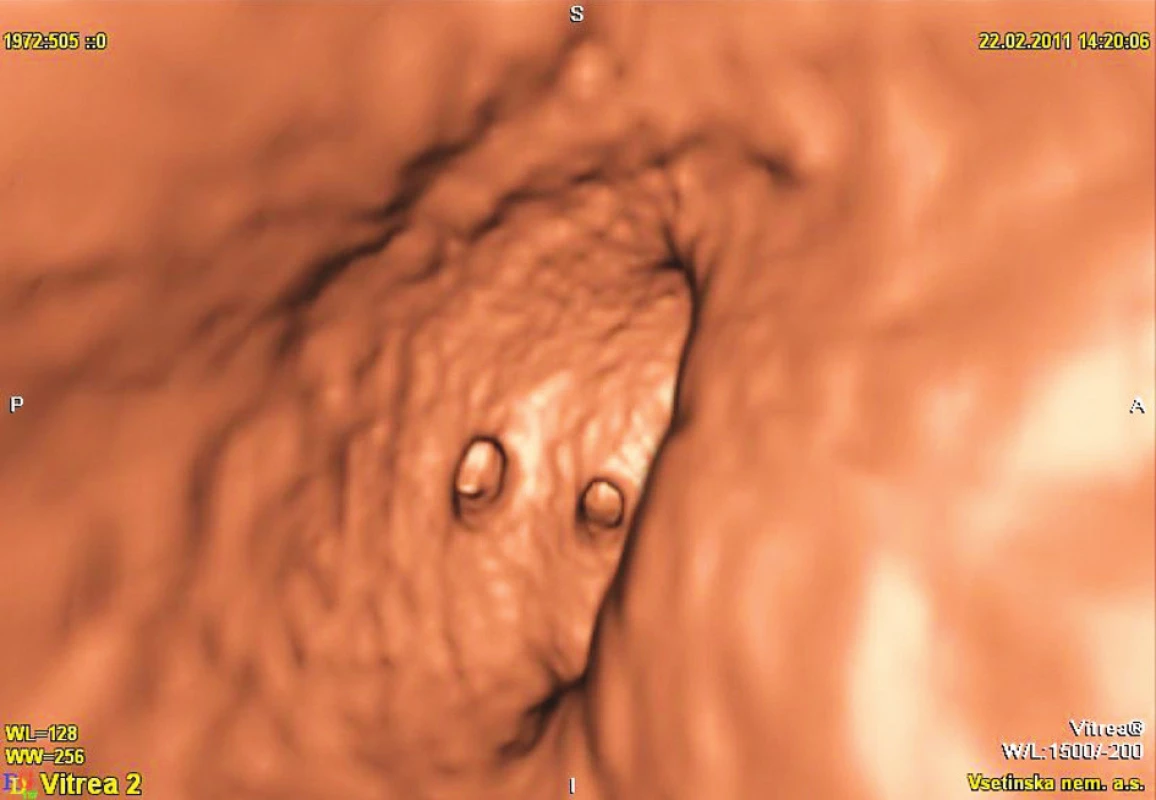
Obr. 3. Virtuální irigografie Fig. 3. Virtual irigography 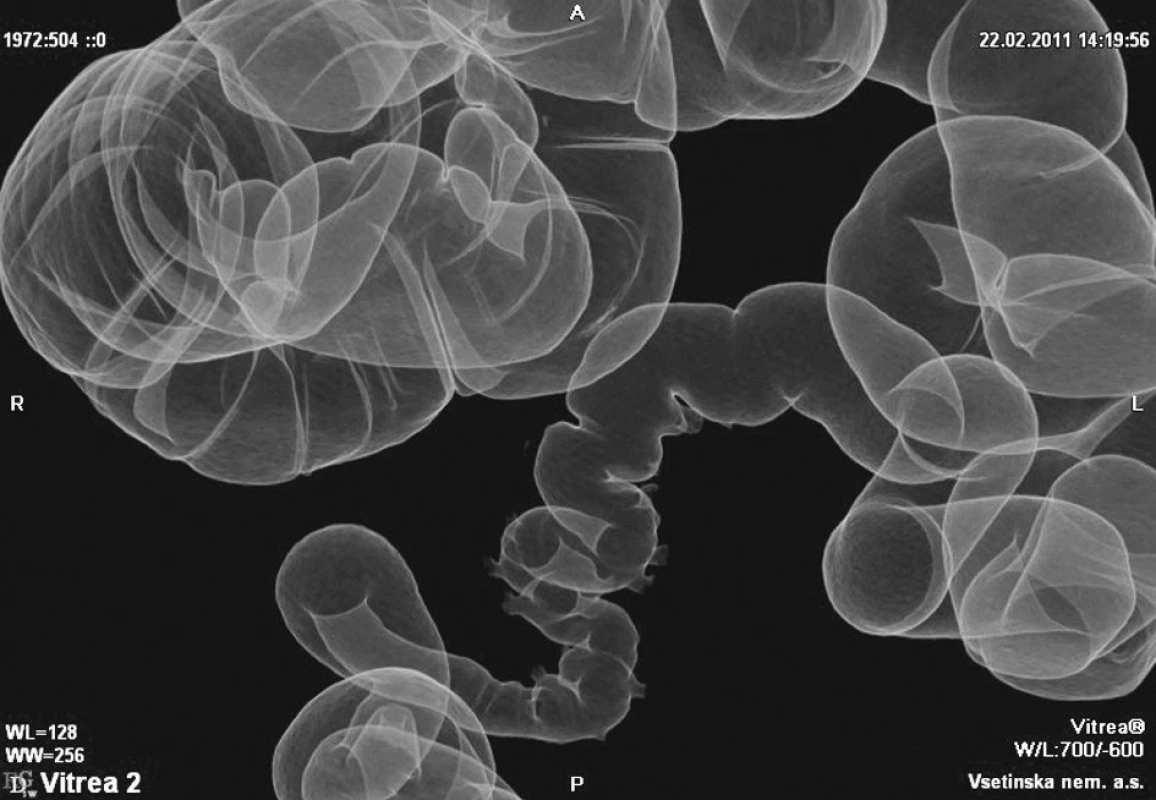
(Obrázky 1–3 poskytl MUDr. Tomáš Husa, oddělení radiodiagnostiky, Vsetínská nemocnice a.s.)
TERAPIE
Dietní opatření, farmakoterapie
U asymptomatické i symptomatické formy DNT jsou základem léčby dietní opatření. Většinou autorů je doporučován dostatek vlákniny. Denní příjem vlákniny by měl být 25–30 g. Skutečný příjem u běžné populace se v západních zemích pohybuje kolem 15 g/den.
Z tohoto důvodu jsou doporučovány otruby jako nevydatnější zdroj balastních látek. Dostatek vlákniny, zvýšený příjem tekutin a pravidelný pohyb by měly mít za následek pravidelnou, měkkou, objemnou stolici. Současně i redukci hmotnosti pacienta.
Četné publikace poukazují na pozitivní vliv prebiotik a probiotik na střevní potíže. Jako probiotika bývají nejčastěji podávány: Bifidobacterium spp, Lactobacillus a kvasnice – Saccharomyces cerevisiae. Tyto mikroorganismy by měly znemožňovat adherenci patogenu, stimulovat sekrece IgA z Payerských plaků a podporovat imunní systém – vyvážení pro - a protizánětlivých cytokinů [49]. Podle pražské studie přidání nepatogenní E. coli k antibiotické terapii a aktivnímu uhlí vedlo ke zlepšení symptomatologie a prodloužení bezpříznakových intervalů [50]. Další studie srovnávala účinnost Lactobacillus casei s mesalazinem versus mesalazin samotný. Skupina léčená i probiotiky vykazovala výraznější zlepšení symptomatologie [51].
Experimentálně byla pacientům podávána imunostimulancia (bakteriální lysáty), které by měly zabránit rekurentním atakám divertikulitidy. Tato enterovakcína by měla stimulovat produkci IgA a zabránit rozmnožení nejčastějším patogenům – patogenní Escherichie coli a Proteu spp. První slibné výsledky jsou popsány. Rekurentní divertikulitida se objevila jen u 4,6 % lysátem léčených pacientů, proti 12,5 % pacientů, kterým lysát nebyl podán [52].
Dalším, v poslední době často zmiňovaným farmakem je mesalazin. Udávají se jeho imunomodulační a protizánětlivé účinky. In vitro studie popisují vychytávání kyslíkových radikálů, supresi syntézy leukotrienů a prostaglandinů, supresi adheze leukocytů. Měl byt tak zmírňovat potíže, upravovat pasáž, bránit rekurentní atace divertikulitidy. Podle italské studie by měl snižovat proliferaci epiteliálních buněk, která je u divertikulózy zvýšená [53].
Obdobné klinické výsledky nabízí léčba novějším preparátem – Balsalazidem (Colazal, u nás není dostupný), který by měl navodit remisi rychleji. Aminosalicyláty bývají kombinovány jak s probiotiky (Lactobacilus casei), tak s antibiotiky, např. s rifaximinem. Samotný mesalazin dle jedné studie zredukoval rekurenci divertikulitidy z 46 % na 15 %. (Studie byla provedena na 166 pacientech). Další studie na 268 pacientech se zabývala zlepšením symptomatologie v závislosti na dávkování, kontinuální podávání u symptomatických pacientů s nekomplikovanou divertikulitidou mělo lepší výsledky než cyklické [54].
Avšak stejně jak u bakteriálních lyzátů, chybí větší randomizované zaslepené studie s kontrolní skupinou léčenou placebem, které by jejich účinnost potvrdily. U některých studií scházelo endoskopické potvrzení divertikulózy. Všechny studie s mesalazinem byly provedeny v Itálii.
Bolesti tlumíme spazmolytiky a nesteroidními analgetiky. Metamizol kombinuje oba tyto účinky. Je vhodné se vyhnout opioidům pro obstipační účinek. Pokud jsou silná analgetika nezbytná, je doporučován pethidin. Rozhodně nepodávat morfin, který může působit hypersegmentaci a spazmy tlustého střeva.
Projímadla jsou často zneužívána, vedou sice k rychlejším výsledkům než úprava životosprávy, mají však jen dočasný účinek. Krátkodobě lze využít účinků osmoticky působících (Glauberova sůl, síran hořečnatý, manitol, laktulóza) a hydrofilních (agar-agar) projímadel. Nevhodná jsou změkčující projímadla a projímadla dráždící střevní stěnu (antrachinony, ricinový olej, difenoly).
Střevní křeče je doma nejlépe tlumit spazmolytickými čaji (heřmánkovým, mátovým, fenyklovým). Spazmolytika jsou ordinována u těžších potíží. Anticholinergik se vyvarujeme pro snížení střevní motility. Stejně tak prokinetika neindikujeme pro možné zhoršení křečí.
Dle výsledků jedné studie by perforaci divertikulitidou postiženého střeva mohly zabránit blokátory kalciových kanálů, které redukují střevní kontraktilitu a tonus [55].
ANTIBIOTICKÁ LÉČBA
U divertikulitidy je většinou autorů doporučováno včasné podání antibiotik. Volíme taková antibiotika, která jsou účinná na gramnegativní a anaerobní bakterie. U mírnějších infekcí, kde si můžeme dovolit perorální terapii, jsou jako empiricky nasazovaná antibiotika doporučována: amoxicilin/klavulanát + metronidazol, ciprofloxacin + metronidazol (účinnost pareneterální a perorální kombinace ciprofloxacin + metronidazol má být obdobná), případně rifaximin. Rifaximin je semisyntetické antibiotikum, které blokuje DNA dependentní RNA polymerázu. Jen omezeně se vstřebává ze zažívacího traktu, po perorálním podání zůstává ve střevě asi 80–90 % podaného množství. Antimikrobiální spektrum má široké – jak grampozitivní tak gramnegativní bakterie, aeroby i anaeroby. Zřídkavá rezistence a malý počet systémových nežádoucích účinků patří mezi jeho další klady. Předpokládá se, že rifaximin také redukuje metabolickou aktivitu střevní mikroflóry, a tak zpomaluje degradaci vlákniny a tvorbu plynů. Latella et al. provedl multicentrickou prospektivní randomizovanou studii na 968 pacientech s DNT zaměřenou na srovnání zlepšení symptomatologie u pacientů léčených rifaximinem a vlákninou, či jen vlákninou. Po roce léčby bylo asymptomatických 56 % pacientů léčených současně i rifaximinem a jen 29 % pacientů léčených pouze vlákninou [56].
U komplikované divertikulitidy se obvykle podává amoxicilin/ klavulanát, gentamicin, metronidazol, piperacillin, tazobaktam. U pacientů s difuzní peritonitidou bývají podávány: acylaminopenicilin s inhibitorem laktamasy, carbapenem, cefalosporin 3. a 4. generace s metronidazolem, fluorochinolon 2. či 3. skupiny s metronidazolem, fluorochinolon 4. skupiny. Není-li léčba do 48 hodin účinná a pokud se nezdařilo určení původce, použije se imipenem s imidazolem, příp. imipenem s cilastatinem a aminoglykosidem. Při dobrém průběhu přecházíme po třech dnech z parenterálních na perorální antibiotika. V jejich aplikaci pokračujeme do celkové doby 7–14 dní. Samotná antibiotická léčba je považována za metodu volby u Hinchy I, podle některých je dostačující u Hinchy II, pokud se jedná o absces menší než 3–4 cm.
Ne všichni autoři však antibiotickou léčbu považují za nezbytnou, prosté omezení perorálního příjmu se ukazuje jako dostačující u mírně probíhající divertikulitidy. Příznivci pouze dietních opatření nepopisují ani častější recidivy. Poukazují na dobře známá negativa antibiotik – rezistenci, změny střevní mikroflóry, finanční náklady a riziko vedlejších účinků. Jiní však navrhují cyklickou antibiotickou léčbu jako prevenci recidiv. Pokud se při antibiotické terapii objeví zelenavé průjmy, febrilie, zvýší se zánětlivé markery, je nutné pomýšlet na kolitidu klostridiové etiologie. To platí zejména při léčbě ampicilinem, klindamycinem, cefalosporiny 3. generace. Léčbou volby je metronidazol.
Po propuštění z nemocniceje vhodný minimálně třítýdenní klidový režim. Po tuto dobu je vhodná bezezbytková dieta. Až po definitivním zklidnění ataky doporučíme otruby. Za 6–8 týdnů od dimise se má provést definitivní diagnostika – koloskopie, doplněná příp. irigografií či CT.
MINIMÁLNĚ INVAZIVNÍ VÝKONY
Punkce a drenáž abscesu
Minimálně invazivní výkony se rozvíjí současně se zdokonalováním zobrazovacích a endoskopických metod. Počátky této terapie se datují do 70. let 20. století. Jedná se o punkci abscesu, kterou je možno provést transkutánně, rektálně či vaginálně, příp. kolonoskopicky. Drenáž abscesu nemocnému uleví, sníží počet bakterií, umožní zjistit patogen, sníží riziko perforace do břišní dutiny a dá tak čas k přípravě pacienta k případné elektivní operaci. Celý výkon je nejčastěji prováděn transkutánně pod sonografickou či CT kontrolou. Hůře proveditelná je punkce abscesu, v jehož těsné blízkosti jsou střevní kličky, pokud je absces již konsolidovaný či je jeho dutina septovaná, pokud se jedná o vícečetné drobné abscesy. U jednodutinového abscesu je však úspěšnost této léčby až 80 %. Průměrná velikost abscesu vhodného k punkci je více než 6 cm. K perkutánní drenáži je vhodné asi 20–30 % abscesů. Podle dalších sdělení až 75 % abscesů [57]. Po punkci je vhodné absces proplachovat min. 2x denně nebo kontinuálně fyziologickým roztokem. Pokles teploty, leukocytózy a CRP je očekáván do 72 hodin. Drén by v ideálním případě měl být ponechán do doby, než dojde ke kolapsu abscesové dutiny a než se uzavře komunikace abscesu se střevem, v průměru asi 14 dní. Monitorování rozsahu abscesu nástřikem kontrastní látky je doporučeno v týdenních intervalech.
Komplikace punkce a drenáže se vyskytují v 5 %. Jedná se o krvácení, perforaci střeva či bránice, poranění jater či sleziny, tvorbu píštělí, celulitidu v okolí vstupu drénu, obstrukce drénu. Drenáž abscesu pro relativně vysokou rekurenci onemocnění (až 30–58 %) není většinou autorů považována za definitivní řešení, ale pouze jako možnost oddálit akutní výkon a provést následně elektivní resekci s primární anastomózou. Většinou po úplném vymizení zánětu, cca za 6–8 týdnů.
Ambrosetti et al. porovnával prognosu mezokolických a pelvických abscesů. Zjistil, že pelvické vykazují agresivnější chování a vyžadují tudíž urychlenou drenáž [58]. Ne všechny studie považují perkutánní drenáž za jedinou možnou léčbu abscesu. Například podle Brandta et al. byly výsledky antibiotické a drenážní léčby srovnatelné. Ale abscesy léčené pouze antibiotiky byly v této studii menších rozměrů než ty drénované [59].
Kolonoskopie
Kolonoskopie je suverénní diagnostickou a terapeutickou metodou při krvácení z dolní části GIT. Kolonoskopie je diagnostickou metodou pro klidovou či krvácející divertikulózu, umožňuje diferenciálně diagnosticky odlišit tumor, záněty a další intraluminální patologie. Kolonoskopie umožňuje alespoň přibližnou lokalizaci krvácení, což podstatně usnadňuje následný operační výkon. Příprava střeva nezesiluje či neaktivuje krvácení. Endoskopie umožňuje taktéž stavění krvácení (bipolární koagulací, laserovou koagulací, opichem epinefrinem, sklerotizací aethoxysklerolem, zalepením fibrinogenem, klipováním).
Další, pouze na některých pracovištích používaná možnost, je endoskopický banding – divertikl je evertován do lumina a následně naložena ligatura [60].
Pokud je pomýšleno na následnou operační léčbu, je vhodné výkon zakončit instilací metylenové modři do stěny střeva – tato tetováž slouží k snadnému nalezení postiženého úseku při následné operaci. U pacientů se stenózující chorobou může být využito endoluminálních kovových stentů k překlenutí akutního stadia. Po prodělané divertikulitidě by měla kolonoskopie následovat za 6 týdnů – k potvrzení diagnózy a vyvrácení jiných příčin potíží, zejména malignit.
Selektivní angiografie
Selektivní angiografie a. mesenterica je indikována, pokud krvácení je větší než 0,5–1 ml/min. Pokud je krvácející místo identifikováno, umožňuje aplikací vazopresinu či embolizací toto krvácení zastavit.
Méně nežádoucích účinků má embolizace segmentární arterie – metylcelulózou, kolagenovou suspenzí, kovovou spirálou. Angiografie má však také nemalé rizika, např. arteriální disekci, okluzi, střevní infarkt.
OPERAČNÍ LÉČBA
Myotomie
Myotomie mají, či spíše měly, za cíl snížit intraluminální tlak v tračníku. Začaly se používat na základě úspěchu Hellerovy myotomie u achalázie jícnu či Ramstedovy myotomie u pylorostenózy. Efekt se dostavoval zejména u spastické formy DNT, využívaly se jako doplněk při resekcích. Jejich výhodou byla neexistence anastomózy, neotevření střevního lumina. Krátký výkon umožňoval operovat i rizikové nemocné. Zprvu se prováděly longitudinální myotomie podle Reillyho (protnutí cirkulární ztluštělé svaloviny až do submukózy mezi taenia libera a taenia omentalis, podle novější modifikace byl řez veden v taenia libera). Snížení bazálního intraluminálního tlaku se ukázalo pouze jako přechodné, snížila se však citlivost na farmakologické a reflexní podněty. Recidiva klinických potíží je přičítána vytvoření jizevnaté tkáně, která střevo opět zúží. Dlouhodobější výsledky měla příčná myotomie podle Hodgsona. V tomto případě se taenia omentalis a taenia libera protínají příčně, střídavě, v odstupu asi 2 cm. Zákrok je rychlejší, dochází k menšímu krvácení, poranění sliznice je méně časté. Taenie se mezi řezy kontrahují, tento stav si uchovávají i během jizvení. Dlouhodobějších výsledků se snaží některá pracoviště dosáhnout kombinací obou metod. Pro zmínky o myotoniích musíme prohledat starší literaturu, současná se o těchto metodách prakticky nezmiňuje.
Operace bez odstranění septického zdroje
Mezi dnes již zřídka aplikované postupy patří sutura perforace, divertikulektomie, omentoplastika, invaginace divertiklu. Představují sice minimální operační zákrok, ale vlastní problém, zdroj infekce, neodstraní.
Drenážní laparoskopický výkon při peritonitidě bývá indikován společně se stomií u komplikovaných pacientů. Resekce střeva pak následuje v druhé době. Již u připraveného, stabilního pacienta. Krátký výkon, nesoucí poměrně malá rizika, bývá i v poslední době často a úspěšně používán [61].
Resekční výkony
Již do historie chirurgie patří troj až čtyřdobý výkon podle Schloffera (1. dvojhlavňová transverzostomie, 2. resekce perforovaného segmentu, 3. anastomóza, 4. uzávěr stomie).
Resekce podle Mikulicze – zde se zánětlivě změněné střevo anteponuje před břišní stěnu, provede se resekce a vytvoří se dvojhlavňová stomie. Ta se v druhé době zanoří.
Resekce podle Hartmanna – při tomto postupu se opět zánětlivě změněné střevo zresekuje, aborální pahýl se ponechá v břišní dutině a slepě uzavře. Proximální konec tračníku se anteponuje před břišní stěnu jako terminální stomie. Doba uzavření stomie je předmětem diskusí. (Časné provedení v období 4–21 dnů po operaci, po stabilizaci celkového stavu pacienta má výhodu v tom, že se rektální pahýl nestačí kontrahovat. Většina autorů se přiklání ke střednímu intervalu 1–3 měsíců, kdy dojde ke zhojení všech operačních ran, po kompletním pooperačním zotavení pacienta. Extrémní interval 3–6 měsíců bývá někdy uplatněn u hodně starých pacientů.)
Resekce podle Hartmanna bývá upřednostněna u nestabilních pacientů, u stadia Hinchy IV a zejména u pacientů s počínajícím abdominálním kompartment syndromem.
Resekce podle Endlera – se podobá Hartmannově postupu až do fáze resekce rektosigmoideálního přechodu. V tomto případě se colon descendens mobilizuje a našije se descendento-rektální anastomóza end-to-side, stomie se vyšije na zdravé části c. descendens.
Resekce s primární anastomózou – se do praxe zavedla až později než výše uvedené metody. Je však stále častěji užívána nejen u elektivních, ale i u akutních výkonů.
Její velkou výhodou je, že není nutná následná operace. Nutnost dvou operací u Hartmanova postupu znamená pro pacienta nárůst rizika. Podle Aydinovy studie mají pacienti podstupující Hartmanovu operaci 2,1x větší pravděpodobnost pooperačních komplikací, než ti s primární anastomózou [62].
Musíme však dodat, že Hartmanova resekce se volí u pacientů s komorbiditami a s vyšším Hinchyho skorem, s vyšším rizikem komplikací. Proximální rozsah resekčního výkonu se určuje podle délky postižení. Vždy by však anastomóza měla být našívána na horní rektum, nikoliv sigma. Pokud se vyšije colosigmoideální anastomóza, zdvojnásobí se rekurence onemocnění. Podle některých autorů by její součástí měla být i laváž nepřipraveného tlustého střeva. Obávanou časnou komplikací je dehiscence anastomózy, na jejímž vzniku se nejčastěji podílí nadměrná skeletizace střeva, sutura pod tahem, přetočení některého z pahýlů, nešetrná manipulace při sutuře, přítomnost divertiklů v sutuře. Pokud je výkon elektivní, střevo pacienta bývá vyprázdněno perorálními roztoky. Valverde et al. poukazuje na výhody předoperační přípravy střeva nálevy, zejména s roztokem iod-povidonu [63]. Podle novějších studií však preoperační příprava kolonoroztoky vede k dehydrataci, hypotonii střeva a pooperační paralýze. Podle studie provedené v Heidelbergu jsou výsledky resekčních operací ovlivněny zejména stadiem nemoci a nutností peroperačního podání krevní transfuze [64]. Dále se na operačních výsledcích podílí věk a komorbidity pacienta. Dlouhodobá kvalita života u pacientů operovaných podle Hartmana a pacientů s primární anastomózou je srovnatelná [65].
Laparoskopie – první zmínky o laparoskopii se objevují v roce 1991. Uplatňuje se ve stále větší míře. Můžeme rozlišit výhradně laparoskopický výkon (střevo se odstraňuje širokým portem, rektem, vaginou), laparoskopicky asistovaný výkon (po skeletizaci se otevře břišní dutina v délce asi 6 cm, střevo se resekuje před břišní stěnou), rukou asistovaný laparoskopický výkon (s řezem asi 12 cm pro jednu ruku). Ve zkušených rukou je to bezpečná metoda i v akutním stadiu onemocnění. (Např. brémští autoři používají laparoskopickou resekci v akutním stadiu u Hinchy I a II, pooperační průběh je zcela srovnatelný s elektivními výkony [66].) První výsledky srovnávající laparoskopickou a otevřenou resekci sigmatu v akutním stadiu choroby vyzvedávají často zmiňované klady laparoskopie – o 15,4 % nižší výskyt závažnějších komplikací (p = 0,038), menší pooperační bolest, dřívější dimise (p = 0,01) [67], snížení výskytu incizionálních hernií z 11–15 % u otevřeně operovaných na 0,2–1 % u pacientů podstoupivších laparoskopii. Úspěšné využití laparoskopie i u kolovezikálních píštělí dokumentuje Bartus et al. [68].
K dispozici jsou už i první, slibné výsledky roboticky provedené resekce sigmatu [69].
TERAPIE JEDNOTLIVÝCH STADIÍ DNT
Pravostranná divertikulitis
Podle studií, prováděných zejména asijskými kolegy, je u tohoto onemocnění plně dostačující konzervativní terapie – dočasné vyloučení perorálního příjmu, antibiotika. Jen zlomek léčených si vyžádá drenážní výkon. Pokud je pacient operován pro podezření na apendicitidu, je mnohými doporučena apendektomie, antibiotická léčba, nikoliv resekce divertiklů či hemikolektomie.
Někteří však obhajují resekční výkon, pokud je již operováno pro podezření na apendicitidu, obzvláště pokud nelze vyloučit neoplazii [70]. Autoři z Kalifornie se domnívají, že pravostranná divertikulitida může mít na Západě větší tendenci k recidivám než v Asii a proto jsou zastánci radikálních výkonů.
Po úspěšné konzervativní terapii se rekurence pravostranné divertikulitidy udává asi ve 4–20 %. Elektivní výkony by měly být nabídnuty pacientům s častými rekurentními atakami, u nichž onemocnění interferuje s běžnými denními aktivitami.
Gigantický divertikl
Divertikulektomie není doporučovaná. Krček divertiklu může být hodně široký a okolní zánět by mohl způsobit rozpad sutury. Tyto divertikly se nejčastěji vyskytují na sigmatu současně s dalšími drobnými divertikly, proto je doporučovaná sigmoidektomie s primární end-to-end anastomózou [71]. Zatím spíše ojediněle, ale prozatím úspěšně se užívá i laparoskopická technika [72]. Však u komplikovaných případů je preferována Hartmanova operace.
Krvácení z divertiklu
Většina (kolem 80 %) případů krvácení z divertiklů ustoupí spontánně. Pacient je pouze sledován za hospitalizace, lačný, hydratován infuzními roztoky. Pokud je krvácení masivní, je zapotřebí buď kolonoskopické (klipování, argonová či termická koagulace, opich adrenalinem) nebo angiografické ošetření, které navazuje během 12–24 hod. na resuscitaci oběhu krystaloidy, koloidy, transfuzemi. Selektivní angiografie a. mesenterica je indikována, pokud krvácení je větší než 0,5–1 ml/min. Pokud je krvácející místo identifikováno, umožňuje aplikací vazopresinu či embolizací toto krvácení zastavit. Má však také nemalá rizika (arteriální disekce, okluze, střevní infarkt). Pokud se jedná o krvácení z více zdrojů, je těmito metodami špatně ošetřitelné. Pak je zvažována chirurgická resekce postižené části střeva.
Zajímavá, ale pouze na jednotlivých případech dokumentovaná, je terapie baryovým nálevem, jak ji popisuje např. Iwamoto. Ten ji úspěšně uplatnil u čtyřech pacientů, u kterých se nedařilo zdroj krvácení identifikovat a zastavit ani kolonoskopicky, ani angiografií. K nálevu použil 200% baryovou kaši o objemu 400 ml s 50 000 jednotkami trombinu [73].
S malými obměnami ve složení nálevu (např. baryum + adrenalin) je úspěch této metody popsán i jinými autory. Panuje domněnka, že baryum přilne ke sliznici, vyplní krvácející divertikl a tím jej zatamponuje. Baryum by mohlo mít i přímý hemostatický účinek.
Akutní divertikulitis
Léčba akutní nekomplikované divertikulitidy spočívá zejména v omezení perorálního příjmu, antibioticích. Většinou se pacienti alespoň v prvních dnech nemoci hospitalizují. Však již existují publikace, poukazující na dostatečnost ambulantní terapie. Například v Barceloně, ale i jinde, pacienty s diagnózou akutní nekomplikované divertikulitidy (podle CT) vybavili antibiotiky a pozvali na kontrolu 4. a 7. den. Pouze 3 % z takto léčených pacientů si vyžádalo pro zhoršení potíží hospitalizaci [74].
Komplikovaná divertikulitida
Pokud dojde k perforaci divertiklu a šíření zánětu, je zapotřebí zaujmout aktivnější postoj k léčbě.
Když se přidržíme klasifikace podle Hinchyho, tak u stadia I vystačíme s konzervativní terapií. Stadium II bývá někdy taktéž léčeno pouze konzervativně, ale spíše se přistupuje k drenážním výkonům, zejména pod CT či ultrazvukem. Zde se řídíme velikostí abscesu a jeho lokalizací. U abscesů do 4 cm by měla být antibiotická léčba dostatečná (v Japonsku sledovali pacienty s abscesem do 2 cm pouze ambulantně) [75].
Pro obavy z rekurence se doporučuje po vyhojení abscesu zvážit elektivní resekční výkon. Pelvická lokalizace abscesu ukazuje na agresivitu onemocnění a vysokou pravděpodobnost nutnosti chirurgické intervence. Relativní konsenzus panuje v operační léčbě stadií III a IV. Z review, provedeného Toorenvlietem, vztahujícímu se k úspěšnosti laparoskopické drenáže u pacientů Hinchy III vyplývá, že prostá drenáž může být pro pacienty velice prospěšná, má nízkou mortalitu, morbiditu a pacienta nezatěžuje kolostomií.
Léčbu je třeba zahájit co nejdříve, zejména ve vyšším věku, kdy pacienti často přichází k ošetření pozdě. Právě včasnost intervence je jeden z nejdůležitějších prognostických faktorů.
Dříve byla v akutním stadiu většinou indikována Hartmanova operace s dočasnou kolostomií.
V poslední době se hodně chirurgů přiklání k jednodobé operaci s primární anastomózou, protože se ukazuje, že tento postup má nižší morbiditu a mortalitu [76]. Postup by měl být stanoven případ od případu, v závislosti na stavu tkání, komorbiditách a peroperační stabilitě pacienta.
Elektivní operace
Indikace k elektivní operativě po úsměšné léčbě akutního stadia zůstávají předmětem diskusí.
Literatura udává rekurenci divertikulitidy u 30–40 % pacientů po prodělané akutní divertikulitidě.
Obyčejně je zvážení resekce doporučováno po 2 atakách nekomplikované divertikulitidy [77], mj. i Evropskou asociací pro endoskopickou chirurgii (doporučení z roku 1999) [78]. Toto doporučení je zpochybňováno těmi, kteří upozorňují, že u 53 % pacientů s komplikovanou divertikulitidou a u 89 % zemřelých, se jednalo o první ataku onemocnění [4].
Po akutní divertikulitidě dojde k rekurenci do 1 roku asi u 7–35 % pacientů. Do 5 let asi u 19 % (u starších) – 54 % (u mladších pacientů) [79]. Třetí ataku zažije asi jedna třetina z těch, kteří již dvakrát překonali akutní divertikulitidu. Argumentem odpůrců elektivních kolektomií je výskyt rekurentní divertikulitidy u operovaných 1–10 % případů a přetrvávání abdominálního dyskomfortu u 25–33 % operovaných (zde je předpokládán současný výskyt syndromu dráždivého tračníku, ale i ten nevysvětluje potíže u všech operovaných).
Nepochybným kladem elektivních výkonů je jejich nízká mortalita (1–4 %). Přesto Salem et al. doporučuje elektivní kolektomii až po čtvrté atace divertikulitidy, nikoliv po druhé. Podle jeho porovnání vedl tento postup ke snížení úmrtnosti o 0,5 %, ke snížení nutných kolostomií o 0,7 % a ke snížení nákladů na léčbu [80].
V roce 2000 Wong prošel data, na nichž je založeno doporučení operovat po dvou atakách nekomplikované divertikulitidy a zjistil, že nejsou příliš aktuální. Prací starších více než 10 let bylo 68, 28 prací více než 20 let. Pouze 15 publikací vyšlo v posledních 10 letech. Dalším nedostatkem je důkazová hladina (level of evidence) 3–4 většiny prací [81].
Na Mayo Clinic porovnávali dvě skupiny pacientů, rozdělených podle počtu atak akutní divertikulitidy před rozvojem komplikované divertikulitidy. Došli k závěru, že pacienti s více než dvěma atakami mají srovnatelnou morbiditu a mortalitu s těmi, kteří prodělali před komplikovanou divertikulitidou pouze 1–2 ataky divertikulitidy [82].
Z výše uvedených důvodů bývá závěrem novějších publikací uvedeno, že rozhodnutí o operaci musí být individuální, založené na průběhu předchozí ataky, klinickém stavu pacienta a jeho přání [83]. Ze sledování pacientů Hinchy II, u kterých bylo postupováno konzervativně, vyplynulo, že 40–50 % nepotřebovalo další chirurgickou léčbu [84]. Přesto u prokázaného a konzervativně léčeného abscesu se majorita autorů přiklání k elektivní operaci. Většina autorů se rovněž shodne na indikaci k elektivní operaci u pacientů s komorbiditami jako je diabetes mellitus, imunosuprese [83]. U těchto pacientů by měla být doporučena resekce po jedné atace. Dalším předmětem diskusí je onemocnění u pacientů mladších 50 let. Jedněmi autory byl doporučován aktivnější, invazivnější přístup, protože věří, že choroba je u těchto pacientů agresivnější [85]. Ve Finsku se ve své studii zaměřili na porovnání průběhu DNT u mladých (pod 50 let) a starších pacientů. Dospěli k názoru, že tito pacienti si vyžádali více hospitalizací. Průběh choroby však nebyl agresivnější než u starších pacientů (procentuální zastoupení komplikované divertikulitidy a úmrtí byla v mladší skupině menší).
Převládá názor, že riziko u těchto pacientů je pouze kumulativní, dáno delší očekávanou dobou života. Mnozí se nyní spíše přiklánění ke konzervativnímu postupu u této věkové skupiny.
Mnoho studií se zabývá pouze „tvrdými“ fakty jako je mortalita, morbidita při porovnávání konzervativního a operačního postupu. Mueller et al., Forgione et al. a jiní upozorňují na to, že chirurgická intervence může mít pozitivní vliv na dlouhodobou kvalitu života pacientů [86]. Tato tvrzení však další publikace neguje. Scarpa et al. porovnával kvalitu života u operovaných a neoperovaných pacientů s nekomplikovanou divertikulitidou. Výsledky obou skupin byly podobné, proto je dle jejich názoru vhodné operovat pouze komplikovanou divertikulitidu [87].
Americká chirurgická společnost – The American Society of Colon and Rectal Surgeons (ASCRS) – doporučuje indikovat elektivní sigmoidektomii u pacientů po prodělané akutní divertikulitidě čistě na individuální bázi [88]. Americká gastroenterologická společnost – The American College of Gastroenterology Practice Parameters Committee – se k elektivním výkonům taktéž nestaví zády, ale zvážení elektivní resekce doporučuje až při opakovaných atakách divertikulitidy, u komplikované divertikulitidy a dále u imunokompromitovaných pacientů [89]. Společnost pro chirurgii zažívacího traktu – Society for Surgery of the Alimentary Tract – doporučovala dříve elektivní operaci po dvou atakách akutní divertikulitidy, po jedné atace vyžadující hospitalizaci u pacienta mladšího 40 let, po jedné atace s průkazem perforace, obstrukce či zasažení močového traktu a pokud nebylo jinak možné vyloučit karcinom tlustého střeva. Podle posledních dat však již elektivní operaci nepodmiňuje počtem prodělaných akutních divertikulitid či věkem.
Další diskusním tématem u elektivních operací je vhodné načasování. Siewert et al. doporučuje časnou elektivní operaci po přípravě antibiotiky, podobně jako u akutní cholecystitidy. Upozorňuje na snazší preparaci, protože pozánětlivé srůsty ještě nejsou tak pevně a četně vytvořeny jako u pozdní elektivní operace [90]. Natarajan et al. rozdělil retrospektivně pacienty do tří skupin, podle doby uplynuvší od začátku potíží do operace. První skupina byla operovaná během prvních 30 dnů, druhá mezi 30. a 60. dnem a třetí s delším časovým odstupem. Operační výsledky byly téměř totožné [91]. Podle retrospektivní německé studie, lepší operační výsledky měla elektivní operace v odstupu 4–6 týdnů ve srovnání s operovanými za 4–8 dnů od přijetí pro akutní potíže. V časně operované skupině byla o 11,7 % vyšší incidence infektu v ráně a o 6,9 % vyšší výskyt závažných komplikací, jako je např. insuficience anastomózy [92].
ZÁVĚR
Přes četné studie, zkoumající DNT, představuje tato choroba stále jistou výzvu pro svou pestrost, různorodost. Ať již z pohledu patogeneze, symptomatologie či terapie. Možných důvodů jejího vzniku je celá řada (od molekulárních změn ve stěně střevní, přes abnormální neurohormonální signalizaci, po bakteriální, zánětlivou, dietní či genetickou příčinu). Klinické projevy mohou být silně variabilní, od bezpříznakových pacientů po těžké stavy s peritonitidou, končící v některých případech smrtí pacienta. Stesky pacienta ovlivňují naši terapii, od pouhého doporučení změny stravovacích návyků, přes spíše experimentálně podávaná probiotika a aminosalicyláty, po antibiotickou terapii. U komplikovaných forem pak již nastupuje invazivní terapie. Zde je náš arzenál také bohatý – punkce pod CT, koloskopie, laparoskopické drenážní výkony, resekční výkony. Pacienti s recidivujícími atakami divertikulitid mohou být indikováni k elektivní operaci, nejčastěji sigmoidektomii. Poslední doporučení kladou velký důraz na individuální přístup, zvážení předchozího průběhu DNT a přání pacienta.
Poznámka redakce:
Vzhledem k tomu, že se jedná o přehledný článek o komplexní problematice bylo recenzenty povoleno použít větší počet citací, které jsou jinak v originálních pracech limitovány počtem 20.
MUDr. Zuzana Adamová
Ševcova 12
613 00 Brno
e-mail: adamovaz@gmail.com
Zdroje
1. Strate, L. L., Liu, Y. L., Syngal, S., Aldoori, W. H., Giovannucci, E. L. Nut, corn, and popcorn consumption and the incidence of diverticular disease. JAMA, 2008 Aug 27; 300 (8): 907–914.
2. Touzios, J. G., Dozois, E. J. Diverticulosis and acute diverticulitis. Gastroenterol. Clin. North Am., 2009 Sep; 38 (3): 513–525.
3. Etzioni, D. A., Cannom, R. R., Ault, G. T., Beart, R. W. Jr, Kaiser, A. M. Diverticulitis in California from 1995 to 2006: increased rates of treatment for younger patients. Am. Surg., 2009 Oct; 75 (10): 981–985.
4. Chapman, M. D, Davies M., Wolff B., et al. Complicated Diverticulitis Is It Time to Rethink the Rules? Ann. Surg., 2005 October; 242 (4): 576–583.
5. Hjern, F., Johansson, C., Mellgren, A., Baxter, N. N., Hjern, A. Diverticular disease and migration – the influence of acculturation to a Western lifestyle on diverticular disease. Aliment Pharmacol. Ther., 2006 Mar 15; 23 (6): 797–805.
6. Kiguli-Malwadde, E., Kasozi, H. Diverticular disease of the colon in Kampala, Uganda. Afr. Health Sci., 2002 Apr; 2 (1): 29–32.
7. Painter, N. S., Burkitt, D. P. Diverticular disease of the colon: a deficiency disease of Western civilization. Br. Med. J., 1971 May 22; 2 (5759): 450–454.
8. Gear, J. S., Ware, A., Fursdon, P., Mann, J. I., Nolan, D. J., Brodribb, A. J., Vessey, M. P. Symptomless diverticular disease and intake of dietary fibre. Lancet, 1979 Mar 10; 1 (8115): 511–514.
9. Fisher, N., Berry, C. S., Fearn, T., Gregory, J. A., Hardy, J. Cereal dietary fiber consumption and diverticular disease: a lifespan study in rats. Am. J. Clin. Nutr., 1985 Nov; 42 (5): 788–804.
10. Wess, L., Eastwood, M. A., Edwards, C. A., Busuttil, A., Miller, A. Collagen alteration in an animal model of colonic diverticulosis. Gut, 1996 May; 38 (5): 701–706.
11. Wess, L., Eastwood, M., Busuttil, A., Edwards, C., Miller, A. An association between maternal diet and colonic diverticulosis in an animal model. Gut, 1996 Sep; 39 (3): 423–427.
12. Commane, D. M., Arasaradnam, R. P., Mills, S., Mathers, J. C., Bradburn, M. Diet, ageing and genetic factors in the pathogenesis of diverticular disease. World J. Gastroenterol., 2009 May 28; 15 (20): 2479–2488.
13. Papagrigoriadis, S., Macey, L., Bourantas, N., Rennie, J. A. Smoking may be associated with complications in diverticular disease. Br. J. Surg., 1999 Jul; 86 (7): 923–926.
14. Aldoori, W. H., Giovannucci, E. L., Rimm, E. B., Wing, A. L., Trichopoulos, D. V., Willett, W. C. A prospective study of alcohol, smoking, caffeine, and the risk of symptomatic diverticular disease in men. Ann. Epidemiol., 1995 May; 5 (3): 221–228.
15. Wald, A., Back, C., Bayless, T. M. Effect of caffeine on the human small intestine. Gastroenterology, 1976 Nov; 71 (5): 738–742.
16. Mpofu, S., Mpofu, C. M., Hutchinson, D., Maier, A. E., Dodd, S. R., Moots, R. J. Steroids, non-steroidal anti-inflammatory drugs, and sigmoid diverticular abscess perforation in rheumatic conditions. Ann. Rheum. Dis., 2004 May; 63(5): 588–590.
17. Heaton, K. W., Thompson, W. G. Exercise and diverticular disease. BMJ, 1995 May 20; 310 (6990): 1332.
18. Simpson, J., Scholefield, J. H., Spiller, R. C. Pathogenesis of colonic diverticula. Br. J. Surg., 2002 May; 89 (5): 546–554.
19. Commane, D. M., Arasaradnam, R. P., Mills, S., Mathers, J. C., Bradburn, M. Diet, ageing and genetic factors in the pathogenesis of diverticular disease. World J. Gastroenterol., 2009 May 28; 15 (20): 2479–2488.
20. Stefánsson, T., Ekbom, A., SparŹn, P., PĆhlman, L. Increased risk of left sided colon cancer in patients with diverticular disease. Gut, 1993 Apr; 34 (4): 499–502.
21. Morini, S., de Angelis, P., Manurita, L., Colavolpe, V. Association of colonic diverticula with adenomas and carcinomas. A colonoscopic experience. Dis. Colon Rectum, 1988 Oct; 31 (10): 793–796.
22. Soran, A., Harlak, A., Wilson, J. W., Nesbitt, L., Lembersky, B. C., Wienad, H. S., O’Connell, M. J. Diverticular disease in patients with coloncancer:subgroup analysis of national surgical adjuvant breast and bowel project protocol C-06. Clin. Colorectal Cancer, 2006 Jul; 6 (2): 140–145.
23. Kazil, P., Kazilová, M. Divertikulární nemoc tračníku. Grada, 2007.
24. Parra-Blanco, A. Colonic diverticular disease: pathophysiology and clinical picture. Digestion, 2006; 73 Suppl 1 : 47-57. Epub 2006 Feb 8.
25. Hobson, K. G., Roberts, P. L. Etiology and pathophysiology of diverticular disease. Clin. Colon Rectal Surg., 2004 Aug; 17 (3): 147–153.
26. Bode, M. K., Karttunen, T. J., Makela, J., Risteli, L., Risteli, J. Type I and III collagens in human colon cancer and diverticulosis. Scand. J. Gastroenterol., 2000; 35 : 747–752.
27. Stumpf, M., Krones, C. J., Klinge, U., Rosch, R., Junge, K., Schumpelick, V. Collagen in colon disease. Hernia, 2006 Dec; 10 (6): 498–501.
28. Bassotti, G., Battaglia, E., De Roberto, G., Morelli, A., Tonini, M., Villanacci, V. Alterations in colonic motility and relationship to pain in colonic diverticulosis. Clin. Gastroenterol. Hepatol., 2005 Mar; 3 (3): 248–253.
29. Manousos, O. N., Truelove, S. C., Lumsden, K. Transit times of food in patients with diverticulosis or irritable colon syndrome and normal subjects. Br. Med. J., 1967 Sep 23; 3 (5568): 760–762.
30. Shafik, A., Ahmed, I., Shafik, A. A., El Sinaj, O. Diverticular disease: electrophysiologic study and a new concept of pathogenesis. World J. Surg., 2004 Apr; 28 (4): 411–415. Epub 2004 Mar 4.
31. Huizinga, J. D., Waterfall, W. E., Stern, H. S. Abnormal response to cholinergic stimulation in the circular muscle layer of the human colon in diverticular disease. Scand. J. Gastroenterol., 1999 Jul; 34 (7): 683–688.
32. Tomita, R., Fujisaki, S., Tanjoh, K., Fukuzawa, M. Role of nitric oxide in the left-sided colon of patients with diverticular disease. Hepatogastroenterology, 2000 May-Jun; 47 (33): 692–696.
33. Bassotti, G., Battaglia, E., Bellone, G., Dughera, L., Fisogni, S., Zambelli, C., Morelli, A., Mioli, P., Emanuelli, G., Villanacci, V. Interstitial cells of Cajal, enteric nerves, and glial cells in colonic diverticular disease. J. Clin. Pathol., 2005 Sep; 58 (9): 973–977.
34. Guagnini, F., Valenti, M., Mukenge, S., Matias, I., Bianchetti, A., Di Palo, S., Ferla, G., Di Marzo, V., Croci, T. Neural contractions in colonic strips from patients with diverticular disease: role of endocannabinoids and substance P. Gut, 2006 Jul; 55 (7): 946–953. Epub 2006 Jan 19.
35. Burcher, E., Shang, F., Warner, F. J., Du, Q., Lubowski, D. Z., King, D. W., Liu, L. Tachykinin NK2 receptor and functional mechanisms in human colon: changes with indomethacin and in diverticular disease and ulcerative colitis. J. Pharmacol. Exp. Ther., 2008 Jan; 324 (1): 170–178. Epub 2007 Oct 24.
36. Banerjee, S., Akbar, N., Moorhead, J., Rennie, J. A., Leather, A. J., Cooper, D., Papagrigoriadis, S. Increased presence of serotonin-producing cells in colons with diverticular disease may indicate involvement in the pathophysiology of the condition. Int. J. Colorectal. Dis., 2007 Jun; 22 (6): 643–649. Epub 2006 Nov 4.
37. Mimura, T., Bateman, A. C., Lee, R. L., Johnson, P. A., McDonald, P. J., Talbot, I. C., Kamm, M. A., MacDonald, T. T., Pender, S. L. Up-regulation of collagen and tissue inhibitors of matrix metalloproteinase in colonic diverticular disease. Dis. Colon Rectum, 2004 Mar; 47 (3): 371–378; discussion 378–379.
38. Stumpf, M., Cao, W., Klinge, U., Klosterhalfen, B., Kasperk, R., Schumpelick, V. Increased distribution of collagen type III and reduced expression of matrix metalloproteinase 1 in patients with diverticular disease. Int. J. Colorectal Dis., 2001 Sep; 16 (5): 271–275.
39. Rosemar, A., Ivarsson, M. L., Börjesson, L., Holmdahl, L. Increased concentration of tissue-degrading matrix metalloproteinases and their inhibitor in complicated diverticular disease. Scand. J. Gastroenterol., 2007 Feb; 42 (2): 215–220.
40. Kealy, W. F. Lymphoid tissue and lymphoid-glandular complexes of the colon: relation to diverticulosis. J. Clin. Pathol., 1976 Mar; 29 (3): 245–249.
41. Altaf, N., Geary, S., Ahmed, I. Giant colonic diverticulum. J. R. Soc. Med., 2005 Apr; 98(4): 169–170.
42. Freeman, H. J. Segmental colitis associated with diverticulosis syndrome. World J. Gastroenterol., 2008 Nov 14; 14 (42): 6442–6443.
43. Jansen, A., Harenberg, S., Grenda, U., Elsing, C. Risk factors for colonic diverticular bleeding: a Westernized community based hospital study. World J. Gastroenterol., 2009 Jan 28; 15 (4): 457–461.
44. Brouard, M. C., Chavaz, P., Borradori, L. Acute pustulosis of the legs in diverticulitis with sigmoid stenosis: an overlap between bowel-associated dermatosis-arthritis syndrome and pustular pyoderma gangrenosum. J. Eur. Acad. Dermatos. Venereol., 2004 Jan; 18(1): 89–92.
45. Pfeifer, J. Diverticulitis. Acta Chir. Iugosl., 2008; 55(3): 97–102.
46. Almeida, A. T., Melčo, L., Viamonte, B., Cunha, R., Pereira, J. M. Epiploic appendagitis: an entity frequently unknown to clinicians – diagnostic imaging, pitfalls, and look-alikes. AJR Am. J. Roentgenol., 2009 Nov; 193(5): 1243–1251.
47. Poletti, P. A., Platon, A., Rutschmann, O., Kinkel, K., Nyikus, V., Ghiorghiu, S., Morel, P., Terrier, F., Becker, C. D. Acute left colonic diverticulitis: can CT findings be used to predict recurrence? AJR Am. J. Roentgenol., 2004 May; 182 (5): 1159–1165.
48. Tursi, A., Brandimarte, G., Elišek, W., Giorgetti, G. M., Inchingolo, C. D., Aiello, F. Faecal calprotectin in colonic diverticular disease: a case-control study. Int. J. Colorectal Dis., 2009 Jan; 24 (1): 49–55. Epub 2008 Oct 22.
49. Gionchetti, P., Amadini, C., Rizzello, F., Venturi, A., Palmonari, V., Morselli, C., Romagnoli, R., Campieri, M. Probiotics – role in inflammatory bowel disease. Dig. Liver Dis., 2002 Sep; 34 Suppl 2: S58–62.
50. Fric, P., Zavoral, M. The effect of non-pathogenic Escherichia coli in symptomatic uncomplicated diverticular disease of the colon. Eur. J. Gastroenterol. Hepatol., 2003 Mar; 15(3): 313–315.
51. Tursi, A., Brandimarte, G., Giorgetti, G. M., Elisei, W. Mesalazine and/or Lactobacillus casei in maintaining long-term remission of symptomatic uncomplicated diverticular disease of the colon. Hepatogastroenterology, 2008 May-Jun; 55 (84): 916–920.
52. Dughera, L., Serra, A. M., Battaglia, E., Tibaudi, D., Navino, M., Emanuelli, G. Acute recurrent diverticulitis is prevented by oral administration of a polybacterial lysate suspension. Minerva Gastroenterol. Dietol., 2004 Jun; 50 (2): 149–153.
53. Tursi, A., Brandimarte, G., Elisei, W., Giorgetti, G. M., Inchingolo, C. D., Aiello, F. Effect of mesalazine on epithelial cell proliferation in colonic diverticular disease. Dig. Liver Dis., 2008 Sep; 40 (9): 737–742. Epub 2008 Apr 2.
54. Comparato, G., Fanigliulo, L., Cavallaro, L. G. Prevention of complications and symptomatic recurrences in diverticular disease with mesalazine: a 12-month follow-up. Dig. Dis. Sci., 2007 Nov; 52 (11): 2934–2941. Epub 2007 Apr 5.
55. Morris, C. R., Harvey, I. M., Stebbings, W. S. Do calcium channel blockers and antimuscarinics protect against perforated colonic diverticular disease? A case control study. Gut, 2003 Dec; 52(12): 1734–1737.
56. Latella, G., Pimpo, M. T., Sottili, S., Zippi, M., Viscido, A., Chiaramonte, M., Frieri, G. Rifaximin improves symptoms of acquired uncomplicated diverticular disease of the colon. Int. J. Colorectal Dis., 2003 Jan; 18 (1): 55–62. Epub 2002 May 9.
57. Stanule, B. E., Puccio, E., van Sonnenberg, E., Neff, C. C. Discussion. Preoperative percutaneous drainage of diverticular abscesses. Am. J. Surg., 1990 Jan; 159 (1): 99–104.
58. Ambrosetti, P., Chautems, R., Soravia, C., Peiris-Waser, N., Terrier, F. Long-term outcomeof mesocolic and pelvic diverticular abscesses of the left colon: a prospective study of 73 cases. Dis. Colon Rectum, 2005; 48 : 787–791.
59. Brandt, D., Gervaz, P., Durmishi, Y., Platon, A., Morel, P., Poletti, P. A. Percutaneous CT scan-guided drainage vs. antibiotherapy alone for Hinchey II diverticulitis: a case-control study. Dis. Colon Rectum, 2006; 49 : 1533–1538.
60. Farrell, J. J., Graeme-Cook, F., Kelsey, P. B. Treatment of bleeding colonic diverticula by endoscopic band ligation: an in-vivo and ex-vivo pilot study. Endoscopy, 2003 Oct; 35 (10): 823–829.
61. Alamili, M., Gögenur, I., Rosenberg, J. Acute complicated diverticulitis managed by laparoscopic lavage. Dis. Colon Rectum, 2009 Jul; 52 (7): 1345–1349.
62. Aydin, H. N., Remzi, F. H., Tekkis, P. P. Hartmann‘s reversal is associated with high postoperative adverse events. Dis. Colon Rectum, 2005, Nov; 48(11): 2117–2126.
63. Valverde, A., Msika, S., Kianmanesh, R. Povidone-iodine vs sodium hypochlorite enema for mechanical preparation before elective open colonic or rectal resection with primary anastomosis: a multicenter randomized controlled trial. Arch. Surg., 2006 Dec; 141 (12): 1168–1174.
64. Antolovic, D., Reissfelder, C., Koch, M. Surgical treatment of sigmoid diverticulitis – analysis of predictive risk factors for postoperative infections, surgical complications, and mortality. Int. J. Colorectal Dis., 2009 May; 24 (5): 577–584.
65. Constantinides, V. A., Aydin, H. N., Tekkis, P. P. Long-term, health-related, quality of life comparison in patients undergoing single stage vs staged resection for complicated diverticular disease. Colorectal Dis., 2006 Oct; 8 (8): 663–671.
66. Böttger, T. C., Müller, M., Terzic, A. Laparoscopic resection with primary anastomosis in Hinchey stages I and II without previous abscess drainage. Chirurg, 2007 May; 78 (5): 454, 456–460.
67. Guller, U., Jain, N., Hervey, S. Laparoscopic vs open colectomy: outcomes comparison based on large nationwide databases. Arch. Surg., 2003 Nov; 138(11): 1179–1186.
68. Bartus, C. M., Lipof, T., Sarwar, C. M., et al. Colovesical fistula: not a contraindication to elective laparoscopic colectomy. Dis. Colon Rectum, 2005 Feb; 48 (2): 233–236.
69. Weber, P. A., Merola, S., Wasielewski, A., et al. Telerobotic-assisted laparoscopic right and sigmoid colectomies for benign disease. Dis. Colon Rectum, 2002; 45 : 1689.
70. Fang, J. F., Chen, R. J., Lin, B. C., et al. Aggressive resection is indicated for cecal diverticulitis. Am. J. Surg., 2003 Feb; 185 (2): 135–140.
71. de Oliveira, N. C., Welch, J. P. Giant diverticula of the colon: a clinical assessment. Am. J. Gastroenterol., 1997 Jul; 92(7): 1092–1096.
72. Collin, J. E., Atwal, G. S., Dunn, W. K., et al. Laparoscopic-assisted resection of a giant colonic diverticulum: a case report. J. Med. Case Reports, 2009 May 28; 3 : 7075.
73. Iwamoto, J., Mizokami, Y., Shimokobe, K., et al. Therapeutic barium enema for bleeding colonic diverticula: four case series and review of the literature. World J. Gastroenterol., 2008 Nov 7; 14 (41): 6413–6417.
74. Alfonso, S., Pera, M., Parés, D., et al. Outpatient treatment of patients with uncomplicated acute diverticulitis. Colorectal Dis., 2009 Nov 10.
75. Mizuki, A., Nagata, H., Tatemichi, M., et al. The out-patient management of patients with acute mild-to-moderate colonic diverticulitis. Aliment Pharmacol. Ther., 2005 Apr 1; 21 (7): 889–897.
76. Constantinides, V. A., Tekkis, P. P., Athanasiou, T., et al. Primary resection with anastomosis vs. Hartmann’s procedure in nonelective surgery for acute colonic diverticulitis: a systematic review. Dis. Colon Rectum, 2006; 49 : 966.
77. Germer, C. T., Buhr, H. J. Sigmoid diverticulitis. Surgical indications and timing. Chirurg, 2002 Jul; 73 (7): 681–689.
78. Köhler, L., Sauerland, S., Neugebauer, E. Diagnosis and treatment of diverticular disease: results of a consensus development conference. The Scientific Committee of the European Association for Endoscopic Surgery. Surg. Endosc., 1999 Apr; 13 (4): 430–436.
79. Chautems, R. C., Ambrosetti, P., Ludwig, A., et al. Long-term follow-up after first acute episode of sigmoid diverticulitis: is surgery mandatory?: a prospective study of 118 patients. Dis. Colon Rectum, 2002 Jul; 45 (7): 962–966.
80. Salem, L., Veenstra, D. L., et al. The timing of elective colectomy in diverticulitis: a decision analysis. J. Am. Coll. Surg., 2004; 199 : 904–912.
81. Wong, W. D., Wexner, S. D., et al. Practice parameters for the treatment of sigmoid diverticulitis – supporting documentation. Dis. Colon Rectum, 2000; 43 : 289–297.
82. Chapman, J. R., Dozois, E. J., Wolff, B. G., et al. Diverticulitis: a progressive disease? Do multiple recurrences predict less favorable outcomes? Ann. Surg., 2006 Jun; 243 (6): 876–830; discussion 880–883.
83. Ooi, K., Wong, S. W. Management of ymptomatic colonic diverticular disease. Med. J. Aust., 2009 Jan 5; 190 (1): 37–40.
84. Ambrosetti, P., Chautems, R., Soravia, C., Peiris-Waser, N., Terrier, F. Long-term outcome of mesocolic and pelvic diverticular abscesses of the left colon: a prospective study of 73 cases. Dis. Colon Rectum, 2005; 48 : 787–791.
85. Ambrosetti, P., Morel, P. Acute left-sided colonic diverticulitis: diagnosis and surgical indications after successful conservative therapy of first time acute diverticulitis. Zentralbl. Chir., 1998; 123 (12): 1382–1385.
86. Forgione, A., Leroy, J., Cahill, R. A., et al. Prospective evaluation of functional outcome after laparoscopic sigmoid colectomy. Ann. Surg., 2009 Feb; 249 (2): 218–224.
87. Scarpa, M., Pagano, D., Ruffolo, C., et al. Health-related quality of life after colonic resection for diverticular disease: long-term results. J. Gastrointest. Surg., 2009 Jan; 13 (1): 105–112. Epub 2008 Aug 27.
88. Rafferty, J., Shellito, P., Hyman, N. H., et al. Practice parameters for sigmoid diverticulitis. Dis. Colon Rectum, 2006 Jul; 49 (7): 939–944.
89. Stollman, N., Raskin, L. Diagnosis and management of diverticular disease of the colon in adults. Ad Hoc Practice Parameters Committee of the American College of Gastroenterology. Am. J. Gastroenterol., 1999; 94 : 3110–3121
90. Siewert, J. R., Huber, F. T., Brune, I. B. Early elective surgery of acute diverticulitis of the colon. Chirurg, 1995 Dec; 66 (12): 1182–1189.
91. Natarajan, S., Ewings, E. L., Vega, R. J. Laparoscopic sigmoid colectomy after acute diverticulitis: when to operate? Surgery, 2004 Oct; 136 (4): 725–730.
92. Ritz, J. P., Reissfelder, C., Holmer, C., et al. Results of sigma resection in acute complicated diverticulitis : method and time of surgical intervention. Chirurg, 2008 Aug; 79 (8): 753–758.
Štítky
Chirurgia všeobecná Ortopédia Urgentná medicína
Článok vyšiel v časopiseRozhledy v chirurgii
Najčítanejšie tento týždeň
2011 Číslo 8- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- 15. výročí ustanovení Traumatologického centra ve Fakultní nemocnici Královské Vinohrady
- Neoadjuvantní chemoterapie a chirurgická léčba u pokročilých stadií nemalobuněčného karcinomu plic
- SILS cholecystektómia – analýza súboru prvých 100 pacientov
- Nenádorové stenózy žlučových cest
- Transanální endoskopická mikrochirurgie a její postavení v chirurgii rekta – review
- 1000 laparoskopických operací na kolorektu
- Divertikulární nemoc tračníku
- Biochemický průkaz přítomnosti moči v drénu po chirurgickém výkonu
- Pilonidálny sinus – klasická plastika podľa Limberga alebo modifikovaná verzia?
- Význam a nadčasovosť osobnosti Prof. MUDr. Pavla ŠTEINERA, DrSc. (*28. 3. 1908 +4. 6. 1969)
- Diskusní příspěvek
- Zápis z jednání schůze výboru ČCHS dne 7. 6. 2011
- Rozhledy v chirurgii
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Pilonidálny sinus – klasická plastika podľa Limberga alebo modifikovaná verzia?
- Divertikulární nemoc tračníku
- Nenádorové stenózy žlučových cest
- Biochemický průkaz přítomnosti moči v drénu po chirurgickém výkonu
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



