-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Současné technické možnosti zvýšení peroperační bezpečnosti při mikrochirurgii mozkových aneuryzmat – souhrnný referát
The current technical possibilities of the peroperative safety advancement in the microsurgery of cerebral aneurysms – a review article
The authors present the technical aspects of perioperative safety during the microsurgery of cerebral aneurysms. We evaluated the advantages and disadvantages of the microvascular Doppler ultrasonography, the intraoperative digital subtraction angiography, the intraoperative transit time flowmetry, the intraoperative monitoring - motor evoked potentials and somatosensory evoked potentials, and the ICG videoangiography. The authors, based on their own experience, recommend combining different methods to eliminate the weak points of the individual specific methods. Combining the ICG with the flowmetry and the motor evoked potentials enhances safety during the surgery of cerebral aneurysms with the resultant reduction of the perioperative morbidity/mortality.
Key words:
cerebral aneurysm – ICG videoangiography – intraoperative DSA – motor evoked potentials MEP – mirovascular Doppler ultrasonography MDU – intraoperative flowmetry TTFM
Autori: V. Přibáň 1; I. Holečková 1; J. Mraček 1; D. Štěpánek 1; J. Fiedler 2
Pôsobisko autorov: Neurochirurgické oddělení, Lékařská fakulta v Plzni, Univerzita Karlova v Praze a Fakultní nemocnice Plzeň, primář: MUDr. V. Přibáň, Ph. D. 1; Neurochirurgické oddělení, Nemocnice České Budějovice a. s, primář MUDr. V. Chlouba 2
Vyšlo v časopise: Rozhl. Chir., 2013, roč. 92, č. 9, s. 481-487.
Kategória: Souhrnné sdělení
Súhrn
Autoři prezentují technické možnosti peroperační bezpečnosti při mikrochirurgii mozkových aneuryzmat. Hodnotí přednosti a nevýhody mikrovaskulární dopplerovské ultrasonografie, intraoperační digitální subtrakční angiografie, intraoperační flowmetrie, intraoperačního monitoringu – motorických evokovaných potenciálů a somatosenzorických evokovaných potenciálů – a ICG videoangiografie. Doporučují na základě vlastní zkušenosti kombinaci metod, tak aby byly eliminovány jejich jednotlivé nevýhody. Kombinace ICG s flowmetrií a motorickými evokovanými potenciály zvyšuje bezpečnost operativy mozkových aneuryzmat se snížením perioperační morbidity/mortality.
Klíčová slova:
mozková aneuryzmata – ICG videoangiografie – motorické evokované potenciály MEP – mikrovaskulární dopplerovská ultrasonografie MDU – intraoperační flowmetrie TTFMÚvod
Chirurgie mozkových aneuryzmat patří v neurochirurgii k nejobtížnějším oblastem. V současné době se jedná o problematiku multidisciplinární, na které se podílejí neurochirurgové a intervenční radiologové. Podmínky pro lepší operační výsledky přinesla diagnostika, kde v současnosti dominuje CT angiografie a 3D angiografie. Tyto metody zobrazí detailně velikost a tvar vaku. Proti konvenční angiografii navíc určí směřování aneuryzmatu a detailně zobrazí sekundární váčky a perforující tepénky. Detailní předoperační studium nálezu pomáhá zvolit nejvhodnější terapeutickou modalitu, což je obvykle kliping nebo koiling, a zároveň snižuje vlastní operační riziko. Při otevřené operaci je v současnosti samozřejmostí využití mikroskopu a mikrochirurgické techniky [1]. Otevřená operační léčba je, díky mikroskopu, který umožní adekvátní zvětšení a nasvícení operačního pole, bezpečnější než v minulosti. Principem výkonu je kompletní vyřazení vaku z cirkulace při zachování průtoku v magistrálních a perforujících tepnách. Nicméně možnost komplikací ani při aplikaci mikrochirurgických principů vyloučit nelze. Rizika operace spočívají zejména v neúplném uzavření vaku s možností recidivy krvácení, v okluzi magistrální tepny klipem a v iatrogenním uzávěru nebo poranění perforujících tepének. Recidivující krvácení z aneuryzmatu může být smrtící komplikací. Okluze magistrální tepny může způsobit rozsáhlou ischemii v jejím povodí s těžkým následným neurologickým deficitem. Okluze perforátorů může postihnout hluboké struktury mozku (vnitřní kapsulu nebo corona radiata) s následnou kontralaterální hemiparézou. Z těchto důvodů je klíčové využití metod, které dokážou identifikovat potenciální technickou chybu během operace a umožnit její napravení. Pravidlo time is brain platí při operativě mozkových aneuryzmat absolutně. Čas na nápravu chyby se počítá v minutách. Při kontrole bezpečného operování mozkových aneuryzmat se v současnosti využívají zobrazovací metody, jako je intraoperační angiografie, ICG videoangiografie a mikrovaskulární dopplerovská sonografie. Dále se používá intraoperační elektrofyziologická monitorace a intraoperační flowmetrie. Tématem našeho sdělení je seznámení s jednotlivými metodami a nastínění jejich výhod a limitů při operativě mozkových aneuryzmat.
Metodika
Mikrovaskulární dopplerovská ultrasonografie (MDU)
Využití Dopplerova efektu při hodnocení hemodynamiky v cerebrovaskulární chirurgii zavedl Nornes a Gilsbach na přelomu 70.–80. let 20. století [2,3]. V současnosti se využívají 16–20mHz sondy o průměru 1 mm v modu pulzové vlny s insonačním úhlem vyšetření 30–60 stupňů. Velikost sondy 1 mm dává relativní šanci k vyšetření tenkých perforátorů. Použití MDU je výhodné pro relativní technickou a časovou nenáročnost ve srovnání s jinými metodami. Navíc je jeho použití levnější než většina ostatních technik. Při vyšetření MDU lze provést kvalitativní a kvantitativní analýzu dat. Při kvalitativním vyšetření je vždy zaznamenáván akustický signál. Dále jsou hodnoceny: spektrum průtoku, amplitudy a eventuální inverzní průtok. Kvantitativní hodnocení zahrnuje systolickou, diastolickou a průměrnou velocitu a dále indexy pulzatility a rezistence. Vyšetření vaku aneuryzmatu, magistrálních tepen a perforátorů se provádí před a po zaklipování krčku aneuryzmatu. Detekce inkompletního uzávěru vaku je technicky jednoduchá: jakákoliv známka toku nebo přítomnost akustického signálu svědčí pro inkompletní uzávěr. Pro stenózu magistrální tepny jsou charakteristické tyto nálezy: v místě stenózy dochází ke zvýšení velocity ve srovnání s iniciálním vyšetřením; proximálně od stenózy je snížená diastolická velocita a zvýšen index pulzatility; distálně od stenózy dochází ke snížení systolické velocity i indexu pulzatility. Určení stenózy magistrálních tepen a přítomnosti/absence toku ve vaku po zaklipování je pomocí MDU velmi přesné. Doppler technicky selhává při určení rezidua vaku a vzhledem k velikosti často i při detekci toku krve v perforátorech [4,5].
Intraoperační angiografie (iDSA)
Provedení angiografie (DSA) během operace je relativně náročná procedura. Vyžaduje speciální technologie v podobě pojízdného rentgenu, radiolucentního rámu a stolu. Výkon je časově náročný – trvá 45–60 minut a vyžaduje přítomnost neuroradiologa na operačním sále. Katétr je zaveden retrográdně cestou arteria femoralis Seldingerovou technikou buď na počátku operace, nebo po zaklipování. Jedná se tedy o invazivní techniku, která zvyšuje obecně riziko komplikací. Proto se většina autorů přiklání k selektivnímu užití intraoperační angiografie u gigantických a komplexních aneuryzmat, zejména ve vertebrobazilární lokalizaci a dále u výdutí ve speciálních lokalizacích [6–10].
Ultrazvuková flowmetrie (transit time flow measurment – TTFM)
Vyšetření flowmetrem umožňuje intraoperační kvantitativní stanovení průtoku v měřené cévě v absolutních hodnotách v ml/min [11]. Přístroj je vybaven perivaskulárními průtokovými sondami velikosti 1,5–8 mm, které korespondují s kalibrem vyšetřovaných intrakraniálních (1,5, 2, 3 mm) a extrakraniálních tepen (4, 6, 8 mm). Tělo perivaskulární sondy obsahuje dva ultrazvukové transducery, na konci sondy je umístěn akustický reflektor. Do okénka mezi transducery a reflektorem se umístí céva, která je předmětem měření. (Obr. 1). Transducery emitují alternativně ve směru a v protisměru toku krve ultrazvukové paprsky proti sobě pod úhlem 45 stupňů. TTFM pracuje na principu srovnání tranzitních časů těchto paprsků pronikajících vyšetřovanou cévou v celém jejím průřezu. Integrací rozdílu těchto změn je určen průtok cévou v mililitrech za minutu [12]. Hodnota takto zjištěného průtoku je nezávislá na úhlu přiložení, průměru cévy, hematokritu či na turbulencích v cévě [13]. Nevýhoda TTFM spočívá v potřebě preparace okolo výdutě a magistrálních tepen ve větším rozsahu pro potřeby měření. To je potenciálně spojeno s větším rizikem operace a přináší časovou prodlevu během výkonu. Proto se obvykle musí operatér s touto technikou sžít. Měření se provádí nejprve před zaklipováním výdutě a následně po aplikaci svorky na tepnách, které jsou předmětem zájmu. Nebo může být měření indirektní. To se využívá v případě rizika manipulace s tepnami blízko vaku. Příkladem je monitorace průtoku v přilehlých tepnách u aneuryzmatu přední komunikující tepny. Měří se ipsilaterálně A1 před a po zaklipování se současně umístěnou svorkou na kontralaterální A1. V tomto případě tok krve v ipsilaterální A1 reflektuje celkový průtok v obou A2. Průtok krve v měřených tepnách by měl být po zaklipování stejný nebo o 20–30 % vyšší než iniciálně. Za zvýšení průtoku je zodpovědná hyperemie, která je spojena s aplikací dočasných svorek na magistrální tepny během preparace. Podmínkou adekvátního měření jsou stabilní podmínky během anestezie s důrazem na hodnoty krevního tlaku a hladiny CO2. Výhodou TTFM je okamžitá identifikace a přesná lokalizace okluze/stenózy magistrální tepny s možností okamžité nápravy. Za signifikantní se považuje snížení toku o 25 % proti stavu před zaklipováním. Trvalé snížení toku o 50 a více procent je spojeno s těžkým neurologickým deficitem bez výjimky [11].
Obr. 1. Sonda (*) k měření průtoku krve (flowmetrie) v mozkových cévách M2, M3 - větvení a. cerebri media Fig. 1: Perivascular flow probe (*) M2, M3 - MCA branches 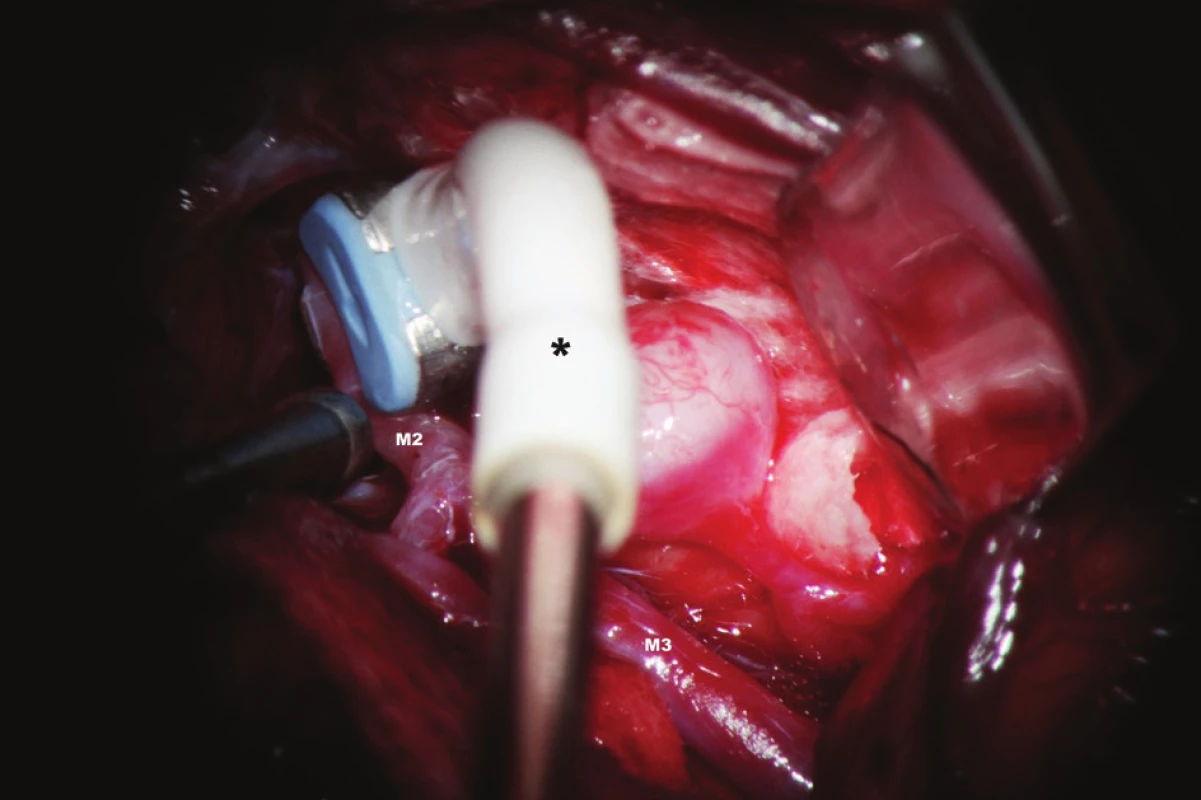
Intraoperační monitoring motorických funkcí pomocí motorických evokovaných potenciálů (MEPs-motor evoked potentials)
Monitorace motorickými evokovanými potenciály (MEPs) může být prováděna dvojím způsobem: 1. transkraniální elektrickou stimulací (TES – transcranial electric stimulation), 2. přímou kortikální stimulací (DCS – direct cortical stimulation). V obou případech je odpověď registrována ze svalů na končetinách. Obě z uvedených technik mají svá omezení i výhody. Přímá kortikální stimulace vyžaduje zavedení stripové elektrody do oblasti centrálního sulku, což je jednak spojeno s rizikem poranění přemosťujících žil a vzhledem k lokalizaci kraniotomie nemusí být toto vždy realizovatelné. Metoda dále neumožňuje sledování motorických funkcí v celém průběhu operace. Jako nevýhoda bývá uváděna i relativně malá oblast motorického kortexu, který je takto stimulován. Je-li však elektroda přiložena, umožňuje kontinuální monitoraci. Transkraniální elektrická stimulace má naopak výhodu v monitoraci funkcí v celém průběhu operace od prvotního řezu do posledního stehu s možností okamžité reakce na patologické změny. Její nevýhodou je provokace svalových záškubů, které částečně omezují operatéra. Metoda dále neumožňuje monitorování kontinuální, je prováděna jednotlivými stimuly. Volba jedné z uvedených metod závisí hlavně na lokalizaci a rozsahu kraniotomie. Bez ohledu na zvolenou techniku znamená trvalá ztráta odpovědi MEPs v důsledku těžký, trvalý neurologický deficit. Z literárních údajů vyplývá, že přechodná změna odpovědi MEPs (tzn. snížení amplitudy o více než 50 %) nevyvolává v 70 % případů žádný neurologický deficit, ve 30 % případů může být spojena s přechodným neurologickým deficitem. Bývá udáváno, že u 2 % pacientů s přechodným, lehkým neurologickým deficitem nedochází peroperačně ke změnám odpovědi MEPs vůbec, a to hlavně u pacientů při monitoraci přímou kortikální stimulací [14–17].
Infračervená videoangiografie s indocyaninovou zelení (ICG videoangiografie)
ICG videoangiografie byla v chirurgii mozkových aneuryzmat užita poprvé v roce 2003 [18] a velmi rychle doznala rutinního využití. Indocyaninová zeleň (ICG) je látka s vlastností fluorescence při nasvícení v infračervené části spektra světla s maximem na vlnové délce 805 nanometrů. Látka je aplikována intravenózně, do několika sekund se navazuje na globuliny v séru a je kompletně vyloučena játry s poločasem rozpadu 3–4 minut. Doporučená dávka je 0,2–0,5 mg/kg. Operační pole je před aplikací ICG ozářeno zdrojem světla o vlnové délce 700–850 nm. Takto vyvolaná ICG fluorescence je nahrána na videokameru integrovanou v mikroskopu. Stejně jako při konvenční angiografii, rozlišujeme při videoangiografii v reálném čase arteriální, kapilární a venózní fázi (Obr. 2). Velkým přínosem je následná analýza záznamu ihned po proběhlém vyšetření ještě během operace. ICG videoangiografie umožňuje posoudit vyřazení výdutě z cirkulace a kvalitativní hodnocení průtoku krve v magistrálních tepnách (Obr. 3). Ve srovnání s ostatními metodami dokáže posoudit průtok krve v perforátorech. Tato schopnost je mimořádně cenná [19].
Obr. 2. ICG videoangiografie v její časné fázi Vak aneuryzmatu (‡) je uzavřen klipem (*) a neplní se kontrastem. Nález se jevil jako příznivý, bez nutnosti korekce klipu.1- hlavní kmen střední mozkové tepny M1,naplněný kontrastem. 2-temporální větev M2. Fig. 2: Early phase of ICG videoangiography The sac of the aneurysm (‡) is occluded by a clip (*) without filling with contrast.The result was favourable, there was no need of the clip correction there. 1-main trunk of MCA - M1, filled with the contrast medium. 2 – the temporal branch of M2. 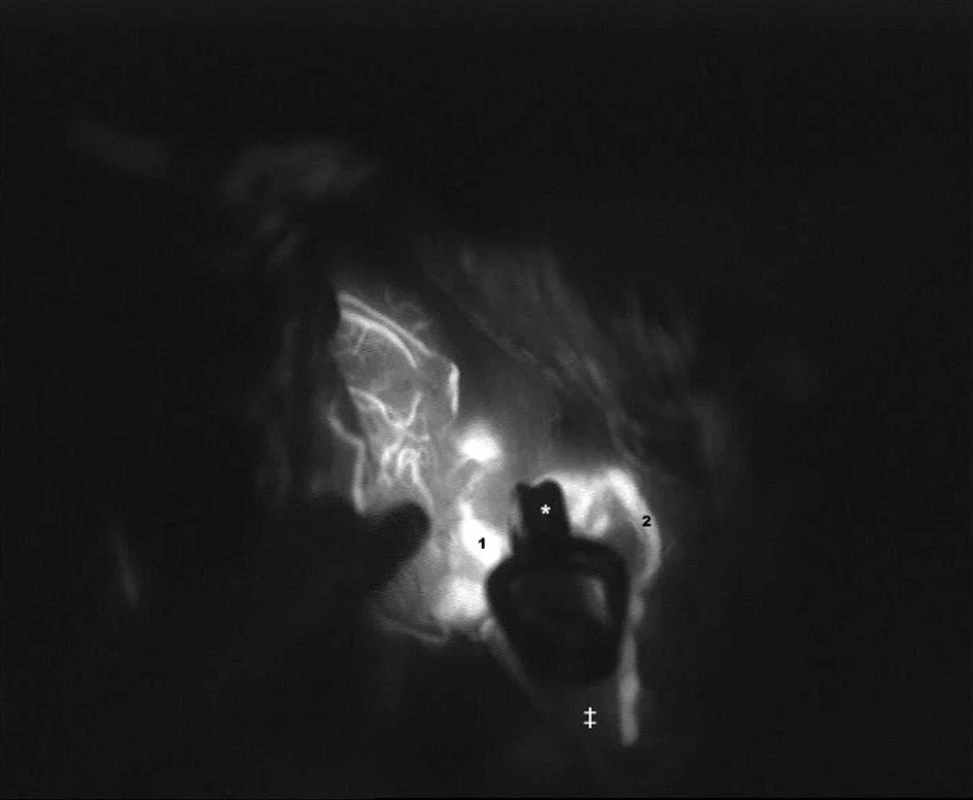
Obr. 3. V časovém odstupu 45 sekund došlo k průniku kontrastu do vaku (‡) Nález vyžadoval korekci klipování - přidání další svorky, aby byl zajištěn kompletní uzávěr krčku. Předčasné ukončení ICG vyšetření by vedlo k chybnému závěru a neadekvántímu klipování. Fig. 3: Contrast filling into the sac of the aneurysm was discovered in 45 seconds (‡) Clipping correction was neceséry. An additional clip secured a complete clipping of the neck of the aneurysm. An early termination of ICG videoangiography would result in a false conclusion and inadequate clipping. 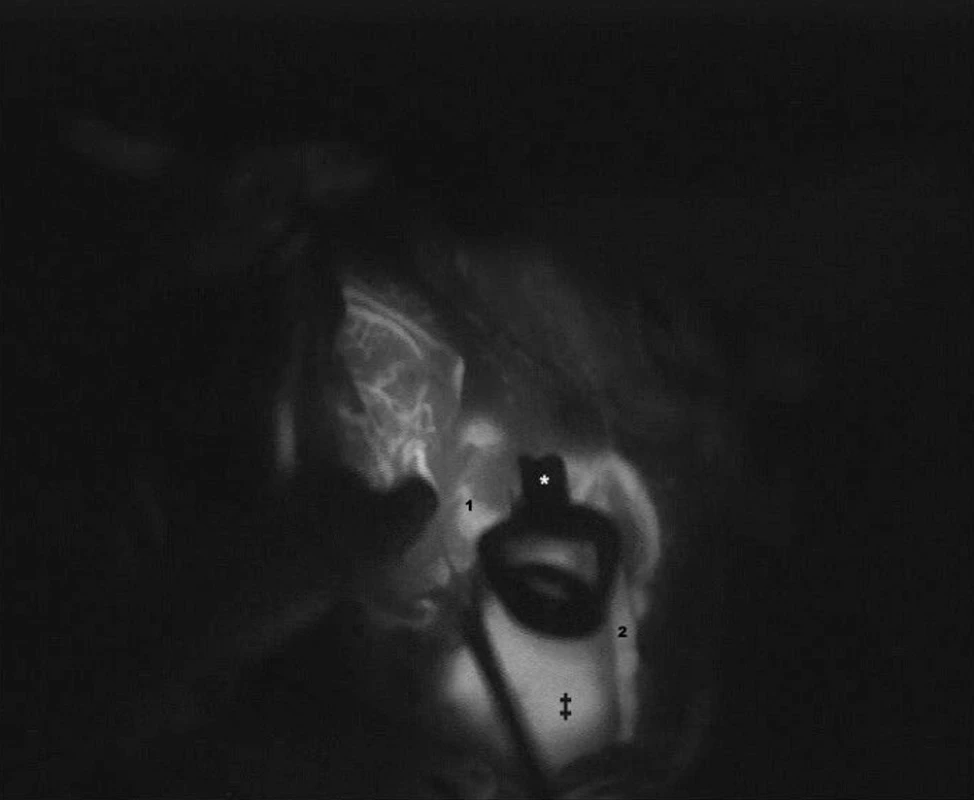
Diskuze
Standardní metodou kontroly vyřazení aneuryzmatu z cirkulace a absence rezidua vaku je pooperační mozková angiografie. Při ní lze prokázat trvající plnění rezidua krčku nebo celého vaku ve 4–19 % a okluzi/stenózu magistrální tepny v 0,3–12 % [7,20,21,22]. Ne všechny tyto nálezy mají klinické důsledky. Část pacientů lze kontrolovat na DSA v definovaných časových intervalech a zasáhnout aktivně pouze v případě růstu rezidua vaku. Pokud se však nesprávně aplikovaný klip projeví klinicky, pak je výsledkem ischemie při stenóze/okluzi magistrálních tepen nebo recidiva krvácení po ruptuře vaku v důsledku trvajícího vtoku krve. Proto je logická snaha ověřit optimální polohu klipu ještě během operace. Jen tak lze hrozící komplikaci odvrátit. Mikrovaskulární dopplerovská ultrasonografie je vyžívána od 70. let 20. století. Její předností je rychlost vyšetření, relativní uživatelská nenáročnost a nízká cena ve srovnání s jinými metodami. Hlavním limitem je nemožnost detekovat reziduum vaku.
Počáteční nevýhodou byla příliš velká sonda, která sloužila pouze k bezpečné detekci kompletní okluze krčku klipem [2]. Tyto nedostatky byly rychle překonány. Použití sond o vyšší frekvenci vedlo k jejich miniaturizaci. To umožnilo vyšetření magistrálních tepen a částečně i perforátorů [3]. Bailes a spol. vyšetřili peroperačně pomocí MDU 42 aneuryzmat u 35 pacientů. Využili 20-MHz sondu o průměru 1 mm. V 31 % zaznamenal doppler stenózu nebo okluzi tepny. Po repozici klipu došlo ve všech případech k normalizaci
MDU nálezu. Reziduální plnění vaku nenastalo ani u jednoho pacienta. Nebyla zachycena žádná komplikace v souvislosti s vyšetřením [4]. Stendel vyšetřil peroperačně 75 pacientů s 90 aneuryzmaty. Významnou stenózu tepen nalezl u 18,9 % a inkompletní uzávěr vaku u 12,2 %. Celkem byla pozice klipu na podkladě MDU nálezu změněna u 28,8 % případů. V případě aneuryzmat a. cerebri media to bylo dokonce v 38,6 % případů [5].
Cui využil MDU u 79 pacientů s 85 aneuryzmaty. Inkompletní uzávěr vaku byl nalezen u 10,6 % a významná stenóza magistrálních tepen u 12,7 % případů. Po repozici klipu došlo k úpravě nálezu [23].
Využití intraoperační angiografie se datuje stejně jako MDU do 70. let minulého století [20]. Jedná se o metodu technicky, organizačně a cenově náročnou. MacDonald analyzoval data ze souboru pacientů s časnou pooperační DSA a ve 4 % nalezl reziduum vaku, ve 4 % plnění celého vaku a u 12 % (devět pacientů) okluzi magistrální tepny. Okluze tepny měla v šesti případech za následek těžký iktus a ve dvou případech smrt. Na základě toho doporučil paušální vyšetřování intraoperační angiografie [21]. Alexander měl v souboru 107 klipovaných aneuryzmat u 92 pacientů na základě provedené intraoperační DSA v 6 % okluzi magistrální tepny a v 10 % reziduální plnění vaku. Patologické nálezy byly převážně u gigantických aneuryzmat a aneuryzmat v zadní cirkulaci [7]. Martin prokázal na intraoperační DSA špatnou polohu klipu u 5 z 57 aneuryzmat. Pooperační kontrola však zároveň odhalila reziduální plnění vaku u dvou aneuryzmat – to značí selhání intraoperační DSA v 3,5 % případů [6]. V rozsáhlé sestavě Dreydena (234 aneuryzmat) vedla intraoperační DSA k repozici klipu v 16,8 % případů. Jako rizikové skupiny byla vyhodnocena aneuryzmata v oblasti a. hypophysealis superior (38,9 %), a. cerebelli superior (60 %) a bifurkace karotidy (33,3 %). Pooperační angiografie odhalila reziduum vaku při negativním nálezu na iDSA u 7 % pacientů [8]. Payner doporučuje intraoperační DSA použít selektivně u velkých a gigantických aneuryzmat a u aneuryzmat a. hypophysealis superior. V souboru 173 případů byl nucen přesadit klip ve 27 %. Na pooperační DSA navíc nalezl reziduální plnění vaku v 3,2 % a okluzi tepny v 1,9 % případů [23]. V souboru Origitana vedla iDSA k repozici klipu u 34 % aneuryzmat, z toho 22 % pro stenózu tepny, 44 % pro reziduální plnění vaku a v 34 % pro obojí [9]. Katz se vyjadřuje k užitečnosti iDSA na základě časné pooperační angiografie. V souboru 147 aneuryzmat nalezl reziduum u 4,1 % a stenózu tepny u 2,7 % pacientů. Jednalo se bez výjimky o velká aneuryzmata, která byla v polovině případů lokalizovaná na střední mozkové tepně. Pro tyto případy doporučuje selektivní využití intraoperační DSA [10]. Metoda iDSA by měla být pečlivě zvažována, protože je z podstaty invazivní a tím potenciálně riziková. Barrow měl v souboru 115 pacientů dvě periprocedurální komplikace (1,7 %), z toho jednu smrtelnou [25].
Kvantitativnímu měření průtoku krve (flowmetrii) v magistrálních tepnách v oblasti aneuryzmatu se dlouhodobě věnuje chicagská skupina, reprezentovaná F. Charbelem a S. Amin-Hanjani. Prokázali, že snížení průtoku krve v tepnách po zaklipování o více než 25 % je spojeno s jasným rizikem ischemie. Pokles o 50 % pak hraničí s jistotou iktu [26]. K podobným závěrům došli i další autoři [27,28]. Pokles průtoku o 25 % koreluje se zúžením tepny o 80 % původního průsvitu [29]. V sestavě 106 aneuryzmat u 103 pacientů zaznamenala Amin-Hanjani redukci průtoku o ≥ 25 procent 31 případů (33,1 %). U 27 pacientů se průtok po repozici klipu normalizoval. U dvou pacientů vznikla trombóza tepny a u šesti případů nastal reverzibilní spazmus. Třikrát stačilo uvolnění excesivní retrakce mozku a došlo k restituci průtoku. Obecnou nevýhodou metody je nemožnost identifikovat reziduum vaku a dále nelze hodnotit průtok v tepnách pod 1 mm průsvitu, tedy perforátory [26]. Kombinací s dalšími metodami lze tento hendikep překonat.
Více než 30 let jsou využívány při peroperačním monitorování somatosenzorické evokované potenciály (SSEP). Vztah mezi SSEP a průtokem krve v mozku byl využit v detekci mozkové ischemie [30]. Nicméně SSEP selhávají při detekci subkortikální ischemie, způsobené postižením perforátorů [31]. Proto byla monitorace doplněna o MEPs, které jsou schopny detekce subkortikální ischemie [32]. Někteří autoři navrhují při monitoraci MEPs kombinovat transkraniální a přímou kortikální stimulaci [15]. V souboru 119 pacientů se 148 aneuryzmaty byla v souboru publikovaném Szelényi transkraniální stimulace použita vždy a přímá kortikální stimulace ve 84 % operací. Změny MEPs se v tomto souboru vyskytly u 14 pacientů: devětkrát po dočasné okluzi mateřské tepny, čtyřikrát po aplikaci klipu na krček, dvakrát po poklesu krevního tlaku a jednou při nadměrné retrakci mozku lopatkou. Vždy následovala adekvátní reakce chirurga – sejmutí dočasného nebo trvalého klipu, elevace tlaku a uvolnění retrakce. MEPs se upravily v 10 případech, patologické změny zůstaly ve čtyřech případech. Trvalá ztráta MEP způsobila vždy těžký neurologický deficit. Na druhou stranu pokud došlo k úpravě MEP během 5 minut, nikdy neurologický deficit nevznikl [15]. Yeon srovnával skupinu 66 neprasklých aneuryzmat, operovaných bez monitorace, se skupinou 98 aneuryzmat, u kterých byly během výkonu snímány MEPs. V první skupině byl zaznamenán trvalý neurologický deficit u tří pacientů, ve skupině s MEPs monitorací se nevyskytl. Přitom k deterioraci MEPs došlo celkem 12krát: jedenkrát v důsledku hypotenze, sedmkrát po dočasném klipu a čtyřikrát po zasvorkování krčku klipem. Okamžitá reakce operatéra vedla k restituci MEP a následně absenci neurologického deficitu. Paralelně snímané SSEP byly přitom patologické pouze ve čtyřech případech [14]. Irie publikoval soubor 110 pacientů, u 98 z nich s normálním záznamem MEPs nedošlo k rozvoji neurologického pooperačního deficitu. U čtyř pacientů, u kterých byla detekována přechodná změna MEPs, nedošlo k rozvoji neurologického deficitu. U dvou pacientů trvalá ztráta MEPs vyústila dle očekávání v kontralaterální hemiparézu. Zároveň bylo v sestavě detekováno šest pacientů s falešně negativními MEPs, tzn. rozvinul se u nich pooperační neurologický deficit, přestože MEPs byly normální. Dvakrát se jednalo o pozdní pooperační rozvoj hemiparézy, pro kterou neměli autoři jasné vysvětlení. Ve čtyřech případech byl klinický obraz přítomen již po probuzení. Vysvětlením tohoto nálezu může být změna polohy klipu po uvolnění retraktorů s následnou zástavou toku krve v perforátorech. MEPs již v této fázi operace nebyly monitorovány, proto není výsledný stav možné chápat jako selhání metody [33]. Motoyama vyšetřoval paralelně TES a DCS u 48 pacientů s neprasklými aneuryzmaty. Potvrdil větší senzitivitu DCS při detekci hrozící ischemie. Zároveň zdůraznil snazší proveditelnost TES. Proto ve shodě se Szelényi navrhuje kombinovat při monitorování obě techniky MEPs [33]. Neuloh a Schramm srovnávali efektivitu MEPs, SSEPs a MDU v souboru 129 operovaných aneuryzmat. MEPs prokázaly nejlepší senzitivitu v detekci motorického postižení, zejména subkortikální ischemie. MDU bylo favoritní v detekci inadekvátního klipingu a stenózy/okluze magistrální tepny. Nicméně nedávalo, na rozdíl od MEPs, informaci o suficientnosti kolatelárního toku krve [32].
S ohledem na riziko reziduálního plnění zasvorkovaného aneuryzmatu a stenózy/okluze magistrální tepny [7,20–22] bylo žádoucí zavedení rychlé, jednoduché a především spolehlivé metody peroperační kontroly správné aplikace klipu. Tyto požadavky naplnila ICG videoangiografie, jejíž využití poprvé publikoval v cerebrovaskulární chirurgii Raabe v roce 2003 [18]. Velmi rychle došlo k jejímu širokému uplatnění v neurochirurgické obci [19,35].
Předností ICG videoangiografie při operacích aneuryzmat je vysoká spolehlivost spojená s uživatelskou přívětivostí. Raabe a spol. srovnávali prospektivně ICG videoangiografii s peroperační a pooperační DSA u 114 pacientů. Nedostatečně kvalitní ICG zobrazení zaznamenali ve 4,3 %. Příčinou bylo difuzní krvácení v operačním poli, hluboko uložené aneuryzma s omezením zorného pole a aterosklerotické kalcifikace tepen. V 95,7 % byla kvalita zobrazení adekvátní. ICG vedla u 10 pacientů (9 %) k nutnosti korekce polohy klipu. V šesti případech šlo o reziduální plnění vaku, u tří pacientů o okluzi/stenózu magistrální tepny a v jednom případě o okluzi perforátorů. Korelace mezi ICG a peroperační a pooperační DSA nastala v 90 % případů. V případě neshody se obvykle jednalo o hemodynamicky nevýznamnou stenózu magistrální tepny, nalezenou na DSA bez klinického dopadu a nutnosti operační revize. Ve dvou případech bylo na DSA nalezeno reziduum vaku. V obou případech byla zvolena observace. Autoři zdůraznili výhody ICG ve srovnání s DSA. Ocenili rychlost, jednoduchost a bezpečnost provedení ICG ve srovnání s DSA. Další předností byla vysoká rozlišovací schopnost, která umožnila zobrazit i perforující arterie. Nevýhodu ICG viděli v nemožnosti vyloučit reziduum vaku, pokud je toto mimo zorné pole (například zakryto svorkou, koagulem, mozkovou tkání). Limit vyšetření ICG je i v případě tlustostěnných, sklerotických stěn vaku a cév, u kompletně trombózovaných výdutí a zejména u gigantických aneuryzmat. Tam je DSA metodou volby [18]. Dashti hodnotil patentnost větví a reziduum vaku po klipingu u 190 pacientů s 239 ošetřenými výdutěmi. Reziduum vaku nalezl v 6 % a okluzi magistrálních tepen v 6 % případů při hodnocení na pooperační CT angiografii. ICG hodnotí jako nevhodnou u gigantických a hluboko uložených výdutí. Mimořádně kladně naopak hodnotil možnost zobrazení perforátorů a možnost pečlivého opakovaného hodnocení smyčky záznamu k vyloučení retrográdního toku nebo reziduální fluorescence [19].
Možnost přesnějšího hodnocení ICG poskytuje grafická analýza intenzity fluorescence v časové závislosti (FLOW 800). Vyšetření diagramu odliší reziduální plnění od zbytkové fluorescence v případě krátkého intervalu opakovaného podání. Druhý případ nevyžaduje chirurgickou korekci [36]. Další zlepšení přináší využití endoskopu při ICG videoangiografii. Přidaná hodnota metody spočívá v zobrazení perforátorů mimo zorné pole mikroskopu [37]. Washington a spol. srovnali výsledky ICG videoangiografie s intraoperační DSA u 49 pacientů. V 7 případech DSA prokázala patologii (reziduum vaku, stenózu tepny), ačkoliv ICG byla negativní. Autoři proto doporučují nadále iDSA jako zlatý standard [38]. Naproti tomu Morcos vidí roli pro DSA jako omezenou a doporučuje kombinaci ICG videoangiografie a kvantitativní flowmetrie jako optimální kombinaci metod k eliminaci peroperačních rizik chirurgie aneuryzmat [39]
Závěr
Monitorace bezpečnosti klipování mozkových aneuryzmat je klíčová z hlediska prevence recidivy ruptury a pooperační ischemie.
Žádná výše uvedená metoda není sama o sobě dostačující.
Kombinace metod s eliminací jejich slabin je optimálním řešením.
Volba jednoduchých řešení je preferována. Kombinace ICG+TTFM+MEP/SSEP dle zkušenosti autorů je schopná detekce chyby v drtivé většině případů.
MUDr. Vladimír Přibáň, Ph.D
alej Svobody 80
304 60, Plzeň
e-mail: v.priban@centrum.cz
Zdroje
1. Yasargil MG. Microneurosurgery. Vol. II. Stuttgart. New York, Georg Thieme Verlag 1984.
2. Nornes H, Grip A, Wikeby P. Intraoperative evaluation of cerebral hemodynamics using directional Doppler technique: 2-Saccular aneurysms. J Neurosurg 1979;570–577.
3. Gilsbach JM. Intraoperative Doppler Sonography in Neurosurgery. New York, Springer-Verlag 1983.
4. Bailes JE, Tantuwaya LS, Fukushima T, et al. Intraoperative Microvascular Doppler Sonography in Aneurysm Surgery. Neurosurgery 1997;40 : 965–972.
5. Stendel R, PietiAlä T, Al Hassan AA, et al. Intraoperative microvascular Doppler ultrasonography in cerebral aneurysm surgery. J Neurol Neurosurg Psychiatry 2000;68 : 29–35.
6. Martin NA, Bentson J, Vinuela F, et al. Intraoperative digital subtraction angiography and the surgical treatment of intracranial aneurysms and vascular malformations. J Neurosurg 1990; 73 : 526–533.
7. Alexander TD, MacDonald RL, Weir B, et al. Intraoperative Angiography in Cerebral Aneurysms Surgery: A Prospective Study of 100 Craniotomies. Neurosurgery 1996;39 : 10–18.
8. Dreyden CP, Moran CJ, DeWitte TC et al. Intracranial Anerysms: Anatomic Factors That Predict the Usefulness of Intraoperative Angiography. Radiology 1997;205 : 335–339.
9. Origitano TC, Schwartz K, Anderson D, et al. Optimal Clip Application and Intraoperative Angiography for Intracranial Aneurysms. Surg Neurol 1999;51 : 117–128.
10. Katz M, Gologorsky BA, Tsiouris IJ, et al. Is Routine Intraoperative Angiography in the Surgical Treatment of Cerebral Aneurysms Justified? A Consecutive Series of 147 Aneurysms. Neurosurgery 2006;58 : 719–727.
11. Amin-Hanjani S, Charbel FT. Flow-assisted surgical technique in cerebrovascular surgery. Surg Neurol 2007;68(Suppl 1):S4–S11.
12. Drost CJ. Vessel diameter-independent volume flow measurements using ultrasound. Proc San Diego Biomed Symp 1978;17 : 299–302.
13. Lundell A, Bergqvist D, Mattsson E, Nilsson B. Volume blood flow measurements with transit time flowmeter: An in vivo and in vitro variability and validation study. Clin Physiol 1993;13 : 547–557.
14. Yeon JY, Seo DW, Hong SC, Kim JS. Transcranial motor evoked potential monitoring during the surgical clipping of unruptured intracranial aneurysms. J Neurological Sci 2010;293 : 29–34.
15. Szelényi A, Langer D, Kothbauer K, et al. Monitoring of muscle motor evoked potentials during cerebral aneurysm surgery: intraoperative changes and postoperative outcome. J Neurosurg 2006;105 : 675–681.
16. Neuloh G, Schramm J. Monitoring of motor evoked potentials compared with somatosensory evoked potentials and microvascular Doppler ultrasonography in cerebral aneurysm surgery. J Neurosurg 2004;100 : 389–399.
17. Szelényi A, Langer D, Beck J, Raabe A, Flank ES, Seifert V, Deletis D. Transcortical and direkt cortical stimulation for motor evoked potential monitoring in intracerebral aneurysma surgery. Neurophysiologie Clinique/Clinical Neurophysiology 2007;37 : 391–398.
18. Raabe A, Beck J, Gerlach R, Zimmermann M, Seifert V. Near-infrared indocyanine green video angiography: a new method for intraoperative assessment of vascular flow. Neurosurgery 2003;52 : 132–139.
19. Dashti R, Laakso A, Niemelä M, Porras M, Hernesniemi J. Microscope-integrated near-infrared indocyanine green videoangiography during surgery of intracranial aneurysms: the Helsinki experience. Surg Neurol 2009;71 : 543–550.
20. Drake CG, Allcock JM. Postoperative angiography and the slipped clip. J Neurosurg 1973;39 : 683–689.
21. MacDonald RL, Wallace MC, Kestle JR. Role of angiography following aneurysm surgery. J Neurosurg 1993;79 : 826–832.
22. Rauzinno MJ, Quinn CM, Fischer W. Angiography after aneurysm surgery: indications for selective angiography. Surg Neurol 1998;49 : 32–40.
23. Cui H, Wang Y, Wan J, Fei Z, Gao W, et al. Role of intraoperative microvascular Doppler in the microsurgical management of intracranial aneurysms. J Clin Ultrasound 2011;39 : 27–31.
24. Payner TD, Horner TG, Leipzig TJ, et al. Role of intraoperative angiography in the surgical treatment of cerebral aneurysms. J Neurosurg 1998;88 : 441–448.
25. Barrow DL, Boyer KL, Joseph GJ. Intraoperative angiography in the management of neurovascular disorders. Neurosurgery 1992;30 : 153–159.
26. Amin-Hanjani S, Meglio G, Gatto R, Bauer A, Charbel FT. The utility of intraoperative blood flow measurement during aneurysm surgery using an ultrasonic perivascular probe. Neurosurgery 2008;62 : 1346–1353 suppl.
27. Eckert B, Thie A, Carvajal M, et al. Predicting hemodynamic ischemia by transcranial Doppler monitoring during therapeutic balloon occlusion test of internal carotid artery. Am J Neuroradiol 1998;19 : 577–582.
28. Jawad K, Miller D, Wyper DJ, Rowan JO. Measurement of CBFand carotid artery pressure compared with cerebral angiography in assessing blood supply after carotid ligation. J Neurosurg 1977;46 : 185–196.
29. Spencer MP, Reid JM. Quantitation of carotid stenosis with continuous-wave (C-W) Doppler ultrasound. Stroke 1979;10 : 326–330.
30. Meyer KL, Dempsey RJ, Roy MW, Donaldson DL. Somatosensory evoked potentials as a measure of experimental cerebral ischemia. J Neurosurg 1985;62 : 269–275.
31. Gao L, Gelb AW. The use of motor evoked potential monitoring during cerebral aneurysm surgery to predict pure motor deficits due to subcortical ischemia. Clinical Neurophysiology 2011;122 : 648–655.
32. Neuloh G, Schramm J. Monitoring of motor evoked potentials compared with somatosensory evoked potentials and microvascular Doppler ultrasonography in cerebral aneurysm surgery. J Neurosurg 2004;100 : 389–399.
33. Irie T, Yoshitani K, Ohnishi Y, et al. The efficacy of motor-evoked potentials on cerebral aneurysm surgery and new-onset postoperative motor deficits. J Neurosurg Anesthesiol 2010;22 : 247–251.
34. Motoyama Y, Kawaguchi M, Yamada S, et al. Evaluation of combined use of transcranial and direct cortical motor evoked potential monitoring during unruptured aneurysm surgery. Neurol Med Chir 2011;51 : 15–22.
35. Snyder, LA, Spetzler, RF. Current indications for indocyanine green angiography. World Neurosurgery 2011;76 : 405–406.
36. Oda J, Kato Y, Chen SF, Sodhiya P, Watabe T, et al. Intraoperative near-infrared indocyanine green-videoangiography (ICG-VA) and graphic analysis of fluorescence intensity in cerebral aneurysm surgery. J Clin Neurosci 2011;18 : 1097–1010.
37. Nishiyama Y, Kinouchi H, Senbokuya N, Kato T, Kanemaru K, et al. Endscopic indocyanine green video angiography in aneurysm surgery: an innovative method for intraoperative assessment of blood flow in vasculatuer hidden from microscopic view. J Neurosurg 2012;117 : 302–308.
38. Washington CW, Zipfel GJ, Chicoine MR, et al. Comparing indocyanine green videoangiography to the gold standard of intraoperative digital subtraction angiography used in aneurysm surgery. J Neurosurg 2012;16 : 1–8.
39. Morcos JJ. Indocyanine green videoangiography or intraoperative angiography? J Neurosurg DOI: 10.3171/2012.6. JNS 1285.
Štítky
Chirurgia všeobecná Ortopédia Urgentná medicína
Článok vyšiel v časopiseRozhledy v chirurgii
Najčítanejšie tento týždeň
2013 Číslo 9- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Simulace virtuální reality a specializační vzdělávání v chirurgii
- Současné technické možnosti zvýšení peroperační bezpečnosti při mikrochirurgii mozkových aneuryzmat – souhrnný referát
- Profesor Jan Wechsler se dožívá 75 let
- Jaterní a plicní metastázy kolorektálního karcinomu – zkušenosti Chirurgické kliniky FN v Plzni
- Nitrokloubní artrodéza při nestabilitě lumbosakrální páteře – první výsledky prospektivní studie
- Kouření a pooperační komplikace
- Raritná komplikácia po staplerovej hemoroidektómii
- Rekurentný subareolárny non- puerperálny absces prsníka s fistuláciami ductus lactiferi (Zuskas disease)
- 10th International Gastric Cancer Congress 2013 Verona June 19-22
- Přípustná rizika v chirurgii
- Přípustná rizika v chirurgii z pohledu Medicíny založené na důkazech a hodnocení kvality chirurgické péče
-
Komplikace a rizika chirurgie nádorů horní části zažívacího traktu (Foregut)
I. část: Jícen -
Komplikace a rizika chirurgie nádorů horní části zažívacího traktu (Foregut)
II. část: Žaludek
- Rozhledy v chirurgii
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Kouření a pooperační komplikace
- Rekurentný subareolárny non- puerperálny absces prsníka s fistuláciami ductus lactiferi (Zuskas disease)
- Jaterní a plicní metastázy kolorektálního karcinomu – zkušenosti Chirurgické kliniky FN v Plzni
- Raritná komplikácia po staplerovej hemoroidektómii
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



