-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Cievne plastiky a úpravy ciev u pacientov pri transplantácii obličiek v 10 ročnom sledovaní
Different techniques of vessel reconstruction in kidney transplantation −10-years experiences
Introduction:
The aim of the study was to analyze own results from Transplant Center Kosice, Slovak Republic.Methods:
In total 457 patients in the end-stage renal failure were included to the kidney transplant program. Following techniques were used: arterioplasty, individual renal artery anastomosis and multiple renal arteries anastomosed on a common patch. The kidney transplant (Tx) especially requires surgical technique of a vascular anastomosis.Results:
Renal transplantation has been established in Transplant Center Kosice since 1988. The arterioplasty of renal artery was performed in 102 (22.3%) and individual artery anastomosis in 25 (5.5%) patients. Multiple artery anastomosis on the patch was done in 43 (9.4%) and implantation of pole renal arteries to the main trunk performed in 34 (7.4%) cases.Conclusion:
Renal transplantation is a lifesaving method in end stage renal failure.Key words:
kidney transplantation – arterioplasty, cold ischemia time − vascular anastomosis
Autori: P. Závacký 1; Ľ. Beňa 2; M. Zavacká 3; M. Frankovičová 3
Pôsobisko autorov: I. Chirurgická klinika UNLP a LF Univerzity Pavla Jozefa Šafárika, Košice prednosta: prof. MUDr. J. Radoňak, PhD. 1; Transplantačné oddelenie UNLP, Košice vedúci pracoviska: MUDr. Ľ. Beňa, PhD. 2; Klinika cievnej chirurgie LF Univerzity Pavla Jozefa Šafárika a VÚSCH, a. s., Košice prednosta: prof. MUDr. M. Frankovičová, PhD. 3
Vyšlo v časopise: Rozhl. Chir., 2016, roč. 95, č. 6, s. 231-239.
Kategória: Původní práce
Súhrn
Úvod:
Cieľom štúdie bolo analyzovať výsledky činnosti transplantačného centra v Košiciach.Metódy:
Do transplantačného programu boli zaradení pacienti v kritickom štádiu obličkového zlyhávania. Na transplantáciu obličky bolo indikovaných 457 pacientov. Z metodík bola použitá plastika tepny, našitie tepny samostatne a našitie na spoločnom terčíku. Transplantácia (Tx) obličky vyžaduje predovšetkým techniku cievnej anastomózy - chirurgického spojenia ciev.Výsledky:
Transplantácie obličiek sa v Transplantačnom centre Košice realizujú od roku 1988. Plastiku tepny sme vykonali u 22,3 % (102) pacientov. Z toho tepny našité samostatne boli u 5,5 % (25). Na spoločnom terčíku ich bolo 9,4 % (43). V 7,4 % (34) bola plastika realizovaná ako implantácia pólových renálnych artérií do hlavného kmeňa.Záver:
Transplantácia obličiek je život zachraňujúca metóda.Kľúčové slová:
transplantácia obličky − plastika tepny − doba studenej ischémie − cievna anastomóza − centrumÚvod
Transplantácia obličky je liečebnou metódou, ktorá z medicínskeho hľadiska najkomplexnejšie nahrádza funkciu orgánu pri jeho nezvratnom zlyhaní (Abecassis, 2008) [1]. Pacientovi s obličkovým zlyhaním poskytuje transplantácia v porovnaní s ostatnými spôsobmi náhrady obličkových funkcií najvyššiu možnú kvalitu života a súčasne je z ekonomického hľadiska najlacnejším spôsobom terapie obličkového zlyhania s ESRD (Port, 1993; Seghal, 2002) [2,3].
Výsledky transplantácie obličiek sa menia v závislosti od skúseností jednotlivých transplantačných centier. Z chirurgického hľadiska sú to hlavne peri - a po-operačné komplikácie ( aj z cievnej stránky). Podľa údajov veľkých pracovísk s viac ako 50 operáciami ročne prebieha transplantácia obličky s technickými komplikáciami len u 5 % pacientov (Suthanthiran, 1994) [4]. Za bezproblémovým priebehom transplantácie, nízkym počtom komplikácií a ich rýchlym zvládnutím stojí adekvátna starostlivosť o darcu a príjemcu, tímová práca s jasne definovanými postupmi ako aj pozornosť k detailom, umožňujúca dosiahnuť pozitívne výsledky s jedno a viac ročným prežívaním prvej obličky od kadaverózneho darcu, ktorá by mala byť viac ako 95 % (Allen, 1994) [5].
Cievny štep v transplantačnej chirurgii
V transplantačnej chirurgii vzniká často potreba predĺženia cievnej stopky, pretože nedostatočne dlhú cievu nie je možné kvalitne našiť. Nekvalitná cievna stena, poškodenie intimy, zatrhnutie médie, disekcia, zmliaždenie a subintimálny hematóm, sú indikáciami resekcie ciev. Najvhodnejšie sú autotransplantáty: autoarteriálne a autovenózne (Krylov, 1978) [9]. Priechodnosť cievneho štepu závisí od kvality cievneho spojenia. Správne evertovaná intima, priemerný ťah uzla, dostatočne veľký záber steny, to všetko závisí od klinickej skúsenosti operujúceho a jeho operačnej erudovanosti. Veľmi dôležitá je kvalita cievneho štepu, jeho opracovanie, spôsob a kvalita odberu a manipulácie počas našívania. Niektoré práce opisujú aj rekonštrukciu renálnych ciev pri transplantácií obličiek použitím polytetrafluóretylénoveho (PTFE) vaskulárneho štepu (Mohamed H., 2007) [10]. Zatiaľ však nie sú známe štúdie porovnávajúce dlhodobé výsledky biologických vs. protetických/náhradných vaskulárnych štepov v transplantácii obličiek.
Medzi rozličné techniky na opravu krátkej alebo poškodenej darcovskej renálnej artérie patria end-to-end anastomóza štepu artérie, side-to-side anastomóza rozvetvej artérie a použitie iliakálneho arteriálneho štepu. Krátka darcovská renálna žila sa môže upraviť prenesením príjemcovej vonkajšej iliakálnej žily po podviazaní vnútornej iliakálnej žily, predĺžením darcovskej žily pomocou disekcie v renálnom hile a použitím venóznych štepov.
Typy úprav
Typ 1: predĺženie štepov iliakálnej artérie – priečne prerezaná alebo skrátená jediná renálna artéria sa obvykle dá zrekonštruovať pomocou end-to-end (koniec ku koncu) anastomózy k vnútornej iliakálnej artérii príjemcu (Obr. 1).
Obr. 1. Predĺženie jednej renálnej artérie použitím darcovského vonkajšieho iliakálneho štepu [11] Fig. 1: Extension of one renal artery using a donor external iliac graft [11] ![Predĺženie jednej renálnej artérie použitím darcovského vonkajšieho iliakálneho štepu [11]
Fig. 1: Extension of one renal artery using a donor external iliac graft [11]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/46118708273022c2af2bd8c422914814.jpg)
Typ 2: revízia aortálnej záplaty – táto technika je užitočná u obličiek s duálnym krvným zásobovaním, u ktorých sa vyskytlo poranenie aorty medzi vyústeniami (take-off renálnych artérií, alebo kde aortálne vyústenie (take-off) medzi dvoma artériami je oddelené o viac než 1 cm (Obr. 2).
Obr. 2. Premodelovanie aortálnej záplaty u obličky s dvojitou artériou [11] Fig. 2: Remodeling of the aortic pay with double kidney artery [11] ![Premodelovanie aortálnej záplaty u obličky s dvojitou artériou [11]
Fig. 2: Remodeling of the aortic pay with double kidney artery [11]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/78460b5853d51e9823264906753707a2.jpg)
Typ 3: oprava poškodení menších artérií – poškodenia malých horných polárnych artérií majú za následok malé infarkty pri hornom póle štepu. Dolné polárne cievy sa opravujú buď priamo (Obr. 3a), pomocou reimplantácie do väčšej renálnej cievy (Obr. 3b), alebo použitím side-to-side „spojenej“ anastomózy, aby sa vytvorilo spoločné ústie, ktoré by sa mohlo našiť koncom ku koncu k hypogastrickej artéii (Obr. 4a), alebo k darcovskému vaskulárnemu štepu (Obr. 4b). Spojená technika je možná len keď cievy sú dostatočne dlhé a podobnej veľkosti.
Obr. 3. a,b: Oprava poškodenej segmentálnej artérie a) priama oprava a b) reinplantácia do väčšej renálnej cievy [11] Fig. 3. a,b: Repair of damaged segmental arteries a) direct repair and b) reimplantation in greater renal arteries [11] ![a,b: Oprava poškodenej segmentálnej artérie a) priama oprava a b) reinplantácia do väčšej renálnej cievy [11]
Fig. 3. a,b: Repair of damaged segmental arteries a) direct repair and b) reimplantation in greater renal arteries [11]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/65229d291cf6531b1656bae6c3cf83cb.jpg)
Obr. 4. a,b: Oprava poškodenia segmentálnej artérie pomocou side-to-side-spojenej anastomózy a) hypogastickou artériou a b) s darcovským vaskulárnym štepom [11] Fig. 4. a,b: Repair of segmental artery damage using side-to-side anastomosis with a) hypogastic artery b) donor vascular graft [11] ![a,b: Oprava poškodenia segmentálnej artérie pomocou side-to-side-spojenej anastomózy a) hypogastickou artériou a b) s darcovským vaskulárnym štepom [11]
Fig. 4. a,b: Repair of segmental artery damage using side-to-side anastomosis with a) hypogastic artery b) donor vascular graft [11]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/7dde087a98f933af1f11b377daca1aa9.jpg)
Typ 4: kombinácia typov 1−3 – Všetky hore uvedené základné techniky sa môžu používať v kombinácii (Obr. 5, 6).
Obr. 5. Kombinované rekonštrukčné techniky [11] Fig. 5: Combined reconstruction techniques [11] ![Kombinované rekonštrukčné techniky [11]
Fig. 5: Combined reconstruction techniques [11]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/76db1594deddf3d453bf9ee330c2982b.jpg)
Obr. 6. Možnosti rekonštrukcie renálnych artérií [12] Fig. 6: Reconstruction options in renal arteries [12] ![Možnosti rekonštrukcie renálnych artérií [12]
Fig. 6: Reconstruction options in renal arteries [12]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/f5bceb395d33f1a4e3492a7e65591326.jpg)
a) anastomóza „end to end“ b) anastomóza „end to side“ c) spoločný terčík tepien d) implantacia pólovej tepny do a.epigastrica inferior e) f ) vytvorenie spoločného ústia renálnych tepien Metódy
Do našej retrospektívnej observačnej kohortovej štúdie bolo zaradených 457 pacientov s ESRD (end stage renal disease) v liečbe mimotelovou eliminačnou metódou (hemodialýza, resp. peritoneálna dialýza), ktorí v období medzi rokmi 2005 a 2015 podstúpili transplantáciu obličky na I. Chirurgickej klinike UNLP a Lekárskej fakulty Univerzity P. J. Šafárika v Košiciach. Zaraďovacím kritériom bola úspešne realizovaná transplantácia obličky. Vylučovacím kritériom pre nezaradenie do štúdie bolo úmrtie, graftektómia a akútne srdcové zlyhanie do 24 hodín po KTx. Ani jeden pacient nesplnil vylučovacie kritérium a preto výsledná vzorka respondentov pozostávala zo 457 respondentov.
Oblička bola transplantovaná od mŕtveho alebo žijúceho darcu. Jej kontrola pred samotnou inzerciou sa realizovala za sterilných podmienok na operačnej sále. Následne bola ponorená do ľadovej drte.
U každej sme kontrolovali: anatomické štruktúry, celistvosť intimy tepny i žily, prítomnosť akcesórnych tepien, efektívnosť preplachu. Ak akcesórne tepny neboli poškodené a neboli ďaleko od ústia hlavnej tepny, ponechali sme ich na spoločnom terčíku. Ak boli vzdialené, poškodené alebo oddelené, všívali sme ich do hlavnej artérie „end to side“, alebo sme ich rekonštruovali pomocou cievnych alotransplantátov (najčastejšie iliackých ciev), alebo autotransplantátov odobratých od príjemcu (arteria epigastrica inferior alebo vena saphena magna).
Oblička bola pri transplantácii vložená extraperitoneálne do fossa iliaca, pričom donorské cievy sa našívali na iliacké cievy príjemcu koncom ku strane (end to side) pokračujúcim stehom z neresorbovateľného materiálu, najlepšie Prolen 5/0 alebo Vascufil 5/0. Začínali sme žilovým spojením, po kontrole anastomózy nasledovalo spojenie tepien k a. iliaca interna alebo a. iliaca externa (Obr.7). Pri sklerotických zmenách na tepne sme anastomózu našili v mieste s najmenším postihnutím. Ak to nebolo možné, vykonali sme endarterektómiu daného úseku a následne sme našili anastomózu. V ďalšom kroku sme rekonštruovali močové cesty. Po izolácii časti prednej a bočnej steny močového mechúra laterálne od vertexu sme implantovali močovod transplantovanej obličky do močového mechúra.
Obr. 7. Našitie graftu arteriálna a venózna anastomóza (I. Chirurgická klinika UNLP, Košice) Fig. 7 : Graft reperfusion renal - artery and venous anastomosis (I. Clinic of Surgery University Hospital, Košice) 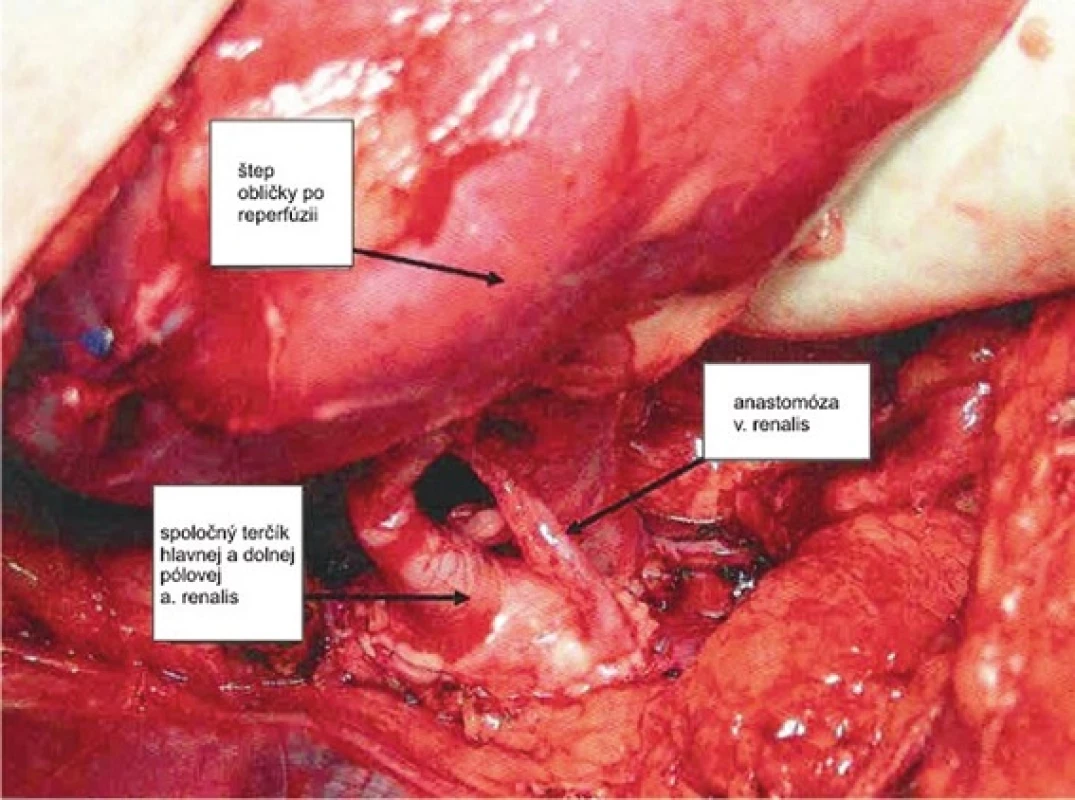
Sledované výstupy
Sledované údaje a informácie sme získali zo zdravotnej dokumentácie lôžkovej časti TC KE. Boli to: sociodemografické parametre, základná diagnóza, ktorá viedla k zlyhaniu obličiek, predchorobie a komorbidity, typ darcu, údaje o primárnej, resp. následnej transplantácii, realizovaných operačných výkonoch, biochemické parametre v sére, peri-, post-operačné komplikácie, typ imunosupresie, prítomnosť infekcí, typu rejekcie a informácie o realizovaní prípadnej graftektómie.
Sérové hodnoty kreatinínu po 3. mesiaci a po 1. roku od KTx, informácie o prežívaní pacientov, zlyhaní štepu s potrebou eliminačnej terapie sme doplnili z ambulantnej dokumentácie TC KE.
GFR bola vypočítaná CKD-EPI formulou podľa Leveyho a následne boli stanovené stupne CKD (1−5) (Levey, 2010) [13]. Stratifikácia do troch pracovných skupín CKD bola realizovaná v súlade s klinickým aspektom, zlyhanie štepu bolo vzhľadom na nízky počet respondentov zlúčené s graftektómiou, keďže klinický výstup je ten istý – eliminačná liečba. Akútna rejekcia a chronická dysfunkcia štepu boli diagnostikované na základe Banffskej klasifikácie pre obličkovú biopsiu aktualizovanej v roku 2009 (Sis, 2010) [14].
Štatistická analýza
Priemerné hodnoty urey a kreatinínu pred KTx a pri prepustení v skupinách s okamžitým, respektíve oneskoreným nástupom funkcie štepu, alebo bez nástupu funkcie štepu boli analyzované pomocou ANOVY.
Hodnoty kreatinínu a urey pred a po výkone transplantácie sme v skupinách pacientov podľa druhu operačného výkonu (kontrolná skupina bez plastiky, AA samostatne, na spoločnom terčíku, implantácia pólových renálnych artérií do hlavného kmeňa) a podľa doby studenej ischémie porovnávali pomocou ANOVY a následne sme použili Sheffeho post hoc test.
Vplyv typu operačného zákroku, doby studenej ischémie a komorbidity (ischemickej choroby srdca a diabetu prvého a druhého typu) na pravdepodobnosť oneskoreného, alebo zlyhaného nástupu funkcie štepu sme overovali pomocou logistickej regresie, pri súčasnom zohľadnení vplyvu pohlavia a veku. Priemerné hodnoty kreatinínu a urey pri prepustení v skupinách bez/s ischemickou chorobou srdca a diabetom prvého a druhého typu sme porovnali t-testom pre dva nezávislé výbery.
Súvislosť druhu operačného výkonu a doby studenej ischémie s funkciou štepu po 3 mesiacoch a po roku sme overovali pomocou modelu logistickej regresie adjustovaného na vek a pohlavie.
Súvislosť druhu operačného výkonu a doby studenej ischémie s hodnotami GFR rozdelenými do 4 kategórii podľa stupňa CKD) (graftektómia) po 3 mesiacoch sme overovali pomocou ANOVY a následne sme použili Sheffeho post hoc test.
Súvislosť druhu operačného výkonu a doby studenej ischémie s graftektómiou po 3 mesiacoch sme overovali pomocou multinomiálnej regresnej analýzy.
Výsledky
Výskumná kohorta pozostávala zo 457 pacientov, ktorí podstúpili transplantáciu obličky (od žijúceho alebo mŕtvého darcu) s priemerným vekom 47,92 (±12,22) rokov (rozsah od 9 do 75) (viď Graf 1).
Graf 1. Zastúpenie respondentov vo vekových skupinách (v %) Graph 1: Representation of respondents in age groups (in %) 
V súbore prevažovalo mužské pohlavie s percentuálnym zastúpením 58,4 % (267), žien bolo 41,6 % (190). 92,1 % (421) respondentov podstúpilo prvú transplantáciu obličky, 7,0 % (32) sa podrobilo v poradí druhej transplantácii obličky. V poradí tretia transplantácia sa vyskytla u 3 pacientov, čo predstavovalo 0,7 % a u 1 pacienta išlo o v poradí štvrtú transplatáciu (0,2 %).
92,3 % (422) respondentov dostalo obličku od mŕtveho darcu a 7,7 % (35) pacientov od žijúceho darcu. Z toho bolo 50,1 % (229) transplantovaná ľavá oblička a v 49,9 % (228) pravá oblička. Anatomicky bolo najviac obličiek − 77,7 % (355) s 1 tepnou, 19 % (87) s 2, 2,4 % (11) s 3 a 0,7 % (3) so 4 tepnami. V drvivom počte – 93,6 % (428) bola prítomná 1 žila, 6,1 % (28) obličiek darcu malo 2 žily a len 0,2 % (1) darovaných obličiek s 3 žilami. Iba v 1,1 % (5) pacientov sa vyskytli 2 uretery na donorskej obličke. Doba studenej ischémie bola u 22,1% (n=101) pacientov kratšia ako 12 hodín a u 77,9 % (n=356) trvala viac ako 12 hodín.
Plastika tepny bola prevedená u 22,3 % (102) pacientov, z toho tepny našité samostatne boli v 5,5 % (25), na spoločnom terčíku 9,4 % (43) a v 7,4 % (34) bola plastika realizovaná ako implantácia pólových renálnych artérií do hlavného kmeňa (Graf 2).
Graf 2. Druh operačného výkonu (výskyt v %) Graph 2: Type of surgery ( prevalence in %) 
Hodnoty urey a kreatinínu vo vzťahu k typu nástupu funkcie štepu
Hodnoty kreatinínu a urey merané pred zákrokom sa štatistiky významne nelíšili (ani ako kontinuálna, ani ako kategoriálna premenná) podľa typu nástupu funkcie štepu. Opačná situácia nastala v týchto hodnotách pri prepustení (viď Tab. 1). Neskorší nástup funkcie štepu, prípadne jeho zlyhanie sa odrazilo aj na štatisticky významne odlišných (horších) hodnotách urey a kreatinínu pri prepustení (p<0,001).
Tab. 1. Porovnanie priemerných hodnôt kreatinínu a urey pred Tx a po prepustení v skupine pacientov s okamžitým, oneskoreným nástupom alebo bez nástupu funkcie štepu (ANOVA) Tab. 1: A comparison of average values of creatinine and urea before transplantation and after discharge among patients with immediate , delayed onset or without the onset of graft function (ANOVA) 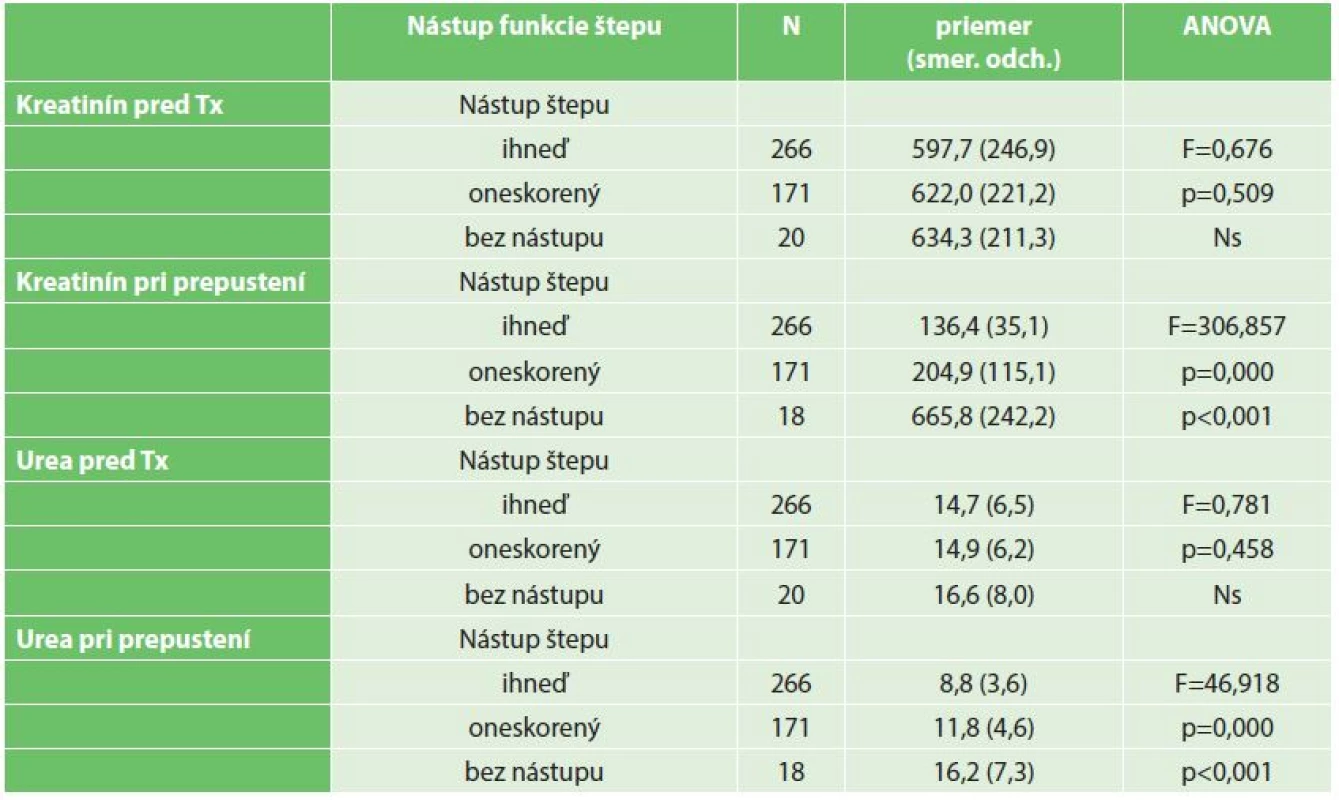
Skupiny pacientov podľa druhu operačného výkonu sa štatisticky významne nelíšili v hodnotách kreatinínu ani urey pred výkonom ani v čase prepustenia po transplantácii obličky. Obdobne sa skupiny pacientov sa štatisticky významne nelíšili podľa druhu operačného výkonu a doby studenej ischémie v hodnotách kreatinínu po transplantácii. Avšak, porovnaním skupiny pacientov podľa druhu operačného výkonu a doby studenej ischémie sme potvrdili štatisticky významný rozdiel v hodnotách urey po výkone transplantácie (viď Tab. 2). Skupina bez plastiky s dobou studenej ischémie viac ako 12 hodín mala štatisticky významne vyššie hodnoty urey pri prepustení v porovnaní so skupinou pacientov, u ktorých nebola vykonaná plastika ale transplantácia bola vykonaná do 12 hodín (p<0,05).
Tab. 2. Porovnanie priemerných hodnôt urey v skupinách pacientov rozdelených podľa druhu operačného výkonu a doby studenej ischémie (ANOVA, Scheffeho post hoc test) Tab. 2: A comparison of average values of urea in patient groups divided according to type of surgery and duration of cold ischemia (ANOVA, Scheffeho post hoc test) 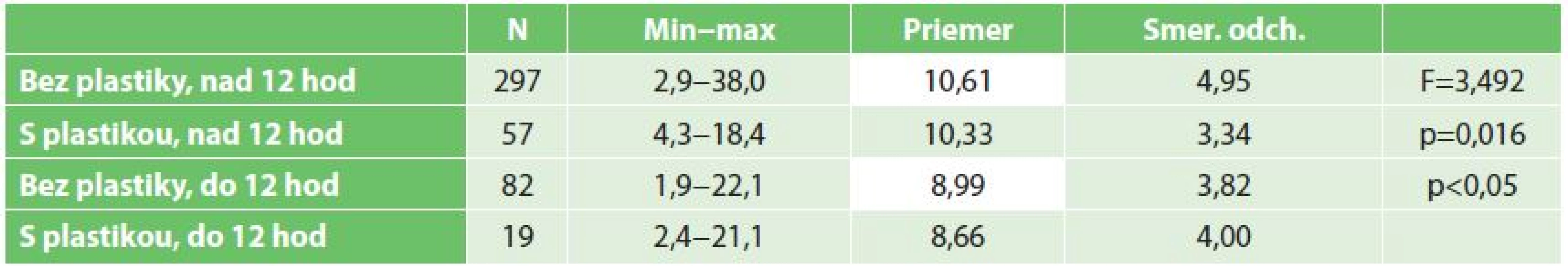
Súvislosť typu operačného výkonu, pohlavia či veku s rizikom oneskoreného nástupu, alebo zlyhania nástupu funkcie štepu sme nepotvrdili. Na druhej strane, dlhšia doba studenej ischémie bola štatisticky významne asociovaná s nástupom funkcie štepu. Transplantovaní pacienti s dobou studenej ischémie viac ako 12 hodín mali 2 a pol krát vyššiu šancu (OR=2,49/ CI: 1,50-4,13) oneskoreného nástupu, alebo zlyhania funkcie štepu oproti tým, u ktorých bola doba studenej ischémie kratšia ako 12 hodín (viď Graf 3).
Graf 3. Výskyt oneskoreného nástupu alebo zlyhania nástupu funkcie štepu v skupinách pacientov podľa typu operačného zákroku a podľa doby studenej ischémie (v % ) Graph 3: The occurrence of delayed onset or the onset of graft function failure in the patient groups according to the type of surgical procedure, and the time of cold ischemia ( in % ) 
Druh operačného výkonu a nástup funkcie štepu
Pacienti, u ktorých nebola vykonaná plastika, ale doba studenej ischémie bola do 12 hodín mali viac než 2krát nižšiu šancu (OR/CI: 0,43/0,25-0,75) oneskoreného nástupu, alebo zlyhania funkcie štepu oproti respondentom s dobou studenej ischémie nad 12 hodín, ale bez nutnosti vykonania plastiky. Podobne pacienti, u ktorých bola doba studenej ischémie menej 12 hodín a bola vykonaná plastika mali 4 a pol krát nižšiu šancu (OR/CI: 0,22/0,06–0,79) oneskoreného nástupu, alebo zlyhania funkcie štepu oproti respondentom s dobou studenej ischémie nad 12 hodín, ale bez nutnosti vykonania plastiky.
Druh operačného výkonu, doba studenej ischémie, komorbidita a nástup funkcie štepu
Pacienti s dobou studenej ischémie nad 12 hod mali 2,42x vyššiu pravdepodobnosť a pacienti s komorbiditou (ICHS/DM) mali 1,65x vyššiu pravdepodobnosť oneskoreného nástupu funkcie, alebo zlyhania štepu v porovnaní s pacientmi s kratšou dobou studenej ischémie a bez komorbidity. Interakcia vplyvu druhu operačného výkonu a komorbidity nebola štatisticky významná. Inými slovami druh operačného výkonu štatisticky významne nesúvisel s nástupom funkcie štepu, ani keď bol hodnotený zvlášť v skupine s a bez komorbidity (Graf. 4).
Graf 4. Výskyt oneskoreného nástupu funkcie štepu alebo zlyhania nástupu funkcie štepu v skupinách rozdelených podľa druhu operačného výkonu a prítomnosti komorbidity (ICHS/DM) (v %) Graph 4: The occurrence of delayed onset graft function or failure of the onset of graft function in groups divided according to type of surgery and the presence of comorbidities (CHD / DM ) (in %) 
Druh operačného výkonu a priemerné hodnoty kreatinínu po 3 mesiacoch a po roku
Pre účely tejto analýzy sme za zhoršený nástup funkcie štepu považovali hodnoty kreatinínu nad 150, alebo revíziu, dialýzu, respektíve graftektómiu. Súvislosť typu operačného výkonu a doby studenej ischémie s výskytom zhoršenej funkcie štepu po 3 mesiacoch, respektíve po 1 roku sme nepotvrdili (Graf 5). Muži majú v porovnaní so skupinou žien, približne 2x vyššiu šancu mať zhoršenú funkciu štepu po 3 mesiacoch aj po 1 roku od KTx.
Pacienti, u ktorých bola vykonaná plastika (na spoločnom terčíku + implantácia pólových renálnych artérií do hlavného kmeňa) mali v priemere nižšie hodnoty kreatinínu v meraní po 3 mesiacoch (129,66 vs 138,98), aj po 1 roku od transplantácie (128,98 vs 133,13), rozdiely ale neboli štatisticky významné.
Graf 5. Výskyt zhoršenej funkcie štepu po 3 mesiacoch a po 1 roku v skupinách pacientov rozdelených podľa druhu operačného výkonu a doby studenej ischémie Graph 5: Frequency of decreased graft function after 3 months and after 1 year in patient groups divided according to the type of surgery and duration of cold ischemia 
Druh operačného výkonu, doba studenej ischémie, GFR a kategórie CKD
V skupinách pacientov rozdelených podľa druhu operačného výkonu a doby studenej ischémie sme potvrdili štatisticky významné rozdiely v hladine GFR po 3 mesiacoch (ANOVA), ale iba medzi skupinami bez plastiky (iba 1 artéria alebo AA na spoločnom terčíku) s dobou studenej ischémia nad 12 hodín a do 12 hodín (Sheffeho test). Dlhšia doba studenej ischémie súvisela s vyšším stupňom CKD v skupinách bez plastiky.
Pacientov sme v nasledujúcom kroku na základe hodnoty GFR rozdelili do 5 kategórii CKD po 3 mesiacoch od KTx a následne sme stupne G1-G5 CKD a graftektómiu stratifikovali do 4 kategórií (CKD 1: G1+G2, CKD2: G3+G4 a CKD3: G5 a graftektómia).
Doba studenej ischémie súvisí s hodnotami kreatinínu aj po 3 mesiacoch (prepočítaných do CKD kategórií), kým súvislosť s vykonaním cievneho operačného výkonu sa nám nepodarilo potvrdiť. Pacienti, ktorí mali dobu studenej ischémie kratšiu ako 12 hodín mali 1,7x (1/0,6) nižšiu pravdepodobnosť mať hodnoty kreatinínu v skupine CKD2 (1,0 >GFR ≥0,5) než v skupine CKD1(GFR ≥1,0) a 12,5x (1/0,08) nižšiu pravdepodobnosť mať hodnoty kreatinínu v skupine CKD3 (0,5 >GFR) než v skupine CKD1(GFR ≥1,0) v porovnaní s pacientami, ktorí mali dobu studenej ischémia dlhšiu ako 12 hodín (viď Graf 5). Zároveň, ale mali 3,4x vyššiu šancu, že podstúpia graftektómiu . Avšak s ohľadom na veľmi nízke počty pacientov, najmä v skupine s plastikou je potrebné dané zistenie interpretovať s veľkou opatrnosťou.
Diskusia
Cieľom tejto práce bola analýza benefitu pacientov po transplantácií obličky s vyhodnotením významu rozličných chirurgických techník a posúdením skúsenosti I. Chirurgickej kliniky UNLP a Lekárskej fakulty UPJŠ v Košiciach s transplantáciami obličiek (nielen od mŕtvych, ale aj žijúcich darcov) s viacpočetnými artériami.
Retrospetívne sme sledovali 457 pacientov, ktorí podstúpili transplantáciu obličky v rokoch 2005−2015 na I. Chirurgickej klinike UNLP a Lekárskej fakulty Univerzity P. J. Šafárika v Košiciach.
Oblička bola transplantovaná od mŕtvého alebo žijúceho darcu. U každej sme kontrolovali anatomické štruktúry, celistvosť intimy tepny i žily, prítomnosť akcesórnych tepien, efektívnosť preplachu. Ak akcesórne tepny neboli poškodené a neboli ďaleko od ústia hlavnej tepny, ponechali sme ich na spoločnom terčíku. Ak boli vzdialené, poškodené alebo oddelené, všívali sme ich do hlavnej artérie „end to side“, alebo sme ich rekonštruovali pomocou cievnych alotransplantátov (najčastejšie iliackých ciev), alebo autotransplantátov odobratých od príjemcu (arteria epigastrica inferior alebo vena saphena magna) (Frankovičová, et al., 1995 [18].
V našom súbore bola plastika tepny robená u 22,3 % (102) pacientov, z toho tepny našité samostatne boli v 5,5 % (25), na spoločnom terčíku 9,4 % (43) a v 7,4 % (34) bola plastika realizovaná ako implantácia pólových renálnych artérií do hlavného kmeňa.
Anatomicky bolo najviac obličiek s 1 tepnou (77,7 %), 19 % s 2 tepnami, 2,4 % s 3 tepnami a 0,7 % so 4 tepnami. V drvivom počte – 93,6 % bola prítomná 1 žila, 6,1 % obličiek darcu malo 2 žily a len 0,2 % darovaných obličiek malo 3 žily. Iba v 1,1% pacientov sa vyskytli 2 uretery na donorskej obličke.
Mnohí autori udávajú incidenciu viacerých renálnych artérií v rozmedzí od 18 % do 30 % (Suthanthiran, et al., 1994 ; Navrátil, et al., 2005 ; Viklický, et al., 2008, Zvara, et al., 1973;) [4,6,7,9]
Incidencia u pacientov Aydinovej štúdie z roku 2014 s renálnymi transplantátmi bola 12,8 %. Autori retrospektívne hodnotili 225 dospelých obličkových transplantátov. 29 pacientov (12,8 %) mali štepy s viacerými renálnymi artériami. Pre rekonštrukciu viacerých renálnych artérií opisuje Aydin a kol. rozličné techniky (Aydin, et al., 2004) [15]. Doteraz sa však žiadna z rekonštrukčných techník nedokázala ako najlepšia s poukázaním na komplikácie a mieru prežívania štepu. Ani táto štúdia nepreukázala žiadne signifikantné rozdiely u štepov a pacientov medzi alograftami s viacerými a jednou artériou. Ak to bolo vhodné, uprednostňovali Aydin a kol. spájanie artérie extrakorporálne ako jednu renálnu artériu, aby sa vytvoril spoločný terčík. U alograftov s viacerými renálnymi artériami taktiež nedemonštrovali signifikantné rozdiely v prežívaní štepov u pacientov s rozličnými technikami rekonštrukcie. Priemerný systolický krvný tlak, hladiny kreatinínu v prvom roku a pri poslednom sledovaní a miera komplikácií boli v akceptovateľnom rozmedzí (Aydin, et al. 2004) [15].
V našom súbore prevažovalo mužské pohlavie s percentuálnym zastúpením (58,4 %). Až 92,1% respondentov podstúpilo prvú transplantáciu obličky, 7,0 % sa podrobilo v poradí druhej transplantácii obličky. V poradí tretia transplantácia sa vyskytla u 0,7% pacientov a u 1 pacienta išlo o v poradí štvrtú transplantáciu (0,2 %). Z komorbidít sme najčastejšie dokumentovali : artériovú hypertenziu (92,6 %), ICHS (22,8 %), diabetes mellitus 1. a 2. typu (3,9 %) a v 3,7 % prípadov anémiu z renálnych príčin. 92,3 % respondentov dostalo obličku od mrtvého darcu a 7,7 % pacientov od žijúceho darcu. Nástup funkcie štepu bol okamžitý u 58,2 % pacientov, oneskorený u 37,4 % pacientov a zlyhal v 4,4 % prípadov.
Ďalej sme v štúdii retrospektívne sledovali a hodnotili priemerné hodnoty urey a kreatinínu pred KTx, pri prepustení, po 3. mesiaci a po 1. roku po transplantácii. Tieto hodnoty namerané pred KTx sa štatistiky významne nelíšili, avšak hodnoty sledovaných premenných po emisii pacientov po KTx štatisticky signifikantne poukazovali na neskorší nástup funkcie, prípadne zlyhanie obličky. Druh vykonanej plastiky pri transplantácii štatisticky nemal vplyv na zmeny hodnôt urei, kreatinínu.
Hodnoty urey a kreatinínu sú odrazom funkcie obličky (Jafri, et al., 2009) [19]. Z tohto dôvodu, ak berieme do úvahy daný fakt, že pacienti, ktorý podstupujú KTx sú v koncovom štádiu CKD s potrebou eliminačnej liečby, výsledky analýz nám adekvátne nepotvrdili vzťah medzi týmito hodnotami a nástupom funkcie štepu (Seghal, 2002) [3]. Avšak, po úspešnej transplantácii v čase prepustenia sú už parametre funkčnosti obličky štatisticky významne asociované s nástupom funkcie štepu, keďže je medzi nimi lineárny vzťah (Jafri, et al., 2009) [19]. S tým súvisí aj potvrdenie obrátenej štatisticky významnej asociácie medzi neskorším nástupom funkcie štepu, prípadne jeho zlyhaním a vyššími hodnotami urey a kreatinínu v čase prepustenia. Danú štatisticky významnú asociáciu sme preukázali aj medzi hodnotami urey a kretinínu s druhom operačného výkonu.
Pri porovnaní skupín pacientov podľa typu vykonanej plastiky sme potvrdili štatisticky signifikantný rozdiel v hodnotách urei po KTx. A síce skupina transplantovaných pacientov s dobou studenej ischémie viac ako 12 hodín mala štatisticky významne vyššie hodnoty urei pri emisii, v porovnaní s pacientami, u ktorých síce plastika vykonaná nebola, ale doba studenej ischémie obličky bola menej ako 12 hodín (p<0,05).
V rámci tejto práce sme potvrdili význam vykonávania rekonštrukcie ciev v obličkách darcov, ktoré nesúviselo s pohlavím a vekom, ale so sérovou hladinou urey. Skupina bez plastiky, s dobou studenej ischémie nad 12 hodín mala štatisticky významne vyššie hodnoty urey pri prepustení v porovnaní so skupinou pacientov, u ktorých nebola vykonaná plastika, ale transplantácia bola realizovaná do 12 hodín. Na strane druhej, asociáciu medzi hladinou kreatinínu pri prepustení a druhom operačného výkonu sme potvrdili len v skupine pacientov so závažnou komorbiditou v zmysle ischemickej choroby srdca a/alebo diabetom. Navyše sme dokázali aj vzťah medzi dlhšou dobou studenej ischémie a nástupom funkcie štepu.
Pacienti po transplantácii obličky s dobou studenej ischémie viac ako 12 hodín mali 2,5krát vyššie riziko oneskoreného nástupu, respektíve zlyhania funkcie štepu oproti tým, u ktorých bola doba studenej ischémie kratšia ako 12 hodín. Pacienti, u ktorých síce nebola vykonaná plastika, ale doba studenej ischémie bola do 12 hodín, mali viac ako 2x nižšie riziko oneskoreného nástupu, alebo zlyhania funkcie štepu oproti respondentom s dobou studenej ischémie nad 12 hodín, ale bez nutnosti vykonania plastiky. Daný výsledok vysvetľuje dôvody pre skrátenie studenej ischémie na minimum.
Avšak, izolovaná plastika ciev nebola nezávisle asociovaná s funkciou štepu pri hodnotení bez doby studenej ischémie a komorbidít. Tieto výsledky ponúkajú ideálnu možnosť, ktorou je súčasne sa vyskytujúca doba studenej ischémie pod 12 hodín a realizácia plastiky obličkovej tepny. V danom prípade riziko oneskoreného nástupu funkcie transplantovanej obličky, respektíve zlyhanie štepu klesne 4,5krát oproti respondentom s dobou studenej ischémie nad 12 hodín bez vykonania plastiky. Z daných analýz vyplýva dôležitý poznatok profitovania z rekonštrukcií ciev obličky darcu, pričom benefit stúpa viac u pacientov s komorbiditou, ako bez nej (Levey 2010; Sis 2010) [13,14].
Na druhej strane, nielen samotná dlhšia doba studenej ischémie a nerealizácia plastiky tepny obličky darcu, ak sú pre ňu možnosti, zvyšujú riziko oneskoreného nástupu, resp. straty funkcie štepu, ale aj komorbidity. Pacienti s komorbiditou v zmysle ischemickej choroby srdca a diabetu prvého a/alebo druhého typu mali takmer 2násobne vyššiu pravdepodobnosť oneskoreného nástupu funkcie štepu, alebo jeho zlyhania v porovnaní s pacientami s kratšou dobou studenej ischémie a bez komorbidity.
Asociácia medzi funkciou obličky (meranou podľa sérovej hodnoty kreatinínu) po prvom roku od KTx a vykonanou plastikou a/alebo kratšou dobou studenej ischémie nebola potvrdená. Pre dané výsledky svedčí fakt, že po stabilizačnom období troch mesiacov nie je v popredí aspekt chirurgickej intervencie. V danom období je dôležitým faktorom zachovanej funkcie obličky adekvátna imunosupresia, neprítomnosť infekčných, rejekčných a iných komplikácií (Abecassis 2008) [1]. Výsledky v súvislosti so štatisticky významnou asociáciou medzi mužským pohlavím a zhoršením funkcie štepu potvrdzujú viacerí autori (Franke 2003; Benjamins 2004) [16,17]. V našom súbore sme demonštrovali, že muži majú v porovnaní so ženským pohlavím približne 2-krát vyššiu šancu na zhoršenie funkcie štepu po 3 mesiacoch, ako aj po 1 roku od KTx.
Štatisticky významné rozdiely sme potvrdili len v kontrolných skupinách bez plastiky s rozdielnou dobou studenej ischémie v 3. mesiaci po transplantácii. Kontrolná skupina bez plastiky s dobou studenej ischémie do 12 hodín mala štatisticky významné nižšie priemerné hodnoty kreatinínu po 3 mesiacoch od vykonania transplantácie v porovnaní s kontrolnou skupinou s dobou studenej ischémie nad 12 hodín. Napriek tomu, že sme nepreukázali žiadnu inú významnú asociáciu medzi funkciou štepu a vykonaním plastiky, resp. dobou studenej ischémie po 1. roku od KTx, na základe získaných výsledkov registrujeme tendenciu vývoja hladiny kreatinínu, pričom najnižšie priemerné hodnoty po 3 mesiacoch mali pacienti, u ktorých bola doba studenej ischémie do 12 hodín a mali iba jednu artériu, alebo im nebola vykonaná plastika. Avšak, ak doba studenej ischémie bola nad 12 hodín, najnižšie priemerné hodnoty kreatinínu po 3 mesiacoch mali naopak pacienti, u ktorých bola plastika realizovaná. Priemerné hodnoty kreatinínu po 1 roku od transplantácie mali bez ohľadu na dobu studenej ischémie pacienti, u ktorých bola vykonaná implantácia pólových renálnych artérií do hlavného kmeňa a v skupine nad 12 hodín u tých, ktorým bola vykonaná plastika.
Po stratifikovaní súboru sme potvrdili štatisticky významné rozdiely medzi jednotlivými kategóriami CKD po 3 mesiacoch, ale iba medzi skupinami bez plastiky s dobou studenej ischémie nad 12 hodín a do 12 hodín. Dlhšia doba studenej ischémie súvisela s vyšším stupňom CKD v skupinách bez plastiky. Na druhej strane, súvislosť medzi vykonaním cievneho operačného výkonu a jednotlivými kategóriami CKD sa nám potvrdiť nepodarilo.
Záver
V rámci štúdie sme potvrdili význam vykonávania rekonštrukcie ciev na obličkách darcov, ktoré nesúviselo s pohlavím a vekom, ale so sérovou hladinou urey. Skupina pacientov, u ktorej nebola vykonaná plastika, s dobou studenej ischémie viac ako 12 hodín mala štatisticky významne vyššie hodnoty urey pri prepustení v porovnaní so skupinou chorých, u ktorých plastika vykonaná nebola, ale transplantácia bola realizovaná do 12 hodín. Avšak asociáciu medzi hladinou kreatinínu pri prepustení a druhom operačného výkonu sme potvrdili len v skupine chorých so závažnou komorbiditou v zmysle ischemickej choroby srdca a/alebo diabetom. Preukázali sme aj vzťah medzi dlhšou dobou studenej ischémie a nástupom funkcie štepu.
Štatisticky významné rozdiely sme potvrdili len v kontrolných skupinách bez plastiky s rozdielnou dobou studenej ischémie v 3. mesiaci po transplantácii. Kontrolná skupina bez plastiky s dobou studenej ischémie viac ako 12 hodín mala štatisticky významne nižšie priemerné hodnoty kreatinínu po 3 mesiacoch od vykonania transplantácie v porovnaní s kontrolnou skupinou s dobou studenej ischémie viac ako 12 hodín. Napriek tomu, že sme nepreukázali žiadnu inú významnú asociáciu medzi funkciou štepu a vykonaním plastiky, resp. dobou studenej ischémie po 1. roku od transplantácie obličky, na základe získaných výsledkov registrujeme tendenciu vývoja hladiny kreatinínu, pričom najnižšie priemerné hodnoty po 3 mesiacoch mali pacienti, u ktorých bola doba studenej ischémie do 12 hodín s jednou artériou, alebo im nebola vykonaná plastika. Avšak, ak doba studenej ischémie bola nad 12 hodín, najnižšie priemerné hodnoty kreatinínu po 3 mesiacoch pretrváva naopak u chorých, u ktorých bola plastika realizovaná. Priemerné hodnoty kreatinínu po 1 roku od transplantácie sme zistili bez ohľadu na dobu studenej ischémie chorých, u ktorých bola vykonaná implantácia pólových renálnych artérií do hlavného kmeňa a v skupine nad 12 hodín u tých, ktorým bola vykonaná plastika.
Silnou stránkou práce je súhrnné spracovanie transplantovaných pacientov v období desiatich rokov v rámci jedného transplantačného centra na Slovensku s majoritným vykonávaním transplantácií obličky. Longitudinalita spracovania dát posilňuje výpovednú hodnotu výsledkov.
Konflikt záujmov
Autori článku vyhlasujú, že nie sú v súvislosti so vznikom tohto článku v konflikte záujmov a že tento článok nebol publikovaný v žiadnom inom časopise.MUDr. Peter Zavacký
I. Chirurgická klinika UNLP a LF UPJŠ
Tr. SNP č. 1
040 11 Košice
e-mail: peterzavacky963@gmail.com
Zdroje
1. Abecassis M, Bartlett ST, Collins AJ, et al. Kidney transplantation as primary therapy for end-stage renal disease: A National Kidney Foundation/Kidney Disease Outcomes Quality Initiative (NKF/KDOQITM) Conference. Clin J Am Soc Nephrol 2008;3 : 471−80.
2. Port FK, Wolfe RA, Mauger EA, et al. Comparison of survival probabilities for dialysis patients vs cadaveric renal transplant recipients. JAMA 1993;270 : 1339−43.
3. Sehgal AR. What is the best treatment for end-stage renal disease? Am J Med 2002;112 : 735−6.
4. Suthanthiran M, Strom TB. Renal transplantation. N Engl J Med 1994; 331 : 365−76.
5. Allen RDM, Chapman JR. The surgical procedure. In: Allen RDM, Chapman JR. Manual of renal transplantation. 1st ed. Oxford , Oxford University Press 1994 : 68−89
6. Navrátil P. Praktická urológia u nemocných v dialyzační léčbe, před a po transplantaci ledviny. Hradec Králové, vydavatelství Oľga Čermáková 2005.
7. Viklický O, Janoušek L, Baláž P, et al. Transplantace ledviny v klinické praxi. Praha, Grada 2008.
8. Zvara V, Řezníček J. Možnosti aktívnej liečby terminálneho štádia chronickej nedostatočnosti obličiek chronickou hemodialýzou a transplantáciou obličiek. Lek Obzor 1973;22 : 489.
9. Krylov VS, Stepanov GA, Acchurin RS, et al. Autovenosus plasty of vessels in emergenc surgery. Klin Khir 1983;7 : 30−3.
10. Mohamed HK, Anil AT, Ponusamy MH, et al. Renal vessel reconstruction in kidney transplantation using a polytetrafluor ethylene (PTFE) vascular graft. Journal of surgical case reports. 2007;22 : 1030−2.
11. Tzakis AG, Mazzaferro V, Pan CE, et al. Renal artery reconstruction for harvesting injuries in kidney transplantation with particular reference to the use of vascular allografts. Transpl Int 1988;9 : 80−5.
12. Campbell-Walsh Urology: Preparation of kidney graft. Saunders 2007.
13. Levey AS, Stevens LA. Estimating GFR using the CKD Epidemiology Collaboration (CKD-EPI) creatinine equation: More accurate GFR estimates, lower CKD prevalence estimates, and better risk predictions. Am J Kidney Dis 2010;55 : 622−7.
14. Sis B, Mengel M, Haas M, et al. Banff ‘09 meeting report: Antibody mediated graft deterioration and implementation of banff working groups. Am J Transplant 2010;10 : 464−71.
15. Aydin NM, Berber I, Altaca G, et al. The outcome of kidney transplants with multiple renal arteries. BMC surgery 2004;4 : 4−8.
16. Benjamins MR, Hummer RA, Eberstein IW, et al. Self-reported health and adult mortality risk: An analysis of cause-specific mortality. Soc Sci Med 2004; 59 : 1297−1306.
17. Franke GH, Reimer J, Philipp T, et al. Aspects of quality of life through end-stage renal disease. Qual Life Res 2003;12 : 103−15.
18. Frankovičová M, Bober J, Arendarčík F, et al. Rekonštrukčné operácie v našom klinickom materiáli. Bratislavské lekárske listy 96 1995;12 : 658−60.
19. Jafri SSA, Younas M, Chughtai MN, et al. Surgical aspect and outcomes of kidney transplantation with multiple renal arteries. In Annals 2009;15 : 122−8.
Štítky
Chirurgia všeobecná Ortopédia Urgentná medicína
Článek Personalizovaná medicína?Článek Jubileum
Článok vyšiel v časopiseRozhledy v chirurgii
Najčítanejšie tento týždeň
2016 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Personalizovaná medicína?
- Léčba akutní pooperační bolesti po torakotomii – současné možnosti
- Jubileum
- Přežívání pacientů s radikálně neresekabilním karcinomem pankreatu
- Laparoskopická resekční rektopexe v léčbě obstrukčního defekačního syndromu
- Cievne plastiky a úpravy ciev u pacientov pri transplantácii obličiek v 10 ročnom sledovaní
- Alveolární echinokokóza – vzácné onemocnění s problematickou diferenciální diagnostikou
- Videothorakoskopické odstranění mediastinálně uloženého adenomu příštítného tělíska při primární hyperparathyreóze
- Intraparietální hemoragie tenkého střeva při antikoagulační terapii pacienta jako neobvyklá příčina hemoperitonea
-
Odcházení v chirurgii 2
k editorialu Odcházení v chirurgii, Rozhl Chir 5;96:175−176
- Rozhledy v chirurgii
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Laparoskopická resekční rektopexe v léčbě obstrukčního defekačního syndromu
- Cievne plastiky a úpravy ciev u pacientov pri transplantácii obličiek v 10 ročnom sledovaní
- Léčba akutní pooperační bolesti po torakotomii – současné možnosti
- Videothorakoskopické odstranění mediastinálně uloženého adenomu příštítného tělíska při primární hyperparathyreóze
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



