-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Solidní pseudopapilární tumor pankreatu
Solid pseudopapillary neoplasms of the pancreas
Introduction:
Solid pseudopapillary neoplasm (SPN) is a very rare neoplasm that occurs in girls and young women in 90% of cases; the range is 7−79 years of age, and the median is 28 years of age. This tumour was first described by Virginia Frantz in 1959 as a papillary cystic tumour of the pancreas.Methods:
The aim of this retrospective study was to analyse the incidence of SPN in all patients with a pancreatic tumour operated at the 1st Dept. of Surgery, University Hospital Olomouc between years 2006 and 2015. Clinical symptoms, imaging methods used, tumour marker positivity, histological findings, postoperative complications and disease-free interval were all evaluated.Results:
Of the 454 patients operated on between 2006−2015, the diagnosis of SPN was made in five female patients. The following imaging methods were used in the preoperative diagnostic process: CT, MRI, PET/CT and endosonography. In four patients the tumour was localised in the tail of the pancreas; these women underwent left-sided pancreatectomy. In one patient, the tumour was located in the pancreatic head and a pylorus-preserving pancreaticoduodenectomy was performed. Complications were seen only in one patient who underwent revision on the first postoperative day for bleeding from the pancreatic cut surface. Pancreatic fistula was not observed in any of the patients. The procedures were considered as sufficient from the oncological viewpoint due to the radical resection procedure and negative resection margin, and therefore no adjuvant oncological treatment was indicated in any of the patients. During the follow-up period, recurrence was not observed in any one of the patients.Conclusion:
Solid pseudopapillary neoplasm of the pancreas is a rare disorder with a low malignant potential occurring primarily in young women. Generally, SPN has a good prognosis; however, advanced stages of the disease with distant metastases may be encountered in rare cases. The only curative treatment is radical surgical resection.Key words:
solid pseudopapillary neoplasm − Frantz’s tumour − pancreas
Autori: J. Tesaříková 1; M. Loveček 2; Č. Neoral 1,2; K. Vomáčková 2; L. Bébarová 1; P. Skalický 2
Pôsobisko autorov: I. chirurgická klinika FN Olomouc, přednosta: prof. MUDr. Č. Neoral, CSc. 1; I. chirurgická klinika LF Univerzity Palackého, Olomouc, přednosta: prof. MUDr. Č. Neoral, CSc. 2
Vyšlo v časopise: Rozhl. Chir., 2017, roč. 96, č. 4, s. 163-167.
Kategória: Původní práce
Súhrn
Úvod:
Solidní pseudopapilární neoplazie (SPN) patří mezi vzácná onemocnění, která se v 90 % vyskytují u dívek a mladých žen, věkové rozmezí je mezi 7. a 79. rokem života, medián je 28 let. Poprvé tento tumor popsala roku 1959 Virginia Frantz jako papilární cystický tumor pankreatu.Metody:
Cílem této retrospektivní studie bylo analyzovat výskyt SPN u všech pacientů operovaných na I. chirurgické klinice FN Olomouc pro tumor pankreatu v období 2006−2015. Studie byla zaměřena na hodnocení klinických příznaků, lokalizaci a velikost tumoru, využité zobrazovací metody, tumor markery, histologický nález, pooperační komplikace a disease – free interval.Výsledky:
Ze 454 pacientů operovaných za období 2006−2015 byla zjištěna diagnóza SPN u 5 pacientek. V rámci předoperační diagnostiky byly využity zobrazovací metody – CT, MRI, PET/CT, endosonografie. U čtyř pacientek byla lokalizace tumoru v oblasti kaudy pankreatu, tyto pacientky podstoupily levostrannou resekci pankreatu. U jedné pacientky byl tumor lokalizován v hlavě slinivky, u této nemocné byla provedena pravostranná pylorus šetřící duodenohemipankreatektomie. Komplikace byla pouze u jedné pacientky, která byla první pooperační den revidována pro krvácení z resekční plochy pankreatu. U žádné z pacientek nebyla prokázána pankreatická píštěl. Vzhledem k radikálnímu resekčnímu výkonu a negativitě resekční linie byl operační výkon z onkologického hlediska považován za dostatečný, a proto u žádné pacientky nebyla indikována adjuvantní onkologická terapie. U žádné z pacientek za sledované období nebyla zjištěna recidiva tumoru.Závěr:
Solidní pseudopapilární neoplazie pankreatu je vzácné onemocnění s nízkým maligním potenciálem vyskytující se zejména u mladých žen. SPN je onemocnění obecně s dobrou prognózou, výjimečně se ale můžeme setkat s pokročilým stadiem onemocnění a výskytem vzdálených metastáz. Za kurativní metodu se považuje radikální chirurgický resekční výkon.Klíčová slova:
solidní pseudopapilární neoplazie − Frantz tumor − pankreasÚvod
Solidní pseudopapilární neoplazie (SPN) patří mezi vzácné nádory s nízkým maligním potenciálem. Poprvé tento tumor popsala a nazvala roku 1959 Virginia Frantz jako papilární cystický tumor pankreatu [1]. Od roku 1996 byl tento tumor World Health Organization (WHO) řazen mezi tumory pankreatu a nazýván jako „solidní pseudopapilární tumor“ [2]. Roku 2010 byl překlasifikován WHO na „solidní pseudopapilární neoplazii“ a řazen mezi low-grade maligní epiteliální tumory pankreatu [3]. V literatuře bychom tento tumor našli pod různými synonymy – „solidní a cystický tumor pankreatu”, „papilárně cystický tumor”, „papilární epiteliální neoplázie” či „Frantz tumor”.
Jde o vzácný tumor, který tvoří 1−2 % všech nádorů pankreatu [4]. SPN se vyskytuje v 90 % u mladých žen ve věku mezi 20. a 30. rokem života. Vzácně se vyskytuje u mužů, méně než v 10 % případů [5,29]. Ve 20 až 25 % případů se s touto diagnózou SPN můžeme setkat i u dětských pacientů [6]. Největší doposud publikovaný soubor pacientů ze zahraniční literatury udává systematické review autorů z Baltimorské univerzity, které má sestavu 2744 pacientů s diagnózou SPN [7]. V domácí literatuře jsou dostupné práce Gürlicha a spol. a Brázdila a spol. s prezentací celkem osmi pacientek [8,9].
Metody
Cílem této retrospektivní studie bylo analyzovat výskyt SPN u všech pacientů operovaných na I. chirurgické klinice Fakultní nemocnice Olomouc pro tumor pankreatu v letech 2006–2015. Studie byla zaměřena na hodnocení klinických příznaků, věk pacientek v době diagnózy, lokalizaci a velikost tumoru, využité zobrazovací metody, tumor markery, histologický nález, pooperační komplikace a disease-free interval.
Výsledky
Na I. chirurgické klinice Fakultní nemocnici Olomouc bylo v letech 2006–2015 provedeno 454 resekčních výkonů na pankreatu. Pravostrannou duodenohemipankreatektomii nebo totální pankreatektomii pro tumor v hlavě pankreatu podstoupilo 365 pacientů, u 89 pacientů byla provedena levostranná resekce pankreatu pro tumor v oblasti těla či kaudy pankreatu. Z celkového počtu 454 pacientů byla za toto období potvrzena diagnóza SPN u 5 pacientek, tedy v 1 % případů (Tab. 1). Šlo o ženy ve věku 27 až 37 let, průměrný věk 34 let. Většina pacientek byla vyšetřována pro neurčité bolesti břicha. U čtyř žen z pěti byla lokalizace tumoru v kaudě pankreatu (Obr. 1, 2), pouze u jedné pacientky byl tumor lokalizován v hlavě pankreatu (Obr. 3). Na základě ultrasonografického vyšetření, kde byl nález tumoru v oblasti pankreatu, byly v rámci došetřování doplněny další zobrazovací metody – CT, PET/CT, MRI nebo endosonografie. Standardně odebrané tumor markery (CEA, CA 19-9, chromogranin) byly u všech pacientek negativní. U čtyř pacientek byla provedena levostranná resekce pankreatu se splenektomií a lymfadenektomií z důvodu radikality pro nejistou předoperační diagnózu. U jedné pacientky byla provedena pravostranná pylorus šetřící duodenohemipankreatektomie. Jedna pacientka byla revidována první pooperační den pro hemoperitoneum způsobené krvácením z resekční plochy pankreatu po levostranné pankreatektomii. U žádné pacientky nebyla přítomna pankreatická píštěl. Průměrná doba hospitalizace byla 16,8 dne (7−23 dní). V definitivní histologii byla ve všech případech potvrzena diagnóza SPN. U všech pacientek byl resekční výkon s ohledem na negativní resekční linie považován za radikální, proto z onkologického hlediska byla doporučena pouze dispenzarizace. Průměrná doba sledování v našem souboru pacientek je 28,8 měsíce (8−63 měsíců). Žádná z uvedených pacientek nemá známky recidivy.
Tab. 1. Klinické údaje pacientů Tab. 1: Clinical data of the patients 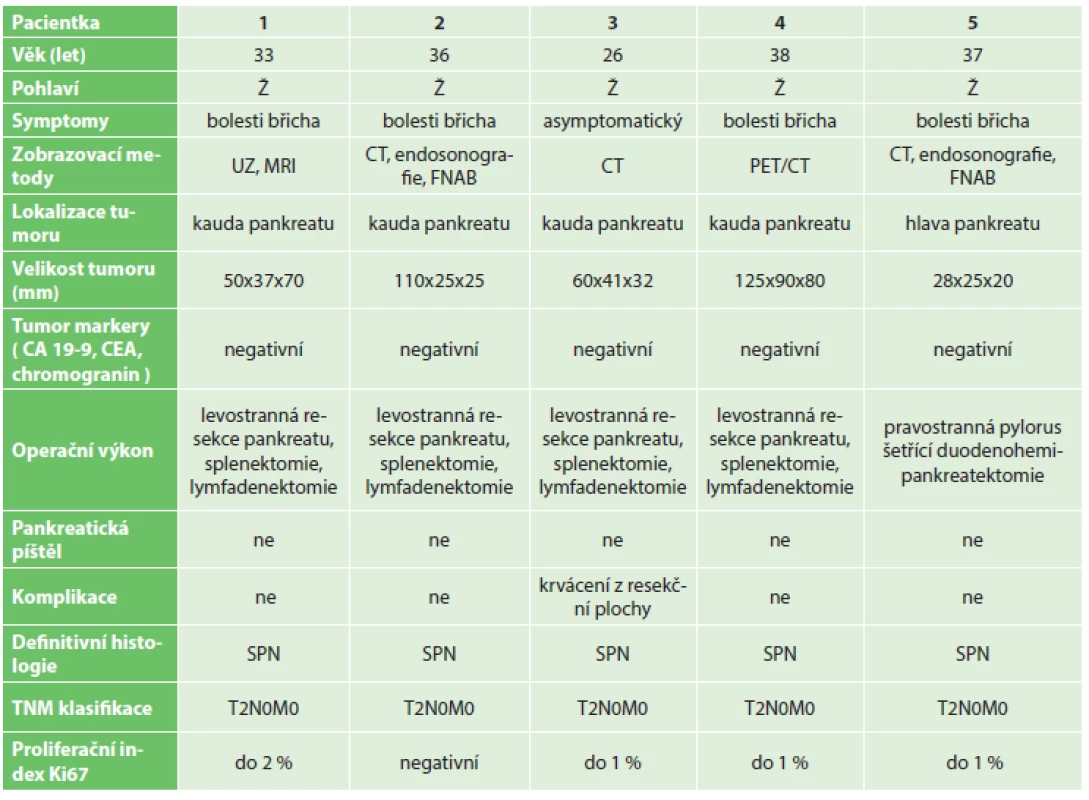
Obr. 1. CT břicha s nálezem SPN v oblasti kaudy pankreatu Fig. 1: Abdominal CT with the finding of SPN of the pancreatic tail 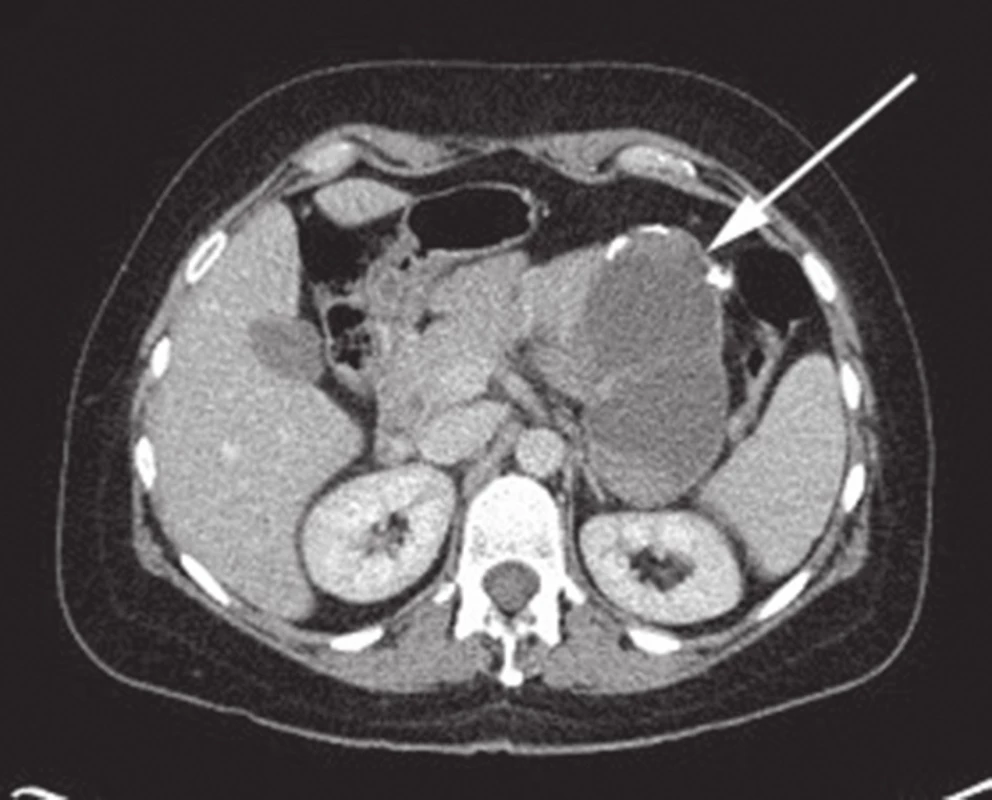
Obr. 2. MRI s nálezem SPN v oblasti kaudy pankreatu Fig. 2: Abdominal MRI with the finding of SPN of the pancreatic tail 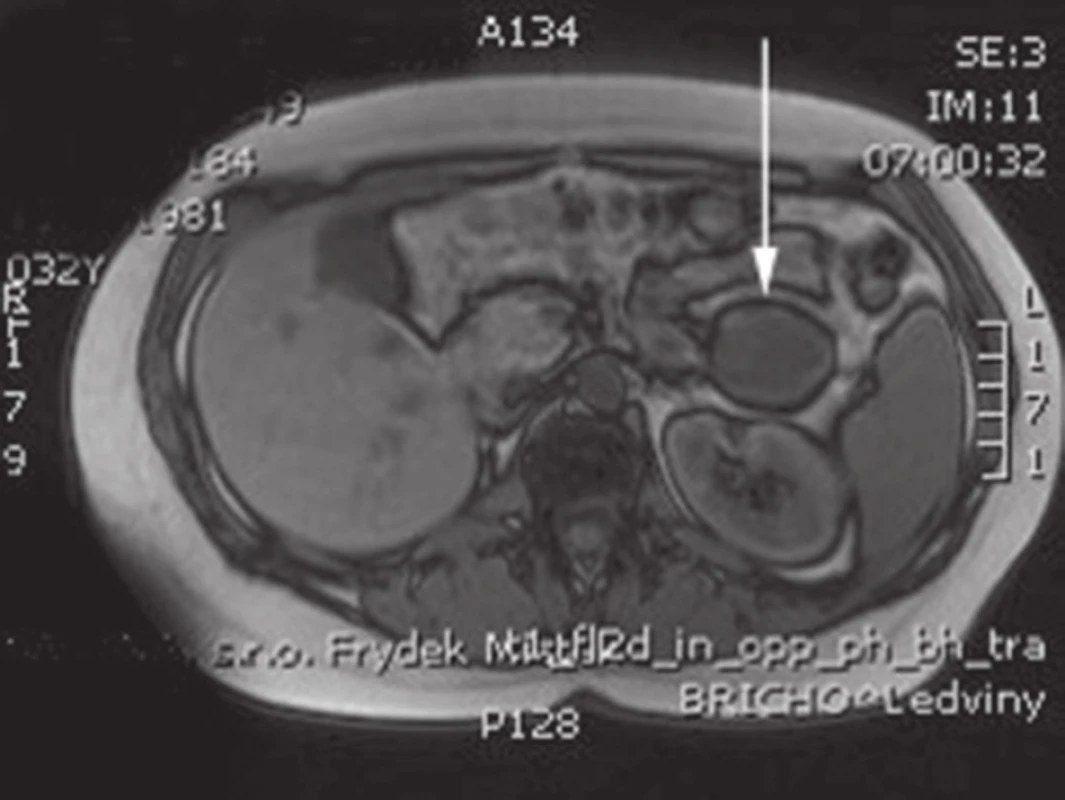
Obr. 3. CT břicha s nálezem SPN v oblasti hlavy pankreatu Fig. 3: Abdominal CT with the finding of SPN of the head of the pancreas 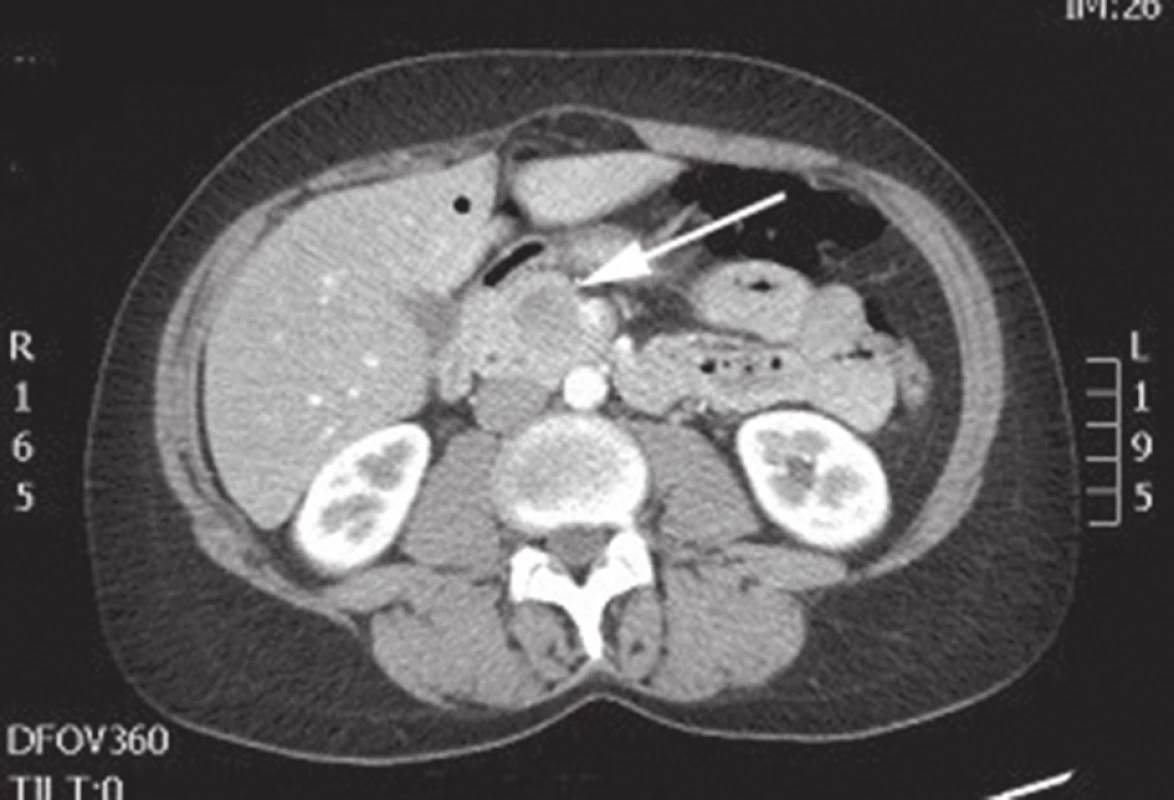
Diskuze
SPN nemá predilekční lokalizaci v rámci pankreatu [3]. Onemocnění nemá jednoznačné příznaky, může být zjištěno jako náhodný nález v rámci vyšetřování pro neurčité bolesti v nadbřišku, dyspepsie či zvracení [10]. Až ve 30 % případů může probíhat asymptomaticky [11]. U 8 % pacientů je SPN diagnostikován v rámci náhlé příhody břišní, kdy je pacient revidován pro hemoperitoneum při spontánní ruptuře pouzdra pankreatu, intratumorózním krvácení nebo při poranění břicha [11]. Velikost tumoru se pohybuje v rozmezí 1−20 cm, medián 8 cm [12]. V případě, že tumor dosahuje větších rozměrů, projevuje se jako hmatná rezistence v epigastriu nebo může způsobovat útlak okolních orgánů. Standardní biochemické vyšetření krve u pacientek, které zahrnuje amylázy, lipázy a jaterní enzymy, bývá v normě. Stejně tak bývají negativní i tumor markery – CEA, CA 19-9, CA 125 a chromogranin [13]. SPN má určité radiologické znaky, na jejichž podkladě můžeme uvažovat o této diagnóze. Na ultrasonografii se zobrazí jako dobře ohraničený, opouzdřený tumor s intraluminární hemoragickou složkou [18]. Ultrasonografie má však své limitace v rámci zobrazení pankreatu a tumor nemusí být jednoznačně prokázán. V rámci dalšího vyšetřovacího algoritmu se nejčastěji využívá CT a MRI vyšetření. Při provedení CT břicha s intravenózním podáním kontrastní látky se zobrazí tumor, který má charakter dobře ohraničené solidní a cystické léze, v centru s přítomností hemoragických nekróz [19]. MRI má vyšší přínos v rámci diferenciální diagnostiky tím, že umožňuje lepší průkaz solidní a cystické složky tumoru a hemoragickou degeneraci. Pro maligní potenciál SPN svědčí přítomnost periferní kalcifikace léze, obraz radiální centrální jizvy a zvýraznění nodulací či sept [20]. K vyloučení generalizace onemocnění můžeme využít PET/CT, kde může, ale nemusí být zvýšená akumulace glukózy v tumoru. V rámci předoperačního vyšetření máme možnost endosonografického vyšetření, kdy ve většině případů neprokazujeme prorůstání do velkých cév ani regionální lymfadenopatii. Punkční biopsie tenkou jehlou (FNAB) dává často falešně negativní výsledek, a to vzhledem k tomu, že pro SPN je charakteristická převážně hemoragicko-nekrotická složka, která může být, i když v menší míře, přítomna i u maligních lézí [21].
Předoperační stanovení diagnózy SPN je obtížné, v rámci diferenciální diagnostiky musíme pomýšlet na neuroendokrinní tumory (NET), intraduktální papilární mucinózní tumory, mucinózní cystické tumory, pseudocysty pankreatu, gastrointestinální stromální tumory (GIST), ale i na maligní nádory pankreatu, jako je cystadenokarcinom [17].
Z histopatologického hlediska představuje SPN solitární, dobře ohraničený a často opouzdřený tumor. Makroskopicky má na řezu hemoragický vzhled. Mikroskopicky převažují úseky hemoragické nekrózy, solidní partie tvořící monomorfní populaci buněk s eosinofilní cytoplazmou, agregáty pěnitých buněk a cholesterolových krystalů [3]. Imunohistochemicky je pozitivita alfa1 antitrypsinu a vimentinu. Některé studie uvádějí vzájemný vztah mezi tkání pankreatu a genitální lištou v průběhu embryonálního období. Imunohistochemicky je u většiny SPN prokázána pozitivita progesteronových receptorů, není však přítomna pozitivita a vztah tohoto tumoru k estrogenovým receptorům. Lze tedy uvažovat o hypotéze výskytu SPN u žen v důsledku přítomnosti progesteronových receptorů u tohoto typu nádoru [22]. Pozitivita alfa1 antitrypsinu, vimentinu i progesteronových receptorů byla prokázána u všech pacientek se SPN v našem souboru.
SPN má velmi dobrou prognózu, 5leté přežití je 95−100 % [6]. I přes nízký maligní potenciál SPN mohou být u 10–15 % pacientů synchronní metastázy nebo invaze do okolních orgánů. Nejčastěji SPN metastazuje do jater, peritonea, regionálních lymfatických uzlin nebo mezenteria [14].
Dle WHO klasifikace jsou definována kritéria pro maligní chování SPN, jde o angioinvazi, perineurální invazi a extrapankreatické šíření [15]. Některé studie např. Washington a spol., ukazují na další histologické znaky, jako jsou difuzní růst tumoru, žilní invaze, buněčná atypie, mitotická aktivita či přítomnost nekróz, které predikují agresivní biologické chování a metastatický potenciál SPN [16]. V našem souboru nemocných byl prokázán jediný rizikový faktor – lymfangioinvaze u jedné pacientky. Mezi nepřímé znaky maligního chování můžeme podle některých studií řadit i věk pacienta, velikost a lokalizaci tumoru. Vyšší věk nemocného, velikost tumoru větší než 6 cm a lokalizace v těle pankreatu zvyšují pravděpodobnost maligního chování nebo metastazování SPN [12].
Za kurativní metodu pro lokalizovaný SPN se považuje radikální chirurgická resekce s dosažením negativní resekční linie, kterou si můžeme již peroperačně ověřit pomocí kryostatického vyšetření. V případě lokalizace tumoru v oblasti kaudy nebo těla pankreatu se provádí levostranná resekce pankreatu se snahou o zachování sleziny. Toto řešení nemusí být vždy technicky možné s ohledem na lokální vztah tumoru ke slezině nebo slezinným cévám a splenektomie je v těchto případech z důvodů radikality nutná. Pokud je tumor lokalizovaný v hlavě pankreatu, provádí se duodenohemipankreatektomie s podmínkou dosažení negativní resekční linie [14]. Provedení extenzivní lymfadenektomie se nepovažuje za nezbytně nutné vzhledem k vzácnému výskytu metastazování SPN do lymfatických uzlin [15,29]. V našem souboru pacientek nebyla diagnóza SPN předoperačně jednoznačně určena, proto jsme u všech pacientek provedli standardní lymfadenektomii.
Některé práce uvádějí možnost enukleace tumoru u SPN. Tuto metodu bychom mohli zvažovat u velmi malých tumorů s dosažením negativních resekčních okrajů. Všeobecně se však považuje za nedostačující výkon z pohledu onkologické radikality [14,23].
Obdobné platí pro použití lokálně ablačních metod typu RFA nebo etanolové ablace [28].
Výsledky některých studií dokazují, že pacienti s lokálně pokročilým tumorem, kteří podstoupili radikální resekční výkon i za cenu cévních resekcí, mají delší dobu přežívání [24,27]. Lokální recidivu můžeme očekávat v méně než 10 % a objevuje se do 4 let od chirurgického výkonu [14]. Cheng a spol. publikovali případ dvou nemocných s lokálně pokročilým SPN, u kterých provedli radikální resekční výkon s resekcí portální a horní mezenterické žíly. Tito pacienti byli po celou dobu sledování bez známek lokální recidivy [25].
Adjuvantní onkologická léčba je vyhrazena zejména pro nemocné s lokálně pokročilým nebo metastatickým onemocněním [15]. Vzhledem k malému souboru pacientů, kteří onkologickou léčbu podstoupili, nelze jednoznačný benefit této léčby hodnotit. Na našem pracovišti jsme doposud neměli nemocnou, která by adjuvantní onkologickou léčbu musela podstoupit.
Rekurence onemocnění, lokální invaze a přítomnost metastáz se nepovažuje za kontraindikaci k resekčnímu výkonu. V případě generalizace SPN do jater je indikována chirurgická resekce, pokud je technicky možná, v opačném případě má své opodstatnění využití jiných modalit, např. transarteriální chemoembolizace (TACE), radiofrekvenční ablace (RFA) či transplantace jater [14]. Martin a spol. uvedli případ čtyř pacientů, u nichž byl primárně resekován tumor a současně i jaterní metastáza. U dvou ze čtyř pacientů byla prokázána delší doba přežití 6 a 11 let [26].
Závěr
Solidní pseudopapilární neoplazie pankreatu je vzácné onemocnění s nízkým maligním potenciálem vyskytující se zejména u mladých žen. SPN je onemocnění obecně s dobrou prognózou, výjimečně se však můžeme setkat s pokročilým stadiem onemocnění a výskytem vzdálených metastáz. Za kurativní metodu se považuje radikální chirurgický resekční výkon.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Mgr. Pavel Skalický, Ph.D.
I. chirurgická klinika LF UP Olomouc
I. P. Pavlova 6
779 00 Olomouc
e-mail: pavel.skalicky@fnol.cz
Zdroje
1. Frantz VK. Tumors of the pancreas. In: Bumberg CW, editors. Atlas of tumor pathology, VII. Fascicles 27 and 28, Washington, DC, Armed Forced Institute of Pathology 1959 : 32−3.
2. Klöppel G, Solcia E, Longnecker DS, et al. Histological typing of tumor of the exocrine pancreas. In: World Health Organisation international histological classification of tumors. 2nd ed. Berlin, Heidelberg, New York, Springer 1996 : 8452/1.
3. Klöppel G, Hruban RH. Solid-pseudopapillary tumor of pancreas. World Health Organization classification of tumors of the digestive system. Lyon, IARC 2010 : 327−30.
4. Morohoshi T, Held G, Kloppel G. Exocrine pancreatic tumours and their histological classification. A study based on 167 autopsy and 97 surgical cases. Histopathology 1983;7 : 645−61.
5. Lüttges J. Was ist neu?, Die WHO-Klassifikation 2010 für Tumoren des Pankreas, Der Pathologe 2011;32 : 332.
6. Papavramidis T, Papavramidis S. Solid pseudopapillary tumors of the pancreas: review of 718 patients reported in the English literature. J Am Coll Surg 2005;2 : 965−72.
7. Law JK, Ahmed A, Singh VK, et al. A systematic review of solid pseudopapillary neoplasms: Are these rare lesions? Pancreas 2014;43 : 331–7.
8. Gürlich R, Kment M, Novotný J, et al. Solidní pseudopapilární tumor pankreatu. Bulletin HPB Chirurgie 2007;1 : 2–5.
9. Brázdil J, Hermanová M, Křen L, et al. Solidní pseudopapilární tumor pankreatu: soubor pěti případů. Rozh Chir 2004;83 : 73–8.
10. Igbinosa O. Pseudopapillary tumor of the pancreas. An algorithmic approach. JOP. 2011;12 : 262–5.
11. Mirminachi B, Farrokhzad S, Sharifi AH, et al. Solid pseudopapillary neoplasm of pancreas; A case series and review literature. Middle East J Dig Dis 2016;8 : 102–8.
12. Yin Q, Wang M, Wang C, et al. Differentiation between benign and malignant solid pseudopapillary tumor of the pancreas by MDCT. Eur J Radiol 2012;81 : 3010−8.
13. Igbinosa O. Pseudopapillary tumor of the pancreas: An algorithmic approach. JOP 2011;12 : 262−5.
14. Yu PF, Hu ZH, Wang XB, et al. Solid pseudopapillary tumor of the pancreas: a review of 553 cases in Chinese literature. World J Gastroenterol 2010;16 : 1209−14.
15. Xiaolong Tang, Jianwei Zhang, Xu Che, et al. Peripancreatic lymphadenopathy on preoperative radiologic images predicts malignancy in pancreatic solid pseudopapillary neoplasm. Int J Clin Exp Med 2015;8 : 16315−21.
16. Washington K. Solid-pseudopapillary tumor of the pancreas: challenges presented by an unusual pancreatic neoplasm. Ann Surg Oncol 2002;9 : 3−4.
17. Jarboui S, Daghfous A., Kacem K, et al. Solid-pseudopapillary tumor of the pancreas: Clinical and radiological features. Case Reports in Clinical Medicine 2013;2 : 415−21.
18. Frago R, Fabregat J, Jorba R, et al. Solid pseudopapillary tumors of the pancreas: Diagnosis and curative treatment. Revista Espanola de Enfermedades Digestivas 2006;98 : 809−16.
19. Miao F, Zhan Y, Wang XY, et al. CT manifestations and features of solid cystic tumors of the pancreas. Hepatobiliary Pancreat Dis Int 2002;1 : 465−8.
20. Ventriglia A, Manfredi R, Mehrabi S, et al. MRI features of solid pseudopapillary neoplasm of the pancreas. Abdominal Imaging December 2014;39 : 1213–20.
21. Virgilio E, Mercantini P, Ferri M, et al. Is EUS-FNA of solid-pseudopapillary neoplasms of the pancreas as a preoperative procedure really necessary and free of acceptable risks? Pancreatology. 2014;14 : 536−8.
22. Kosmahl M, Seada LS. Solid-pseudopapillary tumor of the pancreas: its origin revisited. Virchows Arch. 2000;436 : 473−80.
23. Cai Y, Ran X, Xie S, et al. Surgical management and long-term follow-up of solid pseudopapillary tumor of pancreas: a large series from a single institution. J Gastrointest Surg 2014;18 : 935−40.
24. Cai Y, Ran X, Xie S, et al. Surgical management and long-term follow-up of solid pseudopapillary tumor of pancreas: a large series from a single institution. J Gastrointest Surg 2014;18 : 935−40.
25. Cheng K, Shen B, Peng C, et al. Synchronous portal-superior mesenteric vein or adjacent organ resection for solid pseudopapillary neoplasms of the pancreas: a single-institution experience. Am Surg. 2013;79 : 534−9.
26. Martin RC, Klimstra DS, Brennan MF, et al. Solid pseudopapillary tumor of the pancreas: a surgical enigma? Ann Surg Oncol 2002;9 : 35−40.
27. Mao C, Guvendi M, Domenico DR, et al: Papillary cyst and solid tumors of the pancreas: a pancreatic embryonic tumor? Studies of three cases and cumulative review of the world´s literature. Surgery. 1995;118 : 821–8.
28. Paik WH, Seo DW, Dhir V, et al. Safety and efficacy of EUS-guided ethanol ablation for treating small solid pancreatic neoplasm. Medicine (Baltimore) 2016;95 : 2538.
29. Gaiguo Dai, Ling Huang, Yian Du, et al. Solid pseudopapillary neoplasms of the pancreas: clinical analysis of 45 cases. Int J Clin Exp Pathol 2015;8 : 11400−6.
Štítky
Chirurgia všeobecná Ortopédia Urgentná medicína
Článok vyšiel v časopiseRozhledy v chirurgii
Najčítanejšie tento týždeň
2017 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Vzpomínka na profesora Miloše Hájka
- Editorial
- Současný pohled na ureterointestinální anastomózu v močové derivaci
- Hemangiomy jater – kdy indikovat invazivní léčbu?
- K životnímu jubileu docenta Leopolda Plevy
- Solidní pseudopapilární tumor pankreatu
- Traumatická ruptura dolní duté žíly s odloženým ošetřením po překladu na specializované pracoviště
- Odešel profesor Miroslav Slavík
- Resekce jater pro recidivující sarkom s náhradou infiltrované dolní duté žíly aortálním allograftem – kazuistika a přehled literatury
- Polymastia v neobvyklej lokalizácii počas gravidity
- Rozhledy v chirurgii
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Hemangiomy jater – kdy indikovat invazivní léčbu?
- Solidní pseudopapilární tumor pankreatu
- Polymastia v neobvyklej lokalizácii počas gravidity
- Současný pohled na ureterointestinální anastomózu v močové derivaci
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




