-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Chirurgická léčba ovariálního karcinomu
Surgical therapy of ovarian cancer
Epithelial ovarian cancer remains the most lethal gynecologic malignancy in the Czech Republic. Due to the nonspecific symptoms of the disease, most cases are diagnosed only in advanced stages. The first line of treatment for ovarian cancer involves primary cytoreductive surgery, followed by combined adjuvant chemotherapy based on platinum and paclixatel, which generally achieves a good therapeutic response. However, in about two thirds of the patients, the disease relapses.
Key words:
ovarian cancer − cytoreductive surgery
Autoři: Josef Chovanec; R. Feranec; Monika Náležinská
; T. Cacek
Působiště autorů: Oddělení gynekologické onkologie, Klinika operační onkologie MOU a LF Masarykovy univerzity Brno přednosta: doc. MUDr. R. Šefr, Ph. D.
Vyšlo v časopise: Rozhl. Chir., 2017, roč. 96, č. 6, s. 237-241.
Kategorie: Souhrnné sdělení
Souhrn
Epiteliální ovariální karcinom má v České republice z gynekologických zhoubných nádorů nejvyšší mortalitu. Většina pacientek je vzhledem k nespecifickým symptomům diagnostikována v pokročilém stadiu nemoci. Úvodní léčba karcinomu ovaria spočívající v primární cytoredukční operaci v kombinaci s adjuvantní chemoterapií na bázi platiny a paklitaxelu dosahuje vysoké léčebné odpovědi. Přesto zhruba u dvou třetin pacientek dochází k relapsu nemoci.
Klíčová slova:
ovariální karcinom − cytoredukční operaceÚvod
Karcinom ovaria patří mezi epiteliální nádory vaječníku a tvoří 70−90 % všech zhoubných nádorů ovaria. V České republice je každoročně karcinom vaječníků diagnostikován u více než 1000 žen a dvě třetiny pacientek na toto onemocnění umírají. Konkrétně v roce 2014 v naší republice bylo nově diagnostikováno celkem 1007 nových případů karcinomu ovaria, což odpovídá incidenci 18,8 onemocnění na 100 000 žen. Mortalita činila 14,17 na 100 000 žen, t.j. 759 případů. Porovnáme-li tato data s dalšími nejčastějšími zhoubnými gynekologickými malignitami – karcinomem děložního těla a děložního hrdla –, zjistíme, že mortalita karcinomu vaječníků je výrazně vyšší [1].
Růst ve volné dutině břišní je obvykle dlouhou dobu asymptomatický a je příčinou vysokého procenta pokročilých nálezů (FIGO III, IV) v době diagnózy. Pozdní záchyt nemoci je rovněž způsoben absencí screeningové metody.
Termín „ovariální karcinom“ je jednotka zahrnující nádory, které vznikají ve vaječníku, tubách a na peritoneu. Jedná se o celou řadu geneticky a etiologicky odlišných karcinomů, které nevznikají pouze z ovariální tkáně.
Současný dualistický model karcinogeneze vaječníku dělí nádory do dvou skupin. V první skupině jsou nádory s celkově lepší prognózou (low grade serózní a endometroidní adenokarcinom, mucinózní adenokarcinom, zhoubný Brennerův tumor a část světlobuněčných adenokarcinomů). Do druhé skupiny náležejí nádory s výrazně horší prognózou (nediferencovaný karcinom, high grade serózní, který představuje tři čtvrtiny všech ovariálních karcinomů, high grade endometroidní karcinom, smíšený maligní mulleriánský nádor, high grade karcinom z přechodných buněk a část světlobuněčných adenokarcinomů). Jako prekurzor high grade serózních karcinomů je v současnosti uváděn tubární intraepiteliální karcinom (TIC)[2], který disponuje maligním potenciálem a šíří se cestou implatačních metastáz. Většina TIC je lokalizovaná v distální části vejcovodu – fimbriích.
Léčba epiteliálních ovariálních karcinomů
Standardní léčba pokročilého ovariálního karcinomu je složena ze dvou léčebných modalit – chirurgického výkonu a chemoterapie. Cílem operace je dosažení maximální cytoredukce – nulového makroskopického rezidua, což výrazně prodlužuje celkové přežití pacientek. Právě velikost reziduálního pooperačního nálezu je důležitým prognostickým faktorem pro tuto nemoc, stejně jako histotyp nádoru a jeho buněčná diferenciace. Standardní chemoterapeutický adjuvantní režim, který následuje po operaci, obsahuje kombinaci karboplatiny (AUC 5–7) s paclitaxelem 175 mg/m2 v 21denních intervalech, šest až devět sérií. Ačkoliv téměř 80 % takto léčených pacientek reaguje pozitivní léčebnou odpovědí, přesto během prvních dvou let po ukončení léčby u 60 % pacientek dochází k recidivě nemoci. Kromě těchto základních léčebných modalit je v terapii karcinomu ovaria omezeně používána hormonální léčba a radioterapie [3,4]. Od roku 2011 se i v léčbě karcinomu ovaria v indikovaných případech používá cílená – biologická – léčba) [5].
Ovariální karcinomy řadíme mezi nádory chemosenzitivní, ale ne chemokurabilní, proto primárním terapeutickým a konečným diagnostickým krokem je léčba chirurgická. Téměř v 90 % je léčba karcinomu ovaria zahájena primární cytoredukční operací, kterou následuje adjuvantní chemoterapie. Role chirurgie v léčbě karcinomu ovaria je tedy společně s chemoterapií stěžejní.
Současná chirurgická léčba
Chirurgický výkon má v léčbě karcinomu ovaria stále stěžejní postavení. Cílem chirurgického vstupu je:
- histologická verifikace nemoci,
- stanovit rozsah nemoci – chirurgický staging,
- provést optimální cytoreduktivní výkon) [6].
Správné klasifikace dle FIGO nelze dosáhnout bez adekvátně provedené operace. Především u stadia FIGO I je nutné vyloučit přítomnost okultních metastáz, které se u časných stadií karcinomu ovaria vyskytují mezi 20–30 %. Japonská studie z roku 2002 prokázala postižení lymfatických uzlin u stadia FIGO I u 20 % pacientek. Vzhledem k tomu, že existuje přesně definovaná skupina nemocných ve stadiu I, které nepotřebují žádnou adjuvantní léčbu, je nutné přísně trvat na provedení adekvátního chirurgického stagingu. Jde o přesná pravidla, která musejí být dodržena, abychom mohli provést přesnou klasifikaci nemoci. Proto kromě vlastního operačního léčebného výkonu je třeba realizovat tyto kroky: peritoneální laváž, inspekci a palpaci všech dostupných peritoneálních povrchů, biopsii či resekci adhezí primárního tumoru k okolí, odběr bioptických vzorků z peritonea močového měchýře, pravého a levého parakolického prostoru, pravé klenby brániční a peritonea pánevní stěny v místě primárního tumoru. V praxi se často setkáváme s neadekvátně provedeným chirurgickým stagingem. Mezi jeho nejčastější chyby patří malý nebo nulový počet biopsií a neprovedení lymfadenektomie.
Důsledkem špatného chirurgického stagingu je nepřesná klasifikace (stanovení nižšího stadia nemoci než ve skutečnosti) a na jejím základě špatně stanovená strategie dalšího léčebného postupu.
1. Primární cytoredukční operační výkon
Již v roce 1934 Meigs) [7] upozornil na význam maximální cytoredukce a pozitivní vliv na délku přežití pacientek. Následující léta tento poznatek jasně potvrdila. V roce 1993 Hoskins prokázal, že velikost reziduálního pooperačního nálezu je významným prognostickým faktorem pro tuto nemoc.
Vlastní radikální operační výkon obsahuje: totální abdominální hysterektomii, oboustrannou adnexetomii, infrakolickou omentektomii, appendektomii, pánevní a paraaortální lymfadenektomii. U pokročilého stadia nemoci se často jedná o multiviscerální chirurgické výkony (resekce jater, žaludku, střevních kliček, splenektomie apod.), což vyžaduje úzkou spolupráci s onkochirurgem či onkourologem. Dosažení tzv. „nulového makroskopického rezidua“ je zásadní. U těch pacientek, kde ho bylo dosaženo, klinické studie prokázaly statisticky významné prodloužení celkového přežití. Ve studii, s celkovým počtem 3126 zařazených pacientek, bylo dosaženo signifikantních rozdílů v délce přežití. Ženy, u kterých bylo operací dosaženo „makroskopického nulového rezidua tumoru“, měly medián přežití 99,1 měsíců. Pacientky s reziduem v rozmezí 0,1–1 cm dosáhly mediánu přežití v délce 36,2 měsíců. Skupina žen, u kterých bylo pooperační makroskopické reziduum tumoru větší než 1 cm, dosáhla mediánu přežití pouze v délce 29,6 měsíců [8]. Dodržení tohoto konceptu vyžaduje někdy rozsáhlé resekční výkony.
Četnost optimálního debulkingu u žen s karcinomem stadia III je nejvyšší, pokud operaci provádí onkogynekochirurg (asi 35 %), a nejnižší, pokud operuje obecný chirurg (asi 5–10 %)[9].
Graf 1. Pravděpodobnost délky přežití (%) v závislosti na odbornosti operatéra Graph 1: Analysis of the relationship between the oncogynecologist’s operative skills and survival rate (in percents) 
2. Odložená cytoredukční operace – interval debulking surgery (IDS)
Pokud nelze z různých důvodů realizovat primární cytoreduktivní výkon (zdravotní stav pacientky, pokročilost choroby apod.), zahajujeme léčbu chemoterapií a po dosažení zmenšení nádorové masy provádíme odložený chirurgický výkon – IDS (Interval debulking surgery), jehož cílem je radikální odstranění chemoterapií zmenšeného nádoru ve stejném rozsahu jako u primární operace. Podmínkou k indikaci IDS je prokázaná regrese nádoru během neoadjuvantní chemoterapie. Časování cytoredukční operace u pokročilého ovariálního karcinomu představuje kontroverzi již několik desetiletí. V devadesátých letech minulého století Evropská organizace pro výzkum a léčbu rakoviny (EORTC-GCG) představila výsledky randomizované multicentrické studie, s cílem stanovit roli odložené cytoredukční operace (interval debulking surgery, IDS) u žen po neúspěšné primární operaci (pooperační reziduum větší než 1 cm) [10].
Zatímco van der Burg zaznamenal přínos odložené operace prováděné ve specializovaném centru po primárně neúspěšném chirurgickém vstupu následovaném 3 cykly chemoterapie, americká studie Gynecologic Oncology Group vedená autorem Rose tyto výsledky zpochybnila. Rose neprokázal benefit IDS na přežití pacientek, které byly primárně operovány specialistou, onkogynekologem, s maximální snahou o dosažení optimálního pooperačního rezidua u první cytoredukční operace [11].
Na základě závěrů metaanalýzy obou studií lze předpokládat, že IDS je přínosná pouze v případech inadekvátní primární operace. Odložená operace by neměla být indikovaná v případech technicky adekvátní, ale neúspěšné primární cytoredukce. Časování odložené cytoredukce je nutné co nejdříve, nejvhodnějším se jeví období po ukončených 3 cyklech chemoterapie. Interval debulking surgery nelze vnímat jako alternativu adekvátní primární operace provedené gynekologickým onkologem s maximální snahou odstranit nádor [12].
Nový pohled na roli odložené cytoredukční operace přinesly výsledky studie Ignace Vergoteho. EORTC-GCG/NCIC-CTG. Jde o multicentrickou studii, do které bylo celkově zařazeno 718 pacientek s pokročilým ovariálním karcinomem, randomizovaných do standardního ramene primární cytoredukční operace následované 6 cykly adjuvantní chemoterapie a experimentálního ramene s neadjuvantní chemoterapií a IDS po 3 cyklech. Studie neprokázala inferioritu neadjuvantní chemoterapie a IDS ve vztahu k celkovému přežití. Tyto výsledky jsou pravděpodobně dosaženy vyšším procentem dosažených kompletních resekcí po neadjuvantní chemoterapii. Na druhou stranu hypotetickou nevýhodou neoadjuvantní chemoterapie je možný vznik chemorezistence objemných, primárně neresekovaných tumorů. Dle závěrů studie se pooperační reziduum jeví jako nejsilnější nezávislý prognostický faktor (multivariantní analýza). Časování operačního výkonu dle autorů není ve vztahu k prognóze a přežití významné. V současné době jsou závěry studie kritizovány pro nízké procento operací s dosaženým optimálním pooperačním reziduem, které se liší v jednotlivých národních skupinách. Dále je kontroverzní povolená variabilita chemoterapeutických režimů, která mohla modifikovat výsledky přežití. Publikovaná délka přežití ve studii I. Vergoteho je rovněž tématem kritiky. Je téměř poloviční ve srovnání se studiemi, které dosahovaly vysokého procenta optimálního pooperačního rezidua u primární operace [13,14].
V roce 2014 byly publikovány výsledky studie autorů Rosen et al. Celkově 326 žen s pokročilým ovariálním karcinomem stadia FIGO IIIC a IV bylo randomizováno do ramene neadjuvantní chemoterapie s následnou odloženou operací (IDS) a do ramene primární cytoredukční operace s adjuvantní chemoterapií. Dosažení nulového pooperačního rezidua bylo vyšší ve skupině neadjuvantní chemoterapie (50,1 %) ve srovnání s úspěšností cytoredukce ve skupině primární operace (41,5 %). Ve skupině po neadjuvantní chemoterapii bylo zaznamenáno 7leté přežití u 8,6 % pacientek, ve srovnání se 41 % přeživších pacientek po primární operaci. Byla prokázána závislost přežití na dosažení nulového rezidua. V selektované skupině pacientek s dosaženým R0 přežilo 7 let pouze 7,8 % pacientek po neadjuvantní chemoterapii ve srovnání se 73,6 % v rameni po primární operaci a adjuvantní chemoterapii [15].
Na základě dostupných dat tak v současné době akceptovaný management pokročilého ovariálního karcinomu zahrnuje iniciální cytoredukční operaci s cílem dosažení optimálního, nulového makroskopického rezidua, následovanou adjuvantní chemoterapií. Za nejsilnější prognostický faktor přežití je považováno pooperační reziduum, které koreluje s rozsahem nemoci, ale i schopnostmi a zkušenostmi operačního týmu včetně řešení peritoneálního rozsevu. Tento přístup je zatížen vyšší morbiditou ve srovnání s neoadjuvantní chemoterapií (NACT) následované IDS, ale současně je NACT spojená s horší prognózou a přežíváním pacientek.
Neoadjuvantní chemoterapie má být určena pro pacientky ve špatném klinickém stavu, které nejsou schopny podstoupit primární radikální operační výkon, a to i s ohledem na věk a komorbidity. Dále má být neoadjuvantní chemoterapie následovaná odloženou cytoredukcí volena v případě rozsáhlých pokročilých tumorózosních postižení, kde není předpoklad dosažení nulového rezidua (rozsáhlá infiltrace mezenteria, postižení portální vény, inoperabilní jaterní metastázy a maligní fluidothorax).
Neoadjuvantní chemoterapii je možné zahájit po histologické, či cytologické verifikaci tumoru (tru cut biopsie pod sonograafickou nebo CT kontrolou). Možností je miniinvazivní laparoskopický odběr vzorku tkáně umožňující současné posouzení operability nádoru. Odložená cytoredukční operace (IDS) následuje optimálně po 3−4 cyklech neoadjuvantní chemoterapie po posouzení regrese tumoru a operability klinickým vyšetřením a pomocí zobrazovacích metod včetně CT.
3. Konzervativní fertilitu zachovávající operační výkony
Tyto postupy přicházejí do úvahy u skupiny mladých žen se snahou o zachování fertility. Výkon, který provádíme u časných stadií FIGO IA, IB event. IC, zahrnuje kroky nutné k provedení adekvátního chirurgického stagingu, dále jednostrannou adnexetomii, omentektomii, apendektomii a systematickou pánevní a paraaortální lymfadenektomii. Problematika resekce zbývajícího makroskopicky nesuspektního ovaria je kontroverzní. V současnosti je doporučeno od resekce kontralaterálního ovaria při jeho normálním vzhledu ustoupit. U pacientek ve stadiu IB (postižení obou ovarií) provádíme oboustrannou adnexektomii s ponecháním dělohy. Pacientky jsou potom zařazeny do programu IVF (donorské vejce).
4. Využití laparoskopie
Laparoskopie není standardní metodou v léčbě karcinomu ovaria. V případě vysoké pravděpodobnosti inoperability tumoru ji lze použít k histologické verifikaci procesu a potvrzení inoperability. I tato indikace je však předmětem četných diskuzí. Jedinou indikací pro terapeutický laparoskopický výkon u karcinomu ovaria je situace, kdy u „časného“ stadia nebyla provedena pánevní a paraaotální lymfadenektomie.
5. Recidivy karcinomu ovaria
Chirurgická léčba má svou roli i v léčbě recidiv karcinomu ovaria. Kromě vyloženě paliativních chirurgických výkonů (kolostomie, resekce střev, nefrostomie, punkce ascitu) zlepšujících kvalitu života nemocné, může mít chirurgický výkon vliv na prodloužení celkového přežití pacientek. V případě výskytu recidivy nemoci jsou mnohem častěji postiženy tkáně a orgány v horní polovině dutiny břišní (na rozdíl od primární nemoci), které se technicky výrazně hůře operují ve smyslu získání nulového rezidua. Tyto operace (sekundární debulking) musejí být uvážlivě indikovány po pečlivém vyhodnocení restagingových vyšetření a dodržení určitých podmínek. Je nutno posoudit délku DFI (disease free interval), počet metastatických ložisek, přítomnost karcinomatózy, celkový zdravotní stav pacientky apod. Optimální pacientka by měla splňovat alespoň 3 ze zmíněných 4 kritériíi uvedených v Tab. 1 [16].
Tab. 1. Optimální podmínky pro sekundární debulking Tab. 1: Optimum conditions for secondary debulking 
Role cytoreduktivních operačních výkonů u recidivujícího ovariálního karcinomu tedy není striktně determinovaná s ohledem na nedostatek prospektivních randomizovaných studií. Dostupná data prokazují, že kompletní resekce rekurentní tumorózní masy vede k prodloužení přežívání. Velmi důležitým se v současné době jeví definování indikačních kritérií i prediktivních markerů kompletní resekce. Dle závěrů AGO DESKTOP studie jsou parametry předpokládané kompletní resekce definovány jako dobrý performance status (ECOG 0), nulové reziduum po primární operaci, absence ascitu. S využitím uvedeného skórovacího systému byla dosažena kompletní resekce v 79 % recidiv. V případě peroperačního průkazu rozsáhlé karcinomatózy byla úspěšnost výrazně nižší [17].
Další skórovací systém sekundárního debulkingu byl prezentován autorem Chi et al. [18] (viz Tab. 2).
Tab. 2. Skórovací systém sekundárního debulkingu dle Chi et al. (SC sekundární cytoredukce) Tab. 2: Evaluation system of secondary debulking according to Chi et al. (SC secondary cytoreduction) 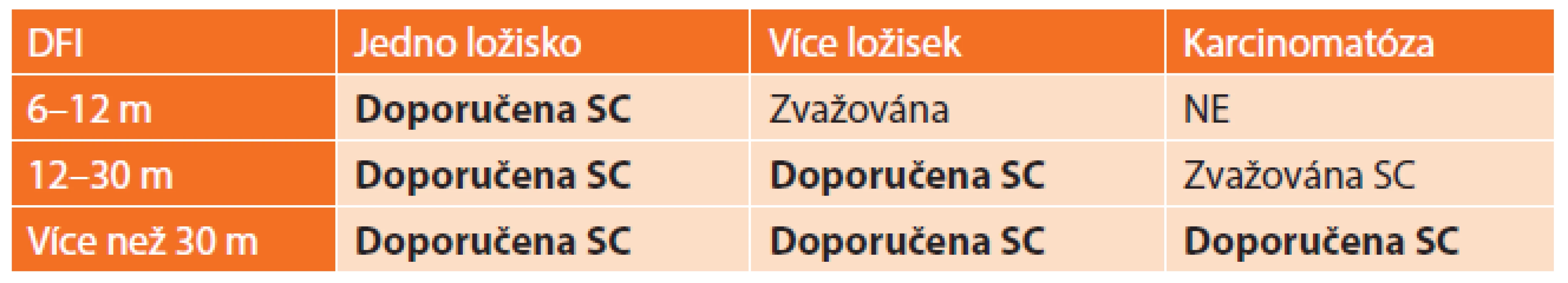
Dosažení úplného odstranění tumoru se jeví nejsilnějším prediktivním faktorem celkového přežívání. Závěry německé skupiny AGO prokazují prodloužení celkového přežití po kompletní resekci platina senzitivní recidivy onemocnění ve srovnání s případy R1 resekce (medián přežití 45 vs. 20 měsíců).
Délka platina-free intervalu (PFI) je dalším významným prognostickým faktorem. Studie Desktop I prokázala benefit při prodloužení PFI na 6 měsíců, tj. u platina senzitivní recidivy onemocnění. Nebyl prokázán rozdíl v délce PFI nad uvedenou hranici půl roku.
Závěr
Pokud má chirurgická léčba karcinomu ovaria maximálně plnit svůj účel, je nutné, aby operaci prováděl zkušený a rutinně operující onkogynekolog, který nemá problém v případě nutnosti přizvat do operačního týmu onkochirurga nebo onkourologa. Výkon totiž často může být (i vzhledem k častějším lokalizacím metastatických ložisek v horní polovině dutiny břišní) velmi radikální a rozsáhlý. Z uvedeného jasně vyplývá, že operace musí být provedena v onkochirurgických centrech, kde jsou zmíněné odbornosti zastoupeny. Současně pracoviště musí operatérovi poskytnout maximální operační zázemí (přístrojové vybavení operačních sálů, anesteziologická pooperační péče), dobře vybavený diagnostický komplement (peroperační histologie) a dostupnost konziliárních vyšetření (histolog, radiodiagnostik, radioterapeut apod.). Tyto operační výkony musejí být centralizovány do onkogynekologických center, která jsou součástí KOC (komplexní onkologické centrum).
V současnosti stále platí, že optimálně provedená chirurgická redukce, tj. dosažení mikroskopického rezidua nemoci, v kombinaci s chemoterapií s platinovým derivátem jsou dvě základní modality léčby pokročilého ovariálního karcinomu. Cílem chirurgické léčby je provedení výkonu bez makroskopického rezidua. A právě výsledné nádorové reziduum je, jak prokázaly klinické studie [19,20], jeden z nejvýznamnějších prognostických faktorů, který statisticky významně prodlužuje celkové přežití pacientky. Navíc se jedná o prognostický faktor, který na rozdíl od zbývajících (věk, stadium, histologie apod.) lze kvalitně provedeným operačním výkonem ovlivnit.
Tato práce byla podporována MZ ČR RVO (MOÚ, 00209805) a MŠMT-NPU I-LO1413.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
prim. MUDr. Josef Chovanec, PhD.
odd. gynekologické onkologie
Klinika operační onkologie LF MU Brno
Masarykův onkologický ústav, Brno
e-mail: josef.chovanec@mou.cz
Zdroje
1. SVOD: Dušek L, Mužík J, Kubásek M, et al. Epidemiologie zhoubných nádorů v České republice [online]. Masarykova univerzita 2005, dostupný z WWW: http://www.svod.cz. Verze 7.0 [2007], ISSN 1802–8861.
2. Dundr P. Prekancerózy endometria, děložní tuby a ovaria: přehled současné problematiky. Česko-slovenská patologie 2012;1 : 30–4.
3. Sjoquist KM, Martyn J, Edmondson R, et al. The role of hormonal therapy in gynecological cancers-current status and future directions. Int J Gynecol Cancer 2011;21 : 1328−33.
4. Engelen MJ, Snel BJ, Schapveld M, et al. Long-term morbidity of adjuvant whole abdominal radiotherapy (WART) or chemotherapy for early stage ovarian cancer. Eur J Cancer 009;45 : 1193−1200.
5. Burger RA. Incorporation of bevacizumab in the primary treatment of ovarian cancer. N Engl J Med 2011;365 : 2473−83.
6. Ramirez I, Chon HS, Apte SM. The role of surgery in the management of epithelial ovarian cancer. Cancer Control 2011;18 : 22–30.
7. Meigs JV.Tumor sof the female pelvic organs. New York, Mc Millan 1934.
8. du Bois A, Reuss A, Pujade-Lauraine E, et al. Role of surgical outcome as prognostic factor in advance epithelial ovarian cancer: a combined exploratory analysis of 3 prospectively randomized phase 3 multicenter trials. Cancer 2009;115 : 1234–44.
9. Skírnisdóttir I, Sorbe B. Prognostic factors for surgical outcome and survival in 447 women treated for advanced (FIGO-stages III-IV) epithelial ovarian carcinoma. Int J Oncol 2007;30 : 727−34.
10. Van Der Burg M, Van Lent M, Buyse M, et al. The effect of debulking surgery after induction chemotherapy on the prognosis in advanced epithelial ovarian cancer. Gynecological Cancer Cooperative Group of the European Organisation for Research and Treatment of Cancer. New Engl J Med 1995;332 : 629−34.
11. Rose P, Nerenstone C, Brady M, et al. Secondary surgical cytoreduction for advanced ovarian Carcinoma. N Engl J Med 2004;351 : 2489−97.
12. Bristow RE, Chi DS. Platinum-based neoadjuvant chemotherapy and interval surgical cytoreduction for advanced ovarian cancer: a meta-analysis. Gynecol Oncol 2006;103 : 1070−6.
13. Vergote I, van Gorp T. Timing of debulking surgery in advanced ovarian cancer. Int J Gynecol Cancer 2008;18 Suppl 1 : 11−9.
14. Vergote I, Trope C, Amant F, et al. Neoadjuvant chemotherapy of primary surgery in stage IIIC or IV ovarian cancer. N Engl J Med 2010;363 : 943−53.
15. Rosen B, Laframboise S, Ferguson S, et al. The impacts of neoadjuvant chemotherapy and of debulking surgery on survival from advanced ovarian cancer. Gynecol Oncol 2014;134 : 462−7.
16. Onda T, Yoshikawa H, Yasugi T, et al. Secondary cytoreductive surgery for recurrent epithelial ovarian carcinoma: proposal for patients selection. Br J Cancer 2005;92 : 1026−32.
17. Harter P. Prospective validation study of a predictive score for operability of recurrent ovarian cancer: the multicenter intergroup study DESKTOP II. A project of the AGO Kommission OVAR, AGO Study Group, NOGGO, AGO Austria, and MITO. Int J Gynecol Cancer 2011;21 : 289−95.
18. Chi DS, McCaughty K, Diaz JP. Guidelines and selection criteria for secondary cytoreductive surgery in patients with recurrent, platinum-sensitive epithelial ovarian carcinoma. Cancer 2006;109 : 1933−9.
19. Gouy S, Chereau E, Custodio AS, et al. Surgical procedures and morbidites of diaphragmatic surgery in patients undergoing initial or interval debulking surgery for advanced-stage ovarian cancer. J Amer College Surg 2010;210,509−14.
20. du Bois A, Reuss A, Pujade-Lauraine E, et al. Role of surgical outcome as prognostic factor in advanced epithelial ovarian cance: a combined exploratory analysis of 3 prospectively randomized phase 3 multicenter trials: by the Arbeitsgemeinschaft Gynaaekologische Onkologie Studiengruppe Ovarialkarzinom (AGO-OVAR) and the Groupe d´Investigateurs Nationaux Pour les Etudes des Cancers de I´Ovaire (GINECO). Cancer 2009;115 : 1234–44.
Štítky
Chirurgia všeobecná Ortopédia Urgentná medicína
Článok vyšiel v časopiseRozhledy v chirurgii
Najčítanejšie tento týždeň
2017 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Pánevní onkochirurgie
- Chirurgická léčba ovariálního karcinomu
- Totální pánevní exenterace – strategie a rozsah operačního výkonu
- ODS − Obstrukční defekační syndrom – souhrnné sdělení
- Maligní nádory tenkého střeva
- Záchranná pánevní lymfadenektomie po selhání chirurgické léčby karcinomu prostaty – kazuistika
- Kombinovaná léčba měkkotkáňového sarkomu v oblasti pánve
- Carneyho trias
- Rozhledy v chirurgii
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- ODS − Obstrukční defekační syndrom – souhrnné sdělení
- Maligní nádory tenkého střeva
- Chirurgická léčba ovariálního karcinomu
- Kombinovaná léčba měkkotkáňového sarkomu v oblasti pánve
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



