-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Chirurgie jater pro metastázy kolorektálního karcinomu
Liver surgery for colorectal liver metastases
Introduction:
Resection of colorectal liver metastases (CLM) is the only radical treatment. Nevertheless, radical liver surgery for CLM is possible in about 30% of patients with 40–50% five year overall survival. The results of liver surgery depend on various factors including the extent of CLM, characteristics of the primary colorectal carcinoma, exact preoperative diagnosis and optimal timing of the surgery by a multidisciplinary team. The aim of this review is to summarize the current possibilities of liver surgery and to point out the possibilities of increasing resectability of primary non-resectable CLM.Methods:
The definition of CLM resectability and the possibilities of perioperative oncological treatment in primary and potentially resectable CLM are discussed based on our long-term experience and experience published in the literature. The methods of increasing resectability of primary non-resectable CLM, liver first and simultaneous resections, liver transplantation, ultrasound-guided enhanced one-stage hepatectomy, resections of extrahepatic metastases, tumour recurrence after liver surgery, palliative thermoablation and embolization methods are also discussed. The author defines the predictive factors of liver surgery and underlines the importance of thorough follow-up of patients after liver surgery for CLM.Conclusion:
Currently, liver surgery is the main treatment option of CLM. Although the procedure is associated with many limits, these limits can be influenced by the strategy and tactics of the diagnostic process and treatment methods as determined by the multidisciplinary team.Key words:
colorectal liver metastases – diagnosis – treatment – results – predictive factors
Autori: V. Třeška
Pôsobisko autorov: Chirurgická klinika, Univerzita Karlova, LF v Plzni, FN Plzeň
Vyšlo v časopise: Rozhl. Chir., 2018, roč. 97, č. 4, s. 149-155.
Kategória: Souhrnné sdělení
Súhrn
Úvod:
Resekce jaterních metastáz kolorektálního karcinomu (JMKRK) je jedinou radikální léčbou. Nicméně radikální resekce jater u JMKRK je v současnosti možná jen u zhruba 30 % nemocných s 40−50% pětiletým přežíváním. Výsledky jaterních resekcí jsou závislé na řadě faktorů spojených s rozsahem nejen JMKRK, ale i s charakteristikou primárního nádoru, jsou závislé na přesné předoperační diagnostice a optimálním načasování chirurgického výkonu v multioborovém týmu v rámci multimodální léčby. Cílem práce je shrnout současné možnosti jaterní chirurgie a zároveň ukázat na možnosti zvýšení resekability JMKRK.Metody:
Na základě dlouholetých vlastních a současných literárních poznatků je definována resekabilita JMKRK a jsou diskutovány možnosti perioperační onkologické léčby u primárně resekabilních a potenciálně resekabilních JMKRK. Autor se zabývá možnostmi zvýšení resekability primárně neoperabilních JMKRK pomocí víceetapových metod s důrazem na metody urychlující růst zbytkového objemu jater, jsou diskutovány rovněž tzv. „liver first“ resekce, jednodobé resekce primárního nádoru, ultrasonograficky asistovaná jednodobá hepatektomie, možnosti transplantace jater, řešení mimojaterních metastáz, nádorových recidiv po jaterních operacích a paliativní termoablační a embolizační postupy. Práce definuje faktory ovlivňující dlouhodobé výsledky jaterních resekcí a zdůrazňuje nutnost důsledné dispenzární péče nemocných po jaterních výkonech pro JMKRK.Závěr:
Jaterní resekce jsou v současnosti hlavní metodou léčby JMKRK, nicméně mají řadu limitů, které je možné zásadně ovlivnit strategií a taktikou diagnostiky a léčby stanovenou v multioborovém týmu.Klíčová slova:
jaterní metastázy kolorektálního karcinomu – diagnostika – léčba – výsledky – prediktivní faktoryÚvod
Kolorektální karcinom (KRK) je třetí nejčastější příčinou smrti nemocných. Přibližně u třetiny nemocných se vyvinou jaterní metastázy (JMKRK) v následujících 15 letech a u 20–30 % nemocných jsou diagnostikovány současně s primárním nádorem, nebo do jednoho roku po operaci primárního KRK. Jaterní resekce, které jsou součástí multimodální léčby, jsou zlatým standardem léčby JMKRK, avšak mají stále své limity. Pokud není možné jaterní resekci provést, pak méně než 20 % nemocných se dožije 3 let od stanovení diagnózy JMKRK. Současné výsledky jaterních resekcí v rámci multimodální léčby dosahují 40–50% pětiletého přežívání a u řady nemocných (kolem 20 %) i dlouhodobé remise. Nicméně jen 20–30 % nemocných s JMKRK jsou primárně operabilní v době stanovení diagnózy. Avšak i nemocní, u kterých lze provést radikální (R0) resekci, mají rozdílnou prognózu v závislosti na některých prediktivních faktorech.
Metody
Resekce JMKRK je definována radikalitou výkonu na játrech u nemocného v celkově dobrém stavu, kterému chirurgický výkon přinese z dlouhodobého pohledu jednoznačný profit. Ještě donedávna se diskutovala různá kritéria resekability JMKRK, mezi která patřil počet jaterních metastáz, jejich velikost a lokalizace, mimojaterní postižení, chirurgický okraj jaterní resekce a řada dalších. S rozvojem technik jaterních resekcí, možností etapových, kombinovaných výkonů (s využitím především termoablačních technik) a onkologických postupů došlo v současnosti k většímu uvolnění těchto kritérií. Dnes za hlavní kritérium resekability považujeme celkový stav nemocného, jeho životní prognózu, kvalitu života, zachování dostatečného zbytkového objemu jater – tzv. „future liver remnant volume“ (FLRV) při dobré funkci jaterního parenchymu. Za radikální (R0) resekci považujeme lem zdravé jaterní tkáně kolem JMKRK, který je >1 mm. Tento lem může být někdy sporem mezi chirurgem a patologem, který popíše R1 resekci, tedy resekci, kdy nádor v mikroskopickém obraze zasahuje do resekční linie. Nicméně v řadě případů se jedná skutečně o resekce R0, protože v současnosti používaný ultrazvukový disektor či water jet disektor nebo bipolární koagulace při jaterních resekcích vytvářejí minimálně 1–2mm lem odstraněné jaterní tkáně kolem nádoru. Nicméně R1 resekce je někdy vynucená především u JMKRK lokalizovaných na hlavních cévních kmenech, které není možné z různých důvodů resekovat. Literatura uvádí [1], že dlouhodobé výsledky R1 resekcí jsou lepší u nemocných, kde byla využita neoadjuvantní onkologická léčba, na kterou měl nádor dobrou odpověď. Nicméně velké sestavy nemocných (např. LiverMetSurvey) [2] – definují R1 resekci jako jeden z negativních prediktorů dlouhodobého přežívání nemocných a časné recidivy JMKRK.
Pro předoperační indikační rozvahu je zásadně nutná přesná diagnostika. V multioborovém týmu má dnes nezastupitelné postavení rentgenolog specializující se na problematiku nádorů jater. V takovém případě má předoperační ultrasonografie, často s využitím intravenózní aplikace kontrastní látky (contrast enhanced ultrasonography – CEUS), vysokou senzitivitu (Obr. 1) podobnou multidetektorové výpočetní tomografii – MDCT – (63–97 %, resp. 75–96 %). MDCT s aplikací kontrastní látky zobrazuje JMKRK jako hypovaskulární léze v portální fázi. Magnetická rezonance (MRI) opět s aplikací kontrastní látky dokáže zobrazit léze o průměru <1 cm (senzitivita 80–97 %), nicméně na úkor specificity [3]. Hybridní metody jako PET CT nebo PET MRI (pozitronová emisní výpočetní tomografie – magnetická rezonance) jsou metody důležité pro detekci mimojaterních metastáz se senzitivitou 94–98 %. Nicméně tyto metody jsou zatíženy určitým počtem falešně pozitivních výsledků.
Obr. 1. USG jater nativně – JMKRK není patrná (vlevo – šipka), CEUS − zvýraznění hypoechogenní JMKRK (vpravo − šipka) Fig. 1: Native USG of the liver – CLM not visible (left – the arrow); CEUS – enhanced hypoechoic CLM (right – the arrow) 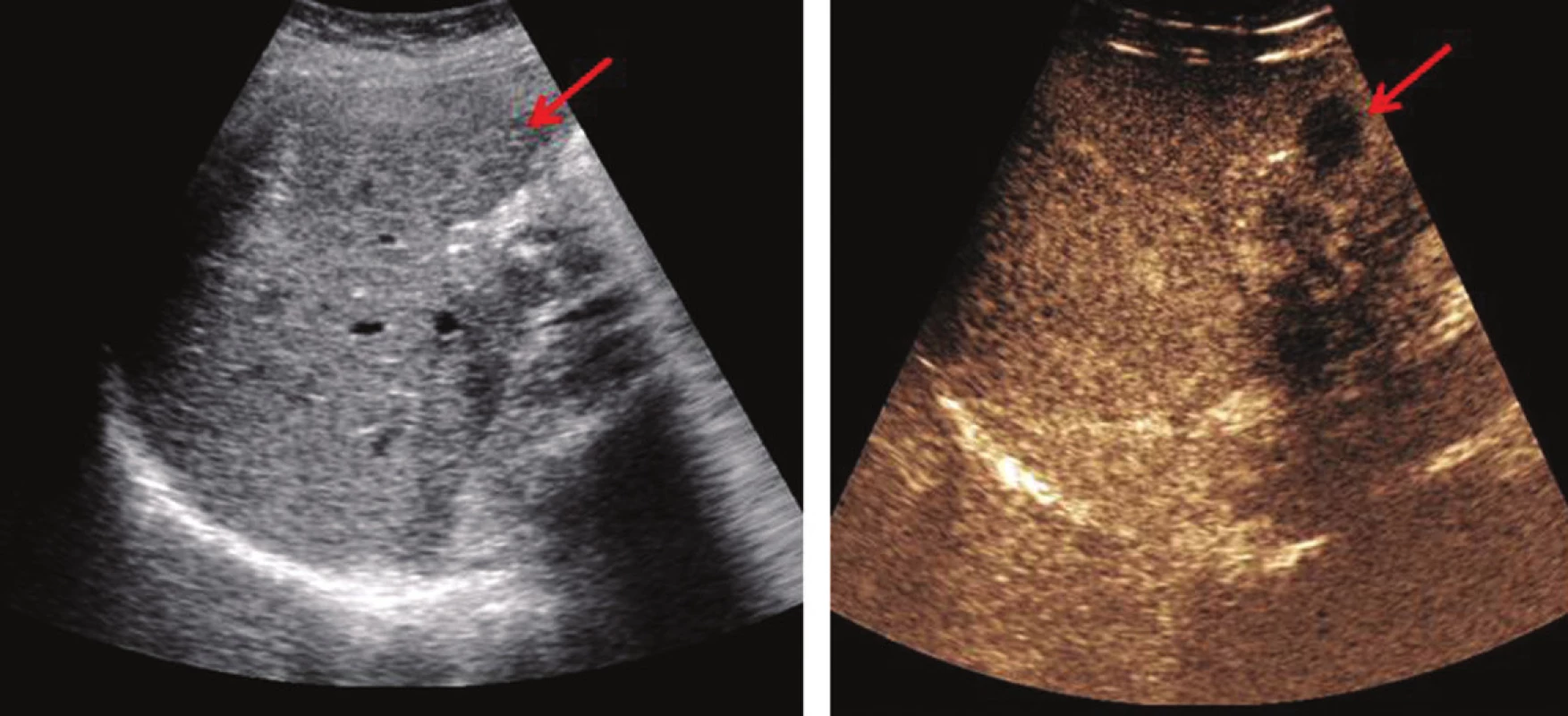
Význam neoadjuvantní onkologické léčby je nesporný u potenciálně resekabilních JMKRK v rámci redukce tzv. „downsizingu“ tumorózní masy až do míry její resekability. Jako linie první volby se využívá kombinace 5 – fluorouracilu, leukovorinu a oxaliplatiny (FOLFOX). Linií druhé volby je pak kombinace s irinotecanem (FOLFIRI). Intenzivnější kombinací je FOLFOXIRI, která má sice vyšší úspěšnost v sekundární resekabilitě JMKRK, nicméně je zatížena také vyšším procentem toxicity v porovnání s např. FOLFIRI. Studie OPUS, CRYSTAL, CELIM nebo GONO prokázaly významný efekt kombinace cytotoxické a biologické léčby na snížení toxicity a zvýšení sekundární resekability JMKRK [4]. Základem biologické léčby jsou protilátky proti receptoru epidermálního růstového faktoru – Cetuximab, Panitumumab, jejichž účinnost je vázána na nemutované formy KRAS, BRAF, NRAS a PIK3CA. U mutovaných forem lze pak využít další biologické protilátky proti receptoru vaskulárního endoteliálního růstového faktoru – Bevacizumabu, Afliberceptu či Vatalanibu [5]. K dalším metodám, které lze využít nejen v primární léčbě u neresekovatelných JMKRK, tak i jako metod redukčních, patří transarteriální chemoembolizace (TACE), transarteriální radioembolizace (TARE) nebo cílená chemoterapie cestou a. hepatica (HAI). TACE využívá směsi Lipiodolu s 5-fluorouracilem, Mitomycinem nebo Doxorubicinem, nicméně nejlepší efekt má irinotecan, který je vázán na mikrokuličkách, ze kterých je postupně uvolňován do JMKRK. Metoda se nazývá „drug eluting beads containing irinotecan“ (DEBIRI). Na obdobném principu pracuje i TARE, které využívá místní působení Yttria-90 po embolizaci JMKRK. HAI využívá rychlého vychytávání Floxuridinu v JMKRK, kde se metabolizuje na fluorouracil, dalším chemoterapeutikem v lokální aplikaci je oxaliplatina. Výše uvedenými postupy lze dosáhnout zvýšení sekundární resekability JMKRK až o 30 %.
V současné době je předmětem odborných diskuzí použití neoadjuvantní onkologické léčby u primárně resekabilních JMKRK. Na jedné straně existují studie podporující neoadjuvantní onkologickou léčbu před jaterní resekcí (např. EORTC 40983) – [6], na straně druhé některé práce hovoří o sporném významu předoperační onkologické léčby. Evropská expertní skupina pro léčbu jaterních metastáz kolorektálního karcinomu doporučuje perioperační onkologickou terapii, tj. využití jak neoadjuvantní, tak adjuvantní onkologické léčby ve spojení s radikální resekcí JMKRK. Určitým ukazatelem obecné dlouhodobé prognózy nemocného je biologická aktivita JMKRK [7]. U 5–15 % nemocných dochází k progresi JMKRK i při neoadjuvantní onkologické léčbě, což je špatný prognostický ukazatel. Nicméně i u takových nemocných má být provedena radikální resekce jater, která má potenciál prodloužit nemocnému život. Pokud využijeme neoadjuvantní onkologickou léčbu v určitých specifických případech, pak z hlediska minimalizace pooperační morbidity a mortality by tato léčba neměla přesáhnout šest cyklů. Každým dalším cyklem navíc se zvyšuje morbidita, mortalita nemocných po resekcích jater v důsledku poškození jaterního parenchymu chemoterapií. Typickými příklady jsou steatohepatitida (žlutá játra) po léčbě irinotecanem a tzv. modrá játra (sinusoidální obstrukce) po léčbě oxaliplatinou [8,9]. Rovněž léčba inhibitory vaskulárního endoteliálního růstového faktoru by měla být vysazena přibližně 4 týdny před jaterní resekcí z hlediska snížení rizika operačních komplikací z důvodů poškozené regenerace jaterní tkáně [10].
Problémem zůstává vymizení JMKRK po neoadjuvantní onkologické léčbě. Přibližně 80 % takových metastáz, které vymizí z radiologického obrazu, obsahuje stále viabilní buňky s promptní schopností růstu po ukončení onkologické léčby. Zatím není jednotný názor, jak u těchto případů postupovat. Někteří autoři doporučují označení JMKRK radiokontrastními značkami před zahájením neoadjuvantní léčby a po jejím ukončení „zmizelé“ JMKRK resekovat v místě označení, jiní pak vyčkat po skončení onkologické léčby na růst JMKRK a pak operovat. Problémem je, že ne vždy se včas zachytí růst JMKRK, které v době diagnostiky již mohou být neresekabilní.
Z hlediska rozsahu jaterních resekcí jsou obecně preferovány výkony šetřící jaterní parenchym (Obr. 2). Důvodem je předpoklad recidivy JMKRK a následných reresekcí či termoablační léčby. Nicméně zastánci větších anatomických resekcí (nad 3 jaterní segmenty) argumentují možnou přítomností mikrometastáz v jaterním parenchymu kolem hlavních metastatických ložisek. Pokud tuto možnost připustíme, pak by nepochybně perioperační onkologická léčba měla hrát důležitou roli v multimodální léčbě. Opět zde platí nezastupitelná úloha multidisciplinárního týmu, který by měl určit terapii „šitou na míru“ pro daného pacienta.
Obr. 2. Resekce 4. jaterního segmentu Fig. 2: Resection of liver segment IV 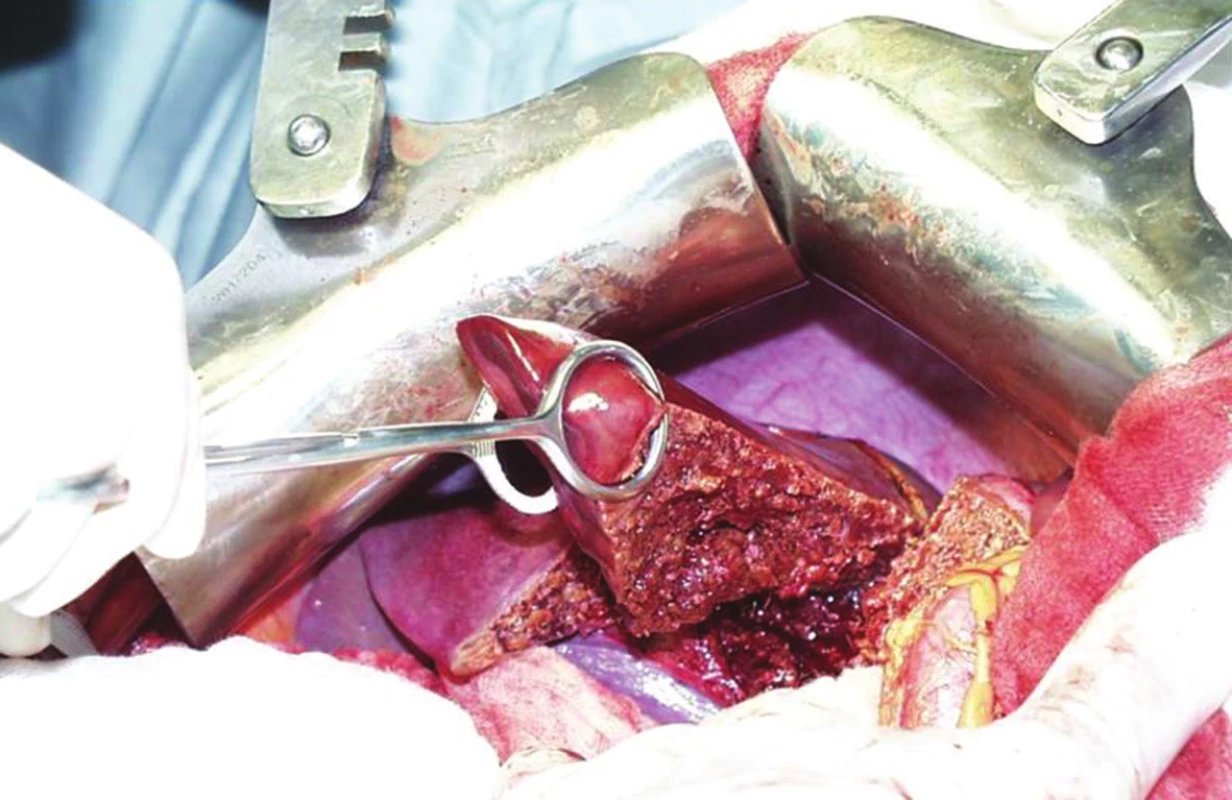
V absolutní většině případů následují resekce synchronních JMKRK v druhé době po resekci primárního KRK. Jednodobé resekce JMKRK s primárním nádorem jsou dobře možné bez zvýšení pooperační morbidity u nemocných, u kterých je jeden výkon jednoduchý, snadno proveditelný. Pokud postižení jaterního parenchymu metastatickým procesem je natolik rozsáhlé, ale resekabilní, pak bychom měli využít metodu „liver first“ [11] – Obr. 3, tj. resekovat nejprve JMKRK a ve druhé době primární kolorektální karcinom. Důvodem je případná komplikace po primární resekci kolorektálního karcinomu, která by oddálila jaterní výkon z časového hlediska natolik, že JMKRK by se staly neresekabilními. U těchto nemocných pak může být výhodné využít předoperační neoadjuvantní onkologickou léčbu před resekcí jater. Někteří autoři u tohoto postupu popisují kvalitní dlouhodobé přežívání (46 % po 4 letech) zejména u nemocných s dobrou odpovědí na neoadjuvantní onkologickou léčbu. „Liver first“ resekce se také používají u nemocných s karcinomem rekta s uzlinovými metastázami, kde je nutná neoadjuvantní chemoradioterapie, která by u některých nemocných při primárním řešení karcinomu rekta mohla vést k progresi a neresekabilitě JMKRK [12,13].
Obr. 3. Objemná JMKRK v pravém laloku jater Fig. 3: Large CLM in the right lobe of liver 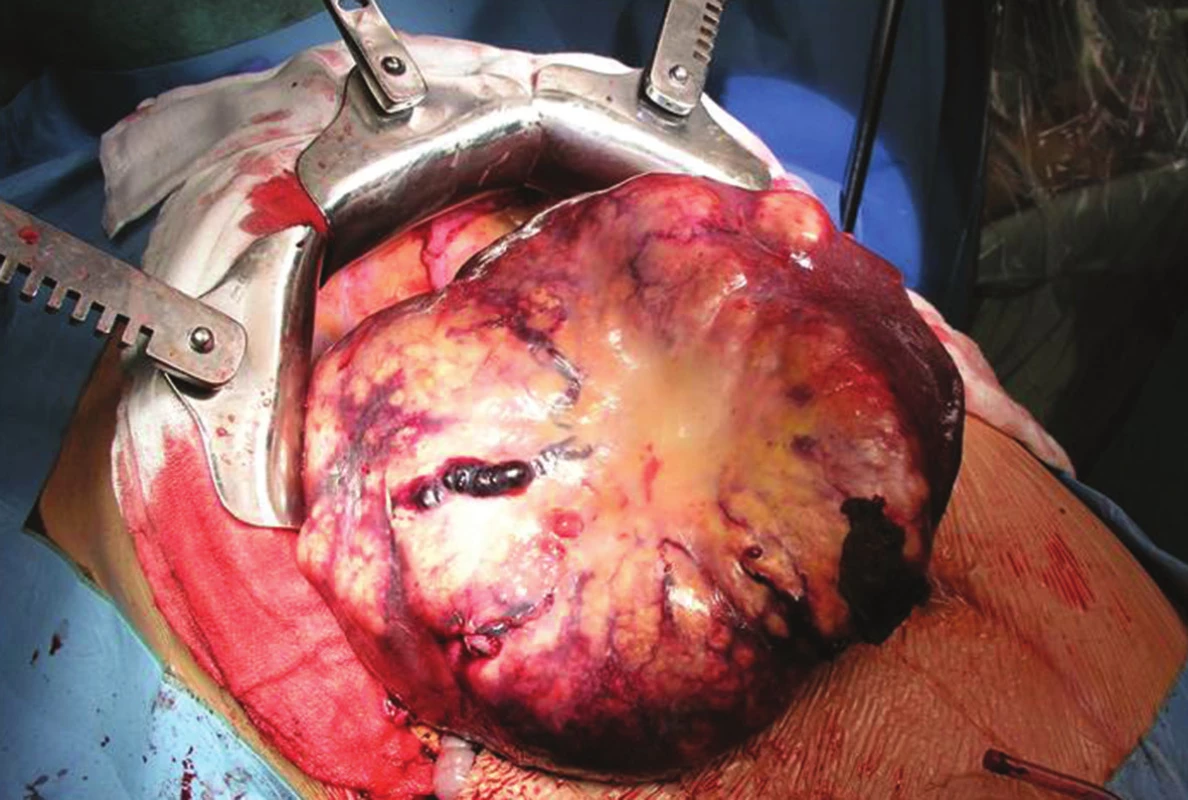
Pro chirurga je z hlediska klinické praxe zásadní rozhodnutí, zda operovat resekabilní JMKRK při přítomnosti mimojaterního nádoru. V současnosti platí, že pokud jsou JMKRK a mimojaterní nádor (např. plicní, uzliny první etáže v hepatoduodenálním ligamentu, implantační peritoneální metastázy) radikálně odstranitelné s výjimkou pozitivních uzlin kolem truncus coeliacus a aorty, má resekce jater jednoznačný smysl [14]. Pětileté přežívání u nemocných s resekabilními plicními metastázami je 36–49 % [15], s resekabilními peritoneálními metastázami 15–30 % a pozitivními uzlinami hepatoduodenálního ligamenta 18–25 %. Musíme však počítat s vysokým procentem recidiv [16] u těchto nemocných, jejichž výskyt se pohybuje v rozmezí 84–95 %, z nichž však řada je opět chirurgicky odstranitelných.
Jednou z hlavních příčin primární neresekability JMKRK je nedostatečný zbytkový objem jater – tzv. future liver remnant volume (FLRV) – Obr. 4. V současnosti máme několik možností, jak zvýšit FLRV. Jde o onkologickou léčbu s cílem snížení objemu JMKRK tak, aby byla možná radikální resekce – tzv. „downsizing“ metoda. K dalším postupům patří dvojdobá resekce jater, embolizace nebo podvaz větve portální žíly na straně nádoru (PVE, PVL). Problémem těchto metod je progrese JMKRK v jaterním parenchymu v době nutné pro růst FLRV, která se pohybuje v rozmezí 4–8 týdnů. Abychom minimalizovali toto riziko, je navržena řada postupů, které mohou zabránit progresi JMKRK, jako jsou PVE s kombinací TACE, TARE, nebo zrychlují růst FLRV, a zkracují tak významně interval nutný k resekci jater – PVE s aplikací autologních mezenchymových kmenových buněk (MSC) a metoda „Associating Liver Partition and Portal Vein Ligation for Staged Hepatectomy“ (ALPPS).
Obr. 4. Stav po PVE dx. (zeleně), FLRV (hnědě) Fig. 4: Status post PVE dx. (green), FLRV (brown) 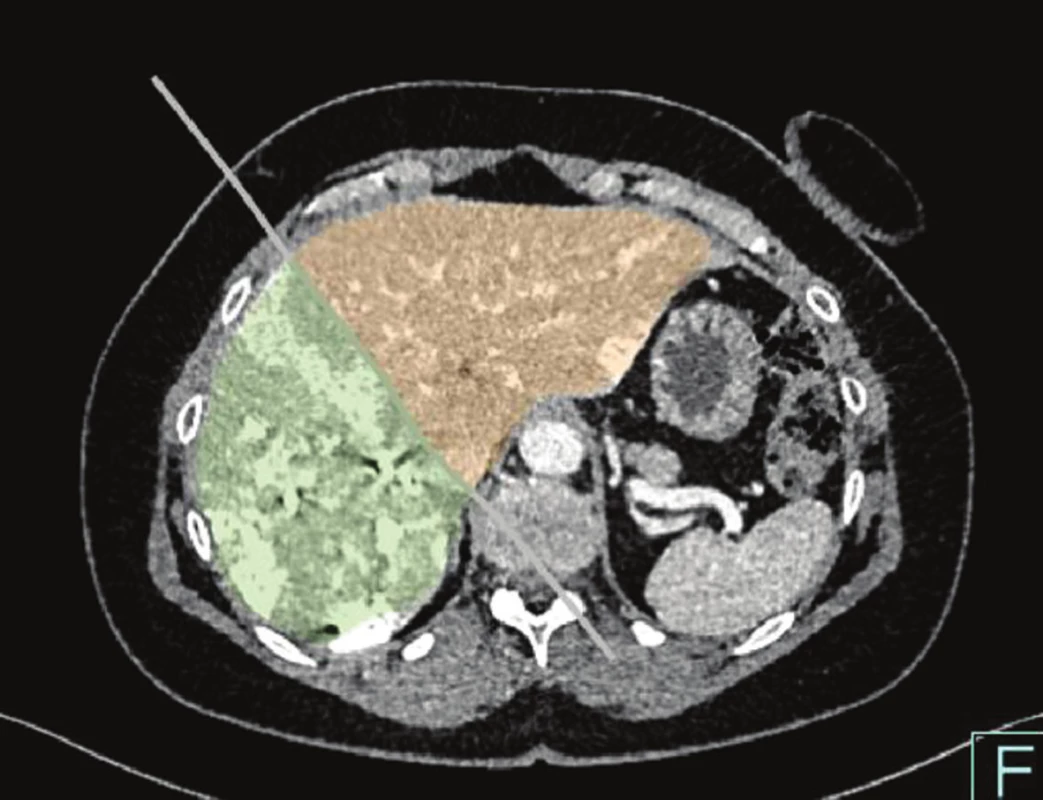
Obecným cílem těchto metod je zvětšení objemu jaterní tkáně, který zůstane po resekci JMKRK a bude dostatečný pro udržení jaterních funkcí. U nemocných s normální jaterní tkání se za dostatečný FLRV považuje objem >25–30 %, u nemocných s poškozeným jaterním parenchymem pak >40 %. U těchto nemocných je důležité kromě stanovení FLRV zjistit rovněž funkci jaterní tkáně pomocí funkčních testů.
Technika dvojdobé resekce jater je indikována u nemocných s bilobárním postižením JMKRK, kde FLRV je nedostatečný. V první době provedeme odstranění nádoru z jednoho (nejčastěji levého) laloku jater a ve druhé době po regeneraci zbylého laloku jater (obvykle po 4–8 týdnech) provedeme odstranění druhostranného jaterního laloku. Mortalita dvojdobé resekce jater je nízká (1–2 %) a je plně srovnatelná s jednodobými resekcemi. Nevýhodou této metody je poměrně dlouhý interval optimálního nárůstu FLRV, kde je nebezpečí dalšího nárůstu nejen jaterních, ale i mimojaterních metastáz. Dalším problémem je vznik adhezí po prvním výkonu, které komplikují sekundární výkon. Nicméně dlouhodobé onkologické výsledky této metody jsou velmi dobré a pětileté přežití se pohybuje nad 40 %. Otázkou zůstává význam onkologické léčby v intervalu mezi operacemi, jejíž role není v recentní literatuře zatím jednoznačná. Pokud je onkologická léčba indikována, pak je dobře volit krátký cyklus, který nepoškozuje regeneraci jaterního parenchymu. Selhání dvojdobé resekce jater z hlediska dostatečného nárůstu FLRV je popisováno u 35 % nemocných. Za rizikové prognostické faktory selhání dvojdobé resekce jsou považovány: počet JMKRK ve FLRV ≥3, věk ≥70 let, progrese malignity během onkologické léčby mezi oběma etapami, předoperační hladina karcinoembryonálního antigenu ≥30 ng/ml, průměr největší JMKRK ≥ 40 mm, počet cyklů onkologické předoperační léčby ≥12.
Metody PVE (PVL) zvyšují FLRV o 8–27 % u 72–80 % nemocných v intervalu 4–6 týdnů [17,18]. Jde o bezpečné metody, kde dlouhodobé výsledky jsou srovnatelné s výsledky primárních resekcí jater. Hypertrofie jater může být pomalejší u nemocných vyššího věku, dále u diabetiků, malnutrice, infekce a poškození jaterní tkáně zevní noxou. Poměrně dlouhý interval hypertrofie jater po PVE může být příčinou zvětšení objemu jaterních nebo nárůstu mimojaterních metastáz. Nedořešenou otázkou zůstává využití perioperační onkologické léčby současně s PVE, PVL na regeneraci jater a dlouhodobé výsledky následné resekce jater.
Z důvodu poměrně pomalého nárůstu FLRV po PVE (PVL) s nebezpečím progrese JMKRK se hledají další, novější metody, jako jsou ALPPS nebo PVE s aplikací MSC, ke zkrácení intervalu nutného k hypertrofii FLRV.
ALPPS je metoda, která znamenala velký historický průlom v jaterní chirurgii nemocných s primárními nebo sekundárními nádory jater, kde FLRV je nedostačující [19]. Metoda využívá dvouetapového výkonu s maximálním zkrácením časového intervalu mezi oběma výkony, což je podstatné k zabránění růstu nádoru v játrech a vytvoření pevných pooperačních srůstů v oblasti jater. Používá se zároveň u nemocných, kde PVE, PVL selhala jako tzv. „rescue“ terapie. Prvním výkonem je podvaz pravé větve portální žíly společně s větvemi pro segmenty 4A and 4B s ponecháním zásobení jater arteriální krví a in situ rozdělení jaterního parenchymu mezi laterálními a mediálními sektory levého laloku jater. Druhým výkonem je pak podvaz a přerušení pravé jaterní tepny, žlučovodu a žíly a odstranění pravé strany jater s nádorem. Tato metoda je v současnosti dále modifikována na tzv. mini-ALPPS metodu užitím laparoskopické techniky s PVE na straně JMKRK [21]. Recentní studie popisují nárůst FLRV o 40–80 % v intervalu 6 až 9 dní po první fázi výkonu, nebo až 22% každodenní nárůst FLRV v porovnání se zhruba 3% nárůstem po PVE. Trvajícím problémem této metody je stále vysoká morbidita (kolem 35 %) a mortalita (kolem 8 %) v porovnání s ostatními výkony indikovanými pro nárůst FLRV. Za rizikové faktory pooperačních komplikací jsou považovány: věk, operační čas první fáze ≥5 hod, krevní transfuze. Jedno - a dvouleté přežívání nemocných se pohybuje kolem 85 a 60 %, bezpříznakové přežívání pak ve stejných intervalech kolem 60 a 40 % [20].
Metoda PVE s aplikací MSC se snaží zvýšit a zrychlit regenerační kapacitu jaterního parenchymu a zkrátit tak interval nutný pro nárůst FLRV po PVE [22]. Podstatou metody je PVE na straně nádoru, odběr MSC z kostní dřeně nebo z krve pomocí leukaferézy s následnou jejich aplikací do druhostranné větve portální žíly. MSC zvyšují rychlost regenerace jaterního parenchymu především parakrinními mechanismy sekrecí cytokinů a růstových faktorů stimulujících růst a diferenciaci hepatocytů, cholangiocytů a dalších buněk. V porovnání se samotnou PVE má tato metoda lepší výsledky co do rychlosti nárůstu FLRV, která se tak zkracuje na 2–3 týdny (Obr. 5). Velkou výhodou metody oproti ALPPS je nulová mortalita a minimální morbidita nemocných. V souvislosti s kombinací PVE a aplikací MSC zůstává nedořešený problém možného nebezpečí proliferace nedetekovatelných mikrometastáz nejen v játrech, ale i v organismu, související s oběma metodami, které stimulují proliferaci a růst. Jedno - a dvouleté přežívání nemocných se pohybuje kolem 75, resp. 50 % a bezpříznakové přežívání ve stejných intervalech kolem 65, resp. 45 % [23].
Obr. 5. Stav po pravostranné hepatektomii, výrazný nárůst FLRV po PVE dx. s aplikací MSC Fig. 5: Status post right-sided hepatectomy; distinct FLRV growth after PVE dx. with MSC application 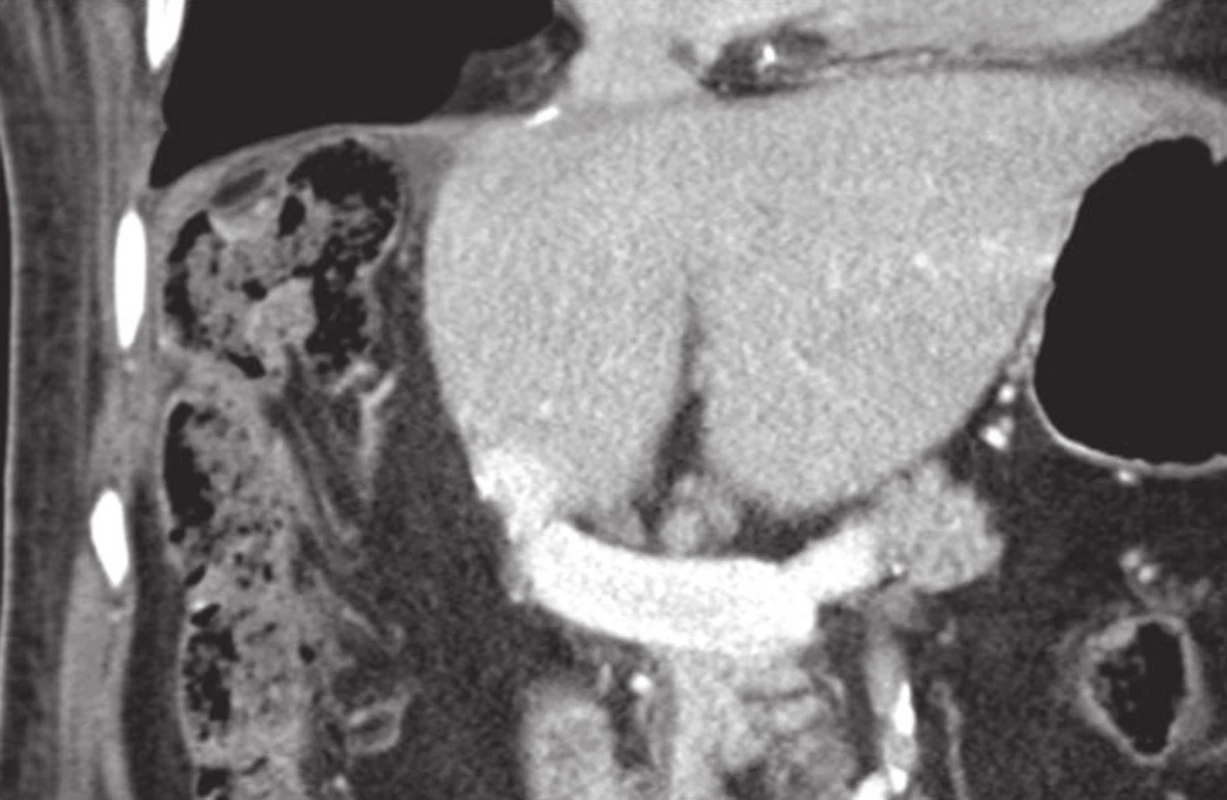
Další metodou je ultrasonograficky asistovaná jednodobá hepatektomie – „ultrasound-guided enhanced one-stage hepatectomy“ (e-OSH), která využívá peroperační USG k navigované resekci bilobárních JMKRK s maximálním šetřením zdravého jaterního parenchymu. Metodu lze využít i u nemocných s větším počtem JMKRK v oblasti FLRV, kde se využívá společně s PVE (PVL) druhostranného řečiště. Průkopníkem metody je Torzilli [24]. Pětileté přežívání nemocných se pohybuje kolem 32 %. Metoda je časově náročnější a vyžaduje dokonalé znalosti peroperační USG jater.
V poslední době je diskutována i možnost transplantace jater [25] u neresekovatelných JMKRK. Tato metoda je využívána jen u přísně selektovaných nemocných s JMKRK bez přítomnosti mimojaterních metastáz. Metoda však dosahuje podstatně horších výsledků než resekční léčba. V současnosti proto probíhají studie (SECA-II, TRANSMET, RAPID) s přísně selektivními kritérii pro zařazení nemocných s JMKRK k transplantaci jater [26–28], jejichž výsledky se očekávají v následujících 5 letech. Problémem zůstává obecně nedostatečný počet jaterních štěpů k transplantaci, v tomto případě zatím víceméně pro klinický experiment.
K paliativním výkonům pak patří termoablační metody (radiofrekvenční ablace – RFA, mikrovlnná ablace – MWA, nebo ireverzibilní elektroporace – IRE), které jsou využívány tam, kde nelze z různých důvodů provést jaterní resekci [29,30]. Jsou rovněž součástí jaterních resekcí, ať už při vytvoření linie řezu pomocí koagulační nekrózy, nebo v rámci kombinovaných výkonů u vícečetných JMKRK, kde se část metastáz resekuje a zbylé pak jsou ošetřeny termokoagulací. K nejčastěji užívaným termoablačním metodám patří RFA a MWA. Obecně mají horší dlouhodobé přežívání a časnější recidivu JMKRK především tam, kde je JMKRK lokalizována u větší cévy, kde krevní proud vede k ochlazování termického efektu (tzv. „heat sink effect“), a tudíž horší ablaci příslušné JMKRK [31]. Horší výsledky jsou rovněž u JMKRK lokalizovaných na povrchu jater (nebezpečí diseminace a implantace nádorových buněk na peritoneu) a u JMKRK větších 3 cm.
Přibližně u 2/3 nemocných, u kterých se primárně podaří odstranit JMKRK, dojde v různém časovém intervalu po operaci k recidivě JMKRK, nejčastěji v prvních 2 letech po operaci jater [32]. Recidiva je vázána jen na jaterní tkáň u 25 % nemocných. Opakované resekce jsou bezpečné a jejich dlouhodobé výsledky se blíží výsledkům primárních resekcí jater [33]. Tam, kde nelze provést další resekční výkon, je často možné využít termoablační techniky k destrukci JMKRK. 5leté přežívání nemocných po opakovaných výkonech se pohybuje mezi 40–50 % [34]. Uvádí se, že čím časnější recidiva, tím horší dlouhodobé přežívání nemocných po dalším výkonu na játrech [35].
Velmi důležitými ukazateli dlouhodobých výsledků léčby JMKRK jsou tzv. negativní prognostické faktory, které je nutné vzít v úvahu při plánování léčebného postupu u nemocných s JMKRK. K takovým faktorům patří předoperační hladina CEA (>200 ng/ml), velikost (největší metastáza) a počet JMKRK, přítomnost mimojaterních metastáz, přítomnost metastáz v lymfatických uzlinách u primárního nádoru, pozitivní lymfatické uzliny v jaterním hilu a synchronní JMKRK [36–38]. K dalším negativním prognostickým faktorům patří nutnost krevních transfuzí v perioperačním období, vznik pooperační infekce snižující protinádorovou imunitu, špatná odpověď na neoadjuvantní onkologickou léčbu dle RECIST kritérií [39]. Tyto ukazatele jsou pak formulovány do různých skórovacích systémů, z nichž známější je tzv. Fongovo kritérium (počet JMKRK, průměr největší metastázy, interval mezi diagnostikou primárního nádoru a JMKRK, CEA, stav postižení lymfatických uzlin u primárního nádoru). K novějším prognostickým ukazatelům patří tzv. tumor infiltrující leukocyty (TIL) v histopatologickém obraze, NLR (poměr neutrofily : lymfocyty), KRAS, BRAF mutace a dále vysoké hladiny telomerázy (enzym důležitý pro dělení rakovinných buněk), thymidylát syntázy (klíčový enzym pro syntézu DNA), faktoru p53 („tumor suppressor gene“), Ki-67 antigen (nutný pro proliferaci nádorových buněk) a přítomnost cirkulujících nádorových buněk [40–42]. Důležitým prognostickým faktorem u nemocných po resekci JMKRK je i histopatologická odpověď nádoru na předoperační onkologickou léčbu – tzv. Tumor Regression Grading (TRG) systém [43,44]. Na tomto místě je třeba zdůraznit, že částečně regredující JMKRK má maximum viabilních nádorových buněk na svém obvodu v tzv. „halo“ (4 mm až 1 cm kolem vlastní JMKRK) zóně mezi nádorem a zdravým jaterním parenchymem, což je důležité pro plánování jaterní resekce [45]. Prognostický význam má i určení růstových vlastností JMKRK, resp. přítomnosti kolagenového pouzdra kolem metastázy, což je z histopatologického hlediska příznivý prognostický faktor. Výše uvedené prognostické faktory jsou důležité pro správné nastavení perioperační onkologické léčby a dispenzarizaci nemocných po jaterních resekcích. Nejsou však kontraindikací jaterní resekce jako takové [46].
U nemocných po operacích jater pro JMKRK je nutná důsledná dispenzární péče. Jako optimální se jeví kontroly ve 3měsíčních intervalech v prvních dvou letech po operaci, v dalším roce po 6 měsících a dále po jednom roce. V těchto intervalech by mělo být provedeno fyzikální vyšetření nemocného, vyšetření sérových nádorových markerů (karcinoembryonální antigen), Rtg plic, USG jater. Koloskopické a CT vyšetření pak v intervalu jednoho roku. Při podezření na recidivu je nutné ihned doplnit další vyšetření (MRI, PET CT, PET MRI).
Závěr
Závěrem lze konstatovat, že jaterní chirurgie udělala v posledním desetiletí velký posun dopředu díky sofistikovaným technikám, které umožňují provádět i složité výkony bez nutnosti krevních převodů. Došlo k velmi významnému posunu v dlouhodobém bezpříznakovém přežívání nemocných s vysokou kvalitou jejich života (Graf 1, 2). To vše je důsledek těsné multidisciplinární spolupráce řady medicínských oborů v diagnostice, léčbě a dispenzární péči nemocných s JMKRK. Nicméně i přes velký posun v péči nemocných s JMKRK stále existují limity jaterních resekcí, které, jak pevně věřím, budou v blízké budoucnosti dále překonávány.
Graf 1. Celkové přežívání nemocných po jaterních resekcích (červeně) a RFA (modře) JMKRK − recentní výsledky vlastního pracoviště Graph 1: Overall survival rate of patients after liver resection (red) and RFA (blue) of CLM – recent results of our department 
Graf 2. Celkové bezpříznakové přežívání nemocných po resekci jater (červerně) a RFA (modře) JMKRK - recentní výsledky vlastního pracoviště Graph 2: Overall symptom-free survival rate of patients after liver resection (red) and RFA (blue) of CLM – recent results of our department 
Práce vznikla s pomocí Výzkumného záměru UK v Praze – PROGRES a grantu AZV ČR č. 17-30015A
Konflikt zájmů
Autor článku prohlašuje, že není v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
prof. MUDr. Vladislav Třeška, DrSc.
Chirurgická klinika UK, LF v Plzni, FN Plzeň,
e-mail: treska@fnplzen.cz
Zdroje
1. Moris D, Pawlik TM. Personalized treatment in patients with colorectal liver metastases. J Surg Res 2017;216 : 26−9.
2. Adam R. LiverMetSurvey, Statistics December 2015. Available from: www.livermetsurvey.org
3. Sofue K, Tsurusaki M, Murakami T, et al. Does Gadoxetic acid-enhanced 3.0T MRI in addition to 64-detector-row contrast-enhanced CT provide better diagnostic performance and change the therapeutic strategy for the preoperative evaluation of colorectal liver metastases? Eur Radiol 2014;24 : 2532−9.
4. Mentha G, Terraz S, Morel P, et al. Dangerous halo after neoadjuvant chemotherapy and two-step hepatectomy for colorectal liver metastases. Br J Surg. 2009; 96 : 95−103.
5. Adam R. Colorectal cancer with synchronous liver metastases. Br J Surg 2007; 94 : 129−31.
6. Nordlinger B, Sorbye H, Glimelius B, et al. EORTC Gastro-Intestinal Tract Cancer Group; Cancer Research UK; Arbeitsgruppe Lebermetastasen und-tumoren in der Chirurgischen Arbeitsgemeinschaft Onkologie (ALM-CAO); Australasian Gastro-Intestinal Trials Group (AGITG); Fédération Francophone de Cancérologie Digestive (FFCD). Perioperative chemotherapy with FOLFOX4 and surgery versus surgery alone for resectable liver metastases from colorectal cancer (EORTC Intergroup trial 40983): a randomised controlled trial. Lancet 2008; 22 : 371 : 1007−16.
7. Adam R, Bhangui P, Poston G, et al. Is perioperative chemotherapy useful for solitary, metachronous, colorectal liver metastases? Ann Surg 2010;252 : 774−87.
8. Nagayama S, Hasegawa S, Hida K, et al. Multi-institutional phase II study on the feasibility of liver resection following preoperative mFOLFOX6 therapy for resectable liver metastases from colorectal cancers. Int J Clin Oncol 2017;22 : 316−23.
9. Rubbia-Brandt L, Lauwers GY, Wang H, et al. Sinusoidal obstruction syndrome and nodular regenerative hyperplasia are frequent oxaliplatin-associated liver lesions and partially prevented by bevacizumab in patients with hepatic colorectal metastasis. Histopathology 2010; 56 : 430−9.
10. Kesmodel SB, Ellis LM, Lin E, et al. Preoperative bevacizumab does not significantly increase postoperative complication rates in patients undergoing hepatic surgery for colorectal cancer liver metastases. J Clin Oncol 2008; 10 : 26 : 5254−60.
11. Andres A, Toso C, Adam R, et al. A survival analysis of the liver-first reversed management of advanced simultaneous colorectal liver metastases: a LiverMetSurvey-based study. Ann Surg 2012;256 : 772−8.
12. Pudil J, Batko S, Menclová K, et al. “Liver first” přístup v léčbě synchronních jaterních metastáz kolorektálního karcinomu. Rozhl Chir 2015; 94 : 522−5.
13. Straka M, Skrovina M, Soumarova R, et al. Up front hepatectomy for metastatic rectal carcinoma − reversed, liver first approach. Early experience with 15 patients. Neoplasma 2014; 61 : 447−52.
14. Quan D, Gallinger S, Nhan C, et al. Surgical Oncology Program at Cancer Care Ontario. The role of liver resection for colorectal cancer metastases in an era of multimodality treatment: a systematic review. Surgery 2012;151 : 860−70.
15. Imai K, Castro Benitez C, Allard MA, et al. Potential of a cure in patients with colorectal liver metastases and concomitant extrahepatic disease. J Surg Oncol 2017;115 : 488−96.
16. Andres A, Mentha G, Adam R, et al. Surgical management of patients with colorectal cancer and simultaneous liver and lung metastases. Br J Surg 2015;102 : 691−9.
17. Schnitzbauer AA, Lang SA, Goessmann H, et al. Right portal vein ligation combined with in situ splitting induces rapid left lateral liver lobe hypertrophy enabling 2-staged extended right hepatic resection in small-for-size settings. Ann Surg 2012;255 : 405−14.
18. Ironside N, Bell R, Bartlett A, et al. Systematic review of perioperative and survival outcomes of liver resections with and without preoperative portal vein embolization for colorectal metastases. HPB (Oxford) 2017;19 : 559−66.
19. Schadde E, Ardiles V, Slankamenac K, et al. ALPPS offers a better chance of complete resection in patients with primarily unresectable liver tumors compared with conventional-staged hepatectomies: results of a multicenter analysis. World J Surg 2014;38 : 1510−9.
20. Tschuor Ch, Croome KP, Sergeant G, et al. Salvage parenchymal liver transection for patients with insufficient volume increase after portal vein occlusion − an extension of the ALPPS approach. Eur J Surg Oncol 2013;39 : 1230−5.
21. de Santibañes E, Alvarez FA, Ardiles V, et al. Inverting the ALPPS paradigm by minimizing first stage impact: the Mini-ALPPS technique. Langenbecks Arch Surg 2016;401 : 557−63.
22. Treska V, Liska V, Lysak D, et al. Portal vein embolization with application of haematopoietic stem cells in patients with primarily non-resectable colorectal liver metastases. Anticancer Research 2014; 34 : 7279−86.
23. Treska V. Methods to increase future liver remnant volume in patients with primarily unresectable colorectal liver metastases: Current state and future perspectives. Anticancer Res 2016;36 : 2065−72.
24. Torzilli G, Adam R, Viganò L, et al. Surgery of colorectal liver metastases: Pushing the limits. Liver Cancer 2016;6 : 80−9.
25. Toso C, Merani S, Bigam DL, et al. Sirolimus-based immunosuppression is associated with increased survival after liver transplantation for hepatocellular carcinoma. Hepatology 2010;51 : 1237−43.
26. Hagness M, Foss A, Line PD, et al. Liver transplantation for nonresectable liver metastases from colorectal cancer. Ann Surg 2013;257 : 800−6.
27. Foss A, Lerut JP. Liver transplantation for metastatic liver malignancies. Curr Opin Organ Transplant 2014;19 : 235−44.
28. Line PD, Hagness M, Berstad AE, et al. Novel concept for partial liver transplantation in nonresectable colorectal liver metastases: The RAPID concept. Ann Surg 2015;262 : 5−9.
29. Aissou S, Cartier V, Hamy A, et al. Radiofrequency in the management of colorectal liver metastases: A 10-year experience at a single center. Surg Technol Int 2016;26 : 99−105.
30. Hur H, Ko YT, Min BS, et al. Comparative study of resection and radiofrequency ablation in the treatment of solitary colorectal liver metastases. Am J Surg 2009;197 : 728−36.
31. Vavra P, Nowakova J, Ostruszka P, et al. Colorectal cancer liver metastases: laparoscopic and open radiofrequency-assisted surgery. Wideochir Inne Tech Maloinwazyjne 2015;10 : 205−12.
32. Fukami Y, Kaneoka Y, Maeda A, et al. Postoperative complications following aggressive repeat hepatectomy for colorectal liver metastasis have adverse oncological outcomes. Surg Today 2017;47 : 99−107.
33. Jones RP, Jackson R, Dunne DF, et al. Systematic review and meta-analysis of follow-up after hepatectomy for colorectal liver metastases. Br J Surg. 2012;99 : 477−86.
34. Saiura A, Yamamoto J, Koga R, et al. Favorable outcome after repeat resection for colorectal liver metastases. Ann Surg Oncol 2014;21 : 4293−9.
35. Hof J, Wertenbroek MW, Peeters PM, et al. Outcomes after resection and/or radiofrequency ablation for recurrence after treatment of colorectal liver metastases. Br J Surg 2016;103 : 1055−62.
36. Pereira AA, Rego JF, Morris V, et al. Association between KRAS mutation and lung metastasis in advanced colorectal cancer. Br J Cancer 2015;112 : 424−8.
37. Bruin SC, He Y, Mikolajewska-Hanclich I, et al. Molecular alterations associated with liver metastases development in colorectal cancer patients. Br J Cancer 2011;12;105 : 281−7.
38. Brudvik KW1, Kopetz SE, Li L, et al. Meta-analysis of KRAS mutations and survival after resection of colorectal liver metastases. Br J Surg. 2015;102 : 1175−83.
39. Azoulay D, Bhangui P, Pascal G, et al. The impact of expanded indications on short-term outcomes for resection of malignant tumours of the liver over a 30 year period. HPB (Oxford) 2017;19 : 638−48.
40. Loes IM, Immervoll H, Sorbye H, et al. Impact of KRAS, BRAF, PIK3CA, TP53 status and intraindividual mutation heterogeneity on outcome after liver resection for colorectal cancer metastases. Int J Cancer 2016;139 : 647−56.
41. Yaeger R, Cercek A, Chou JF, et al. BRAF mutation predicts for poor outcomes after metastasectomy in patients with metastatic colorectal cancer. Cancer 2014;120 : 2316−24.
42. Tran B, Kopetz S, Tie J, et al. Impact of BRAF mutation and microsatellite instability on the pattern of metastatic spread and prognosis in metastatic colorectal cancer. Cancer 2011;117 : 4623−32.
43. Blazer DG, Kishi Y, Maru DM, et al. Pathologic response to preoperative chemotherapy: a new outcome end point after resection of hepatic colorectal metastases. J Clin Oncol 2008;26 : 5344−51.
44. Yokoyama N, Shirai Y, Ajioka Y, et al. Immunohistochemically detected hepatic micrometastases predict a high risk of intrahepatic recurrence after resection of colorectal carcinoma liver metastases. Cancer 2002;94 : 1642−7.
45. Vermeulen PB, Colpaert C, Salgado R, et al. Liver metastases from colorectal adenocarcinomas grow in three patterns with different angiogenesis and desmoplasia. J Pathol. 2001;195 : 336−42.
46. Liška V, Emingr M, Skála M, et al. Jaterní metastázy karcinomů kolon a rekta z pohledu rozdílů v klinických parametrech. Rozhl Chir 2016;95 : 69−79.
Štítky
Chirurgia všeobecná Ortopédia Urgentná medicína
Článok vyšiel v časopiseRozhledy v chirurgii
Najčítanejšie tento týždeň
2018 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Multidisciplinární týmy: jak dál?
- Ocenění nejlepších článků 96. ročníku Rozhledů v chirurgii
- Chirurgie jater pro metastázy kolorektálního karcinomu
- Radioterapie v léčbě karcinomu rekta – čas na změnu?
- Umělý svěrač anu po deseti letech
- Technické aspekty fluorescenční angiografie pro peroperační hodnocení perfuze anastomózy v kolorektální chirurgii
- K životnímu jubileu profesora Vladimíra Krále
- Význam předoperačně zjištěné extramurální vaskulární invaze v léčbě karcinomu rekta
- Operační řešení zlomenin střední části klíční kosti pomocí nitrodřeňového hřebu
- Koincidencia akútnej cholecystitídy a akútnej apendicitídy
- Rozhledy v chirurgii
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Operační řešení zlomenin střední části klíční kosti pomocí nitrodřeňového hřebu
- Umělý svěrač anu po deseti letech
- Chirurgie jater pro metastázy kolorektálního karcinomu
- Radioterapie v léčbě karcinomu rekta – čas na změnu?
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



