-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Role nových antibiotik u nitrobřišních infekcí v éře multirezistentních bakterií
The role of new antibiotics in intra-abdominal infections in the era of multi-resistant bacteria
Complicated intra-abdominal infections (cIAI) are a substantial cause of morbidity at intensive care units. cIAI are frequently caused by multidrug-resistant strains of Enterobacteriaceae and Pseudomonas aeruginosa. In 592 cIAI patients from the First Department of Surgery, General University Hospital in Prague, we found an alarming increase in resistance of Escherichia coli to amoxicillin/clavulanic acid, piperacillin/tazobactam and third-generation cephalosporins in 2014–2017 (from 28.7% in 2014 to 37.5% in 2017, from 25% to 32% and from 2.3% to 5.6%, respectively). Ceftolozane/tazobactam and ceftazidime/avibactam are novel cephalosporins available for the treatment of cIAI. Ceftolozane/tazobactam is highly active against multidrug-resistant strains of P. aeruginosa, including carbapenem-resistant isolates. The new non-b-lactam b-lactamase inhibitor avibactam plus ceftazidime is active against carbapenemases-producing strains of Enterobacteriaceae. Both antibiotics are included in the new WSES guidelines for the management of cIAI.
Keywords:
complicated intraabdominal infections – bacterial resistance – ceftolozane/tazobactam – ceftazidime/avibactam
Autori: V. Adámková
Pôsobisko autorov: Ústav lékařské mikrobiologie Lékařské fakulty Univerzity Palackého, Olomouc ; Ústav lékařské biochemie a laboratorní diagnostiky Všeobecné fakultní nemocnice v Praze
Vyšlo v časopise: Rozhl. Chir., 2019, roč. 98, č. 4, s. 145-151.
Kategória: Souhrnné sdělení
Súhrn
Komplikované nitrobřišní infekce (cIAI) jsou častou příčinou nemocnosti na jednotkách intenzivní péče. Stále častěji jsou vyvolány multirezistentními kmeny enterobakterií či Pseudomonas aeruginosa. V souboru 592 pacientů z 1. chirurgické kliniky VFN v Praze v letech 2014–2017 byl zaznamenán alarmující nárůst rezistence u kmenů Escherichia coli k potencovaným aminopenicilinům, piperacilinu/tazobaktamu a cefalosporinům třetí generace (z 28,7 % v roce 2014 na 37,5 % v roce 2017, z 25 % na 32 % a z 2,3 % na 5,6 % resp.). Ceftolozan/tazobaktam a ceftazidim/avibaktam patří mezi nová cefalosporinová antibiotika s indikací na léčbu komplikovaných nitrobřišních infekcí. Ceftolozan/tazobaktam vykazuje vysokou účinnost vůči multirezistentním kmenům P. aeruginosa včetně karbapenem rezistentních izolátů. Nový nebeta-laktamové inhibitor beta-laktamáz avibaktam v kombinaci s ceftazidimem je účinný na kmeny enterobakterií produkujících karbapenemázy. Obě antibiotika jsou součástí nových WSES doporučených postupů pro terapii komplikovaných nitrobřišních infekcí.
Klíčová slova:
komplikované nitrobřišní infekce – bakteriální rezistence – ceftolozan/tazobaktam – ceftazidim/avibaktam
Úvod
Komplikované nitrobřišní infekce (cIAI) jsou, i přes adekvátní chirurgickou terapii, druhou nejčastější příčinou mortality na jednotkách intenzivní péče [1]. Management cIAI je komplexní a zahrnuje jak chirurgické ošetření zdroje, tak vhodnou antibiotickou terapii. Současné doporučené postupy léčby cIAI navrhují pro empirické antibiotické krytí taková antibiotika, která mají ve svém spektru gramnegativní tyčinky i grampozitivní koky, především enterokoky, a zároveň reflektují lokální epidemiologickou situaci. Přidání antibiotika se spektrem účinku proti obligátním anaerobům je doporučováno do kombinace pouze u infekcí, kde zdrojem infekce je appendix nebo tlusté střevo a konečník. Předchozí doporučené postupy navrhovaly monoterapii (cefalosporiny 3. generace, ertapenem, tigecyklin) pro středně závažné komunitní IAI nebo meropenem, piperacilin/tazobaktam či cefepim s metronidazolem pro závažné nebo nozokomiální IAI [2,3].
Avšak optimální volba antibiotika pro cIAI může být výrazně komplikovanější, a to především díky stále se zvyšujícímu podílu multirezistentních bakterií jako původců cIAI. Nevhodná nebo opožděná antibiotická léčba zvyšuje jak riziko terapeutického selhání, tak náklady spojené s následnou péčí včetně prodloužení délky hospitalizace [4].
Etiologie komplikovaných nitrobřišních infekcí je polymikrobní a zahrnuje mikroorganismy pocházející primárně ze zažívacího traktu pacienta, především enterobakterie. Narůstající rezistence těchto bakterií nejen ve zdravotnických zařízeních, ale i v komunitě se stává obrovskou výzvou v léčbě cIAI [5]. Existující doporučené postupy se v kontextu těchto epidemiologických dat stávají zcela nedostatečnými a nová antibiotika, která by byla účinná na multirezistentní původce, jsou čím dále častěji vyžadována.
Rezistence u původců komplikovaných nitrobřišních infekcí
Enterobakterie jsou nejčastějšími původci cIAI, a proto je třeba jim věnovat zvýšenou pozornost. Současným největším problémem vyskytující se rezistence u těchto bakterií je produkce tzv. širokospektrých beta-laktamáz (ESBL – extended-spectrum beta-lactamase).
Surveillance studie pravidelně monitorující trendy rezistence u patogenů cIAI, jako např. SMART (the Study for Monitoring Antimicrobial ResistanceTrends), dokládají narůstající podíl ESBL produkujících kmenů Escherichia coli z 9 % v roce 2003 na 11 % v roce 2010 a Klebsiella pneumoniae ze 14 % na 23 %, zároveň byl zaznamenán trend poklesu citlivosti těchto původců k fluorovaným chinolonům z 81 % v roce 2003 na 71 % v roce 2007 a cefalosporinům třetí generace z 90 % na 77 % [6]. Ačkoliv zůstávají karbapenemy (ertapenem, meropenem, imipenem) lékem první volby na infekce vyvolané ESBL produkujícími kmeny enterobakterií, je pozorován snižující se trend citlivosti kmenů K. pneumoniae produkujících ESBL k ertapenemu [7,8].
Rozsáhlé a nepřiměřené používání karbapenemů podporuje objevení se karbapenem rezistentních kmenů, jejichž zvyšující se podíl je patrný především u infekcí spojených s poskytovanou zdravotní péčí.
Kromě enterobakterií může být dalším původcem cIAI Pseudomonas aeruginosa, především u zánětlivých pooperačních komplikací, u které je zachycen nepříznivý nárůst rezistence (>30 %) k amikacinu, ceftazidimu či karbapenemům u izolátů z nozokomiálních IAI [9].
V případě nitrobřišních infekcí spojených s poskytovanou zdravotní péčí je třeba vzít v potaz i roli enterokoků a kvasinek, přičemž zde je problém narůstající rezistence kmenů Enterococcus faecium k vankomycinu a kvasinek k flukonazolu [10,11].
Zvyšující se trend výskytu rezistentních kmenů je alarmující, avšak globální data nejsou dostatečným podkladem pro adekvátní antibiotickou léčbu konkrétního pacienta. Vždy je třeba vzít v úvahu, kromě rizikových faktorů výskytu rezistentních bakterií, i lokální epidemiologickou situaci. Bohužel nejsou k dispozici celonárodní data, která by se dala porovnat s těmi evropskými, ale každé chirurgické pracoviště by mělo mít k dispozici kumulativní antibiogramy nejčastěji se vyskytujících původců nitrobřišních infekcí.
V případě původců nitrobřišních infekcí analyzovaných v letech 2014–2017 na 1. chirurgické klinice VFN v Praze je též patrný nárůst rezistence k nejčastěji používaným antibiotikům, ať již používaných v profylaxi, nebo terapeuticky.
V uvedeném souboru bylo vyšetřeno 592 pacientů s nitrobřišní infekcí, přičemž nejčastěji zastoupeným původcem byla Escherichia coli s narůstají rezistencí k potencovaným aminopenicilinům, piperacilinu/tazobaktamu i fluorovaným chinolonům, Klebsiella sp. se stejnými trendy rezistence a navíc ojedinělým záchytem karbapenem rezistentních kmenů (v roce 2015 a 2017), Enterococcus faecium, kdy rezistence k vankomycinu byla zachycena pouze v roce 2014 a 2015, a dále Pseudomonas aeruginosa s výraznou rezistencí ke karbapenemům (Tab. 1, Graf 1, 2, 3). Data u izolátů E. faecium a P. aeruginosa jsou srovnatelná s evropskými trendy, ale podíl ESBL produkujících kmenů K. pneumoniae je téměř dvojnásobný, což dokumentují i surveillance data z jiné databáze – EARS-Net (European Antimicrobial Resistance Surveillance Network), která monitoruje rezistenci u invazivních izolátů z hemokultur a kde je Česká republika na čelních místech ve výskytu ESBL produkujících enterobakterií [12].
Tab. 1. Zastoupení nejčastějších bakteriálních kmenů z klinických materiálů z dutiny břišní a podíl významného typu rezistence
Tab. 1: Incidence of the most frequent bacteria from intra-abdominal specimen and proportion of important type of antibacterial resistance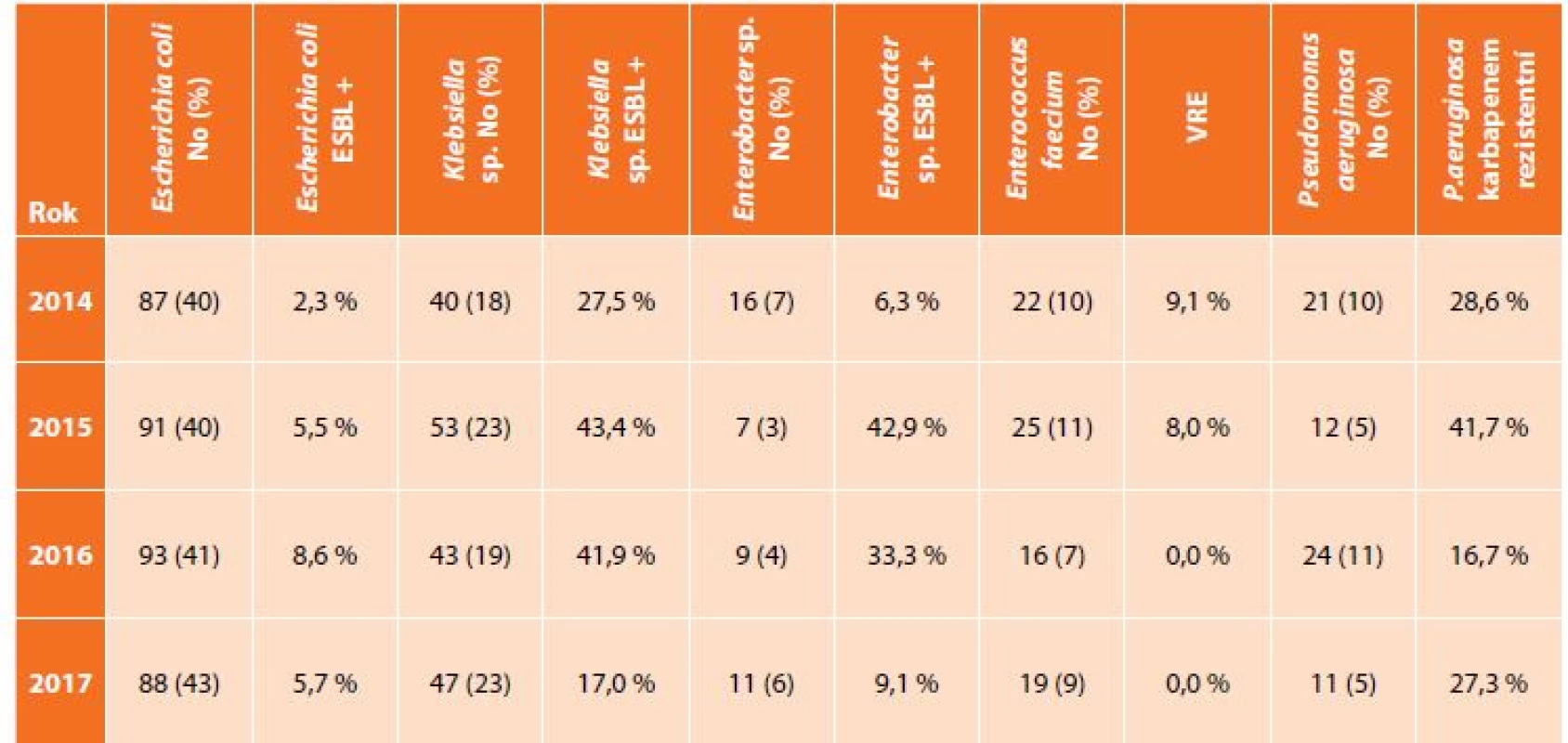
Zkratky: ESBL – extended-spectrum beta-lactamase Graf 1. Přehled rezistence u kmenů Escherichia coli izolovaných z cIAI
Graph 1: Resistance trends of Escherichia coli isolated from cIAI
Zkratky: AMC – amoxicilin/k. klavulanová, AMI – amikacin, CEF III – cefalosporiny 3. generace, KAR – karbapenemy, GEN – gentamicin, FQ – fluorované chinolony, PIP/TAZ – piperacilin/tazobaktam, TGC - tigecyklin Abbreviations: AMC – amoxicillin/clavulanic acid, AMI – amikacin, CEF III – 3rd generation of cephalosporines, KAR – carbapenems, GEN – gentamicin, FQ – fluoroquinolones, PIP/TAZ – piperacillin/tazobactam, TGC - tigecycline Graf 2. Přehled rezistence u kmenů Klebsiella sp. izolovaných z cIAI
Graph 2: Resistance trends of Klebsiella sp. isolated from cIAI
Zkratky: AMC – amoxicilin/k. klavulanová, AMI – amikacin, CEF III – cefalosporiny 3. generace, KAR – karbapenemy, GEN – gentamicin, FQ – fluorované chinolony, PIP/TAZ – piperacilin/tazobaktam, TGC - tigecyklin Abbreviations: AMC – amoxicillin/clavulanic acid, AMI – amikacin, CEF III – 3rd generation of cephalosporines, KAR – carbapenems, GEN – gentamicin, FQ – fluoroquinolones, PIP/TAZ – piperacillin/tazobactam, TGC - tigecycline Graf 3. Přehled rezistence u kmenů Pseudomonas aeruginosa izolovaných z cIAI
Graph 3: Resistance trends of Pseudomonas aeruginosa isolated from cIAI
Zkratky: AMI – amikacin, CIP – ciprofloxacin, CTZ – ceftazidim, GEN – gentamicin. KAR – karbapenemy, PIP/TAZ – piperacilin/tazobaktam Abbreviations: AMI – amikacin, CIP – ciprofloxacin, CTZ – ceftazidime, GEN – gentamicin, KAR – carbapenems, PIP/TAZ – piperacilin/tazobactam Nová antibiotika pro terapii nitrobřišních infekcí
Znepokojivá epidemiologická data ukazují potřebu nových přístupů k terapii infekcí vyvolaných těmito multirezistentními bakteriemi, v případě komplikovaných nitrobřišních infekcí je to především otázka vhodného antibiotického krytí producentů širokospektrých beta-laktamáz. V rutinní praxi jsou stále častěji používány karbapenemy, popřípadě tigecyklin, avšak narůstající spotřeba karbapenemových antibiotik vede k další selekci rezistentních bakterií. Rezistence ke karbapenemovým antibiotikům je způsobena buď produkcí karbapenemáz (enzymy degradující karbapenemová antibiotika – KPC, OXA, VIM, IMP a NDM) (Tab. 2), nebo změnou porinové permeability, jež má za následek sníženou schopnost antibiotika dostat se k cílové struktuře bakteriální buňky [13]. Velkou výzvou současné medicíny je nejenom vývoj nových molekul s účinkem na karbapenemrezistentní bakterie, ale též snížení jejich spotřeby, aby se rezistence dále nezvyšovala.
Tab. 2. Klasifikace beta-laktamáz dle Amblera a vztah C/T a C/A
Tab. 2: Ambler classification of beta-lactamases and relation to C/T and C/A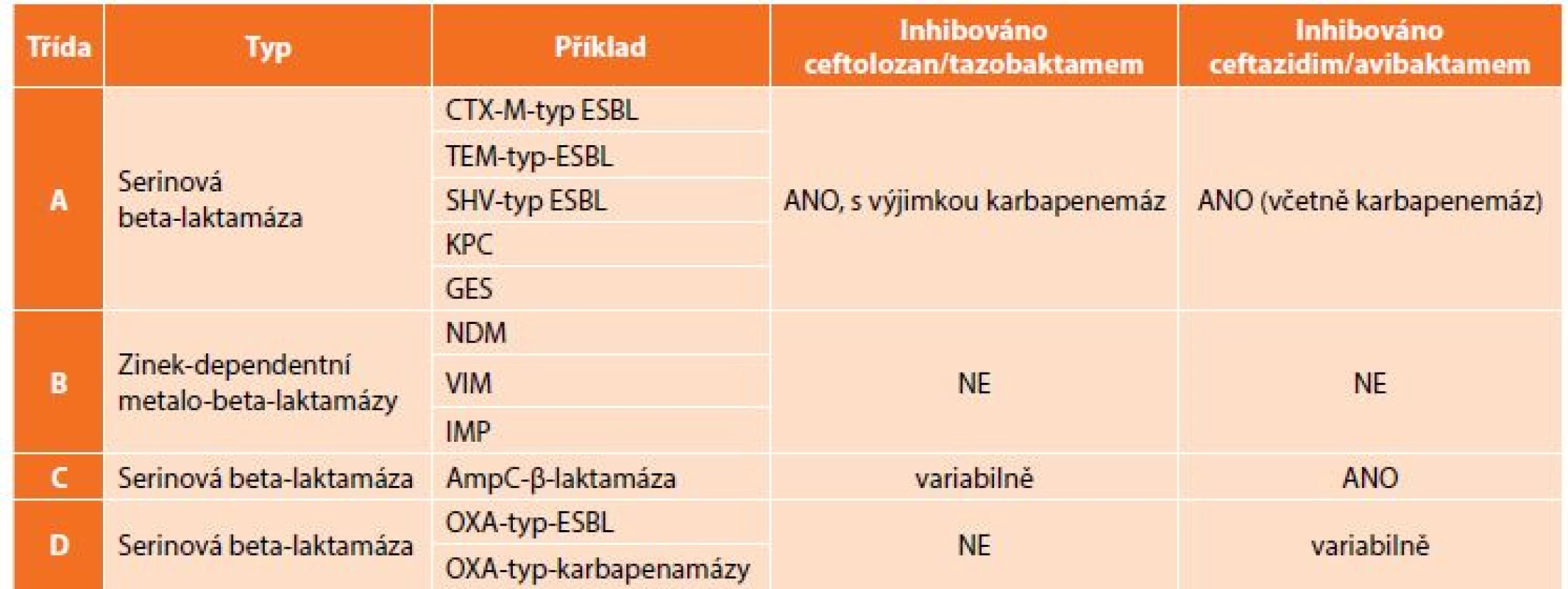
Vysvětlivky: ESBL – extended-spectrum beta-lactamase Jako tzv. karbapenem šetřící strategie se jeví použití dvou nových antibiotik, která byla schválena a uvolněna FDA mimo jiné pro terapii komplikovaných nitrobřišních infekcí vyvolaných rezistentními kmeny Pseudomonas aeruginosa a enterobakterií. Obě jsou ze skupiny cefalosporinů a jsou kombinována s inhibitorem beta-laktamáz. Jedná se o ceftolozan s tazobaktamem a ceftazidim s avibaktamem.
Ceftolozan/tazobaktam (C/T)
Ceftolozan/tazobaktam (ZerbaxaⓇ, MSD, USA) byl v prosinci 2014 schválen FDA pro terapii komplikovaných nitrobřišních infekcí v kombinaci s metronidazolem a pro terapii komplikovaných infekcí močových cest. Ceftolozan je nové cefalosporinové antibiotikum strukturálně podobné třetí generaci cefalosporinů, avšak s posílenou účinností vůči kmenům P. aeruginosa díky zvýšené odolnosti vůči hydrolýze a efluxu. Kombinace s tazobaktamem, jako inhibitorem beta-laktamáz, zvyšuje odolnost ceftolozanu před účinkem beta-laktamáz třídy A a C [14].
Na základě výsledků klinických zkoušek ASPECT-cIAI (Assessment of the Safety Profile and Efficacy of Ceftolozane/Tazobactam in Complicated Intra-abdominal Infections) byl uvolněn pro léčbu cIAI v kombinaci metronidazolem. Komparátorem ve studii byl meropenem a ceftolozan/tazobaktam splnil kritéria noninferiority. Klinická účinnost byla 94,2 % pro C/T a 94,7 % pro meropenem. Mezi nejčastěji izolované původce patřily kmeny E. coli, (65,1 %), K. pneumoniae (9,4 %) a P. aeruginosa (8,9 %). Více než polovina pacientů měla polymikrobní nález. U pacientů s infekcí vyvolanou producenty ESBL byla klinická účinnost zaznamenána v 95,8 % ve skupině ceftolozan/tazobaktam s metronidazolem a v 88,5 % pro meropenem [15]. Analýza subpopulace pacientů s infekcí P. aeruginosa ukázala 100% účinnost C/T oproti 93,1% u meropenemu. In vitro aktivita C/T vůči klinickým izolátům P. aeruginosa hodnocená MIC90 byla dvojnásobná než u meropenemu, 32násobná vůči piperacilinu/tazobaktamu a 8násobná než u gentamicinu [16]. Nežádoucí účinky byly srovnatelné v obou skupinách, nejčastěji se jednalo o nauzeu nebo průjem. Dávkování C/T je 1,5 g každých 8 hodin (+ metronidazol 500 mg po 8 hod). Ceftolozan/tazobaktam je eliminován převážně ledvinami, a proto je nutná úprava dávky (Tab. 3) [17].
Tab. 3. Dávkování ceftolozan/tazobaktamu a ceftazidim/avibaktamu při renální insuficienci
Tab. 3: Dosage of ceftolozane/tazobactam and ceftazidime/avibactam in renal insufficiency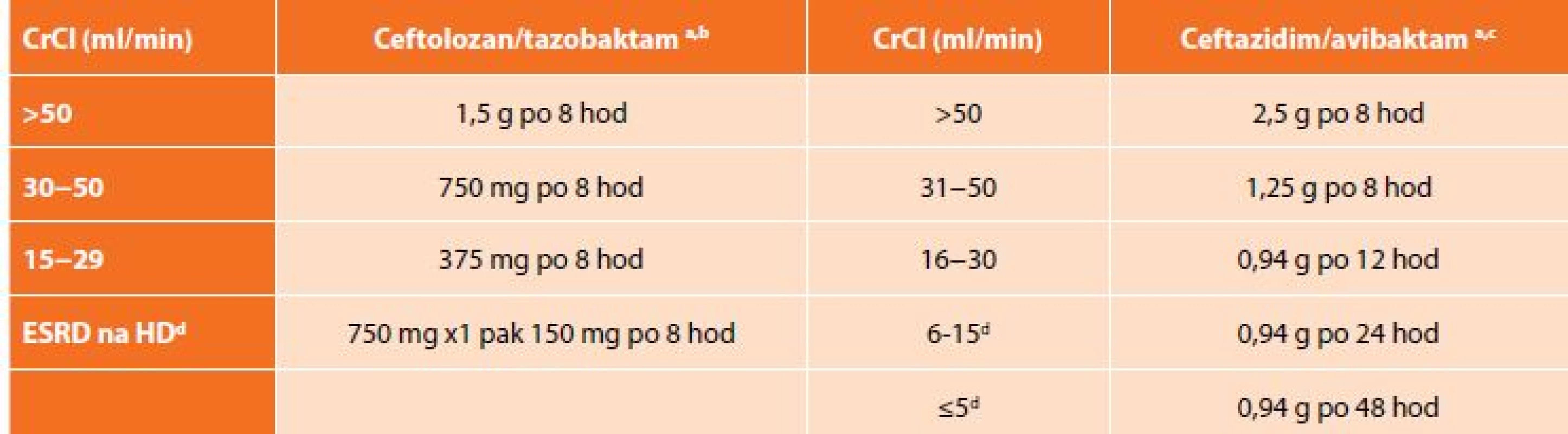
Vysvětlivky: a celková dávka cefalosporinu a inhibitoru betalaktamáz; b hodinová infuze; c délka infuze 2 hodiny; d dávka se podává po dialýze; CrCl – clearance kreatininu dle Cockroft-Gault; ESRD – end-stage renal disease; HD – hemodialýza. Vzhledem k nákladům na terapii ceftolozan/tazobaktamem v porovnání s ostatními kombinacemi běžně užívaných antibiotik, zůstane C/T lékem především pro pacienty s pseudomonádovou infekcí, kde je jeho účinnost nesrovnatelně vyšší než u ostatních antibiotik včetně karbapenemů.
Ceftazidim/avibaktam (C/A)
Ceftazidim/avibaktam (ZaviceftaⓇ, Pfizer, USA) byl FDA schválen pro léčbu cIAI v únoru 2015 v kombinaci s metronidazolem u komplikovaných močových infekcí, dále je schválen k terapii dospělých hospitalizovaných pacientů s komplikovanými močovými infekcemi včetně pyelonefritidy, s nozokomiální pneumonií včetně ventilátorové a infekcí vyvolaných gramnegativními aerobními bakteriemi s omezenými léčebnými možnostmi. Jedná se o zavedený cefalosporin třetí generace kombinovaný s novým nebeta-laktamovým inhibitorem beta-laktamáz – avibaktamem. Samotný avibaktam nemá dostatečnou klinickou účinnost, ale inhibuje široké spektrum beta-laktamáz třídy A, C a některé z třídy D [18].
V in vitro studiích vykazoval C/A velmi vysokou aktivitu vůči enterobakteriím včetně multirezistentních (99,3 %), extenzivně rezistentních (96,5 %) a meropenem rezistentních kmenů (98 %) [19,20]. Účinnost na karbapenem rezistentní kmeny byla testována v mnoha studiích a ceftazidim/avibaktam byl nejúčinnější ze všech testovaných beta-laktamů. Ze 177 kmenů produkujících různé typy karbapenemáz byla in vitro účinnost C/A 93 % v porovnání s kolistinem (88 %), tigecyklinem (79 %) a fosfomycinem (78 %) [21]. Ceftazidim/avibaktam není in vitro účinný na kmeny produkující metalo-beta-laktamázy (třída B).
Klinická účinnost byla hodnocena ve dvou randomizovaných, dvojitě zaslepených mezinárodních studiích, komparátorem byl opět meropenem. Nejčastější diagnózou byla perforace apendixu nebo periapendikulární absces (42 %), dále perforace žaludečního či duodenálního vředu a cholecystitida. Ve všech sledovaných parametrech, ať již klinické účinnosti, nebo mikrobiologické eradikaci, byl ceftazidim/avibaktam v kombinaci s metronidazolem srovnatelný s meropenem. Nežádoucí účinky byly též srovnatelné a většinou se jednalo o zažívací obtíže.
Doporučené dávkování je 2,5 g každých 8 hod. (+ metronidazol 500 mg po 8 hod). Stejně jako ceftolozan/tazobaktam i ceftazidim/avibaktam se vylučuje ledvinami, a proto je nutná úprava dávky při renální insuficienci (Tab. 3). C/A se odstraňuje dialýzou, a tak je doporučeno podávání až po dialýze [22].
Další nová antibiotika
Kromě výše uvedených kombinací antibiotik, která jsou již dostupná v klinické praxi, jsou ve fázi klinických zkoušek testovány další molekuly či kombinace „starých“ antibiotik s novými druhy inhibitorů beta-laktamáz. K dispozici jsou zatím pouze výsledky laboratorní účinnosti, které se jeví jako slibné, avšak je třeba počkat na závěry klinického hodnocení (Tab. 4) [23].
Tab. 4. Přehled nových antibiotik a jejich in vitro aktivita vůči multirezistentním gramnegativním bakteriím
Tab. 4: New antibiotics and their in vitro activity against multi-drug resistant bacteria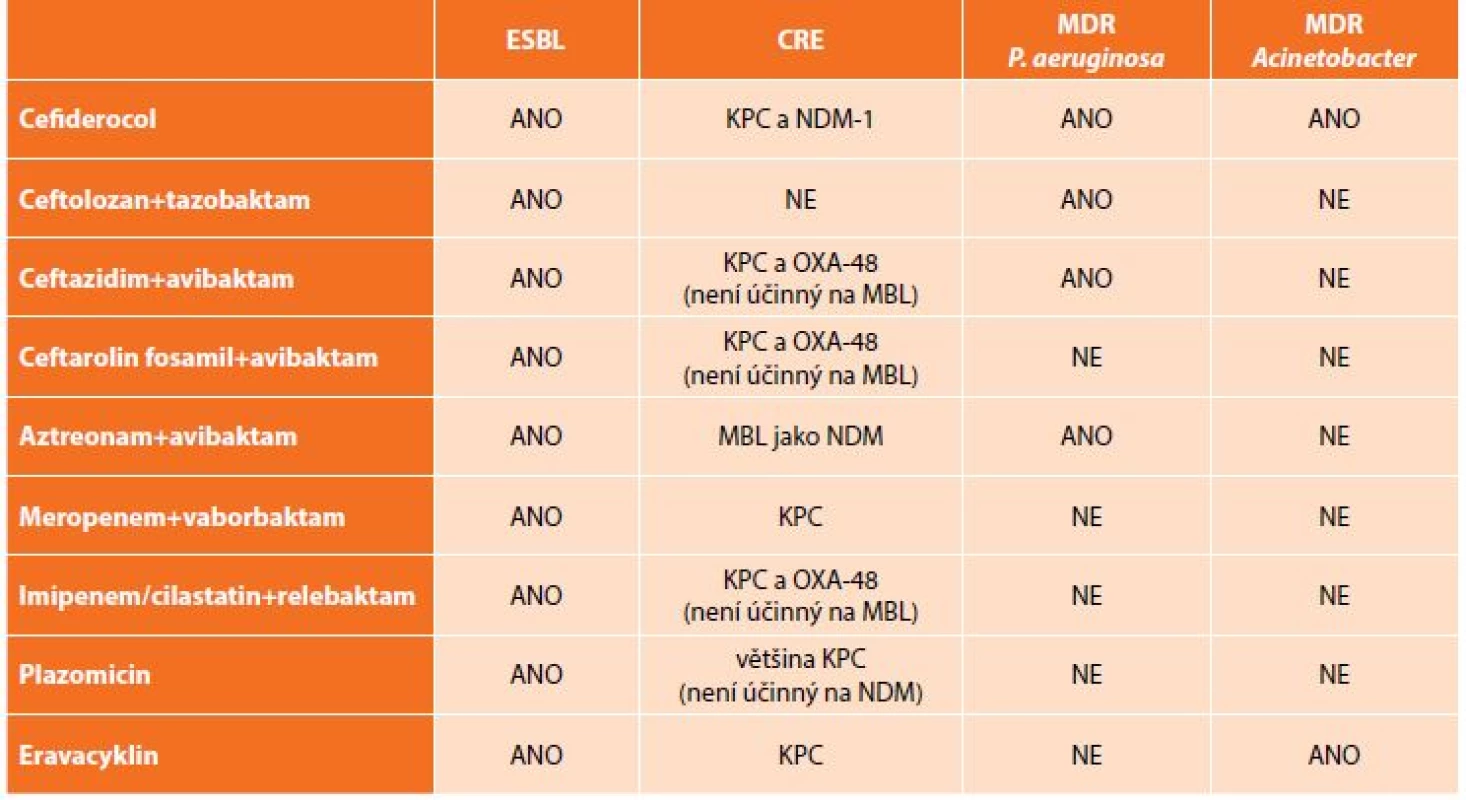
Diskuze
Antibiotická terapie hraje klíčovou roli v managementu komplikovaných nitrobřišních infekcí, zvláště u pacientů v kritickém stavu, kteří vyžadují bezprostřední zahájení adekvátní léčby. Nevhodná úvodní antibiotická léčba jednoznačně zvyšuje riziko klinického selhání, na druhé straně nadužívání širokospektrých antibiotik má za následek selekci rezistentních bakterií a jejich šíření, což se v konečném důsledku promítne i do nákladové efektivity léčby.
Optimální strategie antibiotické terapie nitrobřišních infekcí by měla zahrnovat účinnou iniciální terapii, která bude na jedné straně klinicky efektivní, ale zároveň nepovede k nadměrné spotřebě antibiotik, a tím nebude zvyšovat selekční tlak. Změna přístupu k antiinfekční terapii nitrobřišních infekcí odráží narůstající rezistenci nejčastějších bakteriálních původců k antibiotikům – kmeny E. coli, K. pneumoniae produkující širokospektré beta-laktamázy, karbapenem rezistentní kmeny P. aeruginosa, vankomycin rezistentní enterokoky, methicilin rezistentní S. aureus, multirezistentní kmeny Acinetobacter spp. – a současný vzestup výskytu mykotických agens, která se uplatňují především u kriticky nemocných pacientů s nozokomiálními infekcemi.
Nárůst rezistence původců IAI vede k tomu, že v empirické terapii jsou stále více používány karbapenemy v kombinaci s metronidazolem nebo piperacilin/tazobaktam s aminoglykosidem i pro pacienty, kteří jsou stabilní a nejsou v riziku výskytu multirezistentních bakterií. Doporučený postup pro diagnostiku terapii nitrobřišních infekcí stále velmi dobře reflektuje epidemiologickou situaci, a proto není třeba ho upravovat [24]. Pro terapii sekundární peritonitidy u pacienta stabilizovaného, bez rizika výskytu ESBL pozitivních kmenů, přicházejícího z komunity je dostatečným antibiotickým krytím potencovaný aminopenicilin, v případě alergie na beta-laktamová antibiotika ciprofloxacin v kombinaci s metronidazolem nebo kombinace klindamycinu s gentamicinem a metronidazolem, s nutností monitorování hladin gentamicinu. Pacient stabilizovaný s rizikovými faktory pro přítomnost ESBL pozitivních kmenů enterobakterií musí být zajištěn antibiotiky se spektrem účinku zahrnujícím tuto skupinu původců, tj. ertapenem nebo tigecyklin. Antimykotické krytí u stabilizovaného pacienta z komunity není doporučeno. U pacienta v kritickém stavu s rizikovými faktory pro vznik infekce vyvolané ESBL pozitivními kmeny bakterií jsou doporučeny karbapenemy druhé skupiny v kombinaci s antimykotikem vzhledem k současnému vyššímu riziku přítomnosti kvasinek.
Nozokomiální infekce jsou většinou vyvolané rezistentními bakteriemi, častěji se vyskytují i enterokoky, nefermentující bakterie a kvasinky, proto musí být volba antiinfektiv komplexní. U stabilizovaného pacienta je dostačující kombinace piperacilin/tazobaktamu s gentamicinem, u pacienta v kritickém stavu je to kombinace karbapenemu druhé skupiny s vankomycinem.
Závěr
Všechna nová uvedená antibiotika cílí na rezistentní bakterie, které jsou v současné době největším problémem v terapii cIAI. Pouze u ceftolozanu/tazobaktamu a ceftazidimu/avibaktamu jsou k dispozici i data z klinických zkoušek, která vypadají nadějně, a proto byla obě antibiotika zahrnuta i do nejnovějších mezinárodních doporučených postupů léčby cIAI, ale pouze jako přípravky rezervní a karbapenem šetřící [25].
Ačkoliv se vývoj nových molekul či kombinací antibiotik jeví optimisticky, je třeba si zachovat jistou zdrženlivost, protože ruku v ruce s novými antibiotiky se objeví rezistentní bakterie. Rozvoj rezistence je sice přirozený fenomén, avšak vidíme jeho značnou akceleraci podmíněnou nadužíváním a nesprávným používáním antibiotik. Současný trend v antibiotické politice je zkracování délky podávání, a to i v případě cIAI. Zkrácená doba podávání antibiotik u cIAI na čtyři dny je účinná a bezpečná při adekvátní chirurgické kontrole zdroje [26].
Vyvarování se protrahovanému podávání antibiotik spolu s případnou deeskalací patří mezi důležitá opatření v boji s nárůstem bakteriální rezistence.
Konflikt zájmů
Autorka článku prohlašuje, že není v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Václava Adámková
Klinická mikrobiologie a ATB centrum 1. LF UK a VFN
Ke Karlovu 2
120 00 Praha
e-mail: vaclava.adamkova@vfn.cz
Zdroje
- Armstrong C. Updated guideline on diagnosis and treatment of intra-abdominal infections. Am Fam Phys. 2010;82 : 694–709.
- Solomkin JS, Mazuski JE, Bradley JS, et al. Diagnosis and management of complicated intra-abdominal infection in adultsand children: guidelines by the Surgical Infection Society and the Infectious Diseases Society of America. Clin Infect Dis. 2010;50 : 133–64. doi: 10.1086/649554.
- Sartelli M, Viale P, Catena F, et al. WSES guidelines for management of intra-abdominal infections. World J Emerg Surg. 2013;8 : 3. doi: 10.1186/1749-7922-8-3.
- Chong YP, Bae IG, Lee SR, et al. Clinical andeconomic consequences of failure of initial antibiotic therapy for patientswith community-onset complicated intra-abdominal infections. PLoS One 2015;10:e0119956. doi: 10.1371/journal.pone.0119956
- Sartelli M, Catena F, Ansaloni L, et al. Complicated intra-abdominal infections worldwide: the definitive data of the CIAOWStudy. World J Emerg Surg. 2014;9 : 37. doi: 10.1186/1749-7922-9-37
- Hawser SP, Bouchillon SK, Hoban DJ, et al. In vitro susceptibilities of aerobicand facultative anaerobic Gram-negative bacilli from patients with intra-abdominal infections worldwide from 2005–2007: results from the SMARTstudy. Int J Antimicrob Agents. 2009;34 : 585–8. doi: 10.1016/j.ijantimicag.2009.07.013.
- Huang CC, Chen YS, Toh HS, et al. Impact of revisedCLSI breakpoints for susceptibility to third-generation cephalosporins and carbapenems among Enterobacteriaceae isolates in the Asia-Pacific region: resultsfrom the Study for Monitoring Antimicrobial Resistance Trends (SMART), 2002–2010. Int J Antimicrob Agents. 2012;40(Suppl.)S4–S10. doi: 10.1016/S0924-8579(12)70003-1.
- Kazmierczak KM, Lob SH, Hoban DJ, et al. Characterization of extended-spectrum-lactamases and antimicrobial resistanceof Klebsiella pneumoniae in intra-abdominal infection isolates in Latin America, 2008–2012. Results of the study for monitoring ntimicrobial resistancetrends. Diagn Microbiol Infect Dis. 2015;82 : 209–14. doi: 10.1016/j.diagmicrobio.2015.03.025.
- Badal R, Lob S, Bouchillon S, et al. Susceptibility of intra-abdominal pathogens in Europe, Africa and Middle East—SMART2010/2011. In: 22nd European Congress of Clinical Microbiology and Infectious Diseases (ECCMID) Annual Meeting. Basel, Switzerland ESCMID 2012.
- Swenson BR, Metzger R, Hedrick TL, et al.Choosing antibiotics for intra-abdominal infections: what do we mean by ‘highrisk’? Surg Infect. (Larchmt) 2009;10 : 29–39. doi: 10.1089/sur.2007.041.
- Adámková V, Vaňková A, Ulrych J, et al. Analýza záchytu kvasinek u pacientů po břišním chirurgickém výkonu. Rozhl Chir. 2017;96 : 426−32.
- Wang X, Zhang F, Zhao C, et al. In vitro activities of ceftazidime-avibactam and aztreonam-avibactam against 372 gram-negative bacilli collected in 2011 and 2012 from 11 teaching hospitals in China. Antimicrob Agents Chemother. 2014;58 : 1774–8. doi: 10.1128/AAC.02123-13.
- Livermore DM, Mushtag S, Ge Y. Chequerboard titration of cephalosporin CXA-101 (FR264205) and tazobactam versus beta-lactamase-producing Enterobacteriaceae. J Antimicrob Chemother. 2010;65 : 1972–4. doi: 10.1093/jac/dkq248
- Solomkin J, Hershberger E, Miller B, et al. Ceftolozane/tazobactam plus metronidazole for complicated intra-abdominal infections in an era of multidrug resistance: results from a randomized, double-blind, phase 3 trial (ASPECT-cIAI). Clin Infect Dis. 2015;60 : 1462–71. doi:10.1093/cid/civ097.
- Miller B, Popejoy MW, Hershberger E, et al. Characteristics and outcomes of complicated intra-abdominal infections involving Pseudomonas aeruginosa from a randomized, double-blind, phase 3 ceftolozane/tazobactam study. Antimicrob Agents Chemother. 2016;60 : 4387–90. doi: 10.1128/AAC.03074-15.
- Zerbaxa™ (ceftolozane sulfate; tazobactam sodium) [package insert]. Lexington, MA: Cubist Pharmaceuticals LLC 2015.
- Li H, Estabrook M, Jacoby GA, et al. In vitro susceptibility of characterized β-lactamase-producing strains tested with avibactam combinations. Antimicrob Agents Chemother. 2015;59 : 1789–93. doi: 10.1128/AAC.04191-14.
- Levasseur P, Girard AM, Miossec C, et al. In vitro antibacterial activity of the ceftazidime-avibactam combination against enterobacteriaceae, including strains with well-characterized β-lactamases. Antimicrob Agents Chemother. 2015;59 : 1931–4. doi: 10.1128/AAC.04218-14.
- Mutters NT, Zimmermann S, Kaase M, et al. Activity of temocillin, mecillinam, ceftazidime, and ceftazidime/avibactam against carbapenem-non-susceptible Enterobacteriaceae without carbapenemase production. Eur J Clin Microbiol Infect Dis. 2015;34 : 2429–37.
- Vasoo S, Cunningham SA, Cole NC, et al. In vitro activities of ceftazidime-avibactam, aztreonam-avibactam, and a panel of older and contemporary antimicrobial agents against carbapenemase-producing gram-negative bacilli. Antimicrob Agents Chemother. 2015;59 : 7842–6. doi: 10.1128/AAC.02019-15.
- Avycaz™ (avibactam sodium; ceftazidime) [package insert]. Verona, Italy: GlaxoSmithKling 2015
- Bassetti M, Carnelutti A, Peghin M. Patient specific risk stratification for antimicrobial resistance and possible treatment strategies in gram-negative bacterial infections. Expert Review of Anti-infective Therapy 2017;15 : 55−65. doi: 10.1080/14787210.2017.1251840.
- Gürlich R, Adámková V, Ulrych J, et al. Základní principy diagnostiky a léčby sekundární peritonitidy – doporučení odborníků s podporou SIS. Rozhl Chir. 2014;93 : 334−52.
- Sartelli M, Chichom-Mefire A, Labricciosa FM, et al. The management of intra-abdominal infections from a global perspective: 2017 WSES guidelines for management of intraabdominal Infections. World Journal of Emergency Surgery 2017;12 : 29. doi: 10.1186/s13017-017-0141-6.
- Sawyer RG, Claridge JA, Nathens AB, et al. Trial of short-course antimicrobial therapy for intraabdominal infection. N EnglJ Med. 2015;372 : 1996–2005. doi: 10.1056/NEJMoa1411162.
Štítky
Chirurgia všeobecná Ortopédia Urgentná medicína
Článok vyšiel v časopiseRozhledy v chirurgii
Najčítanejšie tento týždeň
2019 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Komplikované nitrobřišní infekce
- Komentář k editorialu prof. P. Pafka Všeobecná chirurgie?
- Zásady antibiotické léčby
- Role nových antibiotik u nitrobřišních infekcí v éře multirezistentních bakterií
- Instilačná podtlaková terapia ULTRAVAC v terapii infikovaných laparotómií s fascitídou − priebežné výsledky prospektívnej randomizovanej štúdie
- Intraportální aplikace kmenových buněk po embolizaci portální žíly neurychluje růst jaterních metastáz
- Chirurgická léčba alveolární echinokokózy: naše zkušenost a systematický přehled literatury
- Hájkova cena pro rok 2018
- Akutní mezenteriální ischemie s nekrózou celého tenkého střeva
- Hemangiomatóza velkého omenta − kazuistika
- Zbiroh 2019
- Umíme předcházet infekcím v místě operačního výkonu?
- Rozhledy v chirurgii
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Zásady antibiotické léčby
- Akutní mezenteriální ischemie s nekrózou celého tenkého střeva
- Role nových antibiotik u nitrobřišních infekcí v éře multirezistentních bakterií
- Hemangiomatóza velkého omenta − kazuistika
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



