-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Přínos režimu CTD (cyklofosfamid, thalidomid, dexametazon) v léčbě relabujících a refrakterních forem mnohočetného myelomu
The efficacy of the CTD regimen (cyclophosphamide, thalidomide, dexamethasone) in therapy of relapsed and refractory multiple myeloma
Thalidomide has been estimated as a useful drug in the treatment of multiple myeloma in monotherapy or in combinations with steroids and alkylating drugs. The combination of low-dose thalidomide with cyclophosphamide and dexamethasone has shown very good results. In the actual study, authors present the effect, toxicity and results of long-time follow-up of patients treated by the combination of thalidomide, cyclophosphamide and dexamethasone in the „CDT-junior“ regimen for patients up to 65 years (cyclophosphamide 800 mg intravenously on day 1 once a 21-daysę interval, thalidomide 200 mg orally daily and dexamethasone 40 mg orally on days 1–4 and 12–15), and in the „CTD-senior“ regimen for patients over 65 years (cyclophosphamide 50 mg orally daily, thalidomide 100 mg orally daily and dexamethasone 20 mg orally on days 1–4 and 15–18, in a 28-daysę cycle). From the group of 126 patients with progressive form of multiple myeloma or with resistance to conventional chemotherapy, 109 patients were evaluated. Using both modalities of the CTD regimen, objective response was reached in 78 (71.6%) patients, of them complete remission was achieved in 17 (15.6%), very good partial remission in 5 (4.6%) and partial remission in 56 (51.4%) patients. Disease was stabilized in 21 (19.2%) patients, while 10 (9.2%) patients progressed. The toxicity of both regimens was quite low and can be easily managed; weakness, obstipation, neuropathy of lower extremities, glycoregulation worsening and mild leucopenia occured most often. Median of overall survival from the start of the CTD treatment was in the whole group 31.5 months and median of time to progression was 15 months. The difference between „junior“ and „senior“ regimens was not statistically significant. It can be concluded, that the use of thalidomide in both discussed regimens has broaden the therapeutic possibilities in patients with multiple myeloma resistant to conventional chemotherapy.
Key words:
multiple myeloma, resistance to therapy, thalidomide, cyclophosphamide, dexamethasone
Autori: M. Zemanová 1; V. Ščudla 1; L. Pour 2; E. Gregora 3; P. Pavlíček 3; J. Minařík 1; T. Pika 1; J. Bačovský 1; Z. Adam 2; R. Hájek 2; Pro Českou Myelomovou Skupinu
Pôsobisko autorov: III. interní klinika LF UP a FN Olomouc, 2Interní hematoonkologická klinika FN Brno-Bohunice a LF MU v Brně, 3Oddělení klinické hematologie FN KV Praha 1
Vyšlo v časopise: Transfuze Hematol. dnes,16, 2010, No. 3, p. 126-132.
Kategória: Souhrnné práce, původní práce, kazuistiky
Súhrn
Thalidomid se v posledních letech osvědčil jako vysoce účinný lék v terapii mnohočetného myelomu, a to jak v monoterapii, tak v kombinačních režimech, nejčastěji s použitím steroidů a alkylačních cytostatik. Velmi dobré výsledky přinesla kombinace nízce dávkovaného thalidomidu s cyklofosfamidem a dexametazonem. V předloženém sdělení autoři prezentují účinnost, toxicitu i výsledky dlouhodobého sledování nemocných léčených kombinací thalidomidu, cyklofosfamidu a dexametazonu jednak v režimu „CTD-junior“ pro nemocné do 65 let (cyklofosfamid 800 mg 1. den i.v. v intervalu 21 dní, thalidomid 200 mg denně p.o. a dexametazon 40 mg p.o. vždy 1.–4. a 12.–15. den cyklu), jednak režimu „CTD-senior“, určeného pro nemocné nad 65 let (s kontinuálním podáváním cyklofosfamidu 50 mg denně p.o., thalidomidu 100 mg denně p.o. a dexametazonu 20 mg p.o. ve dnech 1–4 a 15–18 v rámci 28denního cyklu). Z celkového souboru 126 nemocných s pokročilou formou mnohočetného myelomu či s projevy rezistence ke konvenční léčbě bylo vyhodnoceno 109 nemocných. Objektivní léčebná odpověď byla dosažena s použitím obou verzí režimu CTD u 78 (71,6 %) nemocných, z toho kompletní remise byla zaznamenána u 17 nemocných (15,6 %), velmi dobrá parciální remise u 5 (4,6 %) a parciální remise u 56 nemocných (51,4 %). Stabilizace choroby byla pozorována u 21 pacientů (19,2 %), zatímco u 10 nemocných (9,2 %) choroba nadále progredovala. Toxicita obou režimů byla poměrně nízká a snadno ovlivnitelná, přičemž nejčastěji se vyskytovala celková slabost, obstipace, neuropatie dolních končetin, porucha glykoregulace a mírná leukopenie. Medián celkového přežití (OS) od zahájení léčby režimem CTD byl v celém souboru 31,5 měsíců, doba do progrese (TTP) 15 měsíců. Rozdíly mezi režimy „senior“ a „junior“ nebyly statisticky významné. Ze studie vyplývá, že použití thalidomidu jako součásti obou hodnocených režimů významně rozšiřuje současné léčebné možnosti u nemocných rezistentních ke konvenční chemoterapii.
Klíčová slova:
mnohočetný myelom, léčebná rezistence, thalidomid, cyklofosfamid, dexametazonÚvod
Mnohočetný myelom (MM) patří dosud mezi nevyléčitelná onemocnění. Díky novým léčebným přístupům je však možno dosáhnout nejen zlepšení léčebné odpovědi a kvality života, ale i významného prodloužení života nemocných. Jedním z relativně nových preparátů s ověřenou účinností u MM je thalidomid. Mechanismus jeho účinku není doposud zcela objasněn, kromě antiangiogenního působení má i účinky imunomodulační a je schopen rovněž indukovat apoptózu nádorových buněk (1). V terapii MM byl využíván zprvu v monoterapii, poté i v kombinaci s dalšími léky, nejčastěji s dexametazonem či s různými chemoterapeutiky (2).
Kombinaci thalidomidu s perorálním cyklofosfamidem a dexametazonem poprvé zveřejnili v roce 2002 španělští autoři (3); ve skupině 22 nemocných s relabující či refrakterní formou MM dosáhli u 76 % nemocných objektivní terapeutické odpovědi. V následujících letech byl jejich soubor rozšířen (4, 5) a objevilo se i několik dalších, podobně koncipovaných sdělení s obdobně příznivými výsledky (6–16). Jednotlivá doporučení se však lišila v dávkování podávaných léků, zejména thalidomidu a cyklofosfamidu. Ukázalo se, že vyšší dávky thalidomidu byly často provázeny vyšším výskytem nežádoucích účinků, zejména závažné neuropatie dolních končetin, vyšší dávky cyklofosfamidu byly častou příčinou neutropenie a závažných infekcí. V podmínkách ČR se navíc zprvu uplatňovala i problematická dostupnost thalidomidu, proto bylo třeba najít takový režim, který by umožnil použití nižší dávky thalidomidu při zachování dobré terapeutické účinnosti. Na podkladě příznivých zkušeností autorského pracoviště sestavila Česká myelomová skupina (CMG) dva léčebné režimy, a to „CTD-junior“ pro nemocné do 65 let a „CTD-senior“ pro pacienty starší 65 let. Dílčí výsledky, zejména hodnocení stupně toxicity a rozbor terapeutické účinnosti obou režimů CTD ve skupině 97 nemocných s MM, již byly v předstihu zveřejněny (17, 18). Předložené sdělení se soustředilo především na doplnění zhodnocení celkové doby přežití (OS) a doby do progrese (TTP, PFS) v souboru 126 nemocných s relabující či refrakterní formou mnohočetného myelomu.
Soubor nemocných a metodika
V době od ledna 2004 do prosince 2006 bylo v ČR pomocí režimu CTD léčeno celkem 126 pacientů s mnohočetným myelomem, splňujících SWOG a IMWG diagnostická kritéria. Zastoupení mužů a žen bylo vyrovnané 0,9 : 1 (64 : 62), medián věku byl 65 let (38–82 let). Imunochemický typ IgG se v souboru vyskytoval nejčastěji, a to celkem u 79 nemocných (63 %), typ IgA u 29 nemocných (23 %), ve 3 případech byl zachycen paraprotein třídy IgD (2 %), jedenkrát paraprotein IgM (1 %), u 10 nemocných (8 %) byly v séru přítomny pouze volné lehké řetězce imunoglobulinů, 3 nemocní (2 %) trpěli zcela nesekreční formou MM u jednoho nemocného (1%) byl současně prokázán paraprotein třídy IgG a IgA. Poměr výskytu lehkých řetězců kappa a lambda byl 2,1 : 1 (84 : 40). Dle stážovacího systému dle Durieho-Salmona bylo nejvíce zastoupeno klinické stadium III (80 pacientů, tj. 63 %) a stadium II (35 pacientů, tj. 28 %), pouze 11 nemocných (9 %) bylo léčeno v klinickém stadiu I, přičemž výrazně převažovali nemocní v klinickém podstadiu A (105 nemocných, tj. 83 %).
Léčba byla podávána ve třech koordinačních centrech ČR, a to na III. interní klinice FN Olomouc (70 nemocných), Interní hematoonkologické klinice FN Brno-Bohunice (48 nemocných) a Oddělení klinické hematologie FNKV Praha (8 nemocných). Režim CTD byl zvolen nejčastěji jako léčba 2. či 3. linie (61 a 31 nemocných). Celkem 51 (40 %) nemocných v minulosti prodělalo vysokodávkovanou chemoterapii s autologní transplantací periferních kmenových buněk, ostatní byli léčeni režimy VAD (vincristin, adriablastin, dexametazon), CyVAD (cyklofosfamid +VAD), MP (melfalan, prednizon), VBMCP (vincristin, BCNU či CCNU, melfalan, cyklofosfamid, prednizon), CIDEX (CCNU, idarubicin, dexametazon), 17 pacientů mělo rovněž předchozí zkušenosti s léčbou samotným thalidomidem.
Pro nemocné do věku 65 let byl zvolen režim „CTD-junior“, pro nemocné nad 65 let režim „CTD-senior“. Režim „CTD-junior“ byl podán celkem (43,79 %) pacientům, režim „CTD-senior“ byl aplikován 71 (56,3 %) nemocným. Schéma režimu „CTD-junior“: thalidomid 200 mg p.o. denně ve večerních hodinách, cyklofosfamid 800 mg i.v. 1. den, dexametazon 40 mg p.o. 1.–4. a 12.–15. den cyklu, přičemž cyklus se opakoval po 21 dnech. Schéma perorálního režimu „CTD-senior“: thalidomid 100 mg (event. 50 mg) denně ve večerních hodinách, cyklofosfamid 50 mg denně, dexametazon 20 mg 1.–4. a 15.–18. den, cyklus se opakoval po 28 dnech. Snížení uvedených dávek bylo prováděno jednotlivě s ohledem na individuální toleranci a případný výskyt vedlejších účinků léčby. Jako profylaxe trombembolické choroby byl po celou dobu terapie režimem CTD u většiny nemocných podáván nízkomolekulární heparin (enoxaparin, nadroparin) v dávce 0,4 ml s.c. 1x denně. Podávání dexametazonu bylo navíc zajištěno standardní profylaxí omeprazolem 20 mg 2x denně p.o., perorální suplementací draslíku a kontrolou stavu glykoregulace.
Thalidomid byl zpočátku poskytován firmou Grünenthal, posléze byl získáván díky mimořádnému dovozu preparátu Myrin (fy Lipomed) na podkladě výjimky SÚKL a schválení revizního lékaře zdravotní pojišťovny vždy individuálně pro konkrétního pacienta. Všichni nemocní byli informováni o použití neregistrovaného léčiva v rámci ČR a byli podrobně seznámeni s jeho možnými nežádoucími účinky, což stvrdili před zahájením léčby podpisem informovaného souhlasu s podáním thalidomidu.
Léčba byla podávána tak dlouho, dokud přetrvával pokles M-proteinu a dokud nemocný léčbu dobře toleroval. U osmi nemocných byly podány jen 4 cykly režimu „CTD-junior“ jako přípravného režimu před autologní transplantací periferních kmenových buněk s následnou udržovací terapií samotným thalidomidem. Léčebná odpověď byla hodnocena dle kritérií ECOG (19), tj. zejména dle hodnot monoklonálního imunoglobulinu (MIG) séra nebo moči.
Ve vybraných případech u nemocných s nízkosekreční formou MM bylo využito hodnocení dle pohybu volných lehkých řetězců séra (20, 21), u nesekrečních forem MM bylo při hodnocení léčebné odpovědi vycházeno i z míry poklesu zastoupení plazmatických buněk v kostní dřeni. Dlouhodobé hodnocení přežití nemocných bylo provedeno k datu 30. 6. 2008, medián sledování od počátku léčby režimem CTD (předčasné) byl 21,7 měsíců.
Výsledky byly hodnoceny využitím programu Statistika 8.0. Pro testování rozdílů mezi režimem „junior“ a „senior“ byl použit t-test či neparametrická obdoba Mann-Whitneyho test. Pro hodnocení kontingenčních tabulek byl použit Fischerův test a M-L chí-square test. U analýzy přežití byly mediány přežití stanoveny Kaplan-Meierovým odhadem. Rozdíl mezi režimy v časech přežití byl testován Log-rank testem. Všechny testy byly provedeny na 5% hladině významnosti.
Výsledky
Z celkového počtu 126 nemocných nebylo možné vyhodnocení léčebné odpovědi u 7 (5,5 %) nemocných s nesekreční nebo nízkosekreční formou MM a u dalších 10 nebo (7,9 %) nemocných s velmi krátkým odstupem od zahájení léčby. U zbylých 109 nemocných, kteří byli z hlediska léčebné odpovědi hodnoceni, bylo dosaženo objektivní léčebné odpovědi (ORR, tj. kompletní a parciální remise) u 78 nemocných (71,6 %), z toho kompletní remise (CR) byla zaznamenána u 17 nemocných (15,6 %), velmi dobrá parciální remise (VGPR) byla zachycena u pěti nemocných (4,6 %) a parciální remise (PR) byla dosažena u 56 nemocných (51,4 %). Stabilizace choroby (SD) bylo dosaženo u 21 pacientů (19,2 %) a 10 nemocných (9,2 %) progredovalo i přes podávanou terapii. U 7 pacientů (6,4 %) byla zaznamenána progrese choroby po předchozí příznivé terapeutické odpovědi, a to u jednoho nemocného ve 28. měsíci od zahájení léčby a po 1 roce trvání kompletní remise, u dalších 6 nemocných došlo k progresi choroby ve 3.–6. měsíci léčby CTD, a to u 4 nemocných po dosažení parciální remise, u jednoho po dosažení odpovědi typu MR a v jednom případě po přechodné stabilizaci choroby (SD). U 6 pacientů (5,5 %) byla v průběhu léčby zachycena extramedulární progrese onemocnění, a to u 3 nemocných i přes významný pokles paraproteinu séra pod 50 %, zatímco u jednoho nemocného byla hodnota MIG trvale stabilní, u dalšího se hodnota MIG séra postupně zvyšovala a u jednoho nemocného se jednalo o nesekreční formu MM. Ložiska plazmocytomu byla u těchto pacientů zachycena ve 4 případech na skeletu lbi, přičemž u jedné nemocné byla zachycena i plazmocelulární infiltrace mozkomíšních plen, u jedné nemocné byla extramedulární progrese v oblasti paže a u další v oblasti přední strany krku a hrudní stěny.
Mezi nemocnými s režimem „CTD-junior“ a „CTD-senior“ nebyl zachycen statisticky významný rozdíl v dosažení léčebných odpovědí (tab. 1 a graf 1).
Tab. 1. Výsledky léčby režimy „CTD-junior“ a „CTD-senior.“ 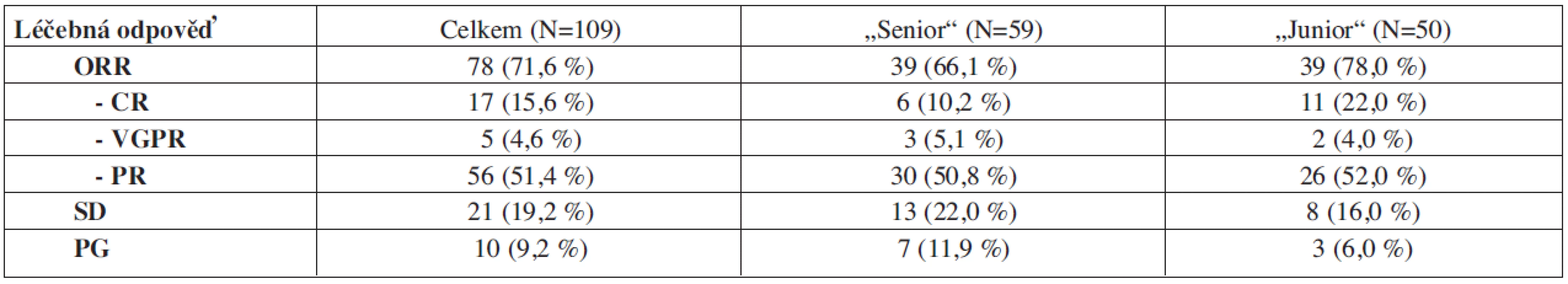
ORR = objektivní léčebná odpověď (objective response rate), tj. pokles M-proteinu nejméně o 50 % výchozí hodnoty (CR + VGPR + PR); CR = kompletní remise (complete remission), tj. úplné vymizení M-proteinu ze séra i moči; VGPR = velmi dobrá parciální remise (very good partial remission), tj. pokles M-proteinu séra nejméně o 90 %; PR = parciální remise (partial remission), tj. pokles M-proteinu séra o 50–90 %; SD = stabilizace choroby (stable disease), tj. M-protein stabilní ±25 % výchozí hodnoty; PG = progrese Graf 1. Porovnání výsledků léčby režimy „CTD-junior“ a „CTD-senior. ORR = objektivní léčebná odpověď (objective response rate); SD = stabilizace choroby (stable disease); PG = progrese 
Léčba byla podávána při dobré individuální toleranci po celou dobu poklesu M-proteinu séra. Pouhé 4 cykly režimu „CTD-junior“ však byly podány v rámci reindukční terapie před druhou autologní transplantací periferních kmenových buněk celkem 8 nemocným.
Z celkového počtu 116 nemocných hodnotitelných z hlediska tolerance režimu CTD bylo nutné předčasné ukončení léčby u 16 pacientů (13,8 %) pro projevy toxicity, u 20 pacientů (17,2 %) pro progresi choroby a u 8 nemocných (6,9 %) z důvodu neuspokojivé léčebné odpovědi. Během terapie režimem CTD zemřelo celkem 11 nemocných (8,7 %), přičemž příčinou úmrtí byla u 4 progrese základního onemocnění MM, zatímco v případě dalších 7 nemocných byla vyjádřena výrazná polymorbidita s nepříznivým ovlivněním celkového stavu, nicméně i u těchto nemocných bylo dosaženo léčebné odezvy s významným poklesem MIG séra. Jedenáct úmrtí bylo zaznamenáno v odstupu 2–7 měsíců po ukončení terapie CTD, a to většinou v souvislosti s progresí základního onemocnění.
Přehled nežádoucích účinků léčby režimem CTD shrnuje tabulka 2. V souvislosti s aplikací thalidomidu se nejčastěji vyskytovala senzomotorická distální neuropatie dolních končetin (DKK), a to u 81 nemocných (69,8 %) – u 44 z nich (37,9 %) však existovala mírná či středně těžká neuropatie DKK ještě před započetím léčby režimem CTD, přičemž pouze u 15 pacientů (12,9 %) došlo k jejímu zhoršení, a to maximálně o 1 stupeň. U 48 nemocných (41,4 %) se vyskytla mírná zácpa, u 49 nemocných (42,6 %) celková slabost a zvýšená ospalost, u 9 (7,8 %) suchost kůže a u 2 pacientů (1,7 %) závažný toxoalergický exantém. U 7 nemocných (6 %), z toho u dvou jedinců se zajištěnou profylaxí nízkomolekulárním heparinem (LMWH), byla zaznamenána hluboká žilní trombóza a u jednoho sukcesivní plicní embolie. V souvislosti s užíváním vysokodávkovaného dexametazonu byla nejčastěji zaznamenána porucha glykoregulace či dekompenzace již existujícího diabetu u 7 nemocných (6 %). Psychické změny, zejména porucha soustředění či zvýšená nervozita, byly zaznamenány u 13 nemocných (11 %), u tří z nich bylo nutné zaměnit dexametazon za lépe tolerovaný prednizon. Méně často se vyskytly některé další vedlejší účinky léčby, jako třes, retence tekutin, tinnitus, porucha vidění, alopecie a detrakční syndrom po vysazení dexametazonu. Nevolnost či nechutenství pozorovalo celkem 6 pacientů (5,2 %), renální insuficience se během léčby vyvinula u 2 nemocných (1,7 %), a to v souvislosti s progresí MM. Hematologická toxicita 2.–3. stupně dle WHO se vyvinula u 56 nemocných (48,3 %), přičemž nejčastěji se jednalo o leukopenii, resp. neutropenii u 38 (32,8 %) nemocných a trombocytopenii u 6 (5,1 %) nemocných. Při snížení či vynechání dávky cyklofosfamidu však docházelo k rychlé úpravě hodnot krevního obrazu. Nebyl zaznamenán žádný případ febrilní neutropenie. Z infekčních komplikací byl zachycen výskyt herpes zoster v 6 případech (5,2 %), dále se jednalo o nekomplikované infekce horních cest dýchacích u 14 nemocných (12,1 %), bronchopneumonie u 7 nemocných (6 %), u 6 pacientů byla zaznamenána kandidóza dutiny ústní a u 4 pacientů (3,4 %) infekce močových cest, přičemž u jednoho nemocného byla predisponujícím faktorem nezbytná potřeba permanentního močového katétru pro hypertrofii prostaty. U dvou nemocných (1,7 %) došlo k rozvoji salmonelové sepse, která byla v obou případech úspěšně zvládnuta několikatýdenní antibiotickou terapií.
Tab. 2. Nežádoucí účinky léčby režimem CTD („junior“ i „senior“). 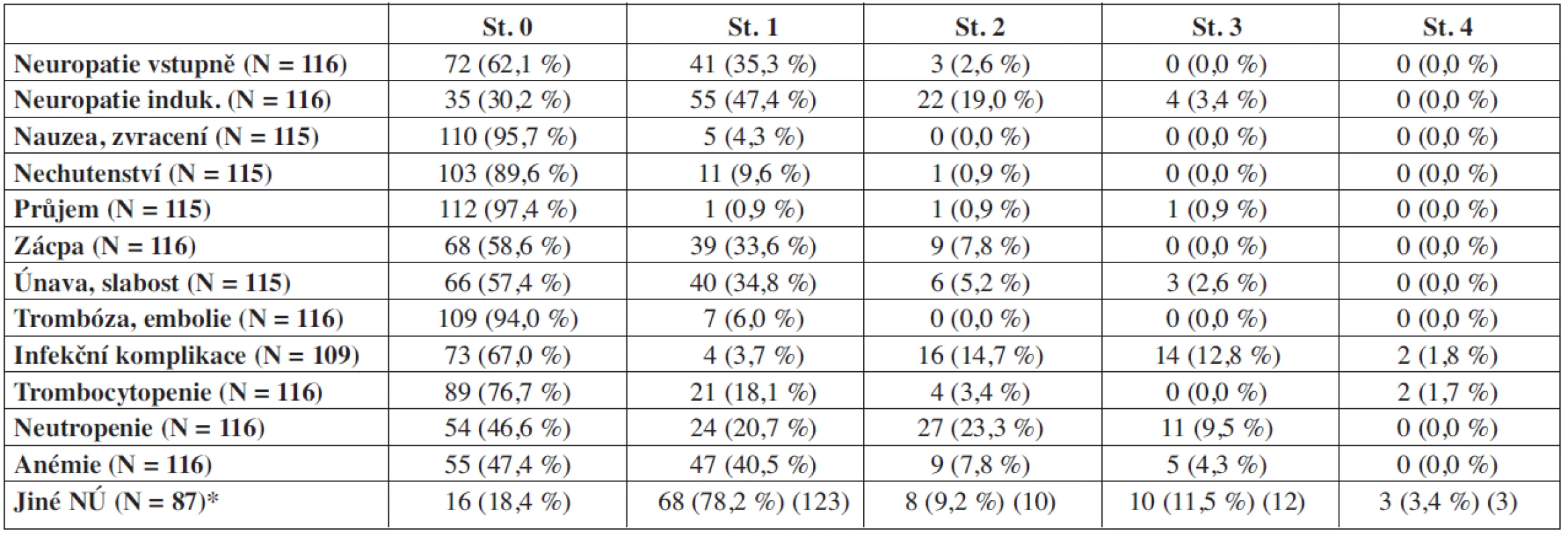
*v závorce uveden počet nežádoucích účinků Ve skupině nemocných léčených režimem „CTD-senior“ byla proti skupině „CTD-junior“ poněkud častěji zachycena hematologická toxicita (68 % versus 34 % výskyt neutropenie a 64 % versus 38 % výskyt anémie, obé max. 3. stupně dle WHO), naopak obstipace byla častější při režimu „junior“ (48 % vs. 23 %), výskyt ostatních nežádoucích účinků byl srovnatelný v obou skupinách nemocných. Redukce dávky thalidomidu z důvodu toxicity byla nutná celkem u 42 pacientů (36,2 %), z toho u 29 nemocných (45 %) léčených režimem „CTD-senior“ a u 13 nemocných (25 %) léčených režimem „CTD-junior“. Celková kumulativní dávka thalidomidu však byla v obou režimech srovnatelná – medián dávky v celém souboru byl 19 g, u režimu „CTD-junior“ byl medián celkové dávky 20,7 g, u režimu „CTD-senior“ 17 g thalidomidu.
Při analýze přežití nemocných byl medián sledování od počátku terapie režimem CTD 21,7 měsíců (1,7–49,8 měsíců), od diagnózy MM byl medián sledování 49 měsíců (10,8–207,3 měsíců), přičemž medián celkového přežití (OS) činil od zahájení léčby režimem CDT v celém souboru 31,5 měsíců, medián přežití od doby diagnózy dokonce 89,5 měsíců. Doba do progrese (TTP) dosáhla mediánu 15 měsíců. Rozdíly mezi režimy „CTD-junior“ a „CTD-senior“ nebyly statisticky významné, jak ukazuje graf 2.
Graf 2. Analýza přežití CTD-junior versus CTD-senior. 
OS = celkové přežití (overall survival) od zahájení terapie režimem CTD; TTP = doba do progrese (time to progression) Diskuse
Účinnost thalidomidu u rezistentních či relabujících forem mnohočetného myelomu byla prokázána v několika studiích zahraničních autorů (2, 22, 23). Při monoterapii byly použity zprvu dávky thalidomidu 200–800 mg, objektivní léčebná odpověď byla dosažena u 30 % nemocných, nicméně vysoký výskyt nežádoucích účinků, zejména závažné neuropatie dolních končetin, vedl k sestavení a ověření účinnosti takových kombinačních režimů, které by se vyznačovaly mnohem nižší toxicitou při zachování dobrého léčebného výsledku. Kombinace thalidomidu s dexametazonem přinesla zvýšení celkové léčebné odpovědi na 50–60 %, nicméně stále byly užívány z dnešního pohledu neúměrně vysoké dávky thalidomidu (23–25). Další zvýšení léčebné odpovědi přinesla kombinace s jinými cytostatiky, např. doxorubicinem, alkylačními působky či etoposidem. Mezi vedlejšími účinky se však stále objevuje závažná neuropatie DKK a zvýšený výskyt hluboké žilní trombózy (26, 27). Menšího výskytu těchto nežádoucích účinků bylo dosaženo použitím nízkých dávek thalidomidu (100–200 mg denně) v monoterapii či v kombinaci s dexametazonem, avšak léčebná odpověď se v těchto studiích pohybovala kolem 30 % (28, 29).
Až kombinace thalidomidu s dexametazonem a cyklofosfamidem se představila jako poměrně bezpečná, přitom ale vysoce účinná léčba rezistentních, pokročilých forem MM. První zkušenosti zveřejnil tým španělských autorů, který poprvé obohatil léčbu thalidomidem (v iniciální dávce 200 mg/den, s možností navýšení při dobré toleranci až do dávky 800 mg/den) kontinuálním podáváním perorální formy cyklofosfamidu v dávce 50 mg denně a dexametazonu v dávce 40 mg po 4 dny, podávaných v intervalu 3 týdnů. V pilotní skupině 22 nemocných bylo dosaženo objektivní léčebné odpovědi v 76 %, progredovalo 24 % nemocných (3). V 71členné skupině, analyzované o 2 roky později, bylo dosaženo objektivní léčebné odezvy dokonce u 83 % nemocných, z vedlejších nežádoucích účinků léčby byly v popředí obstipace, somnolence, neutropenie a neuropatie DKK, u 7 % nemocných se vyskytla hluboká žilní trombóza (4, 5).
Ve stejném roce byly zveřejněny výsledky Dimopoulose a kol. (6, 7), vycházející ale z odlišného dávkování léků: thalidomid byl aplikován pulzně, a to v dávce 400 mg ve dnech 1–5 a 14–18, cyklofosfamid v dávce 150 mg/m2 p.o. každých 12 hodin ve dnech 1–5 a dexametazon v dávce 20 mg/m2 ve dnech 1–5 a 14–18, každých 28 dní. Ve skupině 53 pacientů bylo dosaženo objektivní léčebné odpovědi v 60 %, ve 22 % stabilizace choroby, zatímco u 18 % nemocných choroba dále progredovala. Léčba se vyznačovala poměrně dobrou tolerancí, periferní neuropatie DKK byla zaznamenána pouze u 2 nemocných, hluboká žilní trombóza pouze v jednom případě. Poměrně častá však byla neutropenie (40 %), přičemž u 26 % nemocných dosáhla 3.–4. stupně dle WHO.
V posledních letech byly zveřejněny výsledky pozorování několika dalších autorů, lišící se v dávkování thalidomidu a cyklofosfamidu, resp. i aplikační formou cyklofosfamidu (8–15). Je zajímavé, že dosažení celkové léčebné odpovědi (tj. CR, PR a MR) bylo v uvedených studiích obdobné, pohybovalo se v rozmezí 67–88 %, přičemž CR byla zaznamenána pouze ve 2–4 %, zatímco PR ve 42–83 % a MR ve 12–21 %. Stabilizace choroby bylo dosaženo asi u 20 % a progrese nemoci byla pozorována ve 4–25 % případů (4–15). Výsledky naší studie jsou tedy v plném v souladu s dobrými výsledky předchozích studií. Poněkud příznivější léčebné výsledky režimu „CTD-junior“ oproti režimu „CTD-senior“ v našem pozorování jistě souvisejí i s nižším věkem, menší pokročilostí nemoci, ale zejména s nižší „předléčeností“ nemocných s MM (graf 1). Z uvedených důvodů rovněž nebyl mezi oběma skupinami nemocných zaznamenán v našem souboru podstatnější rozdíl ve výskytu závažné leukopenie či infekčních komplikací.
Celkové přežití nemocných se v uvedených studiích udává v mediánu 17–20 měsíců, medián PFS v rozmezí 8–12 měsíců (6–9, 16), výsledky naší studie jsou tedy dokonce ještě příznivější.
Z výsledků dosavadních studií i ze zkušeností tří pracovišť CMG tedy jednoznačně vyplývá, že režim CTD, a to i v proměnlivém složení, dosahuje velmi dobrých výsledků u nemocných s prvotní i získanou ztrátou citlivosti ke standardní chemoterapii, přičemž k dosažení příznivé léčebné odpovědi není třeba používat vysokého dávkování thalidomidu, zatíženého poměrně častým výskytem nežádoucích účinků, zejména neuropatie DKK a hluboké žilní trombózy. Ukázalo se, že při kombinaci s cyklofosfamidem a dexametazonem postačuje obvykle dobře snášená dávka thalidomidu 100–200 mg denně. Výhodou kontinuální, perorální aplikace je i okolnost, že dávku thalidomidu lze navíc upravovat průběžně podle individuální tolerance. V námi analyzovaném souboru se pohybovala denní dávka thalidomidu v rozmezí 50–200 mg. Podání thalidomidu ve večerních hodinách zajišťuje dobrý spánek a zamezuje výskytu výraznější somnolence přes den, poměrně častou obstipaci lze snadno ovlivnit úpravou jídelníčku či podáním laxativ. K zamezení rozvoje závažné neuropatie DKK je nezbytné pečlivé průběžné hodnocení klinického stavu. Zcela zásadní je rychlé vysazení či snížení dávky thalidomidu, objeví-li se první známky neuropatie. Součástí léčby thalidomidem je i péče o pokožku a důsledná hydratace.
Výskyt hluboké žilní trombózy (6 % nemocných) byl v našem souboru srovnatelný s jinými studiemi (3–8 %), přičemž u pacientů, kteří neměli zajištěnou profylaxi nízkomolekulárním heparinem, byl zaznamenán u 12 %, ale jen u 2 % nemocných s touto profylaxí. Žádný z nemocných neměl prokázanou trombofilii či zvýšené riziko trombembolické nemoci v anamnéze. Otázkou zůstává, zda je u všech nemocných nezbytné každodenní podání LMWH, které je zatíženo nemocnými nevítanou podkožní aplikací a samozřejmě i poměrně značnými finančními nároky na léčbu, nebo zda stačí např. pouze nízké dávky warfarinu či kyseliny acetylsalicylové (8, 10, 26, 27).
Dávkování cyklofosfamidu lze při kontinuální každodenní aplikaci 50 mg p.o. rovněž dobře upravovat dle aktuálních hodnot krevního obrazu – při závažnějším poklesu leukocytů či trombocytů lze snížit dávku cyklofosfamidu na 50 mg obden, případně lze cyklofosfamid přechodně zcela vysadit až do úpravy hodnot krevního obrazu. Při užití pulzní, nitrožilní aplikace cyklofosfamidu je individuální změna dávkování komplikovanější, neboť lze dávku upravit jen 1x za 3 týdny, přičemž jsou žádoucí důsledné průběžné kontroly krevního obrazu v intervalu 1–2 týdnů. Takto sestavený režim CTD je proto vhodnější zejména pro mladší, méně „předléčené“ pacienty. Výskyt případných infekčních komplikací lze ovlivnit včasnou antibiotickou a antimykotickou terapií, zejména je nutná kontrola sliznice dutiny ústní a časný záchyt poměrně časté kandidózy. Ve vybraných případech je vhodné zvážit profylaxi např. malou dávkou cotrimoxazolu – sulfamethoxazolu (480 mg 1x denně).
Nelze opomenout rovněž i okolnost, že v námi analyzovaném souboru byl u 6 pacientů zachycen výskyt extramedulárních forem plazmocytomu, které byly k léčbě thalidomidem zcela rezistentní. Podobná, i když zatím ojedinělá pozorování uvádějí i jiní autoři (30, 31). Výskyt těchto forem nemoci zřejmě souvisí se zásadní změnou biologických vlastností myelomové tkáně, zejména kinetických a proliferačních charakteristik plazmatických buněk v důsledku pozdní fáze nemoci a pravděpodobně i v důsledku léčby thalidomidem (31).
Na základě předložených zkušeností je tedy zřejmé, že režimy „CTD-junior“ i „CTD-senior“ jsou vysoce účinné režimy, velmi dobře použitelné v běžné hematologické praxi. Toxicita je přijatelná a snadno ovlivnitelná, dávkování je velmi jednoduché a vhodné pro ambulantní praxi. Nemocnými je v případě „CTD-senior“ velmi oceňována perorální forma léčby a snadné dávkování. Režim „CTD-junior“ je navíc přínosný v reindukční terapii před opakovanou autologní transplantací periferních kmenových buněk a je snášen lépe, nežli dosud užívané režimy CAD či CED (C-cyklofosfamid, A-adriablastin, D-dexametazon, E-etoposid), toto předběžné pozorování však bude nutné ještě ověřit na rozsáhlejší skupině nemocných. Další nepochybnou předností režimu CTD je okolnost, že podstatně neovlivňuje výtěžnost separace periferních kmenových buněk při běžném použití vysokodávkovaného cyklofosfamidu, jak tomu bylo, v souladu se zahraničními zkušenostmi (12), i u našich 8 nemocných.
Závěr
Z předloženého sdělení vyplývá, že obě formy režimu CTD (tj. „CTD-junior“ i „CTD-senior“) jsou u nemocných s relabující nebo progredující formou MM účinné a nemocnými velmi dobře snášeny, přičemž případné nežádoucí účinky jsou poměrně snadno ovlivnitelné a některým lze cíleně předcházet souběžnou profylaktickou terapií. Kontinuální perorální léčba umožňuje navíc průběžné úpravy dávek jednotlivých léků v případě výskytu nežádoucích účinků. Léčba režimem CTD přináší rovněž významné prodloužení života nemocných s MM.
Oba uvedené režimy CTD byly díky dobré dostupnosti thalidomidu použitelné i v léčbě 1. linie – režim „CTD-senior“ se osvědčil v terapii starších, a to i předléčených nemocných, režim „CTD-junior“ se jeví jako vhodný při užití v indukční léčbě mladších nemocných, a to i před plánovanou autologní transplantací krvetvorných buněk. Jednou z největších předností obou režimů CTD je možnost snadné, plně ambulantní léčby.
Vypracováno s podporou VVZ MSM 6198959205 a IGA CR NR 9500-3
Doručeno do redakce: 19. 11. 2009
Přijato po recenzi: 20. 5. 2010
MUDr. Markéta Zemanová, Ph.D.
III. interní klinika LF UP a FN Olomouc
I. P. Pavlova 6
775 20 Olomouc
marketa.zemanova@fnol.cz
Zdroje
1. Hájek R, Maisnar V, Krejčí M. Thalidomid. Klin Farmakol Farm 2005; 19 : 43-46.
2. San Miguel JF. Thalidomide alone or in combination: results in refractory patients. Hematol Rep 2005; 1 : 2-6.
3. García-Sanz R, Gonzáles-Fraile MI, Sierra M, et al. The combination of thalidomide, cyclophosphamide and dexamethasone (ThaCyDex) is feasible and can be an option for relapsed/ refractory multiple myeloma. Hematol J 2002; 3 : 43-48.
4. García-Sanz R, Gonzáles-Porras JR, Hernández JM, et al. The oral combination of thalidomide, cyclophosphamide and dexamethasone (ThaCyDex) is effective in relapsed/ refractory multiple myeloma. Leukemia 2004; 18 : 856-863.
5. Gonzáles-Porras JR, García-Sanz R, Polo-Zarzuela M, et al. ThaCyDex in relapsed/ refractory multiple myeloma. Hematol J 2003; 4, S1 : 234.
6. Dimopoulos MA, Hamilos G, Zomas A, et al. Pulsed cyclophosphamide, thalidomide and dexamethasone: an oral regimen for previously treated patiens with multiple myeloma. Hematol J 2004; 5 : 112-117.
7. Anagnastopoulos A, Hamilos G, Zomas A, et al. Oral hyperfractionated cyclophosphamide ant intermittent thalidomide-dexamethasone (pulsed CTD) for previously treated patients with multiple myeloma. Hematol J 2003; 4, S1 : 235.
8. Kyriakou C, Thomson K, DęSa S, et al. Low-dose thalidomide in combination with oral weekly cyclophosphamide and pulsed dexamethasone is a well tolerated and effective regimen in patients with relapsed and refractory multiple myeloma. Br J Haematol 2005; 129 : 763-770.
9. Kropff M, Lang N, Bisping G, et al. Hyperfractionated cyclophosphamide in combination with pulsed dexamethasone and thalidomide (HyperCDT) in primary refractory or relapsed multiple myeloma. Hematol J 2003; 4, S1 : 236.
10. Kyriakou C, DęSa S, Fox R, et al. Salvage therapy with cyclophosphamide, dexamethasone and thalidomide (CDT) is a well-tolerated and effective regimen in advanced relapsed/ refractory myeloma. Hematol J 2003; 4, S1 : 237.
11. Caravita T, Siniscalchi A, Postorino M, et al. Thalidomide in combination with dexamethasone for relapsed/ refractory multiple myeloma. Hematol J 2003; 4, S1 : 238.
12. Di Raimondo F, Pennisi A, Buglio D, et al. Combination of thalidomide, cyclophosphamide and dexamethasone in refractory-relapsed multiple myeloma. Hematol J 2003; 4, S1 : 241.
13. Sidra G, Williams CD, Russell NH, et al. Combination chemotherapy with cyclophosphamide, thalidomide and dexamethasone for patients with refractory, newly diagnosed or relapsed myeloma. Haematologica 2006; 91 : 862-863.
14. Kropff M, Lang N, Bisping G, et al. Hyperfractionated cyclophosphamide in combination with pulsed dexamethasone and thalidomide (HyperCDT) in primary refractory or relapsed multiple myeloma. Br J Haematol 2003; 122 : 607-616.
15. Williams CD, Byrne JL, Sidra G, et al. Combination chemotherapy with cyclophosphamide, thalidomide and dexamethasone achieves a high response rate in patients with newly diagnosed, VAD-refractory and relapsed myeloma. Blood 2004; 104: Suppl., No. 1499.
16. Roussou M, Anagnastopoulos A, Kastritis E, et al. Pulsed cyclophosphamide, thalidomide and dexamethasone regimen for previously treated patients with multiple myeloma: Long term follow up and disease control after subsequent treatments. Leukemia Lymphoma 2007; 48 : 754-758.
17. Zemanová M, Ščudla V, Pour L, et al. Režim CTD (cyklofosfamid, thalidomid, dexametazon) v léčbě relabujících a refrakterních forem mnohočetného myelomu. Transfuze Hematol dnes 2007; 13 : 126-132.
18. Zemanová M, Ščudla V, Adam Z, et al. Low-dose thalidomide regimens in therapy of relapsed or refractory multiple myeloma. Neoplasma 2008; 55 : 349-353.
19. Durie BGM, Harousseau JL, Miguel JS, et al. International uniform response criteria for multiple myeloma. Leukemia 2006; 10 : 1-7.
20. Bradwell AR, Mead GP, Carr-Smith HD. Clinical apllications of free light chain assays. Multiple myeloma. In: Bradwell AR, Mead GP, Carr-Smith HD. Serum free light chain analysis. 3rd ed. Birmingham: The Binding Site Ltd. 2005 : 67-89.
21. Ščudla V, Minařík J, Schneiderka P, et al. Význam sérových hladin volných lehkých řetězců imunoglobulinu v diagnostice a hodnocení aktivity mnohočetného myelomu a vybraných monoklonálních gamapatií. Vnitř Lék 2005; 51 : 1249-1259.
22. Palumbo A, Giaccone L, Bertola A, et al. Low-dose thalidomide plus dexamethasone is an effective salvage therapy for advanced myeloma. Haematologica 2001; 86 : 399-403.
23. Palumbo A, Falco P, Ambrosini MT, et al. Thalidomide and dexamethasone is an effective salvage regimen for myeloma patients relapsing after autologous transplant. Blood 2004; 104: Suppl., No. 2396.
24. Boccadoro M, Blade J, Attal M, Palumbo A. The future role of thalidomide in multiple myeloma. Acta Haematol 2005; 114, S1 : 18-22.
25. Neuwirtová R, Špička I, Karban J, et al. Naše zkušenosti s léčbou thalidomidem. Transfuze Hematol dnes 2002; 1 : 13-19.
26. Zangari M, Anaissie E, Barlogie B, et al. Increased risk of deep-vein thrombosis in patients with multiple myeloma receiving thalidomide and chemotherapy. Blood 2001; 98 : 1614-1615.
27. Cavo M, Zamagni E, Cellini C, et al. Deep-vein thrombosis in patients with multiple myeloma receiving first-line thalidomide-dexamethasone therapy. Blood 2002; 100 : 2272-2273.
28. Durie BGM, Stepan DE. Low dose thalidomide alone and in combination: long term follow-up. (Abstract 688). Blood 2001; 98 (Suppl. 1): 163.
29. Maisnar V, Radocha J, Büchler T, et al. Monotherapy with low-dose thalidomide for relapsed or refraktory multiple myeloma: Berger response rate with earlier treatment. Eur J Haematol 2007; 79 : 305-9.
30. RosiĖol L, Cibeira MT, Bladé J, et al. Extramedullary multiple myeloma escapes the effect of thalidomide. Haematologica 2004; 89 : 832-836.
31. Saba S, Epstein A, Niesvizky R, Coleman M. Development of high-grade B-cell neoplasms following thalidomide therapy. Haematologica 2005; 90, S1 : 143.
Štítky
Hematológia Interné lekárstvo Onkológia
Článek Výběr z tisku
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2010 Číslo 3- Nejasný stín na plicích – kazuistika
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Léčba on-demand je jednoznačně neefektivní v prevenci vývoje hemofilické artropatie
-
Všetky články tohto čísla
- Globální hodnocení funkce hemostázy – část II. Vlastní zkušenosti s použitím trombin generačního testu u pacientů s trombofilií
- Přínos režimu CTD (cyklofosfamid, thalidomid, dexametazon) v léčbě relabujících a refrakterních forem mnohočetného myelomu
- Odlišné hladiny asparagin syntetázy nejsou zodpovědné za rozdílnou senzitivitu leukemických blastů k L-Asparagináze
- Cytomegalovirus-specifická buněčná imunita: stanovení profilu imunitní funkce přináší klinicky relevantní odpověď
- Folikulární lymfom a význam nádorového mikroprostředí
- Vlasatobunková leukémia – diagnostika, liečba a monoklonové protilátky
- Imunofenotypizace a diagnostika obtížně klasifikovatelných akutních leukemií – nová diagnostická skupina dle WHO klasifikace 2008
- XXIV. Olomoucké hematologické dny s mezinárodní účastí
- Výběr z tisku a zprávy o knihách
- Autotransfuze v České republice v roce 2009
- Produkce transfuzní služby ČR za rok 2009
- Informace o volbách do výboru České hematologické společnosti, revizní komise, výboru zdravotních laborantů a výboru sester.
- Komentář k článku: Novinky v klasifikaci MDS a stanovení prognózy dle WPSS Žídková M., Voglová J., Bělohlávková P., Vrbacký F. Transfuze a Hematologie dnes 2010, 16: 42-46
- Odpověď na komentář Doc. Neuwirtové
- Výběr z tisku
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Vlasatobunková leukémia – diagnostika, liečba a monoklonové protilátky
- Folikulární lymfom a význam nádorového mikroprostředí
- Cytomegalovirus-specifická buněčná imunita: stanovení profilu imunitní funkce přináší klinicky relevantní odpověď
- Imunofenotypizace a diagnostika obtížně klasifikovatelných akutních leukemií – nová diagnostická skupina dle WHO klasifikace 2008
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



