-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Současné možnosti laboratorní diagnostiky heparinem indukované trombocytopenie
Current possibilities of laboratory diagnosis heparin-induced trombocytopenia
Heparin-induced thrombocytopenia (HIT) represents a serious complication of heparin use. IgG antibodies binding platelet factor 4 (PF4) and heparin trigger the clinical manifestations of HIT. However, only a portion of the antibodies have the ability to activate platelets, and these can be identified by a platelet aggregation test (functional testing). Current methods – heparin-induced platelet aggregation (HIPA) and 14C-serotonin release assay (SRA) – are time-consuming and difficult if HIT is clinically suspected; therefore, numerous new methods have been developed recently. To determine HIT, impedance aggregometry using the Multiplate® analyzer (Verum Diagnostika, Munich, Germany) (MEA) as heparin-induced aggregation techniques and the Technozym HIT Ig ELISA test (Technoclone GmbH, Vienna, Austria) were used. The MEA method uses sensitization of donor platelets with patient plasma in the presence of heparin at a concentration of 0.5 IU/mL. MEA was performed in 300 μL of citrated whole blood with donor platelets, 150 μL of heparin (final concentration of 0.5; 100 IU/mL) and 150 μL of platelet-poor plasma (PPP) from the patient. Changes in aggregation were monitored for 20 minutes. The ELISA test results were evaluated as negative for OD <0.500 and positive for OD> 0.500 according to the manufacturer’s diagnostic setup. We examined 65 patients at a clinically intermediate and higher risk of HIT according to the 4T score. All samples were examined by the ELISA test and MEA, with positive samples being further confirmed by high-concentration heparin. In the studied group, we demonstrated that MEA has sufficient sensitivity and higher specificity. In the group of patients, there were 7.8% of positive results found by MEA as compared with 10.9% determined by ELISA. Unlike the ELISA methods of the same quality, MEA is more suitable for detecting platelet-activating HIT antibodies in practice.
Key words:
heparin-induced thrombocytopenia, functional test for HIT, ELISA determination of HIT
Autoři: L. Slavík; G. Svobodová; J. Úlehlová; V. Krčová; A. Hluší; J. Procházková
Působiště autorů: Hemato-onkologická klinika LF UP a FN Olomouc
Vyšlo v časopise: Transfuze Hematol. dnes,18, 2012, No. 2, p. 76-80.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Heparinem indukovaná trombocytopenie (HIT) představuje závažnou komplikaci použití heparinu. IgG protilátky vážící destičkový faktor 4 (PF4) a heparin spouští klinickou manifestaci HIT. Pouze část protilátek však disponuje schopností aktivovat destičky a tyto mohou být identifikovány vyšetřením agregace destiček (funkční vyšetření). Současné metodické postupy - heparinem-indukovaná agregace destiček (HIPA) a 14C-serotonin uvolňovací reakce (SRA) představují zdlouhavá a náročná vyšetření při klinickém podezření na HIT proto se v poslední době rozvinula řada nových metod. Pro stanovení HIT byla námi použita impedanční agregometrie na analyzátoru Multiplate® (Verum Diagnostika, Mnichov, Německo) (MEA) jako heparinem indukované agregační techniky a Technozym HIT Ig ELISA test (Technoclone GmbH, Vídeň, Rakousko). MEA metoda využívá senzibilizace dárcovských destiček plazmou pacienta v přítomnosti heparinu v koncentraci 0,5 IU/ml. MEA stanovení bylo prováděno v 300 μl citrátové plné krve s dárcovskými trombocyty, 150 μl heparinu (konečná koncentrace 0,5 resp. 100 IU/ml) a 150 μl plazmy chudé na destičky (PPP) vyšetřovaného pacienta. Změny v agregaci byly monitorovány po dobu 20 min. Výsledky ELISA vyšetření byly vyhodnoceny jako negativní při OD < 0,500 a pozitivní OD > 0,500 dle doporučení výrobce diagnostického stanovení. Vyšetřili jsme 65 pacientů, kteří měli klinicky střední a vyšší riziko vzniku HIT dle 4T skóre. Veškeré vzorky byly vyšetřeny ELISA testem a MEA metodikou, kde pozitivní vzorky byly dále konfirmovány vysokou koncentrací heparinu. Ve vyšetřovaném souboru se nám podařilo prokázat, že MEA disponuje dostatečnou citlivostí a vyšší specificitou. V souboru pacientů byla nalezena 7,8% pozitivita MEA oproti 10,9% pozitivitě ELISA. Stanovení MEA je, na rozdíl od stejně kvalitních ELISA metodik, použitelnější pro praxi při detekci destičky aktivujících HIT protilátek.
Klíčová slova:
heparinem indukovaná trombocytopenie, funkční test na HIT, ELISA stanovení HITÚvod
Heparinem indukovaná trombocytopenie (HIT) je klinicko-patologický syndrom, který je diagnostikován u pacientů imunizovaných podáním jak nefrakcionovaných (UFH), tak nízkomolekulárních (LMWH) heparinů a je pro něj typický vývoj protilátek proti komplexům destičkového faktoru 4/heparinu a IgG protilátek aktivujících destičky.
HIT je imunitně indukované onemocnění, jehož příčinou je tvorba protilátek proti komplexu PF4/heparin. PF4 je homotetramer, který se skládá ze 4 jednotek o molekulové hmotnosti 7,8 kDa.
V klinické praxi jsou popsány 2 typy HIT. HIT I se manifestuje poklesem trombocytů po přímém proagregačním účinku heparinu a dochází k němu časně po nasazení heparinu. HIT II je způsoben protilátkami proti komplexu heparin/PF4 a vzniká s odstupem po podání heparinu (1).
Onemocnění se vyskytuje u 0,5–5 % pacientů. Nižší výskyt je udáván u LMWH v důsledku nižší tvorby protilátek ve srovnání s UFH (2).
Patofyziologie
K rozvoji HIT dochází v důsledku uvolňování protilátek proti neoepitopům na základě elektrostatické interakce PF4 vyloučeného z granul destiček a heparinu. Vazba Fc fragmentů protilátky třídy IgG vede k aktivaci signální dráhy a agregaci krevních destiček, které přispívá dále k rychlé destrukci krevních destiček a uvolnění mikročástic, endoteliálnímu poškození, a nakonec trombóze. Nejčastější třídou imunoglobulinů je IgG, která jediná disponuje schopností vazby na FcR destiček, ale přítomná může být i třída IgM. Destičky při aktivaci ztrácejí svůj diskoidní tvar a tvoří četná pseudopodia. Při tomto procesu se odštěpují membránové částice s výraznou prokoagulační aktivitou. Generuje se trombin a uvolňuje se PF4, který je klíčový pro vývoj klinické manifestace HIT (3).
Nevyvázaný PF4 se váže na veškeré molekuly podobné heparinu za tvorby komplexu s IgG protilátkami. Tento komplex se váže na Fc receptor destičky, kterou tím aktivuje. Aktivované destičky vzájemně agregují, agregáty jsou odstraňovány z krevního oběhu jako nežádoucí částice a tímto konzumpčním mechanismem je vyvolána trombocytopenie (1). Jedním z pravděpodobných potencujících faktorů rozvoje HIT II může být genetická odchylka destičkového receptoru. Literárně je popsána záměna aminokyseliny v molekule receptoru, kde v pozici 131 je aminokyselina Arg nahrazena aminokyselinou His (2).
Vyšetření HIT
Obecně existují dva druhy laboratorních testů pro stanovení HIT. Antigenní stanovení detekující přítomnost imunoglobulinů, které vážou antigenní neoepitopy v H:PF4 komplexech. Funkční testy detekující přítomnost protilátek HIT tvořících imunitní komplexy, které způsobí aktivaci krevních destiček. Každý typ testu poskytuje jedinečné a vzájemně se doplňující informace. Žádný z laboratorních testů by neměl být použit samostatně pro potvrzení nebo vyvrácení diagnózy HIT.
Sérologické testy krevních destiček
Mezi sérologické testy řadíme ELISA testy, které jsou založené na interakci protilátky s cílovým antigenem, jež tvoří komplex PF4/heparin. V současné době se rozvíjí gelové testy. Princip jejich stanovení spočívá v reakci polystyrénových částic potažených komplexy rekombinantního PF4/heparin nebo polyvinylsulfonátu s HIT protilátkami (7).
Sérologické testy se obecně vyznačují nejvyšší senzitivitou a nejnižší specificitou.
Funkční testy krevních destiček
Funkční testy jsou metody využívající dárcovské destičky, jež jsou aktivovány reakcí se sérem nebo plazmou pacienta. Přídavek definované koncentrace heparinu k PF4 z dárcovských destiček, vede k tvorbě komplexů H:PF4, které formují a prezentují antigen HIT. H: PF4 imunitní komplexy tvoří cíl pro HIT protilátky a způsobují aktivaci destiček (4).
Zlatý standard funkčních testů tvoří serotonin uvolňovací test (SRA), jež v současné době slouží jako základ pro vývoj řady nových metodik. SRA je prováděn s krevními destičkami, které jsou inkubovány s 14C značeným serotoninem. Krevní destičky nesoucí Fc χ receptor jsou aktivovány IgG imunitními komplexy. Aktivace destiček vede k uvolnění radioaktivně značeného serotoninu. Aktivace destiček je obvykle definována jako 20% nebo vyšší uvolňování serotoninu. Silnější aktivita pravděpodobně naznačuje vysokou afinitu nebo vysoké titry protilátek. Bylo prokázáno, že test je více specifický pro pacienty s HIT způsobenou trombocytopenií a / nebo trombózou. Pro samotný postup je důležitá aktivace pomocí dvou hladin heparinu, nízké (0,1 U / ml) a vysoké (100 U / ml) (5). Za pozitivní výsledek HIT je hodnocena aktivace krevních destiček pouze v přítomnosti heparinu o nízké koncentraci, ale ne v přítomnosti vysoké hladiny heparinu. Za nespecifický nález je považováno, když vzorek způsobuje aktivaci krevních destiček při nízkých i vysokých koncentrací heparinu, což znamená, že protilátky jsou pravděpodobně zaměřeny i proti jiným antigenům než H:PF4. Tyto vzorky mohou obsahovat modifikované imunitní komplexy nebo protilátky, jako je anti-HLA nebo protilátky proti destičkovým receptorům. Použití dvoukoncentračního testu pro diagnózu HIT zvyšuje specifičnost in vitro stanovení a minimalizaci ‘’falešně pozitivních výsledků’’. Podobný postup aktivace destiček je podstatou heparinem indukované agregace destiček (HIPA), která využívá vizuální kontrolu shlukování krevních destiček v průběhu času. HIT protilátky mohou být zjištěny také pomocí analýzy uvolňování ADP, jež se měří lumi-aggregometry nebo měřením uvolňování mikročástic z krevních destiček detekovaných pomocí průtokové cytometrie (6, 8–10).
Další skupinu funkčních testů tvoří agregační testy. Pro tyto testy je charakteristické snadné provedení bez nutnosti práce s radioaktivitou, rychlá dostupnost, ale bohužel zatím nižší senzitivita. Mezi tyto testy řadíme optickou agregometrii (LTA) a vícenásobnou elektrodovou agregometrii (MEA), která má dle literárních poznatků potenciál senzitivitu zvýšit (11, 12).
LTA je založena na změně optické propustnosti vzorku v závislosti na vzniku agregátů krevních destiček po jejich senzibilizaci plazmou s protilátkami proti PF4 za přítomnosti heparinu o koncentraci 0,1 IU/ml. K měření se používá dárcovská plazma bohatá na destičky, která se získává centrifugací při 1000 x g.
MEA test je založen na stejném principu jako optická agregometrie, pouze s tím rozdílem, že indukovaná destičková agregace je měřena s koncentrací heparinu (0,5 IU/ml) a pro stanovení je využíváno plné krve.
Nejlepší volbou diagnostiky HIT je kombinace všech skupin testů (13, 14). Tedy ELISA, agregace a SRA. Tento postup zvyšuje senzitivitu až na 83 %.
Soubor pacientů
Tato studie byla provedena na souboru vzorků krve od pacientů s podezřením na HIT odeslaných do naší laboratoře od ledna do října 2010. Vzorky citrátové plazmy byly analyzovány ihned pomocí MEA metody nebo uloženy při teplotě – 80 °C pro ELISA stanovení. Z dokumentace pacientů byla stanovena pravděpodobnost HIT pomocí 4T bodovacího systému (15).
Odběr krve
Odběr krve byl realizován do jednorázové vakuové zkumavky s použitím jehly VACUETTE® (Greiner Bio-One, Rakousko) – obsahující pufrovaný roztok citrátu sodného o koncentraci 0,109 mol/l (3,2 %). Systém zajistí promíchání antikoagulantu s krví v požadovaném poměru 1 : 10. Následně je krev ve zkumavce opatrně promíchána tím, že je zkumavka několikrát opatrně převrácena dnem vzhůru a transportována do laboratoře, kde je krev nejpozději do 2 hodin zpracována pro MEA stanovení. Vzorek je pak centrifugován 3 minuty při 4440 x g, z horní vrstvy je odpipetováno 0,5 ml plazmy chudé na destičky (PPP) a ta je zamražena a uchována při -80 °C do provedení ELISA analýzy. Pro vlastní analýzu je vzorek rozmrazován v termostatu při 37 °C po dobu 20 min.
Dárcovské trombocyty
Dárcovské trombocyty byly získány přímo ze směsi dvou vzorků plné krve odebrané do VACUETTE® (Greiner Bio-One, Vídeň, Rakousko) obsahující pufrovaný roztok citrátu sodného o koncentraci 0,109 mol/l (3,2 %).
Impedanční agregometrie
Ke stanovení aktivace destiček pomocí impedanční agregometrie bylo použito analyzátoru Multiplate (Dynabyte Informationssysteme GmbH, Mnichov, Německo). Vlastní stanovení bylo provedeno následně: k 300 μl citrátové krve s dárcovskými trombocyty bylo přidáno 150 μl roztoku heparinu o koncentraci 2 IU/ml, po inkubaci 2 minuty při teplotě 37 C byla reakce zahájena přidáním 150 μl PPP. Měření impedance probíhalo 20 minut za kontinuálního míchání vzorku uvnitř kyvety. Konečný výsledek je průměr maximální impedance naměřené po 20 minutách na obou párech elektrod. Konfirmace byla následně provedena stejným postupem, pouze koncentrace heparinu byla použita 100 IU/ml.
ELISA TECHNOZYM HIT IgG
ELISA stanovení bylo provedeno pomocí vyšetřovací soupravy TECHNOZYM HIT IgG (Technoclone GmbH, Vídeň, Rakousko). Stanovení zachycuje pozitivitu protilátek ve třídách IgG. Výsledky ELISA vyšetření byly vyhodnoceny jako negativní při OD < 0,500a pozitivní OD > 0,500 dle doporučení výrobce stanovení.
Statistické hodnocení
Pro statistické hodnocení byl použit Fischerův test nezávislosti a McNemarův test shody četností. McNemarův test se zaměřuje pouze na pozorování, u kterých jsme při opakovaném měření zaznamenali rozdílné výsledky dle níže uvedeného vztahu.
X2= ∑ ∑ i<j (Nij – Nji )2 / Nij + Nji
Nij počet objektů, u nichž je první měření Bi a druhé měření Bj stejné nebo naopak rozdílné.
Výsledky a diskuse
Soubor pacientů
Vyšetření přítomnosti HIT bylo provedeno na skupině 65 pacientů léčených v předchozích 14 dnech hepariny (90 % LMWH, 3 UFH a 7 % kombinace UFH s LMWH). Vyšetření bylo provedeno u skupiny pacientů splňujících klinická kritéria možného výskytu HIT protilátek (označovaná jako 4T kritéria) – trombocytopenie, čas, kdy dojde k poklesu krevních destiček, trombóza nebo její následky a vyloučení jiné příčiny trombocytopenie (tab. 2).
V souboru bylo 34 žen (52 %) a 29 mužů (48 %). Průměrný věk u žen byl 56,5 roku s mediánem 64,5. U mužů byl průměrný věk 64,2 s mediánem 68.
MEA
Celý soubor pacientů byl vyšetřen metodou MEA na přítomnost protilátek aktivujících destičky. Pro vyšetření bylo použito modifikované metodiky s dárcovskými destičkami.
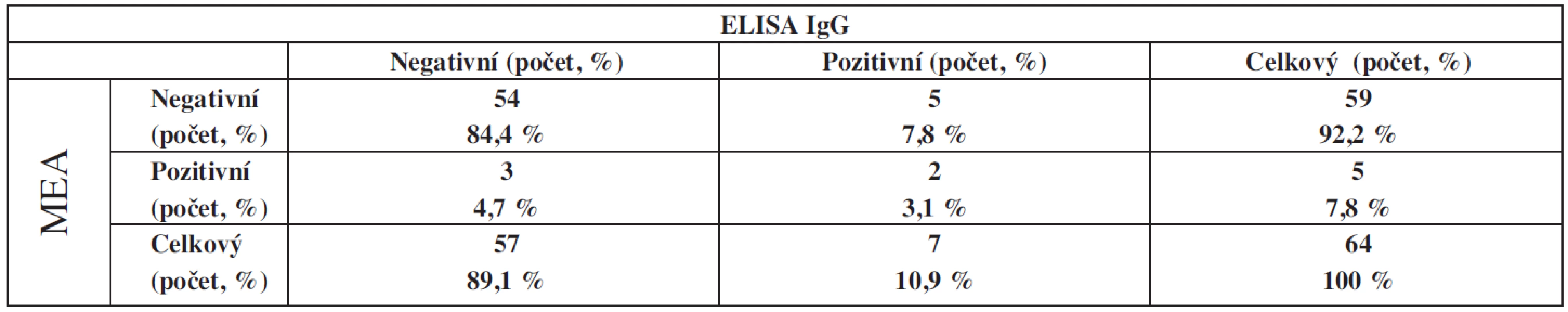
Pozitivita vzorků (cut-off 20 AU) aktivovaných pomocí nízké koncentrace heparinu byla potvrzována inhibicí prostřednictvím vysoké koncentrace heparinu (tab. 3).
ELISA
Celý soubor pacientů byl současně vyšetřen imunologickým testem. Výsledky testu jsou uvedeny v tabulce 4.
Výsledky vyšetření HIT v souboru pacientů léčených oběma typy heparinů ukázaly, že použité metodiky poskytují značně rozdílné výsledky. Tento závěr plně koresponduje s teoretickými modely, na jejichž základě byla vyšetření heparinem indukované trombocytopenie navržena (15).
Z naměřených dat plyne, že pouze u dvou pacientů (3,1 %) z 5 pozitivních metodou MEA resp. 7 ELISA metodou byl pozitivní nález potvrzen oběma metodami. Oba pacienti měli 4T skóre 6 s poklesem trombocytů o více než 50 % mezi 5. a 10. dnem po podání heparinu a s vyloučenou jinou příčinou trombocytopenie. U dalších pacientů byl pozitivní pouze jeden z testů. Pozitivita ELISA testu na přítomnost protilátek HIT byla 10,9 %, pozitivita MEA na přítomnost aktivovaných trombocytů inhibovanou vysoce koncentrovaným UFH byla 7,8 %. Pozitivita alespoň v jednom z testů byla 15,6 %. Pomocí statistického hodnocení dle McNemara je patrné, že se jedná o dvě nezávislá stanovení.
Graf 1. Porovnání MEA a ELISA testu. Graf zaznamenává korelaci výsledků obou metod. U MEA je pozitivita nad hodnotu 20,0 AU/min a u ELISA nad 0,500 Abs. 
Závěr
Diagnostika HIT stále zůstává velmi komplikovanou klinicko-laboratorní problematikou. Nicméně nové diagnostické možnosti poskytují značný potenciál pro řešení tohoto problému (16).
ELISA metodika vyšetření protilátek nám poskytuje informaci o přítomnosti všech typů protilátek (převážně IgG) proti komplexu destičkovému faktoru 4 s heparinem, čímž je splněn požadavek na vysokou senzitivitu, nicméně neposkytuje žádnou informaci o samotné aktivaci krevních destiček, která je nezbytná ke klinické manifestaci HIT ve formě trombocytopenie.
MEA metodika nám naopak poskytuje informaci pouze o aktivovaných krevních destičkách v přítomnosti heparinu, což plně koresponduje s modelem aktivace krevních destiček při klinické manifestaci HIT. Nicméně jsme ochuzeni o informaci, zda jsou přítomny protilátky, které zatím neaktivují krevní destičky, ale které mohou tuto reakci vyvolat v delším časovém intervalu.
Posun ve vývoji funkčních testů umožňuje rozšíření této diagnostiky do širokého spektra laboratoří, což bylo dosud hlavní nevýhodou SRA (17) a limitovalo to využití laboratorní detekce protilátek v klinické praxi. Kombinace funkčních testů s imunologickými vyšetřeními poskytuje komplexní obraz o protilátkové odpovědi při imunizaci organismu po podání heparinů (18).
Poděkování
Podpořeno grantem IGA MZd ČR NS 10319-3/2009 86-14 a grantovým projektem LF-2012-007.
Mgr. Luděk Slavík, Ph.D.
Hemato-onkologická klinika
LF UP a FN Olomouc
I. P. Pavlova 6
77520 Olomouc
e-mail:ludek.slavik@fnol.cz
Zdroje
1. Králová S, Klodová D, Gumulec J, et al. Heparinem indukovaná trombocytopenie. Vnitř lék 2006; 52 : 98–106.
2. Malý J, Pecka M, Dulíček P, et al. Jsou všechny nízkomolekulární hepariny stejné? Trombóza a hemostáza 1999; Malý J. & Pecka M., 24–25.
3. Novotný J, Konvičková L. Heparinem indukovaná trombocytopenie, Vnitř Lék 1998; 44 : 282–287.
4. Albeiro L, Kimmerle S, Baumann A, et al. Rapid determination of anti-heparin/platelet factor 4 antibody titers in the diagnosis of heparin-induced thrombocytopenia, Am J Med 2003; 114 : 528–536.
5. Andersson LO, Barrowcliffe TW, Holmer E, Johnson EA, Söderström G. Molecular weight dependency of the heparin potentiated inhibition of thrombin and activated factor X. Effect of heparin neutralization in plasma. Thromb Res 1979; 15 : 531–41.
6. Stewart MW, Etches WS, Boshkov K, et al. Heparin-induced thrombocytopenia: an improved method of detection based on lumi-aggregometry. Brit J Haematol 1995; 91 : 173–177.
7. Meyer O, Salama A, Pittet N et al. Rapid detection of heparin–induced platelet antibodies with particle gel immunoassay (ID–HPF4). Lancet 1999; 354 : 1525–1526.
8. Pauzner R, Greinacher A, Selleng K, Althaus K, Shenkman B, Seligsohn U. False-positive tests for heparin-induced thrombocytopenia in patients with antiphospholipid syndrome and systemic lupus erythematosus. J Thromb Haemost 2009; 7 : 1070–1074.
9. Polack B, Schved JF, Boneu B. Preanalytical recommendations of the ‘Groupe d’Etude sur l’Hemostase et la Thrombose’ (GEHT) for venous blood testing in hemostasis laboratories. Haemostasis 2001; 31 : 61–68.
10. Tomer A, Masalunga C, Abshire TC. Determination of heparin-induced thrombocytopenia: A rapid flow cytometric assay for direct demonstration of antibody - mediated platelet activation. Am J Hematol 1999; 61 : 53–61.
11. Elalamy I, Galea V, Hatmi M, Gerotziafas GT. Heparin-induced multiple electrode aggregometry: a potential tool for improvement of heparin-induced thrombocytopenia diagnosis, J Thromb Haemost 2009; 7 : 1932 – 1934.
12. Morel-Kopp MC, Aboud M, Tan CW, Kulathilake C, Ward C. Whole blood impedance aggregometry detects heparin-induced thrombocytopenia antibodies, Thromb Res 2010; 125 : 234–239.
13. Walenga JM, Jeske WP, Wood JJ, et al. Laboratory tests for heparin-induced thrombocytopenia: a multicenter study. Semin Hematol 1999; 36 : 22–28.
14. Greinacher A, Levy JH. HIT happens: diagnosing and evaluating the patient with heparin-induced thrombocytopenia. Anesth Analg 2008; 107 : 356–358.
15. Warkentin TE. Heparin-induced thrombocytopenia: pathogenesis and management. Br J Haematol 2003; 121 : 535–55.
16. Kelton JG, Warkentin TE. Diagnosis of heparin–induced thrombocytopenia, still a journey, not yet a destination. Am J Clin Pathol 1995; 104 : 611–613.
17. Levy-Toledano S, Gallet, C, Nadal F, et al. Phosphorylation and dephosphorylation mechanism in platelet function a tightly regulated balance. Thromb Haemost 1997; 78 : 226–227.
18. Selleng S, Malowsky B, Itterman T, et al. Incidence and clinical relevance of anti-platelet factor 4/heparin antibodies before cardiac surgery, Am Heart J 2010; 160 : 362–369.
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2012 Číslo 2- Nejasný stín na plicích – kazuistika
- Jak naučit dítě s hemofilií aplikovat injekci? V Motole pomáhají sestrám i umělé ruce
- Když se ve střevech děje něco nepatřičného...
- Centrální žilní katetry a trombóza u dětských pacientů s hemofilií?
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
-
Všetky články tohto čísla
- Základní Imunohematologická laboratorní vyšetření červené řady – Obecné zásady a technické postupy
- Imunohematologická vyšetření dárců krve a krevních složek
- Úvodní slovo
- Význam stanovení hladiny hepcidinu v diagnostice vybraných typů anémií v dětském věku
- Hodnocení časné molekulární odpovědi po 3 měsících léčby imatinibem může u nemocných s chronickou myeloidní leukemií přispět k upřesnění odhadu prognózy – zkušenosti jednoho centra
- Identifikace patogeneticky významných mutací u chronické lymfocytární leukemie pomocí „sekvenování nové generace“
- Současné možnosti laboratorní diagnostiky heparinem indukované trombocytopenie
- Kolapsový stav u 18leté dívky – kazuistika
- Zpráva o úspěšném ukončení projektu Virtuální mikroskopie
- Zpráva o knize
- Opožděná informace o knize věnované hematologii a transfuziologii vydané na Slovensku
- MUDr. Vladimír Koza
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Současné možnosti laboratorní diagnostiky heparinem indukované trombocytopenie
- Základní Imunohematologická laboratorní vyšetření červené řady – Obecné zásady a technické postupy
- Kolapsový stav u 18leté dívky – kazuistika
- Význam stanovení hladiny hepcidinu v diagnostice vybraných typů anémií v dětském věku
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy