-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Nízkodávková výpočetní tomografie skeletu v hodnocení stadia mnohočetného myelomu
Low-dose computed tomography of the skeleton in multiple myeloma staging
The objective of imaging in plasma cell dyscrasia staging is the detection of osteolytic bone lesions and associated soft tissue masses. In 2012, we initiated a project comparing skeletal surveys using conventional radiography and low-dose CT of equal radiation dose. The end-points included clinical benefit (detection of osteolytic lesions, vertebral compressions), patient comfort, radiation exposure and cost. Seventy-four patients underwent both examinations on the same day. CT showed the presence of osteolytic lesions in 14% of patients with negative finding on radiography and excluded lesions found by radiography in 14% of patients. Conventional radiography detected only 72% of vertebral compressions depicted on CT (p < 0.05). CT moreover demonstrated the additional 31 potentially important extra-skeletal findings. The radiation exposure was 2.7 mSv for CT and 2.5 mSv for radiography (n.s.). The in-room time for radiography was 41 ± 7 min compared to 6 ± 2 min for CT (p < 0.0001). The results of this study demonstrated the difference in diagnostic power between low-dose CT skeletal survey and radiography based skeletal survey for the detection of osteolytic skeletal involvement and extra-skeletal lesions in patients with plasma cell dyscrasias. Low-dose CT can be performed with similar radiation exposure, in the same extent, at lower cost, with significantly superior patient comfort and with improved certainty of the diagnosis. This study confirms the recommendation to include low-dose CT skeletal survey as the new „gold-standard“ in the diagnostic workup of multiple myeloma.
Key words:
multiple myeloma – computed tomography – radiography – staging
Autori: L. Lambert 1; J. Straub 2; Z. Mecková 3; P. Ouředníček 4; L. Šimáková 1; D. Pohlreich 2; G. Gavelli 5; I. Špička 2
Pôsobisko autorov: Radiodiagnostická klinika VFN a 1. LF UK v Praze 1; I. interní klinika – klinika hematologie VFN a 1. LF UK v Praze 2; Ústav nukleární medicíny VFN a 1. LF UK v Praze 3; Radiologická klinika, Fakultní nemocnice u sv. Anny v Brně 4; Radiology Unit, IRCCS – Istituto Scientifico Romagnolo per lo Studio e la Cura dei Tumori (IRST), Meldola (FC), Itálie 5
Vyšlo v časopise: Transfuze Hematol. dnes,22, 2016, No. 4, p. 238-242.
Kategória: Souhrnné práce, původní práce, kazuistiky
Súhrn
Cílem zobrazovacích metod v hodnocení stadia (staging) monoklonálních gamapatií je průkaz osteolytických lézí a solidních nádorových útvarů. V roce 2012 byla na našem pracovišti zahájena studie zaměřená na srovnání rentgenového (RTG) vyšetření skeletu a v té době nově zavedeného nízkodávkového (low-dose) vyšetření skeletu výpočetní tomografií (CT) se srovnatelnou radiační zátěží. Základními cíli bylo zhodnocení klinického přínosu (detekce osteolytických lézí, kompresí obratlů), komfortu pacienta, radiační zátěže a ceny vyšetření. Obě tato vyšetření ve stejný den podstoupilo 74 pacientů. Nízkodávkové CT vyšetření odhalilo přítomnost osteolytických lézí u 14 % pacientů s negativním nálezem na RTG, naopak, u 14 % se RTG nález na CT vyšetření neprokázal. RTG vyšetření detekovalo pouze 72 % obratlových kompresí zobrazených na CT (p < 0,05). CT zobrazilo navíc 31 potenciálně významných extraskeletálních patologií. Průměrná radiační zátěž byla 2,7 mSv u CT a 2,5 mSv u RTG (n. s.). Vyšetření RTG (41 ± 7 min) trvalo 7krát déle než vyšetření CT (6 ± 2 min, p < 0,0001). Výsledky této studie ukazují odlišnost v diagnostické výtěžnosti mezi nízkodávkovým CT skeletu a RTG skeletu v hodnocení stadia osteolytického postižení skeletu i v hodnocení extraskeletálních lézí u pacientů s monoklonálními gamapatiemi. CT lze provádět se stejnou radiační zátěží jako rentgenové vyšetření, ve stejném rozsahu, za menší cenu, s podstatně vyšším komfortem pro pacienta a větší jistotou správné diagnózy. Výsledky naší studie potvrzují současná doporučení CT vyšetření s nízkou dávkou jako nového „zlatého standardu“ v diagnostice mnohočetného myelomu.
Klíčová slova:
mnohočetný myelom – výpočetní tomografie – rentgen – stagingÚVOD
Primárním cílem zobrazovacích metod v hodnocení stadia (staging) monoklonálních gamapatií je průkaz osteolytických lézí a solidních nádorových útvarů. Zobrazovací metody jako jedno z doplňkových vyšetření pomáhají upřesnit diagnózu a stadium onemocnění, a tím ovlivňují volbu léčby pacienta [1, 2]. Mezi modality, které v současné době můžeme pro staging onemocnění použít, patří skiagrafické (rentgenové, RTG) vyšetření kostí, výpočetní tomografie (CT), magnetická rezonance (MR), pozitronová emisní tomografie (PET-CT), nebo PET-MR [3, 4]. Jednotlivé metody se však liší svou diagnostickou úrovní, dostupností, cenou a komfortem pro pacienty [3, 5].
V roce 2012 jsme zahájili studii zaměřenou na srovnání RTG vyšetření skeletu a v té době nově zavedeného nízkodávkového (low-dose) CT vyšetření skeletu. Základními cíli bylo zhodnocení klinického přínosu (detekce osteolytických lézí, obratlových kompresí), komfortu pacienta, radiační zátěže a ceny vyšetření.
MATERIÁL A METODIKA
Studie byla schválena Etickou komisí Všeobecné fakultní nemocnice v Praze a všichni pacienti podepsali informovaný souhlas. Do této prospektivní studie bylo zařazeno 74 pacientů s monoklonální gamapatií, kteří mezi rokem 2013 a 2015 podstoupili jak RTG, tak CT vyšetření ve stejný den.
RTG vyšetření, které bylo provedeno na standardním skiagrafickém kompletu s nepřímou digitální skiagrafií (Multix Pro, Siemens), zahrnovalo celkem 19 projekcí (lebka [2 projekce], krční, hrudní a bederní páteř [2 projekce], žebra, pánev, stehenní kosti, kosti bérce, pažní kosti a kosti předloktí). CT vyšetření bylo provedeno na 256řadém přístroji (iCT 256, Philips Healthcare) nativně, ve spirálním módu (napětí = 120 kV, plánovaný součin času a proudu = 30 mAs), od vertexu po kolena. Pacienty jsme vyšetřovali v poloze na zádech s připaženýma rukama, položenýma co možná nejvíce dopředu kvůli redukci artefaktů v oblasti hrudní a bederní páteře. Doba vyšetření u RTG a CT byla měřena mezi vstupem na vyšetřovnu a odchodem z vyšetřovny. Radiační zátěž byla spočítána inženýrem v oboru radiační fyziky. Dva zkušení radiologové hodnotili na RTG i CT počet osteolytických lézí. Pro srovnání citlivosti obou metod jsme využili binární hodnocení přítomnosti či absence léze, které je v současné době preferováno [1, 6]. Jeden z radiologů dále vyhodnotil počty kompresí obratlových těl a přítomnost extraskeletálních patologií. Pro porovnání CT a RTG byl použit Wilcoxonův párový test nebo párový t-test. Hodnotu p < 0,05 jsme považovali za významnou.
VÝSLEDKY
Pacienti byli ve věku 65 ± 11 let a 47 % bylo žen. Polovina pacientů v minulosti podstoupila chemoterapii nebo transplantaci kmenových buněk pro mnohočetný myelom a vyšetření bylo prováděno pro podezření na relaps nebo progresi. U druhé poloviny šlo o vstupní vyšetření nebo kontrolu v rámci sledování („watch and wait“). Základní charakteristiky pacientů shrnuje tabulka 1.
Tab. 1. Charakteristika pacientů 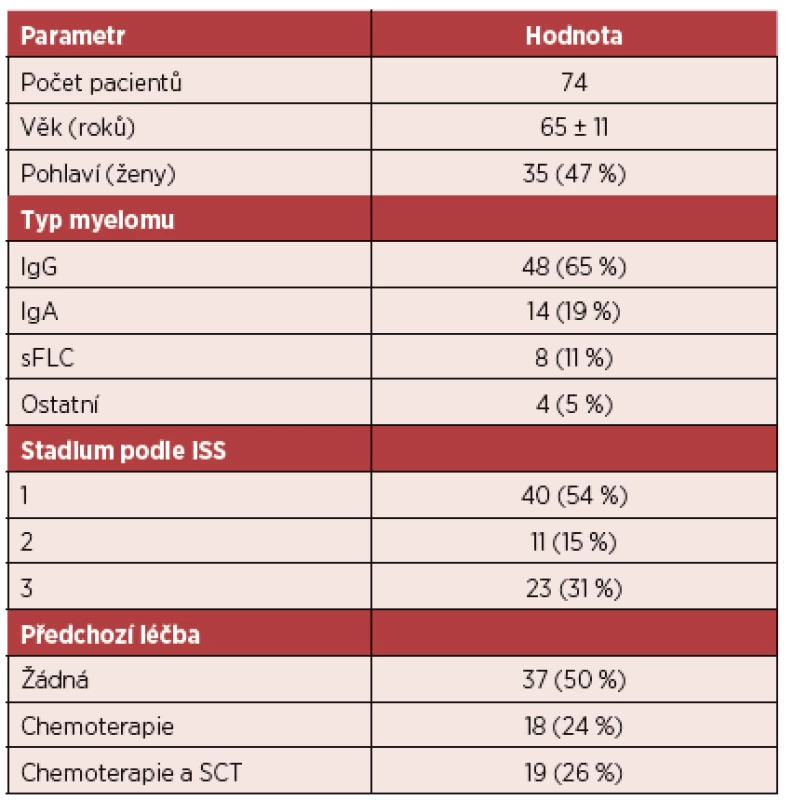
Vysvětlivky: sFLC – typ s volnými lehkými řetězci, ISS – International Staging System, SCT – transplantace krvetvorných buněk Low-dose CT vyšetření odhalilo přítomnost lézí u 14 % pacientů s negativním nálezem na RTG, a naopak, u 14 % se pozitivní RTG nález na CT vyšetření neprokázal. RTG vyšetření detekovalo v porovnání s CT pouze 72 % kompresí obratlových těl (93 u CT a 67 u RTG, p < 0,05). Další rozdíl byl v nálezech mimo skelet, kdy CT odhalilo navíc 31 potenciálně významných extraskeletálních patologií (měkkotkáňová formace, zvětšené lymfatické uzliny, aneurysma břišní aorty, pneumonie, ascites, …). Průměrná radiační zátěž byla 2,7 mSv u CT a 2,5 mSv u RTG (n. s.). Vyšetření RTG (41 ± 7 min) trvalo 7krát déle než vyšetření CT (6 ± 2 min, p < 0,0001). Za všechna RTG vyšetření se celkově vykazuje 3 050 bodů, za jedno nativní CT vyšetření 2 048 bodů.
DISKUSE
Vyšetření skeletu pomocí RTG („skeletal survey“) je historicky základní metodou pro hodnocení osteolytického postižení skeletu u pacientů s mnohočetným myelomem, které bylo zapracováno již v původním staging systému podle Durieho a Salmona z roku 1975 [2, 7, 8]. Ve světle rozvoje moderních trojrozměrných zobrazovacích metod, byl tento systém o necelých 30 let později rozšířen na Durie-Salmon PLUS staging systém [9, 10]. Vzhledem k odlišnému fyzikálnímu principu těchto pokročilých metod a jejich podstatně vyšší přesnosti pak v řadě indikací RTG vyšetření zcela vytlačily. Do srovnání jednotlivých zobrazovacích metod v detekci myelomových lézí a kvantifikaci postižení skeletu včetně kostní dřeně bylo věnováno značné úsilí [5, 11, 12]. Debatu o kvantifikaci myelomových lézí na trojrozměrných zobrazovacích metodách ukončil konsenzus Mezinárodní pracovní myelomové skupiny (International Myeloma Working Group, IMWG), která doporučila považovat nález byť jen jediné osteolytické léze jako klinicky významný [13, 14].
Hlavní překážkou většího rozšíření moderních zobrazovacích metod však byla jejich cena, dostupnost a do určité míry i radiační zátěž při CT a PET-CT vyšetření. U CT vyšetření se díky rozvoji nových technologií zaměřených na snížení radiační zátěže a faktu, že mezi kostí a osteolytickou tkání je vysoký kontrast, podařilo snížit radiační zátěž až na 4 mSv, která odpovídá ročnímu úhrnu radiační zátěže z přírodního pozadí [15]. K dalšímu snížení radiační zátěže, kterého bylo dosaženo v této studii, byla použita iterativní rekonstrukce. Jedná se o pokročilou metodu tvorby obrazů z dat naměřených CT přístrojem, která zohledňuje geometrii systému, fyzikální vlastnosti (útlum) částí spektra vyzařovaného rentgenkou, a která v cyklickém výpočtu snižuje množství obrazového šumu a artefaktů [16].
Prezentovaná studie ukazuje rozdíl v hodnocení osteolýzy mezi RTG a CT vyšetřením [1, 13]. Pokud není osteolýza masivní, vznikají značné neshody mezi RTG a CT, zejména při hodnocení v oblasti páteře (obr. 1) a hrudního koše (obr. 2) [17]. Při hodnocení kalvy, kde je na RTG obtížné rozlišit běžné diploické lakuny od osteolytických ložisek, se na CT lze řídit např. jejich napojením na diploické cévní kanálky a emissaria. Vzhledem k tomu, že podle doporučení IMWG stačí zobrazit jedinou osteolytickou lézi, je značný rozdíl v rozsahu osteolýzy mezi CT a RTG v konečném hodnocení menší. Tato studie ukázala, že rozdíl mezi RTG a CT je nejen v detekci osteolytických ložisek, ale i obratlových kompresí a extraskeletálních lézí, které mohou být klinicky významné [18]. Ačkoliv by se mohlo zdát, že obratlové komprese jsou na RTG snímku dobře patrné, jejich detekci snižuje přítomnost osteoporózy, degenerativních změn, poruch osy páteře a sumace s okolními strukturami, jako jsou střevní kličky a plicní parenchym [19]. Hodnocení postižení skeletu myelomem pomocí CT je spojeno s vyšší mírou jistoty správné diagnózy i pro radiology [17]. Se vzrůstajícím počtem provedených vyšetření roste i expertiza a erudice v jeho hodnocení, jehož doba se neliší od jiných CT vyšetření [17]. Opakovaně se nám podařilo zachytit extraskeletální propagaci myelomové masy i na nízkodávkovém nativním CT vyšetření (viz obr. 2).
Obr. 1. Nízkodávkové CT skeletu ukazuje rozsáhlé osteolytické postižení hrudní a bederní páteře u pacienta s mnohočetným myelomem 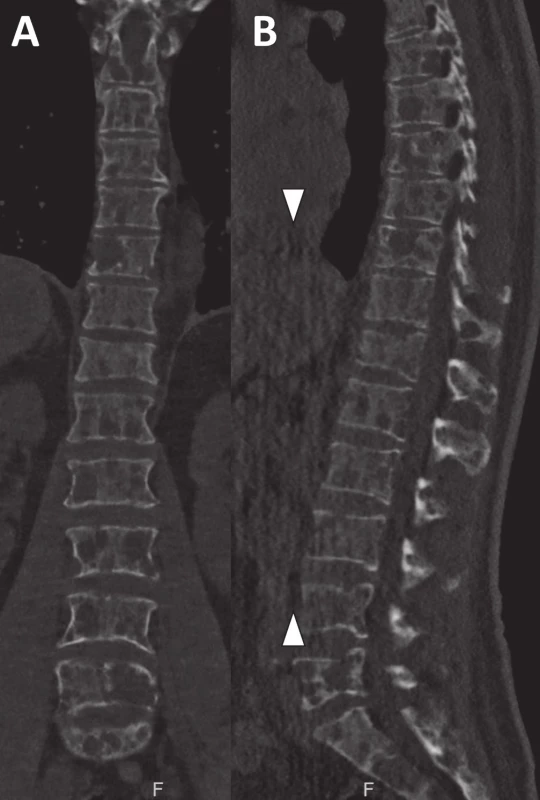
Ačkoliv je postižení skeletu masivní, jejich detekce na RTG snímcích je velmi obtížná a nejistá. Při prohlížení vyšetření v koronární rovině (a) je obrazová kvalita lepší než v sagitální rovině (b), kde se zobrazuje řada pruhových, vertikálně orientovaných artefaktů (šipky). Obr. 2. Drobná osteolytická ložiska ve sternu (a) a žebru (b) velikosti 1–2 mm jsou díky velkému denzitnímu rozdílu mezi kortikou a měkkou tkání s jistotou detekovatelná i na CT vyšetření provedeném se srovnatelnou radiační zátěží jako RTG Na CT se rovněž zobrazila měkkotkáňová formace zasahující do páteřního kanálu v bederní oblasti (c). 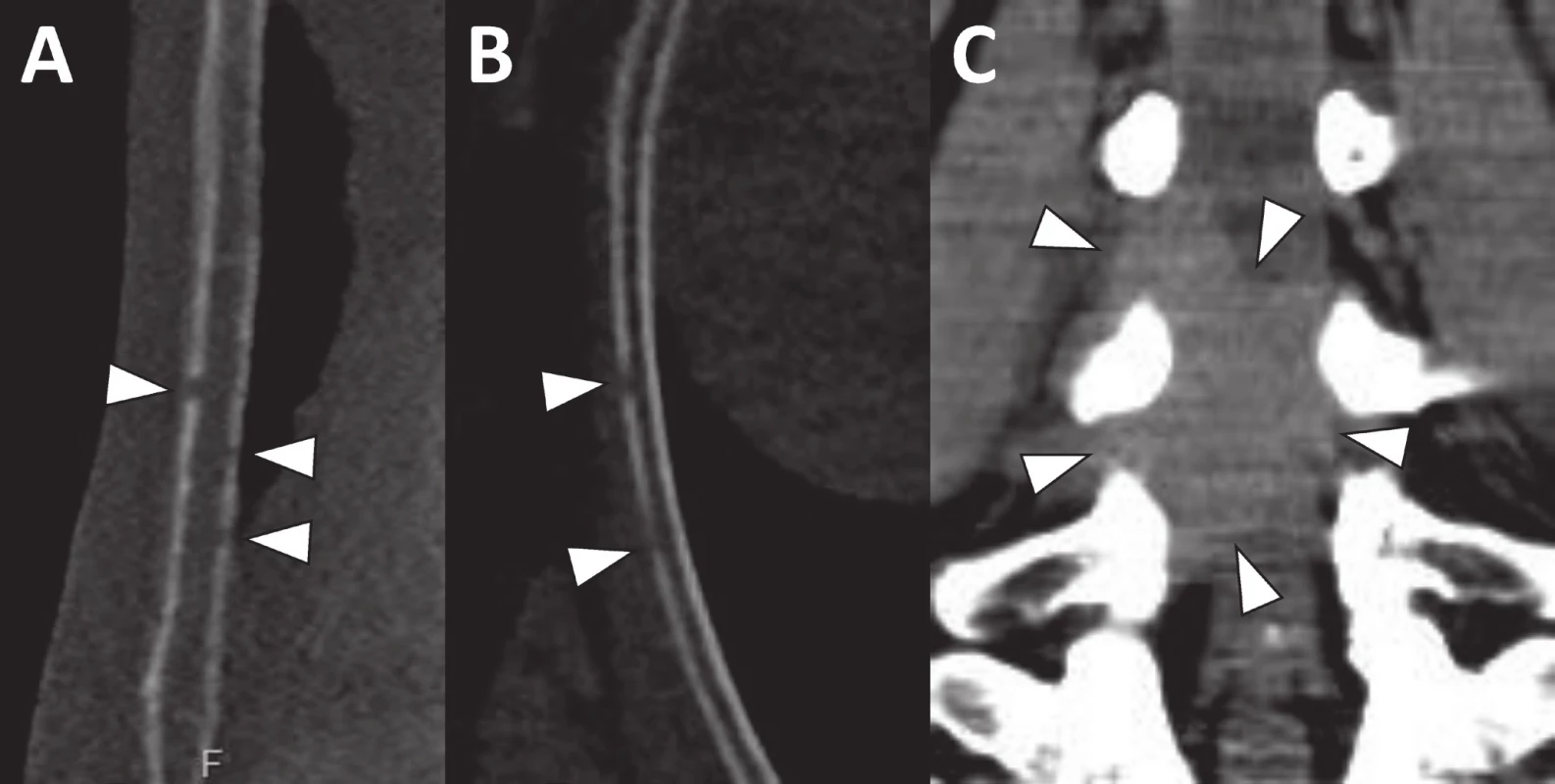
Rozdíly mezi jednotlivými zobrazovacími metodami nelze spatřovat pouze v detekci osteolytických a extraskeletálních lézí. Pacienti s mnohočetným myelomem jsou často „fragilní“. Opakované zaujímání nefyziologických poloh při snímkování skeletu působí některým nemocným bolest a v minulosti byla u části z nich nutná analgetická premedikace. Při CT vyšetření se pacient na vyšetřovacím stole polohuje pouze jednou, a to na záda, a celý pobyt ve vyšetřovně trvá pouze kolem 6 minut. U prvních CT vyšetření, která jsme začali provádět koncem roku 2012, měli pacienti ruce za hlavou, nicméně i toto bylo pro část z nich spojeno s výrazným nepohodlím. Polohování rukou podél těla pacienta vede k nárůstu obrazového šumu v oblasti hrudní a bederní páteře. Obrazový šum a artefakty lze ale redukovat použitím iterativní rekonstrukce a prohlížením páteře v koronární rovině (viz obr. 1), kde působí artefakty méně rušivě a např. i tím, že se horní končetiny posunou více ventrálně před tělo pacienta, aby nebyly v jedné ose s páteří. Dalším důvodem, proč provádět CT místo RTG je i cena vyšetření, která na našem pracovišti hovoří ve prospěch CT, což je dáno tím, že se každé RTG vyšetření, které je samo o sobě levné, účtuje zvlášť.
ZÁVĚR
Výsledky této studie ukazují odlišnost v diagnostické výtěžnosti mezi nízkodávkovým CT skeletu a RTG skeletu v hodnocení osteolytického postižení skeletu i v hodnocení extraskeletálních lézí u pacientů s monoklonálními gamapatiemi. Lze ho provádět se stejnou radiační zátěží jako rentgenové vyšetření, ve stejném rozsahu, za menší cenu, s podstatně vyšším komfortem pro pacienta a s větší jistotou správné diagnózy. Výsledky naší studie potvrzují současná doporučení využití CT vyšetření s nízkou dávkou jako nového „zlatého standardu“ v hodnocení stadia mnohočetného myelomu [1].
Podíl autorů na rukopisu
LL, IŠ, JS, LŠ – příprava studie
LL, LŠ, PO, ZM, GG – zobrazovací metody
IŠ, JS, DP – léčba nemocných
LL, IŠ, ZM, PO, LŠ – napsání rukopisu
LL, IŠ, PO, GG – revize rukopisu
Poděkování
Tato práce byla podpořenou 1. Lékařskou fakultou Univerzity Karlovy v Praze (PRVOUK – P27/LF1/1).
Čestné prohlášení autorů
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku neshledávají žádný střet zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Doručeno do redakce dne 19. 5. 2016.
Přijato po recenzi dne 19. 9. 2016.
MUDr. Ing. Lukáš Lambert, Ph.D.
Radiodiagnostická klinika VFN a 1. LF UK v Praze
U Nemocnice 2
128 08 Praha 2
e-mail: lambert.lukas@gmail.com
Zdroje
1. Rajkumar SV, Dimopoulos MA, Palumbo A, et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol 2014; 15(12): e538–e548.
2. Czech Myeloma Group. Souhrn doporučení 2009 „Diagnostika a léčba mnohočetného myelomu” Doporučení vypracované Českou mye-lomovou skupinou, Myelomovou sekcí České hematologické společnosti a Slovenskou myelomovou společností pro diagnostiku a léčbu mnohočetného myelomu. Transfuze Hematol dnes 2009; 15(Suppl. 2): 5–16.
3. Zamagni E, Nanni C, Patriarca F, et al. A prospective comparison of 18F-fluorodeoxyglucose positron emission tomography-computed tomography, magnetic resonance imaging and whole-body planar radiographs in the assessment of bone disease in newly diagnosed multiple myeloma. Haematologica 2007; 92(1): 50–55.
4. Minařík J, Hrbek J, Mysliveček M, et al. Racionální algoritmus zobrazovacích vyšetření u mnohočetného myelomu v podmínkách České republiky. Transfuze Hematol dnes 2015; 21(4): 200–205.
5. Lütje S, de Rooy JWJ, Croockewit S, Koedam E, Oyen WJG, Raymakers RA. Role of radiography, MRI and FDG-PET/CT in diagnosing, staging and therapeutical evaluation of patients with multiple myeloma. Ann Hematol 2009; 88(12): 1161–1168.
6. Durie BGM. The role of anatomic and functional staging in myeloma: Description of Durie/Salmon plus staging system. Eur J Cancer 2006; 42(11): 1539–1543.
7. Durie BG, Salmon SE. A clinical staging system for multiple myeloma. Correlation of measured myeloma cell mass with presenting clinical features, response to treatment, and survival. Cancer 1975; 36(3): 842–854.
8. Adam Z, Straub J, Ščudla V. Doporučení České myelomové skupiny (CMG) pro zajištění časné diagnostiky mnohočetného myelomu v podmínkách ambulantní klinické praxe. Transfuze Hematol dnes 2008; 14 : 93–94.
9. Durie BGM, Kyle RA, Belch A, et al. Myeloma management guidelines: a consensus report from the Scientific Advisors of the International Myeloma Foundation. Hematol J 2003; 4(6): 379–398.
10. Fechtner K, Hillengass J, Delorme S, et al. Staging monoclonal plasma cell disease: comparison of the Durie-Salmon and the Durie-Salmon PLUS staging systems. Radiology 2010; 257(1): 195–204.
11. Sachpekidis C, Hillengass J, Goldschmidt H, et al. Comparison of 18F-FDG PET/CT and PET/MRI in patients with multiple myeloma. Am J Nucl Med Mol Imaging 2015; 5(5): 469–478.
12. Delorme S, Baur-Melnyk A. Imaging in multiple myeloma. Eur J Radiol 2009; 70(3): 401–408.
13. Dimopoulos M, Terpos E, Comenzo RL, et al. International myeloma working group consensus statement and guidelines regarding the current role of imaging techniques in the diagnosis and monitoring of multiple Myeloma. Leukemia 2009; 23(9): 1545–1556.
14. Rajkumar SV. Myeloma today: Disease definitions and treatment advances. Am J Hematol 2016; 91(1) :90–100.
15. Baur-Melnyk A, Buhmann S, Becker C, et al. Whole-body MRI versus whole-body MDCT for staging of multiple myeloma. Am J Roentgenol 2008; 190(4) :1097–1104.
16. Mehta D, Thompson R, Morton T, Dhanantwari A, Shefer E. Iterative model reconstruction: simultaneously lowered computed tomography radiation dose and improved image quality. Med Phys Int J 2013; 2(1): 147–155.
17. Kröpil P, Fenk R, Fritz LB, et al. Comparison of whole-body 64-slice multidetector computed tomography and conventional radiography in staging of multiple myeloma. Eur Radiol 2007; 18(1): 51–58.
18. Gabzdilová J, Tóthová E, Guman T, Raffač S, Jarčuška P. Mykotické komplikácie po autológnej transplantácii krvotvorných buniek u pacientov s mnohopočetným myelómom. Transfuze Hematol dnes 2015; 21(1): 21–29.
19. Mahnken AH, Wildberger JE, Gehbauer G, et al. Multidetector CT of the Spine in Multiple Myeloma: Comparison with MR Imaging and Radiography. Am J Roentgenol 2002; 178(6): 1429–1436.
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2016 Číslo 4- Nejasný stín na plicích – kazuistika
- Subkutánne vs. intravenózne imunoglobulíny u pacientov s CLL
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
-
Všetky články tohto čísla
- Využití monoklonální protilátky daratumumab v léčbě mnohočetného myelomu
- Nízkodávková výpočetní tomografie skeletu v hodnocení stadia mnohočetného myelomu
- Trombocyty z aferézy a z plné krve – srovnání kvality a bezpečnosti
- Stabilita parametrů krevního obrazu a mikroskopicky stanoveného diferenciálního počtu leukocytů
- Vplyv ibrutinibu na doštičkovú agregáciu
- Kryokonzervované trombocyty v klinické praxi: srovnávací studie s nativními trombocyty
- Hodnocení nátěru aspirátu kostní dřeně
- Životní jubileum doc. MUDr. Adély Bártové, CSc.
- OBSAH ROČNÍKU 22/2016
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Trombocyty z aferézy a z plné krve – srovnání kvality a bezpečnosti
- Stabilita parametrů krevního obrazu a mikroskopicky stanoveného diferenciálního počtu leukocytů
- Hodnocení nátěru aspirátu kostní dřeně
- Nízkodávková výpočetní tomografie skeletu v hodnocení stadia mnohočetného myelomu
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



