Zkušenosti s léčbou ruxolitinibem u pacientů s myelofibrózou a pravou polycytemií na českých hematologických pracovištích
Experience with ruxolitinib in the treatment of myelofibrosis and polycythaemia vera at Czech haematological institutions
Backgrounds:
Ruxolitinib, a Janus kinase 1 and 2 inhibitor, demonstrated efficacy in patients with myelofibrosis and polycythaemia vera in the randomized COMFORT-I, COMFORT-II and RESPONSE studies. Ruxolitinib demonstrated superior durable reduction of splenomegaly and disease-associated symptoms, maintenance of haematocrit values, improvement in quality of life and overall survival compared to placebo or best available therapy.
Material and Methods:
A retrospective analysis evaluated efficacy and tolerability of ruxolitinib in a cohort of unselected myelofibrosis and polycythaemia vera patients treated in routine clinical practice at 14 Czech haematological centres from 2013 to 2016.
Results:
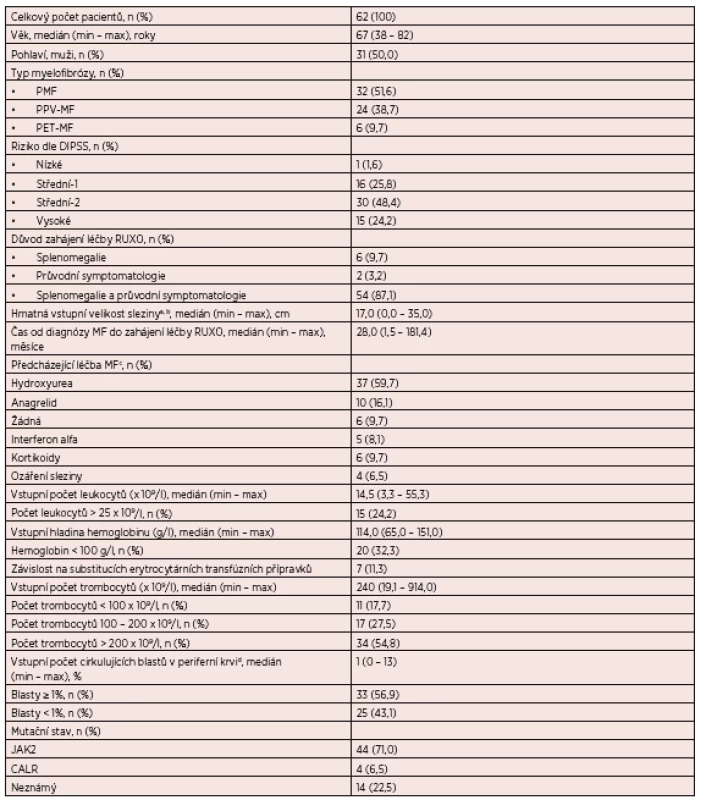
Myelofibrosis – a total of 62 patients with myelofibrosis treated with ruxolitinib were evaluated. The most frequent indication for treatment was concurrent splenomegaly and constitutional symptoms in 54 (87.1%) cases. Reduction ≥ 1/3 in palpable spleen length was achieved in 43 (72.9%) patients with baseline splenomegaly at a median of 4 weeks after starting therapy. Constitutional symptoms receded in 38 (92.7%) of 41 patients at a median of 4 weeks after starting therapy. While on ruxolitinib, eleven (18.0%) patients developed grade 3–4 anaemia and thirteen (21.3%) patients developed grade 3–4 thrombocytopenia. Forty six (74.2%) patients survived. Twenty five (40.3%) patients discontinued therapy, most frequently due to inefficacy (16.1% of patients) or haematological toxicity (8.1% of patients). Median duration of ruxolitinib therapy was 41 weeks.
Polycythaemia vera – a total of 8 patients with polycythaemia vera treated with ruxolitinib because of resistance or intolerance of previous treatment was analysed. Six (75.0%) patients achieved complete remission. All patients experienced resolution of disease-associated symptoms. No patient developed grade 3 to 4 toxicity. At evaluation, all patients remained on ruxolitinib with a median duration of 32.5 weeks.
Conclusion:
Our analysis confirmed the very good treatment efficacy of ruxolitinib in patients with myelofibrosis and polycythaemia vera on reduction of splenomegaly and alleviation of disease-associated symptoms. Ruxolitinib additionally led to the correction of haematocrit values in patients with polycythaemia vera. Haematological toxicity was generally low.
KEY WORDS:
ruxolitinib – myelofibrosis – polycythaemia vera – treatment outcome – drug toxicity
Autoři:
B. Weinbergerová 1; P. Čičátková 1; M. Palová 2; L. Stejskal 3; P. Bělohlávková 4; J. Kissová 5; L. Walterová 6; H. Fraňková 6; O. Černá 7; L. Lakomá 8; M. Brejcha 9; J. Pelková 10; M. Schutzova 11; J. Obernauerová 12; D. Nechvílová 13; E. Bogoczová 14; A. Hluší 2; E. Faber 2; M. Penka 5; Y. Brychtová 1; L. Červinek 1; M. Doubek 1; P. Žák 4; J. Mayer 1; Z. Ráčil 1
Působiště autorů:
Interní hematologická a onkologická klinika LF MU a FN Brno
1; Hemato-onkologická klinika FN Olomouc
2; Klinika hematoonkologie FN Ostrava a LF OU
3; IV. Interní hematologická klinika FN a LF UK, Hradec Králové
4; Oddělení klinické hematologie FN Brno
5; Oddělení klinické hematologie Krajské nemocnice Liberec
6; Interní hematologická klinika FNKV a LF UK, Praha
7; Hematologická ambulance Nemocnice Havlíčkův Brod
8; Hematologická ambulance Nemocnice Nový Jičín
9; Hematologické a transfúzní oddělení Nemocnice Vsetín
10; Hematologicko-onkologické oddělení FN Plzeň
11; Hematologicko-transfúzní oddělení Nemocnice Mladá Boleslav
12; Hematologicko-transfúzní oddělení Orlickoústecké nemocnice, Ústí nad Orlicí
13; Hematologická ambulance Vítkovické nemocnice, Ostrava-Vítkovice
14
Vyšlo v časopise:
Transfuze Hematol. dnes,23, 2017, No. 1, p. 30-40.
Kategorie:
Souhrnné práce, původní práce, kazuistiky
Souhrn
Úvod:
Ruxolitinib, inhibitor Janusových kináz 1 a 2, prokázal účinnost u pacientů s myelofibrózou a pravou polycytemií v mezinárodních randomizovaných studiích COMFORT-I, COMFORT-II a RESPONSE. Ve srovnání s placebem a nejlepší dostupnou léčbou dosáhl lepších výsledků týkajících se zmenšení splenomegalie, zmírnění průvodních symptomů nemoci, udržení hodnoty hematokritu, zlepšení kvality života a celkového přežívání.
Materiál a metodika:
Retrospektivní analýza zahrnovala zhodnocení efektu a nežádoucích účinků léčby ruxolitinibem u pacientů s myelofibrózou a pravou polycytemií léčených na celkem 14 českých hematologických pracovištích v letech 2013–2016.
Výsledky:
Myelofibróza – celkem bylo hodnoceno 62 pacientů s myelofibrózou léčených ruxolitinibem. Nejčastější indikací k zahájení léčby byla současná splenomegalie a průvodní symptomatologie u 54 (87,1 %) případů. 43 (72,9 %) pacientů se vstupní splenomegalií dosáhlo zmenšení hmatatelné velikosti sleziny o ≥ 1/3 původní velikosti s mediánem jeho dosažení 4 týdny od zahájení léčby. K vymizení B symptomatologie (hmotnostní úbytek, teploty a noční pocení) došlo u 38 z 41 pacientů s mediánem 4 týdnů od zahájení léčby (92,7 %). Rozvoj anémie a trombocytopenie stupně 3-4 byl pozorován u 11 (18,0 %) a 13 (21,3 %) pacientů. V souboru přežívá 46 (74,2 %) nemocných. U 25 (40,3 %) pacientů byla léčba ruxolitinibem ukončena, nejčastěji z důvodu její neúčinnosti (16,1 % pacientů) nebo hematologické toxicity (8,1 % pacientů). Medián délky léčby ruxolitinibem v souboru byl 41 týdnů.
Pravá polycytemie – celkem bylo ruxolitinibem léčeno 8 pacientů s pravou polycytemií rezistentních k předchozí léčbě a/nebo ji netolerujících. Šest (75,0 %) pacientů dosáhlo kompletní remise. U všech pacientů došlo k vymizení průvodní symptomatologie. U žádného pacienta se nevyskytla toxicita stupně 3–4. V době hodnocení souboru byly všichni pacienti na léčbě ruxolitinibem s mediánem její délky 32,5 týdnů.
Závěr:
Naše analýza potvrdila velmi dobrý efekt léčby ruxolitinibem u pacientů s myelofibrózou a pravou polycytemií týkající se zmenšení splenomegalie a zmírnění průvodní symptomatologie. U pacientů s pravou polycytemií vedl ruxolitinib navíc ke korekci hodnoty hematokritu. Hematologická toxicita byla většinou nízkého stupně.
KLÍČOVÁ SLOVA:
ruxolitinib – myelofibróza – pravá polycytemie – léčebný efekt – toxicita
ÚVOD
Myelofibróza a pravá polycytemie patří mezi Ph (BCR-ABL1)-negativní myeloproliferativní neoplazie (Ph-MPN), u nichž neprokážeme tzv. Filadelfský chromozom (Ph) a jeho produkt fuzní gen BCR-ABL1. Představují onemocnění postihující hematopoetickou kmenovou buňku s následnou aberantní proliferací granulocytární a/nebo erytrocytární a/nebo megakaryocytární linie a zvýšenou tendencí fibrotické a leukemické transformace. Myelofibróza (MF) se může objevit buď jako primární (PMF), nebo sekundární v rámci progredující pravé polycytemie (post-polycythemia vera myelofibrosis, PPV-MF) nebo esenciální trombocytemie (post-essential thrombocythemia myelofibrosis, PET-MF) [1]. Patogenetickým mechanismem vzniku Ph-MPN je porucha regulace dráhy JAK-STAT sloužící k přenosu signálu z Janusových kináz (JAK) na signální přenašeče a aktivátory transkripce (signal transducer and activator of transcription, STAT) [2, 3]. Myelofibróza je charakterizována fibrózou kostní dřeně, extramedulární hematopoézou, hepatosplenomegalií, tromboembolickými a krvácivými komplikacemi, rizikem leukemické transformace. Pacienti s MF mají vysoké hladiny cirkulujících prozánětlivých cytokinů, které jsou odpovědné za doprovodné symptomy (hmotnostní úbytek, noční pocení, horečka a další). Zmíněné symptomy významně zhoršují kvalitu života (quality of life, QoL) postižených jedinců [4]. Celkové přežívání (overall survival, OS) pacientů s MF, zejména ve středním-2 a vysokém riziku nemoci podle dynamického prognostického skórovacího systému (dynamic international prognostic scoring system, DIPSS), je významně zkráceno s mediánem 1,5–4 roky [5, 6].
Pravou polycytemii (polycythemia vera, PV) charakterizuje erytrocytóza. Mezi ostatní příznaky nemoci patří trombocytóza, leukocytóza, splenomegalie, zvýšené riziko tromboembolických komplikací, krvácení, mikrovaskulární příznaky, svědění kůže a riziko leukemické a fibrotické transformace. PV je spojená se zkráceným OS v souvislosti s kardiovaskulárními komplikacemi a progresí do PPV-MF a/nebo leukemie.
Myelofibróza postihuje převážně starší nemocné, kteří mohou být léčeni často pouze paliativní terapií s cílem zmírnění symptomů nemoci, řešení komplikací a zlepšení jejich QoL. Jedinou léčbu s kurativním potenciálem u pacientů s MF představuje alogenní transplantace hematopoetických krvetvorných buněk (allogeneic stem cell transplantation, aloSCT), která je však spojena s vysokým rizikem morbidity a mortality. Cílem léčby PV je primárně snížení rizika trombotických komplikací. Sekundárním cílem je zmírnění ostatních průvodních příznaků. Ani pro pacienty s PV nemáme k dispozici kurativní léčbu.
V poslední době se však s vývojem preparátů regulujících signální dráhu JAK-STAT nabízí možnost léčit pacienty s Ph-MPN pomocí léků potenciálně modifikujících onemocnění.
Ruxolitinib, selektivní inhibitor JAK1/JAK2, prokázal lepší účinnost u pacientů s pokročilou MF ve dvou mezinárodních randomizovaných studiích fáze 3, COMFORT-I a COMFORT-II (Controlled Myelofibrosis Study with Oral JAK Inhibitor Treatment) [7, 8]. Ve srovnání s placebem a nejlepší dostupnou léčbou dosáhl ruxolitinib (RUXO) rychlého a trvajícího zmenšení splenomegalie, zmírnění doprovodných symptomů, zlepšení QoL a prodloužení OS. U pacientů s PV závislých na venepunkcích, splenomegalií a rezistencí na hydroxyureu nebo její intolerancí prokázal RUXO v mezinárodní randomizované studii fáze 3, RESPONSE, lepší efekt ve srovnání s nejlepší dostupnou léčbou na trvalé udržení cílové hodnoty hematokritu (HKT), trombocytů a leukocytů, zmenšení objemu sleziny a zmírnění průvodních symptomů [9]. Na základě těchto výsledků byl RUXO schválen pro použití v běžné klinické praxi u pacientů s MF a PV. Registrace RUXO (přípravek Jakavi®; výrobce firma Novartis, Basilej, Švýcarsko) proběhla v Evropské unii v roce 2012, přičemž lék podléhá v České republice schválení revizním lékařem pojišťovny v rámci paragrafu 16 zákona o veřejném zdravotním pojištění.
Naše práce představuje výsledky léčby RUXO u pacientů s MF a PV v běžné klinické praxi ve srovnání s výsledky léčby v přísně monitorovaných klinických studiích.
MATERIÁL A METODIKA
Provedli jsme retrospektivní analýzu efektu a bezpečnosti léčby RUXO u pacientů s primární nebo sekundární MF a PV diagnostikovanou podle kritérií Světové zdravotnické organizace (World Health Organization, WHO) z roku 2008 [10] léčených na 14 českých hematologických pracovištích v letech 2013 až 2016. Zdrojová data byla čerpána buď z databáze pro Ph-MPN (MyeloprolIferative Neoplasia Database, MIND), která vznikla pod záštitou České leukemické skupiny – pro život (the Czech leukemia study group – for life, CELL) a je schválena etickými komisemi jednotlivých zúčastněných pracovišť, anebo z dotazníků.
Léčebný efekt RUXO byl hodnocen každé 4 týdny od zahájení léčby na základě stanovení rozsahu splenomegalie, výskytu B symptomatologie (hmotnostní úbytek, noční pocení a horečka) a ostatních doprovodných příznaků onemocnění (únava, nechutenství, svědění kůže a další). Splenomegalie byla měřena pohmatem se stanovením velikosti přesahu sleziny přes žeberní oblouk v levé medioklavikulární čáře. Symptomatologie byla hodnocena na základě kvalitativní přítomnosti výskytu jednotlivých příznaků. Parametry krevního obrazu byly sledovány ve stejných intervalech. Toxicita RUXO byla hodnocena podle Společných terminologických kritérií pro nežádoucí účinky – CTCAE (Common Terminology Criteria for Adverse Events) verze 4.03 [11]. Za nežádoucí účinek byl považován nový vedlejší projev nebo zhoršení vstupní odchylky od normy o ≥ 1 stupeň od zahájení léčby RUXO.
Statistické zhodnocení dat bylo provedeno pomocí Fišerova exaktního testu. Spojité proměnné byly porovnány Mannovým-Whitneyovým U testem. Pro všechny analýzy byla použita jako úroveň statistické významnosti α = 0,05.
VÝSLEDKY
1 Myelofibróza
1. 1 Charakteristika souboru
Analyzovaný soubor zahrnuje celkem 62 pacientů s MF léčených RUXO v období 2013–2016 na českých hematologických pracovištích. Kompletní charakteristika souboru je uvedena v tabulce 1. Medián věku pacientů v době zahájení léčby RUXO byl 67 let (min – 38; max – 82). Většina nemocných (51,6 %) byla léčena pro diagnózu PMF (38,7 % PPV-MF; 9,7 % PET-MF). Medián času od stanovení diagnózy MF do zahájení léčby RUXO byl 28,0 měsíců (min – 1,5; max – 181,4). Většina pacientů (45; 72,6 %) byla v době zahájení léčby RUXO klasifikována do středního-2, respektive vysokého rizika podle DIPSS. Padesát devět pacientů (96,7 %) mělo vstupní splenomegalii s mediánem velikosti sleziny 17 cm (min – 2; max – 35) přes levý žeberní oblouk v medioklavikulární čáře. V případě přesahu sleziny 2 cm přes levý žeberní oblouk byla důvodem k zahájení léčby RUXO zvětšující se velikost sleziny na léčbě interferonem alfa u mladého pacienta. U 41 pacientů (66,1 %) byla přítomna vstupní B symptomatologie a 61 pacientů (98,4 %) mělo minimálně 1 jakýkoliv průvodní příznak nemoci (85,5 % únava; 74,2 % břišní diskomfort; 58,1 % pocení; 58,1 % nechutenství; 53,2 % hmotnostní úbytek; 21,0 % svědění kůže; 17,7 % bolesti svalů; 11,3 % horečka; 3,2 % průjem). Třetina pacientů (20; 32,3 %) měla vstupní hladinu hemoglobinu < 100 g/l. Předcházející léčbu myelofibrózy v posledním půlroce před zahájením RUXO představovala nejčastěji hydroxyurea (37; 59,7 % pacientů). Malá část pacientů (6; 9,7 %) neměla žádnou léčbu.
U poloviny nemocných (31; 50,0 %) byla léčba RUXO zahájena v dávce 20 mg 2krát denně. V ostatních případech byla iniciální dávka modifikována (22,6 % – 15 mg 2krát denně, 16,1 % – 5 mg 2krát denně, 11,3 % – jiné dávkování). Medián úvodní denní dávky byl 35 mg (min – 5; max – 40). Úprava iniciálního dávkování byla provedena u velké většiny pacientů (25, 40,3 %) podle doporučení SPC (summary of product characteristics; souhrn údajů o přípravku) s ohledem na vstupní počet trombocytů. Ostatními důvody byly: 2krát vyšší věk pacienta – 3,2 %; 1krát současná kombinovaná cytoredukce – 1,6 %; 1krát vstupní trombocytopenie gr. 4 – 1,6 %; 1krát renální insuficience – 1,6 %; 1krát předchozí radioterapie sleziny – 1,6 %.
Medián délky léčby RUXO v souboru byl 41 týdnů (min – 2; max – 182). V průběhu léčby byla dávka RUXO redukována u 33 (53,2 %) případů z důvodu toxicity. Medián doby změny dávkování byl 9 týdnů od startu RUXO. Léčba byla dočasně přerušena u 17 pacientů (27,4 %) v mediánu 14 týdnů od zahájení RUXO. Celková doba přerušení byla v mediánu 2 týdnů (min – 1; max – 23). Důvodem k přerušení byla toxicita léčby (10; 16,1 % případů) a administrativní důvody při procesu žádosti o schválení navýšení úhrady na léčbu RUXO (7; 11,3 % případů).
1. 2 Efektivita léčby
Čtyřicet tři pacientů (72,9 %) z 59 hodnotitelných pacientů se vstupní splenomegalií dosáhlo zmenšení hmatné velikosti sleziny o ≥ 1/3 původní velikosti s mediánem jeho dosažení 4 týdny (min –4; max – 52) od zahájení léčby. Téměř u všech pacientů (56; 94,9 %) bylo dosaženo jakéhokoliv palpačního zmenšení splenomegalie od výchozího stavu, přičemž redukce velikosti sleziny byla kontinuální v čase (graf 1). Maximální průměrné palpační zmenšení sleziny měřené v levé medioklavikulární čáře bylo o 9 cm. Medián trvání zmenšení splenomegalie o ≥ 1/3 původní velikosti byl minimálně 20 týdnů. K vymizení B symptomatologie došlo u 38 pacientů z 41 (92,7 %)s mediánem 4 týdnů(min – 4; max – 40) od zahájení léčby RUXO. U většiny pacientů došlo k vymizení také ostatních průvodních symptomů s mediánem do 4 týdnů(min – 4; max – 40) od zahájení léčby (graf 2). U 11 ze 42 pacientů (26,2 %) se vstupní leukocytózou > 10 . 109/l došlo k normalizaci počtu leukocytů s mediánem 12 týdnů (min – 4; max – 40) od zahájení léčby. U čtyř ze sedmi anemických pacientů (57,1 %) závislých na substitucích erytrocytárními koncentráty bylo dosaženo během léčby RUXO buď transfúzní nezávislosti, anebo snížení frekvence substitucí.


1. 3 Sledování
Medián délky sledování pacientů v souboru byl 41 týdnů (min – 2, max – 182). Většina pacientů doposud přežívá (46; 74,2 %). Osm pacientů (12,9 %) zemřelo na progresi myelofibrózy, dalších 8 pacientů (12,9 %) zemřelo na jinou příčinu (tab. 2). U 25 pacientů (40,3 %) byla léčba RUXO ukončena s mediánem délky léčby 37 týdnů (min – 2, max – 156).
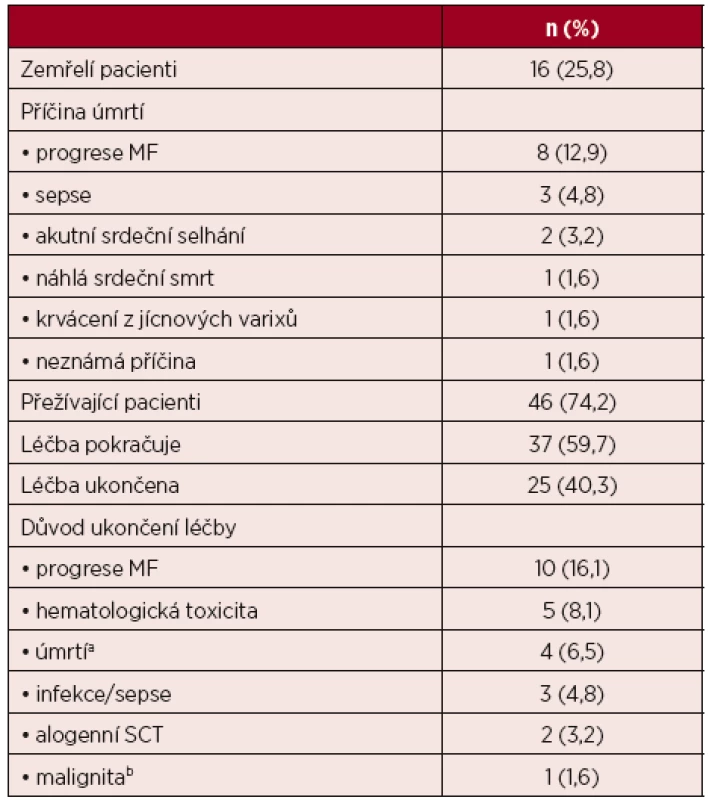
Nejčastějším důvodem ukončení léčby byly její neúčinnost (10; 16,1 % pacientů) nebo hematologická toxicita (5; 8,1 % pacientů). Ostatní důvody ukončení léčby RUXO byly: 4krát úmrtí (6,5 %), 3krát infekce/sepse (4,8 %), 2krát aloSCT (3,2 %), 1krát hepatocelulární karcinom (1,6 %). Z deseti pacientů, u nichž byla ukončena léčba RUXO pro neúčinnost (9 pacientů se vstupní splenomegalií a symptomy, 1 pacient pouze se vstupními symptomy), mělo 7 pacientů pokročilé onemocnění (tj. střední-2 nebo vysoké DIPSS) v době zahájení terapie RUXO. Čtyři pacienti (40,0 %) se vstupní splenomegalií a ukončenou léčbou pro progresi měli stacionární velikost sleziny od zahájení léčby RUXO, u 2 pacientů (20,0 %) došlo k přechodné regresi velikosti sleziny s její následnou progresí, u 1 pacienta (10,0 %) velikost sleziny i přes léčbu progredovala a 3 pacienti (30,0 %) se vstupně pokročilým onemocněním na léčbě progredovali do akutní myeloidní leukemie. Téměř u všech pacientů (8; 80,0 %) s ukončenou léčbou pro neúčinnost však došlo k stacionárnímu vymizení průvodní symptomatologie. Medián délky léčby RUXO u těchto 10 pacientů byl 37,5 týdnů (min – 4; max – 156).
1. 4 Bezpečnost
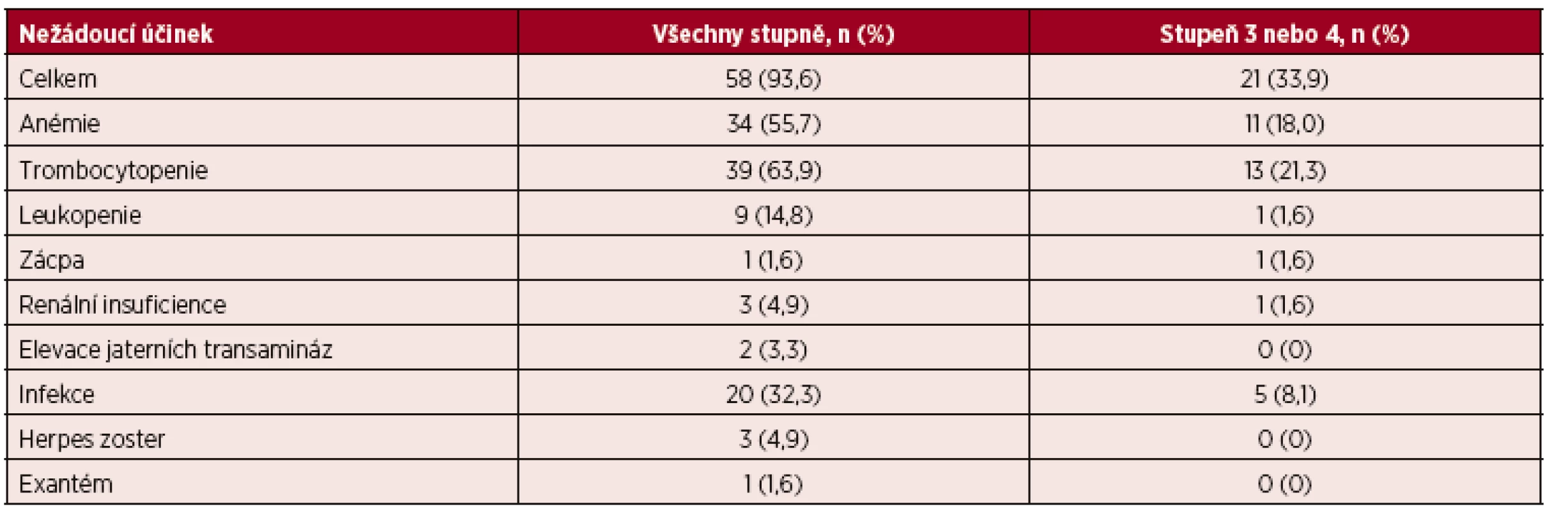
U většiny pacientů (58; 93,6 %) byl zaznamenán jakýkoliv nežádoucí účinek RUXO, většinou však pouze nízkého stupně 1 nebo 2 (tab. 3). Toxicita stupně 3 nebo 4 provázela léčbu RUXO pouze u 21 pacientů (33,9 %). Nová anémie nebo zhoršení stupně anémie o ≥ 1 stupeň bylo pozorováno u 34 pacientů (55,7 %). Anémie stupně 3–4 byla pozorována u 11 (18,0 %) pacientů s mediánem výskytu v 8. týdnu (min – 4; max – 16) od zahájení léčby RUXO. Trombocytopenie stupně 3–4 byla zaznamenána v mediánu 4 týdnů (min – 4; max – 28) od zahájení léčby RUXO u 13 (21,3 %) pacientů. Leukopenie provázela léčbu u 9 pacientů (14,8 %), přičemž pouze u 1 pacienta byla stupně 3–4. Vývoj mediánů hladiny hemoglobinu, počtu trombocytů a leukocytů od zahájení léčby RUXO ukazují grafy 3–5. K nejnižšímu poklesu hladiny hemoglobinu došlo mezi 8.–12. týdnem léčby. Medián počtu leukocytů v čase klesal od vstupní leukocytózy k normálním hodnotám. Z nehematologických vedlejších účinků se nejčastěji vyskytovaly infekční komplikace u 20 pacientů (32,3 %) většinou nízkého stupně 1–2. K rozvoji infekce způsobené Herpes zoster došlo u 3 pacientů (4,9 %) během léčby RUXO.



2 Pravá polycytemie
2. 1 Charakteristika souboru
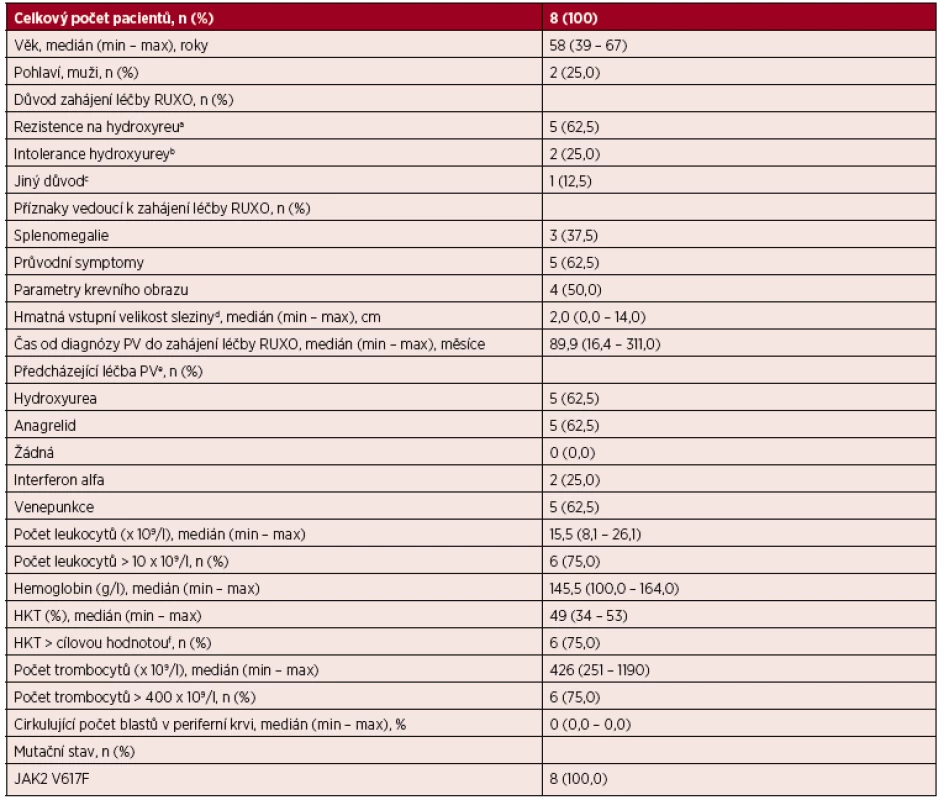
Celkem bylo hodnoceno osm JAK2 V617F pozitivních pacientů s pravou polycytemií léčených RUXO. Kompletní charakteristika souboru je uvedena v tabulce 4.Medián věku pacientů v době zahájení léčby RUXO byl 58 let (min – 39; max – 67). Medián času od stanovení diagnózy PV do zahájení léčby RUXO byl 89,9 měsíců (min – 16,4; max – 311,0). U většiny pacientů (5; 62,5 %)byla léčba RUXO zahájena z důvodu rezistence PV k předchozí léčbě (100 % na hydroxyureu; 80,0 % z nich současně rezistentních také k interferonu alfa a 20,0 % současně netolerujících interferon alfa). Dva (25,0 %) pacienti měli léčbu RUXO pro intoleranci hydroxyurey (1 pacient s extrémní trombocytemií netoleroval ani léčbu interferonem alfa a anagrelidem a 1 pacient byl současně rezistentní k interferonu alfa). V jednom (12,5 %) případě byla indikací k zahájení RUXO v 1. linii rychle narůstající splenomegalie. Hmatné zvětšení sleziny bylo přítomno u 6 pacientů (75,0 %) s mediánem přesahu 5 cm (min – 1; max – 14) přes levý žeberní oblouk v medioklavikulární čáře. U všech pacientů provázel onemocnění před zahájením RUXO nejméně 1 přidružený symptom (100 % únava; 75 % pocení; 62,5 % svědění; 37,5 % nechutenství; 37,5 % kostní bolesti; 37,5 % břišní diskomfort; 12,5 % horečka; 12,5 % hmotnostní úbytek). Většina pacientů (6; 75,0 %) měla vstupní HKT nad cílovou hodnotou (muži > 0,45; ženy > 0,42). Stejný podíl pacientů (6; 75,0 %) měl vstupní hodnotu trombocytů ≥ 400 . 109/l. U poloviny nemocných byla léčba RUXO zahájena v dávce 10 mg 2krát denně. Medián úvodní denní dávky byl 20 mg (min – 10; max – 40). Medián délky léčby RUXO v souboru byl 32,5 týdnů (min – 12; max – 60). V průběhu léčby byla dávka RUXO redukována u 2 (25,0 %) případů z důvodu hematologické toxicity v prvním případě a nadměrného hmotnostního přírůstku v druhém případě. Léčba nebyla přerušena u žádného pacienta.
2. 2 Efektivita léčby
U všech 6 pacientů se vstupní splenomegalií došlo k maximálnímu palpačnímu zmenšení délky sleziny měřené v levé medioklavikulární čáře průměrně o 94,5 % původní velikosti (min – 87,5 %; max – 100,0 %) v mediánu 28 týdnů od zahájení léčby RUXO. U všech 8 pacientů došlo k vymizení přidružené symptomatologie v mediánu 4 týdnů (min – 4; max – 16) léčby RUXO. Většina pacientů dosáhla normalizace počtu leukocytů, HKT respektive trombocytů (4 z 6 pacientů – 66,7 %; 5 z 6 pacientů – 83,3 %, respektive 4 z 6 pacientů – 66,7 %). U 2 pacientů (25,0 %) bylo dosaženo zároveň normalizace parametrů krevního obrazu, nehmatné sleziny a vymizení přidružených symptomů. Ostatních 6 pacientů (75,0 %) dosáhlo parciální odpovědi na léčbu RUXO.
2. 3 Sledování
Medián délky sledování pacientů v souboru byl 32,5 týdnů (min – 12; max – 60). Všichni pacienti doposud přežívají a všichni jsou doposud léčeni RUXO.
2. 4 Bezpečnost
U jednoho pacienta (12,5 %) se rozvinula trombocytopenie stupně 1 ve 12.–16. týdnu léčby. Anémie stupně 1–2 byla zaznamenána ve 3 případech (37,5 %) v 8.–40. týdnu léčby. V jednom případě (12,5 %) komplikovala léčbu RUXO respirační infekce stupně 2 a u jednoho pacienta došlo během léčby k nadměrnému hmotnostnímu přírůstku. U žádného pacienta se nevyskytla toxicita stupně 3–4. Léčbu RUXO nebylo nutné u žádného pacienta přerušit.
DISKUSE
1. Myelofibróza
Primární analýzy randomizovaných studií COMFORT-I a COMFORT-II prokázaly u pacientů s MF ve středním-2 nebo vysokém riziku podle DIPSS rychlý a trvající účinek RUXO na zmenšení objemu sleziny, zmírnění průvodních symptomů onemocnění a zlepšení kvality života [7, 8]. Pětileté analýzy studií následně ukázaly schopnost RUXO dlouhodobého udržení dosažené odpovědi na léčbu a zvýhodnění pacientů v celkovém přežívání ve srovnání s placebem nebo nejlepší dostupnou léčbou [12, 13].
Naše výsledky potvrzují účinek RUXO na promptní a trvající zmenšení sleziny u většiny léčených pacientů s MF. Většina pacientů (72,9 %) dosáhla zmenšení sleziny nejméně o třetinu původní velikosti v mediánu 4 týdnů od zahájení léčby RUXO s mediánem délky trvání efektu minimálně 20 týdnů. Téměř všichni pacienti dosáhli jakéhokoliv zmenšení sleziny. Průměrné zmenšení sleziny dosažené ve 24. týdnu je v našem souboru srovnatelné s výsledky ve studiích COMFORT-I a COMFORT-II (zmenšení o 41,5 % oproti 31,6 % a 29,2 %) [7, 8]. Srovnatelné výsledky týkající se průměrného procentuálního zmenšení sleziny byly dosaženy také ve 48. týdnu v naší studii v porovnání se studií COMFORT-II (zmenšení o 26,8 % oproti 30,1 %)[8]. Při srovnání je však potřeba brát na zřetel fakt, že v našem souboru byla hodnocena velikost sleziny pomocí jejího hmatatelného přesahu přes levý žeberní oblouk a ve studiích byl porovnáván objem sleziny měřený pomocí magnetické rezonance nebo počítačové tomografie. Ve studii COMFORT-II byla délka sleziny měřena i pohmatem, přičemž ve 48. týdnu se nemocným léčeným RUXO zmenšila průměrná délka sleziny proti vstupní hodnotě o 56 %. V naší studii bylo ve 48. týdnu průměrné zmenšení délky sleziny o 44,7 %, tedy výsledky jsou opět srovnatelné. Maximální průměrné zmenšení délky sleziny měřené kdykoliv v průběhu léčby RUXO bylo v našem souboru o 49,2 %. Průvodní symptomy vymizely u většiny pacientů rychle po zahájení léčby RUXO. Jedním z možných faktorů majících vliv na progresi MF během léčby RUXO u celkem 10 pacientů v našem souboru může být buď nízká (10 až 20 mg) iniciální denní dávka RUXO (4; 40,0 % pacientů) nebo pozdější redukce denní dávky na 10–20 mg z důvodu toxicity (2; 20,0 % pacientů). Pouze u 1 pacienta v souboru byla léčba na tři týdny přerušena, avšak tato událost neměla vliv na ukončení RUXO pro neúčinnost. Podobné závěry přináší práce sledující vliv dávky RUXO na dosažení efektu zmenšení splenomegalie u pacientů s pokročilou MF [14], kde denní dávka 2krát 5 mg měla nižší efekt na redukci objemu sleziny než dávky vyšší, 2krát 10 mg, 2krát 15 mg a 2krát 20 mg, s mírně vzrůstajícím efektem s rostoucí dávkou (medián zmenšení sleziny o 10,4 % vs. 30,8 % vs. 35,9 % vs. 38,4 %). Vliv stupně pokročilosti onemocnění podle DIPSS na léčebnou odpověď jsme v našem souboru nepotvrdili. Podíl pacientů s ukončenou léčbou pro progresi MF byl srovnatelný ve skupině s pokročilou (středním-2 a vysokým rizikem) a nepokročilou (nízkým a středním-1 rizikem) chorobou (15,6 % a 17,7 %; p = 1,000). Podobně ani věk pacientů při zahájení léčby RUXO, ani vstupní velikost sleziny nebyly prokázány jako signifikantní rizikové faktory ovlivňující léčebnou odpověď (věk: p = 0,576; slezina: p = 0,503).
Některé studie ukazují účinky dlouhodobého užívání RUXO na snížení alelické zátěže JAK2 a stabilizaci či zmírnění fibrózy kostní dřeně [15, 16]. Kvasnicka et al. prokázali u pacientů léčených RUXO ve fázi 1/2 studie COMFORT-II stabilizaci či zmírnění stupně fibrózy kostní dřeně ve srovnání s pacienty v historické kontrole léčenými běžně dostupnou léčbou, u kterých došlo v čase ke zhoršení stupně fibrózy [17]. Data potvrzují povšechné účinky včasné a dlouhodobé léčby RUXO u pacientů s MF. Nicméně změna stupně fibrózy kostní dřeně či alelické zátěže JAK2 nemají na rozdíl od změny velikosti sleziny či stupně symptomů doposud jasně prokázaný vliv na prognózu onemocnění [18]. Velikost sleziny a stupeň symptomatologie představují tedy i nadále nejlepší faktory pro hodnocení léčebného účinku RUXO v klinické praxi. V našem souboru jsme v rámci sledování nehodnotili ani míru alelické zátěže JAK2, ani stupeň fibrózy kostní dřeně.
Výsledky mnoha studií potvrzují léčebný efekt a bezpečnost RUXO také u pacientů s MF ve středním-1 riziku podle DIPSS [19–21]. Včasné zahájení léčby může nejen zlepšit celkový klinický stav pacienta, ale také maximalizovat chorobu modifikující potenciál dlouhodobé terapie. Za tímto účelem byla navržena dvojitě zaslepená, placebem kontrolovaná, studie fáze 3 ke zhodnocení účinků léčby RUXO na prodloužení doby do progrese onemocnění u asymptomatických pacientů v časném stadiu MF, kteří nesou nejméně 1 vysoce rizikovou mutaci [22]. V našem souboru jsme léčili celkem 17 (27,4 %) pacientů s MF ve středním-1 a nízkém riziku, přičemž průměrné zmenšení délky sleziny dosažené ve 24. týdnu léčby bylo identické s hodnotou dosaženou u pacientů ve středním-2 a vysokém riziku (41,8 % vs. 42,0 %). Průměrná délka léčby RUXO u 3 pacientů, kteří ukončili léčbu pro progresi MPN, v nízkém a středním-1 oproti 7 pacientům ve středním-2 a vysokém riziku byla delší (69,3 vs. 36,0 týdnů). Výsledek však může být ovlivněn malým počtem pacientů ve srovnávaných skupinách.
Naše analýza prokázala bezpečnost a dobrou snášenlivost léčby RUXO u pacientů s pokročilou MF. Nejčastějším nežádoucím účinkem RUXO byla hematologická toxicita daná vlastním mechanismem účinku léku, JAK2 inhibicí. Trombocytopenie a anémie byly většinou nízkého stupně a pouze u 5 pacientů (8,1 %) s MF vedly k ukončení léčby RUXO. Trombocytopenie se nejčastěji objevila v prvním měsíci léčby a u většiny pacientů byla velmi dobře korigovatelná úpravou dávkování RUXO. Anémie byla řešena substitucí erytrocytárních transfuzních přípravků a/nebo úpravou dávky RUXO s největším poklesem hemoglobinu mezi 8. a 12. týdnem léčby a následnou částečnou úpravou a stabilizací hodnot hemoglobinu. Medián hladiny hemoglobinu byl v době zahájení léčby RUXO; 8.–12. týden a 16.–52. týden léčby: 114,0; 95,4 a 103,6 g/l. Naše výsledky týkající se hematologické toxicity RUXO odpovídají datům publikovaným ve studiích COMFORT. Jediným rozdílem bylo vyšší procento pacientů s rozvojem trombocytopenie stupně 3–4 v našem souboru oproti studiím COMFORT-I a COMFORT-II (21,3 % vs. 8,2 % a 12,9 %). Tuto skutečnost můžeme vysvětlit zastoupením pacientů se vstupním počtem trombocytů pod 100 . 109/l v našem souboru oproti studiím, kde tito pacienti zařazováni nebyli. Výsledky nedávné analýzy Polverelliho et al. ukázaly, že samotná léčba RUXO nemusí zvyšovat riziko infekce u pacientů s MF a pacienti odpovídající na léčbu zmenšením sleziny mohou mít nižší pravděpodobnost rozvoje infekce [23]. V našem souboru jsme pozorovali výskyt závažných infekčních komplikací pouze u 8,1 % případů. V porovnání s výsledky studie COMFORT-II jsme potvrdili mírně nižší výskyt infekce virem Herpes zoster u pacientů léčených RUXO (11,5 % vs. 4,9 %).
Většina pacientů ve studiích COMFORT-I a II již ukončila léčbu RUXO (72,3 % a 73,3 %) v mediánu sledování 5,1 a 4,3 let [12, 13]. Nejčastějšími důvody pro ukončení léčby byly vedlejší nežádoucí účinek léčby a progrese myelofibrózy (30,3 %, respektive 24,0 % a 14,8 %,respektive 21,9 %). V našem souboru ukončilo léčbu RUXO celkem 40,3 % pacientů v mediánu sledování 0,8 let. Nejčastěji byla léčba ukončena v průběhu prvního roku léčby (18 pacientů z 25 pacientů s ukončenou léčbou; 72,0 %) stejně jako ve studiích pro vedlejší nežádoucí účinky a progresi nemoci (40,3 % a 40,0 %).
2. Pravá polycytemie
Všichni pacienti s PV léčení RUXO v našem souboru dosáhli léčebné odpovědi týkající se zmenšení splenomegalie a vymizení průvodních symptomů. U většiny pacientů došlo k normalizaci hodnot parametrů krevního obrazu. Výsledky naší analýzy je však nutno hodnotit s ohledem na malý počet zařazených pacientů.
Recentní doporučení pro léčbu PV zmiňují fakt, že ve studii RESPONSE byl sice primární cíl (hodnota hematokritu a zmenšení splenomegalie) dosažen signifikantně významně častěji u pacientů s PV léčených RUXO oproti pacientům léčeným nejlepší dostupnou léčbou, avšak celkem pouze u 21 % pacientů v rameni s RUXO [9, 24]. Ve studii zároveň nebyly primárně sledovány důležité klinické cíle jako přežití bez trombózy, leukemie či fibrózy, a nebyla tedy prokázána žádná aktivita RUXO, která by modifikovala průběh onemocnění. Navíc studie Alvareze-Larrána neprokázala souvislost mezi dosažením kompletní anebo parciální remise a celkovým přežitím anebo přežitím bez trombózy, a tedy rezistence na hydroxyureu u pacientů s PV může představovat více agresivní vlastní biologickou podstatu onemocnění s kratším přežíváním bez leukemie a celkovým přežíváním [25]. Tito pacienti by tedy jinými slovy měli být léčeni léky s jasně prokázaným potenciálem modifikujícím průběh choroby.
ZÁVĚR
Naše analýza potvrdila velmi dobrý a rychlý efekt léčby RUXO u pacientů s MF a PV týkající se zmenšení splenomegalie a zmírnění či vymizení doprovodných symptomů. U velké většiny pacientů s PV vedl RUXO navíc k úpravě parametrů krevního obrazu. RUXO byl pacienty velmi dobře tolerován. Bezpečnostní profil RUXO v našem souboru odpovídá výsledkům randomizovaných studií. Včasné zahájení léčby může u pacientů s MF nejen zlepšit celkový klinický stav, ale také maximalizovat chorobu modifikující potenciál dlouhodobé terapie.
Poděkování
Práce byla podpořena Českou leukemickou skupinou – pro život, grantem MUNI/A/1106/2016 a grantem MZ ČR – RVO (FNBr 65269705).
Podíl autorů na přípravě rukopisu
BW – napsání rukopisu
BW, PČ, ZR, JM – příprava analýzy
BW, PČ, MP, AH, EF, LS, PB, JK, OČ, MS, JO, DN, LW, HF, EB, JP, MB, LL, MP, MD, YB, LČ, PŽ, JM, ZR – léčba nemocných, revize rukopisu
Prohlášení autorů o konfliktu zájmů
BW, PB – Novartis, řečník, cestovní granty
MPe – Novartis, řečník, výzkumné granty
LČ, AH – Novartis, konzultant a řečník
MD, MPa – Novartis, řečník
JM – Novartis, výzkumné granty a cestovní granty
ZR – Novartis, konzultant a řečník, výzkumné a cestovní granty
PČ, LS, JK, LW, HF, OČ, LL, MB, JP, MS, JO, DN, EB, EF, YB, PŽ – autoři prohlašují, že nemají žádný relevantní konflikt zájmů
Doručeno do redakce dne 11. 1. 2017.
Přijato po recenzi dne 17. 2. 2017.
MUDr. Barbora Weinbergerová
Interní hematologická a onkologická klinika LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: weinbergerova.barbora@fnbrno.cz
Zdroje
1. Abdel-Wahab O, Levine RL. Primary myelofibrosis: update on definition, pathogenesis, and treatment. Annu Rev Med 2009; 60 : 233–245.
2. James C, Ugo V, Le Couedic JP, et al. A unique clonal JAK2 mutation leading to constitutive signalling causes polycythaemia vera. Nature 2005; 434(7037): 1144–1148.
3. Kralovics R, Passamonti F, Buser AS, et al. A gain-of-function mutation of JAK2 in myeloproliferative disorders. N Engl J Med 2005; 352(17): 1779–1790.
4. Mesa RA, Schwager S, Radia D, et al. The myelofibrosis symptom assessment form (MFSAF): an evidence-based brief inventory to mea-sure quality of life and symptomatic response to treatment in myelofibrosis. Leuk Res 2009; 33 : 1199–1203.
5. Cervantes F, Dupriez B, Pereira A, et al. New prognostic scoring system for primary myelofibrosis based on a study of the International working group for myelofibrosis research and treatment. Blood 2009; 113 : 2895–2901.
6. Passamonti F, Cervantes F, Vannucchi AM, et al. A dynamic prognostic model to predict survival in primary myelofibrosis: a study by the IWG-MRT (International Working Group for Myeloproliferative Neoplasms Research and Treatment). Blood 2010; 115 : 1703–1708.
7. Verstovsek S, Mesa RA, Gotlib J, et al. A double-blind, placebo-controlled trial of ruxolitinib for myelofibrosis. N Engl J Med 2012; 366 : 799–807.
8. Harrison C, Kiladjian JJ, Al-Ali HK, et al. JAK inhibition with ruxolitinib versus best available therapy for myelofibrosis. N Engl J Med 2012; 366 : 787–798.
9. Vannucchi AM, Kiladjian JJ, Griesshammer M, et al. Ruxolitinib versus standard therapy for the treatment of polycythemia vera. N Engl J Med 2015; 372(5): 426–435.
10. Tefferi A, Thiele J, Orazi A, et al. Proposals and rationale for revision of the World Health Organization diagnostic criteria for polycythemia vera, essential thrombocythemia, and primary myelofibrosis: recommendations from an ad hoc international expert panel. Blood 2007; 110 : 1092–1097.
11. Evs.nci.nih.gov [internetová stránka]. Department of Health and Human Services, National Institutes of Health, National Cancer Institute: Common terminology criteria for adverse events v4.03. [aktualizováno 14. června 2010; citováno 12. prosince 2016]. Dostupné z: http://evs.nci.nih.gov/ftp1/CTCAE/CTCAE_4.03_2010-06-14_QuickReference_5x7.pdf.
12. Verstovsek S, Mesa RA, Gotlib JR, et al. Long-term outcomes of ruxolitinib (RUX) therapy in patients (PTS) with myelofibrosis (MF): 5-year final efficacy and safety analysis from COMFORT-I. Abstract S452. Haematologica 2016; 101(S1): 162.
13. Harrison CN, Vannucchi AM, Kiladjian JJ, et al. Long-term findings from COMFORT-II, a phase 3 study of ruxolitinib vs best available therapy for myelofibrosis. Leukemia 2016; 30(8): 1701–1707.
14. Verstovsek S, Gotlib J, Gupta V, et al. Management of cytopenias in patients with myelofibrosis treated with ruxolitinib and effect of dose modifications on efficacy outcomes. Onco Targets Ther 2013; 7 : 13–21.
15. Deininger M, Radich J, Burn TC, et al. The effect of long-term ruxolitinib treatment on JAK2 V617F allele burden in patients with myelofibrosis. Blood 2015; 126 : 1551-1554.
16. Wilkins BS, Radia D, Woodley C, et al. Resolution of bone marrow fibrosis in a patient receiving JAK1/JAK2 inhibitor treatment with ruxolitinib. Haematologica 2013; 98 : 1872–1876.
17. Kvasnicka HM, Thiele J, Bueso-Ramos CE, et al. Changes in bone marrow morphology in patients with myelofibrosis treated for up to 5 years with either ruxolitinib or best available therapy. Abstract P405. Haematologica 2014; 99(S1): 127.
18. Vannucchi AM, Kantarjian HM, Kiladjian JJ, et al. A pooled analysis of overall survival in COMFORT-I and COMFORT-II, 2 randomized phase 3 trials of ruxolitinib for the treatment of myelofibrosis. Haematologica 2015; 100 : 1139–1145.
19. Giraldo P, Palandri F, Palumbo GA, et al Safety and efficacy of ruxolitinib (RUX) in patients with intermediate-1–risk myelofibrosis (MF) from an open-label, multicenter, single-arm expanded-access study. Abstract P675. Haematologica 2015; 100 : 265.
20. Mead AJ, Milojkovic D, Knapper S, et al. Response to ruxolitinib in patients with intermediate-1-, intermediate-2-, and high-risk myelofibrosis: results of the UK ROBUST Trial. Br J Haematol 2015; 170 : 29–39.
21. Davis KL, Cote I, Kaye JA, et al. Real-world assessment of clinical outcomes in patients with lower-risk myelofibrosis receiving treatment with ruxolitinib. Adv Hematol 2015; 2015 : 848473.
22. Passamonti F, Kiladjian J-J, Vannucchi AM, et al. ReTHINK: a randomized, double-blind, placebo-controlled, multicenter, phase 3 study of ruxolitinib in early myelofibrosis patients with high molecular risk mutations. Abstract TPS7080. J Clin Oncol 2016; 34(S).
23. Polverelli N, Breccia M, Benevolo G, et al. Risk factors for infections in myelofibrosis: role of disease status and treatment. A study on 507 patients. Abstract. Blood 2015; 126 : 1606.
24. Tefferi A, Barbui T. Polycythemia vera and essential thrombocythemia: 2017 update on diagnosis, risk-stratification and management. Am J Hematol 2017; 92 : 95–108.
25. Alvarez-Larran A, Pereira A, Cervantes F, et al. Assessment and prognostic value of the European LeukemiaNet criteria for clinicohematologic response, resistance, and intolerance to hydroxyurea in polycythemia vera. Blood 2012;119 : 1363–1369.
Štítky
Hematológia Interné lekárstvo OnkológiaČlánok vyšiel v časopise
Transfuze a hematologie dnes

2017 Číslo 1
- Nejasný stín na plicích – kazuistika
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- Myasthenia gravis: kombinace chirurgie a farmakoterapie jako nejefektivnější modalita?
- Jak přistupovat k akutnímu kloubnímu krvácení u pacientů s hemofilií
- Efekt prozóny v diagnostice lupus antikoagulans při krvácení v důsledku hypoprotrombinémie
Najčítanejšie v tomto čísle
- Autoimunitní hemolytická anémie – diagnostika a léčba, včetně transfuze erytrocytů
- Moderní léčba akutní myeloidní leukemie
- Zkušenosti s léčbou ruxolitinibem u pacientů s myelofibrózou a pravou polycytemií na českých hematologických pracovištích
- Prevence a léčba venózního tromboembolismu u nemocných s nádorovým onemocněním
