-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Prevence a léčba venózního tromboembolismu u nemocných s nádorovým onemocněním
Prevention and therapy of venous thromboembolism in cancer patients
Symptomatic venous thromboembolism occurs 4–7 times more frequently in cancer patients as compared to non-cancer patients. This is due to many factors related to the tumour itself, the patient or the treatment. Therefore appropriate and efficient thromboprophylaxis of venous thromboembolism is very important, as it results in a decrease in morbidity and mortality rates. However, thromboprophylaxis is still underused or rather not used appropriately. Thromboprophylaxis is recommended in cancer patients undergoing surgery, those hospitalised for an acute medical condition or those who are immobile. Benefit of thromboprophylaxis remains controversial in outpatients and may be limited those patients with locally advanced or metastatic pancreatic or lung cancer treated with chemotherapy. LMWHs remain the treatment of choice for the prevention and therapy of venous thromboembolism in cancer patients.
KEY WORDS:
venous thromboembolism – cancer – prevention – therapy – survival – LMWH
Autoři: P. Ďulíček
Působiště autorů: IV. interní hematologická klinika FN a LF Hradec Králové
Vyšlo v časopise: Transfuze Hematol. dnes,23, 2017, No. 1, p. 6-14.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Symptomatický venózní tromboembolismus se vyskytuje u nemocných s nádorem 4–7krát častěji. Je to dáno množstvím rizikových faktorů, které souvisí s nádorem, pacientem nebo léčbou. Správná profylaxe venózního tromboembolismu je proto velmi důležitá, vede ke snížení morbidity i mortality nemocných a v praxi je stále podceňována, respektive nepodávána správně. Je jasné, že benefit z farmakologické profylaxe mají nemocní s nádorem podstupující chirurgický výkon, hospitalizování pro akutní onemocnění, imobilizování. Otázkou zůstává, jak je to u ambulantních nemocných. Zatím se zdá, že nejméně někteří pacienti budou mít v této situaci z farmakologické profylaxe venózního tromboembolismu profit, např. jedinci s pokročilým nádorem pankreatu (lokálně nebo s metastázemi) a nemocní s karcinomem plic léčení chemoterapií. V prevenci a léčbě venózního tromboembolismu u nemocných s nádorem jsou stále na prvním místě LMWH.
KLÍČOVÁ SLOVA:
venózní tromboembolismus – nádor – prevence – léčba – přežití – LMWHÚVOD
Venózní tromboembolismus (VTE) je stále závažným medicínským a sociálně ekonomickým problémem. Přes stále rostoucí počet znalostí o etiologii VTE zůstává incidence v populaci stejná – 1/1000 a závisí na věku. Ve věkové kategorii do 45 let je o řád nižší, a to 1/10 000 [1].
Venózní tromboembolismus je častou a závažnou komplikací u nemocných s nádorovým onemocněním [2]. Na vzniku se podílí mnoho faktorů, jedná se o dynamickou interakci vrozených a získaných rizikových faktorů pro trombózu [3]. Nejčastějšími projevy jsou hluboká žilní trombóza (DVT), plicní embolie (PE), trombóza v neobvyklé lokalizaci nebo trombóza centrálního žilního katétru (CVT). VTE je na druhém místě v příčině úmrtí nemocných s nádorem. Je to dáno nejen vlastní VTE a rekurencí, ale také krvácením [4]. Na základě velkých registrů se kumulativní incidence VTE udává od 1 % do 8 %, podle typu nádoru a jeho pokročilosti, podle délky sledování, metody diagnostiky VTE a také vyšší frekvencí VTE u nemocných na chemoterapii [2]. Většina studií hodnotí symptomatickou VTE, ale ty, které zahrnují i pitevní nález nediagnostikované DVT a PE, prokazují VTE až u 50 % nemocných s nádorem [5]. Počet asymptomatických PE diagnostikovaných v rámci rutinního vyšetření u nemocných s nádorem je kolem 2–3 %. S počtem provedených CT při kontrole léčby či určení stadia onemocnění přibývá prokázaných asymptomatických PE. Počet prokázaných VTE u maligních onemocnění tudíž stoupá [2]. Bylo již identifikováno mnoho faktorů, které ovlivňují riziko VTE u nemocných s nádorem [6, 7].
Vzrůstající počet VTE je multifaktoriální:
- a) větším používáním účinné chemoterapie, která má pro protrombogenní účinek;
- b) vyšším počtem CVT a delší dobou zavedení (léčba, podpůrná terapie);
- c) vyšším věkem nemocných s nádorem, a tudíž větším počtem rizikových faktorů VTE, patřící k věku a ne k nádoru [8].
ETIOPATOFYZIOLOGIE
Na vzniku trombózy se podílí celá řada mechanismů, většinou více najednou. Mezi známé faktory patří látka označováná CP (Cancer Procoagulant), která aktivuje F X. Dále se na aktivaci hemostázy podílí tkáňový faktor (tumor associated tissue factor activity), u některých jedinců dochází díky vzestupu F VIII a poklesu proteinu S k získané rezistenci na aktivovaný protein C. Také u řady nádorů prokážeme protilátku typu LA (lupus antikoagulans).
Riziko VTE závisí na typu nádoru, lze je dělit podle míry rizika do skupin, ale vzhledem k histologicky různým subtypům je to spíše arbitrární. Rizikové faktory můžeme dělit na [9, 10]:
- Rizikové faktory pacienta
- vyšší věk (zejména > 65 let),
- pohlaví (ženy),
- rasa (Afroameričané > Asiaté),
- obezita,
- komorbidity (onemocnění ledvin, plic, neutropenie, infekce),
- předchozí anamnéza VTE,
- vrozený trombofilní stav (FV Leiden, mutace F II20210a),
- nízký performance status,
- imobilizace,
- gravidita.
- Faktory odvozené od nádoru
- typ nádoru, lokalizace (zejména karcinom pankreatu, gastrointestinálního traktu (GIT), mozku, plic, gynekologické tumory, renální, hematologické malignity);
- subtyp nádoru – podle histologie (adenokarcinom > karcinom ze skvamózních buněk);
- první 3–6 měsíců od diagnózy;
- přítomnost metastáz.
- Faktory související s léčbou
- recentní velká operace,
- současná hospitalizace,
- centrální žilní katétr,
- aktivní chemoterapie,
- aktivní hormonální terapie (současně nebo v minulosti aplikovaná antiangiogenní terapie, thalidomide, lenalidomide, bevacizumab),
- transfuze krve či podání trombocytárních koncentrátů.
Na závěr několik dat ohledně maligních onemocnění a VTE
- Maligní onemocnění jsou častou příčinou VTE (příčina 15–20 % nově diagnostikovaných VTE).
- Aktivní malignita zvyšuje 4–7krát riziko VTE (podle typu).
- Nemocní s nádorem + VTE mají horší přežívání během prvního roku (než nemocní s nádorem bez VTE, což je dáno nejen VTE, ale i agresivnější formou malignity).
- Přítomnost tumoru je nezávislým rizikovým faktorem pro úmrtí během prvních 7 dnů od vzniku VTE (8krát větší při chemoterapii).
- 10 % idiopatických VTE je prvním projevem okultní malignity, či dojde k manifestaci nádoru během prvního roku (prs, plíce, prostata, tlusté střevo).
- Větší výskyt migrující tromboflebitidy.
- VTE se nezřídka vyskytuje v hlubokém i povrchovém žilním systému.
- VTE v neobvyklé lokalizaci (renální, portální, horních končetin aj.).
- ↑ procento nárůstu trombu při terapii akutní trombózy (jak při použití nefrakcionovaného heparinu – UFH, tak v menší míře i při LMWH).
- ↑ procento rekurence VTE (2–3krát větší riziko).
- ↑ riziko velkého krvácení (2–6krát vyšší riziko).
- Každá riziková operace pro VTE (3krát vyšší při tumoru).
PROFYLAXE VTE U NEMOCNÝCH S NÁDOREM
V posledních cca 10 letech se objevilo mnoho národních a mezinárodních doporučených postupů – guidelines [11] (italských [12], francouzských [13, 14], britských [15, 16], a ze severní Ameriky [17–19]. Ve snaze sladit tyto postupy, mezinárodní multidisciplinární pracovní skupina vydala v roce 2013 postupy vycházející z dat založených na důkazech („evidence based“) a jejich stupně doporučení [21, 22].
Tab. 1. Prediktivní model pro VTE u nemocných s nádorem 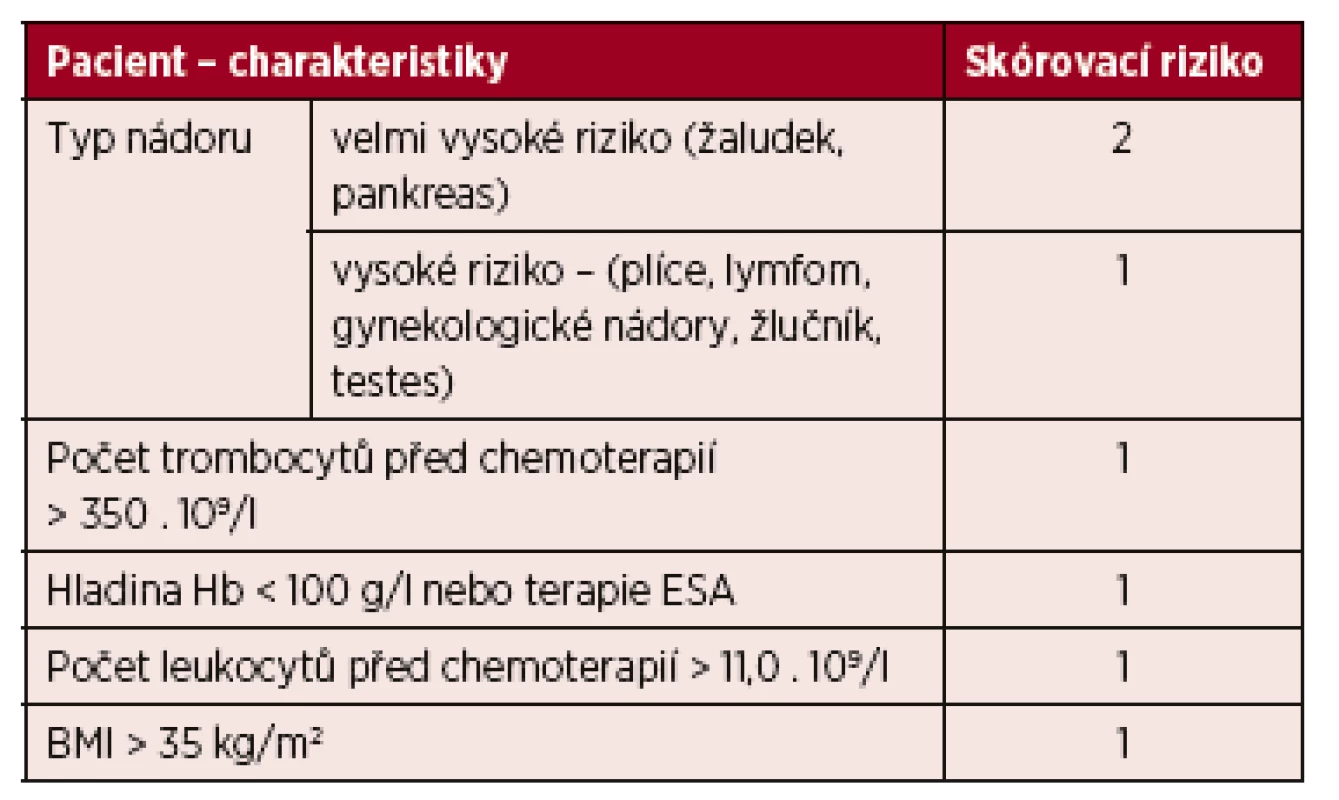
Poznámky: nízké riziko (skóre 0), střední riziko (skóre 1–2), a vysoké riziko (skóre 3) Skóre ≥3 znamená vysoké riziko (7% riziko VTE) u ambulantních nemocných s nádorem. Vysvětlivky: BMI – body mass index; ESA – erytropoezu stimulující agens; Hb – hemoglobin; VTE – venózní tromboembolismus. Riziko VTE se mění během průběhu onemocnění a mělo by být pravidelně přehodnocováno.
Dnes je proto snahou vytvořit modely predikující riziko VTE. Existuje celá řada modelů. Nejčastěji používaný je tzv. Khorana model (the Khorana risk score), založený na sběru těchto informací: typ nádoru, BMI > 35 a parametrů krevního obrazu (trombocyty >350 . 109/l, leukocyty >11,0 . 109/l, hemoglobin (Hb) <100 g/l), každý parametr má hodnotu l nebo 2 bodů [9].
Tento model byl poprvé zhodnocen v prospektivním souboru 2 701 ambulantních nemocných na chemoterapii pro nádorové onemocnění a dále byl validizován nezávislou, prospektivně hodnocenou skupinou 1 365 nemocných [9]. Skórování bylo prospektivně a nezávisle hodnoceno u 819 pacientů s různými malignitami v prospektivní skupině Vienna Cancer and Thrombosis Study (CATS) [10].
Prediktivní výpovědní hodnota byla zásadně zvýšená přidaná 2 biomarkerů, sP-selectin a D-dimerů: nemocní se skórem ≥ 5 podle tohoto rozšířeného modelu měli pravděpodobnost vzniku VTE během 6 měsíců (35 %) [10] ve srovnání s nejvyšším skórem podle Khorana model (6,7 %) [9]. Model ale nebyl validizován u ambulantních nemocných.
Dále bude profylaxe rozdělena podle situace, ve které se pacient může v rámci své terapie ocitnout.
1. Profylaxe VTE u chirurgických nemocných s nádorem
Indikace k profylaxi je vcelku jednoznačná. Pacienti s nádorem postupující operaci mají 2krát větší riziko VTE [23], a až 2–3krát větší riziko fatální plicní embolie [24] ve srovnání s nemocnými bez nádoru. Již dříve provedené metaanalýzy hodnotící benefit profylaxe LMWH či UFH ve srovnání s placebem jasně prokázaly benefit této profylaxe jak u nemocných s nádorem [25], tak bez nádoru, tam kde byla hodnocena podskupina s nádorem [26]. Riziko je variabilní a závisí na délce trvání výkonu a typu nádoru [27].
Otázky spojené s profylaxí
- Čím?
LMWH i UFH jednoznačně prokázaly benefit stran snížení výskytu postoperační VTE, se snížením výskytu trombózy v rozmezí 42–75 % [25, 26].
Metaanalýza 16 randomizovaných klinických studií (RCTs), která porovnávala účinnost a bezpečnost LMWH ve srovnání s UFH [28] prokázala, že UFH 3krát denně je stejně efektivní jako LMWH 1krát denně, ale LMWH je účinnější než podávání UFH 2krát denně [28]. Navíc je zde trend k nižšímu výskytu krvácení u LMWH.
Není dostatečně dat o výhodě jednoho typu LMWH před druhým, stejně jako o fondaparinuxu jako alternativě k LMWH, protože přímé porovnání léků neprokázalo rozdíl mezi léky.
- Jak dlouho?
Doba profylaxe po operaci je obecně doporučována 7–10 dnů, v některých situacích je indikována i déle. Například ve studii ENOXACAN II [29], prodloužení profylaxe na 4 týdny enoxaparinem 40 mg denně ve srovnání s týdenním podáváním, vedlo k signifikantnímu snížení postoperační trombózy u nemocných s velkou břišní operací pro nádor [29]. Dvě recentní studie analyzovaly benefit prolongované profylaxe po velké břišní či pánevní operaci [30, 31] a prokázaly snížení frekvence výskytu VTE ve srovnání s kontrolním souborem a stejný výskyt krvácení [30, 31]. Tento trend (4 týdny profylaxe) prokázala i studie u nemocných po laparoskopické operaci kolorektálního karcinomu [31]. U prolongované profylaxe je trend k zvýšenému výskytu krvácení.
Na základě těchto dat vydala mezinárodní skupina (International clinical practice guidelines) v roce 2013 několik doporučení ohledně tromboprofylaxe u chirurgicky nemocných s nádorem [22].
Léčebné režimy – schémata v tromboprofylaxi u chirurgických nemocných s nádorem, ověřená v klinických studiích.
Tab. 2. LMWH v profylaxi VTE u chirurgických nemocných 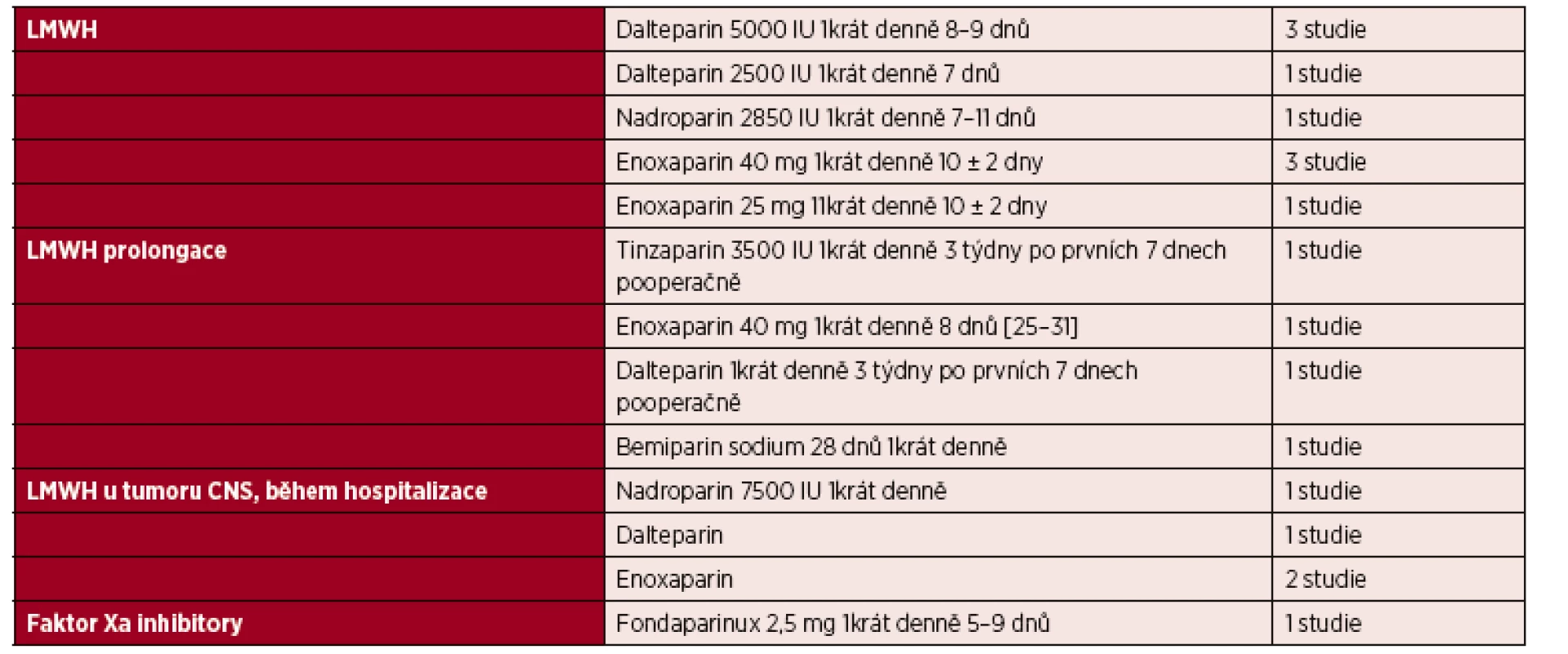
Vysvětlivky: CNS – centrální nervový systém; LMWH – nízce molekulární heparin; VTE – venózní tromboembolismus Nedávno publikovaná recentní studie [32] zahrnující 2 508 916 pacientů, kteří podstoupili velký chirurgický výkon, prokázala, že VTE je nejčastější komplikací s frekvencí výskytu 1,3 % u hospitalizovaných.
Doporučení pro praxi
LMWH 1krát denně
- První dávka by měla být podána 12 nebo 2 hodiny před operací a pokračovat po dobu nejméně 7–10 dnů.
- Nejsou žádná spolehlivá data, která by zvýhodňovala jeden typ LMWH před druhým, ani neexistují žádné důkazy k náhradě LMWH za fondaparinux.
- Výhodné je použít nejvyšší doporučovanou profylaktickou dávku.
- LMWH je indikován u nemocných podstupujících laparoskopickou chirurgii stejně jako laparotomii.
- Prolongovaná profylaxe (4 týdny) po velké břišní operaci by měla být indikována u nemocných s nádorem, kteří jsou ve vysokém riziku VTE a nízkém riziku krvácení, proto je profylaxe doporučována po propuštění z nemocnice.
- Mechanické metody nejsou jako monoterapie doporučovány, pouze v případech, kdy jsou farmakologické metody kontraindikovány.
2. Profylaxe u hospitalizovaných nemocných s nádorem („medical cancer patients“)
Co se týče této problematiky, je podstatně méně dat než u chirurgických nemocných. Vychází se z několika málo prací a z dat o profylaxi u interních nemocných přijatých do nemocnice pro akutní onemocnění nebo u nemocných s omezenou pohyblivostí.
Tři hlavní RCTs (MEDENOX, PREVENT a ARTEMIS) porovnávaly výsledky profylaxe LMWH (enoxaparin 40 mg 1krát denně, dalteparin 5000 IU 1krát denně nebo fondaparinuxem 2,5 mg 1krát denně) s placebem [33–35]. Jen 5–15 % pacientů s malignitou bylo zařazeno v těchto studiích. Farmakologická profylaxe vede k signifikantnímu snížení výskytu VTE ve srovnání s nemocnými bez této profylaxe. Nebyl pozorován rozdíl mezi nemocnými s nádorem a bez nádoru, a to platí i na základě metaanalýzy těchto 3 studií, která se soustředila na podskupinu nemocných s nádorem [36]. Ale je nutno vzít v úvahu značnou heterogenicitu mezi těmito studiemi a také je malý počet nemocných s nádorem (n = 307) z celkového počtu 5 134 [36].
V případě tromboprofylaxe je nutno zvážit pečlivě i rizika pro krvácení – typ nádoru, trombocytopenii po chemoterapii, ostatní komorbidity.
Mezinárodní doporučení (International clinical practice guidelines) [21, 22]
pro hospitalizované interní nemocné s nádorem a sníženou mobilitou
Doporučení pro praxi
- Profylaxe LMWH, UFH nebo fondaparinuxem (hodnota doporučení 1B) je doporučována u všech nemocných s nádorem a sníženou pohyblivostí [22].
3. Ambulantní nemocní na chemoterapii
V poslední době se tato problematika stala centrem zájmu, protože velmi často (až v 74 %) se VTE vyskytla u ambulantních nemocných [37]. Pacienti na chemoterapii či hormonální terapii mají až 7krát větší riziko VTE ve srovnání s nemocnými bez nádoru [38]. Také podpůrná terapie zvyšuje riziko VTE (erytropoetin aj.) [39]. Nicméně benefit tromboprofylaxe v této skupině je stále předmětem diskusí, protože nebyl jednoznačně prokázán. Značně závisí na typu nádoru [40]. Dvě nedávno publikované metaanalýzy ukázaly benefit profylaxe [41, 42]. První (n = 6 809 nemocných) prokázala, že heparin jak UFH, tak LMWH signifikantně snížil počet VTE bez zvýšeného rizika velkého krvácení. Druhá studie prokázala, že aplikace LMWH (n = 1 829) signifikantně snížila incidenci symptomatické VTE ve srovnání s kontrolní skupinou bez profylaxe (n = 1 427) s podobným výskytem velkého krvácení. Benefit byl prokázán u nemocných s nádorem pankreatu a plic, léčených ambulantně. Projevil se jak v celkovém snížení počtu VTE, tak ve snížení absolutního rizika. Studie s nadroparinem „Prophylaxis of Thromboembolism during Chemotherapy Trial“ (PROTECHT) [40] prokázala signifikantní snížení relativního rizika VTE, ale malé snížení absolutního rizika: 2,0 % ve skupině s nadroparinem ve srovnání s 3,9 % ve skupině s placebem.
Doporučení pro praxi
- Profylaxe není rutinně doporučována (1B).
- Primární farmakologická profylaxe by měla být aplikována u nemocných s pokročilým nádorem pankreatu (lokáně nebo s metastázami) a s karcinomem plic léčených chemoterapií a nízkým rizikem krvácení (2B).
- U nemocných léčených thalidomidem nebo lenalidomidem společně s kortikoidem a/nebo chemoterapií je indikována profylaxe VTE, a to buď antagonisty vitaminu K v nízkých až terapeutických dávkách a LMWH v profylaktické dávce, nebo malá dávka aspirinu mající podobný efekt (2C).
Pozn.: klasifikace – silné (stupeň 1) nebo slabé (stupeň 2).
TERAPIE VTE U NEMOCNÝCH S NÁDOREM
Terapie se v zásadě neliší od nemocných bez nádoru, ale má přece jen svá specifika a úskalí. Je snaha o „sjednocení“ terapeutických doporučení, protože jich existuje celá řada včetně různých „guidelines odborných společností, která se liší metodologicky“ [21, 22].
Během léčby může dojít k různé tíži trombocytopenie, některé lokalizace nádoru predisponují k většímu riziku krvácení, nemocní s postižením jater při nádoru mohou mít koagulopatii aj.
Léčba je proto spojena s 2–5krát zvýšeným rizikem rekurence VTE a 2–6krát zvýšeným rizikem velkého krvácení.
Proč léčit?
- Prevence fatální VTE.
- Prevence rekurence.
- Prevence výskytu postrombotického syndromu a plicní hypertenze.
- Frekvence výskytu rekurence a velkého krvácení je zvýšena zejména u jedinců s nádorem ve srovnání s nemocnými bez nádoru.
Terapie se standardně skládá z několika období [21, 22]
- Úvodní léčba (prvních 5–10 dnů) od diagnózy VTE
- Časná udržovací léčba (> 10 dnů až 3 měsíce)
- Dlouhodobá léčba (> 3 měsíce) od diagnózy VTE
Samozřejmě mohou nastat specifické situace, které si vyžadují i individualizaci další léčby.
- Terapie rekurence VTE při dobře nastavené antikoagulační terapii.
- Terapie u prokázané trombózy zavedeného katétru.
- Specifické situace: nádory mozku, neurochirurgie, renální selhání, trombocytopenie, těhotné ženy s nádorem.
Mezinárodní doporučení pro léčbu VTE u nemocných s nádorem [21, 22]
Doporučení pro praxi
1. Úvodní léčba diagnostikované VTE u pacientů s nádorem (Prvních 5–10 dnů antikoagulační terapie)
Doporučení
- LMWH je lékem volby, ačkoliv fondaparinux a UFH lze také použít.
- LMWHs a fondaparinux jsou jednodušší pro použití než UFH.
- Inserce kaválního filtru má být zvážena v případě kontraindikace antikoagulační léčby či v případě rekurence VTE za dobře vedené antikoagulační terapie.
- Trombolýza má být zvážena individuálně, zejména v život ohrožujících situacích s vědomím zvýšeného rizika krvácení.
- Přímá orální antikoagulancia (DOACs) nejsou t. č. lékem volby u nemocných s nádorem – viz dále.
Tab. 3. Srovnání jednotlivých léků [21] ![Srovnání jednotlivých léků [21]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/0b0ed530f2b9f4d42e1690f367da2fdf.png)
Vysvětlivky: LMWH – nízce molekulární heparin; UFH – nefrakcionovaný heparin; VKA – antagonista vitaminu K Dávkování nadroparinu v této fázi: 2krát denně (po 12 h.) po dobu 10 dnů; při tělesné hmotnosti do 50 kg jednotlivá dávka 0,4 ml, 50–59 kg 0,5 ml, 60–69 kg 0,6 ml, 70–79 kg 0,7 ml, 80–89 kg 0,8 ml, 90–99 kg 0,9 ml a nad 100 kg 1 ml.
2. Časná udržovací léčba (Časná udržovací léčba zahrnuje období 10. dne do konce 3. měsíce antikoagulace.)
U nemocných bez nádoru, léčba LMWH a VKA byla po mnoho let standardem, dnes se dostávají do popředí nová antitrombotika. Terapie VKA u nemocných s nádorem zvyšuje riziko rekurence VTE a krvácení ve srovnání s nemocnými bez nádoru. Metaanalýzy prokázaly, že samotná terapie LMWH ve srovnání s terapií heparinem a VKA signifikantně snižuje riziko VTE až o 50 % bez zvýšení rizika krvácení a bez efektu na mortalitu. Nadroparin podáváme ve stejné dávce jako v úvodní terapii, a to během prvních 3–4 týdnů, dále dávku snižujeme na dávku 3/4 či 2/3.
3. Dlouhodobá léčba (Je to léčba po 3. měsíci.)
Doporučení
- LMWHs jsou upřednostňovány před warfarinem.
- LMWHs by měly být podávány nejméně po dobu 3 měsíců.
- Denní aplikace s. c. injekce je pro nemocného nepohodlná.
- Po 3–6 měsících ukončení LMWH nebo warfarinu by mělo být vždy individuálně rozhodnuto – poměr benenefitu a rizika terapie, zejména podle aktivity nádorového onemocnění. Dále je nutno zhodnotit toleranci terapie, preferenci pacienta.
Trvání – délka antikoagulace.
Jedna studie porovnává pacienty a aktivní malignitou a první epizodou DVT, kteří byli léčeni 6 měsíců LMWH a byli rozděleni do 3 skupin:
U pacientů s DVT, po 6měsíční antikoagulační terapii.
Tab. 4. Výsledky léčby VTE 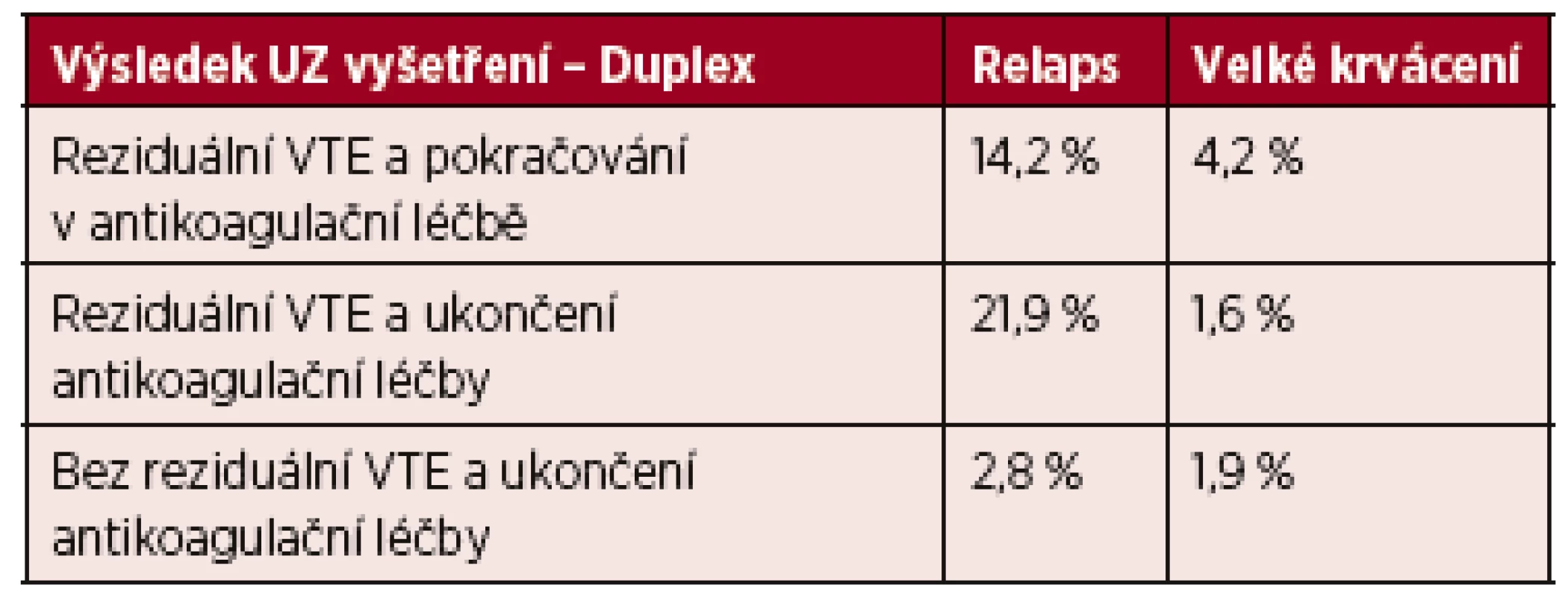
Vysvětlivky: VTE – venózní tromboembolismus; UZ – sonografické vyšetření Provedení sonografického vyšetření (UZ) dopplerovou metodou nebylo spolehlivým markerem ukončení antikoagulační terapie a zůstavá otazkou provedení UZ v té době. Provedení D-dimerů není spolehlivým markerem ukončení antikoagulační léčby. Žádná studie neporovnávala 3měsíční a 6měsíční aplikaci LMWH [21].
V případě recidivy VTE na antikoagulační terapii, lze postupovat podle 3 možností [21, 22]:
- Pokud je nemocný na warfarinu → změna z warfarinu na LMWH.
- Pokud je nemocný léčen LMWH → zvýšit dávku LMWH.
- Zavedení kaválního filtru.
V případě recidivy VTE na antikoagulační terapii je nutno vždy vyloučit recidivu VTE.
Na závěr jen ukázka posledního ACCP doporučení z roku 2016 [43].
Nemocní s VTE (DVT v DK nebo PE) /cancer-associated thrombosis/, LMWH je preferován během prvních 3 měsíců před VKA, dabigatranem, rivaroxabanem, apixabanem nebo edoxabanem (Grade 2C).
DOACS V LÉČBĚ VTE U NEMOCNÝCH S NÁDOREM
Tyto léky zatím nejsou rutinně doporučovány v prevenci a léčbě nemocných s VTE jak hospitalizovaných, tak operovaných, a to na základě nedostatku jasných dat.
Co se týče terapie VTE pomocí DOACs, tak v klinických studiích byli léčeni i nemocní s nádorovým onemocněním. Stejně tak existují data z registrů DOACs a t. č. platí, že léčba je srovnatelná s léčbou warfarinem, méně konzistentní jsou data ve srovnání s LMWH. Probíhá však celá řada studií, které přinesou více dat, a tudíž doporučení pro klinickou praxi. Je potřeba přímých srovnávacích studií DOACs a LMWH.
VLIV LMWH NA PŘEŽITÍ
Experimentální práce, studie a některá klinická pozorování vedou k závěrům, že LMWH mají antineoplastický účinek, který vede k prodlouženému přežívání u nemocných s nádorem. Jiné skupiny předpokládají, že antitumorózní aktivita LMWH je náhodným nálezem, nezavislým na antikoagulačním efektu. Podle tohoto názoru by proto podávání LMWH z hlediska přežívání mělo být hodnoceno odděleně od antikoagulačního efektu. Touto problematikou se pilotně zabývaly 3 studie – CLOT, FAMOUS a MALT. Ve studii Kakkara [44] (Fragmin Advanced Malignancy Outcome Study [FAMOUS] trial), rozdíl v přežívání během jednoho roku nebyl prokázán, ale u pacientů, kteří přežili více než 17 měsíců, bylo pozorováno ve skupině s dalteparinem delší přežívání (p = 0,04). Ve studii CLOT [45] nebylo přežívání primárním cílem hodnocení, nicméně závěrem studie je, že nemocní se solidním nádorem bez metastatického postižení v době akutní VTE léčení dalteparinem ve srovnání s antagonisty vitaminu K měli lepší celkové přežití. Tyto studie se také liší dávkou LMWH. Co se týče nadroparinu, ve studii MALT [46] byl nadroparin aplikován v terapeutické dávce 148 nemocným po dobu 2 týdnů se snížením na polovinu po další 4 týdny. Ve 2. skupině s placebem bylo 154 nemocných. Statisticky významné zlepšení v celkové přežívání bylo pozorováno ve skupině s nadroparinem. Medián sledování byl jeden rok. Průměrná doba přežití byla 8 měsíců ve skupině s nadroparinem a 6,6 měsíců ve skupině s placebem. Snížení mortality bylo také ve prospěch nadroparinu v podskupině nemocných, u kterých byla odhadovaná doba přežití více než 6 měsíců. Výskyt velkého krvácení byl u 5 jedinců ve skupině s nadroparinem a u jednoho nemocného v placebu. Ve studii PROTECHT [40], aplikace nadroparinu (3800 anti-Xa IU 1krát denně po dobu 120 dnů) vedlo ke snížení incidence žilní a arteriální trombózy o 50 % u 1 150 nemocných s nádorem, léčených ambulantně chemoterapií (p = 0,024). V následné analýze byla data každého nemocného posuzována individuálně, a to jak odpověď na chemoterapii, tak celkové přežití. Celkové přežití bylo kalkulováno jako jeden rok po studijní medikaci (nadroparin nebo placebo), odpověď na terapii (kontrola onemocnění nebo ne). Hlavním statistickým závěrem bylo, že rozdíl v přežití závisí na léčebné odpovědi. Nadroparin může vést k prodlouženému přežívání, zejména u nemocných, u kterých se dostala malignita pod kontrolu.
Existuje také několik experimentálních prací, které ukazují, že nandroparin může signifikantně inhibovat motilitu nádorových buněk. Tudíž by nandroparin mohl ovlivnit metastázy nádorových buněk. Tak tomu je např. v práci Zhonga G., kde nadroparin měl vliv na motilitu a adhezivitu buněk adenokarcinomu plic.
Další studie s nadroparinem však neprokázala žádný pozitivní vliv na přežívání u nemocných léčených nadroparinem a pokročilým nádorem prostaty, plic nebo pankreatu. Čili vliv LMWH na přežití zůstává otázkou.
Shrnutí
Přestože o profylaxi VTE u nemocných s nádorem bylo v minulých 10–15 letech hodně napsáno, stále je jak u nás, tak ve světě co zlepšovat, a to přes existenci doporučených postupů. Obecně je celková adherence k doporučeným postupům v každodenní praxi nízká [8]. Celá řada prací a studií [47, 48, 49] tento fakt potvrzuje. Například ve „Fundamental Research in Oncology and Thrombosis“ (FRONTLINE) [50] se prokázalo, že správnou farmakologickou profylaxi dostávalo jen 52 % chirurgických nemocných a méně než 5 % interních. Benefit ze správné profylaxe VTE mají všichni nemocní s nádorem podstupující chirurgický výkon či nemocní přijatí do nemocnice pro akutní onemocnění či při zhoršené mobilitě. Samozřejmě pokud není kontraindikace k podání heparinu. U ambulantních nemocných se zdá, že farmakologická profylaxe by měla být u některých typů nádorů přínosná. Takto to bylo prokázáno nedávno u jedinců s karcinomem pankreatu s místní progresí či metastázami. Osobní anamnéza VTE, přítomnost dalšího trombofilního stavu, typ nádoru a jeho rozsah, stejně jako léčba jsou hlavní faktory, které je nutno vždy zhodnotit.
ZÁVĚR
LMWH jsou stále na prvním místě v profylaxi a léčbě nemocných s nádorem. To platí i pro nadroparin, který je u nás k dispozici již 25 let. Další zlepšování v kvalitě péče o nemocné mohou přinést další klinické studie s novými antitrombotiky, dodržování aktuálních doporučení, ale i např. nové inovativní počítačové programy, které dále zpřístupňují a rozšiřují informace o této problematice.
Čestné prohlášení autora
Autor prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku neshledává žádný střet zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Doručeno do redakce dne 19. 10. 2016.
Přijato po recenzi dne 20. 12. 2016.
doc. MUDr. Petr Dulíček, Ph.D.
IV. interní hematologická klinika
FN a LF Hradec Králové
e-mail: PetrDulicek@seznam.cz
Zdroje
1. Nordström M, Lindblad B, Bergqvist D, Kjellström T. A prospective study of the incidence of deep – vein thrombosis within a defined urban population. J Intern Med 1992; 232 : 155–160.
2. Timp JF, Braekkan SK, Versteeg HK, Cannegieter SC. Epidemiology of cancer-associated venous thrombosis. Blood 2013; 122 : 1712–1723.
3. Heit JA. Epidemiology of venous thromboembolism. Nat Rev Cardiol 2015; 12 : 464–474.
4. Khorana AA, Francis CW, Culakova E, et al. Thromboembolism is a leading cause of death in cancer patients receiving outpatinent chemotherapy. J Thromb Haemost 2007; 5 : 632–634.
5. Falanga A, Zacharski L. Deep vein thrombosis in cancer: the scale of the problem and approaches to management. Ann Oncol Off J Eur Soc Med Oncol ESMO 2005; 16 : 696–701.
6. Connolly GC, Francis CW. Cancer-associated thrombosis. Hematol Educ Program Am Soc Hematol Am Soc Hematol Educ Program 2013; 2013 : 684–691.
7. Streiff MB. Association between cancer types, cancer treatments, and venous thromboembolism in medical oncology patients. Clin Adv Hematol Oncol 2013; 11 : 349–357.
8. Farge-Bancel D, Bounameaux H, Brenner B, Büller HR, Kakkar A, Pabinger I. Implementing thrombosis guidelines in cancer patients: a review. Rambam Maimonides Med J 2014; 5: e0041.
9. Khorana AA, Kuderer NM, Culakova E, Lyman GM, Francis CHW. Development and validation of a predictive model for chemotherapy--associated thrombosis. Blood 2008; 111 : 4902–4907.
10. Ay C, Dunkler D, Marosi CH, et al. Prediction of venous thromboembolism in cancer patients. Blood 2010; 116 : 5377–5382.
11. Mandalà M, Falanga A, Roila F. Management of venous thromboembolism (VTE) in cancer patients: ESMO Clinical Practice Guidelines. Ann Oncol Off J Eur Soc Med Oncol ESMO 2011; 22. Suppl 6): vi85–92.
12. Mandalà M, Falanga A, Piccioli A, Prandoni P, Pogliani EM, Labianca R. Venous thromboembolism and cancer: guidelines of the Italian Association of Medical Oncology (AIOM). Crit Rev Oncol Hematol 2006; 59 : 194–204.
13. Farge D, Bosquet L, Kassab-Chahmi D, Mismetti P, Elalamy I, Meyer G. 2008 French national guidelines for the treatment of venousthromboembolism in patients with cancer: report from the working group. Crit Rev Oncol Hematol 2010; 73 : 31–46.
14. Debourdeau P. 2008 SOR guidelines for the prevention and treatment of thrombosis associated with central venous catheters in patients with cancer: report from the working group. Ann Oncol Off J Eur Soc Med Oncol ESMO 2009; 20 : 1459–1471.
15. Noble SIR, Shelley MD, Coles B, Williams SM, Wilcock A, Johnson MJ. Management of venous thromboembolism in patients with advanced cancer: a systematic review and meta-analysis. Lancet Oncol 2008; 9 : 577–584.
16. Watson HG, Keeling DM, Laffan M, Tait RC, Makris M. Guideline on aspects of cancer-related venous thrombosis. Br J Haematol 2015; 170 : 640–648.
17. Khorana AA, Carrier M, Garcia DA, Lee AY. Guidance for the prevention and treatment of cancer-associated venous thromboembolism. J Thromb Thrombolysis 2016; 41 : 81–91.
18. Easaw JC, Shea-Budgell MA, Czaykowski PM, et al. Canadian consensus recommendations on the management of venous thromboembolism in patients with cancer. Part 1: prophylaxis. Curr Oncol Tor Ont 2015; 22 : 133–143.
19. Easaw JC, Shea-Budgell MA, Czaykowski PM, et al. Canadian consensus recommendations on the management of venous thromboembolism in patients with cancer. Part 2: treatment. Curr Oncol Tor Ont 2015; 22 : 144–155.
20. Streiff MB, Holmstrom B, Ashrani A, et al. Cancer-Associated Venous Thromboembolic Disease, Version 1.2015. J Natl Compr Cancer Netw 2015; 13 : 1079–1095.
21. Farge D, Debourdeau P, Beckers M, et al. International clinical practice guidelines for the treatment and prophylaxis of venous thromboembolism in patients with cancer. J Thromb Haemost 2013; 11 : 56–70.
22. Debourdeau P, Farge D, Beckers M, et al. International clinical practice guidelines for the treatment and prophylaxis of thrombosis associated with central venous catheters in patients with cancer. J Thromb Haemost 2013; 11 : 71–80.
22. Kakkar AK, Williamson RC. Prevention of venous thromboembolism in cancer patients. Semin Thromb Hemost 1999; 25 : 239–243.
23. Kakkar AK, Haas S, Wolf H, Encke A. Evaluation of perioperative fatal pulmonary embolism and death in cancer surgical patients: the MC-4 cancer substudy. Thromb Haemost 2005; 94 : 867–871.
24. Einstein MH, Pritts EA, Hartenbach EM. Venous thromboembolism prevention in gynecologic cancer surgery: a systematic review. Gynecol Oncol 2007; 105 : 813–819.
25. Mismetti P, Laporte S, Darmon JY, Buchmuller A, Decouses H. Meta-analysis of low molecular weight heparin in the prevention of venous thromboembolism in general surgery. Br J Surg 2001; 88 : 913–930.
26. Kim JYS, Khavanin N, Rambachan A, et al. Surgical duration and risk of venous thromboembolism. JAMA Surg 2015; 150 : 110–117.
27. Akl EA, Kahale L, Sperati F, et al. Low molecular weight heparin versus unfractionated heparin for perioperative thromboprophylaxis in patients with cancer. Cochrane Database Syst Rev 2014; 6: CD009447.
28. Bergqvist D, Agnelli G, Cohen Eldor A, Nilsson PE, Le Moigne-Amrani A. Duration of prophylaxis against venous thromboembolism with enoxaparin after surgery for cancer. N Engl J Med 2002; 346 : 975–980.
29. Kakkar VV, Balibrea JL, Martinez-Gonzales J, Prandoni P. Extended prophylaxis with bemiparin for the prevention of venous thromboembolism after abdominal or pelvic surgery for cancer: the CANBESURE randomized study. J Thromb Haemost 2010; 8 : 1223–1229.
30. Vedovati MC, Becattini C, Rondeli F, et al. A randomized study on 1-week versus 4-week prophylaxis for venous thromboembolism after laparoscopic surgery for colorectal cancer. Ann Surg 2014; 259 : 665–669.
31. Trinh VQ, Karakiewicz P, Sammon J, et al. Venous thromboembolism after major cancer surgery: temporal trends and patterns of care. JAMA Surg 2014; 149 : 43–49.
32. Samama MM, Cohen AT, Darmon JY, et al. A comparison of enoxaparin with placebo for the prevention of venous thromboembolism in acutely ill medical patients. Prophylaxis in Medical Patients with Enoxaparin Study Group. N Engl J Med 1999; 341 : 793–800.
33. Leizorovicz A, Cohen AT, Turpie AG, et al. Randomized, placebo-controlled trial of dalteparin for the prevention of venous thromboembolism in acutely ill medical patients. Circulation 2004; 110 : 874–879.
34. Cohen AT, Davidson BL, Gallus AS, et al. Efficacy and safety of fondaparinux for the prevention of venous thromboembolism in older acute medical patients: randomised placeb controlled trial. Br Med J 2006; 332 : 325–329.
35. Carrier M, Khorana AA, Moretto P, Le Gal G, Karp R, Ywicker JI. Lack of evidence to support thromboprophylaxis in hospitalized medical patients with cancer. Am J Med 2014; 127 : 82–86.
36. Spencer FA, Lessard D, Emery C, Reed G, Goldberg RJ. Venous thromboembolism in the outpatient setting. Arch Intern Med 2007; 167 : 1471–1475.
37. Khorana AA, Dalal M, Lin J, Connolly GC. Incidence and predictors of venous thromboembolism (VTE) among ambulatory high-risk cancer patients undergoing chemotherapy in the United States. Cancer 2013; 119 : 648–655.
38. Khorana AA, Francis CW, Blumberg N, Culakova E, Refaai MA, Lyman GH. Blood transfusions, thrombosis, and mortality in hospitalized patients with cancer. Arch Intern Med 2008; 168 : 2377–2381.
39. Agnelli G, Gussoni G, Bianchini C, et al. Nadroparin for the prevention of thromboembolic events in ambulatory patients with metastatic or locally advanced solid cancer receiving chemotherapy: a randomised, placebo-controlled, double-blind study. Lancet Oncol 2009; 10 : 943–949.
40. Akl EA, Kahale LA, Ballout RA, et al. Parenteral anticoagulation in ambulatory patients with cancer. Cochrane Database Syst Rev 2014; 12: CD006652.
41. Di Nisio M,Porreca E, Otten Hm, Rutjes AW. Primary prophylaxis for venous thromboembolism in ambulatory cancer patients receiving chemotherapy. Cochrane Database Syst Rev 2014;8: CD008500.
42. Kearon C, Akl EA, Jimenez D, et al. Antithrombotic therapy for VTE disease: CHEST guideline and expert panel report. Chest 2016; 149(2): 293–294.
43. Kakkar AK, Levine MN, Kadziola Z, et al. Low molecular weight heparin, therapy with dalteparin, and survival in advanced cancer: the fragmin advanced malignancy outcome study (FAMOUS). J Clin Oncol 2004; 22 : 1944–1948.
44. Lee AYY, Levine MN, Baker RI, et al. Low-molecular-weight heparin versus a coumarin for the prevention of recurrent venous thromboembolism in patients with cancer. N Engl J Med 2003; 349 : 146–153.
45. Klerk PWG, Smorenburg SM, Otten HM, et al. The effect of low molecular weight heparin on survival in patients with advanced malignancy. J Clin Oncol 2005; 23 : 2130–2135.
46. Kahn SR, Panju A, Geerts W, et al. Multicentre evaluation of the use of venous thromboembolism prophylaxis in acutely ill medical patients in Canada. Thromb Res 2007; 119 : 145–155.
47. Tapson VF, Decousos H, Pini M, et al. Venous thromboembolism prophylaxis in acutely ill hospitalized medical patients: findings from the International Medical Prevention Registry on Venous Thromboembolism. Chest 2007; 132 : 936–945.
48. Kucher N, Spirk D, Kalka C, et al. Clinical predictors of prophylaxis use prior to the onset of acute venous thromboembolism in hospitalized patients SWIss Venous ThromboEmbolism Registry (SWIVTER). J Thromb Haemost 2008; 6 : 2082–2087.
49. Kakkar AK, Levine M, Pinedo HM, Wolff R, Wong J. Venous thrombosis in cancer patients: insights from the FRONTLINE survey. Oncologist 2003; 8 : 381–388.
Štítky
Hematológia Interné lekárstvo Onkológia
Článek Úvodník
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2017 Číslo 1- Nejasný stín na plicích – kazuistika
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
-
Všetky články tohto čísla
- Moderní léčba akutní myeloidní leukemie
- Zkušenosti s léčbou ruxolitinibem u pacientů s myelofibrózou a pravou polycytemií na českých hematologických pracovištích
- Autoimunitní hemolytická anémie – diagnostika a léčba, včetně transfuze erytrocytů
- Úvodník
-
Zemřel MUDr. Vladimír Veselý, CSc.
(30. 5. 1931–25. 5. 2016) - Vzpomínka na pana profesora MUDr. Ivo Krče, DrSc.
- Prevence a léčba venózního tromboembolismu u nemocných s nádorovým onemocněním
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Autoimunitní hemolytická anémie – diagnostika a léčba, včetně transfuze erytrocytů
- Moderní léčba akutní myeloidní leukemie
- Zkušenosti s léčbou ruxolitinibem u pacientů s myelofibrózou a pravou polycytemií na českých hematologických pracovištích
- Prevence a léčba venózního tromboembolismu u nemocných s nádorovým onemocněním
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



