-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Manažment veľkých operácií u pacientov s hemofíliou A kontinuálnou infúziou a bolusovými injekciami FVIII – farmakokinetický prístup k liečbe
Management of major surgery in patients with haemophilia A using continuous infusion vs. bolus injections of FVIII – a pharmacokinetic approach to treatment
Management of major surgery represents the most challenging issue of replacement therapy in severe haemophilia. The aim of our open, prospective, nonrandomised study was to evaluate continuous infusion (CI) of factor VIII (FVIII) and traditional therapy with bolus injections (BI) in severe haemophilia A patients undergoing major surgery with similar requirements regarding intensity and duration of replacement therapy, namely 13 days. We also focused on the benefit of preoperative pharmacokinetics (PK) studies either for CI or BI therapy. We evaluated a total of 100 major surgeries performed between 1998 and 2016 in 60 patients without inhibitors. Of these, 49 and 51 surgeries were performed using CI and BI respectively. Median trough levels of FVIII were comparable in both CI and BI groups [68% (interquartile range 59–90%) vs. 70% (57–77%)]. However, in the CI group we observed a lower, though non-significant, level of blood loss; fall in haemoglobin and number of serious bleedings compared with the BI group. In the CI group, there was a significantly lower number of patients requiring blood transfusions (33% vs. 55%, p < 0.05). Gradual decrease of FVIII clearance during CI resulted in lower week 1 and total FVIII consumption [357 (308–378) IU/kg vs. 426 (375–467) IU/kg and 520 (474–585) IU/kg vs. 612 (554–625) IU/kg, respectively, p < 0.001], especially due to significant FVIII cost reduction in patients with total arthroplasty treated with CI. PK evaluation performed before 60 surgeries (44 CI and 16 BI) revealed a shorter biological half time < 10 h in 17 (28%) patients tested, suggesting the potential of PK for individual tailoring of effective postoperative factor replacement either using CI or BI with the aim of further increasing the safety of major surgical procedures in haemophilia.
Key words:
haemophilia – major surgery – continuous infusion – bolus injections – pharmacokinetics of FVIII
Autoři: D. Jankovičová 1; B. Šteňo 2; T. Prigancová 1; A. Morongová 1; J. Škultéty 3; I. Majeský 3; E. Khúnová 1; M. Mistrík 1; A. Bátorová 1
Působiště autorů: Klinika hematológie a transfuziológie LF UK, SZU, Univerzitná nemocnica Bratislava 1; II. Ortopedicko-traumatologická klinika LF UK, Univerzitná nemocnica Bratislava 2; II. Chirurgická klinika LFUK, Univerzitná nemocnica Bratislava 3
Vyšlo v časopise: Transfuze Hematol. dnes,23, 2017, No. 2, p. 61-72.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Manažment veľkých operácií u pacientov s hemofíliou predstavuje jednu z najzávažnejších oblastí substitučnej liečby hemofílie. Cieľom našej prospektívnej nerandomizovanej otvorenej štúdie bolo vyhodnotiť liečbu kontinuálnou infúziou (KI) a bolusovými injekciami (BI) FVIII u pacientov s ťažkou hemofíliou A, ktorí sa podrobili veľkým operáciám s rovnakými požiadavkami na intenzitu a trvanie liečby počas 13 dní. Zamerali sme sa aj na hodnotenie prínosu predoperačného vyšetrenia farmakokinetiky (PK) pred KI aj pred BI. Vyhodnotili sme 100 veľkých operácií vykonaných v období rokov 1998–2016 u 60 pacientov bez inhibítora, z nich 49 liečených KI a 51 BI. Medián minimálnych hladín FVIII bol porovnateľný v oboch skupinách [pri KI 68 % (IQR 59–90 %) a pri BI 70 % (57–77 %)], ale pri KI sme pozorovali nižšie, i keď nesignifikantne, krvné straty, pokles hemoglobínu a nižší výskyt závažných krvácaní ako pri BI. Nižší počet pacientov vyžadujúcich transfúziu pri KI (33 % vs. 55 %) dosiahol štatistickú významnosť (p < 0,05). Postupný pokles klírens FVIII počas KI viedol k signifikantne nižšej spotrebe FVIII: v 1. týždni 357 (308–378) IU/kg vs. 426 (375–467) IU/kg a celková spotreba 520 (474–585) IU/kg vs. 612 (554–625) IU/kg, p < 0,001, na čom sa podieľala signifikantná úspora FVIII pri totálnych artroplastikách liečených s KI. Vyšetrenie PK vykonané pred 60 operáciami (44 KI a 16 BI) odhalilo kratší biologický polčas < 10 h až u 17 pacientov (28 %), čo naznačuje, že vyšetrenie PK môže mať význam pre individuálne dávkovanie a časovanie pooperačnej substitučnej liečby nielen pri KI, ale aj pri BI s cieľom zvýšiť bezpečnosť veľkých chirurgických operácií u pacientov s hemofíliou.
KĽÚČOVÉ SLOVÁ:
hemofília – veľké operácie – kontinuálna infúzia – bolusové injekcie – farmakokinetika FVIIIÚVOD
Pokroky v liečbe hemofílie prispeli k významnému zlepšeniu možností a bezpečnosti chirurgickej liečby, ktorá dnes predstavuje bežnú súčasť komplexnej starostlivosti o pacientov s hemofíliou. Medzi elektívnymi výkonmi stále dominujú ortopedické operácie, ale zvýšenie dostupnosti koncentrátov FVIII/IX a zavedenie včasnej profylaxie u detí viedlo k zmene ich profilu. Dramaticky sa znížila potreba synovektómií zameraných na zníženie frekvencie krvácaní do cieľových kĺbov a na druhej strane sa zvýšil podiel totálnych artroplastík pre pokročilé štádiá hemofilickej artropatie a operácií pre typické choroby vyššieho veku. Počas operácie je potrebná normalizácia hemostázy s udržaním jej adekvátnej úrovne v pooperačnom období až do zhojenia, čo pri veľkých operáciách trvá najmenej 10–14 dní, neraz aj dlhšie [1]. Dodnes nebola exaktne stanovená minimálna hemostatická úroveň FVIII, ale v súčasnosti panuje všeobecná zhoda, že v čase operácie má byť aktivita FVIII 100 % [2–4], zatiaľ čo požiadavky na minimálnu aktivitu FVIII v pooperačnom období značne kolíšu od veľmi nízkych hladín 30–40 % v krajinách s limitovanou dostupnosťou koncentrátov [5] až po > 60–100 % [2, 6, 7]. Po operácii sa FVIII tradične aplikuje formou intermitentných bolusových injekcií (BI), ktorú sprevádza veľká fluktuácia FVIII medzi minimálnou hladinou pred nasledujúcou dávkou a zbytočne vysokou hladinou po podaní bolusu [8, 9]. Mnohé pracoviská dnes používajú kontinuálnu infúziu (KI), ktorá udržiava rovnovážny stav s konštantnou hladinou FVIII. Pre stanovenie iniciálnej udržiavacej dávky slúži hodnota klírens FVIII zistená vyšetrením farmakokinetiky pred KI [7]. Možno predpokladať, že predoperačné vyšetrenie farmakokinetiky môže mať význam aj pri BI, keďže pre rozhodovanie o intervaloch liečby má kľúčový význam biologický polčas (T½) FVIII. Dnes sa intervaly BI najčastejšie určujú na základe populačného T½ alebo hodnoty udanej výrobcom.
Na našom pracovisku cloníme chirurgickú liečbu tradičnou bolusovou liečbou a od r. 1993 aj kontinuálnou infúziou FVIII [10]. V prospektívnej nerandomizovanej otvorenej observačnej štúdii sme sledovali účinnosť a bezpečnosť KI FVIII, ktorú sme porovnali so štandardnou bolusovou liečbou pri veľkých operáciách u pacientov s ťažkým stupňom hemofílie A. Hodnotili sme prínos vyšetrenia farmakokinetiky FVIII pri oboch typoch substitučnej liečby.
SÚBOR PACIENTOV A METÓDY
Do štúdie sú od r. 1998 postupne zaraďovaní pacienti s ťažkým stupňom hemofílie A (FVIII < 1 %) bez inhibítora FVIII s plánovanou veľkou operáciou s očakávaným trvaním pooperačnej substitučnej liečby KI alebo BI 13 dní. Veľké operácie boli definované ako ortopedické operácie (synovektómia, artroplastika bedrových a kolenných kĺbov, osteosyntéza pre fraktúru femuru s dislokáciou), abdominálne, hrudné a neurochirurgické operácie a tonzilektómia.
Predoperačné vyšetrenie
Pred plánovanou operáciou sme u všetkých pacientov vylúčili prítomnosť inhibítora FVIII klasickou Bethesda metódou [11] a modifikovanou Nijmegen metódou [12] a overili účinnosť liečby po podaní jednorazovej dávky 30–40 IU FVIII/kg. „In vivo recovery“ (IVR) sme vypočítali podľa vzorca:
IVR (%/ IU/kg) =[FVIII po podaní (%)–bazálna hladina FVIII (%)]//dávka FVIII (IU/kg).
Kompletné vyšetrenie farmakokinetiky (PK) robíme u všetkých pacientov pred plánovanou liečbou KI štandardným spôsobom podľa odporučení ISTH (International Society of Thrombosis and Hemostasis) [13]. Po 72 h vynechaní liečby a podaní dávky 30–40 IU FVIII/kg vyšetrujeme aktivitu FVIII vo vzorkách odobratých za 10 min, 30 min, 1, 3, 6, 9, 12, 24 a 48 h a farmakokinetické parametre hodnotíme nekompartmentovou, „model-independentnou“ metódou s použitím komputerového programu PKRD [13, 14, 15], ktorá spoľahlivo určí hodnotu klírensu potrebnú pre výpočet iniciálnej rýchlosti kontinuálnej infúzie [8, 15]. S cieľom zistiť možnosť vyšetrenia PK s limitovaným počtom vzoriek sme porovnali hodnoty kompletnej PK s výsledkami parametrov PK získanými hodnotením 5 vzoriek odobratých za 10 min, 1, 9, 24 a 48 h po podaní bolusu [16, 17]. V posledných rokoch vyšetrujeme PK aj u pacientov liečených BI.
Operačná technika
Plánované operácie vykonáva stabilný operačný tím so skúsenosťami v liečbe hemofílie s dôrazom na dôkladnú lokálnu hemostázu. Synovektómie a totálne artroplastiky sa vykonávajú v turnikete, s jeho uvoľnením pred ukončením operácie a sutúrou operačnej rany.
Hemostatický manažment operácie
Pri veľkých operáciách od r. 1993 preferujeme substitúciu FVIII kontinuálnou infúziou s použitím transportovateľnej minipumpy. V čase nedostupnosti KI podmienenej nedostatkom jednorazových infúznych setov cloníme operačné výkony BI. Po operácii pacienti dostávajú antifibrinolytiká.
Predoperačná hemostatická príprava a monitorovanie substitučnej liečby
Iniciálny predoperačný bolus FVIII podávame pri oboch spôsoboch liečby (KI aj BI) tesne pred celkovou anestéziou v dávke vypočítanej podľa predoperačne zistenej hodnoty IVR s cieľom dosiahnuť hladinu FVIII 100 %. Na výpočet dávky používame vzorec:
Dávka (IU) = želaný vzostup FVIII (%) x hmotnosť (kg)/IVR (%/IU/kg)
Hladinu FVIII overujeme vo vzorke odobratej 10 minút po podaní predoperačného bolusu a na konci operácie. Po podaní iniciálneho bolusu nasleduje substitúcia KI alebo BI s rovnakými cieľovými minimálnymi hladinami FVIII v pooperačnom období: v dňoch 1–3 (D1–D3) FVIII ≥ 60–80 %, v D4–D7 ≥ 50–60 % a v D8–D13 ≥ 30–40 %. Liečbu monitorujeme denným vyšetrením hladiny FVIII, pri BI zo vzoriek odoberaných pred podaním rannej dávky, spravidla o 8 h (12 h po prechádzajúcej dávke). Pri KI nie je časovanie odberov dôležité, nakoľko hladina odráža rovnovážny stav, ale aj tu vzorky odoberáme o 8 h ráno.
Pooperačná substitučná liečba
Kontinuálna infúzia FVIII
Používame KI s adjustovanými dávkami FVIII [7, 8]. Po podaní iniciálneho bolusu napojíme KI krátko po začatí operácie. Na výpočet iniciálnej rýchlosti infúzie použijeme hodnotu klírens zistenú pri predoperačnej PK a dávku vypočítame podľa vzorca:
Dávka FVIII (IU/kg/h)=požadovaná hladina FVIII (IU/ml) x klírens FVIII (ml/kg/h)
Hladinu FVIII kontrolujeme aj 6–8 h po operácii a v prípade potreby rýchlosť KI modifikujeme. V nasledujúcich dňoch udržiavaciu dávku adjustujeme podľa aktuálnej hodnoty klírens vypočítanej podľa vzorca:
Klírens FVIII (ml/kg/h)=dávka FVIII (IU/kg/h)//aktuálne nameraná hladina FVIII (IU/ml)
Na KI používame koncentráty FVIII s potvrdenou stabilitou po rozpustení pri izbovej teplote > 7 dní [10, 18]. Koncentrovaný roztok FVIII pripravený v sterilných podmienkach bez ďalšej dilúcie a s pridaním heparínu (5 U/ml) na prevenciu lokálnej flebitídy sa aplikuje infúznymi minipumpami InfuMed 300 a Walkmed 300 (Duluth Inc,USA) s možnou minimálnou rýchlosťou 0,1 ml/h. Infúzny vak s obsahom 60 ml a infúzna linka sa menia každých 24–72 h. Po veľkých operáciách dostávajú pacienti KI FVIII počas 13 dní.
Pooperačná liečba bolusovými injekciami
Ako už bolo spomenuté vyššie, iniciálny bolus FVIII sa podá na operačnej sále tesne pred operáciou. Na konci operácie aplikujeme zaisťovací bolus FVIII (15–20 IU/kg). Ďalej pokračuje liečba BI v dávke cca 30 IU/kg v intervaloch 12 h až do D7, v dňoch D8–D13 v dávke 30–40 IU v intervale 24 h. U pacientov, u ktorých sme predoperačne vyšetrili PK, prispôsobujeme podanie zaisťovacej dávky času, v ktorom sme zistili pokles FVIII o 30 % z dosiahnutého píku a pri stanovení intervalov BI zohľadňujeme zistenú hodnotu T½. Substitučná liečba BI trvá 13 dní.
Hodnotenie krvných strát a kritéria pre podanie transfúzie erytrocytov (Er)
Lekár nášho centra je prítomný pri každej veľkej operácii hemofilika. Operačnú stratu určujeme v spolupráci s operatérom súčtom objemu krvi v rezervoári odsávania a odhadu strát do rúšok. Pooperačnú stratu určujú straty do drénov, prípadne odhad straty pri potrebe reoperácie. Za signifikantné krvácanie považujeme intraoperačnú stratu hodnotenú chirurgom ako neprimeranú danému typu operácie, pokles hemoglobínu (Hb) pod 80 g/l a krvácanie vyžadujúce liečebnú intervenciu alebo reoperáciu. Indikáciou pre podanie Er je prudký pokles Hb o ≥ 50 g/l, hladina Hb < 80 g/l a prítomnosť klinických symptómov ťažkej anémie.
Hodnotenie
Pri KI aj BI sme hodnotili úspešnosť liečby podľa udržania minimálnej pooperačnej hladiny FVIII, sledovali sme intraoperačné a pooperačné krvné straty a potrebu transfúzií. Vyhodnotili sme 7-dňovú a celkovú spotrebu FVIII a vznik inhibítora FVIII. Zvlášť sme analyzovali tri súbory pacientov podľa typu operácií s odlišnou predispozíciou ku veľkosti krvných strát (totálne artroplastiky veľkých kĺbov, iné ortopedické operácie a brušné operácie).
Štatistická analýza
Kvantitatívne parametre sú vyjadrené počtom, mediánom s dolným a horným kvartilom (M, IQR), prípadne rozptylom minimálnej a maximálnej hodnoty. Kategorické dáta vyjadrujeme ako početnosti, prípadne ako percento z celkového počtu. Pre testovanie rozdielov v sledovaných súboroch sme použili nepárový t-test, pri málo početných alebo asymetricky rozdelených súboroch neparametrický Mannov-Whitneyov test. Pre kategorické dáta sme použili exaktné binomické testy proporcií a testy kontingenčných tabuliek.
VÝSLEDKY
Vyhodnotili sme celkom 100 postupne idúcich veľkých operácií u 60 pacientov s ťažkou hemofíliou A s vekovým mediánom 43 rokov (IQR 25–52 rokov; rozptyl 10–73 rokov) a hmotnosťou 72 kg (IQR 60–80 kg; rozptyl 37–113 kg), ktoré splnili kritérium trvania substitučnej liečby 13 dní. Z nich 36 pacientov absolvovalo jednu, 12 pacientov dve, 8 pacientov tri a 4 pacienti až štyri veľké operácie. 49 operácií (39 pacientov) sme clonili farmakokineticky riadenou KI a 51 operácií (34 pacientov) BI FVIII. Z tých, ktorí absolvovali viac operácií, bolo 13 pacientov zastúpených v obidvoch skupinách (KI aj BI). Tabuľka 1 uvádza základné charakteristiky a typy operačných výkonov v oboch skupinách chorých. Rozdiely vo veku a hmotnosti pacientov sú dané vyšším podielom synovektómií v skupine KI, ktoré sa vykonávajú u mladších jedincov a naopak vyšším podielom totálnych artroplastík u dospelých v skupine s BI. Pri analýze spotreby FVIII preto v oboch skupinách hodnotíme spotrebu prepočítanú na hmotnosť pacienta (IU/kg).
Tab. 1. Charakteristiky pacientov s ťažkým stupňom hemofílie A s veľkými operáciami clonenými kontinuálnou infúziou (KI) a bolusovými injekciami (BI) FVIII 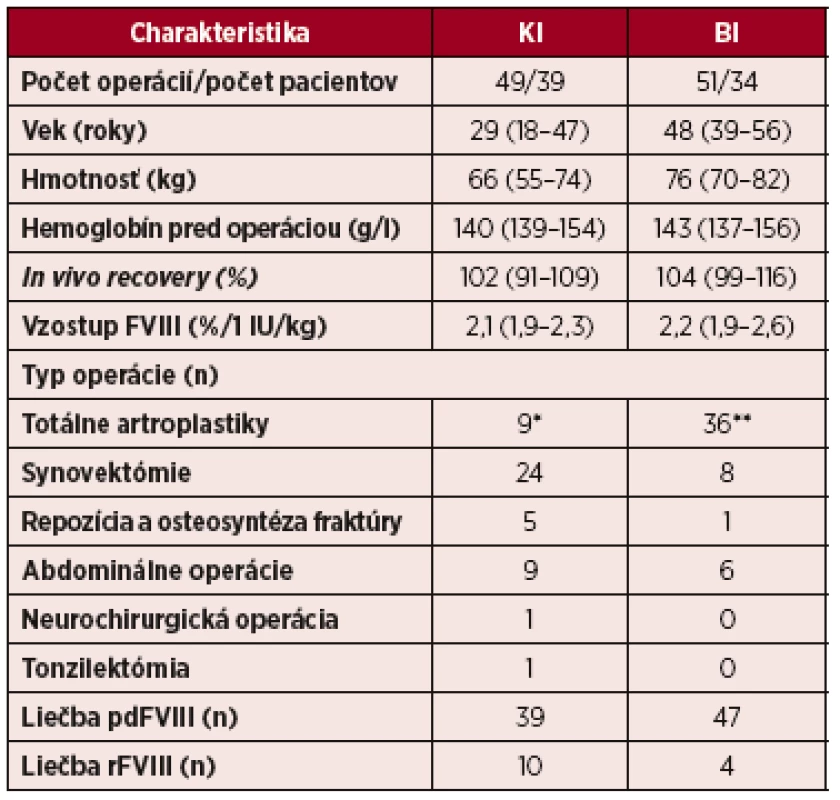
Vysvětlivky: Hodnoty sú uvedené v mediánoch (interkvartilový rozptyl – IQR) pdFVIII – FVIII vyrobený z plazmy; rFVIII- rekombinantný FVIII *artroplastika kolenného kĺbu 4, artroplastika bedrového kĺbu 5 **artroplastika kolenného kĺbu 29, artroplastika bedra 6, artroplastika členka 1 U 41 pacientov sme vykonali celkove 60 predoperačných vyšetrení PK, z nich 44 pred plánovanou liečbou KI a 16 pred BI. 13 pacientov absolvovalo 2–4 opakované vyšetrenia PK. Výsledky PK parametrov po podaní bolusu FVIII 29–48 IU/kg boli porovnateľné v oboch skupinách KI a BI (tab. 2). Výsledky parametrov PK sa nelíšili pri hodnotení kompletnej PK (9 vzoriek) a limitovaného počtu 5 vzoriek odobraných za 10 min, 1, 9, 24 a 48 h po podaní bolusu FVIII (graf. 1). Na krivke znázorňujúcej elimináciu FVIII u 44 pacientov pred KI vidno, že v 3. hodine po podaní sa zníži aktivita z dosiahnutého píku o 30 % a v 6. hodine klesne takmer na polovicu. Až 1/3 pacientov mala T½ < 10 h (12 KI a 5 BI) a 5 pacientov (2 KI a 3 BI) malo dokonca T½ < 8 h (6,7–7,8 h). U 4 z 5 pacientov s T½ < 8 h nastala redukcia aktivity o 30 % už v 2. hodine, pritom krátky T½ nekoreloval s hodnotou klírens, ktorý bol v normálnom rozmedzí (3,5–4,9 ml/kg/h). Jeden pacient s T½ 6,7 h mal zvýšený aj klírens FVIII (6,1 ml/kg/h).
Graf 1. Eliminácia FVIII z cirkulácie a výsledky vyšetrenia farmakokinetiky u 44 pacientov s hemofíliou A pred plánovanou veľkou operáciou clonenou KI FVIII (hodnotenie kompletného vyšetrenia 9 vzoriek a limitovaného počtu 5 vzoriek) 
Vysvetlivky: PK – farmakokinetika; MRT – priemerný rezidenčný čas; Vss – distribučný objem v rovnovážnom stave; AUC – plocha pod krivkou; T½ – polčas; h – hodina Tab. 2. Predoperačné vyšetrenie farmakokinetiky u pacientov s hemofíliou A pred operáciami s kontinuálnou infúziou (KI) a bolusovými injekciami (BI) FVIII 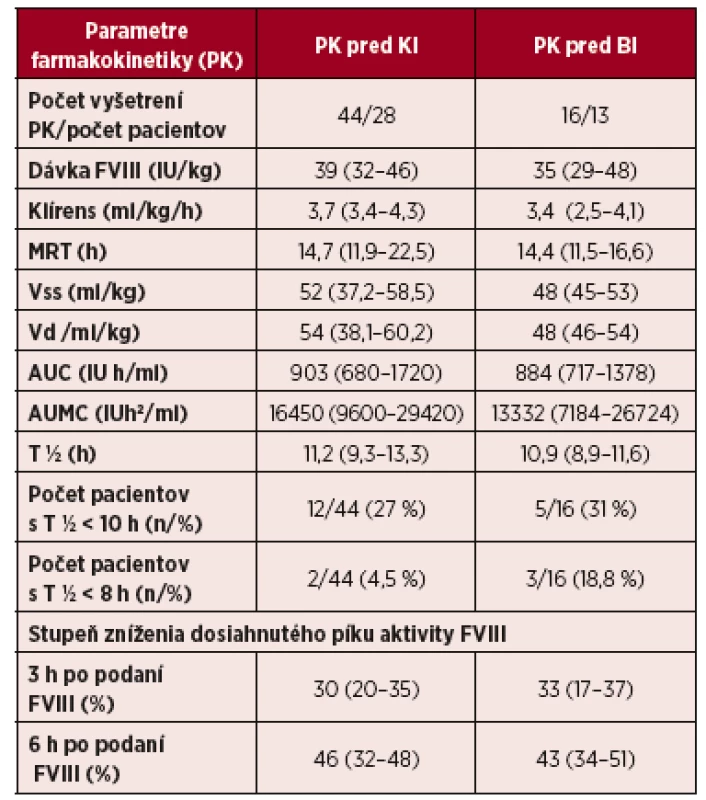
Hodnoty sú uvedené v mediánoch (interkvartilový rozptyl – IQR). Vysvetlivky: MRT – priemerný rezidenčný čas, Vss – distribučný objem v rovnovážnom stave ; Vd – distribučný objem; AUC – plocha pod krivkou; AUMC – plocha pod krivkou v danom momente; T ½ biologický polčas; h – hodina. Kontinuálnu infúziu sme napojili na začiatku operácie s iniciálnou dávkou 2,9 IU/kg/h (IQR: 2,0–3,0 IU/kg/h; rozptyl 1,75–4,2 IU/kg/h), vypočítanou na základe predoperačného vyšetrenia klírens FVIII s cieľom udržať rovnovážnu hladinu FVIII v deň operácie > 80 %. Už od druhého dňa kontinuálnej infúzie sme potvrdili signifikantné znižovanie klírens FVIII (graf. 2), pokles dosiahol plateau medzi 5.–8. dňom s ďalšou redukciou až do D13. Východisková hodnota klírens 3,7 ml/kg/h (IQR 3,4–4,3 ml/kg/h) sa znížila na konečnú úroveň 2,2 ml/kg/h (IQR 1,7–2,9 ml/kg/h); p < 0,001. Pokles klírens umožnil progresívne znižovanie dennej dávky FVIII z iniciálnej 2,9 (IQR 2,0–3,5) IU/kg/h na konečnú dávku 1,2 (0,9–1,5) IU/kg/h, pričom hladiny FVIII boli nad stanoveným dolným limitom (graf 3). V skupine pacientov s BI sme štyrom pacientom s predoperačne zisteným kratším T½ pridali bolus (cca 15 IU/kg) intraoperačne už 1 h po iniciálnej dávke FVIII, zaisťovaciu dávku FVIII sme podali po ukončení operácie a v dňoch 1–3 sme aplikovali bolusy 35 IU/kg v 8 h intervaloch s udržaním hladiny FVIII nad požadovaným minimom.
Graf 2. Redukcia klírens FVIII u 49 pacientov s hemofíliou A v priebehu kontinuálnej infúzie FVIII po veľkých chirurgických operáciách (medián, interkvartilový rozptyl) 
Graf 3. Hladiny FVIII u 49 pacientov s hemofíliou A po veľkých operáciáchclonených kontinuálnou infúziou FVIII (medián, interkvartilový rozptyl) 
Hodnotenie krvných strát, nárokov na transfúzie a spotreby FVIII v celom súbore pacientov liečených KI a BI uvádza tabuľka 3. V skupine pacientov s KI sme pozorovali nižšie hodnoty intraoperačnej krvnej straty, pooperačných strát do drénov a nižší pokles hemoglobínu, ale rozdiely neboli signifikantné. Štatistickú významnosť dosiahol rozdiel v počte pacientov s transfúziou krvi, ktorý bol vyšší v skupine BI (28/55 % vs. 16/33 %; p = 0,02) s pomerom rizika RR 1,68 (95% KI 1,04–2,69). Signifikantné krvácanie v pooperačnom období sa v celom súbore vyskytlo v 10/100 (10 %) prípadov, z nich u 4 (8,2 %) pacientov s KI a u 6 (11,7 %) pacientov s BI. U všetkých bola pritom hladina FVIII nad úrovňou požadovaného minima (FVIII 63–78 %). Analýza spotreby koncentrátu FVIII ukázala pri liečbe kontinuálnou infúziou signifikantne nižšie denné dávky (graf 4), nižšiu spotrebu FVIII v 1. týždni aj v celom sledovanom období 13 dní oproti BI (graf 5). Úspora lieku pri KI činila 15 %.
Graf 4. Medián denných dávok FVIII (IU/kg/deň) u pacientov s hemofíliou A po veľkých operáciách clonených bolusovými injekciami (BI; n = 51) a kontinuálnou infúziou FVIII (KI; n = 49). V dňoch 1–9 rozdiel štatisticky významný (p < 0,05). 
Graf 5. Spotreba FVIII v 1. pooperačnom týždni a celková spotreba FVIII (IU/kg) u pacientov s hemofíliou A po veľkých operáciách clonených bolusovými injekciami (BI; n= 51) a kontinuálnou infúziou FVIII (KI; n = 49). 
Tab. 3. Intraoperačná a pooperačná krvná strata, pokles hemoglobínu, nároky na transfúzie a spotreba FVIII v 1. týždni a v intervale 13 pooperačných dní u pacientov s hemofíliou A pri veľkých operáciách liečených kontinuálnou infúziou (KI) a bolusovými injekciami (BI) FVIII 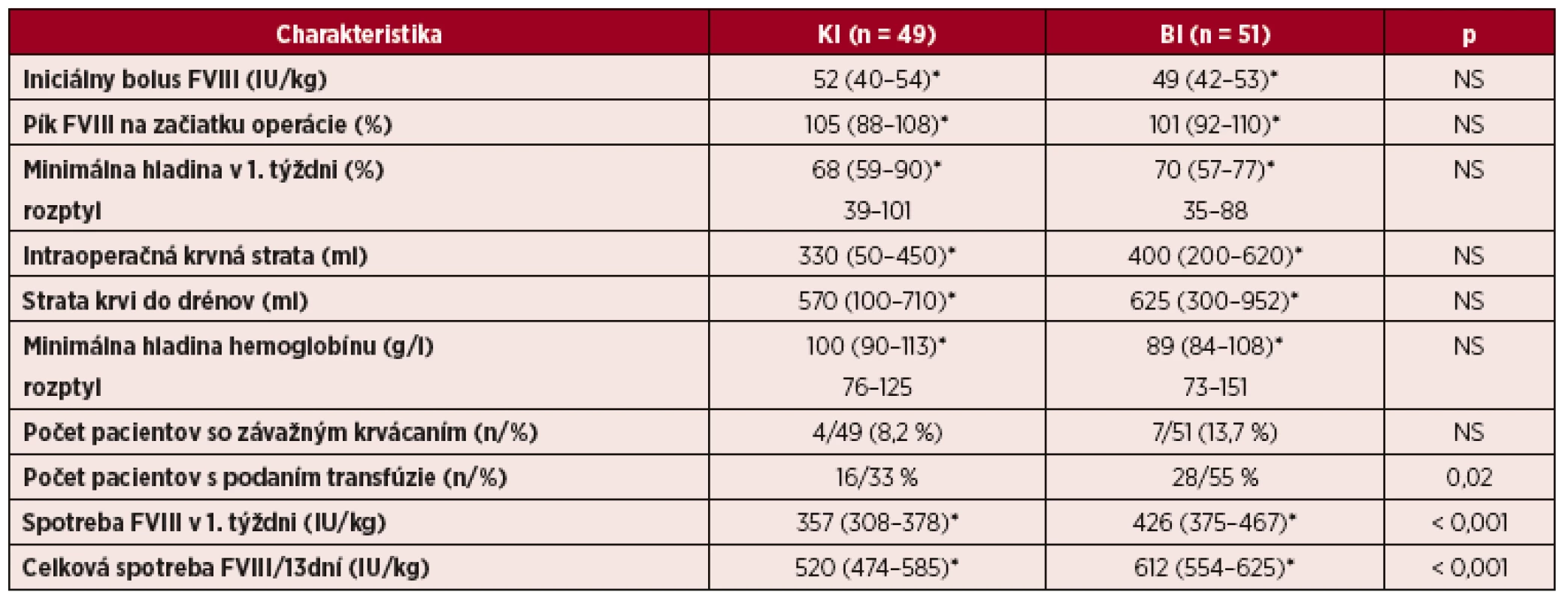
Vysvětlivky: *Medián (interkvartilový rozptyl – IQR) Sledované parametre sme zvlášť vyhodnotili v troch skupinách pacientov s porovnateľným typom operácií a rizikom krvácania (tab. 4). Vek a hmotnosť pacientov boli signifikantne nižšie v skupine KI s ortopedickými operáciami inými ako totálne artroplastiky (TA), čo bolo dané vyšším podielom synovektómií u mladších pacientov. Dosahované hladiny FVIII pri všetkých typoch operácií boli porovnateľné pri KI a BI. Rozdiely v krvných stratách medzi KI a BI boli mierne, zreteľne vyššie straty boli len u pacientov s BI pri TA, ale rozdiely pre veľký rozptyl hodnôt neboli signifikantné. V tejto skupine bol aj vyšší počet pacientov s podaním transfúzie (24/67 % vs. 4/44 %), opäť štatisticky nevýznamne, s RR 1,22 (95% KI 0,66–2,29); p = 0,32. Po totálnej artroplastike kolena (TAK) sme pozorovali svalové hematómy u 7/29 (24 %) pacientov s BI a u 2/4 (50 %) s KI, bez potreby zmeny režimu substitučnej liečby. Porovnanie spotreby FVIII ukázalo nižšiu spotrebu pri KI pri všetkých typoch operácií, ale štatistickú významnosť dosiahol tento rozdiel len pri totálnych artroplastikách (tab. 4).
Tab. 4. Porovnanie efektivity substitučnej liečby kontinuálnou infúziou (KI; n = 47) a bolusovými injekciami (BI; n =5 1) u pacientov s hemofíliou A pri porovnateľných typoch veľkých operácií 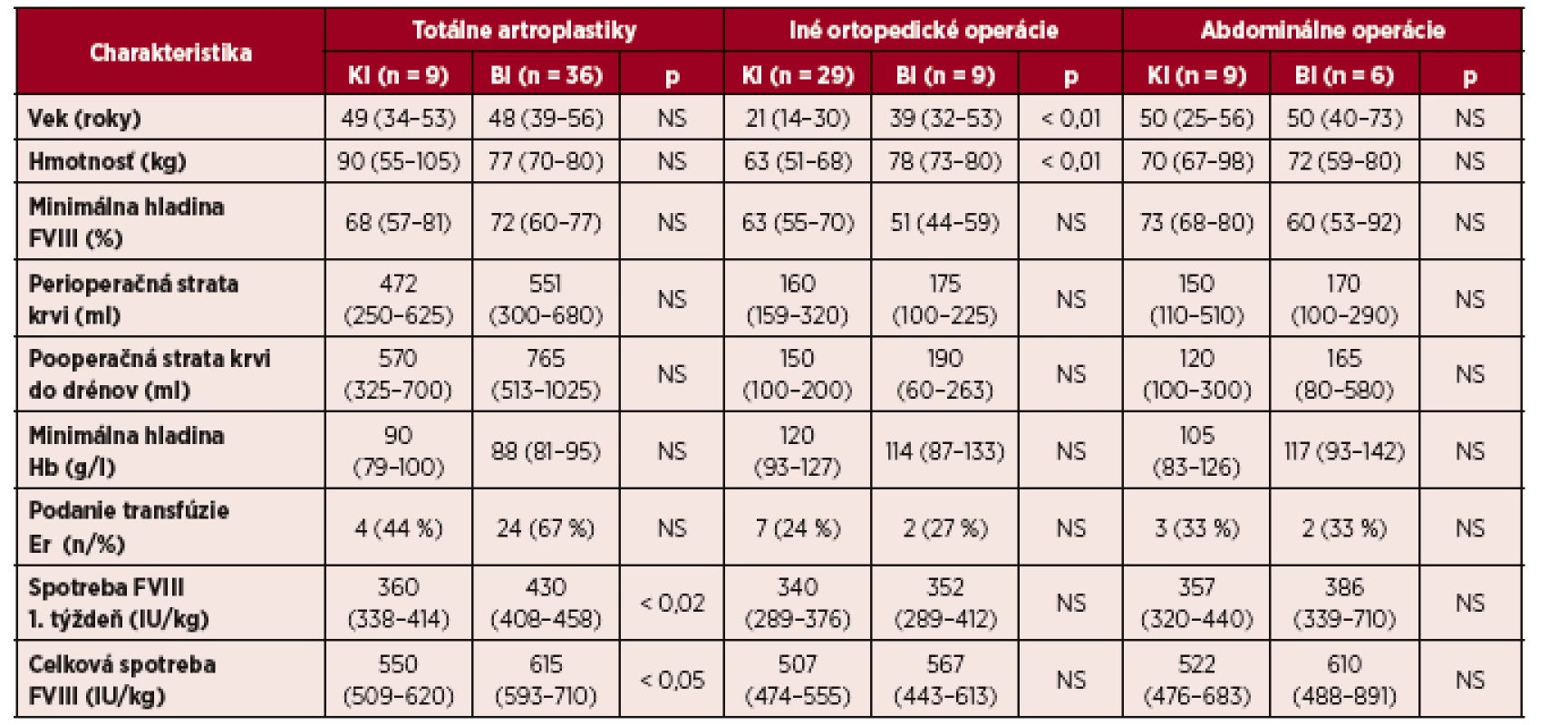
Vysvetlivky: Hb = hemoglobín; Er = erytrocyty Hodnoty sú vyjadrené v mediánoch (interkvartilový rozptyl – IQR) V podskupine 16 pacientov s BI s predoperačne vyšetrenou PK viedol intenzívnejší režim u 4 pacientov s kratším T½ k vyššej spotrebe FVIII oproti skupine 35 pacientov bez PK: v 1. týždni bola spotreba 478 (IQR 410–504) IU/kg verzus 408 (IQR 375–455) IU/kg a celková spotreba 628 (IQR 604–747) IU/kg verzus 600 (IQR 542 až 633) IU/kg, rozdiely však neboli štatisticky významné.
Vznik inhibítora sme zaznamenali na 20. deň intenzívnej liečby kontinuálnou infúziou rekombinantným FVIII (rFVIII) u 23-ročného pacienta, predtým liečeného s pdFVIII (FVIII vyrobený z plazmy), ktorý dostal enormné dávky rFVIII pre komplikovaný pooperačný priebeh po totálnej endoprotéze bedra s potrebou revíznej operácie. Pre vysoký titer inhibítora bol pacient ďalej liečený rekombinantným FVIIa a neskôr sa podrobil úspešnej imunotolerančnej liečbe. Ďalší 6 pacienti predtým liečení s pdFVIII a operovaní pod clonou KI s rFVIII však inhibítor nevyvinuli.
DISKUSIA
Kontinuálna infúzia FVIII je dnes široko používaný spôsob substitučnej liečby hemofílie vhodný najmä pre situácie vyžadujúce dlhšie trvajúcu intenzívnu liečbu a stabilné hemostatické hladiny FVIII [7, 9]. Túto metódu využíva viac ako 60 % hemofilických centier v USA [19, 20], približne 55 % veľkých hemofilických centier v krajinách EU [4, 21–23] a v Japonsku je KI liečbou prvej voľby pre intenzívnu liečbu hemofílie [24, 25]. Fixné dávkovanie KI vychádza z pôvodných kalkulácií, že dávka 4 IU/kg/h udrží aktivitu FVIII > 100 % a dávka 2 IU/kg/h na úrovni 50 % [27]. Pri fixnej dávke však dochádza k nadmernému zvyšovaniu FVIII v dôsledku progresívnej redukcie klírens [8, 9, 18]. Martinowitz et al. (1992) vyvinuli nový model farmakokineticky riadenej KI s adjustáciou dávok podľa klírens zisteného predoperačným vyšetrením a neskôr v priebehu KI rekalkulovaného na základe aktuálnej hladiny FVIII [8]. Tento spôsob KI priniesol významný ekonomický efekt do náročnej liečby hemofílie s úsporou FVIII 10–36 % [3, 6, 9, 10]. Z dôvodov viacerých výhod je KI už od roku 1993 preferovaným spôsobom intenzívnej liečby hemofílie aj na našom pracovisku. Doteraz sme vykonali viac ako 160 KI a od roku 1998 sme v rámci prospektívnej observačnej štúdie clonili kontinuálnou infúziou 49 veľkých operácií s trvaním liečby 13 dní. Liečbu KI sme porovnali s efektom liečby BI pri 51 veľkých operáciách s rovnakým trvaním liečby 13 dní, vykonaných v rovnakom časovom období.
Pri hodnotení celej skupiny 49 operácií s KI a 51 operácií s BI sme v súlade s literárnymi údajmi [4, 22, 25, 27–29] a s prechádzajúcimi výsledkami nášho pracoviska [10] potvrdili dobrú účinnosť KI s vyššou mierou bezpečnosti oproti liečbe BI. Jedným z kritérií efektivity substitučnej liečby pri veľkých operáciách je udržanie hemostatickej hladiny FVIII a redukcia krvácavých komplikácií. Dosahované hladiny FVIII boli porovnateľné pri oboch liečebných režimoch. Kasperová et al. (1985) pri minimálnej pooperačnej hladine FVIII ≥ 70 % pozorovali incidenciu krvácavých komplikácií u 23 % pacientov, pri TAK až v 40 % prípadov [30, 31]. Títo autori upozornili, že hladina FVIII pravdepodobne nie je jediným determinantom rizika pooperačného krvácania [30]. Dingli et al. (2005) napriek 100% cieľovej hladine FVIII v prvých 2–5 pooperačných dňoch pozorovali signifikantné pooperačné krvácanie pri 5/45 (11 %) operácií, všetky sa vyskytli po ortopedických operáciách (5/25; 20 %), a to pri uspokojivých hodnotách FVIII 55–151 % [27]. V bežnej populácii sa pri TAK udávajú krvné straty 500–1500 ml [32] a pokles hemoglobínu (Hb) o 34,6–41,6 g/l [33], pričom transfúziu dostane až 69 % pacientov [34]. U hemofilikov podľa Wiedela et al. (2005) nie je v prvých 3 pooperačných dňoch neobvyklý pokles Hb až o 60–80 g/l [35, 36]. V súčasnej literatúre sa u pacientov s hemofíliou a TAK považujú za primerané celkové in-stra a pooperačné straty do objemu 1500 ml a pokles Hb o 37 ± 17 g/l [4, 25, 29]. V našej štúdii sa celkový výskyt signifikantného krvácania (10 %) a pooperačné krvné straty nelíšili od údajov v literatúre [3, 27, 29]. Krvné straty boli nesignifikantne nižšie pri 49 KI oproti 51 BI (tab. 3), ale počet pacientov s transfúziou krvi bol signifikantne vyšší pri BI oproti KI (28/55 % vs. 16/33 %; p = 0,02). To bolo do značnej miery ovplyvnené vyšším podielom totálnych artroplastík v skupine BI (n = 36) oproti KI (n = 9). V literatúre sú údaje o podaní transfúzií po veľkých operáciách u pacientov s hemofíliou veľmi limitované. Negrier et al. (2008) podali transfúzie pri 9/22 (41 %) veľkých ortopedických operáciách.
Zloženie súborov v našej štúdii nie je identické čo do veku pacientov a typu operácií. V začiatočných fázach štúdie totiž prevažovali synovektómie u mladších pacientov, ktoré sme vykonali prevažne pod clonou KI. Od roku 2004, po zavedení profylaxie, zaznamenávame ústup synovektómií a naopak prevahu totálnych artroplastík, ktoré sme však v dôsledku limitovanej dostupnosti jednorazového materiálu do infúznych púmp v posledných rokoch clonili prevažne BI. Vzhľadom na tieto rozdiely sme zvlášť analyzovali efekt KI a BI v troch skupinách pacientov s porovnateľným typom operácií (viď tab. 4). Rozdiely vo veku a hmotnosti pacientov boli signifikantné len v skupine „iných ortopedických operácií“, kde pacienti liečení BI mali vyšší vek a hmotnosť v dôsledku nižšieho podielu synovektómií. Mohli by sme očakávať, že vyšší vek a hmotnosť v skupine s BI sa odrazí v nižšej spotrebe liekov, keďže vo vyššom veku sa pozoruje znižovanie klírens a predlžovanie T ½ FVIII. Tento efekt sme však nepozorovali. Pri všetkých typoch operácií boli pri BI mierne vyššie krvné straty oproti KI, ale tieto rozdiely neboli signifiantné. Zreteľne vyšší bol však počet pacientov s transfúziou Er v skupine totálnych artroplastík liečených BI (24/67 % vs. 4/44 %), ale rozdiel opäť nebol signifikantný. Štatistickú významnosť v tejto skupine dosiahla redukcia spotreby FVIII pri KI oproti BI v prvom týždni (p < 0,02) aj počas celého intervalu liečby (p < 0,05). Po TAK sa môžu vyskytnúť svalové hematómy stehna, ktoré sme pozorovali u 7/29 pacientov s BI (24 %) a u 2/4 pacientov s KI (50 %), bez nutnosti zmeny liečebného režimu. Chevalier et al. (2013) udávajú výskyt svalových hematómov pri 26 zo 72 (36,1 %) TAK clonených KI [22] a Negrier et al. (2008) pri 5 z 11 (41 %) artroplastikách bez ohľadu na typ liečby [3]. Svalové hematómy môžu byť výsledkom intraoperačnej traumatizácie a krvácania z chirurgickej príčiny, lokálnych príčin daných náročným operačným terénom u hemofilických pacientov, prípadne použitia pneumatického turniketu s ischémiou stimulovanou fibrinolýzou. V ortopédii sa často používajú drény s aktívnym odsávaním, ktoré môžu znižovať udržanie a hemostatickú funkciu chabého koagula. Pacienti po operácii užívajú antifibrinolytiká, ktorých priaznivý efekt na zníženie krvácania sa potvrdil pri artroplastikách kolenných a bedrových kĺbov aj v bežnej populácii, bez zvýšenia rizika trombózy [32, 37]. Tromboprofylaxiu u pacientov s ťažkým stupňom hemofílie paušálne nepodávame.
Inhibítor vyvinul jeden pacient liečený KI s rFVIII po artroplastike bedrového kĺbu. Ku jeho vzniku disponovala koincidencia viacerých rizikových faktorov: veľká operácia, intenzívna liečba FVIII pre komplikovaný priebeh vyžadujúci reoperáciu a zmena z predošlej liečby pdFVIII na rFVIII. V literatúre sa KI zvykla uvádzať ako potenciálny rizikový faktor vzniku inhibítora na základe ojedinelých prípadov pozorovaných najmä u operovaných pacientov so stredne ťažkým a ľahkým stupňom hemofílie [38]. Pri ťažkom stupni hemofílie sa však táto súvislosť nepotvrdila, o čom svedčia publikované veľké súbory pacientov liečených KI [4, 25, 27, 28, 39, 40] ako aj nedávny prehľad o použití 1079 KI u 742 pacientov v 13 európskych centrách [21]. Inhibítor vyvinuli len traja zo 659 (0,45 %) pacientov s ťažkým stupňom a 6/83 (7,2 %) s ľahšími stupňami hemofílie, u ktorých však boli súčasne prítomné viaceré potenciálne predisponujúce faktory ako nízky počet expozičných dní pred intenzívnou liečbou, operácia, neadekvátne vysoké dávky KI, enormne vysoké hladiny FVIII a prítomnosť génovej mutácie Arg593Cys, vysoko rizikovej pre vznik inhibítora [21, 41, 42].
V práci sme sa zvlášť zaoberali otázkou farmakokinetického prístupu k intenzívnej substitučnej liečbe. V priebehu KI sme potvrdili známy fenomén znižovania klírens FVIII, umožňujúci progresívnu redukciu udržiavacích dávok, väčšiu ako vyplývala len zo znižovania požadovanej minimálnej hladiny FVIII v neskoršom pooperačnom období. To sa odrazilo aj v signifikantne nižšej spotrebe FVIII v celej skupine s KI, podmienenej najmä nižšou spotrebou u pacientov s TA oproti pacientom liečeným BI (viď tab. 3). Celkový ekonomický benefit KI 15 % bol však nižší ako v predchádzajúcej práci (35 %), čo možno vysvetliť zvýšením limitu minimálnej hladiny FVIII vo včasnom pooperačnom období (> 60 až 80 %) oproti predošlej štúdii [10]. Rovnako ako iní autori, ktorí pri KI uvádzajú redukciu spotreby FVIII 10–20 % [3, 6], preferujeme pri veľkých operáciách bezpečnosť pred úsporou, ktorá v prípade komplikácií môže priniesť ďalšie zvýšenie nárokov na liečbu.
Komplexné vyšetrenie PK vyžaduje odber veľkého počtu vzoriek v intervale 48 h, a preto nepatrí k povinnému vyšetreniu pred KI. Naše pracovisko robí PK vyšetrenie pred každou plánovanou liečbou s KI. Viacerí autori potvrdili, že PK parametre možno spoľahlivo stanoviť na princípe populačného Bayesovho odhadu s použitím redukovaného počtu vzoriek [16, 17, 43, 45]. V našej práci sme potvrdili zhodné výsledky klírens aj T½ pri hodnotení kompletnej série 9 vzoriek a hodnotení 5 vzoriek. Z praktického hľadiska za najpohodlnejšie pre pacienta i personál považujeme odbery 10 min a 1, 9, 24 a 48 h po podaní FVIII. Dôležité je dodržať interval 48 h, nakoľko pri kratšom intervale sme v zhode s literatúrou pozorovali znižovanie hodnoty T½ a zvyšovanie hodnoty klírens [43, 46].
Význam vyšetrenia PK pred kontinuálnou infúziou zdanlivo spochybňuje fakt, že pri KI sa využíva len jeden parameter (klírens) a len pre výpočet iniciálnej dávky KI [9, 10]. Vyšetrenie však poskytuje aj ďalšie cenné informácie pre manažment intenzívnej liečby nielen s KI ale aj BI, vrátane možnosti odhalenia hraničného alebo štandardnými metódami nedetegovateľného inhibítora. Pri bolusovej liečbe sa na určenie intervalov BI využívajú populačné údaje a hodnoty T ½ udávané výrobcom. Naša analýza 60 vyšetrení PK u 41 pacientov, z ktorých až 13 absolvovalo opakované vyšetrenie, potvrdila z literatúry známu inter - aj intraindividuálnu variabilitu PK [43–46]. Až 17 vyšetrení PK odhalilo T½ < 10 h, z nich 5 (8 %) dokonca ≤ 8 h, pričom boli variabilné výsledky aj u opakovane vyšetrených pacientov. Výsledok PK môže ovplyvniť viacero faktorov, okrem veku, hmotnosti, hladiny von Willebrandovho faktora a krvnej skupiny aj aktuálny stav pacienta, prípadne prítomnosť nedetegovateľného inhbítora. Aj Collins et al. pozorovali hodnotu T ½ na úrovni 7,5 h u 5 % jedincov vo veku 10–65 rokov [47].
Vyšetrenie PK poskytuje obraz o osude FVIII v cirkulácii u konkrétneho pacienta. Eliminácia FVIII je bifázická s rýchlym iniciálnym únikom, podmieneným distribúciou a druhou pomalou eliminačnou fázou, zodpovedajúcou biologickému polčasu [43]. Naše pracovisko používa nekompartmentový model PK, ktorý spoľahlivo stanoví klírens pre výpočet iniciálnej udržiavacej dávky KI a ktorý je vhodný aj na porovnávanie efektivity rôznych typov koncentrátov [15, 48, 49]. Novšie kompartmentové modely PK môžu presnejšie stanoviť T ½ a informovať o klírens FVIII po opakovanej dávke, čo môže mať význam aj pre intenzívnu liečbu BI a nepochybne pre profylaktickú liečbu [47, 49]. Pre potreby jednotného hodnotenia výsledkov našej štúdie sme však metódu PK zatiaľ nemenili.
V bežnej praxi sa podáva iniciálna dávka FVIII kalkulovaná podľa výsledku IVR na dosiahnutie cieľovej hladiny FVIII 100 %, spravidla 30–60 min pred operáciou [3, 23, 26]. Treba si však uvedomiť, že po izolovanom boluse už behom prvých 60 min uniká takmer 20 % z dosiahnutého píku FVIII, čo znamená, že operácia sa prakticky začína pri hladine FVIII okolo 80 %. Naše vyšetrenia PK ďalej ukázali, že do 3 hodín po izolovanom boluse klesne hladina FVIII až o 1/3 z dosiahnutého píku a v 6. hodine je priemerná redukcia hladiny až 45,6 %. To môže byť pri 12-hodinovom režime BI nebezpečné zvlášť u pacientov s nepoznaným krátkym T½ alebo rýchlym klírens. Znalosť špecifickej farmakokinetiky u pacienta umožní individuálne titrovanie dávky. V našom centre aplikujeme úvodnú dávku FVIII na operačnej sále tesne pred celkovou anestéziou a pri režime BI pridávame zaisťovací bolus spravidla na konci operácie, pri kratšom trvaní operácie podanie oddialime, nie však viac ako tri hodiny po podaní iniciálnej dávky. Pri opakovaných bolusových dávkach sa postupne predlžuje polčas znižovania aktivity FVIII [32], čo dovoľuje štandardný 12-hodinový interval BI. U pacientov s T½ ≤ 8h v dňoch 1–3 podávame vyššie bolusy FVIII v 8-hodinovom intervale, čo spôsobí mierne zvýšenie celkovej spotreby FVIII v prvom týždni liečby. Pri liečbe kontinuálnou infúziou napojenie infúzie do 30 minút po iniciálnom boluse zabráni neželanému poklesu FVIII a zabezpečí konštantnú intraoperačnú hladinu FVIII.
Vzhľadom na interindividuálnu variabilitu PK je teda pred veľkou plánovanou operáciou užitočné vykonať vyšetrenie PK a nespoliehať sa len na populačné údaje klírens a T ½. PK vyšetrenie možno spoľahlivo vykonať s limitovaným počtom správne načasovaných 4–5 odberov vzoriek pri zachovaní 48-hodinového intervalu vyšetrenia [15]. Intraindividuálna variabilita odôvodňuje príležitostné vyšetrenie PK s limitovaným počtom vzoriek, ktoré má väčší klinický prínos ako jediná farmakokinetika s veľkým počtom odberov [15, 44, 45].
ZÁVER
U pacientov s ťažkým stupňom hemofílie A podrobujúcich sa veľkým operáciám sme pozorovali vyšší stupeň účinnosti a bezpečnosti substitučnej liečby pri použití kontinuálnej infúzie FVIII so signifikantne nižšou spotrebou transfúzií a nižšou spotrebou FVIII oproti bolusovej liečbe. Pri hodnotení rôznych typov operácií sa ukázal priaznivý prínos KI predovšetkým pre skupinu pacientov s totálnymi artroplastikami veľkých kĺbov. Naše pozorovania naznačujú, že farmakokinetický prístup a predoperačné vyšetrenie PK FVIII môže mať význam aj pre bolusovú liečbu, keďže umožňuje individuálnu titráciu dávok a intervalov v pooperačnom období a môže prispieť k zlepšeniu efektivity liečby. V súčasnosti je možné dosiahnuť spoľahlivé výsledky PK s obmedzeným počtom vzoriek, čo zlepšuje dostupnosť a adherenciu pacienta k vyšetreniu.
Podiel autorov na rukopise
AB a DJ – navrhli štúdiu, zozbierali a vyhodnotili údaje
DJ – napísala rukopis
AB, BŠ, MM – revidovali rukopis a potvrdili finálnu verziu
DJ, AB, TP, AM – participovali na štúdii pri vyšetrení farmakokinetiky a manažmente hemostatickej liečby
BŠ, JŠ, IM – realizovali chirurgické výkony
EK – vykonávala laboratórne vyšetrenie farmakokinetiky a monitorovanie pacientov.
Prehlásenie autorov
Autor práce prehlasuje, že v súvislosti s témou, vznikom a publikáciou tohto článku nie je v strete záujmov, a vznik ani publikácia článku neboli podporené žiadnou farmaceutickou firmou. Toto prehlásenie sa týka aj všetkých spoluautorov.
Doručeno do redakce dne 6. 3. 2017.
Přijato po recenzi dne 3. 4. 2017.
MUDr. Denisa Jankovičová
Klinika hematológie a transfuziológie LF UK, SZU, UNB
Antolská 11
851 07 Bratislava
Slovenská republika
e-mail: djankovicova@chello.sk
Zdroje
1. Hermans C, Altisent C, Batorova A, et al. Replacement therapy for invasive procedures in patients with haemophilia: Literature review, European survey and recommendations. Haemophilia 2009;15 : 639–658.
2. Mulcahy R, Walsh M, Scully MF. Retrospective audit of a continuous infusion protocol for haemophilia A at a single haemophilia treatment centre. Haemophilia 2005;11 : 208–215.
3. Négrier C, Shapiro A, Berntorp E, et al. Surgical evaluation of a recombinant factor VIII prepared using a plasma/albumin free method: Efficacy and safety of Advate in previously treated patients. Thromb Haemost 2008;100 : 217–223.
4. Meijer K, Rauchensteiner S, Santagostino E, et al. Continuous infusion of recombinant factor formulated with sucrose in surgery: Non interventional, observational study in patients with severe haemophilia A. Haemophilia 2015;21:e19–e25.
5. Srivastava A. Dose and response in haemophilia optimization of factor replacement therapy. Br J Haematol 2004;127 : 12–25.
6. Bidlingmaier C, Deml MM, Kurnik K. Continuous infusion of factor concentrates in children with haemophilia A in comparison with bolus injections. Haemophilia 2006;12 : 212–217.
7. Batorova A, Martinowitz U. Continuous infusion of coagulation products in hemophilia. Chapter 29. In: Lee CHA , Berntorp EE, Hoots WK(Eds) Textbook of hemophilia, 3rd Edition, Wiley-Blackwell, 2014;204–212.
8. Martinowitz U, Schulman S, Gitel S, et al. Adjusted dose continuous infusion of factor VIII in patients with haemophilia A. Br J Haematol 1992;82 : 729–734.
9. Martinowitz U, Schulman S. Continuous infusion of coagulation products. Int J Pediatr Hematol/Oncol 1994;1 : 471–478.
10. Batorova A, Martinowitz U. Intermittent injections vs. continuous infusion of factor VIII in haemophilia patient undergoing major surgery. Br J Haematol 2000;110 : 715–720.
11. Kasper CK, Aledort LM, Counts RB, et al. A more uniform measurements of factor VIII inhibitors. Thromb Diath Hemorh 1975;34 : 869–872.
12. Verbrugen B. Diagnosis and quantification of factor VIII inhibitors. Haemophilia 2010;16 : 20–24.
13. Morfini M, Lee M, Messori A. The design and analysis of half-life and recovery studies for factor VIII and factor IX. Scientific and Standardization Committee of the International Society for Thrombosis and Haemostasis. Thromb Haemost 1991;66 : 384–386.
14. Mattucci M, Messori A, Donati-Cori G, et al. Kinetic evaluation of four factor VIII concentrates by model-independent methods. Scand J Haematol 1985;34 : 22–28.
15. Morfini M. Pharmacokinetics of factor VIII and factor IX, Haemophilia 2003;9(S1):94–100.
16. Björkman S. Limited blood sampling for pharmacokinetic. Haemophilia 2010;16 : 579–605.
17. Morfini M. Pharmacokineic studies: international guidelines for the conduct and interpretation of such studies. Haemophilia 2006;12(S4):6–11.
18. Schulman S, Gitel S, Martinowitz U. Stability of factor VIII concentrates after reconstitution. Am J Hematol 1994;45 : 217–223.
19. Osip J, Christie B, Hannemann V, et al. Continuous infusion of factor concentrate practices in the United States – comparison of 1996 and 2005 surveys. Haemophilia 2006;12 : 05PO111.
20. Poppe LB, Eckel SF, Savage SW. Implementation of continuous infusion of blood coagulation factors at an academic medical center. Am J Health Syst Pharm 2012;69(6):522–526.
21. Batorova A, Holme P, Gringeri A, et al. on behalf of the EHTSB. Continuous infusion in haemophilia: current practice in Europe. Haemophilia 2012;18(5):753–759.
22. Chevalier Y, Dargaud Y, Lienhart A, et al. Seventy-two total knee arthroplasties performed in patients with haemophilia using continuous infusion. Vox Sang 2013;2 : 135–143.
23. Prelog T, Benedik Dolničar M, Kitanovski L. Low dose continuous infusion of factor VIII in patients with haemophilia A. Blood Transfus 2016;14 : 474–480.
24. Nishiya K, Nogami K, Tanaka I, et al. Dynamics of plasma factor during the continuous infusion of factor VIII concentrates in twenty patients with hemophilia A. J Thromb Haemost 2011;9(S2):929–930, P-Th-183.
25. Takedani H. Continuous infusion during total joint arthroplasty in Japanese haemophilia A patients: comparison study among two recombinants and one plasma-derived factor VIII. Haemophilia 2010;16 : 740–746.
26. Hermens WTH. Dose calculation of human factor VIII and factor IX concentrates for infusion therapy. In: Brinkhous KM, Hemke HC (eds.) Handbook of hemophilia, Part II. American Elsevier Publishing, New York, 1975;569–589.
27. Dingli D, Gastineau DA, Gilchrist GS, et al. Continuous factor VIII infusion therapy in patients with haemophilia A undergoing surgical procedures with plasma-derived or recombinant factor VIII concentrates. Haemophilia 2002;8 : 629–634.
28. Rahmé M, Ehlinger M, Faradji A, et al. Total knee arthroplasty in severe haemophilic patients under continuous infusion of clotting factors. Knee Surg Sports Traumatol Arthrosc 2012;20(9):1781–1786.
29. Windyga J, Rusen L, Gruppo R, et al. BDDrFVIII (Moroctocog alfa [AF-CC]) for surgical haemostasis in patients with haemophilia A: results of a pivotal study. Haemophilia 2010;16 : 731–739.
30. Kasper CK. In vivo recovery and early half-life of infused factor VIII in haemophilia A. Haemophilia 1995;1 : 14–16.
31. Aledort LM, Levine PH. Surgery in hemophilia. Series on the treatment of hemophilia. Berkeley, WFH 1977 : 1–15.
32. Kundu R, Das A, Basunia SR, et al. Does a single loading dose of tranexamic acid reduce perioperative blood loss and transfusion requirements after total knee replacement surgery? A randomised controlled trial. J NaT Sci Biol Med 2015;6(1):94–99.
33. Pitsaer E. Transfusion of recuperated blood in total knee arthroplasty. Rev Chir Orhop Reparatrice Appar Mot 2002;8 : 777–789.
34. Rosencher N, Kerkkamp HE, Macheras G, et al. Orthopedic surgery transfusion hemoglobin European overview (OSTHEO) study: blood management in elective knee and hip arthroplasty in Europe. Transfusion 2003;43(4):459–469.
35. Wiedel J, Stabler S, Geraghty S. Joint replacement surgery in hemophilia. Treatment of Hemophilia.WFH Publication 2010;50 : 1–10.
36. Rudowski JW, Scharf R and Ziemski JM. Is major surgery in hemophiliac patients safe? World J Surg 1987;11 : 378–386.
37. Kagoma YK, Crowther MA, Douketis J, et al. Use of antifibrinolytic therapy to reduce transfusion in patients undergoing orthopedic surgery: A systematic review of randomized trials. Thromb Res 2009;123 : 687–696.
38. Sharathkumar A, Lillicrap D, Blanchette S, et al. Intensive exposure to factor VIII is a risk factor for inhibitor development in mild haemophilia A. J Thromb Haemost 2003;1 : 1228–1236.
39. Auerswald G, Bade A, Haubold K, et al. No inhibitor development after continuous infusion of factor concentrates in subjects with bleeding disorders undergoing surgery: a prospective study. Haemophilia 2013;19 : 438–444.
40. Batorova A, Jankovicova D, Morongova A et al. Inhibitors in severe hemophilia A: 25-year experience in Slovakia. Semin Thromb Hemost 2016;42(5):550–562.
41. Eckhardt CL, van den Bom JG. Surgery and inhibitor development in hemophilia A: a systematic review. J Thromb Haemost 2011;9(10):1948–1958.
42. Eckhardt CL, Menke LA, Ommen CH, et al. Intensive perioperative use of factor VIII and the Arg593ŐCys mutation are risk factors for inhibitor development in mild/moderate haemophilia A. J Thromb Haemost 2009;7 : 930–937.
43. Björkman S & Collins P for the project on Factor VIII/factor IX pharmacokinetics of the Factor VIII/factor IX scientific and Standardization Committee of the ISTH. Measurements of factor VIII pharmacokinetics in routine clinical practice. J Thromb Haemost 2013;11 : 180–182.
44. Björkman S, Blanchette VS, Fischer K, et al. for the ADVATE Clinical Program Group and Collins PW. Comparative pharmacokinetics of plasma - and albumin-free recombinant factor VIII in children and adults: the influence of blood sampling schedule on observed age-related differences and implications for dose tailoring. J Thromb Haemost 2010;8 : 730–736.
45. Lee M, Morfini M, Négrier C, et al. The pharmacokinetics of coagulation factors. Haemophilia 2006;12(S3):1–7.
46. Morfini M, Marchesini E, Paladino E, et al. Pharmacokinetics of plasma-derived vs. recombinant FVIII concentrates: a comparative study. Haemophilia 2015;21 : 204–209.
47. Collins PW, Björkman S, Fisher K, et al. Factor VIII requirement to maintain a target plasma level in the prophylactic treatment of severe hemophilia A: influences of variance in pharmacokinetics and treatment regimens. J Thromb Haemost 2010;8 : 269–275.
48. Berntorp E and Björkman S. The pharmacokinetics of clotting factor therapy. Haemophilia 2003;9 : 353–349.
49. Morfini M. The history of clotting factor concentrates pharmacokinetics. J Clin Med 2017;6(3):1–14.
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2017 Číslo 2- Subkutánne vs. intravenózne imunoglobulíny u pacientov s CLL
- Nejasný stín na plicích – kazuistika
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
-
Všetky články tohto čísla
- Diagnostika a léčba získané hemofilie – konsenzuální doporučení Českého národního hemofilického programu (ČNHP)
- Výběr z tisku a zprávy o knihách
- Manažment veľkých operácií u pacientov s hemofíliou A kontinuálnou infúziou a bolusovými injekciami FVIII – farmakokinetický prístup k liečbe
- Interferón alfa v liečbe Ph negatívnej myeloproliferatívnej neoplázie
- Konsenzuální doporučení Českého národního hemofilického programu (ČNHP) pro diagnostiku a léčbu pacientů s hemofilií, vydání 2., rok 2017
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Interferón alfa v liečbe Ph negatívnej myeloproliferatívnej neoplázie
- Konsenzuální doporučení Českého národního hemofilického programu (ČNHP) pro diagnostiku a léčbu pacientů s hemofilií, vydání 2., rok 2017
- Manažment veľkých operácií u pacientov s hemofíliou A kontinuálnou infúziou a bolusovými injekciami FVIII – farmakokinetický prístup k liečbe
- Diagnostika a léčba získané hemofilie – konsenzuální doporučení Českého národního hemofilického programu (ČNHP)
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



