-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Hodnocení kostního obratu a významu deficitu vitaminu D u pacientů s myelofibrózou
Assessing bone turnover and the role of vitamin D deficiency in patients with myelofibrosis
Introduction: Primary myelofibrosis belongs to a group of Philadelphia chromosome-negative myeloproliferative neoplasms (Ph-MPN) together with essential thrombocythemia and polycythemia vera, which may also progress to bone marrow fibrosis. The study assessed biochemical markers of bone remodelling and osteoprotegerin to find a suitable marker for non-invasive monitoring of bone marrow fibrosis, as well as bone metabolism, in particular the role of vitamin D.
Patients and methods: Bone remodelling markers (bALP, P1NP, ICTP), bone metabolism and osteoprotegerin were analysed in 34 patients with myelofibrosis, 13 patients with pre-fibrotic primary myelofibrosis and a group of 28 patients with essential thrombocythemia and polycythemia vera.
Results: There was no increase in bALP. P1NP and ICTP were elevated in 18% and 32% of MF, respectively. The values neither correlated with fibrosis stage nor showed significant differences compared to the other Ph-MPN. Osteoprotegerin was increased in 53% of myelofibrosis, values correlated with myelofibrosis risk status (p=0.0043) but did not show a significant difference compared to the other Ph-MPN. Among bone metabolism parameters, significant differences were noted for vitamin D levels. Myelofibrosis had significantly lower vitamin D levels than the other Ph-MPN (p=0.0003), the values correlated with MF risk status (p=0.05).
Conclusion: The tested parameters are not sensitive enough for non-invasive monitoring of bone marrow fibrosis in routine clinical practice. Increased expression of osteoprotegerin is likely to play a role in the pathogenesis of myelofibrosis. Serum concentrations of vitamin D are significantly lower in myelofibrosis; the severity of deficiency correlates with disease stage. Given the fact that vitamin D participates in inhibition of the JAK/STAT signalling pathway, there is an urgent need to verify its prognostic value in the present-day era of JAK inhibitors.
KEY WORDS:
Ph-myeloproliferative neoplasms – myelofibrosis – bone turnover – osteoprotegerin – vitamin D
Autori: M. Palová 1; T. Szotkowski 1; A. Hluší 1; J. Navrátilová 1; M. Divoká 1; T. Papajík 1; P. Petrová 2; J. Prošková 2
Pôsobisko autorov: Hemato-onkologická klinika, Lékařská fakulta Univerzity Palackého a Fakultní nemocnice Olomouc 1; Oddělení klinické biochemie Fakultní nemocnice Olomouc 2
Přijato do tisku - předběžná publikace...
Súhrn
Úvod:
Primární myelofibróza je řazena mezi Ph (Philadelphia chromosome) negativní myeloproliferativní nemoci (Ph-MPN), spolu s pravou polycytemií a esenciální trombocytemií, které ve svém průběhu taktéž mohou přecházet do fibrózy kostní dřeně. V práci byly hodnoceny biochemické markery kostní remodelace a osteoprotegerin s cílem nalezení vhodného parametru pro neinvazivní monitorování pokročilosti fibrózy kostní dřeně, dále byl posuzován kostní metabolismus, zejména význam vitaminu D.
Pacienti a metody:
U 34 pacientů s myelofibrózou, 13 nemocných v prefibrotické fázi primární myelofibrózy a 28 nemocných s pravou polycytemií či esenciální trombocytemií byly analyzovány markery kostní remodelace (bALP, P1NP, ICTP), kostní metabolismus a osteoprotegerin.
Výsledky:
Nebylo prokázáno zvýšení bALP, P1NP byl zvýšen u 18%, ICTP u 32% nemocných s myelofibrózou. Hodnoty nekorelovaly s pokročilostí fibrózy, nevykazovaly významný rozdíl oproti prefibrotické fázi primární myelofibrózy ani ostatním Ph-MPN. Osteoprotegerin byl zvýšen u 53% myelofibróz, hodnoty korelovaly s pokročilostí nemoci (p=0,0043), ale nebyly signifikantně rozdílné ve srovnání s prefibrotickou fází primární myelofibrózy či ostatními Ph-MPN. Z hodnocených parametrů kostního metabolismu byly zaznamenány významné rozdíly v hladinách vitaminu D. Ve srovnání s ostatními Ph-MPN byl jeho deficit častěji zjištěn ve skupině myelofibróz (p=0,0003), u kterých sérové koncentrace vitaminu D korelovaly s pokročilostí choroby (p=0,05).
Závěr:
Testované plasmatické parametry nejsou dostatečně citlivé pro neinvazivní monitorování fibrózy kostní dřeně v rutinní klinické praxi. Zvýšená exprese OPG zřejmě hraje roli v patogenezi myelofibrózy. U MF jsou nižší sérové koncentrace vitaminu D ve srovnání s ostatními Ph-MPN, tíže jeho deficitu koreluje s pokročilostí choroby. S ohledem na skutečnost, že se vitamin D spolupodílí na inhibici JAK/STAT signální dráhy, vyvstává aktuální potřeba ověřit jeho prognostický význam v éře JAK inhibitorů.
KLÍČOVÁ SLOVA:
Ph-myeloproliferace – myelofibróza – kostní obrat – osteoprotegerin – vitamin D
ÚVOD
Primární myelofibróza (PMF) je chronickým klonálním onemocněním krvetvorby. Spolu s pravou polycytémií (PV) a esenciální trombocytémií (ET), které ve svém průběhu taktéž mohou přecházet do fibrózy kostní dřeně, patří do skupiny Ph (Philadelphia chromosome) negativních myeloproliferativních nemocí [1]. Incidence PMF je 1,5 případu na 100 000 obyvatel za rok [2]. Incidence PV je vyšší u mužů než u žen, a to 2,8 versus 1,3 případu na 100 000 obyvatel za rok. Kumulativní riziko přechodu do post-polycytemické myelofibrózy je 26% po 20 letech trvání nemoci [3,4]. Incidence ET je 2,5 případu na 100 000 obyvatel za rok, kumulativní riziko transformace do post-trombocytemické myelofibrózy je 9% po 15 letech trvání choroby [5,6]. V patogenezi PMF je zásadní dysregulace, respektive konstitutivní aktivace JAK/STAT signální dráhy, jež vede k autofosforylaci STAT proteinů (Signal transducer and activator of transcription) [7]. Konstitutivní aktivace JAK/STAT dráhy může být způsobená buď přímo somatickou mutací genu JAK2 v pozici V617F, nebo nepřímo mutacemi v genu MPL či CALR [8,10]. Důsledkem aktivace signálních drah je u PMF klonální proliferace atypických megakaryocytů s intenzivnější produkcí cytokinů a růstových faktorů, vedoucí ke zvýšené tvorbě neklonálních fibroblastů s následnou zvýšenou tvorbou retikulárních a kolagenních vláken. To zapříčiňuje cytopenii, extramedulární hematopoézu, hepatosplenomegalii a vznik konstitučních symptomů (zvýšení tělesné teploty, noční poty, váhový úbytek) [7]. Zatímco objevy posledních let přinesly průlom v pochopení role „driver“ mutací při aktivaci JAK/STAT signální dráhy vedoucí k proliferaci nádorového klonu, mechanismus samotné fibrogeneze a osteosklerózy dřeně zůstává stále nejasný. Zmnožení retikulárních a následně kolagenních vláken typu 1 a 3, snížené zastoupení až absence osteoklastů a neoangiogeneze jsou dominujícími znaky pokročilé myelofibrózy [11,12]. Již dřívější práce poukázaly na význam narušení cytokinové osy OPG (osteoprotegerin) – RANKL (receptor activator of NF-ĸB ligand) – RANK (receptor activator of NF-ĸB). RANKL, trans-membránový protein produkovaný stromálními buňkami a osteoblasty, po vazbě na receptor RANK indukuje diferenciaci a formaci osteoklastů. OPG, solubilní glykoprotein uvolňovaný osteoblasty a stromálními buňkami, funguje jako „decoy“ receptor pro RANKL (decoy receptory - tzv. „návnadové / matoucí“ receptory, které soutěží o vazbu na ligand; po navázání ligandu neaktivují příslušnou signální dráhu, ale zabraňují jeho interakci s regulérním receptorem). Tím OPG blokuje interakci mezi RANK-RANKL a inhibuje osteoklastogenezi [13,14]. Dalším potenciálním zdrojem OPG jsou endoteliální buňky, pro jejichž proliferaci je OPG důležitý [15]. Vysoká produkce OPG proto může mít duální funkci v patogenezi progrese myelofibrózy, vedle poškození funkce osteoklastů se může podílet také na endoteliálním růstu a neoangiogenezi. Někteří autoři považují právě nadprodukci OPG endoteliálnímí buňkami za jeden z důležitých momentů v procesu fibrotizace dřeně [16,17].
Rychlost tvorby a resorpce kosti lze posoudit podle produktů vznikajících v metabolismu organických složek kostní matrix. Mezi markery novotvorby kosti řadíme kostní izoenzym alkalické fosfatázy (bALP) nebo prokolagen typu 1 (P1NP). P1NP je syntetizován fibroblasty a uvolňován do plasmy během syntézy kolagenu a je přímým markerem procesu osteoformace. Biochemickým markerem odbourávání kostí je koncová část kolagenu typu I (ICTP), degradační produkt kolagenu vznikající vlivem osteoklastů [18,19].
Vitamin D, multifunkční pro-hormon, jehož hlavní funkcí je kontrola kalcium-fosfátového metabolismu, se také specificky podílí na regulaci aktivity osteoklastů a osteoblastů v procesu kostní remodelace. Vitamin D zahrnuje několik kalciferolů, pro potřeby lidského organismu jsou rozhodující cholekalciferol (D3) a ergokalciferol (D2), které jsou biologicky neaktivními prekurzory. V játrech se hydroxylací mění na 25-hydroxyvitamin D (25OHD), hlavní neaktivní formu hormonu v krvi. Další hydroxylací v ledvinách vzniká aktivní forma 1,25-hydroxyvitamin D (kalcitriol) [20]. Vzhledem k delšímu poločasu a vyšší sérové koncentraci je k monitorování koncentrací vitamínu D v těle používán 25OHD.V posledních letech se věnuje značná pozornost dalším úlohám vitaminu D v organismu. Jeho deficit je spojen s rizikem rozvoje kardiovaskulárních, metabolických a autoimunních chorob [20]. Jeho antitumorózní efekt se vysvětluje inhibicí buněčné proliferace, indukcí diferenciace a apoptózy [21,22]. Byla prokázána negativní korelace mezi sérovou koncentrací vitaminu D a incidencí některých solidních tumorů [23]. Výsledky meta-analýzy zahrnující 2284 pacientů s hematologickou malignitou potvrdily asociaci mezi horším celkovým přežitím (OS) a nízkou sérovou koncentrací 25OHD [24]. Ačkoliv epidemiologické studie poukazují na možný prognostický význam vitaminu D a na korelaci mezi jeho deficitem a vyšším rizikem rozvoje malignity či horší prognózou nemocných, není stále jasné, zda jeho suplementace může u pacientů s nově diagnostikovaným nádorovým onemocněním zlepšit léčebné výsledky.
V naší práci jsme hodnotili kostní status u MF pomocí biochemických markerů kostní remodelace (bALP, P1NP, ICTP), kostního metabolismu (ionty Ca2+, fosfáty, hormony ovlivňující kostní metabolismus - parathormon a 25-hydroxyvitamin D) a OPG, pro jeho schopnost inhibice osteoklastů. Cílem naší práce bylo posouzení možnosti identifikace vhodného markeru využitelného k neinvazivnímu monitorování stupně fibrózy kostní dřeně v průběhu nemoci, sledování léčebné odpovědi nebo časnému zastižení přechodu ET a PV do fibrotického stádia, dále zhodnocení kostního metabolismu, zejména významu vitaminu D u pacientů s MF.
PACIENTI A METODY
Z celkového počtu 73 pacientů s MF bylo do analýzy zařazeno 34 vhodných nemocných diagnostikovaných v našem centru v období let 2000 - 2017. Vyloučeni byli všichni v terminálním stavu choroby, po alogenní transplantaci kostní dřeně, s duplicitní malignitou a dalšími stavy, jež by mohly ovlivnit výsledky testovaných parametrů - hyperparathyreózou, renální insuficiencí, hepatopatií, užívající bisfosfonáty, hormonální substituční léčbu nebo glukokortikoidy v dávce vyšší než 10mg/den déle než 3 měsíce a diabetes mellitus léčeným inzulinem. Všichni hodnocení jedinci měli normální funkci štítné žlázy a glykémii. Jednalo se o 22 nemocných s diagnózou PMF, tři s post-PV myelofibrózou a devět s post-ET myelofibrózou. Šlo o 13 mužů, 21 žen, medián věku 61 let (rozmezí 36 – 79 let). V době analýzy užívalo 68 % pacientů specifickou léčbu MPN, a to 38 % hydroxyureu, 9 % anagrelid, 15 % ruxolitinib a 6 % busulfan. Srovnávací soubor zahrnoval 13 pacientů v prefibrotické/ časné fázi PMF (prePMF; 3 muži, 10 žen, medián věku 53 let; rozmezí 25-72) a 28 nemocných s Ph-MPN bez histologicky potvrzené fibrózy kostní dřeně (23 s PV, 5 s ET, 16 mužů, 12 žen, medián věku 61 let; rozmezí 28 - 85). V době analýzy bylo léčeno 69 % nemocných s prePMF (8 % interferonem alfa, 46 % hydroxyureou, 15 % anagrelidem) a 75 % pacientů ze skupiny PV a ET (7 % interferonem alfa, 57 % hydroxyureou, 11 % anagrelidem). Všichni vyšetřovaní měli histologicky verifikovanou diagnózu MPN minimálně jednou biopsií kostní dřeně a splnili kritéria WHO klasifikace 2008 nebo 2016. Nové vyšetření kostní dřeně nebylo pro účely analýzy vyžadováno. Všichni nemocní podepsali informovaný souhlas s odběrem a zpracováním biologického materiálu, vyšetřením genetického materiálu (DNA), hodnocením získaných výsledků. Preanalytické zpracování vzorků a všechna měření byla v obou skupinách prováděna identickým způsobem. Všechny vzorky krve byly sbírány ráno, nalačno, v rámci pravidelných kontrolních vyšetření, standardním postupem z antekubitální žíly.
Detekce somatických mutací
U všech pacientů byla testována přítomnost mutací JAK2 V617F, v genu MPL a CALR. Všechny analýzy byly provedeny s využitím DNA isolované z leukocytů periferní krve. U všech pacientů byla vyšetřována mutace v kodonu 617 genu JAK2 alelově specifickou polymerázovou řetězovou reakcí (AS-PCR) [25]. U všech subjektů jsme realizovali skríning exonu 9 genu CALR pomocí fragmentační analýzy. V pozitivních případech byl přesný typ mutace identifikován Sangerovou metodou sekvenování [10]. Mutace genu MPL (S505N a W515) byly vyšetřeny s využitím AS-PCR a fragmentační analýzy, detekované mutace byly ověřeny Sangerovou metodou sekvenování [9].
Biochemická analýza
Všechny biochemické analýzy byly prováděny na Oddělení klinické biochemie. Pro hodnocení kostního obratu pomocí biochemických parametrů jsme vycházeli z doporučení International Osteoporosis Foundation and International Federation of Clinical Chemistry and Laboratory Medicine in clinical studies [19]. V naší studii jsme vyšetřovali hladiny čtyř parametrů: bALP, P1NP, ICTP a OPG.
P1NP (N-terminální propeptid prokolagenu typu 1) a 25OHD (25-hydroxyvitamin D) byly stanoveny soupravami Elecsys P1NP a Elecsys Vitamin D total (Roche) na analyzátoru Cobas 6000 modul e601 metodou elektrochemiluminiscenční imunoanalýzy (ECLIA), ICTP (karboxyterminální telopeptid kolagenu typu I) soupravou UniQ ICTP RIA (Orion) radioimunoanalýzou, bALP imunoradiometrickou analýzou s užitím kitu OsteaseIRMA (BeckmanCoulter). ICTP a bALP byly měřeny automatickým více detektorovým systémem Wizard 2 model 2470 (Perkin Elmer). OPG (osteoprotegerin) byl vyšetřen automatickým analyzátorem mikrodestiček EVOLIS (Bio-Rad) pomocí soupravy Human Osteoprotegerin ELISA (Bio-Vendor), do doby vyšetření byly vzorky skladovány při teplotě -80°C.
Ostatní parametry kostního metabolismu byly stanoveny soupravami firmy Roche na analyzátorech Cobas (Hitachi). Nevyšetřovali jsme RANK a RANKL z důvodu nepřítomnosti osteolytických lézí u hodnocených pacientů a také s ohledem na závěry všech zatím publikovaných analýz neprokazujících konkomitantní snížení RANKL a poměru RANKL/OPG u Ph-MPN [16,26]. U pacientů s MF jsme hodnotili vztah mezi hematologickým fenotypem, pokročilostí choroby a markery kostního metabolismu. Srovnávací soubor tvořili nemocní s pre PMF, PV a ET bez známek fibrózy kostní dřeně.
Statistika
Rozdíl v hladině spojitých prediktorů mezi MF pacienty a kontrolami byl hodnocen pomocí Kruskal-Wallisova testu. Kruskal-Wallisův test je neparametrická analogie jednovýběrové ANOVY. Test zkoumá, zda obě datové sady pocházejí se stejné distribuce (tedy z distribuce se stejným mediánem). Pro dva vzorky je Kruskal-Wallisův test ekvivalentní Mann-Whitneymu U testu. Všechny čtyři prediktory (OPG, P1NP, bALP a ICTP) jsme zkombinovali pomocí mnohorozměrné logistické regrese. Vzájemný vztah mezi spojitými prediktory jsme analyzovali pomocí neparametrické (Spearmanovy) korelace. Vztah mezi kategorickými proměnnými byl analyzován pomocí chi kvadrát testu v kontingenčních tabulkách. Pokud byly četnosti v buňkách malé, použili jsme exaktní Fisherův faktoriálový test. Všechny testy byly provedeny na hladině statistické významnosti 0.05. Veškerá práce s daty, vizualizace a analýzy byly provedeny v softwaru MATLAB and Statistics Toolbox Release 2012b, The MathWorks, Inc., Natick, Massachusetts, United States.
VÝSLEDKY
Distribuce „driver“ mutací u MF byla následující: JAK2 V617F 18 případů (53 %), CALR (exon 9) 11 případů (32 %), MPL(W515) 5 případů (14 %). Z CALR mutovaných neslo 69 % mutaci typu 1, 7 % mutaci typu 2 a 23 % další méně frekventní typy. Palpačně hmatná splenomegalie byla v době analýzy přítomná u 68 % nemocných s mediánem velikosti 6,5cm pod levý oblouk žeberní (rozmezí 2-24). Hlavní charakteristiky studiové populace a referenční skupiny jsou shrnuty v Tab.1. K posouzení pokročilosti choroby bylo v době analýzy u všech pacientů stanoveno aktuální DIPSS skóre (Dynamic International Prognostic Scoring system, Tab.2) [27]. Hodnoty sledovaných markerů kostního metabolismu a další laboratorní výsledky jsou uvedeny v Tab.3. Výsledky TSH, parathormonu, ionizovaného calcia (Ca), fosforu (P), kreatininu a kostní isoformy alkalické fosfatázy nepřekračovaly u hodnocených subjektů referenční meze. Parametr P1NP byl elevován u 18 % MF a 15 % prePMF, ICTP u 32 % případů MF a 23 % prePMF. Hodnoty nekorelovaly s pokročilostí fibrózy ani dalšími laboratorními parametry, nevykazovaly statisticky významné rozdíly ve srovnání se skupinou PV a ET. OPG byl zvýšen nad laboratoří danou referenční mez u 53 % případů MF, 38 % prePMF a 65,5 % PV a ET, rozdíly mezi skupinami ale nebyly statisticky významné (p˃0,05). U MF korelovaly hodnoty OPG s rizikovým statusem hodnoceným dle DIPSS skóre, s významně vyšším OPG u nemocných s DIPSS skóre ≥ 3 (4,3pmol/L vs 8,8pmol/L; p=0,0043, Graf.1). Nepotvrdili jsme významnou korelaci mezi studovanými parametry kostního statusu a hodnotami laktátdehydrogenázy, solubilního receptoru pro interleukin-2, pohlavím, mutačním stavem ani splenomegalií.
Tab. 1. Klinický a laboratorní fenotyp pacientů s MF, prePMF, PV a ET v době analýzy. 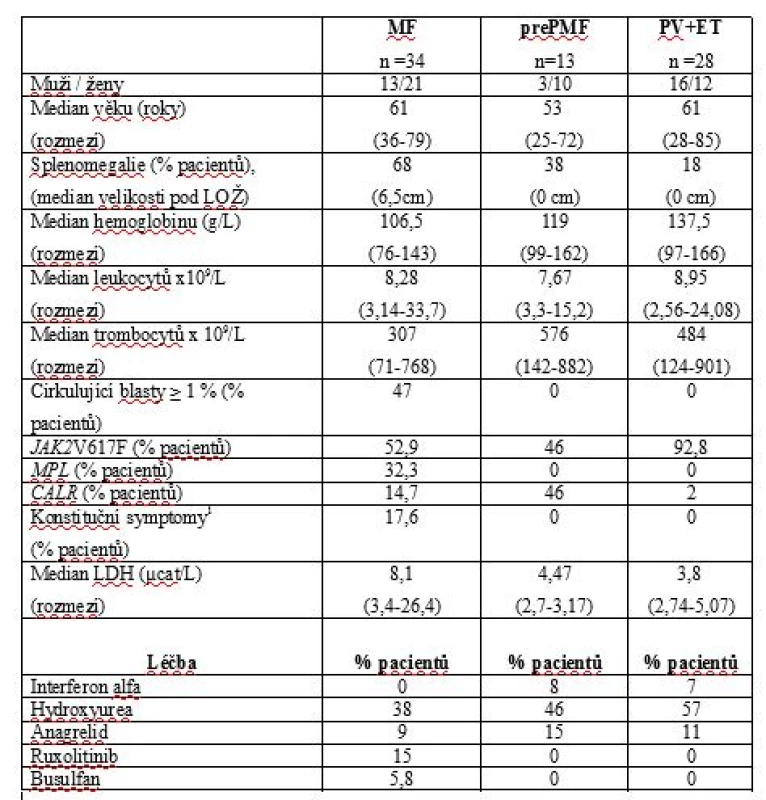
1 – konstituční symptomy: zvýšení tělesné teploty, ztráta hmotnosti a noční poty
LOŽ – levý oblouk žeberní, LDH – laktátdehydrogenáza, MF – myelofibróza, prePMF – prefibrotická fáze primární myelofibrózy, ET – esenciální trombocytemie, PV – pravá polycytemieTab. 2. DIPSS skóre u pacientů s MF a prePMF v době analýzy. 
DIPSS skóre (Dynamic International Prognostic Scoring System) hodnotí rizikové faktory:
věk > 65let (1bod), konstituční symptomy (1bod), hemoglobin < 100g/L (2body), leukocyty > 25x109/L (1bod), cirkulující blasty ≥ 1% (1bod). Riziková stratifikace: low risk (0 bodů), intermediate-1 risk (1-2body), intermediate-2 risk (3-4 body), high risk (≥ 5bodů).
Konstituční symptomy: zvýšení tělesné teploty, ztráta hmotnosti a noční potyTab. 3. Laboratorní parametry pacientů s MF, prePMF, PV a ET. 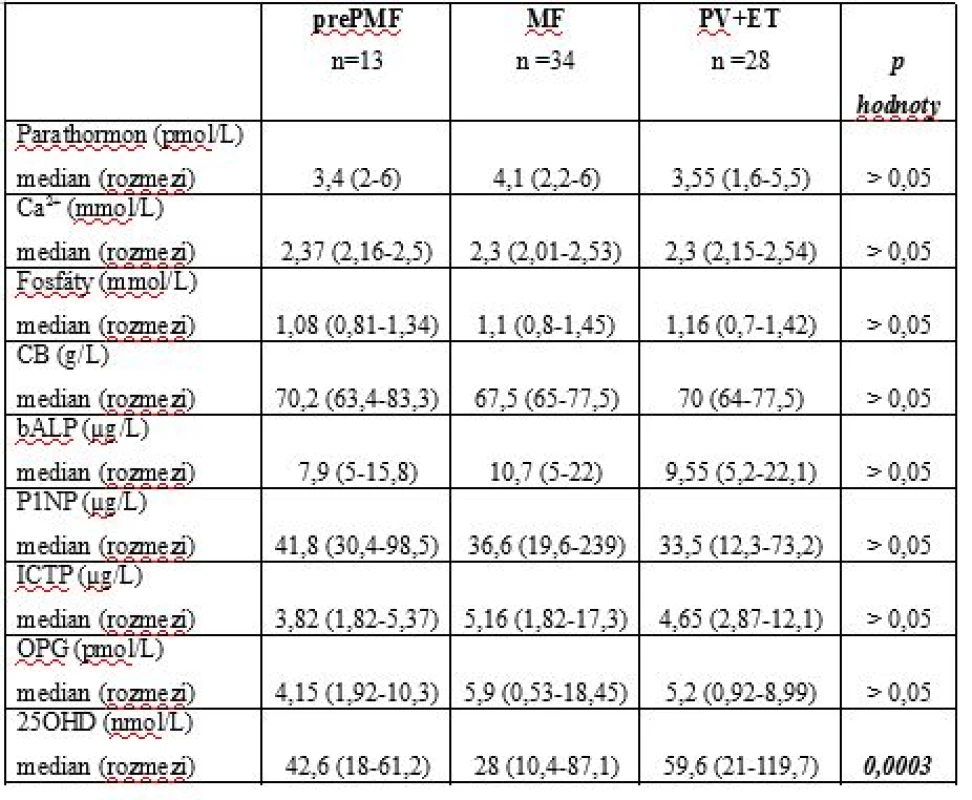
MF – myelofibróza, prePMF – prefibrotická fáze primární myelofibrózy, ET – esenciální trombocytémie, PV – pravá polycytémie, 25OHD – 25-hydroxyvitamin D, Ca2+- calcium, CB – celková bílkovina, P1NP - N-terminální propeptid prokolagenu typu 1, ICTP (karboxyterminální telopeptid kolagenu typu I), bALP - kostní izoenzym alkalické fosfatázy, OPG – osteoprotegerin Graf 1. Hodnoty osteoprotegerinu (OPG) u pacientů s myelofibrózou. 
U myelofibrózy korelují hodnoty OPG s pokročilostí choroby dle DIPSS skóre, s významně vyšším OPG u nemocných s intermediate-2 a vysokým rizikem (p=0,0043). DIPSS – Dynamic International Prognostic Scoring System Medián plasmatických koncentrací 25OHD byl následující: u MF 28nmol/L (rozmezí 10,4 – 87,1), upre-PMF 42,6nmol/L (rozmezí 18 – 61,2), u PV a ET 59,6nmol/L (rozmezí 21 – 119,7). Deficit 25OHD byl častěji zaznamenán ve skupině MF (v 96 %). Pacienti s MF mají také signifikantně nižší hladiny 25OHD ve srovnání s prePMF a skupinou PV a ET (28nmol/L vs 42,6nmol/L vs 59,6nmol/L; p=0,0003, Graf.2). U MF korelují sérové koncentrace 25OHD s pokročilostí choroby, s významně nižší hladinou 25OHD u nemocných s DIPSS skóre ≥ 3 (24nml/L vs 38,4nmol/L; p=0,05, Graf.3). Pro relativně nízký počet zaznamenaných událostí nemůžeme statisticky relevantně zhodnotit vliv deficitu 25OHD na OS ve skupině MF.
Graf 2. Tíže deficitu vitaminu D v závislosti na typu Ph-MPN. 
Pacienti s myelofibrózou mají signifikantně nižší hladiny 25OHD ve srovnání s prePMF a skupinou PV/ET (p=0,0003).
PV – pravá polycytemie, ET – esenciální trombocytémie, Ph-MPN - Philadelphia chromosome negativní myeloproliferativní nemoci, 25OHD – 25-hydroxyvitamin DGraf 3. Tíže deficitu vitaminu D v závislosti MF hodnocené dle DIPSS skóre. 
Sérové koncentrace 25OHD korelovaly s pokročilostí choroby hodnocené dle DIPSS skóre, s významně nižší hladinou 25OHD u MF s DIPSS skóre ≥ 3 (p=0,05).
DIPSS – Dynamic International Prognostic Scoring System, 25OHD – 25-hydroxyvitamin D MF – myelofibrózaDISKUZE
Markery kostní remodelace - v současném písemnictví byl kostní status u MF studován pouze na poměrně malých počtech pacientů a ve většině případů srovnáván se zdravou populací [16-18,26,28]. Závěry dříve publikovaných studií navíc nejsou jednotné. V naší práci jsme vyšetřovali parametry kostního obratu ve větším souboru MF a hodnotili jejich přínos pro běžnou klinickou praxi. Výsledky jsme srovnávali s ostatními Ph-MPN s cílem identifikovat laboratorní marker reflektující přítomnost fibrózy kostní dřeně. Diamond a kol. popisují zvýšení jak bALP (marker kostní formace), tak ICTP (marker kostní resorpce) na 4 kazuistických případech MF [29]. Další práce shodně prokazuje vyšší hodnoty ICTP u nemocných s MF [30]. Farmer a kol. ve svém souboru 18 pacientů s MF popsali signifikantní elevaci P1NP, ale nepotvrdili zvýšení hodnot bALP, ani markerů kostní resorpce [18]. V naší kohortě MF jsme také neprokázali zvýšení bALP. P1NP a ICTP byly zvýšeny nad referenční mez jen u části nemocných, hodnoty nekorelovaly s pokročilostí choroby ani dalšími laboratorními či klinickými parametry, byly srovnatelné jako u prePMF nebo PV/ET. Testované plasmatické markery zřejmě nejsou dostatečně citlivé pro rutinní neinvazivní monitorování stupně fibrózy kostní dřeně. Wang a kol. a Kreipe a kol. popisují vyšší expresi OPG (měřením sérové hladiny OPG a OPG mRNA v kulturách stromálních buněk kostní dřeně) u pokročilé MF oproti ostatním MPN a kontrolní skupině zdravých probandů [17,26]. Shodně s dříve publikovanými studiemi jsme potvrdili zvýšení OPG u většiny pacientů s MF, současně ale také u prePMF a PV/ET skupiny, rozdíly mezi skupinami nebyly statisticky významné. U MF hodnoty OPG korelovaly s rizikovým statusem hodnoceným dle DIPSS skóre, s významně vyšším OPG u pacientů s vysokým a středním-2 rizikem (p=0,0043). Naše výsledky podporují hypotézu, že zvýšená produkce osteoprotegerinu bude důležitým faktorem pro rozvoj fibrózy kostní dřeně u Ph-MPN, ale také se nejeví jako vhodný klinický prediktor, pomocí něhož bychom neinvazivně odlišili MF od prefibrotického stádia nebo ostatních Ph-MPN.
Limitací naší práce může být skutečnost, že biopsie kostní dřeně nebyly realizovány přesně v době odběrů vzorků krve k vyšetření kostního statusu a nelze vyloučit, že u některých pacientů od poslední biopsie mohlo dojít k progresi fibrózy. Pro celkově relativně nízký počet pacientů, nemůžeme statisticky relevantně zhodnotit vliv jednotlivých typů specifické léčby MF na hodnoty indikátorů kostního statusu.
Vitamin D – Pardanani uvádí častější výskyt deficitu vitaminu D u pacientů s PMF a PV, nepotvrdil ale korelaci mezi tíží deficitu a klinickými či laboratorními charakteristikami pacientů s Ph-MPN (věk, mutační stav, transfuzní závislost, DIPSS-Plus skóre, hodnoty hemoglobinu, leukocytů, trombocytů, cirkulujících blastů), ani vliv na OS [31]. Naproti tomu recentní práce hodnotící význam vitaminu D u myeloproliferativních chorob naznačují, že 25OHD může mít odlišný prognostický význam u pacientů léčených různými typy léčby. Radujkovic a kol. popisuje u pacientů s myelodysplastickým syndromem a vyšším vitaminem D před zahájením terapie lepší celkové přežití po první linií hypometylační léčby
5-azacitidinem. Současně in vitro prokázal, že konkomitantní podávání vysokých dávek vitaminu D potencuje antiproliferační efekt 5-azacitidinu [32]. Dřívější studie s limitovaným počtem pacientů s MF sice nepotvrdily terapeutický efekt substituce vitaminem D, avšak aplikace adekvátních dávek vitaminu D byla u použitých preparátů limitována rozvojem hyperkalcémie [33-35].
Další studie na zvířecích modelech přinášejí důkazy o schopnosti vitaminu D snižovat aktivaci STAT 3 a STAT 1 proteinů a tím i produkci proinflamatorních cytokinů [36,37]. V našem souboru koreluje přítomnost fibrózy a stádium dle DIPSS skóre s hladinou vitaminu D, s nižšími hodnotami 25OHD u pacientů s rozvinutou fibrózou (p=0,0003) nebo DIPSS skóre ≥ 3 (p=0,05). Pozorovali jsme signifikantně nižší sérové koncentrace 25OHD u MF oproti prePMF a skupině PV a ET (p=0,0003). S ohledem na tato zjištění a skutečnost, že se vitamin D spolupodílí na inhibici JAK/STAT signální dráhy, vyvstává aktuální potřeba ověřit jeho prognostický význam a přínos suplementace v současné éře JAK-inhibitorů prospektivními studiemi.
ZÁVĚR
Hlubší poznání patogeneze fibrózy kostní dřeně umožní nejen zpřesnit klasifikaci Ph-MPN, ale také snížit potřebu invazivních vyšetření a zlepšit monitoraci nemocných. Ani jeden z testovaných parametrů reflektujících kostní status (bALP, ICTP, P1NP) se ale v běžné klinické praxi nejeví jako přínosný pro sledování rozvoje fibrózy u Ph-MPN populace. Zvýšená exprese osteoprotegerinu, podílející se na inhibici osteoklastů, endoteliální proliferaci a neoangiogenezi, zřejmě hraje podstatnou roli v patogenezi fibrózy kostní dřeně, nicméně není vhodným markerem k neinvazivní monitoraci rozvoje a progrese fibrózy dřeně. Trepanobiopsie zůstává stále nezastupitelným vyšetřením v diagnostice a sledování vývoje MF. Vitamin D je multifunkční pro-hormon s širokým spektrem účinků, kterým se v posledních letech věnuje značná pozornost. Jeho deficit bývá spojován s vyšším rizikem vzniku maligních onemocnění a horší prognózou nemocných [20,22]. V našem souboru pozorujeme u pacientů s MF signifikantně nižší sérové koncentrace vitaminu D ve srovnání s prePMF a ostatními Ph-MPN, tíže jeho deficitu u MF koreluje s pokročilostí nemoci. Hlubší poznání efektu kalcitriolu na nádorový klon může determinovat jeho potenciální využití v léčbě MF. Hypotézu o možném synergistickém působení vitaminu D s JAK-inhibitory bude nutné ověřit budoucími multicentrickými studiemi s dostatečně velkou kohortou pacientů.
ZKRATKY
PMF/ prePMF – primární myelofibróza/ prefibrotická fáze primární myelofibrózy
MF – myelofibróza
PV – pravá polycytémie
ET – esenciální trombocytémie
Ph-MPN – Philadelphia chromosome negativní myeloproliferativní nemoci
JAK2 V617F – mutace genu pro Janusovu kinázu 2 v pozici 617
MPL – Myeloproliferative leukemia virus oncogene
CALR – kalretikulin
STAT – Signal transducer and activator of transcription
AS-PCR – alelově specifická polymerázová řetězová reakce
OS – celkové přežití
LDH – laktátdehydrogenáza
DIPSS – Dynamic International Prognostic Scoring System
OPG – osteoprotegerin
RANK/ RANKL – receptor activator of NF-ĸB/ receptor activator of NF-ĸB ligand
P1NP – N-terminální propeptid prokolagenu typu 1
ICTP – karboxyterminální telopeptid kolagenu typu I
ALP – kostní izoenzym alkalické fosfatázy
25HOD – 25-hydroxyvitamin D
TSH – tyreotropní hormon hypofýzy
Ca2+ – kalcium
Čestné prohlášení autorů
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve středu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Podíl autorů na přípravě rukopisu
MP – příprava rukopisu
TS, AH, TP – podíleli se na revizi, úpravách, doplnění a finální verzi rukopisu
JN, MD – vyšetření mutačních stavů nemocných
PP, JP – realizace vyšetření biochemických parametrů
Poděkování
Tato práce byla podpořena grantovým projektem IGA_LF_2018_004.
Korespondence:
Miroslava Palová, MUDr.
Hemato-onkologická klinika Fakultní nemocnice Olomouc
I. P. Pavlova 6
Olomouc, 779 00
Doručeno do redakce dne: 8. 7. 2018.
Přijato do tisku dne: 2. 10. 2018.
Publikováno elektronicky dne: 20. 11. 2018.
Zdroje
1. Tefferi A. Primary myelofibrosis: 2017 update on diagnosis, risk stratification, and management. Am J Hematol 2016;91(12):1262–1271.
2. Mesa RA, Silverstein MN, Jacobsen SJ, Wollan PC, Tefferi A. Population-based incidence and survival figures in essential thrombocythemia and agnogenic myeloid metaplasia: an Olmsted County study, 1976-1995. Am J Hematol 1999;61(1):10–15.
3. Anía BJ, Suman VJ, Sobell JL, Codd MB, Silverstein MN, Melton LJ. 3rd. Trends in the incidence of polycythemia vera among Olmsted County, Minnesota residents, 1935-1989. Am J Hematol 1994;47(2):89–93.
4. Bonicelli G, Abdulkarim K, Mounier M, et al. Leukocytosis and thrombosis at diagnosis are associated with poor survival in polycythaemia vera: a population-based study of 327 patients. Br J Haematol 2013;160(2):251–254.
5. Moulard O, Mehta J, Fryzek J, et al. Epidemiology of myelofibrosis, essential thrombocythemia, and polycythemia vera in the European Union. Eur J Haematol 2014;92(4):289–297.
6. Barbui T, Thiele J, Passamonti F, et al. Survival and disease progression in essential thrombocythemia are significantly influenced by accurate morphologic diagnosis: an international study. J Clin Oncol 2011;29(23):3179–3184.
7. Reilly JT, McMullinMF, Beer PA, et al. Guideline for the diagnosis and management of myelofibrosis. Br J Haematol 2012;158(4):453–471.
8. Kralovics R, Passamonti F, Buser AS, et al. A gain-of-function mutation of JAK2 in myeloproliferative disorders. N Engl J Med 2005;352(17):1779–1790.
9. Pikman Y, Lee BH, Mercher T, et al. MPLW515L is a novel somatic activating mutation in myelofibrosis with myeloid metaplasia. PLoS Med 2006;3(7):e270.
10. Klampfl T, Gisslinger H, Harutyunyan AS, et al. Somatic mutations of calreticulin in myeloproliferative neoplasms. N Engl J Med 2013;369(25):2379–2390.
11. Barbui T, Thiele J, Gisslinger H, Finazzi G, Vannucchi AM, Tefferi A. The 2016 revision of WHO classification of myeloproliferative neoplasms: clinical and molecular advances. Blood Rev 2016;30(6):453–459.
12. Mesa RA, Steensma DP, Pardanani A, et al. A phase 2 trial of combination low-dose thalidomide and prednisone for the treatment of myelofibrosis with myeloid metaplasia. Blood 2003;101 : 2534–2541.
13. Hofbauer LC, Schoppet M. Clinical implications of the osteoprotegerin/RANKL/RANK system for bone and vascular diseases. Jama 2004;292(4):490–495.
14. Chagraoui H, Sabri S, Capron C, Villeval JL, Vainchenker W, Wendling F. Expression of osteoprotegerin mRNA and protein in murine megakaryocytes. Exp Hematol 2003;31(11):1081–1088.
15. Collin-Osdoby P, Rothe L, Anderson F, Nelson M, Maloney W, Osdoby P. Receptor activator of NF-kappa B and osteoprotegerin expression by human microvascular endothelial cells, regulation by inflammatory cytokines, and role in human osteoclastogenesis. J Biol Chem 2001;276(23):20659–20672.
16. Bock O, Loch G, Schade U, et al. Osteosclerosis in advanced chronic idiopathic myelofibrosis is associated with endothelial overexpression of osteoprotegerin. Br J Haematol 2005;130(1):76–82.
17. Wang JC, Hemavathy K, Charles W, et al. Osteosclerosis in idiopathic myelofibrosis is related to the overproduction of osteoprotegerin (OPG). Exp Hematol 2004;32(10):905–910.
18. Farmer S, Vestergaard H, Hansen S, et al. Bone geometry, bone mineral density, and micro-architecture in patients with myelofibrosis: a cross-sectional study using DXA, HR-pQCT, and bone turnover markers. Int J Hematol 2015;102(1):67–75.
19. Vasikaran S, Cooper C, Eastell R, et al. International osteoporosis foundation and international federation of clinical chemistry and laboratory medicine position on bone marker standards in osteoporosis. Clin Chem Lab Med 2011;49(8):1271–1274.
20. Lai YH, Fang TC. The pleiotropic effect of vitamin D. ISRN Nephrol 2013; DOI: 10.5402/2013/898125.
21. Trump DL, Deeb KK, Johnson CS. Vitamin D: considerations in the continued development as an agent for cancer prevention and therapy. Cancer J 2010;16(1):1–9.
22. Kulling PM, Olson KC, Olson TL, Feith DJ, Loughran TP jr. Vitamin D in hematological disorders and malignancies. Eur J Haematol 2017;98(3):187–197.
23. Maalmi H, Ordonez-Mena JM, Schottker B, Brenner H. Serum 25-hydroxyvitamin D levels and survival in colorectal and breast cancer patients: systematic review and meta-analysis of prospective cohort studies. Eur J Cancer 2014;50(8):1510–1521.
24. Wang W, Li G, He X, et al. Serum 25-hydroxyvitamin D levels and prognosis in hematological malignancies: a systematic review and meta-analysis. Cell Physiol Biochem 2015;35(5):1999–2005.
25. Baxter EJ, Scott LM, Campbell PJ, et al. Acquired mutation of the tyrosine kinase JAK2 in human myeloproliferative disorders. Lancet 2005;365(9464):1054–1061.
26. Kreipe H, Büsche G, Bock O, Hussein K. Myelofibrosis: molecular and cell biological aspects. Fibrogenesis Tissue Repair 2012;5(suppl 1):S21.
27. Passamonti F, Cervantes F, Vannucchi AM, et al. A dynamic prognostic model to predict survival in primary myelofibrosis: A study by the IWG-MRT (International Working Group for Myelofibrosis Research and Treatment). Blood 2010;115(9):1703–1708.
28. Agarwal A, Morrone K, Bartenstein M, Zhao Z, Verma A, Goel S. Bone marrow fibrosis in primary myelofibrosis: pathogenic mechanism and the role of TGF-ß. Stem Cell Investig 2016;3 : 5.
29. Diamond T, Smith A, Schnier R, Manoharan A. Syndrome of myelofibrosis and osteosclerosis: a series of case reports and review of the literature. Bone 2002;30(3):498–501.
30. Jensen MK, Riisbro R, Holten-Andersen MN, et al. Collagen metabolism and enzymes of the urokinase plasminogen activator system in chronic myeloproliferative disorders: correlation between plasma-soluble urokinase plasminogen activator receptor and serum markers for collagen metabolism. Eur J Haematol 2003;71(4):276–282.
31. Pardanani A, Drake MT, Finke C, et al. Vitamin D insufficiency in myeloproliferative neoplasms and myelodysplastic syndromes: clinical correlates and prognostic studies. Am J Hematol 2011;86(12):1013–1016.
32. Radujkovic A, Schnitzler P, Ho AD, Dreger P, Luft T. Low serum vitamin D levels are associated with shorter survival after first-line azacitidine treatment in patients with myelodysplatic syndrome and secondary oligoblastic acute myeloid leukemia. Clin Nutr 2017;36(2):542–551.
33. Wieslander SB, Mortensen BT, Binderup L, Nissen NI. 1 alpha(OH)D3 (ETALPHA) treatment and receptor studies in 16 patients with chronic and myeloproliferative disorders. Eur J Haematol 1987;39(1):35–38.
34. Tsatalas C, Curtoglou G, Fotopoulos D, Halkia P, Vyzantiadis AT, Sinakos Z. 1 alpha(OH)D3 treatment and procollagen III (PC III) studies in idiopathic myelofibrosis. Haematologica 1989;74(6):559–562.
35. Foa P, Maiolo AT, Cortellaro M, et al. 1,25-Dihydroxyvitamin D3 in the treatment of idiopathic thrombocythemia and myelofibrosis. Haematologica 1990;75(3):294–295.
36. Wang Q, Li H, Xie H, et al. 25-Hydroxyvitamin D3 attenuates experimental periodontitis through downregulation of TLR4 and JAK1/STAT3 signaling in diabetic mice. J Steroid Biochem Mol Biol 2013;135 : 43–50.
37. Muthian G, Raikwar HP, Rajasingh J, Bright JJ. 1,25 Dihydroxyvitamin-D3 modulates JAK-STAT pathway in IL-12/INFgamma axis leading to Th1 response in experimental allergic encephalomyelitis. J Neurosci Res 2006;83(7):1299–1309.
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň- Subkutánne vs. intravenózne imunoglobulíny u pacientov s CLL
- Nejasný stín na plicích – kazuistika
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



