-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Farmakokinetika v léčbě hemofilie
Pharmacokinetics in haemophilia treatment
Haemophilia is an inborn X-linked bleeding disorder, which is caused by a deficiency of coagulation factor VIII in haemophilia A and factor IX in haemophilia B. Currently, the standard treatment regimen for severe forms of the disease is the prophylactic intravenous administration of the deficient factor. The initial dosage is assessed identically for all persons with haemophilia and subsequently modified empirically depending on the individual bleeding phenotype. Due to the large inter-individual variability in the response, to the administered factor, this „one-size-fits-all “approach is now deemed obsolete. Treatment individualization and personalization is gaining in importance. One of the most important ways to individualize treatment is using a pharmacokinetic approach. Pharmacokinetics of the administered concentrate provide to detailed and individually specific information regarding treatment efficacy. Based on pharmacokinetics, it is possible to adjust treatment – dose, frequency of infusions and even the choice of factor concentrate. It is complicated to perform a classic pharmacokinetic assessment, which is why a population pharmacokinetic approach is becoming more and more attractive. Using sophisticated population models, it is possible to assess the individual pharmacokinetics from the limited number of samples obtained in different situations. Population pharmacokinetic models are easily available for clinicians as internet-based applications. Apart from assessing the individual pharmacokinetics, they can be used to evaluate the efficacy of the current dosing regimen and generate a new one based on the required frequency of application, trough level or dose. Mobile applications, which will allow each patient to gain access, to his/her current factor level are being developed. With this knowledge, a haemophiliac will be able to assess the suitability of a planned activity at any given moment and schedule their activities in advance according to the estimated protection level.
Keywords:
haemophilia – individualization – pharmacokinetics – population pharmacokinetics
Autoři: J. Máchal
Působiště autorů: Oddělení dětské hematologie FN Brno a LF MU Brno
Vyšlo v časopise: Transfuze Hematol. dnes,25, 2019, No. 3, p. 230-240.
Kategorie: Souhrnné/edukační práce
Souhrn
Hemofilie je vrozené X-vázané krvácivé onemocnění, jehož příčinou je nedostatek koagulačního faktoru VIII (hemofilie A) či IX (hemofilie B). Současným standardem léčby její těžké formy je profylaktické intravenózní podávání koncentrátu chybějícího faktoru. Dávkování se stanovuje totožným způsobem pro všechny osoby s hemofilií a následně se empiricky upravuje podle pacientova krvácivého fenotypu. Vzhledem k významné interindividuální variabilitě v odpovědi na podávaný lék se však tento přístup dnes jeví již jako překonaný. Současný trend se jednoznačně ubírá směrem k individualizaci a personalizaci terapie, jedním z hlavních způsobů individualizace léčby hemofilie je farmakokinetický přístup. Farmakokinetika podaného koncentrátu poskytuje detailní a pro daného jedince specifické informace o efektu léčby. Na jejím základě lze podle potřeby upravit léčebné schéma – interval léčby, její dávkování, případně i výběr přípravku. Vzhledem k náročnosti stanovení farmakokinetických parametrů klasickým způsobem se v současnosti dynamicky rozvíjí disciplína populační farmakokinetiky. Díky sofistikovaným populačním modelům lze vytvořit odhad individuální farmakokinetiky každého pacienta i z velmi omezeného počtu vzorků získaných v různých situacích. Modely populační farmakokinetiky jsou pro klinické pracovníky dostupné prostřednictvím internetového rozhraní. Kromě stanovení individuální farmakokinetiky tyto modely dále umožňují zhodnotit efektivitu stávající léčby a vygenerovat nový dávkovací režim na základě zadaných parametrů (četnost aplikací, prahová hladina faktoru, dávka). Ve vývoji jsou v současnosti i mobilní aplikace, které umožní každému pacientovi získat přehled o aktuální hladině faktoru. Díky těmto informacím bude pacient moci zhodnotit, zda je určitá činnost vhodná v daný moment, a své aktivity dopředu plánovat v závislosti na míře ochrany před krvácením.
Klíčová slova:
hemofílie – individualizace – farmakokinetika – populační farmakokinetika
ÚVOD
Hemofilie je vrozené krvácivé onemocnění s X-vázanou dědičností, které má incidenci asi 1 : 5000 narozených chlapců v případě hemofilie A a 1 : 30 000 narozených chlapců v případě hemofilie B [1]. Léčba její těžké formy je v současné době založena na profylaktickém nitrožilním podávání koncentrátů chybějícího faktoru krevního srážení (FVIII u hemofilie A a FIX u hemofilie B) [2, 3]. Profylaxe vychází z pozorování, že pacienti se středně těžkou hemofilií (s reziduální aktivitou faktoru VIII či IX ≥ 1 %) mají nižší frekvenci krvácení a nižší výskyt s nimi spojených komplikací, zejména postižení kloubů, než ti s hemofilií těžkou (< 1 %) [4]. Jednoznačný přínos profylaxe v prevenci krvácení, a tedy i následného vzniku hemofilické artropatie, potvrdila celá řada studií, včetně velkých randomizovaných z poslední doby [5]. Ze studií publikovaných v posledních letech se rovněž zdá, že hladina faktoru 1 %, která byla původně jako cílová určena z empirických důvodů na základě pozorování minimálního výskytu spontánního krvácení do kloubů u pacientů s aktivitou FVIII > 1 % a rovněž částečně z důvodů ekonomických [6], nemusí být dostatečná k prevenci všech spontánních krvácení u všech pacientů. V současnosti se tak hovoří o nových prahových hodnotách, kompletní ochranu před krvácením nejspíše zajišťuje až aktivita udržovaná na hladinách okolo 10–12 % [7].
Klasický přístup k léčbě hemofilie A, kdy „jedna velikost (dávky) má padnout každému“, může v současnosti představovat například podávání 20–40 IU/kg faktoru VIII se standardním poločasem každý druhý den [3]. Při předpokládaném vzestupu aktivity faktoru VIII o 2 % na každou podanou 1 IU/kg a při průměrném poločase faktoru 12 hodin, by toto dávkování u „průměrného“ hemofilika mělo stačit k udržení aktivity FVIII na úrovni ≥ 1 %. Takové léčebné schéma obvykle vyžaduje empirickou úpravu dávky faktoru v závislosti na krvácivém fenotypu každého pacienta metodou pokus-omyl, kdy je po čase dosaženo přijatelné míry krvácivých epizod. Tento přístup, který by se dal nazvat empirickým, přispěl k všeobecnému rozšíření profylaxe jako metody volby pro léčbu hemofilie [8]. Jeho nevýhodami jsou výskyt četnějších krvácivých epizod v období nastavování terapie a absence znalostí o hladinách faktoru, kterých touto léčbou dosahujeme.
Již delší dobu je známo, že existují významné rozdíly v odpovědi na podávanou profylaktickou léčbu mezi jednotlivými pacienty. Tato variabilita je způsobena mnoha faktory, důležitou roli hraje v první řadě klinicky popsaná náchylnost jednotlivého pacienta ke krvácení. Tuto náchylnost je možné charakterizovat jako farmakodynamickou variabilitu odpovědi na podaný preparát – mechanismus, který spojuje aktivitu podaného faktoru v plazmě a klinickou odpověď na léčbu. Farmakodynamickou variabilitu představuje mnoho jednotlivých faktorů, jako jsou např. počet předchozích krvácení, míra postižení kloubního aparátu a přítomnost cílových kloubů hemofilika, úroveň tělesné aktivity aj. Tato variabilita vysvětluje, proč mají někteří pacienti udržovaní na totožné cílové hladině vysoký počet krvácení a jiní pacienti krvácení takřka nemají [9, 10].
Dalším významným zdrojem variability v odpovědi na podávanou léčbu je variabilita farmakokinetická. Podle údajů z literatury se může poločas koncentrátu faktoru VIII podaného osobě s hemofilií A pohybovat od 6 do 28,8 h [11]. Rozdíly jsou tedy větší než 200 %, a proto standardní dávkování pouze podle hmotnosti může vést k významně odlišným výsledkům u jednotlivých pacientů. U osob s hemofilií B jsou sice procentuální rozdíly méně významné (rozdíl okolo 100 %), avšak vzhledem k významně delšímu poločasu faktoru IX jsou pro volbu léčebného schématu rovněž důležité [12]. Provedené studie prokázaly, že efektivita profylaxe souvisí především s dobou, kdy aktivita podaného koncentrátu koagulačního faktoru v plazmě pacienta je nad určitými tzv. prahovými hodnotami [13], proto vzhledem k vysoké interindividuální variabilitě ve farmakokinetických parametrech může snadno nastat stav, že při shodném dávkování jsou někteří pacienti léčeni nadměrně a jiní nedostatečně.
Rovněž se zdá, že dochází k významným změnám farmakokinetických parametrů s věkem pacienta [14], především v populaci dětských pacientů s hemofilií A [15]. Farmakokinetické studie u těchto pacientů je proto vhodné provádět opakovaně v průběhu růstu, např. každé 2–3 roky tak, aby mohly být změny ve farmakokinetických parametrech zhodnoceny a využity k průběžné úpravě dávkování, která je v dětství vždy nezbytná [16].
Současný léčebný trend se jednoznačně ubírá směrem k personalizaci a individualizaci terapie [17, 18]. Jedním z hlavních způsobů individualizace a personalizace léčby hemofilie je farmakokinetický přístup. Podle farmakokinetiky podaného koncentrátu lze u daného jedince usuzovat na efekt léčby [8]. Na jejím základě lze podle potřeby upravit léčebné schéma – interval léčby, její dávkování, případně i výběr přípravku [16]. Pacient trpící hemofilií rovněž může přizpůsobit své aktivity poskytované léčbě, a maximalizovat tak její efekt (např. prováděním rizikových aktivit pouze v době, kdy je ochrana podaným koncentrátem maximální) [19]. Kombinací ideálního dávkovacího režimu a aktivit léčené osoby lze s pomocí farmakokinetiky dosáhnout i optimalizace nákladů na léčbu vynaložených [20].
V současné době jsou v Evropské unii k dispozici koncentráty rekombinantních faktorů krevního srážení, které jsou prostřednictvím molekulárních metod modifikovány tak, aby byl prodloužen jejich biologický poločas, další jsou pak v registračním procesu. Cílem je dosáhnout s použitím těchto léků trvale vyšších hladin chybějícího faktoru v krvi pacienta, a zlepšit tak účinnost profylaxe. V některých případech mohou tyto preparáty rovněž umožnit prodloužení intervalu mezi jednotlivými aplikacemi [21]. Je však nezbytné přizpůsobit volbu léčebného schématu konkrétní klinické situaci a vhodné dávkování stanovit i se znalostí individuálních farmakokinetických parametrů [16].
Z doposud známých výsledků farmakokinetických měření u faktorů s prodlouženým účinkem (EHLC – Extended Half-Life Concentrates) se totiž zdá, že inter-individuální variabilita jejich farmakokinetiky může být ještě vyšší než u standardních rekombinantních preparátů používaných doposud. Pacienti, u nichž byla provedena změna léčebného schématu z 30 IU/kg standardního preparátu obden na 30 IU/kg faktoru s prodlouženým účinkem preparátu po 72 hodinách, vykazovali kratší dobu strávenou v pásmu hladin nad 10 % a delší v pásmu pod 3 % [22]. Stanovení léčebného schématu pouze metodou pokus-omyl bez provedení farmakokinetického měření proto může vést k výrazně horším výsledkům. Význam stanovení farmakokinetických parametrů se proto bude se zaváděním těchto nových léků pravděpodobně nadále zvyšovat [16].
FARMAKOKINETIKA
Farmakokinetika je disciplínou farmakologie, která studuje absorpci, distribuci, metabolismus a eliminaci do organismu podaného léčiva, tedy i koagulačních faktorů používaných v léčbě hemofilie. Farmakokinetika faktoru VIII po jednorázovém podání s předchozí „wash-out“ periodou (časem, během něhož poklesne aktivita faktoru u pacienta k jeho přirozené hladině) může být farmakokineticky popsána pomocí dvoukompartmentového modelu. V první velmi krátké fázi, v níž dominuje distribuce, aktivita faktoru rychle stoupá, aby pak v následující delší fázi, kdy dominuje eliminace, s pomalejší dynamikou klesala až k přirozené hladině [12]. Farmakokinetické parametry, které se používají při hodnocení farmakokinetiky koncentrátů koagulačních faktorů, shrnuje tabulka 1.
Tab. 1. Nejčastěji používané farmakokinetické pojmy 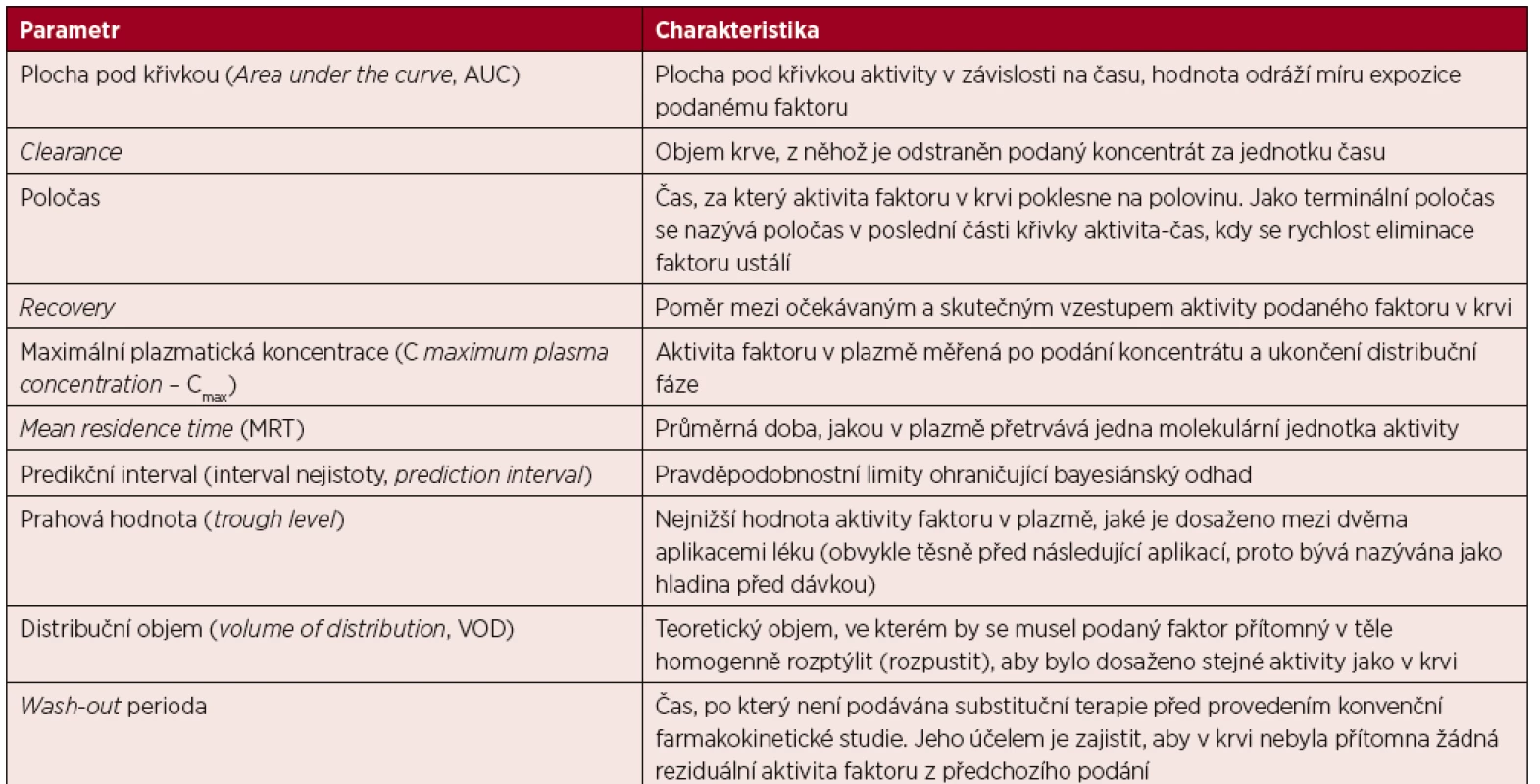
Individuální farmakokinetika
Aby bylo možné určit individuální farmakokinetický profil pacienta, je nutné provést farmakokinetické měření. Původní doporučení Mezinárodní společnosti pro trombózu a hemostázu (ISTH) z roku 2001, která vznikla zejména pro potřeby klinických studií pro registraci nových léčiv, vyžadují provedení celkem deseti až jedenácti odběrů v průběhu 48 hodin po aplikaci faktoru VIII či 72 hodin po aplikaci faktoru IX. U dětí je pak doporučeno provedení celkově alespoň pěti odběrů [23]. Tato doporučení byla původně vytvořena za účelem vzájemného porovnání jednotlivých preparátů faktoru VIII a IX. U pacientů s hemofilií, kteří již tak podstupují velké množství odběrů a aplikací, může náročnost takovéto farmakokinetické studie znamenat, že nebudou prováděny, a bude se namísto toho pokračovat v empirickém podávání koncentrátu dle hmotnosti. Tento moment je zásadní zejména u dětských pacientů, u nichž je, vzhledem ke změnám farmakokinetických parametrů v průběhu věku, žádoucí opakované provádění farmakokinetických studií. Dalším nedostatkem konvenčních farmakokinetických studií je nutnost použití standardní dávky (obvykle 50 IU/kg), která neodpovídá běžnému léčebnému schématu, a nutnost „wash-out“ periody, která potenciálně ohrožuje pacienta krvácením [8].
Populační farmakokinetika
V poslední době se rychle rozvíjí tzv. populační přístup k farmakokinetice, který využívá dat získaných od velké skupiny pacientů s hemofilií, která jsou použita současně s daty získanými ze vzorků konkrétního pacienta jako při klasické farmakokinetice, k odhadu individuálního farmakokinetického profilu. Tento přístup je založen na tzv. bayesiánské analýze a využívá se již delší dobu u různých léků pro určení terapeutických hladin. Jeho velkou výhodou je využití omezeného počtu, typicky 1–4 vzorků [24].
V případě hemofilie jsou data získaná z konvenčních farmakokinetických studií u většího množství pacientů využita k vytvoření farmakokinetického modelu. Důležitým předpokladem pro úspěšné použití bayesiánské analýzy je, že interindividuální variabilita je větší než variabilita intraindividuální, tuto charakteristiku farmakokinetické parametry koagulačních faktorů velmi dobře splňují [8]. Ke zpřesnění modelů jsou dále využívána data o popsaných kovariátách (vysvětlujících proměnných), které mají vliv na farmakokinetiku preparátu. Známými kovariátami v případě farmakokinetiky koagulačních faktorů jsou např. hladina von Willebrandova faktoru, krevní skupina, hematokrit aj. Výhodou populačního farmakokinetického modelování je dále fakt, že bere v úvahu i kovariáty dosud nepopsané, které sice nejsou popsány a kvantifikovány, ale jsou zahrnuty v datech získaných ze studované populace [25].
Aby byl populační model co nejreprezentativnější, musí zahrnovat co nejvíce dat o co nejodlišnějších pacientech (věk, hmotnost, krevní skupina, přirozená aktivita faktoru VIII/IX) i způsobech léčby (dávka, četnost podání, použitý lék). Zvláště důležitá jsou data od minoritních skupin pacientů, jako jsou malé děti nebo výrazně obézní pacienti, u nichž se mohou farmakokinetické parametry dramaticky lišit od průměrných hodnot. Populační model pak integruje data od jednoho pacienta s daty získanými z celé populace pacientů, aby z nich odvodil farmakokinetické parametry u konkrétního jedince [8].
Velkou výhodou tohoto přístupu oproti tradiční farmakokinetice je, že vyžaduje výrazně nižší počet vzorků od jednotlivých pacientů a nevyžaduje „wash-out“ periodu, která může pacienta ohrozit krvácením. Díky datům získaným z malého počtu krevních odběrů mohou být pomocí populačních modelů s velkou přesností odhadnuty farmakokinetické parametry u jednotlivých pacientů. Tato data dále poskytují východisko pro rozhodování o volbě léčebného schématu u konkrétního pacienta [24].
Klinicky použitelný farmakokinetický model by měl být schopen poskytnout odhad predikované hladiny faktoru v plazmě v jakémkoli čase a rovněž i údaj o přesnosti takového odhadu. S použitím těchto údajů je možné určit dobu, za níž je vhodné podat další dávku léku (např. když hladina faktoru poklesne na úroveň 3 % či 1 %) a též dobu, kdy je zajištěna dobrá ochrana (hladina vyšší než 12 %), a pacient se může věnovat činnostem, jež nesou vyšší riziko krvácení. Čas do dosažení těchto zásadních hodnot se jeví jako významné praktické vodítko pro modifikaci léčby. V případě, že se přistupuje ke změně léčebného schématu, s využitím modelu je možné odhadnout farmakokinetické parametry u daného jedince a zhodnotit přínos daných změn [8] – tabulka 2.
Tab. 2. Doporučené postupy pro stanovení populační farmakokinetiky 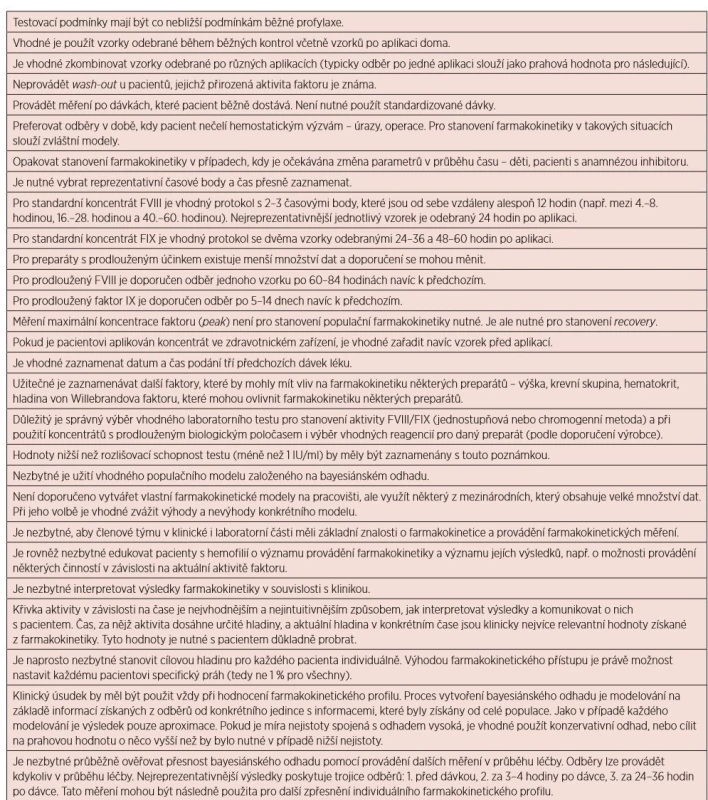
(upraveno podle Iorio A. et al. [16]) Limitace populační farmakokinetiky
Jako v případě každé metody regresní analýzy, modely populační farmakokinetiky dovolují relativně přesně odhadnout individuální parametry u pacienta, jehož charakteristiky odpovídají populaci, která byla použita jako zdrojová pro vytvoření modelu. V případech, kdy se pacient od této populace významným způsobem odlišuje, je přesnost modelu nejistá (malé děti, výrazně obézní, pacienti podstupující operační výkon, pacienti s historií inhibitoru apod.) [26, 27]. Jak bylo zmíněno již výše, je proto důležité vytvořit co největší populační modely s co nejodlišnějšími pacienty v různých situacích, aby bylo dosaženo dostatečné přesnosti modelování i v těchto méně obvyklých situacích [8].
Další situací, kdy populační modely nemusejí být dostatečným vodítkem, je případ, kdy úroveň plazmatické aktivity faktoru u pacienta plně nekoresponduje s klinickou odpovědí – počtem krvácení. Řízení léčby pouze podle znalosti farmakokinetických parametrů bez přihlédnutí k farmakodynamice u konkrétního pacienta proto nejspíše nepovede k volbě optimální léčebné strategie [28].
Dalším momentem, který může limitovat použití populačních modelů pro stanovení dávkování, je situace, kdy je podle stanovených farmakokinetických parametrů vhodné výrazně zvýšit frekvenci podávané substituce. Podle provedených studií jsou k tomuto kroku pacienti ochotni přistoupit pouze v případě, že dojde k významnému snížení počtu krvácivých epizod [29]. „Compliance“ pacienta je zásadním faktorem, který ovlivňuje celkovou úspěšnost léčby.
Existující modely populační farmakokinetiky
Vývoj vlastního farmakokinetického modelu je komplikovaný a vyžaduje značné odborné i finanční zdroje, a je proto mimo možnosti naprosté většiny center zabývajících se léčbou hemofilie. V současné době existuje několik volně dostupných farmakokinetických modelů. První skupinou jsou modely vytvářené výrobci konkrétních antihemofilických přípravků, např. myPKFiT (Baxter/Shire), NuPreviq (Octapharma), jenž původně vznikaly zejména ve snaze podpořit registraci nových antihemofilických přípravků [30]. Tyto farmakokinetické modely jsou v praxi dobře použitelné a uživatelsky přívětivé a nabízí kvalitní výstup v podobě farmakokinetických údajů u pacienta užívajícího konkrétní lék. Jejich hlavní limitací je, že jsou produktově specifické, a nedovolují tak analýzu farmakokinetiky jiných preparátů.
Od roku 2016 začaly práce na populačním farmakokinetickém modelu WAPPS-Hemo. Jedná se o nekomerční mezinárodní výzkumný projekt, jehož cílem je vytvoření robustního modelu, který by zahrnoval co největší množství léků i klinických situací. Tato databáze umožňuje participujícím klinickým centrům prostřednictvím internetu zaslat údaje od konkrétního pacienta a následně obdržet odhad jeho farmakokinetických parametrů. Poskytované údaje jsou generovány farmakokinetickým software a následně vždy validovány odborníkem. V současnosti má model k dispozici data z více než 260 center od více než 3 000 pacientů a 6 500 jednotlivých farmakokinetických profilů.
Pro zvýšení adherence jednotlivých pacientů k léčbě je v současné době ve vývoji rovněž mobilní aplikace myWAPPS. Každý pacient, u něhož budou k dispozici farmakokinetické údaje z modelu WAPPS, si bude moci po stažení této aplikace prohlédnout údaje o svém farmakokinetickém profilu. Po zadání data a času poslední aplikace léku, zobrazí aplikace pacientovi odhad aktuální hladiny faktoru v daný moment, a může tak pomoci při rozhodování pacienta o vhodnosti provádění rizikových aktivit. Je možné zobrazit odhad hladiny i v budoucnu, a aktivity tak plánovat. Aplikace rovněž pacientovi zobrazí upozornění o vhodnosti podání další dávky léku a případně ho upozorní, že k ní v plánovaném intervalu nedošlo. Obdobnou mobilní aplikaci vyvíjí i dodavatel myPKFiT, ale je rovněž omezena pouze na produkty daného výrobce.
Klinické využití
Výstupem z farmakokinetického modelu je report, jehož příklady jsou na obrázku 1 pro myPKFiT a obrázek 2pro WAPPS-Hemo. V reportu je uvedena křivka odhadované aktivity v závislosti na čase s určitým konfidenčním intervalem. Křivka je interaktivní, je proto možné po najetí na určité místo zjistit odhadovanou hladinu v kterýkoliv časový moment. Druhou částí reportu jsou odhady jednotlivých farmakokinetických parametrů a pro praxi užitečné odhady časových intervalů do dosažení určité hladiny. Program WAPPS-Hemo vždy nabízí tři typy odhadů konzervativní („conservative“), vyvážený („balanced“) a optimistický („optimistic“). Vzhledem k tomu, že každý report je individuálně validován odborníkem mohou být jeho součástí i doporučení ohledně vhodné interpretace (např. při velké míře nejistoty či nesrovnalostech v zadaných parametrech) – obrázek 3.
Obr. 1. Report z modelu myPKFiT 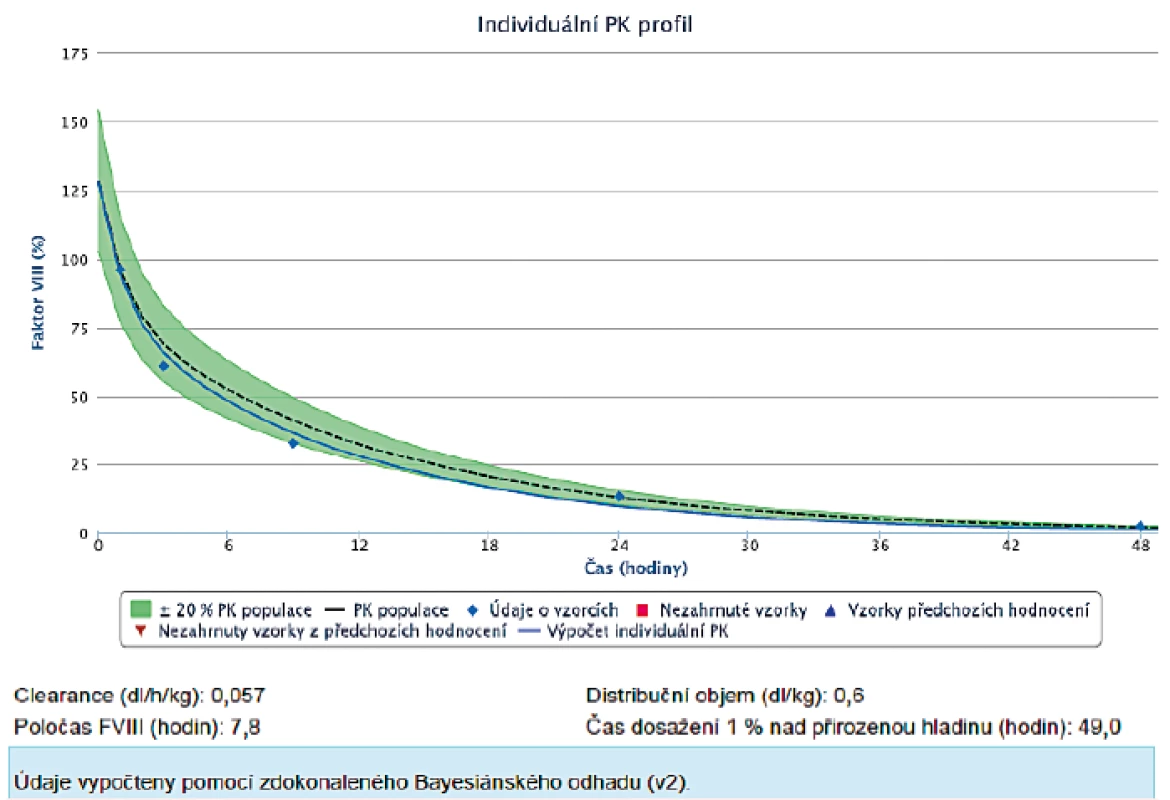
Obr. 2. Report z modelu WAPPS-Hemo 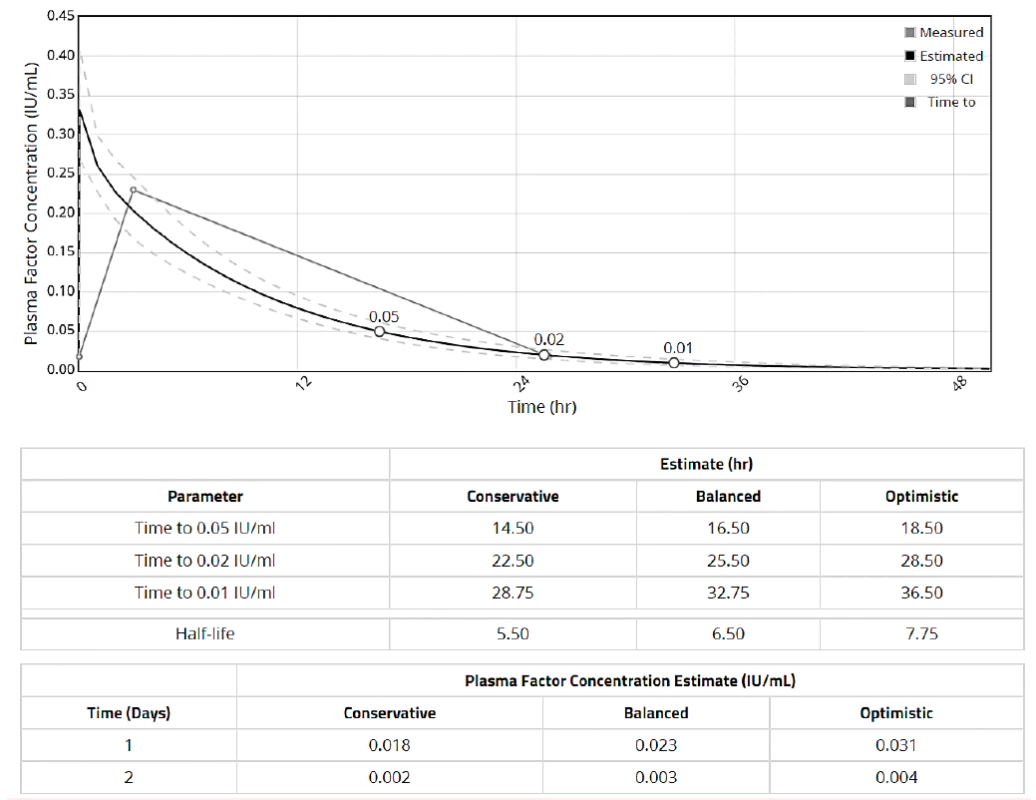
Obr. 3. Report WAPPS-Hemo s doporučením pro interpretaci 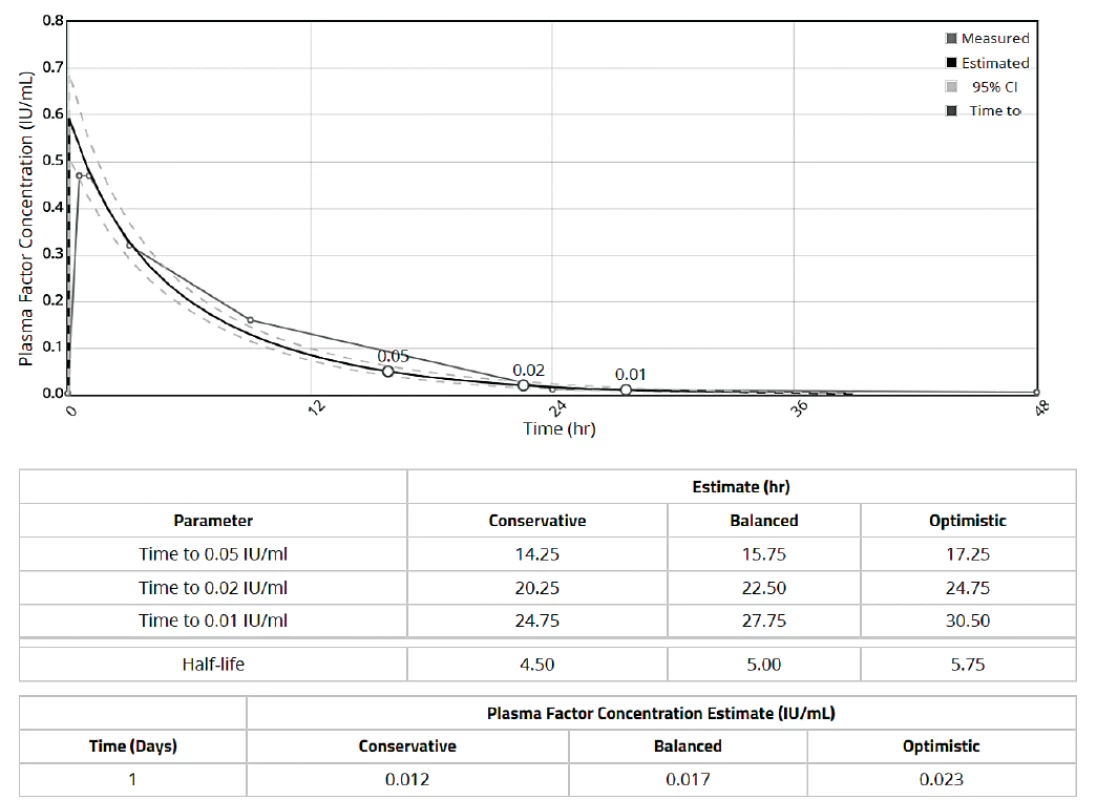
Další funkcí, kterou programy podporují je možnost zhodnocení stávajícího dávkovacího schématu a vytvoření nového podle zadaných parametrů. Obrázek 4 ukazuje vyhodnocení stávajícího schématu u pacienta. Je vidět, že při daném dávkování se hladina po celou dobu udrží nad 1 %. Ale v případě, že u takového pacienta dochází k opakovaným krvácením, je vhodné uvažovat o zvýšení cílové hladiny, např. na 3 %. Obrázek 5 ilustruje, že pro zachování stejné míry ochrany při nepravidelném dávkování 3krát týdně musí být dávka podaná před delším časovým intervalem mnohonásobně vyšší, což by vedlo k výraznému zvýšení spotřeby léku u takového pacienta a ke zbytečně vysoké maximální hladině. V tomto případě je proto vhodné pacienta převést na pravidelné podávání obden. Při malém zvýšení spotřeby preparátu (3000 → 3500 IU týdně) je tak dosaženo výrazného zlepšení ochrany před krvácením – obrázek 6.
Obr. 4. Zhodnocení dávkovacího schématu pacienta dle modelované farmakokinetiky 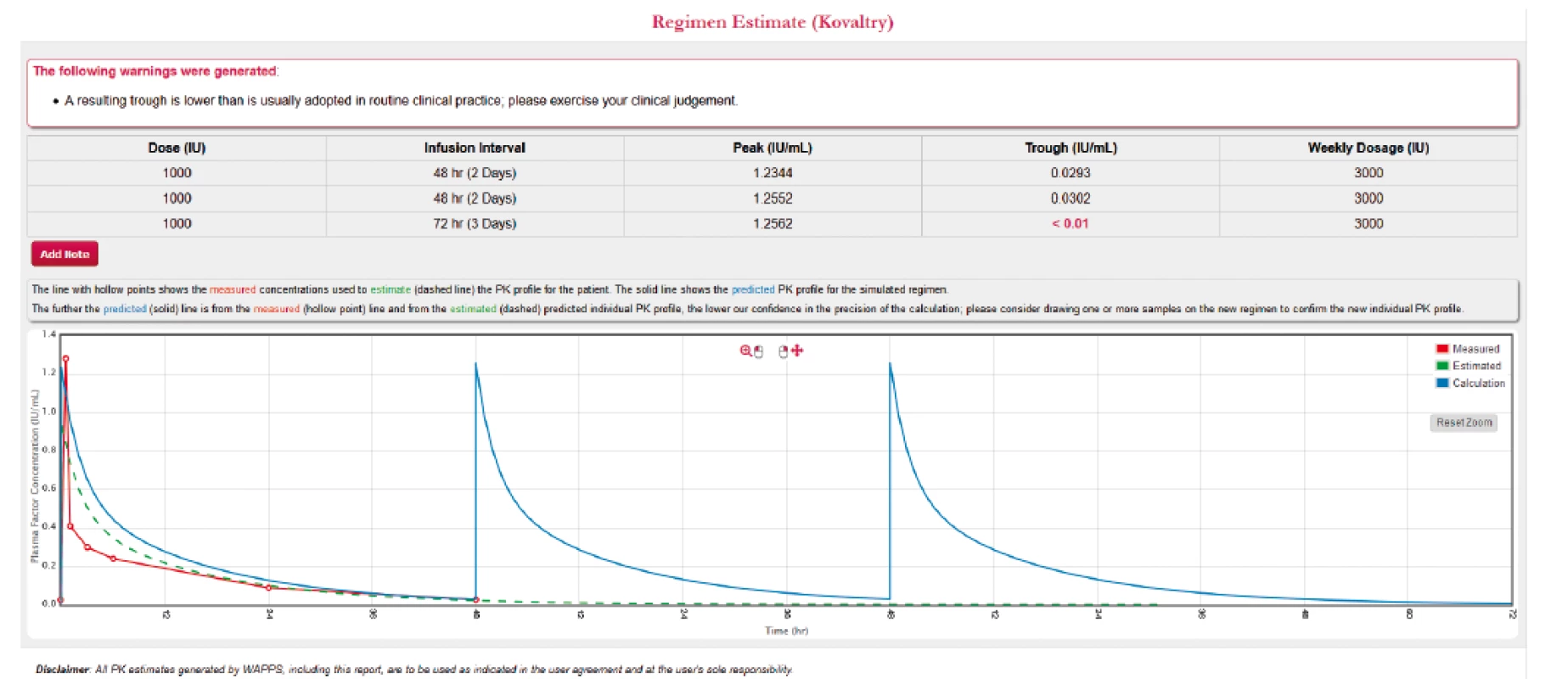
Obr. 5. Upravené dávkování 3x týdně s cílovou hladinou 3 % 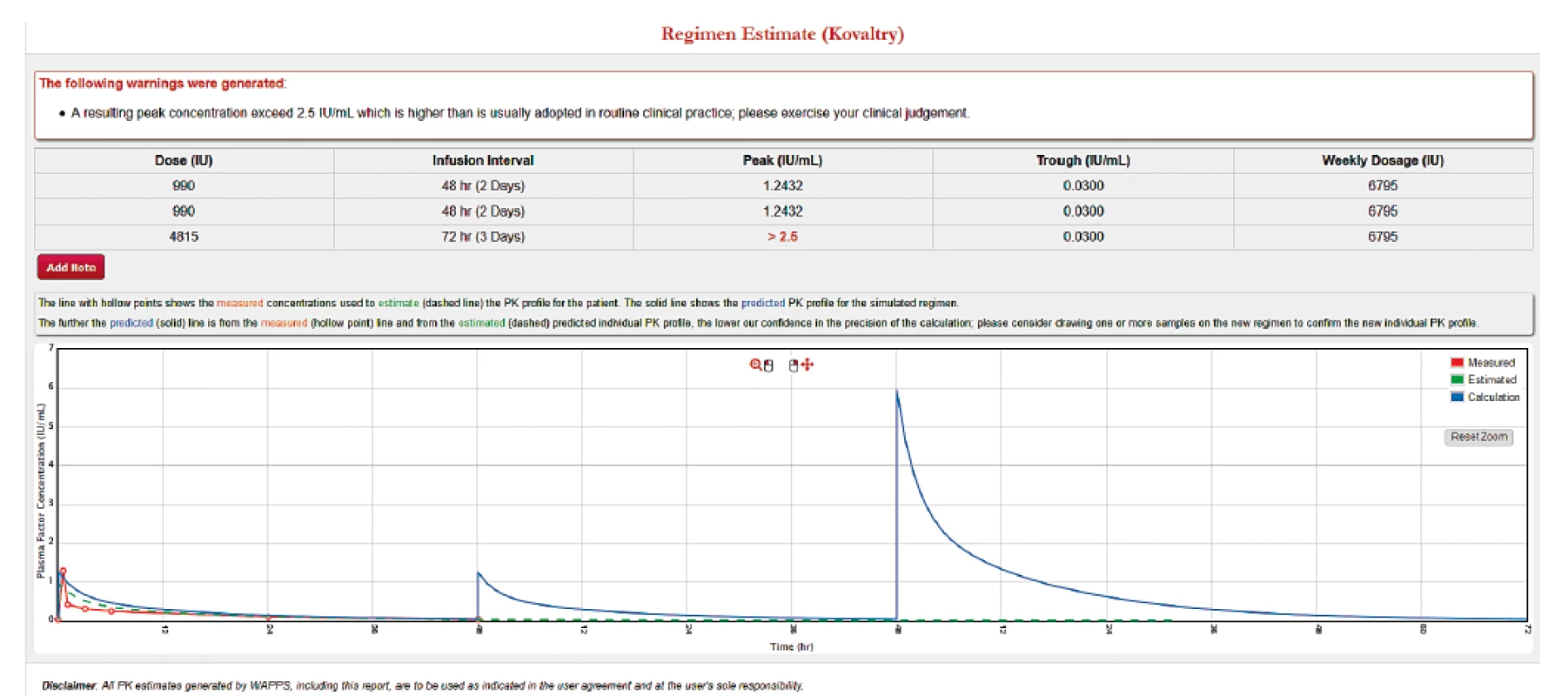
Obr. 6. Upravené dávkování obden s cílovou hladinou 3 % 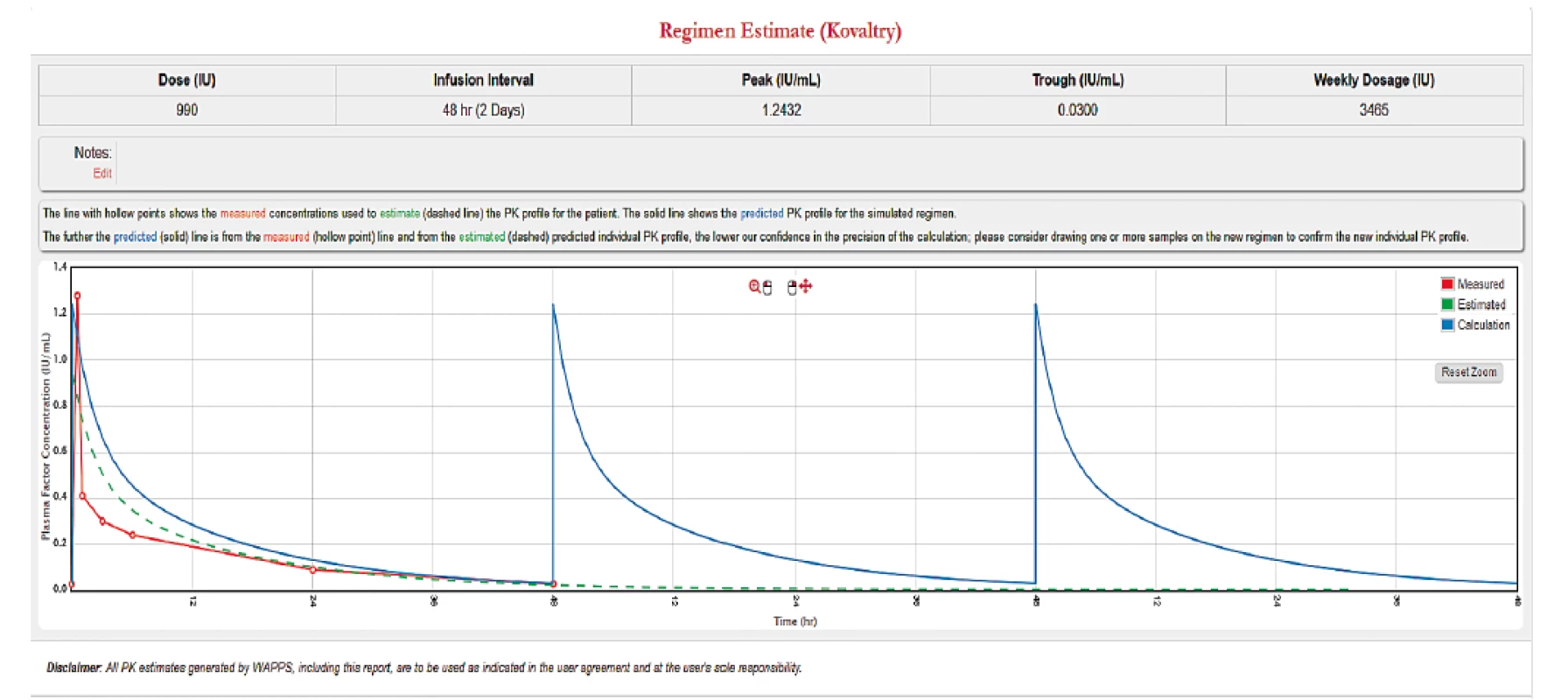
Tabulka 3 ilustruje změny farmakokinetických parametrů v průběhu věku u jednoho pacienta. Data získaná z opakovaných farmakokinetických měření tvoří časovou řadu. Je zjevné, že farmakokinetické parametry se u dětských pacientů v průběhu věku mění, proto je měření vhodné provádět opakovaně v intervalu 2–3 roky a zohlednit tyto změny i při úpravách léčby [16]. Na Oddělení dětské hematologie Fakultní nemocnice Brno v současnosti probíhá příprava pilotního projektu, který se bude zabývat studiem změn farmakokinetických parametrů u pacientů s hemofilií A v průběhu dětského věku.
Tab. 3. Změny farmakokinetických parametrů u konkrétního pacienta v průběhu dětského věku 
Diskuse
Využití farmakokineticky řízené léčby představuje způsob, který může lékař využít pro analýzu léčebného režimu u pacienta s hemofilií a jako východisko pro jeho případné úpravy [16]. Velkou výhodou tohoto přístupu je, že lékaři poskytne konkrétní data o míře ochrany pacienta v průběhu času a není se třeba již spoléhat pouze na odhady a eventuálně zpětné hodnocení prostřednictvím míry krvácení, což je často hodnocení velmi subjektivní. Pro pacienta pak generovaný profil představuje vizualizaci, která usnadňuje pochopení jeho léčby, a při použití některé z farmakokinetických aplikací pro mobilní telefony potom i možnost okamžitě zjistit svou hladinu v daný moment a adekvátně upravit své případné aktivity [19].
Základní nevýhodu farmakokinetického přístupu prozatím představuje malé povědomí klinických lékařů o jeho možnostech a nedostatek zkušeností s interpretací získaných dat. Věříme však, že s postupem času bude obojí vzrůstat a farmakokinetika se stane nedílnou součástí péče o pacienty s hemofilií.
Klinické využití farmakokinetiky v léčbě hemofilie představuje prozatím stále relativně novou metodu a jako taková s sebou nese některé prozatím nezodpovězené otázky a případná rizika. Jednou z otázek je, vzhledem k pravděpodobnostnímu charakteru modelu, jeho fungování v méně obvyklých situacích – u velmi malých dětí, velmi starých lidí, výrazně obézních pacientů, při operačních výkonech apod. V takových situacích je vždy zapotřebí obezřetný přístup k získaným datům a jejich následné klinické aplikaci. Avšak s nárůstem počtu hodnocených farmakokinetik (a tedy i farmakokinetik méně obvyklých) bude přesnost modelů i v těchto situacích postupně vzrůstat [8].
Při využití farmakokinetiky se objevují otázky, zda její široké rozšíření nepovede ke zvýšení spotřeby léků, a tedy ekonomické náročnosti léčby. Žádná z dosud provedených studií toto nepotvrdila, avšak jedná se jistě o věc, která si zaslouží další sledování [20]. Tlak pacientů či jejich rodičů na udržování vyšší prahové hodnoty jsme zatím nezaznamenali – pacienti, kteří trvají na vysoké míře ochrany, ji mají zajištěnu již nyní, což farmakokinetické studie u nich většinou zpětně potvrdily. Farmakokinetika tedy spíše optimalizuje použité zdroje, než by vedla k snížení, či výraznému zvýšení jejich čerpání. Tam, kde však farmakokinetika odhalí nedostatečnou stávající léčbu, jistě k navýšení nákladů dojde. Z toho ale nelze vinit farmakokinetiku jako takovou.
Zájem pacientů a jejich rodičů o farmakokinetiku je na našem oddělení značný. Všichni pacienti s těžkou hemofilií nad přibližně 2 roky věku mají provedeno farmakokinetické vyšetření a v průběhu letošního roku budou vybaveni mobilními farmakokinetickými aplikacemi a instruováni o jejich použití. Velký zájem na našem oddělení je však téměř určitě výrazně ovlivněn věkovou skladbou dotyčných – rodiče jako mladí dospělí a pacienti-teenageři jsou zvyklí používat mobilní aplikace. Zájem zejména starších pacientů o tyto nové metody nebude s nejvyšší pravděpodobností tak vysoký.
Jedním z potenciálních rizik v situaci, kdy se farmakokinetický přístup začlení do běžné klinické praxe, by mohlo být přílišné spoléhání na farmakokinetiku bez korelace s klinickými informacemi. Je třeba si uvědomit, že farmakokinetická data představují pouze jedno z vodítek, které společně s dalšími informacemi – klinický stav pacienta, četnost krvácení, míra aktivity – teprve vedou k návrhu na vytvoření individuálního dávkovacího režimu.
Závěr
Vzhledem k narůstajícím požadavkům na individualizaci léčby hemofilie se stanovení farmakokinetických parametrů pomocí populačních modelů stává důležitým nástrojem, který pomáhá zvolit optimální profylaktickou strategii u každého pacienta. Farmakokinetické modelování je v současnosti díky existenci mezinárodních projektů přístupných z internetového rozhraní použitelné i v rutinní klinické praxi center zabývajících se léčbou hemofilie. Vzhledem k vlastnostem nových koncentrátů rekombinantních faktorů krevního srážení s prodlouženým účinkem bude význam farmakokinetického přístupu pro volbu terapeutického režimu pravděpodobně nadále vzrůstat.
Čestné prohlášení
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Doručeno do redakce dne 9. 11. 2018.
Přijato po recenzi dne 3. 6. 2019.
MUDr. Jan Máchal
Oddělení dětské hematologie
Fakultní nemocnice Brno
Černopolní 9
613 00 Brno
e-mail: machal.jan@fnbrno.cz
Zdroje
1. Mannucci PM, Tuddenham EG. The hemophilias – from royal genes to gene therapy. N Engl J Med 2001;344(23):1773–1779.
2. Berntorp E, Shapiro AD. Modern haemophilia care. Lancet 2012;379(9824):1447–1456.
3. Fischer K, Ljung R. Primary prophylaxis in haemophilia care: guideline update 2016. Blood Cells Mol Dis 2017;67 : 81–85.
4. Ahlberg A. Haemophilia in Sweden VII. incidence, treatment and prophylaxis of arthropathy and other musculo-skeletal manifestations of haemophilia A and B. Acta Orthop Scand 1965 : 77 : 3–132.
5. Manco-Johnson MJ, Abshire TC, Shapiro AD, et al. Prophylaxis versus episodic treatment to prevent joint disease in boys with severe hemophilia. N Engl J Med 2007;357(6):535–544.
6. Skinner MW. WFH: closing the global gap – achieving optimal care. Haemophilia 2012; 4 : 1–12.
7. den Uijl IE, Fischer K, Van Der Bom JG, et al. Analysis of low frequency bleeding data: the association of joint bleeds according to baseline FVIII activity levels. Haemophilia 2011;17(1):41–44.
8. Iorio A, Edginton A, Blanchette V, et al. Performing and interpreting individual pharmacokinetic profiles in patients with hemophilia A or B: rationale and general considerations. Res Pract Thromb Haemost 2018;2(3):535–548.
9. Carcao MD, Iorio A. Individualizing factor replacement therapy in severe hemophilia. Semin Thromb Hemost 2015;41(8):864–871.
10. Ljung R, Fischer K, Carcao M, et al. Practical considerations in choosing a factor VIII prophylaxis regimen: role of clinical phenotype and trough levels. Thromb Haemost 2016;115(5):913–920.
11. Fijnvandraat K, Peters M, ten Cate JW. Inter-individual variation in half-life of infused recombinant factor VIII is related to pre-infusion von Willebrand factor antigen levels. Br J Haematol 1995;91(2):474–476.
12. Björkman S, Carlsson M. The pharmacokinetics of factor VIII and factor IX: methodology, pitfalls and applications. Haemophilia 1997;3(1):1–8.
13. Collins PW, Fischer K, Morfini M, et al. Implications of coagulation factor VIII and IX pharmacokinetics in the prophylactic treatment of haemophilia. Haemophilia 2011;17(1):2–10.
14. Björkman S, Folkesson A, Jönsson S. Pharmacokinetics and dose requirements of factor VIII over the age range 3–74 years: a population analysis based on 50 patients with long-term prophylactic treatment for haemophilia A. Eur J Clin Pharmacol 2009;65(10):989–998.
15. Björkman S, Oh M, Spotts G, et al. Population pharmacokinetics of recombinant factor VIII: the relationships of pharmacokinetics to age and body weight. Blood 2012;119(2):612–618.
16. Iorio A, Blanchette V, Blatny J, et al. Estimating and interpreting the pharmacokinetic profiles of individual patients with hemophilia A or B using a population pharmacokinetic approach: communication from the SSC of the ISTH. J Thromb Haemost 2017;15(12):2461–2465.
17. Ar MC, Baslar Z, Soysal T. Personalized prophylaxis in people with hemophilia A: challenges and achievements. Expert Rev Hematol 2016;9(12):1203–1208.
18. Blatný J, Zapletal O, Köhlerová S, et al. Farmakokinetika jako nástroj k optimalizaci léčby osob s hemofilií. Transfuze Hematol dnes 2014;20(4):103–106.
19. Iorio A. Using pharmacokinetics to individualize hemophilia therapy. 2017;1 : 595–604.
20. Pasca S, Milan M, Sarolo L, et al. PK-driven prophylaxis versus standard prophylaxis: when a tailored treatment may be a real and achievable cost-saving approach in children with severe hemophilia A. Thromb Res 2017;157 : 58–63.
21. Peyvandi F, Garagiola I, Seregni S. Future of coagulation factor replacement therapy. J Thromb Haemost 2013;11(1):84–98.
22. Gringeri A, Wolfsegger M, Steinitz KN, et al. Recombinant full-length factor VIII (FVIII) and extended half-life FVIII products in prophylaxis – new insight provided by pharmacokinetic modelling. Haemophilia 2015;21(3):300–306.
23. Lee M, Morfini M, Schulman S, et al. The design and analysis of pharmacokinetic studies of coagulation factors – International society on thrombosis and haemostasis, inc. Dostupné na www: www.isth.org/members/group_content_view.asp?group=100348&id=159244.
24. Garraffo R, Iliadis A, Cano JP, et al. Application of Bayesian estima-tion for the prediction of an appropriate dosage regimen of amikacin. J Pharm Sci 1989;78(9):753–757.
25. Hazendonk HCAM, van Moort I, Mathôt RAA, et al. Setting the stage for individualized therapy in hemophilia: what role can pharmacokinetics play?” Blood Rev 2018;32(4):265–271.
26. Jankovičová D, Šteňo D, Prigancová T, et al. Manažment veľkých operácií u pacientov s hemofíliou A kontinuálnou infúziou a bolusovými injekciami FVIII – farmakokinetický prístup k liečbe. Transfuze Hematol dnes 2017;23(2):61–72.
27. Morongová A., Jankovičová D, Bátorová A, et al. Analýza zhody vyšetrenia inhibítorov FVIII Bethesda metódou a modifikovanou Nijmegen metódou a vplyv hraničných titrov inhibítorov na farmakodynamiku a farmakokinetiku FVIII u pacientov s hemofíliou A. Transfuze Hematol dnes 2016;22(3):172–181.
27. Iorio A, Fischer K, Blanchette V, et al. Tailoring treatment of haemophilia B: accounting for the distribution and clearance of standard and extended half-life FIX concentrates. Thromb Haemost 2017;117(6):1023–1030.
28. Lock J, de Bekker-Grob EW, Urhan G, et al. Facilitating the implementation of pharmacokinetic-guided dosing of prophylaxis in haemophilia care by discrete choice experiment. Haemophilia 2016;22(1):1–10.
29. McEneny-King A, Iorio A, Foster G, et al. The use of pharmacokinetics in dose individualization of factor VIII in the treatment of hemophilia A. Expert Opin Drug Metab Toxicol 2016;12(11):1313–1321.
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2019 Číslo 3- Nejasný stín na plicích – kazuistika
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficitmi v reálnej praxi
-
Všetky články tohto čísla
- Klinické obrazy histiocytózy z Langerhansových buněk v dospělosti
- Farmakokinetika v léčbě hemofilie
- Osteonekróza čelisti, atypické fraktury kostí a další méně časté nežádoucí účinky bisfosfonátů
- Nábor dárců krvetvorných buněk do Českého národního registru dárců dřeně v letech 2013–2017 (demografická data)
- Externí hodnocení kvality stanovení CD34+ buněk v České a Slovenské republice – dlouhodobé zkušenosti z osmiletého období
- Sirolimus – alternativa pro léčbu autoimunitní hemolytické anémie způsobené tepelnými protilátkami (WAIHA)
- Revakcinace dospělých pacientů po alogenní transplantaci krvetvorných buněk: doporučení České leukemické skupiny – pro život
- Monografie profesora Adama a kolektivu: Maligní onemocnění, psychika a stres
- Profesor MUDr. Jaroslav Čermák, CSc., 65letý
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Osteonekróza čelisti, atypické fraktury kostí a další méně časté nežádoucí účinky bisfosfonátů
- Revakcinace dospělých pacientů po alogenní transplantaci krvetvorných buněk: doporučení České leukemické skupiny – pro život
- Farmakokinetika v léčbě hemofilie
- Profesor MUDr. Jaroslav Čermák, CSc., 65letý
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



