Genová editace systémem CRISPR/Cas9 a její využití v hematologii
Genome editing using the CRISPR/Cas9 system and its application in haematology
Genome editing is considered to be the biggest advance in molecular genetics since the discovery of the polymerase chain reaction. This method enables the introduction of changes in a target DNA sequence with unprecedented accuracy and efficiency. Since it greatly facilitates the study of genes and biological processes, it has been employed in basic research across all biotechnology fields. The CRISPR/Cas9 (Clustered Regularly Interspaced Short Palindromic Repeats/CRISPR Associated Protein 9) system is the most widely used genome-editing platform. Due to its relatively easy construction and high efficiency, this system has revolutionized the field of molecular biology and also holds enormous potential in translational medicine. The aim of this review is to introduce genome-editing technique and summarize the most important applications of this unique technology in research, diagnostics and treatment of haematologic diseases.
Keywords:
genome editing – CRISPR/Cas9 – haematology – monogenic disorders
Autori:
M. Racková 1,2; V. Bakardjieva-Mihaylova 1,2; M. Slámová 1,2; L. Boublíková 1,2; K. Škvárová Kramarzová 1,2
Pôsobisko autorov:
CLIP – Childhood Leukaemia Investigation Prague
1; Klinika dětské hematologie a onkologie, 2. lékařská fakulta, Univerzita Karlova a FN Motol, Praha
2
Vyšlo v časopise:
Transfuze Hematol. dnes,1, 2019, No. Online only 1, p. 1-19.
Súhrn
Genová editace je považována za největší pokrok v molekulárně genetických metodách od objevu polymerázové řetězové reakce. Díky této technologii dnes můžeme provádět cílené změny v nukleotidové sekvenci DNA s mnohem větší přesností a účinností, než bylo doposud možné. Využití nachází genová editace téměř ve všech biotechnologických oborech, neboť výrazně zjednodušuje studium funkce genů a biologických procesů. Nejpopulárnějším nástrojem genové editace je tzv. systém CRISPR/Cas9 (Clustered Regularly Interspaced Short Palindromic Repeats/CRISPR Associated Protein 9), který si díky své relativně snadné konstrukci a vysoké účinnosti vydobyl výsadní postavení v molekulární biologii a jeho ohromný potenciál se již začíná uplatňovat i v translační medicíně. Cílem tohoto souhrnného článku je představení genové editace a shrnutí nejvýznamnějších aplikací této unikátní technologie ve výzkumu, diagnostice a léčbě hematologických onemocnění.
Klíčová slova:
genová editace – CRISPR/Cas9 – hematologie – monogenně podmíněná onemocnění
Úvod
Již krátce po objevu molekuly DNA a odhalení podstaty geneticky podmíněných onemocnění se vědci začali zajímat o možnost provádět cílené změny v genomu a jím kódované genetické informaci. První pokusy o manipulaci buněčné DNA založené na vkládání genů do genomu pomocí virových vektorů prokázaly účinnost této strategie zejména v základním výzkumu [1]. Při snaze o aplikaci stejného přístupu v léčbě pacientů s geneticky podmíněnými onemocněními v rámci tzv. genové terapie se však objevilo mnoho překážek, jejichž odstranění si vyžádalo desítky let výzkumu, než byly dosaženy první klinicky relevantní výsledky [2,3]. Navzdory tomu, že tato strategie nalezla rozsáhlé uplatnění v základním výzkumu a byla úspěšně použita i pro terapeutické účely, její možnosti úpravy DNA jsou velmi omezené a pro mnohé účely nedostačující.
Ve snaze vyvinout nástroj umožňující provádět širší spektrum změn v sekvenci DNA se vědci inspirovali přímo v živých buňkách a to konkrétně v procesu tzv. homologní rekombinace („homology-directed repair“, HDR), který buňka využívá k opravě DNA s poškozenou sekvencí. Během něj dochází k opravě DNA výměnou poškozeného úseku za “zdravou” DNA sesterské chromatidy či homologního chromozomu [4]. Prvotní pokusy o napodobení tohoto procesu v laboratorním prostředí za účelem vnesení přesné změny nukleotidové sekvence do genomu buňky, však vykazovaly velmi nízkou účinnost. Výrazné zlepšení přinesl až objev technologie tzv. genové editace, která dokáže dramaticky zvýšit (až 40 000 krát) frekvenci a úspěšnost HDR a tím i celého procesu [5]. Genová editace tak způsobila revoluci v molekulární biologii a své uplatnění nachází v základním i aplikovaném výzkumu napříč takřka všemi biotechnologickými obory.
Nejlákavějším využitím genové editace je bezesporu oprava kauzálních mutací u pacientů s geneticky podmíněnými chorobami. Velkou část těchto chorob tvoří onemocnění postihující hematopoézu a imunitní systém, pro něž je mnohdy jedinou definitivní léčbou alogenní transplantace krvetvorných kmenových buněk (TKD). Zkušenosti s odběrem a manipulací s krvetvornými buňkami a také se samotnou léčbou těchto pacientů pomocí TKD dělají z hematologických onemocnění v současné době nejatraktivnější cíl pro aplikaci terapeutických přístupů založených na genové editaci. Svůj velký přínos pro hematologii však genová editace ukazuje i v základním výzkumu při studiu fyziologických a patologických procesů v hematopoéze, a také v diagnostice atypických poruch hematopoetického vývoje či imunitního systému.
Genová editace
Technologie genové editace je dosud nejúčinnější metodou pro provedení cílené změny sekvence DNA v buňce. Její úspěch tkví ve schopnosti stimulovat pomocí speciálních molekulárních nástrojů buněčné mechanismy opravy DNA a donutit buňku je použít k provedení změny sekvence DNA. Těmito nástroji jsou tzv. místně-specifické nukleázy, které lze navrhnout a vytvořit tak, aby dokázaly nalézt v genomu vybranou oblast DNA a v přesně stanoveném místě ji rozštěpit. Během následné opravy dvouřetězcového zlomu DNA, který je naprosto klíčový pro celý proces genové editace, dojde k požadované změně nukleotidové sekvence [5]. Mezi místně-specifické nukleázy řadíme tzv. meganukleázy [6], „zinc-finger“ nukleázy (ZFN) [7], „transcription activator-like effector nucleases“ (TALENs) [8] a nukleázy systému CRISPR/Cas9 („clustered regularly interspaced short palindromic repeats (CRISPR)/CRISPR-associated protein 9“) [9–11], které se vyznačují vysokou účinností a zejména jednoduchostí konstrukce, což je hlavní důvod proč mezi ostatními editačními nástroji jednoznačně dominují.
CRISPR/Cas9
Systém CRISPR/Cas9 byl poprvé objeven u bakterií, kde je součástí jejich adaptivního imunitního systému [9,10,12,13]. Díky nukleázám CRISPR/Cas9, kódovaným bakteriálním genomem, jsou bakterie schopny specificky rozštěpit a degradovat nukleovou kyselinu viru, který buňku infikoval. Vzhledem k nutnosti bakterie adaptovat svou protivirovou imunitu na nejrůznější invadující viry, je tento systém schopný rychle a jednoduše změnit cíl štěpení na sekvence nukleových kyselin jiných virů [9]. Tyto unikátní vlastnosti systému CRISPR/Cas9 se ukázaly být velice výhodné pro jeho přenos do laboratorního prostředí a využití v genovém inženýrství, neboť umožňují rychle a elegantně vytvořit nukleázy štěpící nejrůznější oblasti DNA v eukaryotických buňkách [11].
Nukleáza CRISPR/Cas9 je ribonukleoproteinový komplex (RNP) složený z proteinu Cas9 s endonukleázovou aktivitou a krátké molekuly RNA (u jednosložkového systému se jedná o tzv. single guide RNA; sgRNA) (obr. 1) [9,14]. Tato RNA se na základě klasického Watson-Crickovského párování naváže na cílovou sekvenci genomické DNA, kde zprostředkuje štěpení nukleázou Cas9. Specificitu této vazby určuje tzv. „guide“ sekvence, což je 20ti nukleotidový úsek v sgRNA, který lze navrhnout tak, aby byl komplementární k cílové sekvenci v DNA, která má být změněna. Podmínkou pro úspěšné navázání nukleázy systému CRISPR/Cas9 na DNA je zároveň přítomnost tzv. motivu PAM za cílovou sekvencí [9,10]. Jedná se o úsek 2-6 nukleotidů, přičemž pro nejpoužívanější nukleázu Cas9, získanou ze Streptococcus pyogenes (SpCas9), je tímto motivem trojice nukleotidů NGG (kdy N představuje jakýkoliv nukleotid).
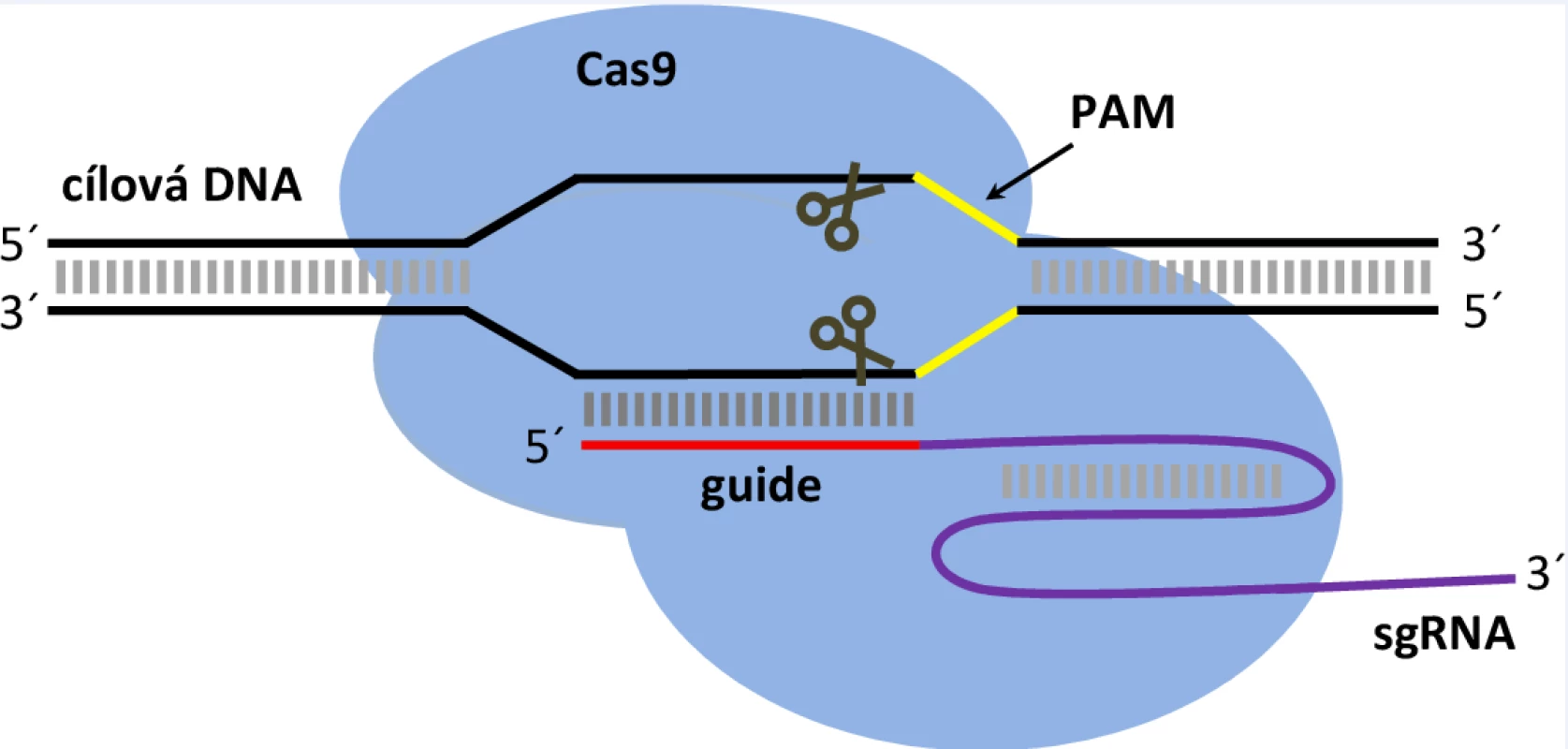
Kromě SpCas9, byly objeveny i další nukleázy z jiných bakteriálních kmenů (SaCas9, Cas12a, Cas13, CasX a další), které se liší svou strukturou i parametry určujícími specificitu štěpení (např. motiv PAM). Spektrum použitelných nukleáz, které se neustále rozšiřuje, tak umožňuje v současné době zacílit takřka jakoukoli oblast v genomu [15,16].
Editační proces
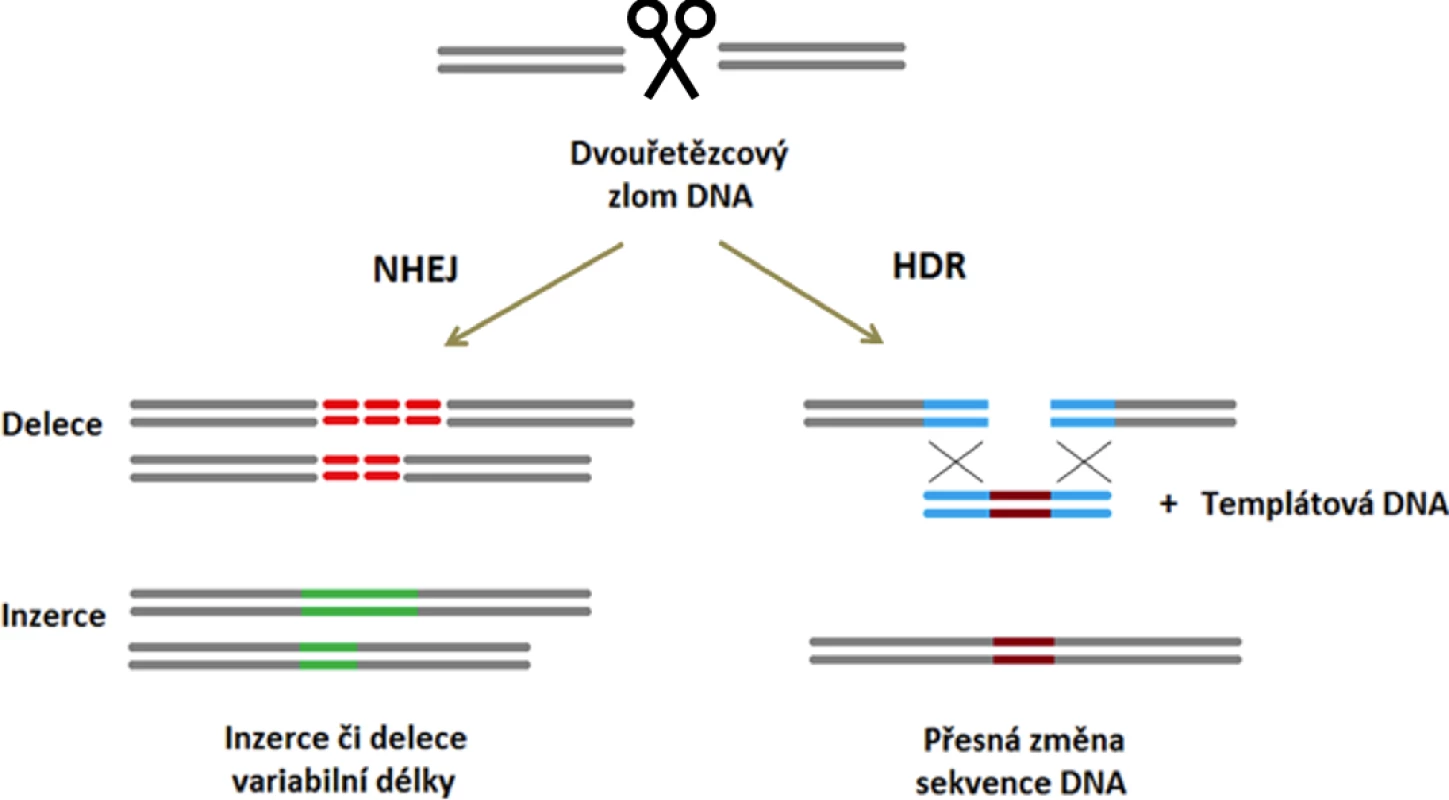
Při opravě dvouřetězcového zlomu DNA vytvořeného nukleázou CRISPR/Cas9 se uplatňují dva hlavní DNA-reparační mechanismy. Preferenčně je DNA opravena pomocí rychlého, ale nepřesného procesu tzv. nehomologního spojování volných konců („non-homologous end joining“, NHEJ), kdy v místě zlomu vznikají delece a inzerce různého rozsahu. Cílem NHEJ je co nejrychlejší zacelení DNA a zachování její integrity na úkor přesnosti opravy [17]. Jako druhý, méně častý reparační mechanismus se uplatňuje výše zmiňovaná HDR, jejímž výsledkem je přesná oprava nukleotidové sekvence podle sesterské chromatidy či homologního chromozomu [18].
Obě tyto reparační dráhy lze využít k docílení požadované změny v DNA. Zacílením nukleázy CRISPR/Cas9 na začátek kódující oblasti genu mohou krátké inzerce či delece vznikající během následné opravy tohoto místa pomocí NHEJ vést k posunu čtecího rámce a vzniku předčasného stop kodónu. Výsledkem celého procesu je „knock-out“ (KO) daného genu (obr. 2). Pokud však kromě nukleázy CRISPR/Cas9 do buňky vložíme i úsek DNA (tzv. templát) se sekvencí podobnou editované oblasti, je dvouřetězcový zlom v tomto místě opraven výměnou templátové sekvence za genomickou DNA v procesu HDR. Jakákoliv odlišnost v sekvenci templátové DNA je tak vnesena do editované oblasti (obr. 2) [19].
Modifikované varianty CRISPR/Cas9
Základní funkcí nukleáz CRISPR/Cas9 je vytvoření dvouřetězcového zlomu DNA. Existují však i modifikované varianty CRISPR/Cas9, které umožňují vytvořit např. jen jednořetězcový zlom DNA (tzv. nikázy, které aktivují odlišné DNA-reparační mechanismy než NHEJ a HDR) a také varianty, jejichž nukleázová aktivita byla zcela inaktivována [20]. Tyto tzv. „dead“ Cas9 (dCas9) si zachovávají schopnost vyhledat a navázat se na konkrétní oblast DNA a lze je spojit s jinými funkčními doménami. Vzniklé fúzní proteiny pak umožňují např. modifikaci exprese genů (tzv. CRISPR interference), epigenetické modifikace, přímou konverzi nukleotidů (tzv. „base" editory) či značení a detekci konkrétních oblastí v genomu (fúze dCas9 s fluorescenčními proteiny) [21]. Všechny tyto varianty rozšiřují již tak obrovské spektrum aplikací genové editace.
Využití genové editace v hematologii
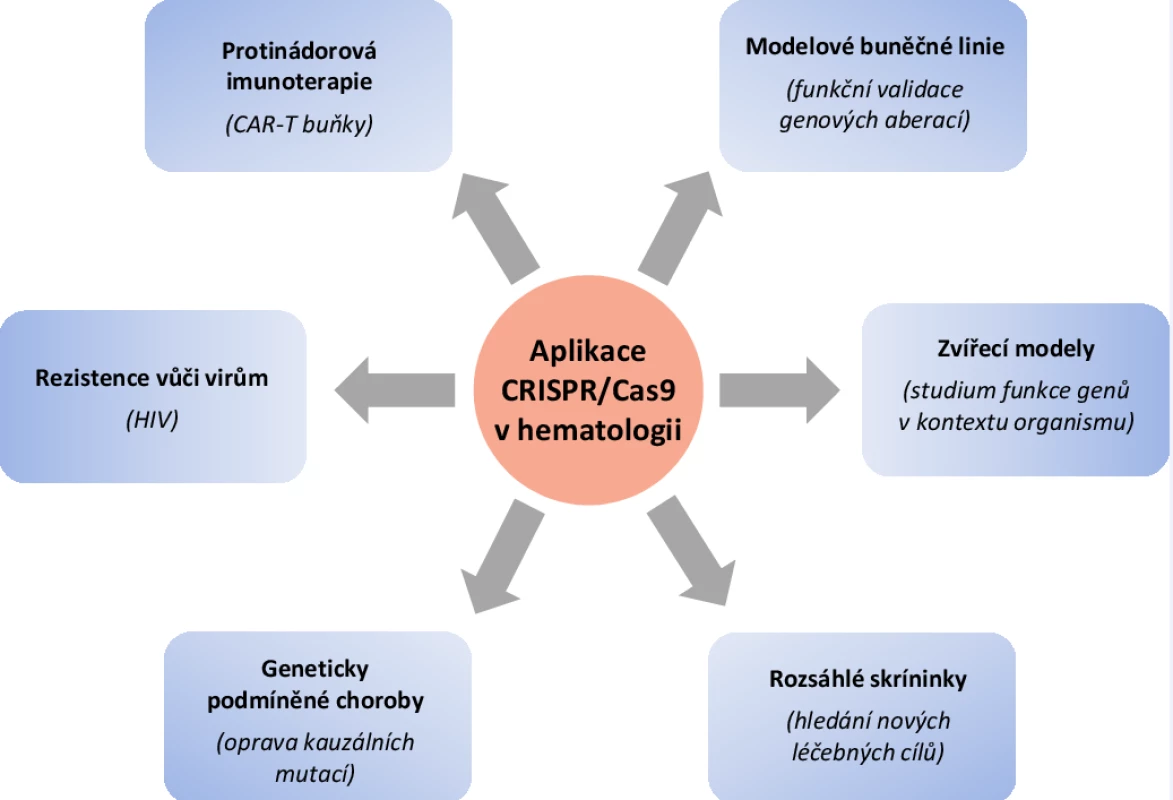
Nedávné pokroky molekulární genetiky, zejména rozvoj technologií sekvenování nové generace (NGS), do velké míry formovaly trendy současné moderní medicíny. Díky tomu, že dnes lépe rozumíme funkcím jednotlivých genů a jejich roli v rozvoji onemocnění, můžeme již některá tato onemocnění léčit kauzálně. Proto je základní výzkum v mnoha svých modifikacích zásadní pro zefektivnění diagnostiky a léčby pacientů. V hematologii nachází genová editace uplatnění ve všech těchto oblastech a velkou měrou se tak podílí na rozvoji tohoto lékařského oboru (obr. 3) [22].
Výzkum
Metody genové editace významně přispívají k výzkumu fyziologických i patologických procesů v hematopoéze a v naprosté většině případů poskytují přesnější informaci o funkci jednotlivých genů než doposud používané metody. Systémem CRISPR/Cas9 lze navíc velice snadno editovat několik genů najednou, což umožňuje studovat komplexnější interakce mezi jednotlivými geny [11]. Díky jednoduchosti a vysoké účinnosti genové editace lze navíc provádět veškeré tyto experimenty nejen na úrovni buněčných linií, ale i ve zvířecích modelech, což nám poskytuje detailní pohled na danou problematiku v kontextu celého organismu [23,24].
Nejjednodušším způsobem, jak studovat funkci konkrétního genu pomocí genové editace je vytvořit jeho KO (viz výše) a sledovat změnu fenotypu buněk. Výhodou oproti doposud používané metodě RNA interference je fakt, že vzniklá modifikace je trvalá a vede ke kompletní ztrátě funkce daného genu. Navíc lze tímto způsobem studovat i jiné než kódující oblasti genomu (promotory, enhancery atd.), čehož lze využít např. ke studiu místně i časově specifické regulace genové exprese v průběhu hematopoézy [25,26]. KO více genů najednou lze využít např. pro studium vzniku hematologických malignit, neboť podobně jako u jiných nádorových onemocnění i zde platí tzv. vícezásahová teorie kancerogeneze [27].
Genová editace umožňuje vytvářet také chromozomální translokace, které se vyskytují u více než poloviny hematologických malignit, a jež jsou považovány za klíčové události v procesu maligního zvratu buněk. Modelování translokací je založeno na simultánním vytvoření dvou dvouřetězcových zlomů na požadovaných chromozomech a následné selekci buněk, u kterých došlo k nesprávnému spojení chromozomů během opravy a tedy ke vzniku translokace. Tímto způsobem již byly např. úspěšně modelovány rekurentní leukemické chromozomální translokace t(8;21), t(4,11) a t(11;19) [28,29].
Velký význam mají také tzv. CRISPR „screen“ studie, které umožňují pomocí velkého množství různých sgRNA provést v buněčné populaci KO až tisíce genů v jediném experimentu. Selekcí buněk s požadovaným fenotypem lze identifikovat geny a regulační oblasti, které mají pro konkrétní fenotyp význam. Pomocí těchto studií byly například identifikovány nové terapeutické cíle pro léčbu akutní myeloidní leukémie či geny odpovědné za rezistenci leukemických buněk na cytarabin [30,31].
Diagnostika
Kromě KO genů či chromozomálních translokací pomocí NHEJ lze v buňkách generovat široké spektrum dalších aberací pomocí HDR (např. bodové mutace nebo tzv. „knock-in“ modely). Tato strategie se uplatňuje zejména při modelování nově nalezených mutací, což má velký význam pro diagnostiku pacientů s geneticky podmíněnými chorobami, jejichž velkou část tvoří onemocnění postihující hematopoézu a imunitní systém. Veškeré nově identifikované aberace nalezené u těchto pacientů, které představují potenciální kauzální genetické léze, musí být validovány funkčními studiemi na odpovídajícím buněčném či zvířecím modelu. Genová editace se ukázala být ideální metodou pro tvorbu těchto modelů, neboť oproti předchozím používaným technikám umožňuje studovat všechny typy mutací. Kromě toho také zachovává fyziologickou regulaci exprese daného genu, takže je stanovení fenotypu mutace mnohem přesnější, než bylo doposud možné.
Modelování nově identifikovaných mutací má význam nejen pro stanovení diagnózy pacienta, ale na jejich základě může být i navržena specifická kauzální léčba. Díky ní je pacient efektivně léčen zacílením konkrétní poškozené buněčné dráhy a je tak ušetřen mnohdy agresivní symptomatické léčby. Závěry takových studií mají ovšem často mnohem dalekosáhlejší dopad než pouze pro daného pacienta, neboť v jejich návaznosti bývají identifikování další pacienti nesoucí stejnou mutaci. Například ve skupině primárních imunodeficitů bylo více než 20 % dosud známých rekurentních mutací poprvé popsáno právě na studiích jediného pacienta [32]. Pro dané onemocnění tak postupně získáváme spektrum kauzálních mutací, které lze zařadit do tzv. sekvenačních panelů a zásadně tak snížit čas i cenu stanovení diagnózy.
Diagnostické metody využívající genovou editaci nejsou omezeny pouze na časově i technicky náročné studie kauzality nových aberací. V současné době jsou vyvíjeny různé rychlé diagnostické testy založené na systému CRISPR/Cas, z nichž můžeme jmenovat např. tzv. DETECTR a SHERLOCK (detekce virových infekcí) [33,34] nebo tzv. CRISPR-Chip (detekce kauzálních aberací) [35]. V budoucnosti se očekává jejich masivní uplatnění v rutinní diagnostice nejrůznějších onemocnění.
Léčba
TKD zůstává pro mnohá hematologická onemocnění jedinou definitivní léčbou. I přes neustálé zlepšování je však alogenní TKD zatížena mnoha limitacemi od omezeného počtu HLA-shodných dárců, reakce štěpu proti hostiteli, až po infekční komplikace v důsledku peritransplantační imunosuprese [36]. V případě autologní TKD je naprostá většina těchto komplikací eliminována, nicméně u geneticky podmíněných hematologických onemocnění dosud nepřipadala v úvahu vzhledem k přítomnosti kauzální genové aberace i v hematopoetických kmenových buňkách (HSCs, „hematopoietic stem cells“). První pokusy o kombinaci autologní TKD a tradičního přístupu genové terapie založeného na vložení “zdravé” formy genu do genomu HSCs ukázaly velmi slibné výsledky, které byly potvrzeny v řadě klinických studií. Z hematologických onemocnění byla tato strategie úspěšně aplikována např. u pacientů s těžkými kombinovanými imunodeficity, beta-talasemií, srpkovitou anémií či hemofilií [37–40]. Přesto existuje stále řada významných limitací této strategie, které souvisí buď s použitím virových vektorů pro přenos genu do buněk (riziko imunotoxicity a genotoxicity) nebo vychází ze samotného principu tohoto přístupu (absence terapeutického efektu u pacientů s aktivačními mutacemi) [2]. Léčebné strategie založené na přesné opravě poškozeného kauzálního genu ex vivo v autologních HSCs pomocí genové editace eliminují jak nedostatky spojené s tradičním přístupem genové terapie, tak i komplikace spojené s alogenní TKD a představují velmi atraktivní léčebný přístup pro geneticky podmíněná hematologická onemocnění [41].
I v případě léčebné aplikace genové editace můžeme využít jak HDR tak i NHEJ zprostředkované změny v sekvenci DNA [22,41]. V prvním případě provedeme v HSCs pomocí HDR dokonalou opravu genové aberace a obnovíme funkci poškozeného genu. Úspěšně byly takto v preklinických studiích opraveny mutace způsobující beta-talasémii, srpkovitou anémii, Fanconiho anémii, ribozomopatie a další onemocnění [2,42–45]. V druhém případě dosáhneme požadovaného terapeutického cíle vyřazením určitého genu z funkce pomocí NHEJ. Tímto způsobem lze někdy obejít dokonalou opravu mutace, která je obecně méně efektivní a vyžaduje design nových editačních nástrojů pro každou mutaci. Krásným příkladem této strategie je léčba vyvinutá pro pacienty s beta-talasémií či srpkovitou anémií [46]. Obě tato závažná onemocnění jsou způsobena poruchou tvorby hemoglobinu důsledkem mutací v beta-globinovém řetězci. Přestože byla u obou onemocnění prokázána proveditelnost přesné opravy beta-globinového genu pomocí HDR, podstatně lepších výsledků bylo dosaženo narušením erytroidně-specifického aktivátoru genu BCL11A v HSCs cestou NHEJ [47]. Tento gen je zodpovědný za utlumení exprese fetálního gamma-globinového řetězce u dospělého člověka. Jeho inaktivace způsobí opětovné uvolnění exprese gamma-globinu v erytrocytech pacienta, který nahradí mutovaný beta-globin v molekule hemoglobinu. V současné době je tato strategie testována ve vůbec první klinické studii využívající technologii CRISPR/Cas9 v západním světě [48,49].
Spektrum chorob, které jsou potenciálně vyléčitelné genovou editací, se však neomezuje pouze na hematologická onemocnění, ale dá se rozšířit o další geneticky podmíněné choroby, u kterých má alogenní TKD ve své klasické podobě klinický benefit. Jedná se především o různé metabolické vady z velké skupiny lyzozomálních střádavých onemocnění [50]. V tomto případě je efekt terapie zprostředkován zejména monocyty pocházejícími z HSCs, u kterých byla pomocí CRISPR/Cas9 buď opravena kauzální mutace, nebo vložena zdravá kopie genu za silný endogenní promotor zprostředkovávající jeho expresi (tzv. cílené vložení genu) [51]. Editované monocyty migrují téměř do všech tkání organismu včetně CNS, kde diferencují v makrofágy a produkují chybějící enzym.
Kromě HSCs lze editovat i diferencovanější hematopoetické buňky a to v případě, kdy není primárně nutné zajistit celoživotní přítomnost editovaných buněk v těle pacienta. Příkladem jsou tzv. CAR-T buňky, což jsou geneticky modifikované cytotoxické T-lymfocyty, které exprimují tzv. CAR (chimérický antigenní receptor) specificky detekující nádorové antigeny [52]. Vazbou na tento antigen se CAR-T buňka aktivuje a dojde tak k destrukci cílové buněčné populace. Obrovský potenciál CAR-T lymfocytů eliminovat nádorové buňky byl prokázán u dětských i dospělých pacientů s refrakterní B-buněčnou malignitou [53]. Ač pro samotnou výrobu CAR-T buněk není třeba genové editace, lze tuto technologii využít k významnému zlepšení jejich vlastností (např. KO inhibičních receptorů (PD-1, TIM-3, LAG-3, CTLA-4), které zabrání imunitnímu vyčerpání a další) [54,55]. Za největší přínos genové editace pro oblast nádorové imunoterapie je však považována možnost výroby tzv. univerzálních CAR-T buněk pro pacienty, u nichž nelze modifikovat jejich vlastní T-lymfocyty (např. z důvodu progredujícího onemocnění či lymfopenie). V těchto případech se vytvoří CAR-T buňky z T-lymfocytů dárců, u nichž je proveden KO jejich vlastních genů TCR (T-cell receptor) i B2M (beta2 mikroglobulin), čímž se zajistí jejich aktivace pouze a specificky přes CAR (eliminace rizika GvHD) a zabrání se jejich odstranění imunitním systémem příjemce [54]. Genová editace tak má potenciál významně zvýšit úspěšnost léčby pomocí CAR-T lymfocytů.
CAR-T buňky nicméně nejsou první léčebnou strategií založenou na editovaných T-lymfocytech. Jako velmi přínosný se tento přístup ukázal při vývoji nové léčby pro pacienty infikované virem HIV. Pomocí ZFN byl v autologních CD4+ buňkách těchto pacientů proveden ex vivo KO genu CCR5, jehož produktem je membránový receptor na povrchu T-lymfocytů, přes který HIV vstupuje do buněk [56]. Kromě významného vzestupu počtu lymfocytů u všech léčených pacientů podmíněného nově získanou rezistencí k HIV, prokázala tato studie účinnost a bezpečnost léčebných produktů na bázi genové editace. Významně tak přispěla k urychlení přechodu dalších podobně koncipovaných studií do klinické praxe.
Z terapeutického hlediska je jistě lákavá možnost editovat buňky pomocí CRISPR/Cas9 přímo v těle pacienta (in vivo). S touto strategií je však v současné době spjata řada ještě stále nedořešených otázek (mimo jiné výběr vhodného transportního systému, či riziko imunitní reakce). Vzhledem k těmto limitacím a také díky relativně snadnému získání hematopoetických kmenových buněk v porovnání s buňkami jiných tkání, představuje přístup ex vivo i do budoucna preferovanou strategii pro léčbu geneticky podmíněných hematologických onemocnění.
Úskalí a limitace genové editace
Hlavní limitací klinického využití genové editace v hematologii zůstává prozatím relativně nízká účinnost HDR v nejprimitivnějších HSCs. Nedostatek opravených dlouhodobých HSCs v transplantované buněčné populaci může ve svém konečném důsledku zapříčinit selhání štěpu. Proto je momentálně velké úsilí věnováno optimalizaci celého procesu tak, aby byla editace úspěšná jak v krátkodobých tak v dlouhodobých HSCs, jelikož obě tyto populace jsou nezbytné pro rychlé a zároveň trvalé přihojení štěpu. Jednou z možností, jak získat větší počet editovaných buněk je jejich selekce a ex vivo expanze, nebo stimulace HDR na úkor NHEJ [57].
Z hlediska bezpečnosti genové editace zůstává největší obavou riziko nespecifického štěpení nukleázy v jiném než požadovaném místě genomu. Výsledkem této tzv. „off-target“ aktivity může být narušení i několika dalších genů, což může mít pro buňku dramatické následky včetně rizika maligního zvratu [58]. V současné době již existují in silico predikční nástroje a speciální molekulárně genetické metody, které umožňují detekci nespecifického štěpení přímo v testovaných buňkách (GUIDE-Seq, DISCOVER-Seq a další [59,60]). Tyto analýzy tak umožňují vytipovat nukleázy s minimem či zcela bez „off-target“ aktivity. Jisté riziko představuje i recentně popsaná aktivace p53 dráhy v průběhu editačního procesu jako odpovědi buňky na přítomnost zlomů v DNA [61]. Jejím hlavním úkolem je kontrolovat integritu DNA a v krajním případě může vést až k zastavení buněčného cyklu. Hrozí tak, že by selekce úspěšně editovaných HSCs mohla zvýhodňovat buňky s defektní p53 dráhou. Toto riziko lze ovšem minimalizovat výběrem kvalitních nukleáz bez „off-target“ aktivity, které kromě požadovaného místa negenerují žádné další zlomy v DNA, případně lze v buňce navodit krátkodobou supresi p53 [62].
Dalším významným úskalím terapeutických přístupů založených na genové editaci je jejich finanční i technická náročnost. Cena doposud uvedených výrobků na bázi tradiční genové terapie dosahovala až 1 milionu USD a očekává se, že podobně tomu bude i v případě genové editace. Takto vysoká cena je podmíněna z velké části tím, že je tento typ léčby vyvíjen pro velmi vzácná onemocnění a v některých případech dokonce pro jednoho konkrétního pacienta a jeho mutaci. Do jisté míry se na tom podílí také fakt, že se jedná o jednorázovou léčbu, která by měla pacienta vyléčit do konce života, bez nutnosti užívání mnohdy velmi drahé symptomatické léčby. I přesto již nyní představuje tato léčebná strategie výhodnou alternativu pro pacienty s onemocněními, jejichž léčba představuje velkou zátěž pro zdravotní systém (např. HIV-pozitivní pacienti či hemofilici). S dalším vývojem této technologie a zkušenostmi z klinických studií se navíc očekává pokles ceny terapeutické genové editace, díky čemuž se stane finančně atraktivní variantou léčby i pro další onemocnění.
Veškeré úsilí, které je v současné době věnováno vývoji terapeutických přístupů s využitím genové editace, se zaměřuje na změnu genetické informace v somatických buňkách pacienta. Nabízí se však otázka, zda by nebylo vhodnější provést genovou editaci již v embryu či dokonce v zárodečných buňkách rodičů. Jedinec by se tak vyvíjel již s opravenou DNA a vzhledem k tomu, že by předal opravenou DNA i svým potomkům, docházelo by teoreticky k snížení výskytu patologických variant v populaci. V roce 2015 publikovali čínští vědci první úspěšnou editaci lidského embrya (konkrétně opravu mutace v beta-globinovém řetězci), které bylo poté následováno dalšími podobnými studiemi [63,64]. Tyto experimenty vzbudily velmi silnou reakci odborné i laické veřejnosti, neboť poprvé reálně poukázaly na rizika, které genová editace může představovat jak pro jedince, tak i pro celý lidský genofond. Ještě více alarmující je počínání čínského vědce Che Ťien Kchueje (v anglické transkripci He Jiankui), který v roce 2018 provedl genovou editaci lidských embryí a jejich implantaci v rámci asistované reprodukce [65]. Po technické stránce byl experiment nejspíše proveden správně, neboť DNA editovaných dětí, které se takto již narodily, nevykazuje jiné změny než cílenou editaci genu CCR5. Tato studie však představuje závažné porušení mezinárodně uznávaných pravidel o genetické manipulaci lidského embrya. Naprostá většina vědecké komunity po celém světě včetně univerzity, na které tento vědec působil, incident odsoudila a v návaznosti na něj zahájila diskuze vedoucí ke stanovení etických rámců pro použití této technologie. Cílem těchto opatření je zabránit zneužití genové editace např. za účelem eugeniky [66].
Závěr
Genová editace systémem CRISPR/Cas9 představuje revoluční technologii, která se stala fenoménem v molekulární biologii, genetice i medicíně. Jsme svědky fascinující éry navazující na předchozí masivní rozvoj technologií NGS, které nám umožnily detailně poznat genom člověka i jiných organismů včetně bakterií, u nichž byl systém CRISPR/Cas9 objeven. Díky jednoduchosti, účinnosti a širokému spektru využití tohoto systému se stala manipulace s nukleotidovou sekvencí DNA takřka rutinní záležitostí v molekulárně genetických laboratořích. Tyto vlastnosti se ukázaly být velmi atraktivní i pro terapeutické účely, neboť nám dávají unikátní možnost léčit pacienty s geneticky podmíněnými chorobami zacílením příčiny daného onemocnění a ne jen jeho symptomů. Hematologie je díky snadné dostupnosti buněk hematopoetického systému a nenáročnosti jejich ex vivo manipulace jedním z oborů, ve kterých se tato technologie s oblibou uplatňuje již od počátku svého objevu. Důkazem budiž nepřeberné množství publikací včetně řady preklinických studií prokazujících opravu mutací odpovědných za vznik geneticky podmíněných hematologických onemocnění. Potenciál genové editace v léčbě těchto chorob jistě musí být potvrzen v navazujících klinických studiích, enormní rychlost vývoje této technologie nám nicméně dává naději, že již v relativně blízké budoucnosti budeme schopni vyléčit pacienty se závažnými onemocněními, u kterých prostředky současné medicíny selhávají.
PODÍL AUTORŮ NA PŘÍPRAVĚ RUKOPISU
- MR a KŠK – sepsaly rukopis a odpovídají za koncepci, revize a finální podobu článku
- VBM – odpovědná za text z pohledu molekulární genetiky
- MS – odpovídá za text z pohledu genetického inženýrství
- LB – odpovídá za text z pohledu lékaře specializovaného na problematiku hematologických malignit a jiných nádorových onemocnění
PODĚKOVÁNÍ
Tato práce byla podpořena Grantovou agenturou České republiky (17-04941Y), Univerzitou Karlovou (PRIMUS/19/MED/004), Grantovou agenturou Univerzity Karlovy (502119) a Ministerstvem školství, mládeže a tělovýchovy České republiky NPU I nr.LO1604.
ČESTNÉ PROHLÁŠENÍ AUTORŮ
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
RNDr. Karolina Škvárová Kramarzová, Ph.D.
Childhood Leukaemia Investigation Prague
Klinika dětské hematologie a onkologie
2. lékařská fakulta, Univerzita Karlova a FN Motol
V Úvalu 84, Praha 5 15006
email: karolina.skvarova@lfmotol.cuni.cz
Tel.: +420224436485
Rukopis doručen do redakce dne 2. 5. 2019.
Rukopis přijat po recenzi dne 6. 6. 2019.
Zdroje
[1] Levine AJ. Virus vector-mediated gene transfer. Microbiol Sci 1987;4(8):245–250.
[2] Naldini L. Genetic engineering of hematopoiesis: current stage of clinical translation and future perspectives. EMBO Mol Med 2019;11(3):E9958.
[3] Thomas CE, Ehrhardt A, Kay MA. Progress and problems with the use of viral vectors for gene therapy. Nat Rev Genet 2003;4(5):346–358.
[4] Pâques F, Haber JE. Multiple pathways of recombination induced by double-strand breaks in Saccharomyces cerevisiae. Microbiol Mol Biol Rev 1999;63(2):349–404.
[5] Porteus MH, Baltimore D. Chimeric nucleases stimulate gene targeting in human cells. Science 2003;300(5620):763.
[6] Stoddard BL. Homing endonucleases: from microbial genetic invaders to reagents for targeted DNA modification. Structure 2011;19(1):7–15.
[7] Kim YG, Cha J, Chandrasegaran S. Hybrid restriction enzymes: zinc finger fusions to Fok I cleavage domain. Proc Natl Acad Sci USA 1996;93(3):1156–1160.
[8] Bogdanove AJ, Voytas DF. TAL effectors: customizable proteins for DNA targeting. Science 2011;333(6051):1843–1846.
[9] Jinek M, Chylinski K, Fonfara I, Hauer M, Doudna JA, Charpentier EA. programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science 2012;337(6096):816–821.
[10] Gasiunas G, Barrangou R, Horvath P, Siksnys V. Cas9-crRNA ribonucleoprotein complex mediates specific DNA cleavage for adaptive immunity in bacteria. Proc Natl Acad Sci USA 2012;109(39):E2579-E2586.
[11] Cong L, Ran FA, Cox D, et al. Multiplex genome engineering using CRISPR/Cas systems. Science 2013;339(6121):819–823.
[12] Mojica FJM, Díez-Villaseñor C, García-Martínez J, Soria E. Intervening sequences of regularly spaced prokaryotic repeats derive from foreign genetic elements. J Mol Evol 2005;60(2):174–182.
[13] Barrangou R, Marraffini LA. CRISPR-Cas systems: Prokaryotes upgrade to adaptive immunity. Mol Cell 2014;54(2):234–244.
[14] Redman M, King A, Watson C, King D. What is CRISPR/Cas9? Arch Dis Child Educ Pract Ed 2016;101(4):213–215.
[15] Liu J-J, Orlova N, Oakes BL, et al. CasX enzymes comprise a distinct family of RNA-guided genome editors. Nature 2019;566(7743):218–223.
[16] Murugan K, Babu K, Sundaresan R, Rajan R, Sashital DG. The revolution continues: Newly discovered systems expand the CRISPR-Cas toolkit. Mol Cell 2017;68(1):15–25.
[17] Chang HHY, Pannunzio NR, Adachi N, Lieber MR. Non-homologous DNA end joining and alternative pathways to double-strand break repair. Nat Rev Mol Cell Biol 2017;18(8):495–506.
[18] Heyer W-D, Ehmsen KT, Liu J. Regulation of homologous recombination in eukaryotes. Ann Rev Genet 2010;44(1):113–139.
[19] Salsman J, Dellaire G. Precision genome editing in the CRISPR era. Biochem Cell Biol 2017;95(2):187–201.
[20] Ran FA, Hsu PD, Lin C-Y, et al. Double nicking by RNA-guided CRISPR-Cas9 for enhanced genome editing specificity. Cell 2013;154(6):1380–1389.
[21] Singh V, Braddick D, Dhar PK. Exploring the potential of genome editing CRISPR-Cas9 technology. Gene 2017;599:1–18.
[22] González-Romero E, Martínez-Valiente C, García-Ruiz C, Vázquez-Manrique RP, Cervera J, Sanjuan-Pla A. CRISPR to fix bad blood: a new tool in basic and clinical hematology. Haematologica 2019;104(5):881–893.
[23] Wang H, Yang H, Shivalila CS, et al. One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering. Cell 2013;153(4):910–918.
[24] Gundry MC, Brunetti L, Lin A, et al. Highly efficient genome editing of murine and human hematopoietic progenitor cells by CRISPR/Cas9. Cell Rep 2016;17(5):1453–1461.
[25] Bauer DE, Canver MC, Smith EC, et al. Crispr-Cas9 saturating mutagenesis reveals an Achilles heel in the BCL11A erythroid enhancer for fetal hemoglobin induction (by genome editing). Blood 2015;126(23):638.
[26] Eldridge L, Zhang L, Ye Z. Defining the role of a GATA-2 enhancer during hematopoietic differentiation of human iPSCs. Blood 2017;130(Suppl 1):4939.
[27] Knudson AG. Two genetic hits (more or less) to cancer. Nat Rev Cancer 2001;1(2):157–162.
[28] Reimer J, Knöß S, Labuhn M, et al. CRISPR-Cas9-induced t(11;19)/MLL-ENL translocations initiate leukemia in human hematopoietic progenitor cells in vivo. Haematologica 2017;102(9):1558–1566.
[29] Torres R, Martin MC, Garcia A, Cigudosa JC, Ramirez JC, Rodriguez-Perales S. Engineering human tumour-associated chromosomal translocations with the RNA-guided CRISPR–Cas9 system. Nat Commun 2014;5(1):3964.
[30] Rathe SK, Moriarity BS, Stoltenberg CB, et al. Using RNA-seq and targeted nucleases to identify mechanisms of drug resistance in acute myeloid leukemia. Sci Rep 2015;4(1):6048.
[31] Shi J, Wang E, Milazzo JP, Wang Z, Kinney JB, Vakoc CR. Discovery of cancer drug targets by CRISPR-Cas9 screening of protein domains. Nat Biotechnol 2015;33(6):661–667.
[32] Casanova J-L, Conley ME, Seligman SJ, Abel L, Notarangelo LD. Guidelines for genetic studies in single patients: lessons from primary immunodeficiencies. J Exp Med 2014;211(11):2137–2149.
[33] Gootenberg JS, Abudayyeh OO, Lee JW, et al. Nucleic acid detection with CRISPR-Cas13a/C2c2. Science 2017;356(6336):438–442.
[34] Chen JS, Ma E, Harrington LB, et al. CRISPR-Cas12a target binding unleashes indiscriminate single-stranded DNase activity. Science 2018;360(6387):436–439.
[35] Hajian R, Balderston S, Tran T, et al. Detection of unamplified target genes via CRISPR–Cas9 immobilized on a graphene field-effect transistor. Nat Biomed Eng 2019;3(6):427–437.
[36] Norkin M, Wingard JR. Recent advances in hematopoietic stem cell transplantation. F1000Research 2017;6:870.
[37] Badat M, Davies J. Gene therapy in a patient with sickle cell disease. N Engl J Med 2017;376(21):2093–2094.
[38] Cavazzana-Calvo M, Payen E, Negre O, et al. Transfusion independence and HMGA2 activation after gene therapy of human β-thalassaemia. Nature 2010;467(7313):318–322.
[39] Fischer A, Hacein-Bey Abina S, Touzot F, Cavazzana M. Gene therapy for primary immunodeficiencies. Clin Genet 2015;88(6):507–515.
[40] Nathwani AC, Tuddenham EGD, Rangarajan S, et al. Adenovirus-associated virus vector–mediated gene transfer in hemophilia B. N Engl J Med 2011;365(25):2357–2365.
[41] Dever DP, Porteus MH. The changing landscape of gene editing in hematopoietic stem cells. Curr Opin Hematol 2017;24(6):481–488.
[42] Huang X, Wang Y, Yan W, et al. Production of gene-corrected adult beta globin protein in human erythrocytes differentiated from patient iPSCs after genome editing of the sickle point mutation. Stem Cells 2015;33(5):1470–1479.
[43] Xie F, Ye L, Chang JC, et al. Seamless gene correction of β-thalassemia mutations in patient-specific iPSCs using CRISPR/Cas9 and piggyBac. Genome Res 2014;24(9):1526–1533.
[44] Skvarova Kramarzova K, Osborn M, Webber B, et al. CRISPR/Cas9-mediated correction of the FANCD1 gene in primary patient cells. Int J Mol Sci 2017;18(6):E1269.
[45] Westin E, Devadasan D, Li C, Ding L, Townes TM, Goldman FD. CRISPR modification of induced pluripotent stem derived from Diamond-Blackfan anemia fibroblasts. Blood 2014;124(21):4804.
[46] Chang K-H, Smith SE, Sullivan T, et al. Long-term engraftment and fetal globin induction upon BCL11A gene editing in bone-marrow-derived CD34 + hematopoietic stem and progenitor cells. Mol Ther Methods Clin Dev 2017;4:137–148.
[47] Wu Y, Zeng J, Roscoe BP, et al. Highly efficient therapeutic gene editing of human hematopoietic stem cells. Nat Med 2019;25:776–783.
[48] A safety and efficacy study evaluating CTX001 in subjects with severe sickle cell disease. www.ClinicalTrials.gov.
[49] A safety and efficacy study evaluating CTX001 in subjects with transfusion-dependent β-thalassemia. www.ClinicalTrials.gov.
[50] Biffi A. Hematopoietic stem cell gene therapy for storage disease: Current and new indications. Mol Ther 2017;25(5):1155–1162.
[51] Moehle EA, Rock JM, Lee Y-L, et al. Targeted gene addition into a specified location in the human genome using designed zinc finger nucleases. Proc Natl Acad Sci 2007;104(9):3055–3060.
[52] Eshhar Z, Waks T, Gross G, Schindler DG. Specific activation and targeting of cytotoxic lymphocytes through chimeric single chains consisting of antibody-binding domains and the gamma or zeta subunits of the immunoglobulin and T-cell receptors. Proc Natl Acad Sci USA 1993;90(2):720–724.
[53] Zhou H, Luo Y, Zhu S, et al. The efficacy and safety of anti-CD19/CD20 chimeric antigen receptor- T cells immunotherapy in relapsed or refractory B-cell malignancies:a meta-analysis. BMC Cancer 2018;18(1):929.
[54] Ren J, Liu X, Fang C, Jiang S, June CH, Zhao Y. Multiplex Cripsr/Cas9 genome editing to generate potent universal CART and PD1-deficient cells against leukemia. Blood 2015;126(23):4280.
[55] Yoon DH, Osborn MJ, Tolar J, Kim CJ. Incorporation of immune checkpoint blockade into chimeric antigen receptor T Cells (CAR-Ts): Combination or built-in CAR-T. Int J Mol Sci 2018;19(2):E340.
[56] Holt N, Wang J, Kim K, et al. Human hematopoietic stem/progenitor cells modified by zinc-finger nucleases targeted to CCR5 control HIV-1 in vivo. Nat Biotechnol 2010;28(8):839–847.
[57] Li G, Zhang X, Zhong C, et al. Small molecules enhance CRISPR/Cas9-mediated homology-directed genome editing in primary cells. Sci Rep 2017;7(1):8943.
[58] Zhang X-H, Tee LY, Wang X-G, Huang Q-S, Yang S-H. Off-target effects in CRISPR/Cas9-mediated genome engineering. Mol Ther Nucleic Acids 2015;4:e264.
[59] Zischewski J, Fischer R, Bortesi L. Detection of on-target and off-target mutations generated by CRISPR/Cas9 and other sequence-specific nucleases. Biotechnol Adv 2017;35(1):95–104.
[60] Wienert B, Wyman SK, Richardson CD, et al. Unbiased detection of CRISPR off-targets in vivo using DISCOVER-Seq. Science 2019;364(6437):286–289.
[61] Ihry RJ, Worringer KA, Salick MR, et al. p53 inhibits CRISPR–Cas9 engineering in human pluripotent stem cells. Nat Med 2018;24(7):939–946.
[62] Conti A, Di Micco R. p53 activation: a checkpoint for precision genome editing? Genome Med 2018;10(1):66.
[63] Schenkwein D, Ylä-Herttuala S. Gene editing of human embryos with CRISPR/Cas9: great promise coupled with important caveats. Mol Ther 2018;26(3):659–660.
[64] Liang P, Xu Y, Zhang X, et al. CRISPR/Cas9-mediated gene editing in human tripronuclear zygotes. Protein Cell 2015;6(5):363–372.
[65] Regalado A. EXCLUSIVE: Chinese scientists are creating CRISPR babies. MIT Technol Rev 2018;Nov 25.
[66] Juengst ET, Henderson GE, Walker RL, et al. Is enhancement the price of prevention in human gene editing? Cris J 2018;1(6):351–354.
Štítky
Hematológia Interné lekárstvo OnkológiaČlánok vyšiel v časopise
Transfuze a hematologie dnes

2019 Číslo Online only 1
- MUDr. Lenka Klimešová: Multiodborová vizita je kľúč k efektívnejšej perioperačnej liečbe chronickej bolesti
- Nejasný stín na plicích – kazuistika
- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
Najčítanejšie v tomto čísle
- Richterova transformace chronické lymfocytární leukemie v éře léčby inhibitory buněčných drah
- Trombotické mikroangiopatie
- Genová editace systémem CRISPR/Cas9 a její využití v hematologii
- Castlemanova nemoc, jedna z příčin chronické systémové zánětlivé reakce, někdy i retence tekutin, vaskulitid a poruch imunity. Mezinárodní diagnostická kritéria z roku 2017.
