-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
preLekára.sk / Odborné časopisy / Transfuze a hematologie dnes / 2020 - Preview preliminary publicationÚskalí léčby chronické myeloidní leukemie dasatinibem – plicní arteriální hypertenze jako vzácná komplikace
Pitfalls of treating chronic myeloid leukaemia with dasatinib – pulmonary arterial hypertension as a rare complication
Dasatinib is a potent tyrosine kinase inhibitor of not only Bcr-Abl1, but also of the Src kinase family, c-kit and PDGFR-β. This „off-target“ effect is the probable cause of pleural effusions, which complicate dasatinib therapy in about one third of patients. The following case report describes a chronic myeloid leukaemia patient with not only recurrent pleural effusions but also pulmonary arterial hypertension as a serious adverse event leading to dasatinib discontinuation.
Keywords:
chronic myeloid leukaemia – dasatinib – pleural effusions – pulmonary arterial hypertension
Autori: P. Čičátková; A. Kvetková; T. Horňák; L. Semerád; D. Žáčková
Pôsobisko autorov: Interní hematologická a onkologická klinika, Fakultní nemocnice Brno a Lékařská fakulta Masarykovy univerzity, Brno
Vyšlo v časopise: Transfuze Hematol. dnes,1, 2020, No. Preview preliminary publication, p. 1-11.
Súhrn
Dasatinib je potentní inhibitor tyrozinkináz, který kromě Bcr-Abl1 kinázy inhibuje také kinázy z rodiny Src, c-kit a PDGFR-β. Toto „off-target“ působení je také pravděpodobně příčinou pleurálních výpotků, které terapii dasatinibem komplikují až u třetiny pacientů. Níže je popsán případ pacientky s chronickou myeloidní leukemií, u které se vyskytly nejen recidivující pleurální výpotky, ale také závažná komplikace v podobě plicní arteriální hypertenze vedoucí k vysazení dasatinibu.
Klíčová slova:
chronická myeloidní leukemie – dasatinib – pleurální výpotky – plicní arteriální hypertenze
Zkrácený název práce: Úskalí léčby CML dasatinibem
ÚVOD
Zavedení imatinibu, prvního inhibitoru tyrozinkináz (tyrosine kinase inhibitor, TKI), vedlo k zásadnímu zlepšení prognózy pacientů s nově diagnostikovanou CML v chronické fázi (chronic phase, CP), kdy desetileté přežitítěchto pacientů ve studii IRIS (International Randomized Study of Interferon and STI571) dosáhlo 83,3 %. Výsledky této studie však také ukázaly, že po deseti letech od zahájení terapie užívala imatinib méně než polovina pacientů, přičemž vysazení proběhlo nejčastěji na vrub rezistence nebo intolerance [1]. To zdůrazňuje význam TKI dalších generací, zejména v každodenní klinické praxi široce používaného nilotinibu a dasatinibu, jejichž účinnost a dobrá snášenlivost byly opakovaně ověřeny v klinických studiích i každodenní praxi jak u pacientů v 1. linii tak při léčbě v liniích následujících [2–6].
Dasatinib patří mezi TKI 2. generace, účinně inhibuje nejen Bcr-Abl1 kinázu ale rovněž kinázy rodiny Src a kinázy c-kit a PDGFR-β a v porovnání s imatinibem je při inhibici nemutované Bcr-Abl1 kinázy in vitro 325krát účinnější [7]. Působí také proti mutovaným formám Bcr-Abl1, rezistentním vůči imatinibu, s výjimkou mutace T315I [8]. Nežádoucím účinkem (NÚ), typickým pro dasatinib, je tvorba pleurálních výpotků (PV). Ve studii DASISION byl jejich výskyt pozorován u 28 % pacientů léčených dasatinibem v porovnání s 0,8 % takto postižených pacientů užívajících imatinib [4]. Řadou studií s dasatinibem v první i následujících liniích bylo ověřeno, že PV se vyskytují až u jedné třetiny takto léčených pacientů a jako příčina se nejčastěji skloňuje „off-target“ působení na inhibované kinázy [9–15]. Léčba PV je individuální v závislosti na tíži a opírá se o doporučení Evropské leukemické sítě (European LeukemiaNet, ELN) [16]. Zahrnuje jednak symptomatickou terapii v podobě diuretik a kortikoidů a v případě výpotků stupně 3 nebo 4 dle CTCAE (Common Terminology Criteria for Adverse Events) je indikována i odlehčovací punkce. Samozřejmostí je přerušení užívání dasatinibu, který může být znovu vrácen do terapie po odeznění PV.
Vzácnou komplikací provázející užívání dasatinibu je rozvoj plicní hypertenze (PH), jejíž výskyt ve studii DASISION byl také pozorován častěji u pacientů užívajících dasatinib (5 % vs. 0,4 %). Ke stanovení diagnózy plicní arteriální hypertenze (PAH) by měla být vždy provedena pravostranná srdeční katetrizace [4]. Přestože incidence PAH je při léčbě dasatinibem nízká (≤ 1%) [16], prognóza je velmi závažná, i když se od zavedení specifické terapie výrazně zlepšila. Při zahájení této léčby do 6 měsíců od stanovení diagnózy je 5leté přežití pacientů 64,5 % [17].
V níže prezentovaném případu pacientky s CML je popsán průběh její terapie, komplikované NÚ jak při terapii imatinibem, tak při užívání dasatinibu, a to včetně právě PAH.
Kazuistika
Pacientka ve věku 47 let byla odeslána na hematologickou ambulanci pro náhodně zjištěnou leukocytózu a následně u ní byla provedenými vyšetřeními zjištěna diagnóza CML v CP s nízkým rizikovým skóre dle Sokala i Hasforda. Po krátké cytoredukční léčbě byla v říjnu 2006 zahájena terapie imatinibem ve standardní dávce 400 mg denně. Po 11 dnech užívání léku se u pacientky objevil generalizovaný celotělový exantém stupně 3 dle CTCAE verze 3.0, pro který byla kromě přerušení imatinibu nutná i hospitalizace na kožní klinice s parenterálním podáváním kortikoidů. Tato opatření vedla k téměř úplné regresi exantému s následným obnovením terapie imatinibem v poloviční dávce (200 mg denně). V řádu několika dní se však exantémznovu rozvinul ve stejném rozsahu, a proto byl imatinib v listopadu 2006 definitivně vysazen. Účast v klinické studii s nilotinibem pacientka odmítla, a tak, s ohledem na absenci příbuzného dárce kostní dřeně, byla jako v té době jediná dostupná možnost konzervativní léčby zvolena terapie interferonem-α. Ten pacientka užívala nejprve v dávce 3 MIU a následně 4 MIU 3krát týdně. Po 6 měsících terapie bylo dosaženo kompletní cytogenetické odpovědi (complete cytogenetic response, CCyR) a klesala i hladina BCR-ABL1 transkriptu s nejnižší hodnotou 0,39 % v únoru 2008 (měsíc 15). V následujících měsících však docházelo k postupnému nárůstu hladiny transkriptu a ve 30. měsíci terapie, v květnu 2009, došlo k desetinásobnému vzestupu hladiny BCR-ABL1 transkriptu a ke ztrátě CCyR. Podle tehdy platných doporučení ELN naplňovala ztráta CCyR definici selhání terapie a byla indikací ke změně TKI [18]. Provedenou mutační analýzou nebyla prokázána žádná mutace.
V červenci 2009 pacientka začala užívat již běžně dostupný dasatinib v dávce 50 mg denně a v září téhož roku byl lék navýšen na plnou dávku 100 mg denně. Dasatinib byl dobře snášen a vyjma asymptomatické elevace jaterních enzymů stupně 1 se zpočátku neobjevily žádné NÚ. Případná přítomnost PV byla v úvodu léčby opakovaně vyloučena preventivním ultrazvukovým vyšetřením pleurálních dutin. Po 3 měsících od zahájení terapie dasatinibem, v říjnu 2009, pacientka obnovila ztracenou CCyR, a dosáhla také velké molekulární odpovědi (major molecular response, MMR) a současně i hluboké molekulární odpovědi (deep molecular response, DMR, tj. hladina BCR-ABL1 transkpritů ≤ 0,01 % vzhledem k mezinárodní škále), ve které setrvávala vyjma ojedinělých zakolísání nepřesahujících úroveň MMR i v dalším sledování. V mezidobí se u pacientky objevily nové komorbidity – arteriální hypertenze, zaléčená inhibitorem angiotenzin-kovertujícího enzymu, a subklinická hypothyreóza, řešená substitucí levothyroxinu. Zlom nastal po 2 letech a devíti měsících od zahájení terapie dasatinibem, v únoru 2012, kdy pacientku přivedly do ambulance mimo plánovanou kontrolu následující potíže: generalizovaný svědivý exantém, periferní otoky a námahová dušnost, rozvíjející se v řádu dní. Objektivním vyšetřením bylo zjištěno bilaterálně bazálně oslabené dýchání, tachykardie 110/min, dekompenzovaná hypertenze a splývavý makulo-papulózní exantém na trupu i končetinách. Rentgenový snímek (RTG) hrudníku odhalil bilaterální fluidothorax (Obr. 1a) a ECHO srdce potvrdilo také středně významný perikardiální výpotek, trikuspidální regurgitaci a středně těžkou plicní hypertenzi. Stav pacientky si vynutil hospitalizaci na JIP. Byla přerušena terapie dasatinibem a podána parenterální diuretika, antihypertenziva a perorální kortikoidy. Po regresi pleurálního výpotku na stupeň 1 (Obr. 1b) i periferních otoků a exantému byla pacientka po 8 denní hospitalizaci propuštěna do ambulantní péče, kde po týdnu od propuštění, po kontrolním RTG hrudníku a ECHO srdce, potvrzujícím regredující pleurální i perikardiální výpotky, byla obnovena po 18 denním přerušení terapie dasatinibem v dávce 50 mg denně. Vzhledem k další částečné regresi výpotků na RTG v dubnu 2012 byla dávka dále navýšena na 70 mg denně. Tato dávka byla velmi dobře tolerována, stav zejména PV byl opakovaně kontrolován jak pomocí RTG tak sonograficky a jejich rozsah zůstával stacionární. I při redukované dávce léku byla léčebná odpověď dlouhodobě udržována v mezích DMR.
Obr. 1a Rentgenový snímek hrudníku pacientky z 09.02.2012 
Obr. 1b Rentgenový snímek hrudníku pacientky z 15.02.2012 
Plíživé zhoršování nastalo od února 2019, kdy si poprvé od událostí v roce 2012 pacientka opět stěžovala na námahovou dušnost, av srpnu 2019 se přidaly perimaleolární otoky. Kontrolní RTG hrudníku konstatoval neměnný nález oboustranného PV a ECHO srdce a sonografie cév dolních končetin nevykazovaly patologických odchylek. Další zhoršení námahové dušnosti s mírnou progresí fluidothoraxu na RTG hrudníku v únoru 2020 vedlo k redukci dávky na 60 mg denně. Zásadní zhoršení nastalo v červenci 2020. Na pravidelné ambulantní návštěvě pacientka udává 3 týdny trvající zhoršování námahové dušnosti až do dušnosti klidové, zhoršení otoků dolních končetin, pocit zvětšeného objemu břicha a suchý kašel. Při fyzikálním vyšetření dominuje dušnost NYHA IV, bilaterálně bazálně oslabené dýchání (více vpravo), otoky dolních končetin v celém jejich rozsahu a ascites, laboratorně pak elevace NTproBNP (2027 ng/l). Pacientka byla přijata k hospitalizaci, kde provedený RTG hrudníku prokázal pouze mírnou pravostrannou progresi fluidothoraxu (Obr. 2), ale nález na ECHO srdce již patologický byl ve smyslu dilatace a systolické dysfunkce pravostranných srdečních oddílů se známkami plicní hypertenze 3. stupně (krevní tlak v arteria pulmonalis 88 mm Hg). Pomocí CT angiografie byla vyloučena plicní embolie jako nejčastější příčina plicní hypertenze a stav byl uzavřen jako vysoce suspektní z plicní arteriální hypertenze způsobené léčbou dasatinibem. Klasifikace a nejčastější příčiny plicní hypertenze jsou shrnuty v Tabulce 1 [19]. Za hospitalizace byla nastavena léčba diuretiky a betablokátorem v rámci terapie akutního srdečního selhání a samozřejmě byl definitivně vysazen dasatinib. To vedlo k promptnímu zlepšení dušnosti a téměř úplné regresi otoků ještě před dimisí. Pacientka byla referována na jedno z 3 center specializovaných na diagnostiku a terapii PAH v ČR do FN Olomouc, kde byla během krátké hospitalizace potvrzena diagnóza těžké fixované prekapilární plicní arteriální hypertenze a nastavena příslušná terapie (duální antagonista endotelinového receptoru a selektivní inhibitor 5-fosfodiesterázy) s efektem dalšího zlepšení klinického stavu, posuzovaného během nynějších častých ambulantních návštěv, motivovaných úplným vysazením terapie TKI a potřebou udržení tzv. remise bez nutnosti podávání terapie (tretament-free remission, TFR). K datu poslední ambulantní návštěvy 20.10.2020 pacientka nadále setrvává v DMR, cítí se výborně, nemá žádných potíží a je kardiopulmonálně kompenzována. Stran specifické terapie PAH bude dle dalšího vývoje stavu zvažována léčba parenterálními prostanoidy.
Obr. 2 Rentgenový snímek hrudníku pacientky z 07.07.2020 
Tab. 1. Klasifikace plicní hypertenze 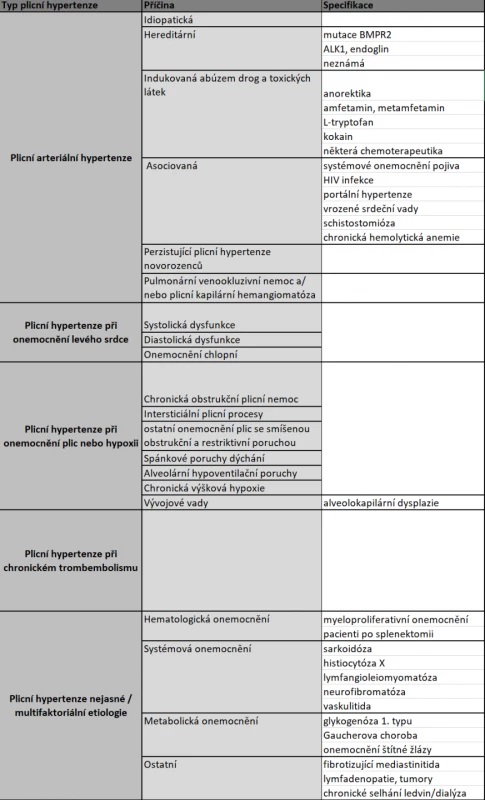
Diskuze a závěr
Rozdílný profil NÚ, typických pro jednotlivé TKI, je dán spektrem blokovaných tyrozinkináz. Exantém se s různou frekvencí vykytuje u všech TKI a i u prezentované pacientky se vyskytnul jak při terapii imatinibem tak při užívání dasatinibu. PV výpotky však představují NÚ specifický pro dasatinib: vyskytují se s frekvencí 14–35 %, jejich výskyt narůstá v čase a příčina se zdá být multifaktoriální [4,11,12]. Na prvním místě je „off-target“ vliv dasatinibu na ostatní inhibované kinázy. Nejčastěji jsou v této souvislosti skloňovány PDGFR-β (díky expresi na pericytech a buňkách hladké svaloviny se podílí na regulaci angiogeneze) a Src kinázy (ovlivňují buněčnou adhezi pleurálních epitelií a cévní propustnost) [10,13]. Dále je zvažována imunitní příčina, jednak s ohledem na vyšší podíl lymfocytů v punktátu nebo tekutině z bronchoalveolární laváže, a jednak s ohledem na reakci na podání kortikosteroidů a vyšší výskyt u pacientů s autoimunitním onemocněním [9,12]. Z rizikových faktorů, které pravděpodobnost rozvoje pleurálních výpotků zvyšují, se u naší pacientky vyskytla arteriální hypertenze a rovněž exantém po obou užívaných TKI. Další rizikové faktory zahrnují srdeční nebo plicní choroby, autoimunitní onemocnění, hypercholesterolémii, vyšší dávku dasatinibu nebo podávání 2krát denně, pokročilejší fázi choroby a také vyšší věk [2,4,11,12,16]. Terapie PV se řídí doporučením ELN a je názorně ukázána na výše prezentované kazuistice. Sestává se jednak z přerušení léčby dasatinibem, z podání diuretika a eventuálně kortikosteroidů. V případě symptomatického výpotku vyššího stupně je indikována také odlehčovací punkce PV, v krajním případě pak hrudní drenáž. Při následném obnovení léčby dasatinibem může být lék podáván ve stejné nebo redukované dávce [16]. Redukce dávky se není třeba obávat, protože nižší než doporučená dávka nebo alternující dávkovací schémata mají srovnatelnou účinnost a opakovaně bylo také prokázáno, že jsou spojeny s nižším výskytem NÚ včetně PV [2,14,15].
Plicní hypertenze může mít různé příčiny, jak přehledně shrnuje Tabulka 1[19]. Jednoznačně nejčastější je plicní embolie, kterou jsme u naší pacientky vyloučili provedením CT angiografie. Další neinvazivní metody, které jsou vhodné k diferenciální diagnostice plicní hypertenze, zahrnují RTG a CT hrudníku k vyloučení intersticiálních plicních onemocnění, ECHO srdce k ozřejmení funkčního stavu srdce a vyloučení levostranného srdečního selhání a vrozených vývojových vad, a také ventilačně-perfúzní scintigrafie plic taktéž k vyloučení plicní embolie. Specializovaným pneumologickým vyšetřením včetně funkčního plicního vyšetření můžeme odhalit chronickou obstrukční plicní nemoc nebo jiná onemocnění plic s obstrukční poruchou a alveolární hypoventilační poruchy. Část z těchto vyšetření podstoupila i naše pacientka, a výše uvedené příčiny a zejména pak plicní embolie byly jednoznačně vyloučeny.
Plicní arteriální hypertenze, představuje vzácnou ale o to závažnější komplikaci léčby dasatinibem. Na PAH je třeba myslet vždy při výskytu PV či dušnosti bez nálezu PV a měla by být vždy potvrzena pravostrannou srdeční katetrizací [4,16]. Odnětí dasatinibu často vede k úplné nebo částečné regresi nálezu a je v terapii PAH zásadní, stejně jako předání pacienta na specializované pracoviště ke zvážení specifické terapie, jak se stalo u naší pacientky [16]. Naše pacientka nyní setrvává 4. měsícem v TFR, která se stala novým cílem léčby pacientů s CML. Toto téma bylo uceleně zpracováno i v českém písemnictví [20]. V případě nárůstu BCR-ABL1 transkriptů by bylo u pacientky nutné znovuzavedení TKI. Do úvahy přichází nejspíše bosutinib, jehož podávání ale také může být komplikováno rozvojem pleurálních výpotků, nebo ponatinib v nižší dávce.
Závěrem lze říci, že dasatinib je velmi účinný i dobře snášený TKI, i když jeho užívání je rozvojem PV často provázeno. Při adekvátní terapii jsou však dobře zvládnutelné, jak dokládá i případ naší pacientky. PAH je naopak závažnou komplikací vylučující další podání dasatinibu, naštěstí je však její incidence nízká (≤ 1 %) [16]. Lepší poznání patogeneze PV a PAH může v budoucnu napomoci při výběru vhodných kandidátů pro léčbu dasatinibem. Do té doby je nutné pacienty řádně edukovat, aby byly PV i PAH co nejdříve odhaleny a zaléčeny. Slibným opatřením se jeví také užití nižších než standardně doporučených dávek či alternativních dávkovacích schémat, které už přinesly své plody v podobě redukce výskytu a závažnosti NÚ při zachované či dokonce zlepšující se účinnosti léčby.
Podíl autorů na přípravě rukopisu
PČ – napsání rukopisu
DŽ – ideový námět práce, ambulantní péče o pacientku, úpravy, doplnění, kontrola a revize rukopisu
AK, TH, LS – kontrola a revize rukopisu
Čestné prohlášení
D.Ž. poskytla konzultační služby společnosti Angelini, přednášela na edukačním sympoziu společnosti Angelini a satelitním sympoziu společnosti Bristol Myers Squibb a zúčastnila se odborné akce s podporou společnosti Novartis a Bristol Myers Squibb. Ostatní autoři prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik a publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Poděkování
Práce byla podpořena z Grantu pro specifický výzkum LF MU pod grantovým číslem MUNI/A/1595/2020.
Adresa
MUDr. Daniela Žáčková, Ph. D.
Interní hematologická a onkologická klinika
Fakultní nemocnice Brno a Lékařská fakulta Masarykovy univerzity, Brno
Jihlavská 340/20
625 00 Brno
e-mail: zackova.daniela@fnbrno.cz
Do redakce doručeno dne 14. 11. 2020
Přijato po recenzi dne 23. 11. 2020.
Zdroje
1. Hochhaus A, Larson RA, Guilhot F, et al. Long-term outcomes of imatinib treatment for chronic myeloid leukemia. N Engl J Med. 2017;376(10):917–927.
2. Shah NP, Rouselot P, Schiffer Ch, et al. Dasatinib in imatinib-resistant or -intolerant chronic-phase chronic myeloid leukemia patient: 7-years follow-up of study CA 180-034. Am J Hematol. 2016;91(9):869–874.
3. Kantarjian HM, Giles F, Gattermann N, et al. Nilotinib (formerly AMN107), a highly selective BCR-ABL tyrosine kinase inhibitor, is effecctive in patients with Philaadelphia chromosome-positive chronic myelogenous leukemia in chronic phase following imatinib resistance and intolerance. Blood. 2007;110(10):3540–3546.
4. Cortes JE, Saglio G, Kantarjian HM, et al. Final 5-year study results of DASISION: The dasatinib versus imatinib study in treatment-Näive chronic myeloid leukemia patients trial. J Clin Oncol.2016;34(20):2333–2340.
5. Hochhaus A, Saglio G, Hughes TP, et al. Long-term benefits and risks of frontline nilotinib vs imatinib for chronic myeloid leukemia in chronic phase: 5-year update of the randomized ENESTnd trial. Leukemia.2016;30(5):1044–1054.
6. Zackova D, Klamova H, Belohlavkova P, et al. Dasatinib treatment long-term results among imatinib-resistant/intolerant patients with chronic phase chronic myeloid leukemia are favorable in daily clinical practice. Leuk Lymphoma. 2021;62(1):194–2020.
7. Lombardo LJ, Lee FY, Chen P, et al. Discovery of N-(2-chloro-6-methyl - phenyl)-2-(6-(4-(2-hydroxyethyl)-piperazin-1-yl)-2-methylpyrimidin-4-ylamino)thiazole-5-carboxamide (BMS-354825), a dual Src/Abl kinase inhibitor with potent antitumor activity in preclinical assays. J Med Chem.2004;47 : 6658–6661.
8. O´Hare T, Walters DK, Stoffregen EP, et al. In vitro activity of Bcr-Abl inhibitors AMN107 and BMS-354825 against clinically relevant imatinib-resistent Abl kinase domain mutants. Cancer Res.2005;65 : 450–4505.
9. Bergeon A, Rea D. Levy V, et al. Lung abnormalities after dasatinib treatment for chronic myeloid leukemia. Am J Respir Crit Care Med.2007;176 : 814–818.
10. Luton F, Verges M, Vaerman JP, et al. The SRC family protein tyosine kinase p62yes contols polymeric IgA transcytosis in vivo. Mol Cell.1999;4 : 627–632.
11. Quintás-Cardama A, Kantarjian H, O'Brien S, et al. Pleural effusion in patients with chronic myelogenous leukemia treated with dasatinib after imatinib failure. J Clin Oncol.2007;25 : 3908–3914.
12. de Lavallade H, Punnialingam S, Milojkovic D, et al. Pleural effusions in patients with chronic myeloid leukaemia treated with dasatinib may have an immune-mediated pathogenesis. Br J Haematol.2008;141 : 745–747.
13. Hellstom M, Kalen M, Lindahl P, et al. Role of PDGF-B and PDGFR - in recruitment of vascula smooth muscle cells and pericytes during embryonic blood vesel formation in the mouse. Development.1999;126 : 3047–3055.
14. La Rosée P, Martiat P, Leitner A, et al. Improved tolerability by a modified intermittent treatment schedule of dasatinib for patients with chronic myeloid leukemia resistant or intolerant to imatinib. Ann Hematol.2013;92(10):1345–1350.
15. Naqvi K, Jabbour E, Skinner J, et al. Long-term follow-up of lower dose dasatinib (50 mg daily) as fontline therapy in newly diagnosed chronic-phase chronic myeloid leukemia. Cancer.2020;126 : 67–75.
16. Steegmann JL, Baccarani M, Breccia M, et al. European LeukemiaNet recommendations for the management and avoidance of adverse events of treatment in chronic myeloid leukaemia. Leukemia.2016;30 : 1648–1671.
17. Dodson MW, Brown LM, Elliot ChG. Pulmonary arterial hypertension. Heart Fail Clin.2018;14(3):255–269.
18. Baccarani M, Saglio G, Goldman J, et al. Evolving concepts in the management of chronic myeloid leukemia: recommendations from an expert panel on behalf of the European LeukemiaNet. Blood.2006;108(6):1809–1820.
19. Ryan JJ, Thenappan T, Luo N, et al. The WHO classification of pulmonary hypertension: A case-based imaging compendium. Pulm Circ.2012;2(1):107–121.
20. Čičátková P, Žáčková D. Vysazování inhibitorů tyrozinkináz u pacientů s chronickou myeloidní leukemií ve studiích a klinické praxi. Transfuze Hematol Dnes.2020;26(4):281–293.
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2020 Číslo Preview preliminary publication- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Nejasný stín na plicích – kazuistika
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- Když se ve střevech děje něco nepatřičného...
- Subkutánne vs. intravenózne imunoglobulíny u pacientov s CLL
-
Všetky články tohto čísla
- Úskalí léčby chronické myeloidní leukemie dasatinibem – plicní arteriální hypertenze jako vzácná komplikace
- Periferně zaváděný centrální katetr je bezpečným prostředkem zajišťujícím dlouhodobý centrální žilní přístup u nemocných s akutní leukemií - zkušenosti jednoho centra
- POEMS syndrom – vzácné onemocnění asociované s monoklonální gamapatií a polyneuropatií: diagnostika a terapie
- Obinutuzumab v léčbě pacientky s Waldenströmovou makroglobulinémií netolerující rituximab: popis případu
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- POEMS syndrom – vzácné onemocnění asociované s monoklonální gamapatií a polyneuropatií: diagnostika a terapie
- Obinutuzumab v léčbě pacientky s Waldenströmovou makroglobulinémií netolerující rituximab: popis případu
- Periferně zaváděný centrální katetr je bezpečným prostředkem zajišťujícím dlouhodobý centrální žilní přístup u nemocných s akutní leukemií - zkušenosti jednoho centra
- Úskalí léčby chronické myeloidní leukemie dasatinibem – plicní arteriální hypertenze jako vzácná komplikace
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



