-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
preLekára.sk / Odborné časopisy / Transfuze a hematologie dnes / 2020 - Preview preliminary publicationObinutuzumab v léčbě pacientky s Waldenströmovou makroglobulinémií netolerující rituximab: popis případu
Obinutuzumab in the treatment of a patient with Waldenström macroglobulinemia and rituximab intolerance: a case report
Obinutuzumab is a new anti-CD20 monoclonal antibody predominantly used in the treatment of patients with chronic lymphocytic leukaemia and follicular lymphoma. In our case report, we describe successful treatment using obinutuzumab in a patient with Waldenström macroglobulinemia. This therapy was used as 4th line-treatment and led to complete biochemical and clinical response of Waldenström macroglobulinemia. Obitunuzumab could thus be useful option even in such a rare disease.
Keywords:
obinutuzumab – Waldenström macroglobulinemia
Autori: Z. Adam; M. Krejčí; L. Pour; M. Štork; V. Sandecká; Z. Král
Pôsobisko autorov: Interní hematologická a onkologická klinika LF MU a FN Brno
Vyšlo v časopise: Transfuze Hematol. dnes,1, 2020, No. Preview preliminary publication, p. 1-15.
Súhrn
Obinutuzumab je nová anti-CD20 monoklonální protilátka, registrovaná pro léčbu nemocných s chronickou B-lymfocytární leukemií a pro pacienty s folikulárním lymfomem. V tomto popisovaném případě byla použita v rámci čtvrté linie léčby u pacientky s Waldenströmovou makroglobulinémií. Při terapii obinutuzumabem bylo dosaženo kompletní biochemické a také klinické léčebné odpovědi. Obinutuzumab může být přínosným lékem i pro tak vzácnou diagnózu, jakou je Waldenströmova makroglobulinémie.
Klíčová slova:
obinutuzumab – Waldenströmova makroglobulinémie
Zkrácený název práce: Obinutuzumab v léčbě WM
ÚVOD
Waldenströmova makroglobulinémie (WM), jedna z nemocí ze skupiny monoklonálních gamapatií, má desetkrát nižší incidenci než mnohočetný myelom (0,4–0,5 /100 000 obyvatel), ale přesto je to nemoc natolik známá, že jsou ji věnována opakovaně aktualizovaná léčebná doporučení České myelomové skupiny [1–3]. Symptomy, které vedou ke stanovení diagnózy a k zahájení léčby, jsou v konkrétních případech odlišné. Klasickým projevem je hyperproteinémie s hyperviskozitou, s typickým nálezem na očním pozadí (fundus paraproteinemicus). Hyperproteinémie s hyperviskozitou může způsobovat epistaxi a další krvácivé projevy. Jindy je dominujícím příznakem cytopenie, která je také indikací k léčbě. V dalších případech jsou to typické B-symptomy, protože tato nemoc asi v 60 % případů vyvolává zánětlivou reakci organismu se vzestupem laboratorních ukazatelů zánětu. V menšině případů jsou pak dominujícími příznaky autoimunitní projevy typu nemoci chladových aglutininů anebo kryoglobulinémie. Monoklonální imunoglobulin typu IgM se váže na autoantigeny a způsobuje autoimunitní projevy častěji než monoklonální imunoglobulin typu IgG [4–10].
Pro léčbu WM se v rámci léčby první linie doporučují cytostatika (cyklofosfamid, bendamustin a jiná) s anti-CD20 monoklonální protilátkou rituximabem. Rituximab se používá i při léčbě relapsu WM [1–10]. Ale co v případě intolerance rituximabu?
Odborná literatura popisuje v případě WM terapeutické použití dominantně dvou anti-CD20 monoklonálních protilátek, rituximabu a ofatumumabu. Do září 2020 nebyly zveřejněny in extenso výsledky žádné klinické studie, která by cíleně hodnotila obinutuzumab v souboru pacientů s WM. Pouze jeden pacient s WM byl léčen v rámci klinické studie fáze 1, jak popsal Salles v roce 2012. Další dva pacienti s WM byli léčeni standardními dávkami obinutuzumabu v rámci klinické studie fáze II, zaměřené na pacienty s refrakterními či relabujícími lymfomy [11]. Zatím pouze ve formě abstraktu byly zveřejněny výsledky studie fáze II. Tato studie analyzovala kombinaci idelalisib a obinutuzumab u refrakterních či relabovaných nemocných s WM [12]. V případě chronické lymfocytární leukemie a folikulárního lymfomu je na rozdíl od WM již hodně klinických studií publikovaných in extenso, popisujících úspěšné použití obinutuzumabu. Waldenströmova makroglobulinémie pro svoji vzácnost nebyla předmětem registračních studií obinutuzumabu. Waldenströmova makroglobulinémie však také patří mezi CD-20 pozitivní low grade lymfoproliferace, a tedy lze očekávat, že obinutuzumab bude stejně dobře fungovat jako v případě výše uvedených diagnóz. Důvodem, proč jsme u naší pacientky upřednostnili obinutuzumab před ofatumumabem, byly mimo jiné výsledky srovnávací studie rituximabu, ofatumumabu a obinutuzumabu provedené in vitro a na xenograftovém modelu, které uvádějí, že právě obinutuzumab je z těchto tří anti-CD20 monoklonálních protilátek nejúčinnější [13].
Popis případu
Pacientka byla až do roku 2006 celkem zdravá, nebrala pravidelně žádné léky a neudávala žádné závažné nemoci. V roce 2006 se dostala na gynekologii pro metrorhagii při děložních myomech. Po gynekologické operaci však přetrvávala vysoká sedimentace erytrocytů, ta byla důvodem k dalšímu vyšetření a nakonec ke stanovení diagnózy WM.
V době příchodu na naše pracoviště pacientka uváděla subfebrilie, noční pocení, migrující bolesti malých i velkých kloubů. Provedená trepanobiopsie kostní dřeně prokázala v roce 2006 30% lymfoplazmocytární infiltraci. Pacientka vstupně měla zvýšenou koncentraci celkové bílkoviny 106 g/l, hraniční hypoalbuminémii 32 g/l, dále opakovaně vyšší hodnotu C-reaktivního proteinu (CRP). Také byla přítomna normocytární anémie s hodnotou hemoglobinu 90 g/l. Vstupní koncentrace monoklonálního imunoglobulinu (MIg) typu IgM byla 32 g/l. Šlo tedy o symptomatickou formu WM s typickými příznaky: anémie a chronická zánětlivá reakce způsobená touto maligní nemocí.
V květnu 2006 byla léčba WM zahájena kombinací rituximab, fludarabin a cyklofosfamid. V prvním cyklu léčba byla aplikována kompletně včetně rituximabu, po kterém však vznikla mírná alergická reakce, zvládnutelná ambulantně. Po druhé aplikaci rituximabu se rozvinula závažná šoková reakce s nutností akutní hospitalizace a léčby na jednotce intenzivní péče. Progredující bronchospasmus, rinitida, konjunktivitida a kožní ekzém nedovolily dokončit podání rituximabu, a tak od jeho další aplikace bylo ustoupeno. Ale i po těchto dvou cyklech bylo dosaženo parciální remise WM s poklesem MIg typu IgM na 15 g/l. Pro dlouhodobě přetrvávající cytopenii po těchto dvou cyklech nebylo v léčbě dále pokračováno a pacientka byla dalších 6 let jen sledována. B-symptomy po těchto dvou cyklech vymizely.
V roce 2012 se navrátily stejné klinické symptomy nemoci (patologická únava a B-symptomy), progrese WM byla potvrzena další trepanobiopsií, v níž byla popsána až 40% infiltrace lymfoplazmocytárními buňkami. Proto v listopadu 2012 v rámci druhé linie léčby byla použita kombinace cyklofosfamid, bortezomib a dexametazon. Tolerance této léčby byla dobrá, a tak bylo celkem podáno 8 cyklů (měsíců) léčby do května 2013. Po třetím měsíci (cyklu) léčby vymizely symptomy nemoci a pacientka se dostala opět do parciální remise s poklesem koncentrace MIg typu IgM na 2,4 g/l.
Remise trvala až do srpna 2017, kdy byla pro další progresi nemoci obnovena léčba, tentokrát ve složení bendamustin, bortezomib a dexametazon. V listopadu 2017 po pěti cyklech byla léčba ukončena po dosažení parciální remise s koncentrací MIg typu IgM 3,0 g/l. Důvodem k ukončení léčby již po pěti cyklech byla neuropatie. Tabulka 1 shrnuje použité léčebné režimy v čase. Tato remise však již byla krátká, vydržela pouze do listopadu 2019, kdy byla při ambulantní kontrole zjištěna další recidiva WM.
Tab. 1. Přehled použitých léčebných linií v čase a výsledná léčebná odpověď u pacientky s WM. 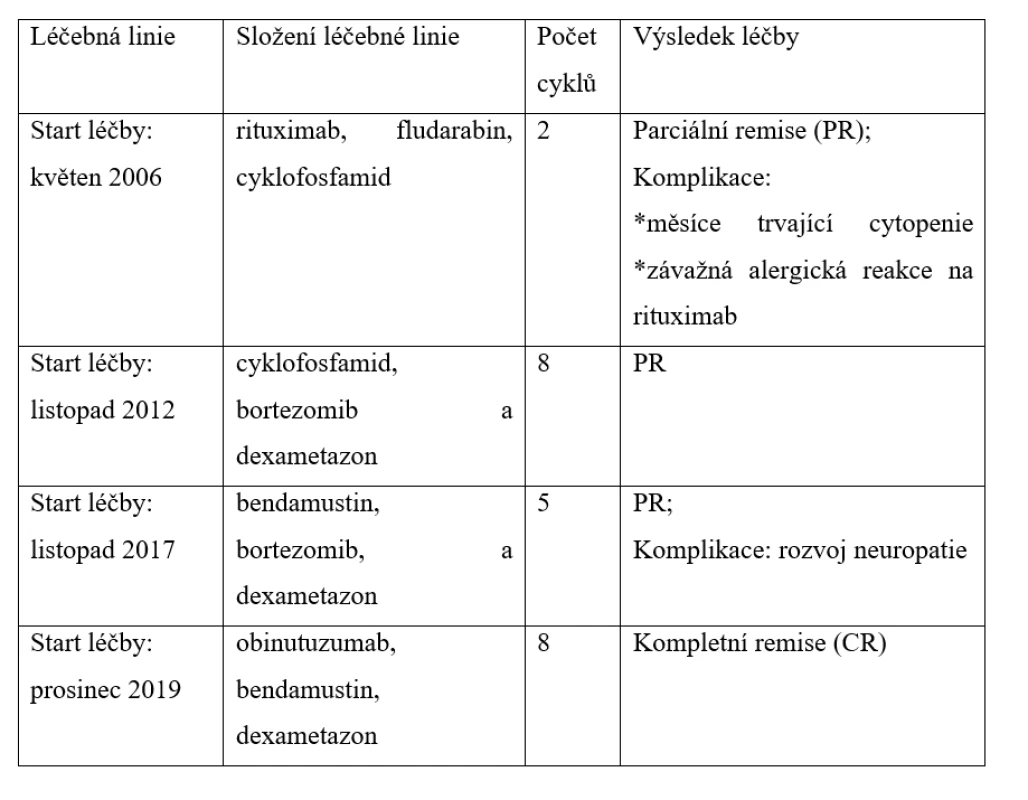
V prosinci 2019 pro čtvrtý relaps WM byla zahájena léčba ve složení obinutuzumab (Gazyvaro) v klasické celkové dávce 1000 mg den 1 cyklu a bendamustin v redukované dávce 70 mg/m2 1. a 15. den cyklu a dexametazon 20 mg 1. a 15. den cyklu. Na zahájení léčby byla pacientka hospitalizována, aby mohla být aplikace obinutuzumabu dostatečně pomalá. První podání obinutuzumabu bylo rozděleno do dvou dnů, první den bylo v pomalé infuzi podáno 100 mg, další den pak zbylých 900 mg. Při další aplikaci již ambulantní cestou jsme obinutuzumab podávali vždy celou dávku 1 000 mg v jeden den po obvyklé premedikaci kortikoidy a antihistaminiky. Tuto léčbu pacientka zvládla bez alergické reakce. Léčba dle vývoje MIg typu IgM byla spojena s rychlým nástupem biochemické léčebné odpovědi a s vymizením symptomů po druhém cyklu. Celkem bylo podáno 8 cyklů terapie a bylo dosaženo kompletní remise (CR) WM. Dávku bendamustinu jsme museli v průběhu léčby redukovat pro neutropenii, kterou nebylo možné řešit obvyklou aplikací injekcí leukocytárních růstových faktorů (G-CSF), protože pacientka tyto injekce také netolerovala. Tabulka 2 pak demonstruje rychlý nástup léčebné odpovědi při použití poslední léčebné linie. Monoklonální imunoglobulin poklesl na denzitometricky nekvantifikovatelné hodnoty, pouze imunofixační elektroforéza prokázala přetrvávající linii malého množství MIg.
Tab. 2. Vývoj laboratorních parametrů, které mají vztah k aktivitě nemoci a léčebné odpovědi v průběhu 8 cyklů léčby obsahující obinutuzumab, bendamustin a dexametazon. 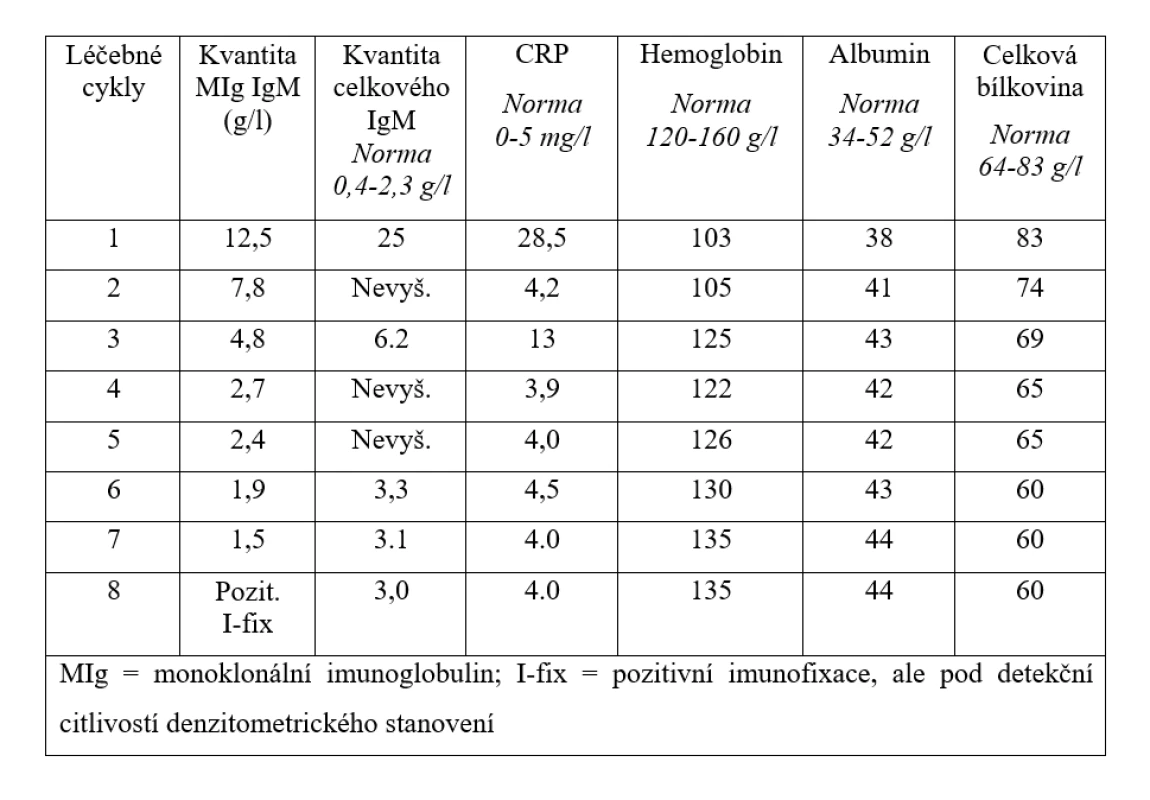
DISKUSE
Indolentní B-buněčné nehodgkinské lymfomy dle WHO klasifikace jsou heterogenní skupinou onemocnění, vycházející z B-buněčné linie. Obvykle pozvolna progredují, a tedy nástup klinických příznaků bývá nenápadný. Nejčastějším z této skupiny je folikulární lymfom, který představuje 22 % všech maligních nehodgkinských lymfomů dle WHO klasifikace, následuje jej lymfocytární lymfom (small lymphocytic lymphoma – SLL/chronická lymfocytární leukemie) představující 6 % a lymfom marginální zóny, přestavující také 6 % případů všech nehodgkinských lymfomů. Lymfoplazmocytární lymfom, který je morfologickým podkladem Waldenströmovy makroglobulinémie, činí jen 1 % všech nehodgkinských lymfomů. Všechny tyto choroby mají na svých buňkách přítomný CD20 antigen. Tento antigen je přítomen od časné pro-B fáze, až po lymfoplazmocytární buňky, ale není již na buňkách plazmatických [1-10].
Rituximab byl první monoklonální protilátkou, vázající se na antigen CD20, která byla schválena pro klinickou praxi agenturou FDA (Food and Drug Administration) v listopadu roku 1997 a evropskou agenturou EMA (European Agency for the Evaluation of Medicinal Products) v červnu roku 1998. Od té doby jsme byli svědky výrazného zlepšení výsledků léčby všech B - lymfoproliferativních chorob, jak indolentních tak i agresivních.
V dalších letech byly testovány jak protilátky s jiným cílem, s nebo bez navázaného toxinu, tak také probíhaly snahy o optimalizaci anti-CD20 monoklonální protilátky s cílem zvýšit vazebnou kapacitu na CD20 antigen, nebo zvýšit aktivitu této protilátky.
Ofatumumab byl syntetizován tak, aby se vázal na nový membránový epitop, a tedy vedl k výraznější na komplementu závislé cytotoxicitě ve srovnání s rituximabem. Ale i přes vyšší vazebnou kapacitu nebyla prokázána superiorita ofatumumabu nad rituximabem v rámci srovnávací studie u pacientů folikulárním lymfomem [14].
Nicméně podání ofatumumabu se objevilo v doporučení pro léčbu WM z roku 2016 [15] a v odborné literatuře je několik publikací, které pozitivně hodnotí použité této látky u pacientů s Waldenströmovou makroglobulinémií a doporučují ji [16–18].
Další testovanou látkou byl obinutuzumab. Zprvu byl testován u chronické lymfatické leukemie a až posléze byl testován u refrakterních indolentních lymfomů. Dále byla srovnávána léčba pomocí obinutuzumabu s bendamustinem oproti monoterapii bendamustinem.
Obinutuzumab byl schválen agenturou FDA v listopadu 2013 a evropskou agenturou EMA v květnu 2014 v kombinaci s chlorambucilem pro léčbu dříve neléčených pacientů s chronickou B-lymfocytární leukemií. V únoru roku 2016 byl také obinutuzumab schválen agenturou FDA pro léčbu refrakterních folikulárních lymfomů v kombinaci s bendamustinem na základě výsledků randomizované klinické studie GADOLIN [19].
Obinutuzumab je typ II anti-CD20 protilátky, s nižší cytotoxicitou závislou na komplementu, ale s větší intenzitou buněčné cytotoxicity závislé na protilátce. Je fakt, že obinutuzumab je in vitro více účinný než rituximab [13, 20]. V rámci randomizované studie fáze II (nazvané GAUSS) byla srovnána monoterapie obinutuzumabem a rituximabem. V tomto prvním randomizovaném srovnání byla testována monoterapie obinutuzumabem anebo rituximabem u 175 nemocných s relabubujícími indolentními lymfomy po předchozí léčbě kombinovanými režimy s rituximabem. Pacienti dostali v týdenních intervalech 4 infuze buď rituximabu v dávce 375 mg/m2 nebo obinutuzumabu (1000 mg celková dávka). Po ukončení těchto 4 aplikací dostávali pacienti s léčebnou odpovědí ten samý léčivý přípravek v rámci udržovací léčby ve dvouměsíčních intervalech po dobu dvou let. V podskupině pacientů s folikulárním lymfomem (n = 149), byla celková léčebná odpověď (overall response rate – ORR) o 11 % vyšší po obinutuzumabu než po rituximabu (44,6 % oproti 33,3 %, p = 0,08). Tento výsledek byl zřetelný v celé skupině pacientů, v níž nezávislý panel hodnotitelů prokázal vyšší ORR po obinutuzumabu než po rituximabu (44,6 % oproti 26,7 %, p = 0.01). Uvedené rozdíly se však nepromítly do zlepšení bezpříznakového přežití (progression-free survival, PFS). Incidence nežádoucích reakcí byla shodná po rituximabu i po obinutuzumabu s výjimkou vyšší četnosti poinfúzních reakcí po obinutuzumabu. Tato studie tedy prokázala vyšší počet celkových léčebných odpovědí (ORR) bez závažnějších rozdílů v toxicitě léčby [21].
V klinické studii s názvem GALLIUM bylo randomizováno 1202 pacientů s folikulárními lymfomy do skupiny dostávající standardní chemoterapii buď s klasickou dávkou rituximabu, nebo s klasickou dávkou obinutuzumabu.
Obinutuzumab byl v této studii podáván 1., 8. a 15. den v dávce 1000 mg a pak vždy první den dalšího cyklu, rituximab byl podáván v standardní dávce 375 mg/m2 první den každého cyklu.
První hodnocení, které bylo provedeno při mediánu sledování 34,5 měsíců, prokázalo, že chemoterapie v kombinaci s obinutuzumabem měla lepší výsledky, nižší riziko progrese a nižší riziko úmrtí, než chemoterapie v kombinaci s rituximabem. Tříletý bezpříznakový interval byl 80,0 % versus 73,3% [22].
Stejně tak další analýza publikovaná s mediánem sledování 41,1 měsíce prokázala delší PFS ve skupině s obinutuzumabem a chemoterapií ve srovnání se skupinou léčenou rituximabem a chemoterapií [23–24]. Signifikantní rozdíly v délce celkového přežití (overall survival, OS) nebyly ve studii GALLIUM prokázány. Další publikace pozitivní hodnocení obinutuzumabu ve srovnání s rituximabem jen potvrdily [25,26].
Z nežádoucích účinků obinutuzumabu je nutno zmínit reakci v průběhu infúzní aplikace tohoto léčivého přípravku. Může se projevit hypotenzí či hypertenzí, tachykardií, dušností, horečkou a zimnicí, dále nevolností a zvracením, průjmem, ale také zarudnutím. Tato reakce je vysvětlována rychlou destrukcí cirkulujících B-buněk a uvolněním cytokinů Il-6 a Il-8. Tento vzestup cytokinů je výraznější po první aplikaci obinutuzumabu než po první aplikaci rituximabu. V průběhu dalších infuzí se pak již hladiny cytokinů zvyšují méně intenzivně. Incidence infúzních reakcí se pohybují mezi 64 % a 86 %, většinou jsou to méně závažné nežádoucí reakce, obvykle stupně I a II [27].
V klinické studii s názvem GAUSS byl srovnáván obinutuzumab s rituximabem. Četnost poinfúzních reakcí byla vyšší u pacientů léčených obinutuzumabem (74 %) než u pacientů léčených rituximabem (51 %). A stejně tak vyšší byl počet poinfúzních reakcí stupně III a IV, 11 % po obinutuzumabu a 5 % po rituximabu [21]. Infúzní reakci lze převážně očekávat v průběhu první infúzní aplikace a obvykle vymizení po zpomalení infúze či přidání glukokortikosteroidů. V klinických studiích se incidence pohybovala od 64 % po 89 %. Nicméně u 7 % pacientů byla infuzní reakce natolik závažná, že nebylo možné v léčbě dále pokračovat [28, 29]. K prevenci se používá paracetamol, antihistaminika a glukokortikoidy, ale tato opatření dle zkušeností z klinických studií mají jen částečný efekt [11]. K infúzním reakcím patří i dušnost a kardiální problémy, a proto je třeba vyšší obezřetnosti u pacientů s onemocněním srdce a plic. Je důležité, i když nelehké, odlišit tyto poinfúzní reakce mediované cytokiny z destruovaných buněk od podstatně vzácnější alergické reakce na podávanou látku.
Z hematologických nežádoucích účinků byla pozorována neutropenie. Při monoterapii byla závažná neutropenie (III. a IV. stupně) zaznamenána asi u 10 % léčených. Kombinace obinutuzumabu s chemoterapií dále zvyšovala incidenci neutropenie [11]. Závažné klinické infekce III. a IV. stupně provázely léčbu obinutuzumabem a bendamustinem asi u 10 % nemocných v jedné studii, zatímco při monoterapii bendamustinem provázely jen 3 % léčených [22].
Při schválení obinutuzumabu se dále objevila informace, že tato léčba zvyšuje riziko reaktivace hepatitidy B. Při léčbě rituximab v kombinaci s chemoterapií (R-CHOP) bylo u pacientů s průkazem povrchového antigenu viru hepatitidy B 59–80% riziko reaktivace hepatitidy. Pacienti, u nichž dříve přítomný povrchový antigen hepatitidy B (HBsAg) vymizel, měli stále ještě 9–24% riziko reaktivace [30]. Proto je vhodné u všech pacientů před zahájením terapie vyšetřit HBsAg. V případě pozitivity se doporučuje pak protivirová profylaxe, jak u rituximabu, tak i u obinutuzumabu. U pacientů dříve pozitivních s negativním výsledkem HBsAg se doporučuje kontrolování možné reaktivace včetně PCR vyšetření HBV.
Dle informací Státního ústavu pro kontrolu léčiv (SÚKL) platných k říjnu 2020 je obinutuzumab hrazen plátci zdravotního pojištění za určitých specifikovaných podmínek u pacientů s chronickou lymfatickou leukemií (CLL) a folikulárním lymfomem (FL). U jiných diagnóz je nutno požádat o schválení obinutuzumabu revizního lékaře příslušné zdravotní pojišťovny na paragraf 16.
V našem případě jsme podávali lék po souhlasu s výjimkou z výše uvedeného pravidla plátcem zdravotní péče. Lymfoplazmocytární lymfom je proti FL či CLL podstatně vzácnější, takže se ekonomicky nevyplatí organizovat pro tak vzácnou diagnózu registrační studie, což je standardní problém nemocí s nízkou incidencí. Obinutuzumab jsme podávali v rámci 4. léčebné linie vždy 1x měsíčně spolu s chemoterapií celkem 8 léčebných cyklů a dosáhli jsme kompletní remise MW, tedy lepší léčebné odpovědi, než při terapii předchozími režimy. Toto by mohlo souviset s popisovanou vyšší účinností obinutuzumabu ve srovnání s rituximabem a ofatumumabem v laboratorních testech [13]. Právě proto jsme se rozhodli u naší pacientky, která netolerovala rituximab, vybrat ze dvou dalších anti-CD20 monoklonálních protilátek (ofatumumabu a obinutuzumabu) právě obinutuzumab. Tolerance obinutuzumabu byla u naší nemocné velmi dobrá a v průběhu terapie nebyly zaznamenány závažnější komplikace.
Možným alternativním řešením by byla léčba ibrutinibem v monoterapii dle genetického profilu. Ibrutinib má maximální účinnost v případech MYD88 mutace a negativity CXCR4 mutace. Další terapeutickou variantou by bylo případně použití BCL2 inhibitorů, anebo PI3K inhibitorů, jak uvádějí citovaná doporučení České myelomové skupiny [1].
ZÁVĚR
Obinutuzumab je nová anti-CD20 protilátka, které má zatím registraci pouze pro nemocné s CLL a pro pacienty s FL. Přínos obinutuzumabu v léčbě CLL a FL dokumentují také publikace v české odborné literatuře [31–34]. V našem popisovaném případu byl obinutuzumab použit po souhlasu plátce zdravotní péče v rámci čtvrté linie léčby u pacientky s Waldenströmovou makroglobulinémií. Pacientka netolerovala rituximab, přitom potřebovala další účinnou léčbu. Po léčbě obinutuzumabem a bendamustinem bylo dosaženo kompletní remise WM s vymizením klinických symptomů a normalizací krevního obrazu. Obinutuzumab může být přínosným lékem i pro tak vzácnou diagnózu, jakou je právě WM.
Podíl autorů na přípravě rukopisu
ZA – příprava rukopisu
KM1, PL, ŠM, SV, KM2, KZ – korekce a revize rukopisu
Čestné prohlášení autorů
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Adresa pro korespondenci
prof. MUDr. Zdeněk Adam, CSc.
Interní hematologická a onkologická klinika LF MU a FN Brno
Jihlavská 20, 625 00 Brno
Email: adam.zdenek@fnbrno.cz
Do redakce doručeno dne 31. 7. 2020.
Přijato po recenzi dne 27. 10. 2020.
Zdroje
- Hájek R. Diagnostika a léčba Waldenströmovy makroglobulinemie. Transfuze Hematol Dnes. 2019;25(Suppl 1):7–33.
- Adam Z, Hájek R, Krejčí M., et al. Diagnostika a léčba Waldenströmovy makroglobulinemie : doplněk č. 1 k doporučení z 9/2012 Diagnostika a léčba mnohočetného myelomu. Transfuze Hematol Dnes. 2014;20(Suppl):7–22.
- Sakalová A, Škultétyová D, Konečná Z., et al. Súčasná klasifikácia, diagnostika a prognóza primárnych monoklonových gamapatií (paraproteinémií). Transfuze Hematol Dnes. 2010;16 : 193–201.
- Adam Z, Koukalová R, Krejčí M., et al. Chronická recidivující kopřivka, bolesti kostí i kloubů, horečka nejasného původu a monoklonální imunoglobulin typu IgM = syndrom Schnitzlerové Transfuze Hematol Dnes. 2018;24 : 88–103.
- Gavriatopoulou M, Musto P, Hájek R, et al. European myeloma network recommendations on diagnosis and management of patients with rare plasma cell dyscrasias. Leukemia. 2018;32 : 1883–1898.
- Tichý M, Maisnar V. Monoklonální imunoglobuliny – výskyt, význam a možnosti jejich průkazu. 1. vyd. Praha: Nucleus HK, 2012;9–16.
- Kaščák M, Ďuraš J, Navrátil M, et al. Autologní transplantace kmenových buněk u Waldenströmovy makroglobulinemie. Transfuze Hematol Dnes. 2016;22 : 28–38.
- Ščudla V, Minařík J, Pika T, et al. Diferenciální diagnostika monoklonálních gamapatií z pohledu klinické praxe. Int Med Prax. 2017;19 : 274–278.
- Pika T, Flodr P, Novák M, et al. Klinická problematika IgM monoklonálních gamapatií. Klin Bioch Metabol. 2014;22 : 61–64.
- Ševčíková S, Novák L, Beše L, et al. Molekulární podstata Waldenströmovy makroglobulinemie. Klin Onkol. 2012;25 : 413–420.
- Salles GA, Morschhauser F, Solal-Céligny P, et al. Obinutuzumab (GA101) in patients with relapsed/refractory indolent non-Hodgkin lymphoma: results from the Phase II GAUGUIN study. J Clin Oncol. 2013;31 : 2920–2926.
- Tomowiak C, Poulain S, Debiais C, et al. Idelalisib and obinutuzumab in relapsed or refraktory Waldenström´s macroglobulinaemia. Blood 2019;134(Suppl 1):346.
- Herter S, Herting F, Mundigl O, et al. Preclinical activity of the type II CD20 antibody GA101 (obinutuzumab) compared with rituximab and ofatumumab in vitro and in xenograft models. Mol Cancer Ther. 2013;12 : 2031–2042.
- Mössner E, Brünker P, Moser P, et al. Increasing the efficacy of CD20 antibody therapy through the engineering of a new Type II anti-CD20 antibody with enhanced direct and immune effector cell mediated B cell cytotoxicity. Blood 2010;115 : 4393–4402.
- Leblond V, Kastritis E, Advani R, et al. Treatment recommendations from the Eighth International Workshop on Waldenström's Macroglobulinemia. Blood. 2016;128 : 1321–1328.
- Gavriatopoulou M, Kastritis E, Kyrtsonis MC, et al. Phase 2 study of ofatumumab, fludarabine and cyclophosphamide in relapsed/refractory Waldenström's macroglobulinemia. Leuk Lymphoma. 2017;58 : 1506–1508.
- Furman RR, Eradat HA, DiRienzo CG, et al. Once-weekly ofatumumab in untreated or relapsed Waldenström's macroglobulinaemia: an open-label, single-arm, phase 2 study. Lancet Haematol. 2017;4:e24–e34.
- Buske C. Ofatumumab: another way to target CD20 in Waldenström's macroglobulinaemia? Lancet Haematol. 2017;4:e4–e5.
- Sehn LH, Chua N, Mayer J, et al. Obinutuzumab plus bendamustine versus bendamustine monotherapy in patients with rituximab-refractory indolent non-Hodgkin lymphoma (GADOLIN): a randomised, controlled, open-label, multicentre, phase 3 trial. Lancet Oncol. 2016;17 : 1081–1093.
- García-Muñoz R, López-Díaz-de-Cerio A, Feliu J, et al. Follicular lymphoma: in vitro effects of combining lymphokine-activated killer (LAK) cell-induced cytotoxicity and rituximab - and obinutuzumab-dependent cellular cytotoxicity (ADCC) activity. Immunol Res. 2016;64 : 548–557.
- Sehn LH, Goy A, Offner FC, et al. Randomized Phase II trial comparing obinutuzumab (GA101) with rituximab in patients with relapsed CD20+ indolent B cell non-hodgkin lymphoma: final analysis of the GAUSS study. J Clin Oncol. 2015;33 : 3467–3474.
- Marcus R, Devies A, Ando K, et al. Obinutuzumab for the first-line treatment of follicular lymphoma. N Engl J Med. 2017;377 : 1331–1344.
- Hiddemann W, Barbui AM, Canales MA, et al. Immunochemotherapy with obinutuzumab or rituximab for previously untreated follicular lymphoma in the randomized Phase III GALLIUM study: influence of chemotherapy regimen on efficacy and safety. J Clin Oncol. 2018;36 : 2395–2404.
- Friedberg JW. Progress in advanced-stage follicular lymphoma. J Clin Oncol. 2018;36 : 2363–2365.
- Seymour JF, Marcus R, Davies A, et al. Association of early disease progression and very poor survival in the GALLIUM study in follicular lymphoma: benefit of obinutuzumab in reducing the rate of early progression. Haematologica. 2019;104 : 1202–1208.
- Jamois C, Gibiansky E, Gibiansky L, et al. Role of obinutuzumab exposure on clinical outcome of follicular lymphoma treated with first-line immunochemotherapy. Br J Clin Pharmacol. 2019;85 : 1495–1506.
- Freeman CL, Morschhauser F, Sehn L, et al. Cytokine release in patients with CLL treated with obinutuzumab and possible relationship with infusion-related reactions. Blood. 2015;126 : 2646–2649.
- Radford J, Davies A, Cartron G, et al. Obinutuzumab (GA101) plus CHOP or FC in relapsed/refractory follicular lymphoma: results of the GAUDI study. Blood. 2013;122 : 1137–1143.
- Goede V, Fischer K, Busch R, et al. Obinutuzumab plus chlorambucil in patients with CLL and coexisting conditions. N Engl J Med. 2014;370 : 1101–1110.
- Kusumoto S, Tobinai K. Screening for and management of hepatitis B virus reactivation in patients treated with anti-B-cell therapy. Hematology 2014. 2014;1 : 576–583.
- Hadrabová M, Doubek M. Obinutuzumab. Remedia. 2016;26 : 44–48.
- Zuchnická J, Fečková-Mihályová J, Hájek R. Obinutuzumab v první linii léčby chronické lymfocytární leukemie ‒ zkušenosti z klinické praxe. Remedia. 2018;28 : 377–381.
- Belada D. Obinutuzumab v léčbě nehodgkinských B lymfomů – studie GADOLIN. Remedia. 2015;25 : 375–378.
- Šimkovič M. Obinutuzumab dosáhl v kombinaci s chlorambucilem ve srovnání s rituximabem zlepšení celkového přežití komorbidních pacientů s chronickou lymfocytární leukemií: finální analýza přežití ve studii CLL11. Transfuze Hematol Dnes. 2018;24 : 129–130.
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2020 Číslo Preview preliminary publication- Nejasný stín na plicích – kazuistika
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Léčba on-demand je jednoznačně neefektivní v prevenci vývoje hemofilické artropatie
-
Všetky články tohto čísla
- Úskalí léčby chronické myeloidní leukemie dasatinibem – plicní arteriální hypertenze jako vzácná komplikace
- Periferně zaváděný centrální katetr je bezpečným prostředkem zajišťujícím dlouhodobý centrální žilní přístup u nemocných s akutní leukemií - zkušenosti jednoho centra
- POEMS syndrom – vzácné onemocnění asociované s monoklonální gamapatií a polyneuropatií: diagnostika a terapie
- Obinutuzumab v léčbě pacientky s Waldenströmovou makroglobulinémií netolerující rituximab: popis případu
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- POEMS syndrom – vzácné onemocnění asociované s monoklonální gamapatií a polyneuropatií: diagnostika a terapie
- Obinutuzumab v léčbě pacientky s Waldenströmovou makroglobulinémií netolerující rituximab: popis případu
- Periferně zaváděný centrální katetr je bezpečným prostředkem zajišťujícím dlouhodobý centrální žilní přístup u nemocných s akutní leukemií - zkušenosti jednoho centra
- Úskalí léčby chronické myeloidní leukemie dasatinibem – plicní arteriální hypertenze jako vzácná komplikace
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



