-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
7. Léčebné strategie
Vyšlo v časopise: Transfuze Hematol. dnes,29, 2023, No. Supplementum 2, p. 48-58.
7.1. Výchozí poznatky pro léčebné strategie
Naše léčebná strategie se v průběhu minulých 4 let částečně obohatila doplněním několika nových léčebných kombinací v oblasti relapsu MM. Stále však čekáme na účinné kombinace pro nemocné refrakterní na lenalidomid. Bohužel v roce 2023 čekáme i na úhradu nejúčinnějších režimů používaných v relapsu u nemocných refrakterních na lenalidomid a nejúčinnějších režimů u nově diagnostikovaných nemocných. Jde přitom o zásadní přínos pro nemocného, neboť nejlepší kombinované režimy v primoléčbě mají medián doby do progrese až 5 let! Jen když budou nejlepší léčebné postupy používány celoplošně, můžeme pozorovat další zásadní zlepšování prognózy nemocných s MM v ČR.
Cílem u nově diagnostikovaných nemocných je dosažení dlouhodobé CR a to nejlépe s negativitou MRD. I v 1.–2. relapsu onemocnění je cílem využít potenciál nových kombinací k navození co nejlepší léčebné odpovědi, která se projeví významným prodloužením doby do další progrese. Zcela revoluční léčba pomocí CAR-T a bispecifických protilátek je doposud nehrazená a v doporučeních je jí věnováno jen limitované místo. Je nepochybné, že do vydání nových doporučení za 4–5 let dojde k zásadnímu pokroku právě díky této léčbě, se kterou má většina hemaotonkologických center již několikaleté zkušenosti v rámci klinických studií.
Doporučení pro podskupinu nemocných s vysokým rizikem definovaným na základě chromozomálních abnormalit se nemění. Režimy by měly obsahovat vždy proteasomový inhibitor, jde-li o rizikové translokace chromozomu t (4; 14), t (14; 16), t (14; 20) (Sonneveld, 2016). Tandemová autologní transplantace je standardem (podívej na algoritmus 7.1). Vždy, když to lze, by měla být použita trojkombinace nejúčinnějších dostupných léků.
Naše stávající léčebné strategie vycházejí z řady vědeckých a výzkumných poznatků, z nichž při nezbytném zjednodušení lze uvést tyto následující:
A) Každému MM předchází stav prekancerózy, tzv. monoklonální gamapatie nejasného významu (MGUS) (Landgren, 2009). Stavy od objevení se prvního klonálního plazmocytu přes MGUS, MM, refrakterní MM až po plazmocelulární leukemii na sebe navzájem navazují a u jednoho nemocného je lze považovat za jedno onemocnění měnící se v čase.
Do které fáze se vstupní klonální plazmocyt vyvine právě u daného nemocného, závisí na řadě vnitřních a vnějších faktorů, tím nejvýznamnějším je zpravidla časový faktor, resp. doba provedeného vstupního vyšetření.
B) Existuje řada podtypů mnohočetného myelomu, onemocnění je silně heterogenní. S tím souvisí i různá prognóza nemocných s MM. Všechny z dostupných klasifikací (na základě ISS či R-ISS, jen cytogenetického nálezu, genového expresního profilu a nejnověji cirkulujících myelomových buněk apod.) umožňují obecně rozdělit nemocné na nemocné s vysokým, nízkým a případně středním rizikem pro dlouhodobé přežití. Bohužel však žádná z klasifikací není natolik specifická, aby jednoznačně předurčovala léčebný úspěch a prognózu u daného nemocného (Fonseca, 2009; Munshi, 2011; Shaughnessy, 2007; Palumbo, 2015; Jelínek, 2023).
C) Na základě klonální teorie a doložených důkazů existuje u většiny nemocných s MM již vstupně při stanovení diagnózy více klonů plazmocytů s rozdílnými charakteristikami vč. senzitivity na léčbu. Jejich poměr se u daného nemocného mění v čase a v závislosti na léčbě. Nové klony pravděpodobně mohou vznikat i v průběhu léčby (Keats, 2012). Toto zjištění je v souladu s významnými úspěchy léčby s trojkombinací léků vč. vyléčení u nemocných léčených intenzivními sekvenčními léčebnými postupy sestávajícími se z nejúčinnějších léků.
D) Rezistence na daný lék nemusí být absolutní. Z výše uvedené klonální teorie vyplývá, že jestliže je onemocnění rezistentní na určitý lék např. při první progresi onemocnění, neznamená to automaticky, že ve čtvrté progresi onemocnění bude rovněž na daný lék rezistentní. V té době může, ale nemusí být v kostní dřeni již přítomný v převaze klon senzitivní na lék nad klonem dříve rezistentním. V případě, že nejsou k dispozici jiné léčebné možnosti, je vhodné odzkoušet senzitivitu na dříve použité léky.
E) Existují metody (průtoková cytometrie, sekvenování nové generace) umožňující vyhodnocení zbytkového nádorové onemocnění se senzitivitou až 10–6. Současně je nepochybné, že dosažení dlouhodobé MRD negativity je nezávislým prognostickým faktorem pro nemocné s novou diagnózou i relapsem onemocnění, přičemž tento stav lze dosáhnout u významné části nemocných s novou diagnózou, ale nově i u části nemocných v relapsu onemocnění (Landgren, 2016; Paiva, 2015; Munshi, 2017).
F) Efektivita režimů složených ze tří léků (dva nové plus dexametazon) a nejnověji ze čtyř léků (tři nové léky plus dexametazon) je v relapsu MM mimořádná. Tyto režimy jsou zkoušené v primoléčbě (Mateos, 2018), záhy nahradí stávající standardy, možná s výjimkou režimu daratumumab-lenalidomid-dexametazon.
G) Je zjevné, že tu stále bude skupiny vysoce rizikových nemocných (asi 20 %) s časově limitovanou prognózou, u které budeme především používat experimentální léčbu až do nalezení účinné.
Tab. 1. Léčba mnohočetného myelomu (MM) pro pacienty vhodné k autologní transplantaci – primoléčba. 
*Jak autologní transplantace, tak konsolidace jsou možné možnosti volby dalšího postupu, je-li cílem dosažení hluboké remise
(kompletní remise a stavu MRD negativity (citlivost 10–5) potvrzenou průtokovou cytometrií nebo NGS. CR – kompletní remise;
Dara – daratumumab; G-CSF – granulocytární kolonie stimulující růstový faktor; MM – monohočetný myelom; MR – minimální
léčebná odpověď; MRD – Minimální zbytková nemoc; NGS – sekvenování nové generace; PG – progrese; SD – stabilní
onemocnění; VRD – bortezomib, lenalidomid, dexamethason; VTD – bortezomib, thalidomid, dexamethason7.2. Léčebná strategie a léčebné linie
První léčebná linie, primoléčba, je léčba nové diagnózy. Druhá léčebná linie je léčba prvního relapsu či progrese. Jedna léčebná linie může zahrnovat indukční fází a udržovací fázi léčby. U nemocných vhodných k provedení autologní transplantace je doplněna o myeloablativní léčbu s podporou periferních krvetvorných kmenových buněk. Součástí jedné linie může být případně konsolidační léčba, zvláště v klinických studiích. Udržovací léčba je definovaná zpravidla dle klinických studií až do relapsu či progrese onemocnění nebo je z různých důvodů (např. bezpečnost) stanovena maximální délka udržovací léčby. Je zásadní správné stanovení linie léčby. Změna léčebné strategie z nějakého důvodu (rezistence, nedostatečná účinnost, rozhodnutí nemocného, …) znamená vždy změnu léčebné linie.
7.3. Základní kameny léčebné strategie
A) Kombinovaná léčba – Od začátku éry nových léků se snažíme používat kombinace léků. Lze pozorovat jednoznačný trend – významné omezení používání melfalanu, ale i cyklofosfamidu a talidomidu. Kombinace (VMP, MPT, CTD, CVD) nejsou v roce 2023 první volbou v 1.–3. léčebné linii, neboť jsou dostupné účinnější a více bezpečné trojkombinace. Na základě stávajících poznatků a evidence based medicine dat je zřejmé, že kombinace imudomodulační látky s proteasomovým inhibitorem je obecně výhodná z pohledu účinnosti i nežádoucích účinků, a to u nemocných vhodných i nevhodných pro provedení autologní transplantace, tedy v našich protokolech u juniorů i seniorů. Režim bortezomib-lenalidomid-dexametazon je jedním z účinných režimů dostupných v současnosti, který by měl být využívaný především v primoléčbě (Attal, 2017; Durie, 2017). Za zcela revoluční lze z novějších trojkombinací označit především režim daratumumab-lenalidomid-dexametazon, jehož účinnost je jak v relapsu, tak v primoléčbě oproti ostatním režimům zásadně a skokově lepší (Facon, 2019; Dimopoulos, 2023). U předléčených nemcných s lenalidomidem jsou v relapsu vysoce účinné režimy s daratumumabem nebo isatuximabem v kombinaci s karfilzomibem a dexametazonem (viz příslušné kapitoly 8.7 a 8.9).
B) Dosažení maximální léčebné odpovědi jako první průběžný cíl léčebné strategie – Stanovení MRD negativity se senzitivitou až 10–6 je dnes dostupné. Dosažení kompletní remise (CR) bylo vždy prognosticky významným faktorem (Barlogie, 2006). Nejnověji se prognosticky z nemocných dosahujících kompletní remisi vyčleňují ti nemocní, kteří dosáhnou po léčbě negativní MRD a tento stav je dlouhodobý. Tito nemocní mají významně lepší prognózu nezávislou na použité léčbě (Munshi, 2017). Rozdíl je klinicky velmi významný. Jde dnes o již nezpochybnitelný prognostický parametr a cíl léčby! Ověření MRD negativity je vhodné doplnit nejlépe PET/CT vyšetřením k vyloučení aktivních fokálních ložisek (Kumar, 2016).
C) Existují i nemocní s indoletním myelomem, kteří nemusí být intenzivně léčeni – Existuje podskupina nemocných s profilem „like MGUS“ podle výsledku průtokové cytometrie (asi 5–7 %), která nikdy nedosáhne ani biochemické CR a přesto to neznamená špatnou prognózu (Paiva, 2013). Tyto nemocné lze najít mezi skupinou nemocných s pomalou reakcí na podanou léčbu a nízkým prognostickým rizikem. Je pravděpodobné, že u nich dochází k „vrácení“ onemocnění do stavu podobného v MGUS fázi. S jistou zbytkovou hladinou M-Ig ve fázi plató žijí tito nemocní dlouhodobě bez nové aktivity onemocnění. Pro jejich prognózu není rozhodující dosažení CR (Burgos, 2023). Naopak by bylo chybou za každou cenu nemocné léčit a snažit se dosáhnout CR pomocí rychlého střídání léků. Určení takového typu nemocného je dnes možné pomocí průtokové cytometrie. Pomůckou při rozhodování, zda jde o takový indolentní typ MM v klinické praxi, je stanovení nízkého rizika onemocnění pomocí ISS a FISH, velmi pozvolný pokles M-Ig při vstupní indukci, rovněž tak následně velmi pozvolný vzestup při progresi a již zmiňovaná nemožnost dosáhnout kompletní remise. Klíčové je, že po zastavení léčby je dlouhodobě hladina M-Ig v plató fázi.
D) Limitovaná konsolidační léčba – Pro jednoznačné doporučení konsolidační léčby v primoléčbě schází jednoznačně přesvědčivé údaje, třebaže je řada pozitivních analýz svědčících pro použití konsolidace. Dostupná data však nejsou tak silná a jednoznačná ve srovnání např. s udržovací léčbou lenalidomidem (Moreau, 2017; Sonneveld, 2016). Obecně má konsolidační léčba smysl tam, kde je cílem dále zlepšit léčebnou odpověď a optimálně dosáhnout hluboké remise. Obecně by měla mít konsolidace jiné složení léků než vlastní indukční léčba, což bude preferovaná strategie dalších let díky dostupnosti většího počtu léků. U nemocných vhodných k autologní transplantaci, je možností, která by měla být využitá tam, kde po první autologní transplantaci není dosaženo kompletní remise, respektive MRD negativity.
E) Udržovací léčba – Lenalidomid 10mg (21 dnů v 28denním cyklu) je doporučenou udržovací léčbou u všech nemocných po provedení autologní transplantace (Attal, 2012 a 2017; McCarthy, 2012; Palumbo, 2012; Holstein, 2017). Výstupy ze studií jsou mimořádné, PFS je díky použití udržovací léčby prodlouženo téměř dvojnásobně a jak francouzská, tak americká studie prokázaly přínos na celkové přežití. Ixazomib a daratumumab byly zkoušené v randomizovaných studiích oproti placebu s pozitivním výsledkem (Dimopoulos, 2019; Dimopoulos, 2020; Moreau, 2021). Nikdy však nebyly srovnané oproti lenalidomidu, což je limitací pro jejich registraci a úhradu.
F) Flexibilita protokolů s ohledem na komplexní stav nemocného – K dispozici jsou protokoly junior a senior s různou intenzitou. Vždy když je to možné, je vhodné začínat standardním dávkováním. Nicméně u fragilních nemocných je prokázáno, že příliš intenzivní léčba vede k horším celkovým výsledkům než léčba přiměřené intenzity s menší toxicitou (Ludwig, 2011; Palumbo, 2011).
G) Monitorace a minimalizace nežádoucích účinků – Pečlivá monitorace nežádoucích účinků, jasná profylaktická opatření (trombóza, herpes zoster, infekce obecně, zácpa, …) a včasné zastavení léčby či včasná redukce dávky jsou efektivní kroky s cílem minimalizovat vedlejší účinky léčby. Zastavení a včasná redukce dávky jsou zvláště v ochraně nemocného před polékovou neuropatií jediné možné účinné rozhodnutí lékaře. Cílem je udržení kvality života i po ukončené léčbě. Především tedy „nevyrobit“ těžší formu neuropatie a obecně minimalizovat stupně 3–4 nežádoucích účinků. Podobně dnes platí pro režimy s carfilzomibem u nemocných s predispozicí pro srdeční selhání v anamnéze. Ukazuje se, že použití monoklonálních protilátek a především bispecifických protilátek proti antigenu BCMA přináší vyšší frekvenci vážných infekčních a také atypických komplikací (viz kapitola 8–12 a 17). Jen to zdůrazňuje zvýšený tlak na profesionalitu a erudici zdravotních týmů a komplexnost péče o nemocné s MM.
H) Ekonomické a racionální používání léků – Naše doporučení již v roce 2009, 2012 a 2018 měla v sobě zabudovaný přísný racionální aspekt, který výrazně ekonomizuje léčbu. Považujeme za jedno z možných řešení ekonomizujících léčbu využívat testování léčebné účinnosti pomocí vstupních dvou cyklů léčby v rámci risk-sharing programů (programů sdíleného rizika) ve spolupráci plátců zdravotní péče s farmaceutickými firmami a následně hradit léčbu z rozpočtu jen u nemocných, u nichž bude po dvou cyklech léčby evidentní, že nemoc není rezistentní na léčbu (změna trendu vývoje paraproteinu ve smyslu nejméně zastavení nárůstu). Toto je názor expertů při reflexi stoupajících nákladů v hematoonkologii a nemůže být odborným doporučením. Jde o nástroj, který by ekonomizoval léčbu zvláště u pozdních relapsů nemocnění a vyžaduje koordinaci nad rámec těchto doporučení. Je zjevné, že vysoce účinné režimy s dlouhou dobou PFS 1 a 2 povedou k zásadnímu snížení počtu léčebných linií v průběhu deseti let života nemocného. Je vysoce pravděpodobné, že dojde k zvýšení podílu nemocných vyléčených. Ekonomizace léčby tedy bude znamenat využití vysoce nákladných trojkombinací a čtyřkombinací v primoléčbě a případně v prvním relapsu.
I) Respekt k biologii onemocnění a individualitě nemocného – U výrazně předléčených nemocných platí individuální postup s cílem dlouhodobější kontroly onemocnění. I stabilizace onemocnění na více než 6 měsíců s individuálně upraveným režimem pro nemocného co do dávek, složení a délky podávaní, lze považovat u nemocných v pátém a dalším relapsu za léčebný úspěch. Neexistují randomizované klinické studie, jejichž výsledky by vedly ke stanovení jasných pravidel léčby u pokročilých onemocnění. Existuje však soubor pravidel pro více předléčené nemocné a pro tzv. fragilní (křehké) nemocné s řadou jiných interních onemocnění, které musí zkušený hematolog využívat (Palumbo, 2011).
7.4. Volba optimální léčby
Zde uvádíme přehled doporučených možností léčby na základě evidence based medicine. Režimy s nejúčinnějšími léky jsou upřednostněny. Jednotlivé klíčové citace jsou uvedeny u léků v kapitolách 8–11.
7.4.1. Volba úvodní léčby – primoléčby
Níže uvedená doporučení platí v případě, že budou dané léky dostupnými a hrazenými léky v primoléčbě mnohočetného myelomu. Neposkytnutí léku z důvodu nedostupnosti v dané zemi nebo z důvodu neuznání úhrady léků zdravotní pojišťovnou nemůže být použito proti lékaři a jeho pracovišti.
V současnosti má lékař a pacient možnost volit mezi následujícími možnostmi, přičemž platí obecné pravidlo, že trojkombinace s využitím dvou nových léků jsou účinnější než dvojkombinace.
Léčba lenalidomidem v kombinaci s bortezomibem a dexametazonem (RVD) je velmi účinný režim u nemocných, kteří nemohou podstoupit vysokodávkovou chemoterapii s následnou autologní transplantací krvetvorných buněk. Jeho použití v primoléčbě je plně indikováno na základě výsledků jedné randomizované klinické studie (stupeň doporučení A, úroveň důkazu Ib). Oba léky jsou registrovány pro primoléčbu. Režim RVD slouží jako referenční režim v kontrolním rameni řady randomizovaných studií.
V indikovaných případech lze modifikovat režim dle stavu nemocného, případně použít jen dvojkombinaci Rd bez bortezomibu.
Daratumumab v kombinaci s lenalidomidem a dexametazonem je dnes považován za nejúčinnější režim. Jeho výsledky jsou především u nově diagnostikovaných nevhodných k transplantaci se standardním rizikem mimořádné.
(Jde o režim preferovaný z odborného pohledu. Bohužel tento režim nemá v roce 2023 v ČR a SR stanovenou úhradu.)
7.4.2. Volba léčby relapsu či rezistentního onemocnění
Níže uvedená doporučení platí v případě, že budou dané léky dostupnými a hrazenými léky v relapsu mnohočetného myelomu. Neposkytnutí léku z důvodu nedostupnosti v dané zemi nebo z důvodu neuznání úhrady léků zdravotní pojišťovnou nemůže být použito proti lékaři a jeho pracovišti.
Platí, že pokrok v poslední době byl významný, tedy nové dostupné kombinované režimy od roku 2018 jsou významněji účinné než historicky zavedené. Všechna mezinárodní doporučení reagovala na zvýšený počet dostupných kombinací zásadním a logickým krokem – následná léčba vždy zásadně zohledňuje léčbu v předchozí linii a refrakternost k dané léčbě (Dimopoulos, 2021). Pochopitelně přibývá nemocných tzv. „triple“ či „penta“ refrakterních. U nemocných s pokročilým myelomem léčeným více jak 3 liniemi jsou výsledky jakékoliv léčby již velmi limitované a zásadní je použití nových možností – bispecifických protilátek nebo CAR-T terapie.
Naopak přes limitovaný počet randomizovaných klinických studií využívajících autologní transplantaci v relapsu onemocnění (Cook, 2016) je názorem expertů na základě retrospektivních analýz, že je použití myeloablativního režimu v relapsu onemocnění velmi účinnou léčebnou strategií, která by měla být využívána častěji, než tomu je doposud (Giralt, 2015).
Daratumumab v kombinaci s lenalidomidem a dexametazonem je účinný režim v případě 1.–3. relapsu onemocnění (stupeň doporučení A, úroveň důkazu Ia).
Karfilzomib v kombinaci s lenalidomidem a dexametazonem je účinný režim v případě 1.–3. relapsu onemocnění (stupeň doporučení A, úroveň důkazu Ia).
Ixazomib v kombinaci s lenalidomidem a dexametazonem je účinný režim v případě 1.–3. relapsu onemocnění (stupeň doporučení A, úroveň důkazu Ia).
Režim je účinný i v pozdějších relapsech onemocnění, pokud je na něj nemocný senzitivní a toleruje jej (názor expertů).
Daratumumab v kombinaci s bortezomibem a dexametazonem je účinný režim v případě 1.–3. relapsu onemocnění (stupeň doporučení A, úroveň důkazu Ia). Režim je účinný i v pozdějších relapsech onemocnění, pokud je na něj nemocný senzitivní (názor expertů).
Daratumumab nebo isatuximab v kombinaci s karfilzomibem a dexametazonem jsou účinné režimy v případě 1.–3. relapsu onemocnění, zvláště pak u nemocných refrakterních na lenalidomid (stupeň doporučení A, úroveň důkazu Ia).
Daratumumab nebo isatuximab nebo elotuzumab nebo bortezomib v kombinaci s pomalidomidem a dexametazonem jsou účinné režimy v případě 2. a vyššího relapsu onemocnění (stupeň doporučení A, úroveň důkazu Ia).
Pomalidomid s dexametazonem je účinný režim v případě 2. a vyššího relapsu onemocnění (stupeň doporučení A, úroveň důkazu Ia).
Daratumumab v monoterapii je účinný režim v případě 3. a vyššího relapsu onemocnění (stupeň doporučení A, úroveň důkazu Ia).
Teclistamab, belantamab, talquetamab jsou léky zásadně účinné v případě 3. a vyššího relapsu a tam, kde ostatní léčba selhává. Jsou dostupné pomocí žádosti na paragraf 16 v ČR. Záhy bude dostupný elranatamab, další anti BCMA bispecifické protilátka.
U všech režimů je možné zvolit možnost konsolidace pomocí myeloablativního režimu (melfalan 100–200 mg/m2), resp. autologní transplantace (stupeň doporučení A, úroveň důkazu Ib).
V případě rezistence na dostupnou léčbu je kombinace kortikoidu s malou dávkou cyklofosfamidu zpravidla nezatěžující akceptovatelnou paliativní léčebnou modalitou, pokud se lékař nerozhodne léčbu ukončit.
7.4.3. Výběr režimu v relapsu onemocnění
Při volbě léčby je vždy třeba zohlednit preference a individuální potřeby pacienta.
Podstatné je, že vedle výběru nemocného můžeme jistě pro nemocné v 1.–3. relapsu najít kombinovaný režim, na který bude dobře léčebně reagovat a bude jej dobře tolerovat (čím hlubší remise tím lépe; dosažení velmi dobré parciální remise by mělo být minimálním cílem; jde jen o názor expertů vyplývající z PFS intervalů dosažených v závislosti na léčebné odpovědi). Některé léky mají mimořádně silný protimyelomový efekt a měly by být upřednostněny např. při vysoce agresivním rychlém relapsu onemocnění (např. carfilzomib, anti-CD38 protilátka). U všech nových léčebných kombinací však první léčebný účinek můžeme pozorovat v mediánu 1–2 měsíců. Jde tedy brzy kvalifikovaně posoudit, zda je na lék nemocný citlivý, třebaže maximálního léčebného účinku dosahují různé kombinace v různé době od zahájení léčby. Autologní transplantace by měla být vždy zvažována jako možná součást léčebné strategie při nedostatečné léčebné účinnosti.
Tab. 2. Přehled doporučených léčebných režimů (obsahuje jen vybrané doporučené režimy). 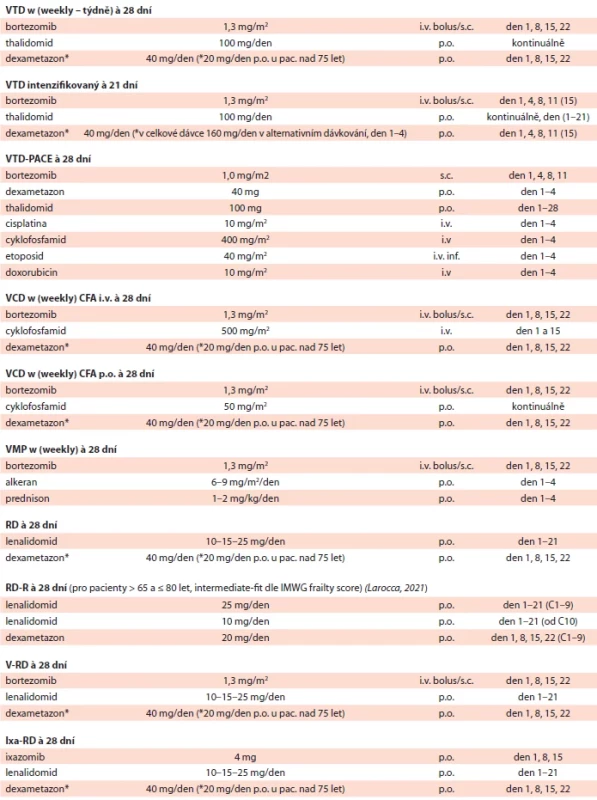
7.5. Výběr režimu u nemocných s vysoce rizikovým (high-risk) MM
7.5.1. Definice vysoce prognosticky rizikové skupiny (high-risk)
Nejprve definování skupiny nemocných, které považujeme za nemocné s horší prognózou na základě FISH vyšetření (dále jen high-risk MM). Označení high-risk souvisí s přežitím ≤ 3 roky v případě nemocných vhodných pro transplantaci a přežitím ≤ 2 roky u nemocných nevhodných pro provedení transplantace (Sonneveld, 2016). Je logické, že se tato definice bude časem měnit tak, jak nové léčebné kombinace posouvají celkové přežití.
Definice high-risk skupiny nemocných na základě přítomnosti cytogenetických aberací (t (4; 14), t (14; 16) a del (17/17p)) je uvedena v kapitole 3. Kombinace ≥ 3 abnormalit znamená ultra-high-risk HR stav s méně než 2letým přežítím (Sonneveld, 2016). Pokud jde o izolovanou změnu, nemusí jít o zvýšené riziko. Všechny prognostické systémy mají své limitace – tedy mají jistý stupeň chybovosti. Je nutné zdůraznit, že v relapsu onemocnění se profil chromozomálních abnormalit může dál vyvíjet a měnit. Je vhodné zjistit aktuální stav před léčbou.
7.5.2. Stávající významné údaje o léčbě high-risk u nově diagnostikovaných nemocných s mnohočetným myelomem (NDMM) a relabujícím nebo refrakterním mnohočetným myelomem (RRMM).
V každé kapitole u nových léků je uveden přínos daného léku v odstavci „jiná závažná pozorování“, pokud jsou k dispozici publikované údaje. Ve většině klinických studií jsou publikované výstupy PFS a OS u podskupin nemocných s translokacemi a del (17/17p). Výjimečně je někdy uveden zisk (1q).
Data v primoléčbě u NDMM nejsou zcela jednoznačná, ale léčebné režimy s bortezomibem nebo s bortezomibem a lenalidomidem mohou zlepšit celkové výsledky u nemocných s t (4; 14) (Sonneveld, 2016). Podobně to platí o indukční léčbě na bázi bortezomibu a tandemové autologní transplantaci, která zlepšuje výstupy u high-risk nemocných, zvláště pak s t (4; 14) (Sonneveld, 2016). Naopak režim Rd s kontinuálním podáním lenalidomidu není vhodný v primoléčbě u high-risk nemocných (Avet-Loiseau, 2015; Benboubker, 2014; Facon, 2018).
U nemocných s RRMM byl pozorován významný klinický přínos trojkombinací u skupiny high-risk. Tyto režimy nepřekonávají negativní prognostický význam high-risk chromozomálních abnormalit, ale klinicky významně zlepšují prognózu této skupiny.
7.5.3. Doporučení pro diagnostiku a léčbu vysoce prognosticky rizikové skupiny (high-risk) nemocných s mnohočetným myelomem
Pro identifikaci podskupiny nemocných s vysokým rizikem pro krátké celkové přežití (tzv. high-risk MM) je vhodné vstupně vyšetřit na myelomových buňkách všechny dostupné rizikové translokace IgH (t (4; 14), t (14; 16), t (14; 20), del (17p), zisk (1q21) a stanovit, zda jde o hyperdiploidní karyotyp. Za nezbytné minimum lze považovat (t (4; 14), t (14; 16) a del (17p) a zisk (1q21). (stupeň doporučení A, úroveň důkazu Ia)
Ultra-high-risk skupinu identifikují komplexní změny karyotypu.
Změny se v čase vyvíjejí, proto je vhodné vyhodnotit tyto změny i před léčbou relapsu onemocnění.
U high-risk podskupiny nemocných s MM by neměly být používány dvojkombinace léků, naopak by měly být použity nejméně nejúčinnější dostupné trojkombinace. Toto platí pro novou diagnózu i relaps onemocnění. (stupeň doporučení A, úroveň důkazu Ia)
V primoléčbě při přítomnosti t (4; 14) by měl být součástí léčebné strategie bortezomib a v indikovaných případech tandemová autologní transplantace. (stupeň doporučení A, úroveň důkazu Ia)7.6. Nejdůležitější změny oproti doporučením z roku 2018 jsou následující
1. Upozornění na stoupající význam průtokové cytometrie pro diagnostiku a prognózu nemocných s MM.
2. Zdůrazněná klíčová role režimu daratumumab-lenalidomid-dexametazon jak v primoléčbě, tak relapsu onemocnění.
3. Posun v léčebném cíli, kdy je optimálním cílem dosažení negativity MRD, protože tito nemocní mají nejlepší šanci na dlouhodobé bezpříznakové přežití
4. Zdůraznění zásadního významu režimů tzv. imid free pro nemocné refrakterní na lenalidomid, konkrétně režimů daratumumab/isatuximab s carfilzomibem a dexametazonem.
5. Zařazení 3 nových léků do léčby relapsu onemocnění (isatuximab, teclistamab, CAR-T, talquetamab), přičemž nejméně jedna další bispecifická protilátka by měla být v EU registrovaná do konce roku 2023.
6. První doporučení pro mimořádně účinné nové typy imunoterapie: CAR-T a bispecifické protilátky.
7.7. Léčebné protokoly
Jednotlivé léčebné protokoly, jejichž přehled je v tab. 7.2, jsou pravidelně aktualizovány v souboru „Léčebné protokoly CMG “ na webových stránkách CMG. Stávající platné verze a aktualizace jsou ke stažení z www.myeloma.cz (sekce mnohočetný myelom/guidelines/aktuální protokoly).
Zdroje
1. Attal M, Lauwers-Cances V, Hulin C, et al. Study IFM. Lenalidomide, bortezomib, and dexamethasone with transplantation for myeloma. N Engl J Med. 2017; 376 : 1311–1320.
2. Attal M, Lauwers-Cances V, Marit G, et al. IFM Investigators. Lenalidomide maintenance after stem-cell transplantation for multiple myeloma. N Engl J Med. 2012; 366 : 1782–1791.
3. Avet-Loiseau H, Hulin C, Benboubker L, et al. Impact of cytogenetics on outcomes of transplant-ineligible patients with newly diagnosed multiple myeloma treated with continuous lenalidomide plus low-dose dexamethasone in the first (MM-020) trial. Blood. 2015; 126 : 730.
4. Barlogie B, Tricot GJ, van Rhee F, et al. Long-term outcome results of the first tandem autotransplant trial for multiple myeloma. Br J Haematol. 2006; 135 : 158–164.
5. Benboubker L, Dimopoulos MA, Dispenzieri A, et al. FIRST Trial Team. Lenalidomide and dexamethasone in transplant-ineligible patients with myeloma. N Engl J Med. 2014; 371 : 906–917.
6. Burgos L, Tamariz-Amador LE, Puig N, et al. Definition and clinical significance of the monoclonal gammopathy of undetermined significance-like phenotype in patients with monoclonal gammopathies. J Clin Oncol. 2023; 41 (16): 3019–3031.
7. Cook G, Ashcroft AJ, Cairns DA, et al. The effect of salvage autologous stem-cell transplantation on overall survival in patients with relapsed multiple myeloma (final results from BSBMT/UKMF Myeloma X Relapse [Intensive]): a randomised, open-label, phase 3 trial. Lancet Haematol. 2016; 3: e340–e351.
8. Dimopoulos AM, Gay F, Schjesvold F, et al. Oral ixazomib maintenance following autologous stem cell transplantation (TOURMALINE-MM3): a double-blind, randomised, placebo-controlled phase 3 trial. Lancet. 2019; 393: P253–P264.
9. Dimopoulos MA, Spicka I, Quach H, et al. TOURMALINE-MM4 study group. Ixazomib as postinduction maintenance for patients with newly diagnosed multiple myeloma not undergoing autologous stem cell transplantation: the phase III TOURMALINE-MM4 trial. J Clin Oncol. 2020; 38 (34): 4030–4041.
10. Dimopoulos MA, Terpos E, Boccadoro M, et al. Daratumumab plus pomalidomide and dexamethasone versus pomalidomide and dexamethasone alone in previously treated multiple myeloma (APOLLO): an open-label, randomised, phase 3 trial. Lancet Oncol. 2021; 22 (6): 801–812.
11. Dimopoulos MA, Orial A, Nahi H, et al. Overall Survival with daratumumab, lenalidomide and dexamethasone in previosu treated multiple myeloma (POLLUX): A randomized, open-label phase III trial. J Clin Oncol. 2023; 41 (8): 1590–1599.
12. Durie BG, Hoering A, Abidi MH, et al. Bortezomib with lenalidomide and dexamethasone versus lenalidomide and dexamethasone alone in patients with newly diagnosed myeloma without intent for immediate autologous stem-cell transplant (SWOG S0777): a randomised, open-label, phase 3 trial. Lancet. 2017; 389: 519–527.
13. Facon T, Dimopoulos MA, Dispenzieri A, et al. Final analysis of survival outcomes in the randomized phase 3 FIRST trial. Blood. 2018; 131 : 301–310.
14. Facon T, Kumar S, Plesner T, et al. Daratumumab plus lenalidomide and dexamethasone for untreated myeloma. N Engl J Med. 2019; 380 : 2104.
15. Fonseca R, Bergsagel PL, Drach J, et al. International Myeloma Working Group molecular classification of multiple myeloma: spotlight review. Leukemia. 2009; 23 : 2210–2221.
16. Giralt S, Garderet L, Durie B, et al. American Society of Blood and Marrow Transplantation, European Society of Blood and Marrow Transplantation, Blood and Marrow Transplant Clinical Trials Network, and International Myeloma Working Group consensus conference on salvage hematopoietic cell transplantation in patients with relapsed multiple myeloma. Biol Blood Marrow Transplant. 2015; 21: 2039–2051.
17. Holstein SA, Jung SH, Richardson PG, et al. Updated analysis of CALGB (Alliance) 100104 assessing lenalidomide versus placebo maintenance after single autologous stem-cell transplantation for multiple myeloma: a randomised, double-blind, phase 3 trial. Lancet Haematol. 2017; 4: e431–e442.
18. Jelinek T, Bezdekova R, Zihala D, et al. More than 2% of circulating tumor plasma cells defines plasma cell leukemia–like multiple myeloma. J Clin Oncol. 2023; 41 (7): 1383–1392.
19. Keats JJ, Chesi M, Egan JB, et al. Clonal competition with alternating dominance in multiple myeloma. Blood. 2012; 120 : 1067–1076.
20. Kumar S, Paiva B, Anderson KC, et al. International Myeloma Working Group consensus criteria for response and minimal residual disease assessment in multipla myeloma. Lancet Oncol. 2016; 17: e328–e346.
21. Landgren O, Kyle RA, Pfeiffer RM, et al. Monoclonal gammopathy of undetermined significance (MGUS) consistently precedes multiple myeloma: a prospective study. Blood. 2009; 113 : 5412–5417.
22. Landgren O, Owen RG. Better therapy requires better response evaluation: paving the way for minimal residual disease testing for every myeloma patient. Cytometry B Clin Cytom. 2016; 90 : 14–20.
23. Larocca A, Bonello F, Gaidano G, et al. Dose/schedule-adjusted Rd-R vs continuous Rd for elderly, intermediate-fit patients with newly diagnosed multiple myeloma. Blood. 2021; 137 (22): 3027–3036.
24. Ludwig H, Beksac M, Bladé J, et al. Multiple myeloma treatment strategies with novel agents in 2011: a European perspective. Oncologist. 2011; 16 : 388–403.
25. Mateos MV, Dimopoulos MA, Cavo M, et al. Daratumumab plus bortezomib, melphalan, and prednisone for untreated myeloma. N Engl J Med. 2018; 378 (6): 518–528.
26. McCarthy PL, Owzar K, Hofmeister CC, et al. Lenalidomide after stem-cell transplantation for multiple myeloma. N Engl J Med. 2012; 366 : 1770–1781.
27. Moreau P, San Miguel J, Sonneveld P, et al. Multiple myeloma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2017; 28: iv52–iv61.
28. Moreau P, Hulin C, Perrot A, et al. Maintenance with daratumumab or observation following treatment with bortezomib, thalidomide, and dexamethasone with or without daratumumab and autologous stem-cell transplant in patients with newly diagnosed multiple myeloma (CASSIOPEIA): an open-label, randomised, phase 3 trial. Lancet Oncol. 2021; 22 (10): 1378–1390.
29. Munshi NC, Anderson KC, Bergsagel PL, et al. Consensus recommendations for risk stratification in multiple myeloma: report of the International Myeloma Workshop Consensus Panel 2. Blood. 2011; 117 : 4696–4700.
30. Munshi NC, Avet-Loiseau H, Rawstron AC, et al. Association of minimal residual disease with superior survival outcomes in patients with multiple myeloma: a meta-analysis. JAMA Oncol. 2017; 3 : 28–35.
31. Paiva B, van Dongen JJ, Orfao A. New criteria for response assessment: role of minimal residual disease in multiple myeloma. Blood. 2015; 125 : 3059–3068.
32. Paiva B, Vídriales MB, Rosiñol L, et al. A multiparameter flow cytometry immunophenotypic algorithm for the identification of newly diagnosed symptomatic myeloma with an MGUS-like signature and long-term disease control. Leukemia. 2013; 27 (10): 2056–2061.
33. Palumbo A, Anderson K. Multiple myeloma. N Engl J Med. 2011; 364 : 1046–1060.
34. Palumbo A, Hajek R, Delforge M, et al. Continuous lenalidomide treatment for newly diagnosed multiple myeloma. N Engl J Med. 2012; 366 : 1759–1769.
35. Palumbo A, Avet-Loiseau H, Oliva S, et al. Revised international staging system for multiple myeloma: a report from International Myeloma Working Group. J Clin Oncol. 2015; 33 : 2863–2869.
36. Shaughnessy JD Jr, Haessler J, van Rhee F, et al. Testing standard and genetic parameters in 220 patients with multiple myeloma with complete data sets: superiority of molecular genetics. Br J Haematol. 2007; 137 : 530–536.
37. Sonneveld P, Avet-Loiseau H, Lonial S, et al. Treatment of multiple myeloma with high-risk cytogenetics: a consensus of the International Myeloma Working Group. Blood. 2016; 127 : 2955–2962.
38. Sonneveld P, Beksac M, Holt B, et al. Consolidation followed by maintenance therapy versus maintenance alone in newly diagnosed, transplant eligible patients with multiple myeloma (MM): a randomized phase 3 Study of the European Myeloma Network (EMN02/HO95 MM Trial). Blood. 2016; 128 : 242.
Štítky
Hematológia Interné lekárstvo Onkológia
Článek EditorialČlánek 2. Epidemiologie
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2023 Číslo Supplementum 2- Nejasný stín na plicích – kazuistika
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficitmi v reálnej praxi
-
Všetky články tohto čísla
- Editorial
- Souhrn doporučení 2023: Diagnostika a léčba mnohočetného myelomu
- 1. Metodické postupy tvorby doporučení
- 2. Epidemiologie
- 3. Nejčastější projevy nemoci a vyšetření vedoucí k rozpoznání a ke stanovení rozsahu nemoci
- 4. Kritéria pro stanovení diagnózy mnohočetného myelomu a jeho klinického stádia, kritéria dalších plazmocelulárních chorob
- 5. Kritéria pro hodnocení léčebného efektu a dlouhodobé úspěšnosti léčby
- 6. Obecné informace o léčbě mnohočetného myelomu
- 7. Léčebné strategie
- 8. Léčba mnohočetného myelomu
- 9. Vysokodávkovaná chemoterapie s transplantací autologních kmenových buněk
- 10. Alogenní transplantace krvetvorných buněk
- 11. Udržovací a konsolidační léčba
- 12. Léčba nemocných s mnohočetným myelomem a renálním selháním
- 13. Vybrané oblasti z komplexní podpůrné léčby mnohočetného myelomu
- 14. Léky inhibující osteolýzu u mnohočetného myelomu
- 15. Komplexní podpůrná léčba – anémie
- 16. Profylaxe tromboembolické nemoci u pacientů s mnohočetným myelomem
- 17. Profylaxe infekčních komplikací
- 18. Fyzioterapie u nemocných s mnohočetným myelomem
- 19. Monoklonální gamapatie nejasného významu (MGUS) – doporučení pro diagnostiku a sledování
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Souhrn doporučení 2023: Diagnostika a léčba mnohočetného myelomu
- 19. Monoklonální gamapatie nejasného významu (MGUS) – doporučení pro diagnostiku a sledování
- 8. Léčba mnohočetného myelomu
- 6. Obecné informace o léčbě mnohočetného myelomu
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy






