-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
GUIDELINES EAU PRO DIAGNOSTIKU A LÉČBU KARCINOMU PENISU
Autoři: E. Solsona; F. Algaba; S. Horenblas; G. Pizzocaro; T. Windahl
Vyšlo v časopise: Urol List 2005; 3(4): 62-77
OBSAH
- Úvod 64
- 1.1 Literatura 64
- Pozadí 64
- 2.1 Klasifikace 65
- 2.1.1 Patologie 65
- 2.1.2 Určení TNM-stadia 65
- 2.2 Literatura 65
- Rizikové faktory u karcinomu penisu 66
- 3.1 Literatura 67
- Diagnóza 67
- 4.1 Primární léze 67
- 4.2 Regionální lymfatické uzliny 68
- 4.2.1 Nehmatné lymfatické uzliny 68
- 4.2.2 Hmatné lymfatické uzliny 68
- 4.3 Guidelines pro diagnózu karcinomu penisu 68
- 4.4 Literatura 69
- Léčba 70
- 5.1 Primární léze 70
- 5.1.1 Penilní intraepiteliální neoplazie 70
- 5.1.2 Kategorie Ta-1G1-2 70
- 5.1.3 Kategorie T1G3, T 2 70
- 5.1.4 Lokální recidiva onemocnění 70
- 5.1.5 Radioterapie 70
- 5.2 Regionální lymfatické uzliny 70
- 5.2.1 Nehmatné lymfatické uzliny 70
- 5.2.2 Hmatné lymfatické uzliny s pozitivním histopatologickým nálezem 70
- 5.3 Guidelines pro léčbu karcinomu penisu 71
- 5.3.1 Doporučení pro léčbu primární léze 71
- 5.3.2 Doporučení pro terapii regionálních lymfatických 71 uzlin, pokud jsou hmatné a patologicky pozitivní
- 5.4 Integrovaná terapie 71
- 5.5 Vzdálené metastázy 72
- 5.6 Kvalita života 72
- 5.7 Technické aspekty 72
- 5.7.1 Primární léze 72
- 5.7.2 Parciální amputace 72
- 5.7.3 Radikální ingvinální lymfadenektomie 72
- 5.7.4 Modifikovaná ingvinální lymfadenektomie 72
- 5.7.5 Lymfadenektomie 72
- 5.7.6 Pánevní lymfadenektomie 72
- 5.8 Chemoterapie 72
- 5.8.1 Adjuvantní chemoterapie 72
- 5.8.2 Neoadjuvantní chemoterapie u fixovaných ingvinálních lymfatických uzlin 72
- 5.8.3 Chemoterapie u pokročilého onemocnění 73
- 5.9 Radioterapie 73
- 5.9.1 Primární tumor 73
- 5.9.2 Profylaktická radioterapie 74
- 5.9.3 Předoperační radioterapie 74
- 5.9.4 Adjuvantní radioterapie 74
- 5.10 Literatura 74
- Sledování 76
- 6.1 Proč provádět sledování? 76
- 6.2 Jak provádět sledování? 76
- 6.3 Kdy provádět sledování 76
- 6.3.1 Primární tumor 76
- 6.3.2 Regionální oblasti 76
- 6.4 Guidelines pro sledování karcinomu penisu 76
- 6.5 Literatura 77
- ZKRATKY POUŽITÉ V TEXTU 77
1. ÚVOD
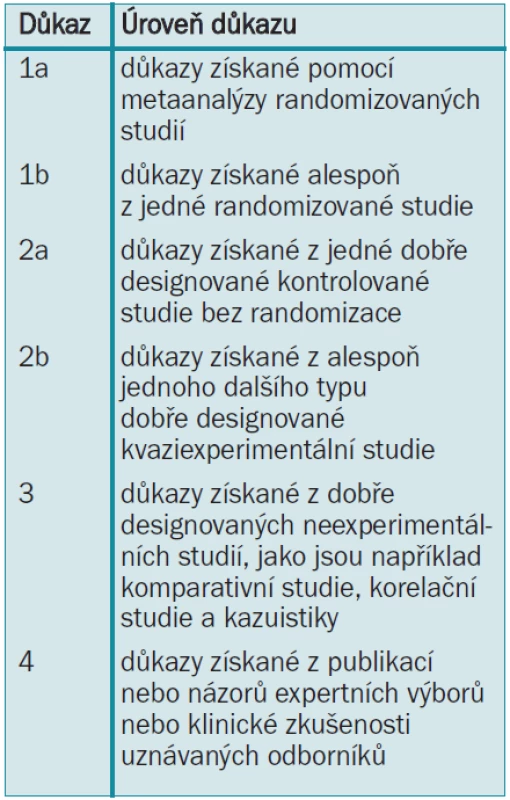
Konsenzní skupina European Association of Urology (EAU) pro otázky karcinomu penisu připravila tyto guidelines, aby pomohla urologům zhodnotit vědecké důkazy při prevenci, diagnostice a léčbě karcinomu penisu a začlenit doporučení do klinické praxe. Literatura použitá v textu byla, jak ukazuje tab. 1, hodnocena dle úrovně vědeckých důkazů. Podle Agency for Health Care Policy and Research [1] bylo hodnoceno také doporučení guidelines (tab. 2).
Tab. 2. Stupně doporučení guidelines [1]. ![Stupně doporučení guidelines [1].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/5cb4cd49b5dc0578152b743e8d64b25b.png)
1.1 Literatura
1. Agency for Health Care Policy and Research. Clinical Practice Guidelines Development: Methodological Perspectives. Washington DC: US Department of Health and Human Services, Public Health Service, 1992 : 115-127. http://www.ahcpr.gov/news/pubsix.htm
2. VÝCHOZÍ SITUACE
Karcinom penisu je zřídka se vyskytujícím onemocněním s incidencí 0,1–7,9 na 100 000 mužů. V Evropě je incidence 0,1–0,9 na 100 000 mužů a ve Spojených Státech 0,7–0,9 na 100 000 mužů. V některých oblastech Asie, Afriky a Jižní Ameriky je incidence signifikantně vyšší, až 19 na 100 000 mužů [1]; v těchto zemích tvoří karcinom penisu 10–20 % karcinomů u mužů.
Karcinom penisu metastazuje lymfatickým systémem a šíří se spíše embolizačním mechanizmem než lymfatickým pronikáním. Vzdálené metastázy se vyskytují velmi vzácně a jsou výsledkem vaskulární diseminace [2]. Obvykle se šíří postupně, nejprve se objeví šíření do ingvinálních lymfatických uzlin, poté metastázy do pelvických uzlin a nakonec vzdálené metastázy. Velmi vzácně proto můžeme pozorovat pacienta s pozitivními pánevními lymfatickými uzlinami nebo vzdálenými metastázami bez postižení ingvinálních lymfatických uzlin.
Primární tumor je lokalizován na glans u 48 % případů, na předkožce u 21 %, na glans i předkožce u 9 % případů, na sulcus coronarius u 6 % a v méně než 2 % případů v těle penisu [3]. Hmatné ingvinální uzliny jsou přítomny při diagnóze u 58 % pacientů (v rozmezí 20–96 %) [4]. Z těchto pacientů má 17–54 % metastázy do lymfatických uzlin, zatímco u zbývajících pacientů se jedná o zánětlivé onemocnění způsobené infekcí primárního tumoru ([4-6]: úroveň důkazu 2a).
Pravděpodobnost bilaterálního postižení je vzhledem k velkému počtu penilních lymfatik v podkožní tkáni značná. Postižení pelvických lymfatických uzlin je zjištěno u 22–56 % pacientů s metastázami do 2 nebo více uzlin ([7-9]: úroveň důkazu 2b). U asi 20 % pacientů s nehmatnými lymfatickými uzlinami se ve skutečnosti nachází mikrometastatické postižení lymfatických uzlin. Výskyt metastáz do lymfatických uzlin je ovlivněn hloubkou invaze, diferenciací tumoru, vaskulárním a lymfatickým postižením, postižením corpora cavernosa, charakterem růstu a spojením těchto faktorů ([10-12]: úroveň důkazu 2a).
Byla zaznamenána 52% míra přežití po dobu 5 let. Pohybuje se v rozmezí od 66 % u pacientů s negativními lymfatickými uzlinami do 27 % u pacientů s pozitivními uzlinami ([4,6,8, 13-15]: úroveň důkazu 2a) a 0-38,4 % u pacientů s postižením pánevních lymfatických uzlin ([4,8,9,16]: úroveň důkazu 2b). Většina pacientů je starších a neoplazma má pomalý charakter růstu. Smrt způsobená karcinomem je obvykle následkem lokálních komplikací jako například infekce, krvácení ulcerovaného tumoru nebo ulcerace ingvinálních metastáz.
Stále ještě existuje mnoho kontroverzních názorů týkajících se řešení karcinomu penisu. Léčba primárního tumoru má tendenci zachovat orgán z důvodu udržení sexuální funkce a lepší kvality života ([1,15,17-19]: úroveň důkazu 2b). Také se vede diskuse týkající se potřeby a rozsahu lymfadenektomie u pacientů s klinicky negativními uzlinami [1,20]. Důležitými faktory ovlivňujícími karcinom penisu jsou zřejmě také sociální a kulturní návyky, což je podloženo faktem, že 44–90 % pacientů trpí při prezentaci fimózou [2] a je u nich zaznamenána souvislost mezi lidským papilomavirem (HPV) a karcinomem penisu ([21-23]: úroveň důkazu 2a).
Všechny tyto faktory spolu s nízkým procentem incidence v zemích s dobrými socioekonomickými podmínkami i absencí velkých nebo randomizovaných studií mají významný vliv na profylaxi, diagnostiku a léčbu karcinomu penisu.
2.1 Klasifikace
2.1.1 Patologie
Spinocelulární karcinom (SCC) je nejčastěji se vyskytujícím maligním onemocněním penisu. Tvoří více než 95 % případů. Maligní melanomy a karcinomy z bazálních buněk se vyskytují méně často. Rozsah, při němž premaligní léze [3,24] (tab. 3) předchází spinocelulární karcinom, není znám. Přestože je SCC nejčastější neoplazií penisu, vyskytuje se v několika různých typech a s různým charakterem růstu [24-26] (tab. 4).
Tab. 4. Neoplazie penisu (SCC). 
Mezenchymální tumory se vyskytují velmi málo [3], s incidencí méně než 3 % (např. Kaposiho sarkom, angiosarkom, epiteloidní hemagioendoteliom).
Metastázy do penisu se vyskytují velmi vzácně, ovšem v případě metastatického onemocnění byly primárními tumory zaznamenány renální a rektální tumor, tumor močového měchýře, a karcinom prostaty [3].
Mezenchymální nádory jsou velmi raritní [3] s incidencí nižší než 3 % (tj. Kaposiho sarkom, angiosarkom, epiteloidní hemangioendoteliom).
V penisu se objevují metastázy jen velmi vzácně. V případě metastázy do penisu se jako primární nádor uvádějí nádory močového měchýře, prostaty, ledvin a konečníku [3].
2.1.2 Určení TNM-stadia
V tab. 5 je ukázána klasifikace tumor uzlina metastáza (Tumour Node Metastasis) z roku 1997 a 2002 [27].
Tab. 5. 1997/2002 TNM-klasifikace karcinomu penisu. 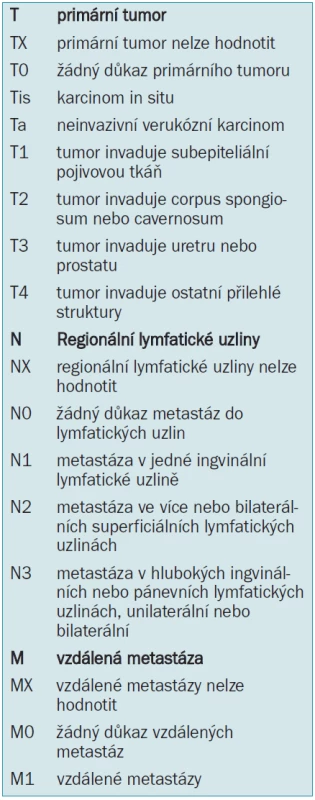
2.2 Literatura
1. Mobilio G, Ficarra V. Genital treatment of penile carcinoma. Curr Opin Urol 2001; 11 : 299-304. Genital treatment of penile carcinoma. Curr Opin Urol 2001; 11 : 299-304. http://www.ncbi.nlm.nih.gov/ entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11371784&dopt=Abstract
2. Burgers JK, Badalament RA, Drago JR. Penile cancer. Clinical presentation, diagnosis and staging. Urol Clin North Am 1992; 19 : 247-256. http://www.ncbi. nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=1574815&dopt=Abstract
3. Sufrin G, Huben R. Benign and malignant lesions of the penis. In: Gillenwater JY (ed). Adult and Pediatric Urology. 2nd ed. Chicago: Year Book Medical Publisher 1991 : 1643.
4. Ornellas AA, Seixas ALC, Marota A, Wisnescky A, Campos F, de Moraes JR. Surgical treatment of invasive squamous cell carcinoma of the penis: retrospective analysis of 350 cases. http://www.ncbi. nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7512656&dopt=Abstract
5. Horenblas S, Van Tinteren H, Delamarre JFM, Lustig V, Van Waardenburg FW. Squamous cell carcinoma of the penis. III. Treatment of regional lymph nodes. J Urol 1993; 149 : 492-497. http://www.ncbi. nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8437253&dopt=Abstract
6. Pizzocaro G, Piva L, Nicolai N. Treatment of lymphatic metastasis of squamous cell carcinoma of the penis at the National Tumor Institute of Milan. Arch Ital Urol Androl 1996; 68 : 169-172. http://www.ncbi. nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8767505&dopt=Abstract
7. Culkin DJ, Beer TM. Advanced penile carcinoma. J Urol 2003; 170 : 359-365. http://www.ncbi.nlm. nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=12853775&dopt=Abstract
8. Horenblas S. Lymphadenectomy for squamous cell carcinoma of the penis. Part 2: the role and technique of lymph node dissection. BJU Int 2001; 88 : 473-483. http://www.ncbi.nlm.nih.gov/entrez/query. fcgi?cmd=Retrieve&db=PubMed&list_uids=11589660&dopt=Abstract
9. Lopes A, Bezerra AL, Serrano SV, Hidalgo GS. Iliac nodal metastases from carcinoma of the penis treated surgically. BJU Int 2000; 86 : 690-693. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11069378&dopt=Abstract
10. Emerson RE, Ulbright TM, Eble JN, Geary WA, Eckert GJ, Cheng L. Predicting cancer progression in patients with penile squamous cell carcinoma: the importance of depth of invasion and vascular invasion. Med Pathol 2001; 14 : 963-968. http://www. ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11598165&dopt=Abstract
11. Ficarra V, Martignoni G, Maffei N, Cerruto MA, Novara G, Cavalleri S, Artibani W. Predictive pathological factors of lymph nodes involvement in the squamous cell carcinoma of the penis. Int Urol Nephrol 2002; 34 : 245-250. http://www.ncbi.nlm. nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=12775105&dopt=Abstract
12. Slaton JW, Morgenstern N, Levy DA, Santos MW jr, Tamboli R, Ro JY, Ayala AG, Pettaway CA. Tumor stage, vascular invasion and the percentage of poorly differentiated cancer: independent prognosticators for inguinal lymph node metastasis in penile squamous cancer. J Urol 2001; 165 : 1138-1142. http:// www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11257655&dopt=Abstract
13. Derakshani P, Neubauer S, Braun M, Bargmann H, Heidenreich A, Engelmann U. Results and 10-year follow-up in patients with squamous cell carcinoma of the penis. Urol Int 1999; 62 : 238-244. http://www. ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10567892&dopt=Abstract
14. Demkow T. The treatment of penile carcinoma: experience in 64 cases. Int Urol Nephrol 1999; 31 : 525-531. http://www.ncbi.nlm.nih.gov/entrez/query. fcgi?cmd=Retrieve&db=PubMed&list_uids=10668948&dopt=Abstract
15. Hakenberg OW, Wirth MP. Issues in the treatment of penile carcinoma. A short review. Urol Int 1999; 62 : 229-233. http://www.ncbi.nlm.nih.gov/entrez/ query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10567890&dopt=Abstract
16. Ravi R. Correlation between the extent of nodal involvement and survival following groin dissection for carcinoma of the penis. Br J Urol 1993; 72 : 817-819. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi? cmd=Retrieve&db=PubMed&list_uids=8281416&dopt=Abstract
17. Ficara V, Maffei N, Piacentine I, Al Rabi N, Cerruto MA, Artibani W. Local treatment of penile squamous cell carcinoma. Urol Int 2002; 69 : 169-173. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=12372882&dopt=Abstract
18. Schoeneich G, Perabo FGE, Muller SC. Squamous cell carcinoma of the penis. Andrologia 1999; 31(Suppl 1): 17-20. http://www.ncbi.nlm.nih.gov/ entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10643514&dopt=Abstract
19. Stancik I, Holtl W. Penile cancer: review of the recent literature. Curr Opin Urol 2003; 13 : 467-472. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=14560140&dopt=Abstract
20. Wilbert DM. [Lymph node metastases in penis carcinoma. Therapeutic options and outcome.] Urologe A 1999; 38 : 332-336. [German] http://www. ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10444790&dopt=Abstract
21. Bezerra AL, Lopes A, Landman G, Alencar GN, Torloni H, Villa LL. Clinicopathologic features and human papillomavirus DNA prevalence of warty and squamous cell carcinoma of the penis. Am J Surg Pathol 2001; 25 : 673-678. http://www.ncbi.nlm. nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11342782&dopt=Abstract
22. Dillner J, von Krogh G, Horenblas, S, Meijer CJ. Etiology of squamous cell carcinoma of the penis. Scand J Urol Nephrol Suppl, 2000; 205 : 189-193. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11144896&dopt=Abstract
23. Picconi MA, Eijan AM, Distefano AL, Pueyo S, Alonio LV, Gorostidi S, Teyssie AR, Casaba A. Human papillomavirus (HPV) DNA in penile carcinomas in Argentina: analysis of primary tumors and lymph nodes. J Med Virol 2000; 61 : 65-69. http://www.ncbi. nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10745234&dopt=Abstract
24. Cubilla AL, Reuter V, Velazquez E, Piris A, Saito S, Young RH. Histologic classification of penile carcinoma and its relation to outcome in 61 patients with primary resection. Int J Surg Pathol 2001; 9 : 111-120. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11484498&dopt=Abstract
25. Broders AC. Squamous cell epithelioma of the skin. Ann Surg 1921; 73 : 141.
26. Maiche AG, Pyrhönen S, Karkinen M. Histological grading of squamous cell carcinoma of the penis: a new score system. Br J Urol 1991; 67 : 522-526. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=1710163&dopt=Abstract
27. Sobin LH, Wittekind Ch. TNM Classification of Malignant Tumors. 6th ed. New York: Wiley-Liss 2002. http://www.wiley.com/go/tnm
3. RIZIKOVÉ FAKTORY U KARCINOMU PENISU
S tímto tumorem často souvisí fimóza a procesy chronického dráždění spojené se špatnou hygienou, zatímco ochranu proti tomuto onemocnění poskytuje obřízka v novorozeneckém věku ([1]: úroveň důkazu 2a). Existují podložené důkazy, že herpesvirus (HPV) typu 16 a 18 souvisí s karcinomem penisu v 50 % případů, stejně jako s karcinomem in situ a s bazaloidními a verukózními variantami ve více než 90 % případů ([1-3]: úroveň důkazu 2a).
Nejlepšími prognostickými faktory souvisejícími s procentem přežití jsou přítomnost pozitivních lymfatických uzlin, počet a umístění pozitivních uzlin a extrakapsulární postižení uzlin ([4-9]: úroveň důkazu 2a). Jsou to důležité faktory, které musíme zvážit při aplikaci doplňujících terapií po patologickém vyšetření preparátu získaného lymfadenektomií.
Prediktivní faktory pro přítomnost metastáz do lymfatických uzlin byly důkladně hodnoceny. Důležité prediktivní faktory zahrnují parametry primárního tumoru, tj. lokalizaci, velikost, stupeň tumoru, invazi corpora cavernosa [10,11] a spojení některých těchto faktorů [12].
Tyto faktory byly ověřeny multivarietní analýzou ([7,8,13-15]: úroveň důkazu 2a) a jsou užívány pro určení skupin s vysokým, pokročilým a nízkým rizikem metastáz do lymfatických uzlin [9,11,12]. Tyto rizikové skupiny byly v nedávné době přijaty v literatuře [13,16,17] a prospektivně ověřeny ([18]: úroveň důkazu 2a). Další významné prediktivní faktory se zvláštním vztahem ke skupině s pokro‑čilým rizikem zahrnují vaskulární a lymfatickou invazi, hloubku invaze a charakter růstu primárního tumoru [19,20]. Všechny tyto faktory byly brány v úvahu při vymezování terapeutických doporučení v těchto guidelines (viz 5.2.1 Nehmatné lymfatické uzliny).
Molekulární markery jako prognostické faktory jsou stále ve fázi výzkumu, ale v současné době nemají v klinické praxi žádné využití [21-23]. Slibnější výsledky při předvídání postižení lymfatických uzlin byly zaznamenány při vysoké expresi p-53 [22,24] a antigenu SCC [25], ovšem tyto výsledky musí být prospektivně ověřeny před tím, než mohou být začleněny do klinické praxe.
3.1 Literatura
1. Dillner J, Meijer CJ, von Krogh G, Horenblas S. Epidemiology of human papillomavirus infection. Scand J Urol Nephrol Suppl 2000; 205 : 194-200. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11144898&dopt=Abstract
2. Bezerra AL, Lopes A, Landman G, Alencar GN, Torloni H, Villa LL. Clinicopathologic features and human papillomavirus DNA prevalence of warty and squamous cell carcinoma of the penis. Am J Surg Pathol 2001; 25 : 673-678. http://www.ncbi.nlm. nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11342782&dopt=Abstract
3. Picconi MA, Eijan AM, Distefano AL, Pueyo S, Alonio LV, Gorostidi S, Teyssie AR, Casabe A. Human papillomavirus (HPV) DNA in penile carcinomas in Argentina: analysis of primary tumors and lymph nodes. J Med Virol 2000; 61 : 65-69. http://www. ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10745234&dopt=Abstract
4. Ravi R. Correlation between the extent of nodal involvement and survival following groin dissection for carcinoma of the penis. Br J Urol 1993; 72 : 817-819. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi? cmd=Retrieve&db=PubMed&list_uids=8281416&dopt=Abstract
5. Ricós Torrent JV, Ramon-Borja JC, Iborra Juan I, Monros Lliso JL, Dumont Martinez R, Solsona Narbon E. [Locoregional treatment of carcinoma of the penis.] Arch Esp Urol 1991; 44 : 667-682. [Spanish] http://www.ncbi.nlm.nih.gov:80/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=1722961&dopt=Abstract
6. Srinivas V, Morse M, Herr E, Sogani P, Whitmore W jr. Penile cancer: relation of extent of nodal metastasis to survival. J Urol 1987; 137 : 880-882. http:// www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=3573181&dopt=Abstract
7. Sarin R, Norman AR, Steel GG, Horwich A. Treatment results and prognostic factors in 101 men treated for squamous carcinoma of the penis. Int J Radiat Oncol Biol Phys 1997; 38 : 713-722. http:// www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9240637&dopt=Abstract
8. Soria JC, Fizazi K, Piron D, Kramar A, Gerbaulet A, Haie-Meder C, Perrin JL, Court B, Wibault P, Theodore C. Squamous cell carcinoma of the penis: multivariate analysis prognostic factors and natural history in monocentric study with a conservative policy. Ann Oncol 1997; 8 : 1089-1098. http://www.ncbi.nlm.nih. gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9426328&dopt=Abstract
9. Horenblas S. Lymphadenectomy for squamous cell carcinoma of the penis. Part 2: the role and technique of lymph node dissection. BJU Int 2001; 88 : 473-483. http://www.ncbi.nlm.nih.gov/entrez/query. fcgi?cmd=Retrieve&db=PubMed&list_uids=11589660&dopt=Abstract
10. Horenblas S, Van Tinteren HV. Squamous cell carcinoma of the penis. IV. Prognostic factors of survival: analysis of tumor, nodes and metastasis classification system. J Urol 1994; 151 : 1239-1243. http:// www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8158767&dopt=Abstract
11. Pizzocaro G, Piva L, Bandieramonte G, Tana S. Up-to-date management of carcinoma of the penis. Eur Urol 1997; 32 : 5-15. http://www.ncbi.nlm.nih.gov/ entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9266225&dopt=Abstract
12. Solsona E, Iborra I, Ricós JV, Monros JL, Dumont R, Casanova J, Calabuig C. Corpus cavernosum invasion and tumor grade in the prediction of lymph node condition in penile carcinoma. Eur Urol 1992; 22 : 115-118. http://www.ncbi.nlm.nih.gov/entrez/query. fcgi?cmd=Retrieve&db=PubMed&list_uids=1478225&dopt=Abstract
13. Ficarra V, Martignoni G, Maffei N, Cerruto MA, Novara G, Cavalleri S, Artibani W. Predictive pathological factors of lymph nodes involvement the squamous cell carcinoma of the penis. Int Urol Nephrol 2002; 34 : 245-250. http://www.ncbi.nlm.nih.gov/ entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=12775105&dopt=Abstract
14. Lopes A, Hidalgo GS, Kowallski LP, Torloni H, Rossi BM, Fonseca FP. Prognostic factors in carcinoma of the penis: multivariate analysis of 145 patients treated with amputation and lymphadenectomy. J Urol 1996; 156 : 1637-1642. http://www.ncbi.nlm. nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8863559&dopt=Abstract
15. Slaton JW, Morgenstern N, Levy DA, Santos MW jr, Tamboli P, Ro JY, Ayala AG, Pettaway CA. Tumor stage, vascular invasion and the percentage of poorly differentiated cancer: independent prognosticators for inguinal lymph node metastasis in penile squamous cancer. J Urol 2001; 165 : 1138-1142. http:// www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11257655&dopt=Abstract
16. Akduman B, Fleshner NE, Ehrlich L, Klotz L. Early experience in intermediate-risk penile cancer with sentinel node identification using the gamma probe. Urology 2001; 58 : 65-68. http://www.ncbi.nlm.nih. gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11445481&dopt=Abstract
17. Stancik I, Holtl W. Penile cancer: review of the recent literature. Curr Opin Urol 2003; 13 : 467-472. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Abstract&list_uids=14560140
18. Solsona E, Iborra I, Rubio J, Casanova JL, Ricós JV, Calabuig C. Prospective validation of the association of local tumor stage grade as a predictive factor for occult lymph node micrometastasis in patients with penile carcinoma and clinically negative inguinal lymph nodes. J Urol 2001; 165 : 1506-1509. http:// www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11342906&dopt=Abstract
19. Cubilla AL, Reuter V, Velazquez E, Piris A, Saito S, Young RH. Histologic classification of penile carcinoma and its relation to outcome in 61 patients with primary resection. Int J Surg Pathol 2001; 9 : 111-120. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11484498&dopt=Abstract
20. Villavicencio H, Rubio Briones J, Regalado R, Chechile G, Algaba F, Palou J. Grade, local stage and growth pattern as prognostic factors in carcinoma of the penis. Eur Urol 1997; 32 : 442-447. http:// www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9412803&dopt=Abstract
21. Alves G, Heller A, Fiedler W, Campos MM, Claussen U, Ornellas AA, Liehr T. Genetic imbalances in 26 cases of penile squamous cell carcinoma. Genes Chromosomes Cancer 2001; 31 : 48-53. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11284035&dopt=Abstract
22. Lam KY, Chan KW. Molecular pathology and clinicopathologic features of penile tumors: with special reference to analyses of p21 and p53 expression and unusual histologic features. Arch Pathol Lab Med 1999; 123 : 895-904. http://www.ncbi.nlm.nih.gov/ entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10506441&dopt=Abstract
23. Ornellas AA, Mendes Campos M, Ornellas MH, Wisnescky A, Koifman N, Cabral Harab R. [Penile cancer: flow cytometry study of ploidies in 90 patients.] Prog Urol 2000; 10 : 72-77. [French] http://www. ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10785922&dopt=Abstract
24. Martins AC, Faria SM, Cologna AJ, Suaid HJ, Tucci S jr. Immunoexpression of p53 protein and proliferating cell nuclear antigen in penile carcinoma. J Urol 2002; 167 : 89-92. http://www.ncbi.nlm.nih.gov/ entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11743282&dopt=Abstract
25. Laniado ME, Lowdell C, Mitchell H, Christmas TJ. Squamous cell carcinoma antigen: a role in the early identification of nodal metastases in men with squamous cell carcinoma of the penis. BJU Int 2003; 92 : 248-250. http://www.ncbi.nlm.nih.gov/entrez/query. fcgi?cmd=Retrieve&db=PubMed&list_uids=12887477&dopt=Abstract
4. DIAGNÓZA
Pro zvolení vhodného diagnostického přístupu ke karcinomu penisu je důležité vzít v úvahu primární lézi, regionální lymfatické uzliny a vzdálené metastázy jak na počátku, tak při sledování.
4.1 Primární léze
Pacienti s podezřelou lézí penisu by měli podstoupit fyzikální vyšetření. To obvykle dostačuje pro stanovení diagnózy a určení stadia, a napomáhá určit terapeutické rozhodnutí. Je důležité zaznamenat:
- průměr léze na penisu nebo podezřelých oblastí
- lokalizaci na penisu
- počet lézí
- morfologie léze, zda je papilární, nodulární, ulcerovaná nebo plochá
- vztah s ostatními strukturami (např. submukóza, corpora spongiosa a/nebo cavernosa, uretra)
- barva a ohraničení léze
Před stanovením léčby je naprosto nutná cytologická nebo histologická diagnóza. Jejím cílem není pouze potvrzení patologické diagnózy, ale také určení stupně histologické diferenciace tumoru. Tato informace pomůže při stanovení terapeutického přístupu týkajícího se primárního tumoru i určení rizikových skupin pro oblastní terapeutickou strategii [1]. Při vybírání nejvhodnější histologické diagnostické metody je třeba vzít v úvahu preference patologa. Patologická diagnóza může být stanovena incizní biopsií, biopsií vzorku tkáně, aspirací jemnou jehlou nebo biopsií odebranou kartáčkem (u cervikálního karcinomu). Biopsii z excize lze také užít jako konzervativní přístup u malých lézí lokalizovaných na předkožce nebo v jiné dosažitelné oblasti.
Diagnostické ultrazvukové vyšetření nebo zobrazovací vyšetření magnetickou rezonancí (MRI) může pomoci při identifikaci hloubky invaze tumoru, zejména s ohledem na infiltraci corpora cavernosa ([2,3]: úroveň důkazu 3). Avšak ultrazvukové vyšetření penisu je někdy obtížné interpretovat a pro detekci mikroskopické infiltrace je nespolehlivou metodou [4].
4.2 Regionální lymfatické uzliny
Je nezbytné provést důkladné fyzikální vyšetření ingvinální oblasti s přihlédnutím k následujícím aspektům:
4.2.1 Nehmatné lymfatické uzliny
V případě nehmatných lymfatických uzlin není indikace pro zobrazovací vyšetření nebo histologické vyšetření lymfatických uzlin. Pokud byly u primárního tumoru zjištěny špatné prognostické faktory, doporučuje se provést patologické a operační určení stadia ingvinálních lymfatických uzlin (viz později). Avšak biopsie sentinelové lymfatické uzliny, jak ji popisuje Canabas [5], se nedoporučuje vzhledem k tomu, že byla zaznamenána až 20% míra falešně negativních výsledků (rozpětí 9–50 % [6]). Existují však studie z poslední doby zabývající se dynamickou biopsií sentinelové lymfatické uzliny s užitím izosulfanové modři a/nebo 99mTc-koloidního sulfuru, což je nová slibná procedura [7,8]. Předběžné výsledky byly potvrzeny se 100% specifitou a 78–80% senzitivitou [9-12] a v nedávné době byly ověřeny v prospektivní studii ([13]: úroveň důkazu 2a). Senzitivita a specifita této metody musí být potvrzena v randomizovaných studiích.
4.2.2 Hmatné lymfatické uzliny
Pokud jsou přítomny hmatné lymfatické uzliny, měly by být zaznamenány následující parametry:
- průměr lymfatické uzlin(y) nebo mas(y)
- uni - nebo bilaterální lokalizace
- počet lymfatických uzlin identifikovaných v každé ingvinální oblasti
- mobilní nebo fixované lymfatické uzliny nebo masy
- vztah k ostatním strukturám (např. kůži, Cooperovu ligamentu) s ohledem na infiltraci, perforaci atd
- přítomnost edému na dolní končetině a/nebo šourku
Z hmatných ingvinálních lymfatických uzlin představuje při diagnóze 50 % spíše uzliny reaktivní než metastatické. Z druhé strany téměř 100 % zvětšených lymfatických uzlin, které se objeví při sledování, jsou metastatické ([14-16]: úroveň důkazu 2a). Regionální lymfatické uzliny by tedy měly být hodnoceny několik týdnů po léčbě primárního tumoru, aby mohla zánětlivá reakce odeznít.
Histologická diagnóza zahrnuje aspirační biopsii jemnou jehlou, biopsii vzorku tkáně jehlou nebo otevřenou biopsii podle preference patologa ([17,18]: úroveň důkazu 2b). V případě negativní biopsie a klinicky podezřelých lymfatických uzlin by měla být provedena opakovaná biopsie, nebo excizní biopsie. Užívány byly i zobrazovací techniky (počítačová tomografie CT, MRI). Ty jsou využívány i nadále, jsou ovšem velmi nákladné, a nadto jsou vhodnější pro určení stadia než pro včasnou detekci. Zkoumá se užití pozitronového emisního tomografického scanu (PET) [19].
4.3 Vzdálené metastázy
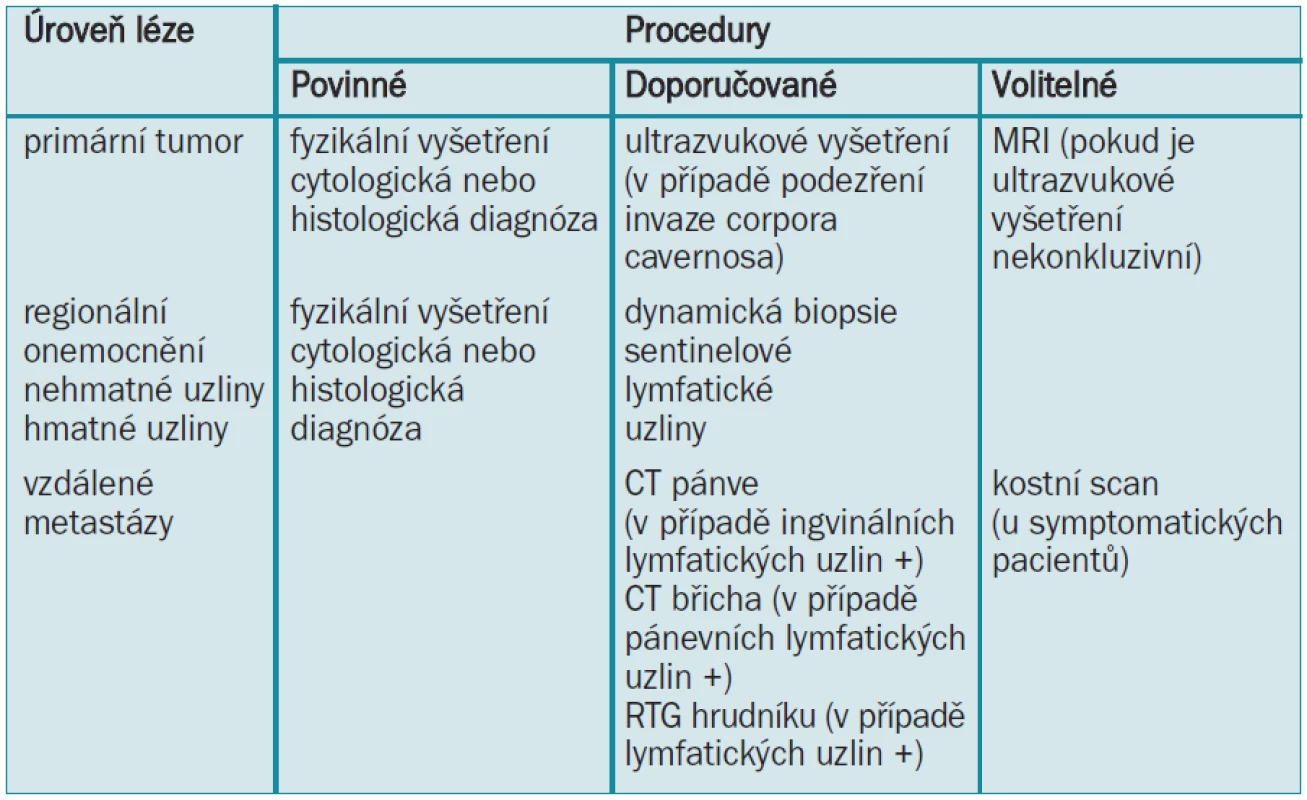
Hodnocení vzdálených metastáz by se mělo provádět pouze u pacientů s prokázanými pozitivními lymfatickými uzlinami ([20,21]: úroveň důkazu 2b). Pro identifikaci pánevních a/nebo retroperitoneálních lymfatických uzlin u pacientů s ingvinálními metastázemi se provádí pánevní/abdominální CT. Přestože to není spolehlivá diagnostická metoda [22], má detekce mas v oblasti pánve významný vliv na terapii a prognózu [23,24]. Pacientům s pozitivními lymfatickými uzlinami by se mělo provádět RTG-vyšetření hrudníku. Rutinní rozbor krve by se měl provádět pouze u pacientů s velkými ingvinálními masami a pánevními uzlinami a u pacientů s metastázami [25,26]. Provedení kostního scanu se doporučuje pouze u symptomatických případů [20]. Diagnostický plán je uveden v tab. 6.
Cabanasova technika [5] se již nedoporučuje. Novou slibnou procedurou je užití izosulfanové modři nebo 99mTc-koloidního sulfuru [7-13].
4.4 Guidelines pro diagnózu karcinomu penisu
Primární tumor
- Fyzikální vyšetření zaznamenávající morfologii a charakter fyzikálních lézí je povinné (stupeň B).
- Cytologická nebo histologická diagnóza je také povinná (stupeň B).
- Zobrazovací vyšetření: Doporučuje se provedení ultrazvukového vyšetření penisu pro demonstraci invaze corpora cavernosa. V případě nekonkluzivních výsledků je volitelnou metodou ultrazvukové vyšetření nebo MRI (stupeň C).
Regionální lymfatické uzliny
- Fyzikální vyšetření je povinné (stupeň B).
- V případě, že jsou uzliny nehmatné, není žádná indikace pro provedení zobrazovacího nebo histologického vyšetření. Doporučuje se provedení nové techniky, dynamické biopsie sentinelové lymfatické uzliny, která má prediktivní hodnotu u pacientů se středním a vysokým rizikem (stupeň B).
- V případě, že jsou uzliny hmatné, je nezbytné zaznamenat morfologii a fyzikální charakteristiku lymfatických uzlin a stanovit histologickou diagnózu (stupeň B).
Vzdálené metastázy (pouze u pacientů s metastázami do ingvinálních lymfatických uzlin) (stupeň B)
- Doporučuje se provedení CT-scanu pánve/břicha (pozitivní pánevní uzliny)
- Doporučuje se také RTG-vyšetření hrudníku.
- Rutinní laboratorní vyšetření je volitelné při specifických podmínkách.
- Kostní scan se doporučuje pouze u symptomatických případů.
4.5 Literatura
1. Solsona E, Iborra I, Rubio J, Casanova JL, Ricós JV, Calabuig C. Prospective validation of the association of local tumor stage grade as a predictive factor for occult lymph node micrometastasis in patients with penile carcinoma and clinically negative inguinal lymph nodes. J Urol 2001; 165 : 1506-1509. http:// www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11342906&dopt=Abstract
2. Agrawal A, Pai D, Ananthakrishnan N, Smile SR, Ratnakar C. Clinical and sonographic findings in carcinoma of the penis. J Clin Ultrasound 2000; 28 : 399-406. http://www.ncbi.nlm.nih.gov/entrez/query. fcgi?cmd=Retrieve&db=PubMed&list_uids=10993967&dopt=Abstract
3. Lont AP, Besnard AP, Gallee MP, van Tinteren H, Horenblas S. A comparison of physical examination and imaging in determining the extent of primary penile carcinoma. BJU Int 2003; 91 : 493-495. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=12656901&dopt=Abstract
4. Horenblas S. The accuracy of ultrasound in squamous cell carcinoma. In: The Management of Penile Squamous Cell Carcinoma. A Retrospective and Prospective Study. Thesis. Amsterdam Zoetermeer: BV Export drukkerij 1993 : 71-83.
5. Cabanas RM. An approach for the treatment of penile carcinoma. Cancer 1977; 39 : 456-466. http:// www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=837331&dopt=Abstract
6. Pettaway CA, Pisters LL, Dinney CPN, Jularbal F, Swanson DA, von Eschenbach AC, Ayala A. Sentinel lymph node dissection for penile carcinoma: the M.D. Anderson Cancer Center Experience. J Urol 1995; 154 : 1999-2003. http://www.ncbi.nlm.nih.gov/ entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7500444&dopt=Abstract
7. Horenblas S. Surgical management of carcinoma of the penis and scrotum. In: Petrovich Z, Baert L, Brady LW (eds). Medical Radiology. Diagnostic Imaging and Radiation Oncology. Carcinoma of the Kidney and Testis, and Rare Urologic Malignancies. Berlin: Springer-Verlag 1999 : 341-354.
8. Pettaway CA, Jularbal FA, Babaian RJ, Dinney CPN, Pisters LL. Intraoperative lymphatic mapping to detect inguinal metastases in penile carcinoma: results of a pilot study. J Urol 1999; 161 : 159 (abstract 612).
9. Akduman B, Fleshner NE, Ehrlich L, Klotz L. Early experience in intermediate-risk penile cancer with sentinel node identification using the gamma probe. Urology 2001; 58 : 65-68. http://www.ncbi.nlm.nih. gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11445481&dopt=Abstract
10. Perdona S, Gallo L, Claudio L, Marra L, Gentile M, Gallo A. Role of crural inguinal lymphadenectomy and dynamic sentinel lymph node biopsy in lymph node staging in squamous-cell carcinoma of the penis. Our experience. Tumori 2003; 89(Suppl): 276-279. http:// www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=12903620&dopt=Abstract
11. Tanis PJ, Lont AP, Meinhardt W, Olmos RA, Nieweg OE, Horenblas S. Dynamic sentinel node biopsy for penile cancer: reliability of a staging technique. J Urol 2002; 168 : 76-80. http://www.ncbi.nlm.nih.gov/ entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=12050496&dopt=Abstract
12. Warwoschek F, Vogt H, Bachter D, Weckermann D, Hamm M, Harzmann R. First experience with gamma probe guided sentinel lymph node surgery in penile cancer. Urol Res 2000; 28 : 246-249. http:// www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11011963&dopt=Abstract
13. Lont AP, Horenblas S, Tanis PJ, Gallee MP, Van Tinteren H, Nieweg OE. Management of clinically node negative penile carcinoma: improved survival after the introduction of dynamic sentinel node biopsy. J Urol 2003; 170 : 783-786. http://www.ncbi.nlm. nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=12913697&dopt=Abstract
14. Horenblas S, Van Tinteren H, Delamarre JFM, Moonen LM, Lustig V, van Waardenburg EW. Squamous cell carcinoma of the penis. III. Treatment of regional lymph nodes. J Urol 1993; 149 : 492-497. http:// www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8437253&dopt=Abstract
15. Ornellas AA, Seixas ALC, Marota A, Wisnescky A, Campos F, de Moraes JR. Surgical treatment of invasive squamous cell carcinoma of the penis: retrospective analysis of 350 cases. J Urol 1994; 151 : 1244-1249. http://www.ncbi.nlm.nih.gov/entrez/ query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7512656&dopt=Abstract
16. Pizzocaro G, Piva L, Nicolai N. Treatment of lymphatic metastasis of squamous cell carcinoma of the penis: experience at the National Tumor Institute of Milan. Arch Ital Urol Androl 1996; 68 : 169-172. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8767505&dopt=Abstract
17. Senthil Kumar MP, Ananthakrishnan N, Prema V. Predicting regional node metastasis in carcinoma of the penis: a comparison between fine-needle aspiration cytology, sentinel lymph node biopsy and medial inguinal lymph node biopsy. BJU 1998; 81 : 453-457. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9523669&dopt=Abstract
18. Skoog I, Collins BT, Tani E, Ramos RR. Fine-needle aspiration cytology of penile tumors. Acta Cytol 1998; 42 : 1336-1340. http://www.ncbi.nlm.nih.gov/ entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9850639&dopt=Abstract
19. Ravizzini GC, Wagner M, Borges-Neto S. Positron emission tomography detection of metastatic penile squamous cell carcinoma. J Urol 2001;165 : 1633-1634. http://www.ncbi.nlm.nih.gov/entrez/query. fcgi?cmd=Retrieve&db=PubMed&list_uids=11342941&dopt=Abstract
20. Burgers JK, Badalament RA, Drago JR. Penile cancer: clinical presentation, diagnosis and staging. Urol Clin North Am 1992; 19 : 247-256. http:// www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=1574815&dopt=Abstract
21. Horenblas S, van Tinteren H, Delamarre JFM, Moonen LM, Lustig V, van Waardenburg EW. Squamous cell carcinoma of the penis. III. Treatment of regional lymph nodes. J Urol 1993; 149 : 492-497. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8437253&dopt=Abstract
22. Horenbas S, Van Tinteren H, Delemarre JFM, Moonen LM, Lustig V, Kroger R. Squamous cell carcinoma of the penis: accuracy of tumor, nodes and metastasis classification system, and role of lymphangiography, computed tomography scan and fine needle aspiration cytology. J Urol 1991; 146 : 1279-1283. http://www.ncbi.nlm.nih.gov/entrez/query. fcgi?cmd=Retrieve&db=PubMed&list_uids=1942279&dopt=Abstract
23. Lopes A, Bezerra AL, Serrano SV, Hidalgo GS. Iliac nodal metastases from carcinoma of the penis treated surgically. BJU Int 2000; 86 : 690-693. http:// www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11069378&dopt=Abstract
24. Srinivas V, Morse M, Herr E, Sogani P, Whitmore WF jr. Penile cancer: relation of extent of nodal metastasis to survival. J Urol 1987; 137 : 880-882. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=3573181&dopt=Abstract
25. Dexeus FH, Logothetis CJ, Sella A, Amato R, Kilbourn R, Fitz K, Striegel A. Combination chemotherapy with methotrexate, bleomycin and cisplatin for advanced squamous cell carcinoma of the male genital tract. J Urol 1991; 146 : 1284-1287. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=1719241&dopt=Abstract
26. Montie JE. Follow-up after penectomy for penile carcinoma. Urol Clin North Am 1994; 21 : 725-727. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7974900&dopt=Abstract
5. LÉČBA
5.1 Primární léze
5.1.1 Intraepiteliální neoplazie penisu
V případech intraepiteliální neoplazie penisu se doporučuje strategie léčby zachovávající penis. Úspěšně byly aplikovány následující terapie ([1,2]: úroveň důkazu 3):
- laserová terapie (oxid uhličitý-laser nebo Neodymium:Ytrium-aluminum-Garnet Nd-YAG)
- kryoterapie
- fotodynamická terapie
- topický imiquimod (5%)
- 5-fluorouracil (5-FU) krém
- lokální excize
- Mohsova operace
Terapeutický přístup by měl být stanoven v závislosti na preferenci operatéra a pacienta a dostupné technologii.
5.1.2 Kategorie Ta-1G1-2
U pacientů, u nichž je možné zabezpečit pravidelné sledování, se velmi doporučuje strategie zachovávající penis, tj. laserová terapie [3-7], lokální excize + rekonstrukční operace [8-10], radioterapie nebo brachyterapie [11-16], glansektomie ([10,17]: úroveň důkazu 2a). U radioterapie a laserové terapie je míra zachování orgánu 55–84 %.
Mezi mikrografickou operací, zevní radiační terapií, intersticiální brachyterapií a laserovou terapií nejsou žádné rozdíly v procentu lokální recidivy (15–25 %). Avšak při tradiční konzervativní operaci je procento recidivy proměnlivější, 11–50 % [10]. Při provádění těchto procedur a pro snížení procenta lokální recidivy na 9–24 % je nezbytné patologické hodnocení chirurgických okrajů ([9,18,19]: úroveň důkazu 2b).
Aby bylo možno léčit lokální recidivu onemocnění co nejdříve, je nezbytné pečlivé sledování. Obecně nemusí mít lokální recidiva negativní vliv na přežití ([12,20]: úroveň důkazu 3). U pacientů, u nichž není možno zajistit pravidelné sledování, se doporučuje parciální amputace.
5.1.3 Kategorie T1G3, T2
Částečnou, nebo úplnou amputaci nebo zeslabení v závislosti na rozsahu tumoru lze považovat za standardní terapii ([2,10,21,22]: úroveň důkazu 2a).
Konzervativní strategie je alternativou u pečlivě vybraných pacientů s tumorem postihujícím méně než polovinu glans, u nichž lze provádět sledování ([17,23]: úroveň důkazu 2b).
Užití indukční dávky chemoterapie v kontextu klinické studie následované konzervativními procedurami v případě úplné nebo částečné odpovědi, lze považovat za výzkumné doporučení. U druhé procedury byly zaznamenány slibné výsledky, dokonce i v případě infiltrace corpora cavernosa ([12,24,26]: úroveň důkazu 3).
5.1.4 Lokální recidiva onemocnění
U lokální recidivy po konzervativní terapii se důrazně doporučuje druhá konzervativní procedura v případě, že nejsou invadována corpora cavernosa ([7,20]: úroveň důkazu 2b). V případě velké nebo hluboko infiltrující recidivy se však důrazně doporučuje částečná nebo úplná amputace.
5.1.5 Radioterapie
Radiace zevním paprskem nebo brachyterapie zajišuje excelentní výsledky u infiltrujících tumorů, které mají méně než 4 cm v průměru. Pozdní následky (např. stenóza meatu, nekróza kůže) nejsou výjimečné. Užitím jedné techniky dosáhneme lepších výsledků než při kombinaci zevní iradiace a brachyterapie ([11-16]: úroveň důkazu 2a).
5.2 Regionální lymfatické uzliny
U karcinomu penisu souvisí úspěch terapie se stavem a léčbou lymfatických uzlin. Pro pacienty s pozitivními lymfatickými uzlinami je úspěšnou terapií lymfadenektomie ([21,22,27-29]: úroveň důkazu 2a). Tato procedura je však spojena s vysokou mírou morbidity (30–50 %) [2,30], dokonce i při užití moderních technických modifikací [31-33]. Tato morbidita zabraňuje profylaktickému užití lymfadenektomie, přestože je tento aspekt stále kontroverzní [1,34]. Racionální provedení lymfadenektomie vyžaduje pečlivé vyšetření třísla a uvědomění si prediktivních faktorů pozitivních lymfatických uzlin [35-37].
5.2.1 Nehmatné lymfatické uzliny
Analýza (uni - a multivarietní) prognostických faktorů určila 3 rizikové skupiny pro vznik uzlinových metastáz ([2,4,38,39]: úroveň důkazu 2a).
Skupina s nízkým rizikem:
U pacientů s nízkým rizikem vzniku uzlinových mikrometastáz (pTis, pTaG1-2 nebo pT1G1) se doporučuje program sledování, vzhledem k tomu, že pravděpodobnost vzniku okultních mikrometastáz v ingvinálních lymfatických uzlinách je menší než 16,5 % ([38-40]: úroveň důkazu 2a). Pokud jsou pacienti pro sledování považováni za nespolehlivé, doporučuje se „modifikovaná“ ingvinální lymfadenektomie.
Skupina se středním rizikem:
V případech se středním rizikem (T1G2) by měl výběr terapie vzít v úvahu vaskulární a lymfatickou invazi a charakter růstu ([35-37]: úroveň důkazu 2a).
U pacientů bez vaskulární nebo lymfatické invaze nebo u superficiálního charakteru růstu primárního tumoru je povinný program sledování. Avšak v případech vaskulárního nebo lymfatického postižení nebo infiltrujícího charakteru růstu, pokud nemohou pacienti spolehlivě podstoupit pravidelné sledování, se doporučuje modifikovaná lymfadenektomie. Současná vysoká spolehlivost dynamické biopsie sentinelových lymfatických uzlin zaznamenaná v nedávno provedených studiích ([41]: úroveň důkazu 2a) může nahradit užití prediktivních faktorů při indikování potřeby modifikované lymfadenektomie ve skupině s tímto rizikem.
Skupina s vysokým rizikem:
U pacientů s vysokým rizikem postižení lymfatických uzlin (pT2 nebo G3) se doporučuje modifikovaná nebo radikální ingvinální lymfadenektomie. U těchto pacientů se incidence okultních metastáz pohybuje mezi 68 % a 73 % ([4,38-40]: úroveň důkazu 2a).
Modifikovanou lymfadenektomii lze rozšířit na radikální lymfadenektomii, v případě, že jsou při vyšetření „nazmrzlo“ přítomny pozitivní lymfatické uzliny.
5.2.2 Hmatné lymfatické uzliny s pozitivní histopatologií
Pozitivní hmatné uzliny:
V případě pozitivních hmatných uzlin se doporučuje bilaterální radikální ingvinální lymfadenektomie.
Na to, kdy se má provádět pánevní lymfadenektomie, jsou stále kontroverzní názory. Okamžitou nebo opožděnou pánevní lymfadenektomii lze provádět v případech, v nichž jsou při biopsii „nazmrzlo“ nebo při standardním patologickém vyšetření zjištěny 2 nebo více pozitivních ingvinálních lymfatických uzlin nebo, je li zjištěna extrakapsulární invaze. V těchto případech se incidence pozitivních pánevních lymfatických uzlin zvyšuje na 30 % ([28]: úroveň důkazu 2b).
Celkově je pravděpodobnost postižení pánevních lymfatických uzlin 23%, pokud jsou postiženy 2–3 ingvinální uzliny, a 56%, pokud jsou postiženy více než 3 uzliny ([42]: úroveň důkazu 2b). V těchto případech jsou metastázy často mikroskopické a nabízejí možnost vyléčení v 14–54 % ([28,43]: úroveň důkazu 2b).
V kontralaterální oblasti bez hmatných lymfatických uzlin lze nejprve zvážit modifikovanou lymfadenektomii a poté ji rozšířit, v případě, že jsou při biopsii „nazmrzlo“ přítomny pozitivní lymfatické uzliny.
Fixované ingvinální masy nebo klinicky pozitivní pánevní lymfatické uzliny (CT-scan nebo MRI):
U pacientů s fixovanými ingvinálními masami nebo klinicky pozitivními pánevními lymfatickými uzlinami (CT-scan nebo MRI) může poskytnout indukční fáze chemoterapie částečnou, nebo úplnou klinickou odpověď ve 21–60 % ([35,42-51]: úroveň důkazu 2b). Doporučuje se následné provedení radikální ilioingvinální lymfadenektomie ([4,34,42,44,51]: úroveň důkazu 2b). Tato strategie by měla být užita jako součást klinické studie.
Další strategií je provedení předoperační radioterapie [52-54], ovšem je třeba vzít v úvahu zvýšenou morbiditu lymfadenektomie po radioterapii ([22]: úroveň důkazu 3). Přesto je tento přístup úspěšný u jiných druhů karcinomu, např. rektálního karcinomu nebo SCC hlavy a oblasti krku.
Přítomnost hmatných ingvinálních lymfatických uzlin při sledování: Pokud se při programu sledování objeví hmatné ingvinální uzliny, doporučují se 2 léčebné postupy.
- První je bilaterální radikální ingvinální lymfadenektomie s podobnými kritérii, která jsme již uvedli výše.
- Druhá je ingvinální lymfadenektomie, prováděná v místě pozitivních lymfatických uzlin v případě dlouhého intervalu bez onemocnění. Pozitivní lymfatické uzliny v obou ingvinálních oblastech po sledování by se měly objevit zároveň, nebo s velmi malým intervalem v obou ingvinálních oblastech. Pravděpodobnost vzniku pozdních metastáz do lymfatických uzlin v kontralaterální ingvinální oblasti po počáteční unilaterální recidivě ingvinální lymfatické uzliny je asi 10% ([55]: úroveň důkazu 3). V těchto případech může být unilaterální lymfadenektomie oprávněná, ovšem doporučuje se program sledování. Pokud je však při unilaterální lymfadenektomii patologická více než 1 lymfatická uzlina je pravděpodobnost okultního kontralaterálního postižení asi 30% a opravňuje časnou bilaterální ingvinální lymfadenektomii ([29]: úroveň důkazu 3).
Adjuvantní terapie se doporučuje, pokud jsou při patologickém vyšetření nalezeny 2 nebo více pozitivních uzlin nebo extrakapsulární postižení uzlin, a to proto, že tito pacienti mají horší prognózu než pacienti s 1 pozitivní lymfatickou uzlinou ([51-58]: úroveň důkazu 2a). Výsledky 2. fáze studií ukazují, že pro tyto pacienty je vhodná adjuvantní chemoterapie ([51,56-58]: úroveň důkazu 2b). Tyto adjuvantní programy by však měly být prováděny jako součást kontrolovaných klinických studií. K dispozici je méně údajů týkajících se adjuvantní radioterapie ([52,54]: úroveň důkazu 3).
5.3 Guidelines pro léčbu karcinomu penisu
5.3.1 Doporučení pro terapii primární léze
Intraepiteliální neoplazie penisu
- Doporučuje se strategie se snahou o zachování penisu (stupeň B)
Kategorie Ta-1G1-2
- Doporučuje se strategie se snahou o zachování penisu
- U pacientů, kteří nedodržují pravidelné sledování, je alternativním řešením parciální amputace (stupeň B)
Kategorie T1G3, T 2
- Za standardní terapii lze považovat parciální nebo úplnou amputaci nebo emaskulinizaci dle rozsahu tumoru (stupeň B)
- Konzervativní terapie u velmi pečlivě vybraných pacientů (stupeň B)
- Chemoterapie po konzervativní proceduře je možností ve fázi výzkumu (stupeň C)
Lokální recidiva onemocnění po konzervativní terapii
- Pokud nedojde k invazi do corpora cavernosa, doporučuje se druhá konzervativní procedura (stupeň B)
- V případě velké nebo infiltrující recidivy se doporučuje parciální nebo úplná amputace (stupeň B)
5.3.2 Doporučení pro terapii regionálních lymfatických uzlin v případě nehmatných uzlin
Nízké riziko skrytých metastáz (pTis, pTaG1-2, pT1G1)
- Doporučuje se program sledování
- U pacientů považovaných za nespolehlivé pro sledování je možným doporučením modifikovaná lymfadenektomie (stupeň B)
Vysoké riziko skrytých metastáz (pT 2 nebo G3)
- Doporučuje se modifikovaná, nebo radikální lymfadenektomie (stupeň B)
Střední riziko skrytých metastáz (pT1G2)
- Výběr terapie může být ovlivněn zvážením vaskulární a lymfatické invaze a charakterem růstu (stupeň B)
- Přísné sledování je možným postupem u pacientů bez těchto nálezů, u nichž je možné spolehlivé a pravidelné sledování (stupeň B)
- Modifikovaná lymfadenektomie je volbou u pacientů se špatnými histologickými nálezy (stupeň B)
- Dynamická biopsie sentinelové lymfatické uzliny pomocí izosulfanové modři a/nebo 99mTc-koloidního sulfuru je alternativní metodou pro indikaci lymfadenektomie, pokud tato je technologie k dispozici
- Modifikovanou lymfadenektomii lze rozšířit na radikální lymfadenektomii, pokud, že jsou přítomny pozitivní lymfatické uzliny (stupeň B)
5.3.3 Doporučení pro terapii regionálních lymfatických uzlin v případě, že jsou přítomny hmatné pozitivní lymfatické uzliny
- Standardním doporučením je bilaterální radikální ingvinální lymfadenektomie (stupeň B)
- Pánevní lymfadenektomii lze provádět v případech s alespoň 2 pozitivními ingvinálními uzlinami nebo extrakapsulární invazí (stupeň B)
- Modifikovanou lymfadenektomii lze nejprve zvážit v kontralaterální ingvinální oblasti bez hmatných lymfatických uzlin (stupeň B)
- Pacienti s fixovanými ingvinálními masami nebo klinicky pozitivními pánevními lymfatickými uzlinami (CT nebo MRI) jsou vhodnými kandidáty pro indukční chemoterapii a následnou ilioingvinální lymfadenektomii (stupeň B). Další strategií je provedení předoperační radioterapie, což může vést k vážným komplikacím (stupeň C)
- Pokud se během programu sledování objeví hmatné ingvinální uzliny jsou zde 2 možná doporučení:
- Bilaterální radikální ingvinální lymfadenektomie
- Ingvinální lymfadenektomie v místě pozitivních lymfatických uzlin podle intervalu bez onemocnění, a pokud byly ve vzorku zjištěny méně než 2 pozitivní lymfatické uzliny (stupeň B). V případě alespoň 2 pozitivních lymfatických uzlin nebo extrakapsulárního postižení uzlin se doporučuje adjuvantní chemoterapie, další možností je adjuvantní radioterapie (stupeň C)
5.4 Integrovaná terapie
U pacientů, u nichž je přítomen primární tumor spolu s pozitivními lymfatickými uzlinami, by měly být oba problémy řešeny současně. U pacientů s počátečním výskytem pozitivních pánevních uzlin by měla být nejprve provedena indukční chemoterapie. Dle odpovědi tumoru je indikována radikální nebo paliativní operace nebo radioterapie.
5.5 Vzdálené metastázy
Chemoterapie nebo paliativní terapie může být vyzkoušena dle věku, stavu a preference pacienta. Vzhledem k špatné účinnosti chemoterapie při metastazujícím onemocnění se tento přístup doporučuje pouze příležitostně u vybraných pacientů, pro něž může být prodloužení doby přežití důležité, nebo u symptomatických pacientů v celkově dobrém stavu, v kombinaci s paliativními procedurami.
5.6 Kvalita života
Přestože je karcinom penisu maligní onemocnění s vysokou pravděpodobností vyléčení, má vysoký stupeň terapeutické morbidity.
Neexistuje žádný konsenzus týkající se vlivu parciální penektomie na kvalitu života, nejspíše vzhledem k odlišným postojům pacientů v Evropě a Jižní Americe [59]. V Evropě však byl pozorován negativní vliv na celkový zdravotní stav, úzkost, sociální obtíže a sexuální funkce ([60,62]: úroveň důkazu 2a).
S ohledem na kvalitu života by měl proces volby terapie brát v úvahu věk pacienta, stav, socioekonomické faktory a geografickou polohu, sexuální funkci, motivaci a psychický stav pacienta, morbiditu různých procedur a biologii tumoru.
5.7 Technické aspekty
5.7.1 Primární léze
Nejdůležitějšími faktory při výběru konzervativní strategie jsou jednoduchost a morbidita procedury a zkušenost operatéra. Před brachyterapií je nutné provedení obřízky.
5.7.2 Parciální amputace
Částečná amputace tradičně vyžadovala odstranění 2cm okrajů bez tumoru. Přestože je to nejspíš více, než je nutné, je nezbytné při patologickém vyšetření dosáhnout okrajů bez tumoru. Bezpečný by byl už chirurgický okraj o rozměru 10 mm [63], v případě G3 by pak měl mít rozměr 1,5 cm ([64]: úroveň důkazu 2b).
5.7.3 Radikální ingvinální lymfadenektomie
Radikální ingvinální lymfadenektomie by měla zahrnovat následující anatomické orientační body: tříselný vaz, m. adductor, m. sartorius s femorální žílou a arterií jako pole preparace.
5.7.4 „Modifikovaná“ ingvinální lymfadenektomie
V. saphena by měla být zachována a měla by být zachována 1–2cm redukce laterálních a inferiorních hranic. S těmito modifikacemi je to bezpečná operace s nižší mírou komplikací a morbidity, než při ileoingvinální lymfadenektomii ([31-34]: úroveň důkazu 2b).
5.7.5 Lymfadenektomie
Morbidita při lymfadenektomii pro karcinom penisu zůstává vysoká, navzdory zlepšení operačních technik, které zahrnují:
- silnější a méně rozsáhlé kožní laloky pro redukci nekrózy kůže
- ochranu femorálních cév překrytím svalovinou m. sartorius
- zlepšení kontroly lymfatických uzlin a zachování v. saphena pro snížení otoku končetin
- antikoagulační léčbu během i po operaci pro prevenci hluboké trombózy žil a plicní embolie
V MD Anderson Cancer Center byly profylaktická a terapeutická preparace spojeny s nižší incidencí komplikací ve srovnání s paliativní preparací a vážné komplikace se vyskytovaly častěji ve skupině, u níž byla provedena paliativní disekce [30].
5.7.6 Pánevní lymfadenektomie
Pánevní lymfadenektomie zahrnuje zevní ilický lymfatický řetězec a ilioobturátorový řetězec s následujícími hranicemi:
- proximální hranice: ilická bifurkace
- laterální hranice: ileoingvinální nerv
- mediální hranice: n. obturatorius
5.8 Chemoterapie
Chemoterapeutický režim by měl být prodiskutován s onkologem. Následující doporučení však lze užít jako guidelines.
5.8.1 Adjuvantní chemoterapie
Adjuvantní chemoterapie zahrnující 2 dávky cisplatiny a 5-FU může být dostatečná, nebo lze ambulantně aplikovat vinkristine, metotrexát a bleomycin 1krát týdně po dobu 12 týdnů [57]. Tento režim po radikální resekci metastáz do lymfatických uzlin dosáhl 82% přežití po dobu 5 let u 25 po sobě jdoucích pacientů ve srovnání s pouze 37% u 31 po sobě jdoucích historických kontrolách léčených samotnou radikální operací [57]. Přesnější analýza 2 souborů umožnila určit zajímavé rizikové faktory: u žádného z pacientů z kategorie pN1 nedošlo k recidivě, a to bez závislosti na tom, zda byla, nebo nebyla aplikována adjuvantní chemoterapie. K recidivě došlo po adjuvantní chemoterapii (50 %) pouze u pacientů s bilaterálními a/nebo pánevními metastázami ([51,58,65]: úroveň důkazu 2b).
5.8.2 Neoadjuvantní terapie u fixovaných ingvinálních lymfatických uzlin
Indukční chemoterapie se skládá ze 3 až 4 dávek cisplatiny a 5-FU s vhodným dávkováním a sekvencí. V Pizzocarových sériích [51,57] mohlo být z 16 pacientů léčených neoadjuvantní chemoterapií u fixovaných ingvinálních uzlin 9 (56 %) radikálně resekováno po primární chemoterapii a 5 (31 %) bylo zřejmě vyléčeno. Autoři pozorovali, že aplikací cisplatiny v kombinaci s 5-FU dosáhneme nejlepších výsledků. To bylo potvrzeno v kompilaci 29 pacientů s podobnou charakteristikou s mírou klinické odpovědi 66 %. U 38 % pacientů byla provedena radikální záchranná operace. Zřejmě vyléčeno bylo 17 % ([46,48,65,66]: úroveň důkazu 2b). Celkem je při kombinaci všech zaznamenaných souborů míra odpovědi 68,5 %, míra radikální operace je 42,8 % a procento přežití je 23 % [42,50].
5.8.3 Chemoterapie u pokročilého onemocnění
Chemoterapie u pokročilého stadia onemocnění není v případě karcinomu penisu příliš rozšířena. Nejčastěji užívanou kombinací je cisplatina a 5-FU [48,65] a cisplatina, bleomycin a metotrexát [46,47]. Kattan et al [66] užívali několik kombinací chemoterapie založených na cisplatině. Výsledky jsou u pacientů s rozšířeným onemocněním obvykle skromné, s 32% mírou úplné a částečné odpovědi a 12% mírou úmrtí spojenými s léčbou v poslední studii [47].
Procento odpovědi je podobné u pacientů léčených cisplatinou v kombinaci s 5-FU, ovšem tolerance této léčby je mnohem lepší při žádném úmrtí spojeném s léčbou [48,65]. Intraarteriální chemoterapie u lokálně pokročilého nebo recidivujícího SCC penisu má slibné výsledky [49,67] jako paliativní léčba i neoadjuvantní terapie.
5.9 Radioterapie
5.9.1 Primární tumor
Radioterapie zevním ozářením nebo brachyoterapie dosahuje 56% a 70% míry úplné odpovědi. Přestože míra lokálního selhání byla 40% a 16%, záchranná resekce může obnovit lokální kontrolu. Srovnání těchto metod je obtížné vzhledem k selekčnímu bias z důvodu vyloučení pacientů s velkým objemem onemocnění (> 4 cm) z léčby ozářením. Časté komplikace zahrnují stenózu meatu u 15–30 %, uretrální striktury u 20–35 % a teleangiektazie u více než 90 %. Změny po radiaci zahrnují nekrózu, kterou je klinicky obtížné rozeznat od perzistujícího tumoru [42].
5.9.2 Profylaktická radioterapie
Profylaktická radioterapie se u klinicky negativních lymfatických uzlin nedoporučuje, protože radioterapie nedokáže zabránit vzniku metastáz do lymfatických uzlin [53,54]. Navíc budou všichni pacienti vystaveni komplikacím spojeným s radioterapií [22,29] a také sledování pacientů je obtížnější vzhledem k fibrotickým změnám spojeným s radiací, což činí fyzikální vyšetření nespolehlivým. Zdá se, že vzhledem k tomu, že procento pacientů s 5letou dobou přežití je u radioterapie poloviční než procento 5letého přežití dosažené operací, nemá radioterapie u pacientů s patologickými lymfatickými uzlinami místo jako primární léčba [29].
5.9.3 Předoperační radioterapie
Předoperační radioterapie u pacientů s fixovanými lymfatickými uzlinami je může učinit operabilními, ovšem není známo, zda je fixace způsobena zánětlivými reakcemi, nebo růstem nádoru [22,29,54]. V současné době studie ukazují, že by tato strategie mohla být nahrazena chemoterapií [4].
5.9.4 Adjuvantní radioterapie
Adjuvantní radioterapie může být v případech metastáz do lymfatických uzlin provedena pro snížení lokální recidivy [8,14]. Terapeutický plán pro karcinom penisu je zobrazen v tab. 7.
Tab. 7. Terapeutický plán pro karcinom penisu. 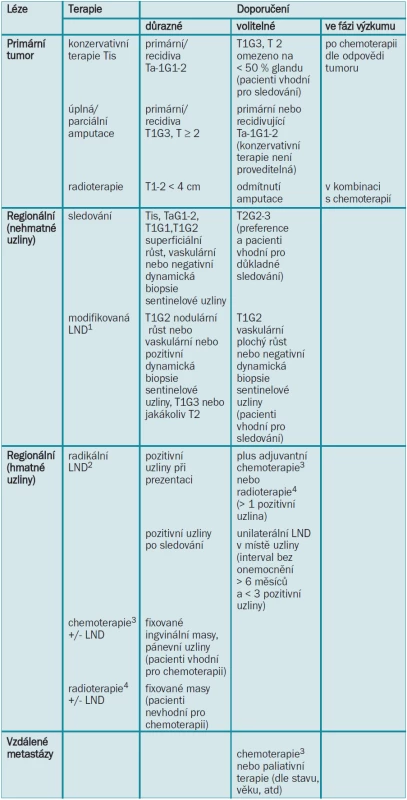
LND = lymfadenektomie 1Modifikovanou LND lze rozšířit na radikální v případě pozitivních uzlin. 2Pokud jsou na protější straně přítomny unilaterální nehmatné uzliny, lze provádět modifikovanou LND. Pánevní LND by měla být provedena při více než 1 pozitivní ingvinální uzlině. 3Chemoterapie by měla být prodiskutována s onkologem a pokud možno prováděna v kontextu klinické studie. 4Radioterapie má nekonzistentní výsledky a vysokou morbiditu spojenou s operací. 5.10 Literatura
1. Mobilio G, Ficarra V. Genital treatment of penile carcinoma. Curr Opin Urol 2001; 11 : 299-304. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11371784&dopt=Abstract
2. Stancik I, Holtl W. Penile cancer: review of the recent literature. Curr Opin Urol 2003; 13 : 467-472. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=14560140&dopt=Abstract
3. Frimberger D, Hungerhuber E, Zaak D, Waidelich R, Hofstetter A, Schneede P. Penile carcinoma. Is Nd: YAG laser therapy radical enough. J Urol 2002; 168 : 2418-2421. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=12441930&dopt=Abstract
4. Pizzocaro G, Piva L, Bandieramonte G, Tana S. Up-to-date management of carcinoma of the penis. Eur Urol 1997; 32 : 5-15. http://www.ncbi.nlm.nih.gov/ entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9266225&dopt=Abstract
5. Van Bezooijen BP, Horenblas S, Meinhardt W, Newling DW. Laser therapy for carcinoma in situ of the penis. J Urol 2001; 166 : 1670-1671. http://www. ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11586199&dopt=Abstract
6. Windahl T, Hellsten S. Laser treatment of localized squamous cell carcinoma of the penis. J Urol 1995; 154 : 1020-1023. http://www.ncbi.nlm.nih.gov/ entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7637046&dopt=Abstract
7. Windalh T, Andersson S-O. Combined laser treatment for penile carcinoma: results after long-term follow up. J Urol 2003; 169 : 2118-2121. http://www. ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=12771731&dopt=Abstract
8. Banon Perez VJ, Nicolas Torralba JA, Valdevira Nadal P, Server Pastor G, Garcia Hernandez JA, Guardiola Mas A, Gomez Gomez G, Prieto Gonzalez A, Martinez Barba E, Perez Albacete M Squamous carcinoma of the penis. Arch Esp Urol 2000; 53 : 693-699. http:// www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11126970&dopt=Abstract
9. Bissada NK, Yakout HH, Fahmy WE, Gayed MS, Touijer AK, Greene GF, Hanash KA. Multi-institutional long-term experience with conservative surgery for invasive penile carcinoma. J Urol 2003;169 : 500-502. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=12544296&dopt=Abstract
10. Ficarra V, Maffei N, Piacentine I, Al Rabi N, Cerruto MA, Artibani W. Local treatment of penile squamous cell carcinoma. Urol Int 2002; 69 : 169-173. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=12372882&dopt=Abstract
11. Crook J, Grimard L, Tsihlias J, Morash C, Panzarella T. Interstitial brachytherapy for penile cancer: an alternative to amputation. J Urol 2002; 167 : 506-511. http://www.ncbi.nlm.nih.gov/entrez/query. fcgi?cmd=Retrieve&db=PubMed&list_uids=11792907&dopt=Abstract
12. Gotsadze D, Matveev, B, Zak, B, Mamaladze V. Is conservative organ-sparing treatment of penile carcinoma justified? Eur Urol 2000; 38 : 306-312. http:// www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10940705&dopt=Abstract
13. Kiltie AE, Elwell C, Close HJ, Ash DV. Iridium-192 implantation for node-negative carcinoma of the penis: the Cookridge Hospital experience. Clin Oncol 2000; 12 : 25-31. http://www.ncbi.nlm.nih.gov/ entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10749016&dopt=Abstract
14. Mahlmann B, Doehn C, Feyerabend T. [Radiochemotherapy of penis carcinoma.] Urologie A 2001; 40 : 308-312. [German] http://www.ncbi.nlm. nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11490865&dopt=Abstract
15. Rozan H, Albuisson E, Giraud B, Donnarieix D, Delannes M, Pigneux J, Hoffstetter S, Gerbaulet A, Chinet-Charrot P, Goupil A et al. Interstitial brachytherapy for penile carcinoma: a multicentric survey (259 patients). Radiother Oncol 1995; 36 : 83-93. http:// www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7501816&dopt=Abstract
16. Zouhair A, Coucke PA, Jeanneret W, Douglas P, Do HP, Jichlinski P, Mirimanoff RO, Ozsahin M. Radiation therapy alone or combined surgery and radiation therapy in squamous-cell carcinoma of the penis? Eur J Cancer 2001; 37 : 198-203. http://www.ncbi. nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11166146&dopt=Abstract
17. Hatzichristou DG, Apostolidis A, Tzortzis V, Hatzimouratidis K, Ioannides E, Yannakoyorgos K. Glansectomy: an alternative surgical treatment for Buschke-Lowenstein tumors of the penis. Urology 2001; 57 : 966-969. http://www.ncbi.nlm.nih.gov/ entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11337304&dopt=Abstract
18. Davis JW, Schellhammer PF, Schlossberg SM. Conservative surgical therapy for penile and urethral carcinoma. Urology 1999; 53 : 386-392. http://www. ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9933060&dopt=Abstract
19. Mohs FE, Snow SN, Larson PO. Mohs micrographic surgery for penile tumors. Urol Clin North Am 1992; 19 : 291-304. http://www.ncbi.nlm.nih.gov/ entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=1574820&dopt=Abstract
20. Koch MO, Smith JA jr. Local recurrence of squamous cell carcinoma of the penis. Urol Clin North Am 1994; 21 : 739-743. http://www.ncbi.nlm.nih.gov/ entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7974902&dopt=Abstract
21. Hakenberg OW, Wirth MP. Issues in the treatment of penile carcinoma. A short review. Urol Int 1999; 62 : 229-233. http://www.ncbi.nlm.nih.gov/entrez/ query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10567890&dopt=Abstract
22. Saint F, Legeais D, Leroy X, Biserte J, Gosselin B, Mazeman E. [Therapeutic management of epidermoid carcinoma of the penis: anatomoclinical discussion and review of the literature.] Prog Urol 2000; 10 : 128-133. [French] http://www.ncbi.nlm.nih.gov/ entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10785933&dopt=Abstract
23. Horenblas S, Van Tinteren H, Delemarre JFM, Boon TA, Moonen LMF, Lustig V. Squamous cell carcinoma of the penis. II. Treatment of the primary tumor. J Urol 1992; 147 : 1533-1538. http://www.ncbi.nlm. nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=1593683&dopt=Abstract
24. Doehn C, Feyerabend T. Radiochemotherapy of penis carcinoma. Urology 2001; 40 : 313-314. http:// www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11490866&dopt=Abstract
25. Shirahama T, Takemoto M, Nishiyama K, Nobori T, Kawahara M, Ohyama M, Ohi Y. A new treatment for penile conservation in penile carcinoma: a preliminary study of combined laser hyperthermia, radiation and chemotherapy. Br J Urol 1998; 82 : 687-693. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9839584&dopt=Abstract
26. Eisenberger MA. Chemotherapy for carcinoma of the penis and urethra. Urol Clin North Am 1992; 19 : 333-338. http://www.ncbi.nlm.nih.gov/entrez/ query.fcgi?cmd=Retrieve&db=PubMed&list_uids=1374199&dopt=Abstract
27. Kamat MR, Kulkarni JN, Tongaonkar HB. Carcinoma of the penis: the Indian experience. J Surg Oncol 1993; 52 : 50-55. http://www.ncbi.nlm.nih. gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8441263&dopt=Abstract
28. Ornellas AA, Seixas ALC, Marota A, Wisnescky A, Campos F, de Moraes JR. Surgical treatment of invasive squamous cell carcinoma of the penis: retrospective analysis of 350 cases. J Urol 1994; 151 : 1244-1249. http://www.ncbi.nlm.nih.gov/entrez/ query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7512656&dopt=Abstract
29. Horenblas S. Lymphadenectomy for squamous cell carcinoma of the penis. Part 2: the role and technique of lymph node dissection. BJU Int 2001; 88 : 473-483. http://www.ncbi.nlm.nih.gov/entrez/query. fcgi?cmd=Retrieve&db=PubMed&list_uids=11589660&dopt=Abstract
30. Bevan-Thomas R, Slaton JW, Pettaway CA. Contemporary morbidity from lymphadenectomy for penile squamous cell carcinoma: the M.D. Anderson Cancer Center Experience. J Urol 2002; 167 : 1638-1642. http://www.ncbi.nlm.nih.gov/entrez/query. fcgi?cmd=Retrieve&db=PubMed&list_uids=11912379&dopt=Abstract
31. Coblentz TR, Theodorescu D. Morbidity of modified prophylactic inguinal lymphadenectomy for squamous cell carcinoma of the penis. J Urol 2002; 168 : 1386-1389. http://www.ncbi.nlm.nih.gov/entrez/ query.fcgi?cmd=Retrieve&db=PubMed&list_uids=12352399&dopt=Abstract
32. Colberg JW, Andriole GL, Catalona WJ. Long-term follow-up of men undergoing modified inguinal lymphadenectomy for carcinoma of the penis. BJU 1997; 79 : 54-57. http://www.ncbi.nlm.nih.gov/entrez/ query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9043497&dopt=Abstract
33. Jacobellis U. Modified radical inguinal lymphadenectomy for carcinoma of the penis: technique and results. J Urol 2003;169 : 1349-1352. http:// www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=12629358&dopt=Abstract
34. Wilbert DM. [Lymph node metastases in penis carcinoma. Therapeutic options and outcome.] Urologe A 1999; 38 : 332-336. [German] http://www. ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10444790&dopt=Abstract
35. Ficarra V, Martignoni G, Maffei N, Cerruto MA, Novara G, Cavalleri S, Artibani W. Predictive pathological factors of lymph nodes involvement in the squamous cell carcinoma of the penis. Int Urol Nephrol 2002; 34 : 245-250. http://www.ncbi.nlm. nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=12775105&dopt=Abstract
36. Lopes A, Hidalgo GS, Kowallski LP, Torloni H, Rossi BM, Fonseca FP. Prognostic factors in carcinoma of the penis: multivariate analysis of 145 patients treated with amputation and lymphadenectomy. J Urol 1996; 156 : 1637-1642. http://www.ncbi.nlm. nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8863559&dopt=Abstract
37. Slaton JW, Morgenstern N, Levy DA, Santos MW jr, Tamboli P, Ro JY, Ayala AG, Pettaway CA. Tumor stage, vascular invasion and the percentage of poorly differentiated cancer: independent prognosticators for inguinal lymph node metastasis in penile squamous cancer. J Urol 2001;165 : 1138-1142. http://www. ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11257655&dopt=Abstract
38. Solsona E, Iborra I, Rubio J, Casanova JL, Ricós JV, Calabuig C. Prospective validation of the association of local tumor stage and grade as a predictive factor for occult lymph node micrometastasis in patients with penile carcinoma and clinically negative inguinal lymph nodes. J Urol 2001; 165 : 1506-1509. http:// www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11342906&dopt=Abstract
39. Horenblas S, Van Tinteren HV. Squamous cell carcinoma of the penis. IV. Prognostic factors of survival: analysis of tumor, nodes and metastasis classification system. J Urol 1994; 151 : 1239-1243. http:// www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8158767&dopt=Abstract
40. Theodorescu D, Russo P, Zhang ZF, Morash C, Fair WF. Outcomes of initial surveillance of invasive squamous cell carcinoma of the penis and negative nodes. J Urol 1996; 155 : 1626-1631. http://www. ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8627839&dopt=Abstract
41. Lont AP, Horenblas S, Tanis PJ, Gallee MP, van Tinteren H, Nieweg OE. Management of clinically node negative penile carcinoma: improved survival after the introduction of dynamic sentinel node biopsy. J Urol 2003; 170 : 783-786. http://www.ncbi.nlm. nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=12913697&dopt=Abstract
42. Culkin DJ, Beer TM. Advanced penile carcinoma. J Urol 2003; 170 : 359-365. http://www.ncbi.nlm. nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=12853775&dopt=Abstract
43. Lopes A, Bezerra AL, Serrano SV, Hidalgo GS. Iliac nodal metastases from carcinoma of the penis treated surgically. BJU Int 2000; 86 : 690-693. http:// www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11069378&dopt=Abstract
44. Fisher HA, Barada JH, Horton J. Neoadjuvant therapy with cisplatin and 5-fluorouracil for stage III squamous cell carcinoma of the penis. Acta Oncol 1990; 27A-653 (Abstract 352A).
45. Corral DA, Sella A, Pettaway CA, Amato RJ, Jones DM, Ellerhorst J. Combination chemotherapy for metastatic or locally advanced genitourinary squamous cell carcinoma: a phase II study of methotrexate, cisplatin and bleomycin (MPB). J Urol 1998; 160 : 1770-1774. http://www.ncbi.nlm.nih.gov/entrez/ query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9783949&dopt=Abstract
46. Dexeus FH, Logothetis CJ, Sella A, Amato R, Kilbourn R, Fitz K, Striegel A. Combination chemotherapy with methotrexate, bleomycin and cisplatin for advanced squamous cell carcinoma of the male genital tract. J Urol 1991; 146 : 1284-1287. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=1719241&dopt=Abstract
47. Haas GP, Blumenstein BA, Gagliano RG, Russell CA, Rivkin SE, Culkin DJ, Wolf M, Crawford ED. Cisplatin, methotrexate and bleomycin for the treatment of carcinoma of the penis: a Southwest Oncology Group Study. J Urol 1999; 161 : 1823-1825. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10332445&dopt=Abstract
48. Hussein AM, Benedetto P, Sridhar KS. Chemotherapy with cisplatin and 5-fluorouracil for penile and urethral squamous cell carcinomas. Cancer 1990; 65 : 433-438. http://www.ncbi.nlm.nih.gov/ entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=2297633&dopt=Abstract
49. Huang XY, Kubota Y, Nakada T, Sasagawa I, Suzuki H, Ishigooka M. Intra-arterial infusion chemotherapy for penile carcinoma deep inguinal lymph node metastasis. Urol Int 1999; 62 : 245-248. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10567893&dopt=Abstract
50. Otto T, Suhur J, Krege S, Rûbben H. [Die therapie des fortgeschitten peniskarzinoms]. Urologe A 2003; 42 : 1466-1469. [German] http://www.ncbi.nlm. nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=14624345&dopt=Abstract
51. Pizzocaro G, Piva L, Nicolai N. Improved management of nodal metastases of squamous cell carcinoma of the penis. J Urol 1995; 153 : 246 (abstract 69).
52. Gerbaulet A, Lambin P. Radiation therapy of cancer of the penis. Indications, advantages, and pitfalls. Urol Clin North Am 1992; 19 : 325-332. http:// www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=1574823&dopt=Abstract
53. Kulkarni JN, Kamat MR Prophylactic bilateral groin node dissection versus prophylactic radiotherapy and surveillance in patients with N0 and N1-2A carcinoma of the penis. Eur Urol 1994; 26 : 123-128. http:/ /www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7957466&dopt=Abstract
54. Ravi R, Chaturvedt HK, Sastry DV. Role of radiation therapy in the treatment of carcinoma of the penis. Br J Urol 1994; 74 : 646-651. http://www. ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7530129&dopt=Abstract
55. Fair WR, Perez CA, Anderson T. Cancer of the urethra and penis. In: De Vita V, Hellman S, Rosemberg SA (eds). Cancer: Principles and Practice of Oncology. Philadelphia: Lippincott Williams & Wilkins 1989 : 1063-1070.
56. Horenblas S. Neo-adjuvant and adjuvant treatment in penile squamous cell carcinoma. Acta Urol Belg 1996; 64 : 99-101. http://www.ncbi.nlm.nih. gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8701826&dopt=Abstract
57. Pizzocaro G, Piva L. Adjuvant and neoadjuvant vincristine, bleomycin and methotrexate for inguinal metastases from squamous cell carcinoma of the penis. Acta Oncol 1988; 27 : 823-824. http:// www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=2466471&dopt=Abstract
58. Pizzocaro G, Piva L, Nicolai N. Treatment of lymphatic metastasis of squamous cell carcinoma of the penis at the National Tumor Institute of Milan. Arch Ital Urol Androl 1996; 68 : 169-172. http:// www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8767505&dopt=Abstract
59. Levy D'Ancona CA, Botega NJ, De Moraes C, Lavoura NS jr, Santos JK, Rodrigues Netto N jr. Quality of life after partial penectomy for penile carcinoma. Urology 1997; 50 : 593-596. http://www.ncbi.nlm. nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9338738&dopt=Abstract
60. Ficarra V, Righetti R, D'Amico A, Pilloni S, Balzarro M, Schiavone D, Malossini G, Mobilio G. General state of health and psychological well-being in patients after surgery for urological malignant neoplasms. Urol Int 2000; 65 : 130-134. http:// www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11054029&dopt=Abstract
61. Hadzi-Djokic J, Dzamic Z, Tulic C, Dragicevic D, Janicic A, Durutovic O. Surgical treatment and quality of life in patients with carcinoma of the penis. Acta Chir Iugosl 1999; 46(Suppl): 7-10. http://www.ncbi. nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10951769&dopt=Abstract
62. Opjordsmoen S, Fossa SD. Quality of life in patients treated for penile carcinoma. A follow-up study. Br J Urol 1994; 74 : 652-657. http:// www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7827818&dopt=Abstract
63. Hoffman MA, Renshaw AA, Loughlin KR. Squamous cell carcinoma of the penis and microscopic margins: how much margin is needed for local cure? Cancer 1999; 85 : 1565-1568. http://www.ncbi.nlm. nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10193947&dopt=Abstract
64. Agraval A, Pai D, Ananthakrishamn N, Smile SR, Ratnakar C. The histological extent of the local spread of carcinoma of the penis and its therapeutic implications. BJU Int 2000; 85 : 299-301. http:// www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10671885&dopt=Abstract
65. Shammas FV, Ous S, Fossa DS. Cisplatin and 5-fluorouracil in advanced cancer of the penis. J Urol 1992; 147 : 630-632. http://www.ncbi.nlm.nih.gov/ entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=1538445&dopt=Abstract
66. Kattan J, Culine S, Droz JP, Fadel E, Court B, Perrin JL, Wibault P, Haie-Meder C. Penile cancer chemotherapy twelve years' experience at Institut Gustave-Roussy. Urology 1993; 42 : 559-562. http:// www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7694417&dopt=Abstract
67. Roth AD, Berney CR, Rohner S, Allal AS, Morel P, Marti MC, Aapro MS, Alberto P. Intra-arterial chemotherapy in locally advanced or recurrent carcinomas of the penis and anal canal: an active treatment modality with curative potential. Br J Cancer 2000; 83 : 1637-1642. http://www.ncbi.nlm.nih.gov/ entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11104558&dopt=Abstract
6. SLEDOVÁNÍ
Karcinom penisu je jedním z mála solidních tumorů, u něhož může lymfadenektomie zajistit vysoké procento vyléčení, dokonce i při postižení lymfatických uzlin. To souvisí s jeho speciální biologickou povahou, vzhledem k tomu, že se onemocnění vyvíjí postupně. Avšak penektomie a preparace ingvinálních lymfatických uzlin jsou spojeny s významnou morbiditou. Urologové proto čelí dilematu dosažení vhodné rovnováhy mezi snížením morbidity prováděním konzervativních procedur a kontrolou onemocnění. V tomto kontextu je sledování velmi důležité pro dosažení podobného procenta doby přežití jako při časné radikální operaci. Navíc většinou k recidivě dojde během prvních 2 let, mohou se, by vzácně, objevit i pozdní recidivy. Vzhledem k tomu, že je výskyt karcinomu penisu spojen se špatnými socioekonomickými podmínkami, nemůže být vždy prováděno pečlivé sledování.
6.1 Proč provádět sledování?
S ohledem na primární lézi je procento lokální recidivy onemocnění velmi proměnlivé v závislosti na typu prováděné terapie. Při parciální nebo úplné penektomii se pohybuje incidence lokální recidivy mezi 0 a 7 %, při konzervativní terapii se může zvýšit na 50 % [1]. Avšak lokální recidiva nemá negativní vliv na přežití, pokud je stanovena diagnóza časně [2,3].
Stále zůstává kontroverzní, zda má být časná nebo opožděná lymfadenektomie prováděna u pacientů, kteří měli na počátku nehmatné ingvinální lymfatické uzliny. Někteří autoři dosáhli obdobné míry přežití při obou přístupech [1,4]. Avšak program sledování vyžaduje důkladZávěrem lze říci, že potencionální vznik lokální recidivy a metastáz do ingvinálních uzlin u pacientů léčených konzervativně stejně jako možnost vyléčení pacientů po časné detekci recidivy opravňuje potřebu sledování pacientů s karcinomem penisu.
6.2 Jak provádět sledování?
Vzhledem k tomu, že penis a ingvinální uzliny jsou oblasti umístěné zevně, je sledování u pacientů s karcinomem penisu založeno na prohlídce a fyzikálním vyšetření. U pacientů s počátečně hmatnými ingvinálními uzlinami se spolehlivost fyzikálního vyšetření ve srovnání s patologickým vyšetřením pohybuje mezi 47–86 % [5,6]. U pacientů s uzlinami na počátku nehmatnými znamená vznik hmatných uzlin během sledování 100% výskyt metastáz.
CT-scan a RTG hrudníku lze užít jako další testy pro identifikaci pánevních lymfatických uzlin nebo vzdálených metastáz, zejména v kategoriích N2 nebo více, vzhledem k tomu, že se tumor šíří hlavně v těchto oblastech. U symptomatických pacientů by měly být provedeny další vhodné diagnostické testy.
6.3 Kdy provádět sledování?
Interval a strategie sledování u pacientů s karcinomem penisu přímo souvisí s počáteční léčbou primární léze a regionálních lymfatických uzlin.
6.3.1 Primární tumor
Pokud byla primární léze léčena konzervativní terapií (lokální resekce, laserová terapie, Mohsova procedura, související terapie) doporučuje se interval sledování 2 měsíce po dobu 2 let a potom každé 3 měsíce po další rok, nebo k největšímu počtu lokálních recidiv dojde v tomto období. Také se doporučuje dlouhodobé sledování každých 6 měsíců vzhledem k tomu, že byl pozorován výskyt pozdních lokálních recidiv [7]. Doporučuje se také vlastní vyšetření prováděné pacienty, přitom by pacienti měli být informováni o možných varovných znameních. Doporučujeme tento plán sledování vzhledem k vysokému procentu recidivy onemocnění, nebo sledování zvyšuje možnost zlepšení péče.
U pacientů léčených parciální nebo úplnou penektomií se doporučuje provádět sledování každé 4 měsíce po dobu 2 let, poté v 6měsíčních intervalech po dobu 1 roku a následně 1krát za rok. Pro posledně zmiňované období nejsou k dispozici žádné údaje pro určení specifického intervalu. Tento rozvrh se doporučuje, protože lokální recidiva onemocnění, by vzácná, se obvykle objevuje velmi časně a vzhledem k tomu, že časná diagnóza je nezbytná kvůli agresivnímu chování tumoru [8].
6.3.2 Regionální oblasti
Pokud byl program sledování započat po odstranění primárního tumoru, doporučuje se provádět vyšetření třísel každé 2 měsíce po dobu 2 let, poté každé 3 měsíce během následujícího roku a pak každých 6 měsíců po dobu dalších 2 let [9,10]. Není nezbytné provádět CT-scan nebo RTG hrudníku. Tento režim vychází z faktu, že většina recidiv ingvinálních lymfatických uzlin je detekována během prvních 2 let. Nadto, pokud dojde k recidivě, je její růst velmi rychlý a prognóza závisí na počtu, velikosti a bilaterálnosti lymfatických uzlin [11,12]. Doporučuje se velmi důkladné sledování.
Pokud byla provedena ingvinální lymfadenektomie a při patologickém vyšetření vzorku nebyl zjištěn žádný tumor, doporučuje se provádět fyzikální vyšetření každé 4 měsíce po dobu 2 let a potom každých 6 měsíců po další rok. Následně již není úplně nezbytné provádět sledování. V těchto případech je lokální nebo vzdálená recidiva vzácná, pokud byla provedena radikální procedura a rozsáhlé patologické vyšetření.
Sledování se zaměřuje především na kvalitu života těchto pacientů, vzhledem k tomu, že ingvinální lymfadenektomie má vysoké procento morbidity.
Pokud byla provedena ingvinální lymfadenektomie a při patologickém vyšetření byly pozorovány pozitivní lymfatické uzliny, nelze doporučit specifické sledování, vzhledem k mnoha proměnným, které zahrnují:
- počet pozitivních lymfatických uzlin (uni - nebo bilaterální)
- zda byla provedena pánevní lymfadenektomie s, nebo bez pozitivních lymfatických uzlin
- druh provedené adjuvantní terapie a užitého schématu.
V závislosti na těchto proměnných by měla každá instituce stanovit fyzikální vyšetření, CT-scan, RTG hrudníku a vhodné intervaly mezi nimi.
Kostní scan a další testy se doporučují pouze u symptomatických pacientů. Hodnocení kvality života by mělo zahrnovat sexuální aktivitu a morbiditu spojenou s lymfadenektomií (lymfedém). Schéma pro sledování je uvedeno v tab. 8.
Tab. 8. Schéma sledování u karcinomu penisu. 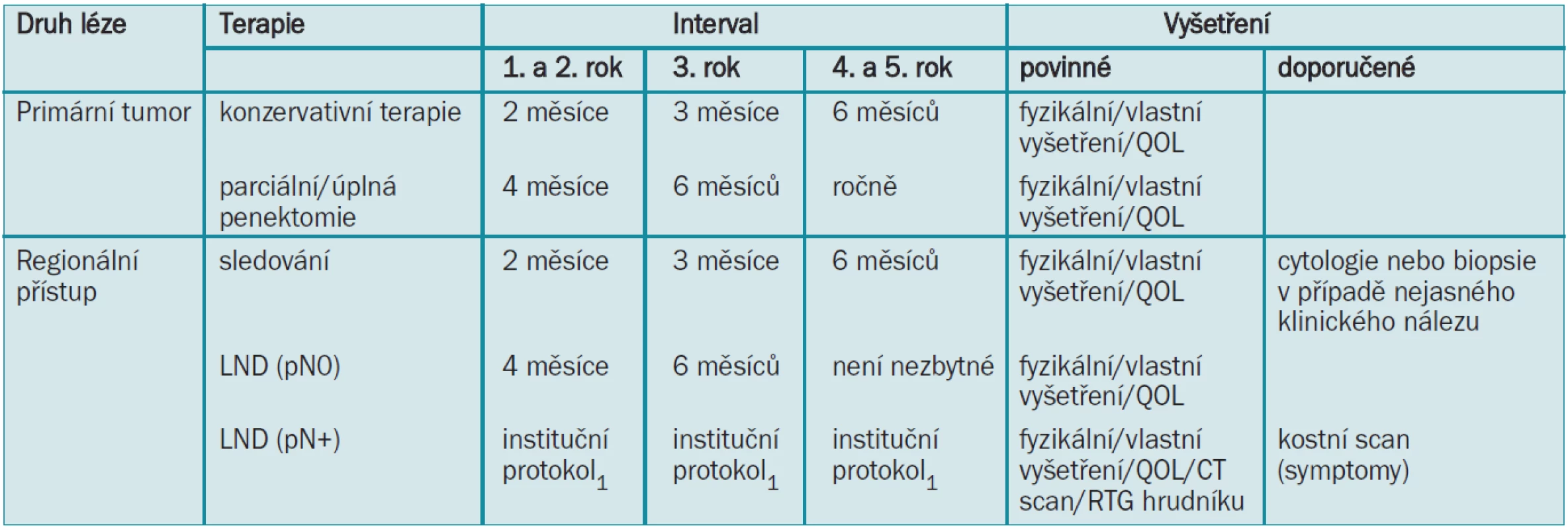
6.4 Guidelines pro sledování při karcinomu penisu
Primární tumor
- Pacienti léčeni konzervativní terapií: sledování každé 2 měsíce po dobu 2 let, poté každé 3 měsíce po 1 rok, dlouhodobé sledování se doporučuje každých 6 měsíců. Mělo by být prováděno fyzikální a vlastní vyšetření (stupeň C)
- Pacienti léčeni parciální nebo úplnou penektomií: sledování každé 4 měsíce po dobu 2 let, 2krát během 3. roku a poté každý rok (stupeň C)
Regionální lymfatické uzliny a vzdálené metastázy
- Pokud byl program sledování určen po odstranění primárního tumoru, doporučuje se vyšetření genitálu každé 2 měsíce po 2 roky, pak každé 3 měsíce po další rok, a každých 6 měsíců po další 2 roky (stupeň C)
- Pokud byla provedena ingvinální lymfadenektomie (pN0) doporučuje se fyzikální vyšetření provádět každé 4 měsíce po 2 roky, pak každé 3 měsíce po další rok. Poté již není povinné provádět sledování (stupeň C)
- Pokud byla provedena ingvinální lymfadenektomie (pN1-3) nelze doporučit specifické sledování. Fyzikální vyšetření, CT-scan, RTG hrudníku a vhodné intervaly mezi nimi by měly být stanoveny jednotlivými institucemi (stupeň C)
- Kostní scan a další testy se doporučují pouze u symptomatických pacientů (stupeň B)
6.5 Literatura
1. Mobilio G, Ficarra V. Genital treatment of penile carcinoma. Curr Opin Urol 2001; 11 : 299-304. http:// www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11371784&dopt=Abstract
2. Gotsadze D, Matveev B, Zak B, Mamaladze V. Is conservative organ-sparing treatment of penile carcinoma justified? Eur Urol 2000; 38 : 306-312. http:// www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10940705&dopt=Abstract
3. Koch MO, Smith JA jr. Local recurrence of squamous cell carcinoma of the penis. Urol Clin North Am 1994; 21 : 739-743. http://www.ncbi.nlm.nih.gov/ entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7974902&dopt=Abstract
4. Wilbert DM. [Lymph node metastases in penis carcinoma Therapeutic options and outcome.] Urologe A 1999; 38 : 332-336. [German] http://www.ncbi.nlm. nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10444790&dopt=Abstract
5. Horenblas S, van Tinteren H, Delamarre JFM, Moonen LM, Lustig V, van Waardenburg EW. Squamous cell carcinoma of the penis. III. Treatment of regional lymph nodes. J Urol 1993; 149 : 492-497. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8437253&dopt=Abstract
6. Solsona E, Iborra I, Ricós JV, Monros JL, Dumont R, Casanova J, Calabuig C. Corpus cavernosum invasion and tumor grade in the prediction of lymph node condition in penile carcinoma. Eur Urol 1992; 22 : 115-118. http://www.ncbi.nlm.nih.gov/entrez/query.f cgi?cmd=Retrieve&db=PubMed&list_uids=1478225&dopt=Abstract
7. Horenblas S, Newling DW. Local recurrence tumour after penis-conserving therapy. A plea for long-term follow-up. Br J Urol 1993; 72 : 976-979. http:// www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8306171&dopt=Abstract
8. Lerner SE, Jones JG, Fleischmann J. Management of recurrent penile cancer following partial or total penectomy. Urol Clin North Am 1994; 21 : 729-737. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7974901&dopt=Abstract
9. Coblentz TR, Theodorescu D. Morbidity of modified prophylactic inguinal lymphadenectomy for squamous cell carcinoma of the penis. J Urol 2002; 168 : 1386-1389. http://www.ncbi.nlm.nih.gov/entrez/ query.fcgi?cmd=Retrieve&db=PubMed&list_uids=12352399&dopt=Abstract
10. Horenblas S. Lymphadenectomy for squamous cell carcinoma of the penis. Part 2: the role and technique of lymph node dissection. BJU Int 2001; 88 : 473-483. http://www.ncbi.nlm.nih.gov/entrez/query. fcgi?cmd=Retrieve&db=PubMed&list_uids=11589660&dopt=Abstract
11. Horenblas S, Van Tinteren HV. Squamous cell carcinoma of the penis. IV. Prognostic factors of survival: analysis of tumor, nodes and metastasis classification system. J Urol 1994; 151 : 1239-1243. http:// www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8158767&dopt=Abstract
12. Srinivas V, Morse M, Herr E, Sogani P, Whitmore W jr. Penile cancer: relation of extent of nodal metastasis to survival. J Urol 1987; 137 : 880-882. http:// www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=3573181&dopt=Abstract
7. ZKRATKY UŽITÉ V TEXTU
CT počítačová tomografie
HPV lidský papilomavirus
MRI ‑zobrazovací vyšetření magnetickou rezonancí
Nd-YAG ‑Neodynium:Yttrium-Aluminum-Garnet
PET pozitronová emisní tomografie
SCC ‑karcinom ze skvamózních buněk
TNM ‑Tumour Node Metastasis (tumor, uzlina, metastáza)
5-FU 5-fluorouracil
Štítky
Detská urológia Urológia
Článek ROZHOVOR S PROFESOREM PATRICKEM C. WALSHEM O JEHO POHLEDU NA RETROPUBICKOU RADIKÁLNÍ PROSTATEKTOMIIČlánek LYMFATICKÁ DRENÁŽ PENISUČlánek ZE ZAHRANIČNÍCH PERIODIKČlánek GENITÁLNÍ LYMFEDÉM U MUŽŮČlánek RECENZEČlánek KVÍZ
Článok vyšiel v časopiseUrologické listy
Najčítanejšie tento týždeň
2005 Číslo 4- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- PROBLEMATIKA UZLINOVÉHO POSTIŽENÍ U KARCINOMU PENISU
- CHIRURGICKÁ LÉČBA KARCINOMU PENISU LOKALIZOVANÉHO NA ORGÁN
- CHEMOTERAPIE KARCINOMU PENISU
- BRACHYTERAPIE V LÉČBĚ KARCINOMU PENISU
- GENITÁLNÍ LYMFEDÉM U MUŽŮ
- SOUČASNÉ INFORMACE O PROBLEMATICE KARCINOMU PROSTATY
- ROZHOVOR S PROFESOREM PATRICKEM C. WALSHEM O JEHO POHLEDU NA RETROPUBICKOU RADIKÁLNÍ PROSTATEKTOMII
- CO NA PUBLIKOVANÉ ČLÁNKY ŘÍKÁ PROFESOR PATRICK C. WALSH?
- LYMFATICKÁ DRENÁŽ PENISU
- ZE ZAHRANIČNÍCH PERIODIK
- GUIDELINES EAU PRO DIAGNOSTIKU A LÉČBU KARCINOMU PENISU
- RECENZE
- KVÍZ
- Urologické listy
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- GENITÁLNÍ LYMFEDÉM U MUŽŮ
- LYMFATICKÁ DRENÁŽ PENISU
- PROBLEMATIKA UZLINOVÉHO POSTIŽENÍ U KARCINOMU PENISU
- CHIRURGICKÁ LÉČBA KARCINOMU PENISU LOKALIZOVANÉHO NA ORGÁN
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy