-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Dihydrotestosteron a inhibitory steroidní 5α-reduktázy
Dihydrotestosterone and inhibitors of steroid 5α-REDUCTASE
In most mammalians, dihydrotestosterone (DHT) is a product of reduction of testosterone by steroid 5α-reductase (5α-RD). It plays a crucial role in the process of sexual differentiation of external genitalia in man. An example of its insufficient production due the 5α-dehydrogenase deficit is the Imperato - McGinley syndrome, in which mutations in type 2 isoenzyme of 5α-reductase cause male pseudohermaphroditism. The affected 46XY individuals have normal to elevated plasma testosterone levels with decreased DHT levels. They have ambiguous external genitalia at birth so that they are believed to be girls and are often raised as such. However, Wolffian differentiation occurs normally and they have epididymides, vas deferens and seminal vesicles. Virilization occurs at puberty frequently due to high testosterone levels, often associated with gender role change. The prostate in adulthood is small and rudimentary, and facial and body hair is absent or decreased. Balding has not been reported. Partial deficiency of 5α-reductase presents with micropenis, which can be corrected by dihydrotestosterone treatment in case of relative deficit of DHT. In normal individuals higher local concentrations of DHT play a key role in benign prostate hyperplasia or prostate carcinoma, but also in the development of male body hair. Administration of type 2 5α-reductase inhibitor, finasteride, has shown effective in the treatment of prostate hyperplasia and of androgenetic alopecia or hirsutism. Until now the physiological effects of DHT on chondrocytes during long-bone growth plate closure, spermatogenesis, especially on the maturation of spermatozoa in epididymis, on sexual brain differentiation and its action as a neuroactive steroid or the association of its higher levels with homosexuality has not been explained in detail and deserves further studies.
Key words:
dihydrotestosteronesteroid 5α-reductase, Imperato-McGinley syndrome, sexual differentiation, micropenis, alopecia, prostate
Autoři: prof. MUDr. RNDr. Luboslav Stárka, DrSc.
Působiště autorů: Endokrinologický ústav
Vyšlo v časopise: Urol List 2007; 5(3): 11-16
Souhrn
Dihydrotestosteron (DHT) vzniká u většiny savců redukcí testosteronu působením steroidní 5α-reduktázy (5α-RD). U člověka má nezastupitelnou úlohu v procesu sexuální diferenciace zevního genitálu. Příkladem jeho nedostatečné tvorby v důsledku deficitu steroidní 5α-dehydrogenázy je syndrom Imperato-McGinleyové, u kterého mutace genu pro izoenzym 5α-RD typu 2 vedou k mužskému pseudohermafroditizmu. Postižení jedinci 46,XY se vyznačují normální až zvýšenou koncentrací plazmatického testosteronu a sníženým DHT. Při narození mají obojetný zevní genitál, takže jsou většinou vychováváni jako dívky. Diferenciace Wolffova vývodu však proběhla normálně, a proto mají epididymis, vas deferens a semenné váčky. V pubertě probíhá pod vlivem dostatečně vysokých hladin testosteronu virilizace, často se změnou pohlavní úlohy. Prostata je v dospělosti malá a rudimentární, faciální a tělesné ochlupení není přítomno nebo je sporé, plešatění nebylo zaznamenáno. Projevem částečného deficitu jsou i některé formy mikropenisu, které lze v případě relativního nedostatku DHT korigovat podáním tohoto hormonu. U normálních dospělých osob jsou vyšší lokální koncentrace DHT spojovány s rozvojem benigní hyperplazie prostaty nebo karcinomu prostaty a také s mužským typem tělesného ochlupení. Pro léčbu hyperplazie prostaty a pro léčbu androgenní alopecie nebo hirzutizmu se osvědčilo podávání inhibitoru 5α-RD 2. typu, finasteridu. Zatím není zcela jasná fyziologická úloha DHT při procesech, jako je jeho působení na chondrocyty v průběhu uzavírání růstové ploténky dlouhých kostí, při působení na spermatogenezi, zvláště pak na zrání spermií v epididymis, na sexuální diferenciaci mozku, působení jako neurosteroidu nebo asociace jeho vyšších koncentrací v oběhu s homosexualitou.
Klíčová slova:
steroidní 5α-reduktáza, syndrom Imperato-McGinleyové, sexuální diferenciace, mikropenis, alopecieÚVOD
Na dihydrotestosteron (DHT, 17b-hydroxy-5α-androstan-3-on) upozornil poprvé Dorfman et al (1939) jako na mezistupeň metabolizmu testosteronu na tehdy právě izolované močové C19 steroidy. Je uváděn [1] pod názvem etioallocholanolon ve schématu znázorňujícím degradaci testosteronu na málo aktivní metabolity, což odpovídá tehdejšímu způsobu uvažování. Jeho androgenně-anabolická aktivita testovaná na m. levator ani byla uváděna jako zhruba poloviční ve srovnání s účinností testosteronu. V testu na m. levator se však uplatňuje i anabolická účinnost, kterou však DHT postrádá [2]. Jinými bioesejemi bylo později zjištěno, že DHT má přibližně 5krát vyšší afinitu k androgennímu receptoru než testosteron, vlastní androgenní účinnost proti testosteronu v cílových tkáních bývá udávána asi jako 2násobná až 3násobná. DHT představuje tedy ze všech endogenních steroidů hormon s nejvyšší androgenní účinností.
DHT byl poměrně dlouho považován za nevýznamný degradační produkt. Pak bylo odhalena jeho významná úloha pro funkci a růst prostaty a navíc bylo zjištěno, že je vázán na androgenní receptory s vyšší afinitou než testosteron [3,4]. Tím se otevřela cesta k intenzivnějšímu studiu fyziologické úlohy DHT.
DHT v organizmu placentárních savců vzniká ireverzibilní redukcí testosteronu za katalytického působení enzymu steroidní 5α-reduktázy (5α-RD), která je známa ve 2 izoformách: typu 1 a 2. 5α-RD-2 je kódována genem SRD5A2 na chromozomu 2p23 [5]. Gen SRD5A2 se skládá z 5 exonů a je exprimován v DHT-dependentních genitálních tkáních a také v jiných tkáních včetně jater.
Je známa i cesta biosyntézy vycházející z 5α-androstan-3β,17β-diolu. Oxidací jeho hydroxylové skupiny v poloze 3 na keton vzniká DHT. Tato cesta zřejmě představuje hlavní způsob tvorby DHT u vačnatců. Podávání androstandiolu samičím plodům v průběhu jejich vývoje ve vaku vede k nápadné virilizaci urogenitálního sinu a zevního genitálu, zřejmě po konverzi na DHT.
Během embryonálního vývoje působí DHT prostřednictvím znásobení signálů, které mohou být jinak vyvolány testosteronem až v mnohem vyšších koncentracích [6,7]. I v postembryonálním životě hraje DHT některé jedinečné role, jejichž dosah dosud není zcela jasný. Dnes víme, že DHT zastává významnou úlohu v prenatální diferenciaci zevního genitálu, při nastavení sexuálního dimorfizmu některých mozkových funkcí, působí jako hlavní androgen v účinku na prostatu, na kožní adnexa - vlasový folikul a mazové žlázky - a ve zrání spermatozoí v epididymis. Doložená, i když zatím méně známá, je úloha DHT pro zrání folikulů v ovariu a působení na chondroblasty v růstových ploténkách dlouhých kostí u samců.
HLADINY DHT U ČLOVĚKA
Koncentrace DHT v séru mužů je přibližně o řád nižší než koncentrace celkového testosteronu, jak vyplývá z tab. 1. Metody stanovení využívají oddělení DHT od blízkých C19 steroidů pomocí plynové nebo kapalinové chromatografie (např. [8]) nebo přímé imunoeseje po destrukci testosteronu (který nejvíce reaguje zkříženou reakcí s DHT) a dalších 3-oxo-4-en steroidů oxidací manganistanem, která ponechává intaktní DHT [9].
Tab. 1. Referenční rozmezí koncentrací DHT a celkového testosteronu (t-testosteron) v séru (podle l. c. [9,10]). ![Referenční rozmezí koncentrací DHT a celkového testosteronu (t-testosteron) v séru (podle l. c. [9,10]).](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/95ff2a9be1ca1389f324cd9268b58f51.png)
SYNDROM NEDOSTATEČNOSTI STEROIDNÍ 5α-RD
Imperato-McGinleyová [11] v roce 1974 poprvé popsala syndrom porušené sexuální diferenciace, jehož příčinou je nedostatečnost steroidní 5α-RD. Syndrom představuje přírodou vytvořený model, z kterého lze odvodit hlavní fyziologické účinky DHT. Nejvýznamnější úlohu plní DHT v průběhu intrauterinního vývoje plodu, protože je řídícím hormonem pro sestup varlat a vývoj zevního genitálu u samců. Jeho postpartální úloha se pak soustřeïuje na méně významné a snad i testosteronem zastupitelné funkce v prostatě a v kožních adnexech.
Fenotyp jedinců postižených nedostatečností steroidní 5α-RD je dán zásahem do sexuální diferenciace. Chlapci s karyotypem 46,XY mají zvýšený nebo normální testosteron, snížené hladiny DHT a vyšší poměr testosteron/DHT. Při narození mají obojetný nebo ženský genitál a jsou často vychováváni jako dívky. Fenotypické spektrum těchto pacientů je široké, od téměř zcela ženského zevního genitálu až k téměř normálnímu mužskému zevnímu pohlavnímu ústrojí [12]. Diferenciace Wolffova vývodu probíhá na rozdíl od vnějšího genitálu normálně, a proto mají tito chlapci epididymis, vas deferens a semenné váčky. V pubertě, při stoupající sekreci testosteronu, probíhá virilizace provázená většinou změnou pohlavní role na mužskou. V dospělosti je prostata rudimentární, faciální a tělesné ochlupení chybí nebo je sporé, nedochází k plešatění, vlasová frontotemporální hranice kštice neustupuje s věkem. Heterosexuální život s mužskou úlohou je normální, objem ejakulátu je malý, ale spermatogeneze probíhá téměř normálně (jsou-li varlata sestouplá), k výraznějším rozdílům vlastností spermatozoí ve srovnání se spermatozoi normálních jedinců dochází až během jejich dozrávání v nadvarleti. Muži jsou někdy normospermičtí, jindy je přítomna oligozoospermie nebo azoospermie [13], ale i u těchto poruch lze docílit otcovství pomocí asistované reprodukce [14]. Porucha je způsobena mutacemi genu pro 5α-RD, kterých zatím bylo prokázáno 31 [15].
Diagnóza v raném dětství [16] se opírá o laboratorní vyšetření. Zvýšení poměru koncentrace kolujícího testosteronu k DHT je patrné jen u některých postižených jedinců, ale zvýšení tohoto poměru po hCG je zřejmé u všech. Protože poměr 5α/5β C19-steroidům v tomto věku se pro jejich malou koncentraci špatně měří, diagnóza nedostatečnosti 5α-RD v raném věku se opírá o zvýšený poměr močového 5β-tetrahydrokortizolu k 5α-tetrahydrokortizolu.
Syndromem nedostatečnosti 5α-RD mohou být postiženy i dívky [17]. Ty se pak rodí bez nápadnějších změn, menarché je opožděna, ale menstruační cyklus má ovulační vrcholy a fertilita je neporušena. Tělesné ochlupení je oslabeno, dívky nemají akné. Poměr močových 5β/5α C19 a C21 steroidních metabolitů je zvýšen, plazmatický testosteron je normální až zvýšený, DHT je nízký, poměr testosteron/DHT je zvýšen a 5α-androstan-3α,17β-diol glukuronid je nízký. Projevy nedostatečnosti 5α-RD u dívek jsou tedy diskrétní a porucha se většinou zjistí jen při cíleném vyšetření ženských příslušníků rodin s familiárním postižením syndromem Imperato-McGinleyové u chlapců.
VLIV DHT NA SEXUÁLNÍ DIFERENCIACI
5α-RD typu 2 tím, že konvertuje testosteron na 5α-dihydrotestosteron (DHT) v periferních cílových tkáních, hraje klíčovou roli v mužské sexuální diferenciaci. Je známo, že maskulinizace Wolffových vývodů je primárně vyvolávána testosteronem, zatímco zevní genitál, uretra a prostata je primárně maskulinizována pod vlivem DHT. Proto deficit 5α-RD-2 nebrání vývoji Wolffových vývodů, ale vede k různým stupňům mužského pseudohermafroditizmu s nedostatečnou maskulinizací zevního genitálu podle stupně zbytkové enzymové aktivity 5α-RD-2 a aktivity 5α-RD-1 [6].
Pro fyziologickou maskulinizaci plodu je rozhodující období mezi 65.–75. dnem života. Schopnost konvertovat testosteron na DHT byla prokázána již v 6. týdnu intrauterinního života v primordiu ještě neutrálního zevního genitálu a v kůži plodu v 7. týdnu [18].
DHT pak hraje důležitou roli pro sestup varlat i pro normální vývoj zevního genitálu. Dokonce i v dětském věku lze podáním DHT nebo syntetických steroidů s 5a-androstanovou konformací docílit výrazného zlepšení u nedostatečně vyvinutého penisu, to znamená, že je možno DHT korigovat některé formy mikropenisu. Nedostatečný průběh růstu penisu může mít různé příčiny, některé formy jsou důsledkem mutace genu pro steroidní 5a-RD 2. typu (SRD5A2 gen). Sasaki et al [19] zjistili, že u mutace R227Q, byla aktivita reduktázy rovnající se jen 3,2 % aktivity normálního enzymu, zatímco u mutace V89L je snížení aktivity reduktázy jen asi 30 %.
Významná je i role DHT při pohlavím podmíněné diferenciaci mozku [20,33]. V této souvislosti je třeba upozornit i na ojedinělý nález významně vyšších hladin DHT u homosexuálů ve srovnání s heterosexuály [21].
VLIV DHT NA REPRODUKČNÍ FUNKCE
Stručným závěrem mnoha studií o hormonálním řízení spermatogeneze [22] je, že FSH hraje klíčovou roli pro přechod spermatogonií A na spermatogonie B a synergicky s testosteronem v regulaci schopnosti dalšího vývoje zárodečných buněk. Testosteron je absolutním požadavkem pro spermatogenezi. Je promotorem adheze okrouhlých spermatid k Sertoliho buňkám. Chybí-li, jsou odlučovány od epitelu kanálků a vázne prodlužování spermatid. Spermiace - uvolňování elongovaných spermatid - je řízena FSH a testosteronem. Údaje získané při studiu steroidních kontraceptiv u opic a lidí ukazují, že narušení spermiace je klíčovým stupněm účinku kontraceptiv k dosažení azoospermie.
Mužská fertilita při nedostatečné aktivitě 5α-RD je zřetelně zhoršena, ale nikoli zcela vyloučena, a to zřejmě díky zbytkové aktivitě 5α-RD-2 a aktivitě 5α-RD-1. Nedostatečnost 5α-RD se příliš neprojevuje v procesu zrání zárodečných buněk v semenotvorných kanálcích, protože intratestikulární hladiny 5α-dihydrotestosteronu (DHT) představují jen asi 2 % hladin testosteronu, a proto není DHT u normálních mužů tolik rozhodující pro spermatogenezi, přestože jeho afinita pro androgenní receptory je vyšší než u testosteronu [23].
U syndromu Imperato-McGinleyové byla vedle oligozoospermie nebo azoospermie pozorována u 2 pacientů i normospermie [13]. To by mohlo být důsledkem dostatečné produkce DHT působením 5α-RD-1 nebo zbytkovou aktivitou 5α-RD-2. Vzorky semene mužů s nedostatečností 5α-RD jsou charakteristické až extrémně nízkým objemem (rozmezí < 0,05 až 1,0 ml), zvýšenou viskozitou a chabou schopností likvefakce. Semeno může mít normální koncentraci spermií a normální motilitu a morfologii, nebo je přítomna oligozoospermie nebo azoospermie. Ale i u porušené spermatogeneze u mužů s deficitem 5α-RD je paternita možná pomocí intrauterinní inseminace [14].
Ani studie na zvířatech s použitím inhibitorů 5α-RD nedávají jednoznačné poznatky o úloze DHT v spermatogenezi. Podávání finasteridu potkanům po dobu 56 dní indukovalo odlučování nezralých zárodečných buněk (spermatid a řidčeji i pachytenních spermatocytů) do lumina semenotvorných kanálků [24] a byl u nich pozorován snížený počet spermatozoí v lumen epididymis. Důležitost aktivity 5α-RD-2 je pro zachování spermatogeneze a zejména zrání spermií v nadvarleti dosvědčují studie s duálními inhibitory 5α-RD. PNU157706 vyvolával signifikantní pokles v podílu progresivně motilních morfologicky normálních spermatozoí v cauda epididymis [25]. Po páření samic se samci, jimž byl podán inhibitor, došlo k menšímu počtu úspěšných gravidit a k vyššímu procentu preimplantačních ztrát [26]. O duálních inhibitorech 5α-RD lze uvažovat jako o potenciální složce mužských kontraceptiv v budoucnosti.
VLIV DHT NA DALŠÍ ORGÁNYA FUNKCE
Prostata
Androgeny prostřednictvím androgenního receptoru regulují expresi mnoha genů, které v prostatické tkáni ovlivňují zejména diferenciaci a proliferaci buněk, regulaci buněčného cyklu a buněčnou smrt apoptózu. Zejména výrazně působí na růstové faktory [27]. U normální prostaty je působení produktů těchto genů v rovnováze, u nádorového bujení převládá proliferace nad apoptózou. Hlavní roli hrají androgeny testosteron a DHT, přesnější vymezení jejich úlohy však není zcela jasné.
Prostata mužů s nedostatečností 5α-RD je v dospělosti atrofická, přestože tito jedinci mají zásobení testosteronem v normálním rozmezí, nebo jsou hladiny testosteronu dokonce nadprůměrné. Normální koncentrace DHT v tkáni prostaty je přibližně 5–10krát vyšší než koncentrace testosteronu [28]. Koncentrace DHT je nižší u karcinomu prostaty než u benigní hyperplazie. Proti hyperplazii se v neoplastické tkáni posouvá poměr obou izoforem 5α-RD směrem k 5α-RD 1 [29,30]. Muži s karcinomem prostaty jsou často geneticky predisponováni k vyšším aktivitám 5α-RD a tím k vyššímu obratu testosteronu na DHT, než je tomu u běžné populace [31].
Byla vyslovena hypotéza [32], že pro iniciaci neoplastického procesu v prostatě tvorbou telomer je nezbytný estradiol a že testosteron zvyšuje expresi proteinů, které podporují apoptózu; DHT by měl podle uvedené domněnky naopak tyto děje usměrňovat tak, že apoptóza bude omezována.
Pilosebaceální jednotka
Androgeny vstupují do řízení růstu vlasu po celém těle. Nepůsobí-li androgeny, nedochází k plešatění kštice a tělesné ochlupení chybí. To lze demonstrovat klinicky na kastrátech a zejména nápadně na obrazu testikulární feminizace, která představuje stav úplné necitlivosti na androgeny v důsledku mutace genu pro androgenní receptor.
Normálně se v dospívání pod vlivem androgenů mění vlas na predisponovaných místech (axily a pubické ochlupení) na terminální vlas u obou pohlaví a u mužů i na tváři, hrudi a končetinách. Je tomu tak i u žen vystavených nadměrným hladinám androgenů: U nich se pak objevuje hirzutizmus. Zvýšená aktivita androgenů u geneticky predisponovaných osob vede naopak k miniaturizaci folikulů v definovaných oblastech kůže hlavy a k výpadu vlasu kštice a plešatění. Proč ochlupení v různých tělesných lokalitách reaguje na androgeny odlišně, není dosud zcela jasno. Jako příčina se uvádí rozdílná úroveň receptorů pro androgeny, zvýšená produkce vysoce účinných androgenů, snížené metabolické degradace androgenů, ale také další faktory.
Pozornosti se dostalo tvorbě účinných metabolitů testosteronu, a to zejména DHT, jehož lokální distribuce je rozdílná v důsledku odlišné lokalizace obou 5α-RD. Oba typy reduktázy najdeme v játrech, která jsou zdrojem většiny kolujícího DHT. Typ 1 převažuje v sebaceálních žlázkách a typ 2 v močových cestách a pohlavním ústrojí, ve vlasových folikulech [34] a snad také v dermální papile [35].
Pro potvrzení úlohy DHT pro růst vlasu je opět názorným modelem syndrom Imperato-McGinleyové. Homozygotní pacienti mají řídké vousy a sporé tělesné ochlupení, nedochází u nich ve vyšším věku k růstu prostaty a k plešatění.
O úloze 5α-RD 1. typu pro růst vlasu nevíme mnoho, ale její úroveň je vysoká v sebaceálních žlázkách, zejména v oblastech náchylných k akné.
Syndrom polyycystických ovarií (PCOS)
V ovariální véně žen se syndromem polycystických ovarií byly ve srovnání s kontrolním souborem zdravých žen zjištěny vyšší hladiny androgenů včetně DHT [36]. DHT zřejmě hraje úlohu při zrání folikulů a podle jedné z hypotéz o patogenezi PCOS je významným faktorem pro vznik onemocnění vyšší aktivita 5α-RD v ovariu [37]. Podle Katze et al [17] DHT nebo poměr DHT/estradiol řídí vývoj folikulů - při nízkých hodnotách je umožněn vývoj více než 1 dominantního folikulu během cyklu a vyšší hladiny DHT brzdí vývoj folikulů a ovulaci.
Neurosteroidy
Působení transmiterů na GABA a NAMD receptory v nejrůznějších mozkových centrech je významně modulována neurosteroidy, které jsou většinou 5a - nebo 5b-redukovanými metabolity progesteronu, deoxykortikosteronu nebo androstendionu, ke kterým patří i DHT. Působí antikonvulzivně, antidepresivně a anxiolyticky a mění některé aspekty sexuálního chování a chování pod vlivem návykových látek. Přispívají tedy k řízení našeho chování, ovlivňují depresivitu, úzkostlivost, odpověï na různé stresové podněty, paměové procesy a další podobné mozkové aktivity [38]. Nakolik je postižena tvorba neuroaktivních steroidů a následně jimi ovlivňované funkce u osob s nedostatečností 5a-RD, eventuálně u osob léčených intenzivně inhibitory reduktáz nebo naopak u těch osob, které mají zvýšenou aktivitu steroidních reduktázy, nebylo dosud zkoumáno. Některé zprávy naznačují, že by blokáda 5a-RD mohla navozovat depresivní stavy [52] nebo symptomy premenstruální dysforey, katameniální epilepsie a zhoršovat abstinenční příznaky u alkoholiků.
Kost
Po srovnáním kostní denzity mužů s nedostatečností 5α-RD-2 a osob s úplnou necitlivostí na androgeny bylo možno konstatovat [39], že na rozdíl od jedinců s necitlivostí na androgeny mají muži s chybějící aktivitou 5α-RD-2 normální hodnoty kostní denzity. Androgeny jsou tedy důležité pro nastavení a udržení kostní denzity a chybění nebo jen velmi nízká hladina DHT není překážkou v zachování dobrého stavu kostního metabolizmu. Jiná je však situace při růstu kosti. Při sledování procesů v růstové ploténce dlouhých kostí samců potkana bylo zjištěno, že testosteron snižuje syntézu DNA v buňkách klidové zóny, ale DHT že na ně nemá žádný vliv. Inhibice reduktázy finasteridem snižovala odpověï samčích buněk růstové zóny na testosteron úměrně dávce inhibitoru, takže lze odvodit, že DHT je potřebný pro odpověï chondrocytů růstové zóny na testosteron. Efekt DHT na samčí růstovou ploténku závisí také na stupni dospívání zvířete [40].
INHIBITORY STEROIDNÍ 5α-RD
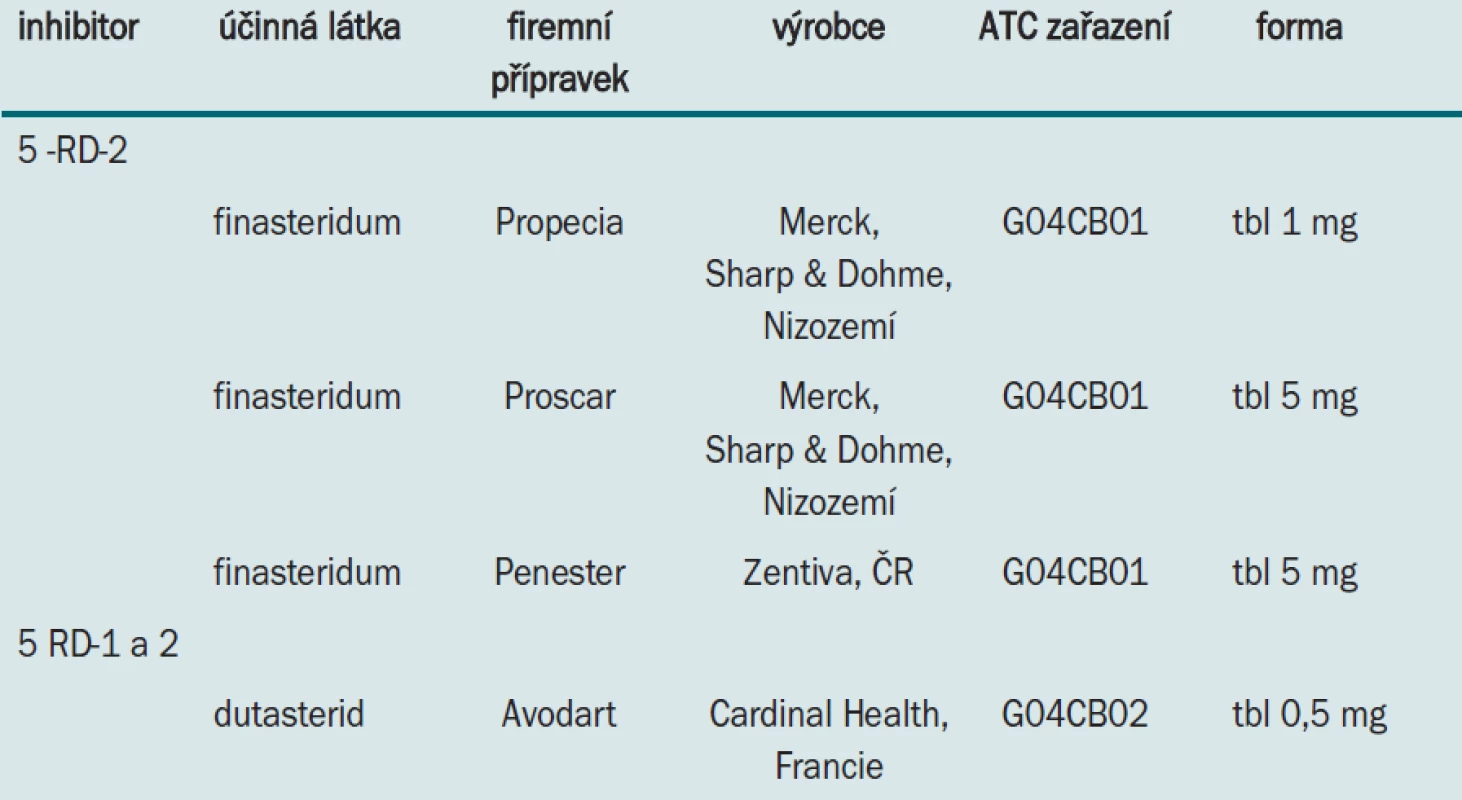
Inhibitory 5α-RD poskytuje příroda (např. extrakty z black cohosh - Cimicifuga racemosa) [41] i farmaceutický průmysl. Pro léčbu některých stavů, v jejichž patogenezi hraje roli DHT, jsou určeny klinicky vyzkoušené, u nás registrované přípravky se selektivním inhibičním účinkem na 5α-RD-2 a přípravky s duálním účinkem na obě izoformy enzymu (tab. 2).
LÉČBA RELATIVNÍHO NADBYTKU DHT
Řada chorobných stavů, jako benigní hyperplazie prostaty, karcinom prostaty, akné, hirzutizmus nebo androgenní alopecie, je úzce spojena s vyššími celkovými nebo lokálními koncentracemi DHT a vyšší aktivitou 5a-RD v cílových tkáních. Inhibice 5a-RD nabízí možnost léčby uvedených stavů.
Benigní hyperplazie a karcinom prostaty
V léčbě benigní hyperplazie prostaty a při antiandrogenní léčbě karcinomu prostaty se osvědčil finasterid v obvyklé dávce 5 mg/den p.o. anebo novější duální inhibitor 5α-RD dutasterid v dávce 0,5 mg/d p.o. Po 3 měsících léčby dutasteridem klesla koncentrace DHT v séru o 93 % a byl redukován i intraprostatický DHT o 94% účinněji než u kontrolní skupiny užívající placebo; intraprostatická koncentrace DHT byla 3,23 ng/g u mužů na placebu a 0,209 ng/g u léčených dutasteridem [42]. Léčba benigní hyperplazie prostaty dutasteridem redukuje sice výrazněji koncentraci DHT než léčba finasteridem, ale léčba oběma inhibitory dociluje stejné redukce objemu prostaty a obstrukčních i iritačních mikčních symptomů. V léčebném profilu obou inhibitorů 5a-RD není prakticky žádný podstatnější rozdíl a léčba symptomů benigní hyperplazie je srovnatelně úspěšná u obou přípravků [43]. Prostatický specifický antigen PSA se obvykle snižuje na poloviční hodnotu po půlroce a objem žlázy o 25 % za 2 roky. Příznivé účinky léčby dutasteridem byly potvrzeny randomizovanými, placebem kontrolovanými 2letými studiemi a k vedlejším účinkům patřilo jen mírné zhoršení některých sexuálních funkcí - libida, erektivity, ejakulační schopnosti, které se nezhoršovaly ani po 4leté léčbě. Na prostatě byly prokázány i antikancerogenní účinky inhibitorů [44].
Androgenní alopecie
Pro léčbu alopecie mužského typu se doporučují dávky finasteridu nižší než pro terapii hyperplazie prostaty – 1 mg/den p.o. [45]. Dlouhodobá léčba alopecie finasteridem vede ke zlepšení hmotnosti přírůstku vlasu ve srovnání s užíváním placeba; zlepšení hmotnosti přírůstku je pak výraznější než zlepšení v počtu vlasů [46]. Hmotnost přírůstku vlasu po 3–4leté léčbě se zvýšila o 21,6 % proti výchozím hodnotám, zatímco u mužů na placebu hmotnost klesla o 24,5 %, takže rozdíl činil celých 46,0 %. Rozdíl v počtu vlasů byl pak 20,3 %. Při léčbě klesá poměr DHT k testosteronu v oblasti vertexu, nikoli však v oblasti okcipitálního ovlasení [47]. Klesají rovněž PSA o 40–50 %. [48]. V přehledu o terapii alopecie [49] se o účinnost léčby u mužů s pleší na vertexu uvádí, že ke zlepšení v růstu vlasů dochází po roce u 48 % a po 2 letech u 66 %; u uživatelů placeba je to 7 %. U další asi 1/5 mužů byl výpad vlasů alespoň zastaven. Pro léčbu alopecie mužského typu se hodí i dutasterid v dávce 0,1–0,5 mg/den s výsledky, které předčí léčbu finasteridem [50].
Poměrně dlouho převládal názor, že pro léčbu inhibitory 5α-RD je vhodná jen androgenní alopecie mužského tzv. Norwoodova typu, zatímco difuzní ženská alopecie Ludwigova typu není pro tuto léčbu vhodná; léčba u žen nebyla doporučována. Ukázalo se však, že při zvýšení dávky finasteridu na 2,5 mg/den a v kombinaci s hormonálním kontraceptivem s drospirenonem došlo u 62 % pacientek s alopecií ženského typu ke zmírnění ztráty vlasu při léčbě finasteridem v dávce 2,5 mg/den. Není jasné, zda je úspěch důsledkem vyšší dávky finasteridu (2,5 mg místo 1 mg) nebo důsledkem spoluúčasti kontraceptiva s antiandrogenní účinností [51].
Rizika léčby finasteridem
U některých, zejména starších, mužů léčených finasteridem ve vyšších dávkách se zaznamenává lehce zvýšená incidence oslabení libida, až sexuální dysfunkce. V poslední době se množí zprávy o zhoršení psychického stavu při léčbě inhibitotry 5a-RD. Zvyšuje se skóre depresivity [52], vyskytují se i akutní deprese [53] a mohou se zhoršovat příznaky premenstruálního dysforického syndromu, postpartální dysforie, katameniální epilepsie u žen nebo abstinenční příznaky u alkoholiků [38].
Práce byla podpořena grantem Interní grantové agentury MZ NR/8525 - 5.
prof. MUDr. RNDr. Luboslav Stárka, DrSc.
Endokrinologický ústav
Národní 8, 116 94 Praha 1
e-mail: lstarka@endo.cz
Zdroje
1. Dorfman RI, Cook JW, Hamilton JB. Conversion by the human of the testis hormone, testosterone, into the urinary androgen, androsterone. J Biol Chem 1939; 130 : 285-295.
2. Borst SE, Lee JH, Conover CF. Inhibition of 5alpha-reductase blocks prostate effects of testosterone without blocking anabolic effects. Am J Physiol Endocrinol Metab 2005; 288(1): 222-227.
3. Bruchovsky N, Wilson JD. The conversion of testosterone to 5-alpha-androstan-17-beta-ol-3-one by rat prostate in vivo and in vitro. J Biol Chem 1968; 243(8): 2012-2021.
4. Bruchovsky N, Wilson JD. The intranuclear binding of testosterone and 5-alpha-androstan-17-beta-ol-3-one by rat prostate. J Biol Chem 1968; 243(22): 5953-5960.
5. Russell DW, Wilson JD. Steroid 5 -reductase: two genes/two enzymes. Annu Rev Biochem 1994; 63 : 25-61.
6. Sinisi AA, Pasquali D, Notaro A et al. Sexual differentiation. J Endocrinol Invest 2003; 26 (suppl 3): 23-28.
7. Tohda A, Matsumoto F, Shimada K, Okuyama A. Differentiation of external genitalia and 5 alpha-reductase. Nippon Rinsho 2004; 62(2): 275-280.
8. Mitamura K, Ogasawara C, Shiozawa A et al. Determination method for steroid 5alpha-reductase activity using liquid chromatography/atmospheric pressure chemical ionization-mass spectrometry. Anal Sci 2005; 21(10): 1241-1244.
9. Hampl R, Putz Z, Stárka L. Radioimunologické stanovení dihydrotestosteronu a jeho význam pro laboratorní diagnostiku. Biochem Clin Bohemoslov 1990; 19 : 157-163.
10. Stárka L, Zamrazil V. Základy klinické endokrinologie. Praha: Maxdorf 2005 : 323.
11. Imperato-McGinley J, Guerrero L, Gautier T, Peterson RE. Steroid 5alpha-reductase deficiency in man: an inherited form of male pseudohermaphroditism. Science 1974; 186 : 1213-1215.
12. Sinnecker GH, Hiort O, Dibbelt L et al. Phenotypic classification of male pseudoherma - phroditism due to steroid 5 -reductase 2 deficiency. Am J Med Genet 1996; 63 : 223-230.
13. Cai LQ, Fratianni CM, Gautier T, Imperato-McGinley J. Dihydrotestosterone regulation of semen in male pseudohermaphrodites with 5 alpha-reductase-2 deficiency. J Clin Endocrinol Metab 1994; 79(2): 1409-1431.
14. Katz MD, Kligman I, Cai LQ et al. Paternity by intrauterine insemination with sperm from a man with 5alpha-reductase-2 deficiency. N Engl J Med 1997; 336(14): 994-997.
15. Imperato-McGinley J, Zhu YS. Androgens and male physiology the syndrome of 5alpha-reductase-2 deficiency. Mol Cell Endocrinol 2002; 198(1-2): 51-59.
16. Imperato-McGinley J, Gautier T, Pichardo M, Shackleton C. The diagnosis of 5 alpha-reductase deficiency in infancy. J Clin Endocrinol Metab 1986; 63(6): 1313-1318.
17. Katz MD, Cai LQ, Zhu YS et al. The biochemical and phenotypic characterization of females homozygous for 5 alpha-reductase-2 deficiency. J Clin Endocrinol Metab 1995; 80(11): 3160-3167.
18. Šulcová J, Stárka L, Jirásek JE. Transformation of testosterone into dihydrotestosterone by the primordia of human genitalia and by the fetal suprascapular skin. Steroids Lipids Res 1973; 4 : 129-134.
19. Sasaki G, Ogata T, Ishii T et al. Micropenis and the 5alpha reductase 2 (SRD5A2) mutation and V89L polymorphism analysis in 81 Japanese patients. J Clin Endocrinol Metab 2003; 88(7): 3431-3436.
20. Negri-Cesi P, Colciago A, Celotti F, Motta M. Sexual differentiation of the brain: role of testosterone and its active metabolites. J Endocrinol Invest 2004; 27(suppl 6): 120-127.
21. Alias AG. A role for 5alpha-reductase activity in the development of male homosexuality? Ann N Y Acad Sci 2004; 1032 : 237-244.
22. McLachlan RI, O'Donnell L, Meachem SJ et al. Identification of specific sites of hormonal regulation in spermatogenesis in rats, monkeys, and man. Recent Progr Hormone Res 2002; 57 : 149-179.
23. Jarow JP, Zirkin BR. The androgen microenvironment of the human testis and hormonal control of spermatogenesis. Ann N Y Acad Sci 2005; 1061 : 208-220.
24. Kolasa A, Marchlewicz M, Wenda-Rozewicka L, Wiszniewska B. Morphology of the testis and the epididymis in rats with dihydrotestosterone (DHT) deficiency. Rocz Akad Med Bialymst 2004; 49(suppl 1): 117-119.
25. Robaire B, Henderson NA. Actions of 5alpha-reductase inhibitors on the epididymis. Mol Cell Endocrinol 2006; 250(1-2): 190-195.
26. Henderson NA, Robaire B. Effects of PNU157706, a dual 5alpha-reductase inhibitor, on rat epididymal sperm maturation and fertility. Biol Reprod 2005; 72(2): 436-443.
27. Le H, Arnold JT, McFann KK, Blackman MR. DHT and testosterone, but not DHEA or E2, differentially modulate IGF-I, IGFBP-2, and IGFBP-3 in human prostatic stromal cells. Am J Physiol Endocrinol Metab 2006; 290(5): E952-960.
28. Marks LS, Hess DL, Dorey FJ, Macairan ML. Prostatic tissue testosterone and dihydrotestosterone in African-American and white men. Urology 2006; 68(2): 337-241.
29. Titus MA, Gregory CW, Ford OH 3rd et al. Steroid 5alpha-reductase isozymes I and II in recurrent prostate cancer. Clin Cancer Res 2005; 11(12): 4365-4371.
30. Titus MA, Schell MJ, Lih FB et al. Testosterone and dihydrotestosterone tissue levels in recurrent prostate cancer. Clin Cancer Res 2005;11(13):4653-4657.
31. Giwercman YL, Abrahamsson PA, Giwercman A et al. The 5alpha-reductase type II A49T and V89L high-activity allelic variants are more common in men with prostate cancer compared with the general population. Eur Urol 2005; 48(4): 679-685.
32. Friedman AE. The estradiol-dihydrotestosterone model of prostate cancer. Theor Biol Med Model 2005; 2(1): 10.
33. Torres JM, Ortega E. Steroid 5alpha-reductase isozymes in the adult female rat brain: central role of dihydrotestosterone. Mol Endocrinol 2006; 36(2): 239-245.
34. Bayne EK, Flanagan J, Einstein M et al. Immunohistochemical localization of types 1 and 2 5alpha-reductase in human scalp. Br J Dermatol 1999; 141(3): 481-491.
35. Hoffmann R, Happle R. Finasteride is the main inhibitor of 5alpha-reductase activity in microdissected dermal papillae of human hair follicles. Arch Dermatol Res 1999; 291(2-3): 100-103.
36. Laatikainen TJ, Apter DL, Paavonen JA, Wahlstrom TR. Steroids in ovarian and peripheral venous blood in polycystic ovarian disease. Clin Endocrinol 1980; 13(2): 125-134.
37. Chin D, Shackleton C, Prasad VK et al. Increased 5alpha-reductase and normal 11beta-hydroxysteroid dehydrogenase metabolism of C19 and C21 steroids in a young population with polycystic ovarian syndrome. J Pediatr Endocrinol Metab 2000; 13(3): 253-259.
38. Finn DA, Beadles-Bohling AS, Beckley EH. A new look at the 5alpha-reductase inhibitor finasteride. CNS Drug Rev 2006; 12(1): 53-76.
39. Sobel V, Schwartz B, Zhu YS et al. Bone mineral density in the complete androgen insensitivity and 5alpha-reductase-2 deficiency syndromes. J Clin Endocrinol Metab 2006; 91(8): 3017-3023.
40. Raz P, Nasatzky E, Boyan BD et al. Sexual dimorphism of growth plate prehypertrophic and hypertrophic chondrocytes in response to testosterone requires metabolism to dihydrotestosterone (DHT) by steroid 5-alpha reductase type 1. J Cell Biochem 2005; 95(1): 108-119.
41. Seidlová-Wuttke D, Pitzel L, Thelen P, Wuttke W. Inhibition of 5alpha-reductase in the rat prostate by Cimicifuga racemosa. Maturitas 2006; 55(suppl 1): S75-82.
42. Wurzel R, Ray P, Major-Walker K et al. The effect of dutasteride on intraprostatic dihydrotestosterone concentrations in men with benign prostatic hyperplasia. Prostate Cancer Prostatic Dis 2007; 10(2): 149-154.
43. Nickel JC. Comparison of clinical trials with finasteride and dutasteride. Rev Urol 2004; 6(suppl 9): 31-39.
44. Marihart S, Harik M, Djavan B. Dutasteride: a review of current data on a novel dual inhibitor of 5alpha reductase. Rev Urol 2005; 7(4): 203-210.
45. Roberts JL, Fiedler V, Imperato-McGinley J et al. Clinical dose ranging studies with finasteride, a type 2 5alpha-reductase inhibitor, in men with male pattern hair loss. J Am Acad Dermatol 1999; 41(4): 555-563.
46. Price VH, Menefee E, Sanchez M, Kaufman KD. Changes in hair weight in men with androgenetic alopecia after treatment with finasteride (1 mg daily): three - and 4-year results. J Am Acad Dermatol 2006; 55(1): 71-74.
47. Ryu HK, Kim KM, Yoo EA et al. Evaluation of androgens in the scalp hair and plasma of patients with male-pattern baldness before and after finasteride administration. Br J Dermatol 2006; 154(4): 730-734.
48. D'Amico AV, Roehrborn CG. Effect of 1 mg/day finasteride on concentrations of serum prostate-specific antigen in men with androgenic alopecia: a randomised controlled trial. Lancet Oncol 2007; 8(1): 21-25.
49. McClellan KJ, Markham A. Finasteride: a review of its use in male pattern hair loss. Drugs 1999; 57(1): 111-126.
50. Olsen EA, Hordinsky M, Whiting D et al. The importance of dual 5alpha-reductase inhibition in the treatment of male pattern hair loss: results of a randomized placebo-controlled study of dutasteride versus finasteride. J Am Acad Dermatol 2006; 55(6): 1014-1023.
51. Iorizzo M, Vincenzi C, Voudouris S et al. Finasteride treatment of female pattern hair loss. Arch Dermatol 2006; 142(3): 298-302.
52. Rahimi-Ardabili B, Pourandarjani R, Habibollahi P, Mualeki A. Finasteride induced depression: a prospective study. BMC Clin Pharmacol 2006; 6 : 7.
53. Altomare G, Capella GL. Depression circumstantially related to the administration of finasteride for androgenetic alopecia. J Dermatol 2002; 29(10): 665-669.
Štítky
Detská urológia Urológia
Článok vyšiel v časopiseUrologické listy
Najčítanejšie tento týždeň
2007 Číslo 3- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- Ze zahraničních periodik
- Dihydrotestosteron a inhibitory steroidní 5α-reduktázy
- Kvíz
- Výsledky vyšetření mikrodelecí oblasti AZF(Yq) u mužů s reprodukčními problémy
- Klinická anatomie sulcus nervi dorsalis penis/clitoridis
- Mužská antikoncepce
- Genová terapie – nová naděje v léčbě erektilní dysfunkce?
- Editorial
- Stárnoucí muž, hormonální a genetické změny
- Je substitúcia testosterónu potenciálnym rizikom pre prostatickú žľazu u stárnuceho muža?
- Rehabilitace erektilní funkce po radikální prostatektomii
- Peyronieho choroba: kontroverzní přístup k terapii Modelace penisu s inflatabilní protézou se stala zlatým standardem léčby Peyronieho choroby
- Vliv endokrinních disruptorů na fertilitu savců
- Erektilní dysfunkce po radikální prostatektomii
- Změny spermiogramu v závislosti na stupni varikokély
- Pracovní výjezdní zasedání Andrologické sekce České urologické společnosti Jana Evangelisty Purkyně v New Yorku 13.–16. 9. 2007
- Druhý Český a mezinárodní andrologický kongres v České republice
-
Druhý Český a mezinárodní andrologický kongres v České republice
Abstrakta
- Urologické listy
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Erektilní dysfunkce po radikální prostatektomii
- Dihydrotestosteron a inhibitory steroidní 5α-reduktázy
- Mužská antikoncepce
- Je substitúcia testosterónu potenciálnym rizikom pre prostatickú žľazu u stárnuceho muža?
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy