Možnosti využití robotické technologie v urologii (vyjma operace prostaty)Možnosti využití robotické technologie v urologii (vyjma operace prostaty)
Key words:
robotic, robotic surgery, robotic urologic surgery
Autoři:
D. Chalmers 1; J. R. Wagner 2
Působiště autorů:
Department of Urology, University of Connecticut
1; Urologic Oncology and Minimally Invasive Surgery, Connecticut Surgical Group Director of Robotic Surgery
2
Vyšlo v časopise:
Urol List 2011; 9(1): 44-48
Souhrn
Klíčová slova:
robotický, robotická technologie, robotická technologie v urologii
Úvod
Sféra užívání robotické technologie se od uvedení systému da Vinci (Intuitive, Sunnyvale, CA, USA) před více než deseti lety stále vyvíjí a rozšiřuje. Pokud vezmeme v úvahu pouze léčbu karcinomu prostaty: počet prostatektomií provedených pomocí robota da Vinci se zvýšil ze 766 případů v roce 2002 na více než 48 000 v roce 2007. Od roku 2008 bylo po celém světě instalováno vice než 1 111 systémů da Vinci. Robotický systém nabízí celou řadu výhod, které podmínily jeho rychlé a masivní rozšíření: trojrozměrná vize, instrumentace poskytující svobodu sedmi stupňů pohybu, větší preciznost a kontrola pohybu, filtr zamezující třesu rukou a ergonomická pozice poskytující větší komfort pro operatéra. Díky těmto výhodám a snadné obsluze nabízí robot přitažlivou učební křivku i pro operatéry, kteří mají malé zkušenosti s laparoskopickými výkony. Podle některých odhadů je operatér schopen provést robotickou prostatektomii během čtyř hodin s uspokojivým výsledkem již po deseti výkonech [2]. Odpůrci robotického přístupu jsou však přesvědčeni, že nákup robotického systému představuje v době omezování nákladů na zdravotní péči vzhledem k prvotní velké investici a vysokým nákladům na údržbu robota nezodpovědné rozhodnutí. Mezi hlavní technické nedostatky robota patří nedostatečná taktilní zpětná vazba.
Díky svým potenciálním rekonstrukčním možnostem se užívání robotického systému rozšířilo na většinu laparoskopických výkonů. Autor tohoto článku podává přehled nejnovějších údajů týkajících se užívání robotického systému v urologii, vyjma operace prostaty. Řada důkazů nasvědčuje tomu, že robotická technologie je vhodnou modalitou pro následující výkony: parciální nefrektomii, rekonstrukci horních cest močových včetně léčby obstrukce ureteropánevní junkce, rekonstrukci močovodu s použitím střevního segmentu, operaci distální části močovodu, cystektomii, divertikulektomii a celou řadu méně obvyklých výkonů.
Parciální nefrektomie
Díky rozšířenému užívání zobrazovacích vyšetření řezu tkáně se významně zvýšila incidence malých tumorů ledviny, u nichž je vhodná indikace parciální nefrektomie (PN). Absolutní indikací pro parciální nefrektomii jsou tumory v solitární ledvině a bilaterální synchronní tumory. V poslední době je stále více uznáván význam nefron šetřící operace. PN by měla být indikována v každém případě, kdy to velikost tumoru a jeho lokalizace umožňují (dokonce u pacientů s normální kontralaterální ledvinou), s cílem maximalizovat funkci ledviny a omezit morbiditu a mortalitu v důsledku renální insuficience.
Laparoskopická parciální nefrektomie (LPN) se objevila jako alternativa otevřené operaci již před více než 15 lety [4]. K dispozici máme ověřené onkologické i funkční výsledky LPN [5]. LPN představuje jeden z technicky nejnáročnějších laparoskopických výkonů, jenž vyžaduje pokročilé znalosti a zkušenosti umožňující izolovat cévní zásobení ledviny, přesnou a precizní resekci tumoru se zabezpečením negativních okrajů a rychlou rekonstrukci defektu parenchymu při současném dosažení hemostázy a minimalizaci délky ischemie. Tento typ rekonstrukční operace umožňuje využít silných stránek robotického systému, kdy zvětšená trojrozměrná vize a vícestupňový rozsah pohybu poskytují větší svobodu, umožňují přesnější resekci tumoru a snazší a preciznější provedení intrakorporální sutury.
Volba vhodného pacienta však má v tomto případě nesmírný význam, zejména u operatérů, kteří nemají větší zkušenosti s robotickým systémem. Minimálně invazivní parciální nefrektomie je absolutně kontraindikována u pacientů s tumory lokalizovanými zcela intrarenálně, s centrálně lokalizovanými tumory a dále s tumory s trombem v renální žíle. Endofytické léze, mnohačetné tumory, tumory přilehlé k vývodnému systému nebo invadující tento systém a tumory o velikosti > 4 cm vyžadují větší technickou zručnost, a představují tedy relativní kontraindikaci pro méně zkušené operatéry.
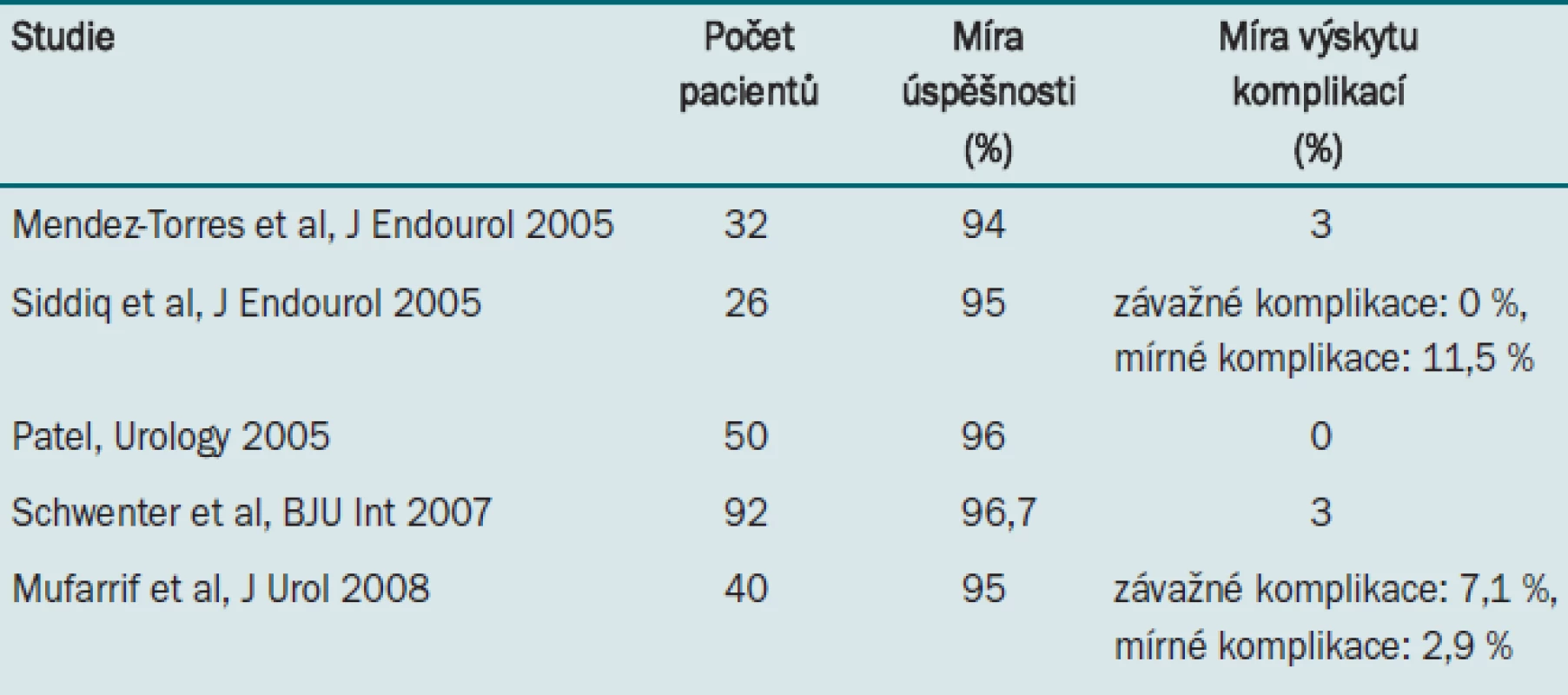
Důkazy pro podporu robotické parciální nefrektomie (RPN) byly publikovány v řadě studií. Ačkoli stále nemáme k dispozici dostatečné údaje o sledování pacientů, kteří podstoupili RPN, výsledky týkající se délky trvání teplé ischemie i onkologické výsledky jsou přinejmenším srovnatelné s výsledky laparoskopického přístupu [6–15]. Velká multicentrická analýza zahrnující 148 pacientů, kteří podstoupili RPN, uvádí následující výsledky: pozitivní okraje byly identifikovány pouze u šesti pacientů (4 %), bez známek recidivy tumoru po průměrné době sledování 7,2 měsíců (celkově) a 18 měsíců (u pacientů s pozitivními okraji) [13]. Tyto výsledky jsou povzbudivé a nasvědčují možnosti dalšího rozšíření nefron šetřící operace.
Robotická rekonstrukce horních cest močových
Otevřená pyeloplastika dosahuje při léčbě obstrukce UPJ u dětské i dospělé populace více než 90% úspěšnosti [16]. Ačkoli je otevřený přístup nadále považován za zlatý standard, minimálně invazivní operace představuje u dobře vybrané skupiny pacientů vhodnou alternativu. Endoskopické techniky, jako např. resekční endopyelotomie, jsou spojeny s 15% mírou selhání, která může být ještě daleko vyšší u pacientů s komplikovanou anatomickou stavbou (např. překřížené cévy) [17]. V rukou zručného a zkušeného urologa-laparoskopisty může být další alternativou laparoskopická pyeoloplastika. Bylo dokázáno, že laparoskopický přístup dosahuje srovnatelných výsledků jako otevřená pyeloplastika. Míra výskytu komplikací při laparoskopické operaci se pohybuje v rozmezí 11,5–12,7 % [18,19]. Tato technika je však technicky poměrně náročná a nebyla všeobecně přijata.
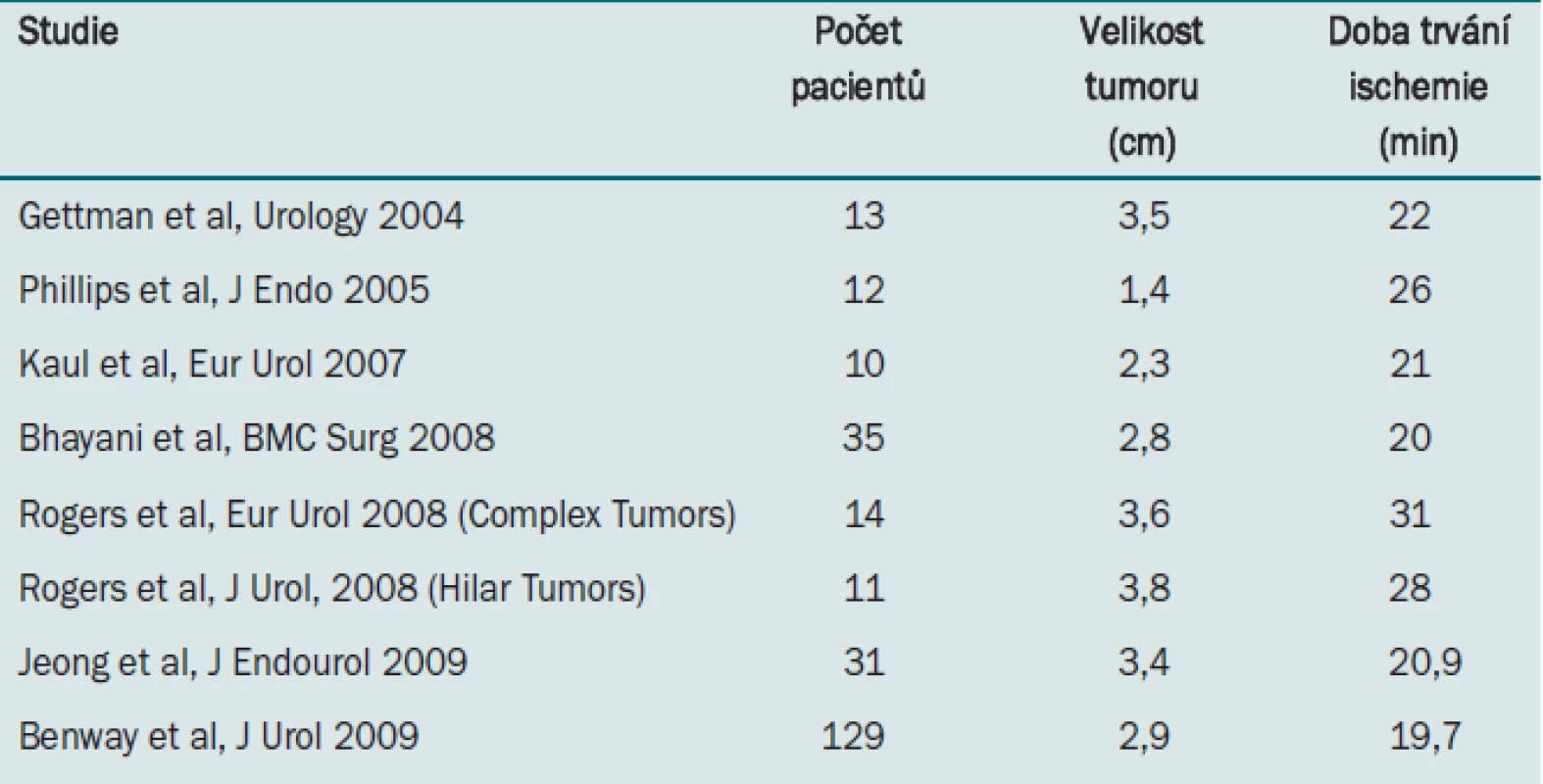
Kombinace robotické technologie a laparoskopického přístupu spojuje výhody nižší pooperační morbidity a snazší preparace a sutury. Další benefity zahrnují menší bolest po výkonu, kratší dobu hospitalizace i rekonvalescence a lepší kosmetický výsledek. Robotická technologie umožňuje operatérovi modifikovat tradiční pyeloplastiku podle Anderson-Hynese bez provádění technicky náročné laparoskopické intrakorporální sutury. Na základě vlastních preferencí a anatomických poměrů může operatér zvolit i techniky bez resekce pyeloureterální junkce (tzn. „non-dismembered“ techniky) – plastiku dle Fengera, Y-V plastiku a techniky s použitím spirálního laloku. Ve srovnání s otevřenou operací se robotická pyeloplastika jeví jako bezpečná technika s reprodukovatelnými výsledky (tab. 2) [20–24].
Robotický systém lze využít i u dalších složitějších rekonstrukčních operací horních cest močových, jako je náhrada močovodu pomocí střevního segmentu nebo ureterokalikostomie. Vytvoření močovodu z ilea může být nutné v případě poranění močovodu, striktury, nebo maligního onemocnění, jehož rozsah neumožňuje provedení primární reimplantace nebo techniky s použitím Boariho laloku. Střevní segment, jenž představuje neobvyklý, ale důležitý rekonstrukční materiál, se při rekonstrukci močovodu užívá více než 50 let. Laparoskopický přístup byl s dobrým výsledkem užit při léčbě TCC močovodu [25] a mnohačetné tuberkulózní ureterální striktury [26]. V několika studiích bylo prokázáno, že laparoskopická technika poskytuje benefit v podobě časné pooperační rekonvalescence, aniž by ohrozila funkční výsledek operace [27,28]. Náhrada močovodu pomocí střevního segmentu představuje bez ohledu na zvolenou techniku složitou operaci, pro niž se ideálně hodí užití robotického systému, který umožňuje provádět složité pohyby v těsném prostoru. V naší instituci jsme provedli úspěšnou robotickou náhradu močovodu pomocí ilea u 32letého muže s anamnézou cystinových konkrementů a mnohačetné ureterální striktury [29]. Je možné, že se robotický přístup stane dalším stupněm ve vývoji této techniky. Omezení robotického i laparoskopického přístupu jsou zapříčiněny poměrně vzácnou indikací tohoto výkonu. Nová technika může operatérovi a celému operačnímu týmu prodlužovat operační čas. Příčina patologie v močovodu vyvolá často současně zánětlivou reakci, což dále komplikuje technickou proveditelnost operace. Dále máme k dispozici výsledky dlouhodobého sledování pacienta, který podstoupil roboticky asistovanou laparoskopickou ureterokalikostomii [30]. Tento výkon může být indikován u pacientů s tenkým parenchymem, intrarenální pánvičkou nebo po předchozí neúspěšné operaci. Bezpečně jsme provedli výkon u 32leté ženy, která dva roky před touto operací podstoupila otevřenou pravostrannou nefrolitotomii.
Rekonstrukce distální části močovodu
Rekonstrukce distální části močovodu může být indikována pro léčbu jak benigních, tak maligních onemocnění. Zejména u větších ureterálních tumorů je obvykle vhodné se vyhnout endoskopické ablaci z důvodu rizika perforace močovodu a rozsevu nádorových buněk a vzniku striktury po termální ablaci. Byly popsány případy léčby distálního ureterálního tumoru pomocí laparoskopické ureterektomie [31,32]. Technická náročnost tohoto výkonu však zamezuje jeho většímu rozšíření. Vzhledem k jemné sutuře, jež má u této techniky zásadní význam, je u této operace obzvláště vhodný robotický přístup. Roboticky asistovanou laparoskopickou operaci distální části močovodu jsme bezpečně vyzkoušeli jak při léčbě onkologických, tak benigních onemocnění [33]. Provedli jsme pět ureterektomií společně s lymfadenektomií u pacientů s TCC – celková doba na operačním sále činila tři hodiny a průměrná délka robotické operace přibližně dvě hodiny. Reimplantace močovodu byla úspěšná rovněž u pacientů s benigním onemocněním. Robotický přístup lze v případě potřeby užít i při technice s užitím Boariho laloku a fixaci k musculus psoas („Psoas hitch“) [32]. Pomocí robotického systému jsme provedli techniku s užitím Boariho laloku u 75leté ženy s přetrvávající ureterální strikturou [34].
Cystektomie
Radikální cystektomie představuje zlatý standard při léčbě karcinomu močového měchýře invadujícího svalovinu a neinvazivního karcinomu vysokého grade refrakterního na intravezikální terapii. Bohužel i nadále představuje jeden z nejsložitějších urologických výkonů spojených s největší morbiditou – míra výskytu komplikací se pohybuje mezi 30–50 %. Laparoskopický přístup, pakliže umožní zachovat požadovaný onkologický výsledek, představuje vhodný způsob pro snížení morbidity. Proveditelnost tohoto přístupu byla prokázána [35], bohužel však nemáme k dispozici dlouhodobé údaje. První studie testující robotickou radikální cystektomii ukazují slibné výsledky jak s ohledem na patologický výsledek, tak na preparaci pánevních uzlin i krátkodobou morbiditu.
Aby byla indikace minimálně invazivní techniky ospravedlnitelná, musejí být onkologické výsledky přinejmenším srovnatelné s otevřenou operací. První studie prozatím ukazují srovnatelné výsledky, míra výskytu pozitivních okrajů se při robotické technice pohybuje v rozmezí 0–7 % [36–39]. Patologické výsledky jsou rovněž srovnatelné s otevřenou operací (tab. 3).
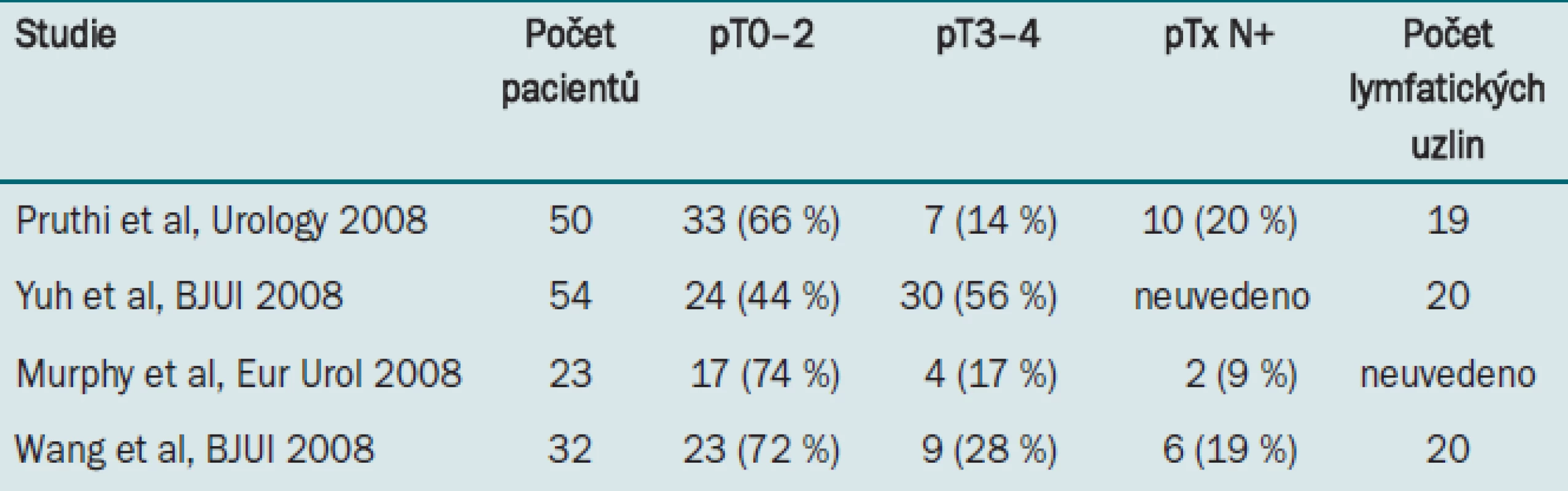
U pacientů podstupujících radikální cystektomii pro léčbu karcinomu močového měchýře o vysokém grade se dnes běžné provádí rozšířená lymfadenektomie. Studie ukazují, že velký počet odstraněných lymfatických uzlin zlepšuje dobu přežití u pacientů s tumory N0 a N1 [40]. Někteří odborníci doporučují odebrat pro větší benefit během výkonu alespoň 10–15 lymfatických uzlin. Aby bylo možné považovat robotickou cystektomii za adekvátní alternativu, musí umožňovat odběr stejného počtu lymfatických uzlin jako otevřená cystektomie. Ačkoli se může absolutní počet lymfatických uzlin u jednotlivých pacientů významně lišit, první studie ukazují, že lze běžně během operace odebrat > 20 lymfatických uzlin, což je výsledek srovnatelný s otevřeným přístupem [36–39]. Tab. 3 ukazuje počet lymfatických uzlin (střední hodnota) resekovaných během bilaterální robotické preparace ve vybraných studiích.
Morbidita i mortalita spojená s robotickou cystektomií se zdá být v mnoha ohledech srovnatelná s otevřenou operací, robotická cystektomie však vykazuje potenciální benefit s ohledem na odhadovanou ztrátu krve, délku hospitalizace a pooperační bolestivost. Pruthi et al zaznamenali u prvních 25 případů 36% míru komplikací, avšak pouze 32% míru u dalších 25 případů, což jasně ukazuje na učební křivku, která je podpořena zkrácením délky výkonu a zmenšením ztráty krve [42]. Wood et al zaznamenali podobnou míru výskytu pooperačních komplikací (33 %, 9/27 pacientů). Tyto výsledky jsou v souladu s výsledky dosaženými při otevřené operaci [43]. Všechny studie prokázaly významný benefit s ohledem na odhadovanou ztrátu krve, jež činí po robotické radikální cystektomii obvykle < 500 mls [42,43]. Studie rovněž uvádějí potřebu pouze pětidenní hospitalizace [36]. Validované dotazníky distribuované pacientům po robotické radikální cystektomii ukazují vynikající výsledky v doménách bolestivosti i kvality života [37].
Divertikulektomie močového měchýře
Divertikl močového měchýře může být jak vrozenou poruchou, tak získaným onemocněním. Pro léčbu refrakterních symptomů dolních cest močových, recidivující infekce, konkrementů v močovém měchýři, ureterální obstrukce nebo karcinomu divertiklu může být indikována chirurgická léčba.
První případ laparoskopické divertikulektomie močového měchýře byl popsán v roce 1992 [44]. Proveditelnost této techniky byla potvrzena vynikajícími výsledky a významným snížením krevní ztráty, zkrácením délky hospitalizace a zmírněním pooperační bolestivosti [45–47]. Při této technice bylo rovněž vyzkoušeno užití robotického systému. Naše malá studie (zahrnující 5 pacientů) dosáhla ve srovnání s laparoskopickým i otevřeným přístupem příznivých výsledků. Nebyl zaznamenán jediný případ úniku moči. Průměrná délka operace 178 minut je srovnatelná s délkou trvání otevřené divertikulektomie. Střední délka hospitalizace byla 3 dny. Obavy týkající se nedostatečné taktilní zpětné vazby byly vyřešeny zdokonalením trojrozměrné vizualizace umožňující zobrazit divertikl z různých úhlů za pomoci lepšího zvětšení. Užití robotické technologie skýtá výhodu oproti laparoskopii zejména v případě, kdy je v těsné oblasti pánve nutné provedení ureteroneocystostomie.
Další užití
Spolu s rozšiřováním možností užití robotické technologie ji urologové stále raději užívají pro neobvyklé výkony. Přístupy k parciální cystektomii se rychle vyvíjejí. Studie ukazují, že u vybraných pacientů lze otevřenou parciální cystektomii provádět se srovnatelnými onkologickými výsledky jako radikální cystektomii, ovšem při nižší morbiditě [49]. Colombo et al popsali 6 případů laparoskopické parciální cystektomie při léčbě karcinomu močového měchýře a urachu (v různých centrech) [50]. Tareen et al popsali čtyři případy robotické parciální cystektomie pro léčbu benigního onemocnění a jeden případ robotické parciální cystektomie pro léčbu karcinomu divertiklu [51]. Balaji et al popsali v nedávné době 3 případy robotické parciální cystektomie pro léčbu TCC a adenokarcinomu močového měchýře [52].
Čím dál častěji se setkáváme s užíváním robotického systému při operaci nadledvin. První případ robotické adrenalektomie popsali Horgan a Vanuno v roce 2001 [53]. Dále byla publikována malá studie s několika případy robotické adrenalektomie [54,55] a dokonce parciální adrenalektomie [56].
Popsali jsme případ operační korekce vezikovaginální píštěle pomocí robotického systému [57]. Několik kazuistik demonstruje užití robota rovněž při výkonu v semenných váčcích [58,59].
Závěr
Robotická technologie představuje pro urology nový technický pokrok v oblastech i mimo radikální prostatektomii. Bylo jasně prokázáno, že minimálně invazivní techniky snižují ztrátu krve během operace, zkracují délku hospitalizace a zlepšují kosmetický výsledek. Funkční i onkologické výsledky se v současné době v mnoha oblastech jeví jako minimálně srovnatelné s výsledky otevřeného a laparoskopického přístupu.
Spolu s dalším technologickým pokrokem a rozšířením možností užití se bude robotická technologie jistě dále rozvíjet. V příbuzných oborech urogynekologie a pediatrické urologie si robotická technologie již vydobyla svou pozici. Zejména při rekonstrukčních technikách umožňují trojrozměrná vize, pohyb „endowrist“ a omezení pohybu lepší manipulaci s tkání v omezeném prostoru.
David
Chalmers, MD
Department
of Urology
University
of Connecticut
Health
Center Farmington, CT 06030
Joseph R.
Wagner, MD
Urologic
Oncology and
Minimally Invasive Surgery
Connecticut
Surgical Group Director of Robotic Surgery
Hartford
Hospital Hartford,
CT 06106J
Wagner@ctsurgical.com
Zdroje
1. http://www.intuitivesurgical.com/corporate/companyprofile/index.aspx.
2. Ahlering TE, Skarecky D, Lee D et al. Successful transfer of open surgical skills to a laparoscopic environment using a robotic interface: initial experience with laparoscopic radical prostatectomy. J Urol 2003; 170(5): 1738–1741.
3. Steinberg PL, Merguerian PA, Bihrle W et al. The cost of learning robot-assisted prostatectomy. Urol 2008; 72(5): 1068–1072.
4. Winfield HN, Donovan JF, Lund GO et al. Laparoscopic partial nephrectomy: Initial experience and comparison to the open surgical approach. J Urol 1995; 153(5): 1409–1414.
5. Lane BR, Gill IS. Five-year outcomes of laparoscopic partial nephrectomy. J Urol 2007; 177(1): 70–74.
6. Bhayani SB, Das N. Robotic assisted laparoscopic partial nephrectomy for suspected renal cell carcinoma: Retrospective review of surgical outcomes
of 35 cases. BMC Surg 2008; 8: 16.
7. Gettman MT, Blute ML, Chow GK et al. Robotic-assisted laparoscopic partial nephrectomy: Technique and initial clinical experience with DaVinci robotic system. Urology 2004; 64(5): 914–918.
8. Kaul S, Laungani R, Sarle R et al. da Vinci-assisted robotic partial nephrectomy: Technique and results at a mean of 15 months of follow-up. Eur Urol 2007; 51(1): 186–191.
9. Rogers CG, Metwalli A, Blatt AM et al. Robotic partial nephrectomy for renal hilar tumors: A multi-institutional analysis. J Urol 2008; 180(6): 2353–2356.
10. Rogers CG, Singh A, Blatt AM et al. Robotic partial nephrectomy for complex renal tumors: Surgical technique. Eur Urol 2008; 53(3): 514–521.
11. Caruso RP, Phillips CK, Kau E et al. Robot assisted laparoscopic partial nephrectomy: Initial experience.
J Urol 2006; 176(1): 36–39.
12. Phillips CK, Taneja SS, Stifelman MD. Robot-assisted laparoscopic partial nephrectomy: The NYU technique. J Endourol 2005; 19(4): 441–445.
13. Rogers CG, Menon M, Weise ES et al. Robotic partial nephrectomy: A multi-institutional analysis.
J Robotic Surg 2008; 2: 141–143.
14. Benway BM, Bhayani SM, Rogers CG et al. Robot assisted partial nephrectomy versus laparoscopic partial nephrectomy for renal tumors: a multi-institutional analysis of perioperative outocomes. J Urol 2009; 182(3): 866–873.
15. Jeong W, Park SY, Lorenzo EL et al. Laparoscopic partial nephrectomy versus robotic-assisted laparoscopic partial nephrectomy. J Endourol 2009; 23: 1457–1460.
16. Brooks JD, Kavoussi LR, Preminger GM et al. Comparison of open and endourologic approaches to the obstructed ureteropelvic junction. Urology 1995; 46(6): 791–795.
17. Motola JA, Badlani GH, Smith AD. Results of 212 consecutive endopyelotomies: an 8 year follow-up.
J Urol 1993; 149(3): 453–456.
18. Jarrett TW, Chan DY, Charambura TC et al. Laparoscopic pyeloplasty: the first 100 cases. J Urol 2002; 167(3): 1253–1256.
19. Soulié M, Salomon L, Patard JJ et al. Extraperitoneal laparoscopic pyeloplasty: a multicenter study of 55 procedures. J Urol 2001; 166(1): 48–50.
20. Mendez-Torres F, Woods M, Thomas R. Technical modifications for robot-assisted laparoscopic pyeloplasty. J Endourol 2005; 19(3): 393–396.
21. Siddiq FM, Leveillee EJ, Villicana P et al. Computer-assisted laparoscopic pyeloplasty. University of Miami experience with the da Vinci surgical system.
J Endourol 2005; 19(3): 387–392.
22. Patel V. Robotic-assisted laparoscopic dismembered pyeloplasty. Urology 2005; 66(1): 45–49.
23. Schwenter C, Pelzer A, Springer B et al. Robotic Anderson-Hynes pyeloplasty: 5-year experience of one centre. BJU Int 2007; 100(4): 880–885.
24. Mufarrij PW, Woods M, Shah OD et al. Robotic dismembered pyeloplasty: a 6-year, multi-institutional experience. J Urol 2008; 180(4): 1391–1396.
25. Gill IS, Savage SJ, Senagore AJ et al. Laparoscopic ileal ureter. J Urol 2000; 163(4): 1199–1202.
26. Kamat N, Khandelwal P. Laparoscopy-assisted ileal ureter creation for multiple tuberculous strictures: report of two cases. J Endourol 2006; 20(6): 388–393.
27. Stein RJ, Turnaa B, Patela NS et al. Laparoscopic Assisted Ileal Ureter: Technique, Outcomes and Comparison to the Open Procedure. J Urol 2009; 182(3): 1032–1039.
28. Simmons MN, Gill IS, Fergany AF et al. Laparoscopic ureteral reconstruction for benign stricture disease. Urology 2007; 69(2): 280–284.
29. Wagner JR, Schimpf MO, Cohen JL. Robot-assisted laparoscopic ileal ureter. JSLS 2008; 12(3): 306–309.
30. Schimpf MO, Wagner JR. Robotic-Assisted Laparoscopic Ureterocalicostomy with Long-Term Follow-Up.
J Endourol 2009; 23(2): 293–295.
31. Gerber E, Dinlenc CZ, Wagner JR. Laparoscopic distal ureterectomy for low-grade transitional cell carcinoma. J Urol 2003; 169(6): 2295.
31. Rouprêt M, Harmon JD, Sanderson KM. Laparoscopic distal ureterectomy and anastomosis for management of low-risk upper urinary tract transitional cell carcinoma: preliminary results. BJU Int 2007; 99(3): 623–627.
32. Schimpf MO, Wagner JR. Robotic-Assisted Laparoscopic Distal Ureteral Surgery. JSLS 2009; 13(1): 44–49.
33. Schimpf MO, Wagner JR. Robotic-Assisted Laparoscopic Boari Flap Ureteral Reimplantion. J Endourol 2008; 22(12): 2691–2694.
34. Finelli A, Gill I, Desai M et al. Laparoscopic extended pelvic lymphadenectomy for bladder cancer: Technique and initial outcomes. J Urol 2004; 172 (5 Pt 1): 1809–1812.
35. Pruthi RS, Wallen EM. Is robotic radical cystectomy and appropriate treatment for bladder cancer? Short-term oncologic and clinical follow-up in 50 consecutive patients. Urology 2008; 72(3): 617–622.
36. Yuh B, Padalino J, Butt ZM et al. Impact of tumor volume on surgical and pathological outcomes after robot-assisted radical cystectomy. BJU Int 2008; 102(7): 840–843.
37. Murphy DG, Challacombe BJ, Elhage O et al. Robotic-assisted laparoscopic radical cystectomy with extracorporal urinary diversion: Initial experience. Eur Urol 2008; 54(3): 570–580.
38. Wang GJ, Barocas DA, Raman JD et al. Robotic vs. open radical cystectomy: Prospective comparison of perioperative outcomes and pathologic measures of early oncologic efficacy. BJU Int 2008; 101(1): 89–93.
39. Herr HW, Bochner BH, Dalbagni G et al. Impact of the number of lymph nodes retrieved on outcome in patients with muscle invasive bladder cancer. J Urol 2002; 167(3): 1295–1298.
40. Stein JP, Cai J, Groshen S et al. Skinner, Risk factors for patients with pelvic lymph node metastases following radical cystectomy with en bloc pelvic lymphadenectomy: the concept of lymph node density. J Urol 2003; 170(1): 35–41.
41. Pruthi RS, Smith A, Wallen EM. Evaluating the learning curve for robot-assisted laparoscopic radical cystectomy. J Endourol 2008; 22(11): 2469–2474.
42. Woods M, Thomas R, Davis R et al. Robot-assisted extended pelvic lymphadenectomy. J Endourol 2008; 22(6): 1297–1302.
43. Parra RO, Boullier JA. Endocavitary (laparoscopic) bladder surgery. Semin Urol 1992; 10(4): 213–221.
44. Parra RO, Jones JP, Andrus CH et al. Laparoscopic diverticulectomy: Preliminary report of a new approach for the treatment of bladder diverticulum.
J Urol 1992; 148(3): 869–871.
45. Jarrett TW, Pardalidis NP, Sweetser P et al. Laparoscopic transperitoneal bladder diverticulectomy: Surgical technique. J Laparoendosc Surg 1995; 5(2): 105–111.
46. Nadler RB, Pearle MS, McDougall EM et al. Laparoscopic extraperitioneal bladder diverticulectomy: Initial experience. Urology 1995; 45(3): 524–527.
47. Myer EG, Wagner JR. Robotic assisted laparoscopic bladder diverticulectomy. J Urol 2007; 178(6): 2406–2410.
48. Kassouf W, Swanson D, Kamat AM et al. Partial cystectomy for muscle invasive urothelial carcinoma of the bladder: A contemporary review of the MD Anderson Cancer Center experience. J Urol 2006; 175(6): 2058–2062.
49. Colombo JR, Desai M, Canes D et al. Laparoscopic partial cystectomy for urachal and bladder cancer. Clinics 2008; 63(6): 731–734.
50. Tareen BU, Mufarrij PW, Godoy G et al. Robot-assisted laparoscopic partial cystectomy and diverticulectomy: Initial experience of four cases. J Endourol 2008; 22(7): 1497–1500.
51. Allaparthi S, Ramanathan R, Balaji KC. Robotic partial cystectomy for bladder cancer: a single-institutional pilot study. J Endourol 2010; 24(2): 223–227.
52. Horgan S, Vanuno D. Robots in laparoscopic surgery. J Laparoendosc Adv Surg Tech A 2001; 11(6): 415–419.
53. Brunard L, Ayav A, Zarnegar R et al. Prospective evaluation of 100 robotic-assisted unilateral adrenalectomies. Surgery 2008; 144(6): 995–1001.
54. Zafar SS, Abaza R. Robot-assisted laparoscopic adrenalectomy for adrenocortical carcinoma: initial report and review of the literature. J Endourol 2008; 22(5): 985–989.
55. Kumar A, Hyams ES, Stefelman MD. Robot-assisted partial adrenalectomy for isolated adrenal metastasis. J Endourol 2009; 23(4): 651–564.
56. Schimpf MO, Morgenstern JH, Tulikangas PK et al. Vesicovaginal fistula repair without intentional cystotomy using the laparoscopic robotic approach: a case report. JSLS 2007; 11(3): 378–380.
57. Carmack AJ, Siddiq FM, Leveillee RJ. Novel use of da Vinci Robotic Surgical System: removal of seminal vesicle cyst in previously dissected pelvis. Urology 2006; 67(1): 199.
58. Moore CD, Erhard MJ, Dahm P. Robot-assisted excision of seminal vesicle cyst associated with ipsilateral renal agenesis. J Endourol 2007; 21(7): 776–779.
Štítky
Detská urológia UrológiaČlánok vyšiel v časopise
Urologické listy

2011 Číslo 1
- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
Najčítanejšie v tomto čísle
- Léčba striktury uretry: dorzální lalok z bukální sliznice – zlatý standard
- Poranění močových cest a genitálu
- Hormonální terapie při léčbě karcinomu prostaty: jak léčit karcinom a neuškodit pacientovi
- Neurourologické vyšetření a léčba
