-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Guidelines EAU pro léčbu a sledování mužů se symptomy dolních cest močových jiného než neurogenního původu (včetně benigní prostatické obstrukce)
Autori: M. Oelke; A. Bachmann; A. Descazeaud; M. Emberton; S. Gravas; M. C. Michel; J. N’dow; J. Nordling; J. J. De La Rosette
Vyšlo v časopise: Urol List 2013; 11(2): 59-82
Kategória: Guidelines
© 2013 European Association of Urology
1. ÚVOD
Symptomy dolních cest močových (LUTS) u starších mužů byly tradičně přisuzovány zvětšující se prostatě. Za jejich příčinu byla považována některá z následujících patologií (případně všechny): histologicky prokázaná benigní hyperplazie prostaty (BPH), benigní zvětšení prostaty (BPE) nebo benigní prostatická obstrukce (BPO). V uplynulých deseti letech však začala být příčinná souvislost mezi prostatou a patogenezí LUTS zpochybňována [1]. Ačkoli zvětšená prostata může u určitého procenta mužů starších 40 let přispívat ke vzniku LUTS, stejně významnou roli hrají i další faktory. Schéma 1 demonstruje nejrůznější příčiny LUTS. U všech pacientů, kteří si stěžují na LUTS, je obvykle přítomno více těchto faktorů. Díky tomuto konceptu multifaktoriální etiologie LUTS začala většina odborníků posuzovat celé močové cesty jako jedinou funkční jednotku. V důsledku tohoto širšího, komplexnějšího přístupu k patogenezi LUTS členové panelu změnili předchozí název EAU guidelines pro léčbu LUTS nasvědčujících přítomnosti BPO (BPH) [2] na aktuálnější a přesnější titul EAU guidelines pro léčbu symptomů dolních močových cest jiné než neurogenní povahy u mužů včetně BPO (s cílem zohlednit změnu pohledu na toto onemocnění).
Schéma 1. Multifaktoriální etiologie LUTS. EAU guidelines pro léčbu LUTS jiné než neurogenní povahy u mužů se zaměřují zejména na LUTS vyvolané benigním zvětšením prostaty (BPE) nebo benigní prostatickou obstrukcí (BPO), hyperaktivním detruzorem nebo hyperaktivním močovým měchýřem (OAB), a nykturií v důsledku noční polyurie. Ostatními příčinami LUTS u mužů se zabývají samostatné EAU guidelines [3–7]. ![Schéma 1. Multifaktoriální etiologie LUTS. EAU guidelines pro léčbu LUTS jiné než neurogenní povahy u mužů se zaměřují zejména na LUTS vyvolané benigním zvětšením prostaty (BPE) nebo benigní prostatickou obstrukcí (BPO), hyperaktivním detruzorem nebo hyperaktivním močovým měchýřem (OAB), a nykturií v důsledku noční polyurie. Ostatními příčinami LUTS u mužů se zabývají samostatné EAU guidelines [3–7].](https://pl-master.mdcdn.cz/media/image/7412874f20353e1d1d17cc0602f1ba7b.png?version=1537790390)
Jelikož pacienti vyhledávají pomoc kvůli LUTS a nikoli kvůli prvotním problémům s prostatou, jako jsou např. BPH nebo BPE, byla tato aktualizovaná guidelines vypracována z pohledu mužů, kteří si stěžují na řadu jímacích, mikčních a/nebo postmikčních symptomů. Doporučení obsažená v těchto guidelines jsou založena na nejlepších dostupných důkazech. Tato doporučení platí pro muže ve věku ≥ 40 let, kteří vyhledávají odbornou pomoc z důvodu přítomnosti nejrůznějších benigních forem LUTS jiného než neurogenního původu, jako jsou např. LUTS/BPO, hyperaktivita detruzoru/hyperaktivní močový měchýř (OAB) nebo noční polyurie. EAU guidelines pro léčbu LUTS vyvolaných neurologickým onemocněním [3], močovou inkontinencí [4], urogenitálními infekcemi [5], ureterolitiázou [6] nebo maligními onemocněními dolních cest močových [7] jsou součástí jiného dokumentu.
2. ZÍSKÁNÍ DŮKAZŮ
Doporučení v těchto guidelines vycházejí ze strukturovaného vyhledávaní v literatuře prostřednictvím článků v angličtině zveřejněných v databázích PubMed/Medline, Web of Science a Cochrane od roku 1966 do 31. října 2012. Vyhledávány byly následující termíny: „symptomy dolních cest močových“, „benigní hyperplazie prostaty“, „hyperaktivita detruzoru“, „hyperaktivní močový měchýř“, „nykturie“ a „noční polyurie“ v kombinaci s různými léčebnými modalitami a s omezením vyhledávaní na „lidé“, „dospělí muži“, „přehledový článek“, „randomizované klinické studie“, „klinické studie“ a „metaanalýza“ (tab. 1).
Tab. 1. Metodologie vyhledávání v literatuře. 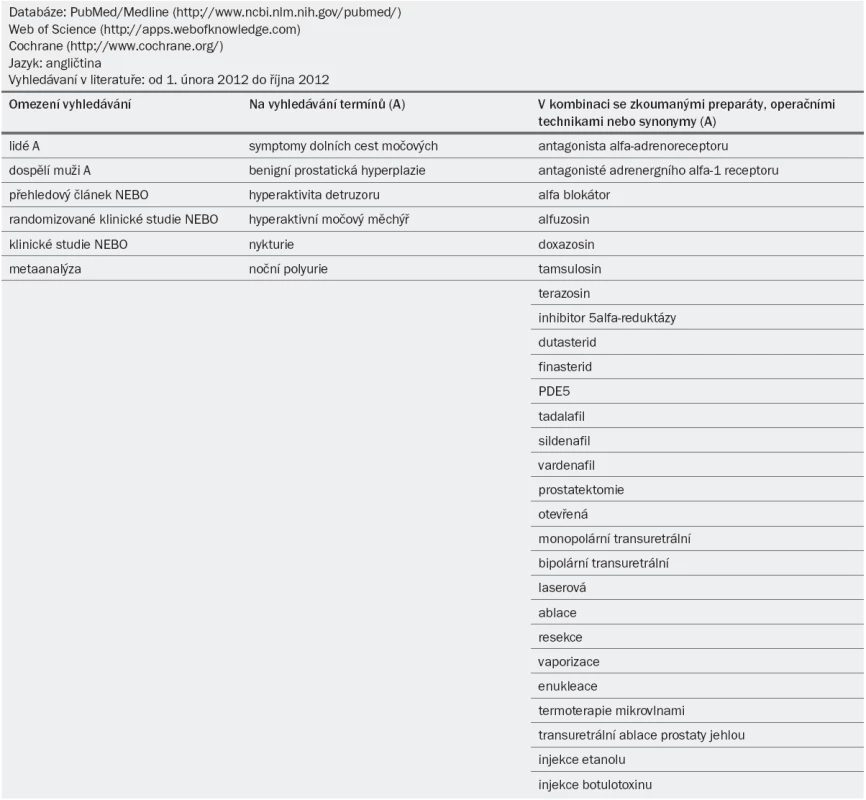
Každý extrahovaný článek byl samostatně analyzován, klasifikován a označen úrovní důkazů (LE) podle klasifikačního systému oxfordského Centra pro medicínu založenou na důkazech z roku 2001 (tab. 2a) [8]. Pododdíly věnované nejrůznějším typům konzervativní léčby, farmakoterapii a operačním technikám jsou jednotně strukturovány v následujícím pořadí: 1. mechanizmus účinku, 2. dostupná léčiva s tabulkou klíčových farmakokinetických profilů (pro tento článek shrnuty v tab. 3), 3. účinnost s tabulkou uvádějící studie s nejvyšší úrovní důkazů, 4. tolerance a bezpečnost, 5. praktické úvahy a 6. doporučení, která byla stanovena na základě příslušných článků za pomoci stupňů doporučení (grade of recommendation – GR) podle klasifikačního systému, který představuje modifikovanou verzi systému oxfordského Centra pro medicínu založenou na důkazech (tab. 2b) [8]. Kompletní analýza literatury, včetně tabulek, doporučení a závěrů je k dispozici online na webových stránkách Evropské urologické asociace (www.uroweb.org/gls/pdf/12_Male_LUTS.pdf). Tento článek prezentuje souhrn těchto analýz a uvádí všechny úrovně důkazů a stupně doporučení analyzovaných terapeutických modalit v jediné tabulce (tab. 4).
Tab. 2. (a) Úroveň důkazu a (b) stupeň doporučení, modifikováno podle oxfordského Centra pro medicínu založenou na důkazech [8]. ![(a) Úroveň důkazu a (b) stupeň doporučení, modifikováno podle oxfordského Centra pro medicínu založenou na důkazech [8].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/a2542e9c62f0d35bcb86d8343e16bd53.png)
Tab. 3. Hlavní farmakokinetické vlastnosti preparátů a standardní dávkování schválené v Evropě pro léčbu symptomů dolních cest močových. 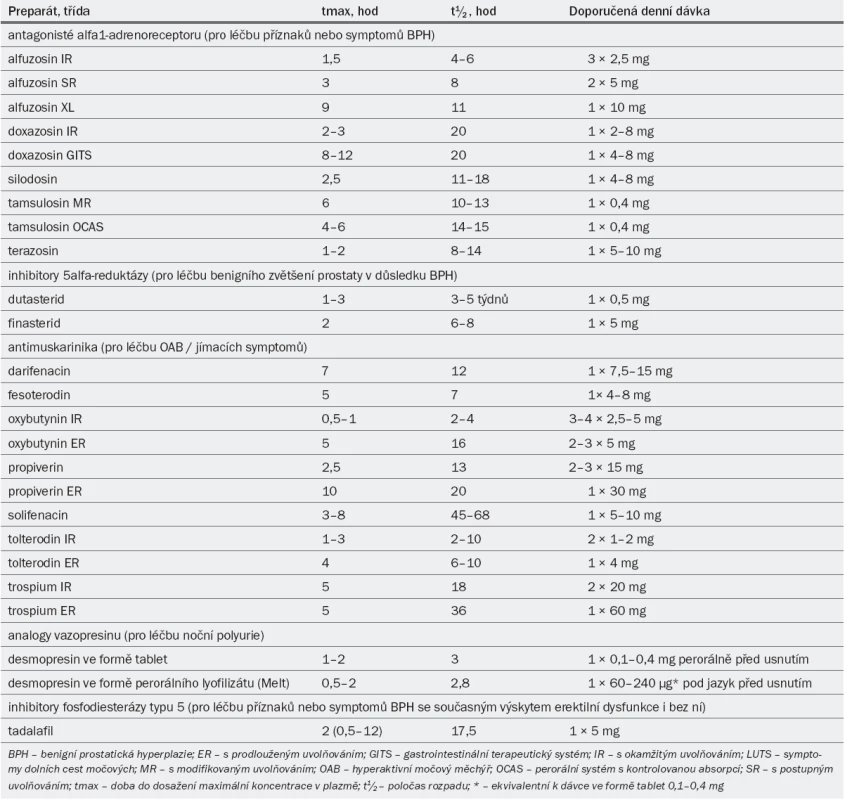
Tab. 4. Úrovně důkazů a stupně doporučení jednotlivých metod pro léčbu a sledování symptomů dolních cest močových u mužů. 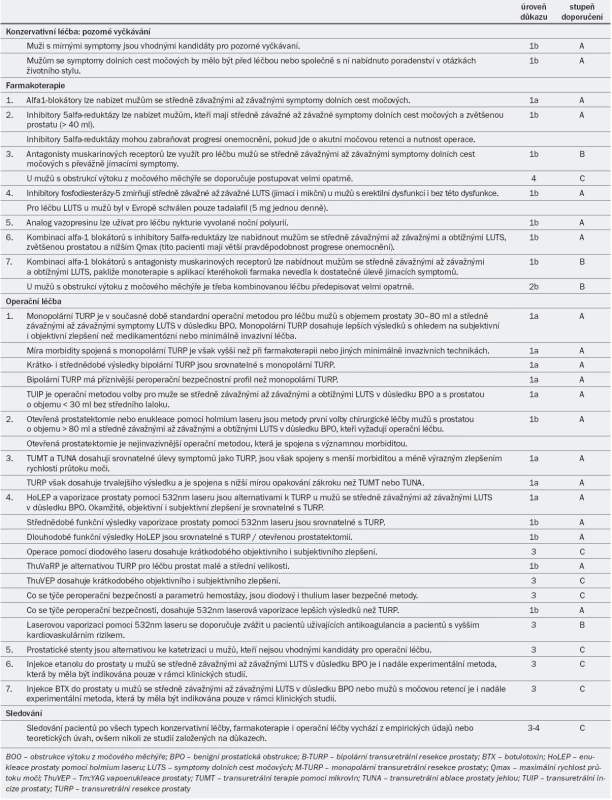
Tato guidelines vypracoval panel odborníků sestávající z urologů, farmakologa, epidemiologa a statistika, kteří se danému tématu věnují posledních šest let. Tato guidelines jsou určena především urologům, ale mohou posloužit i praktickým lékařům, pacientům a dalším zúčastněným stranám. Panel odborníků, který tato guidelines vypracoval, se chystá aktualizovat jejich obsah a doporučení v souladu s danou strukturou a klasifikačními systémy každé dva roky.
3. SYNTÉZA DŮKAZŮ
3.1. Konzervativní léčba
Řadu mužů s LUTS jejich symptomy neobtěžují natolik, aby vyžadovali medikamentózní nebo operační léčbu. Většinu těchto pacientů lze léčit konzervativně pomocí postupu označovaného jako pozorné vyčkávání (watchful waiting – WW). U všech mužů s LUTS by mělo být před zahájením jakékoli formy léčby provedeno formální vyšetření s cílem posoudit závažnost LUTS a rozlišit pacienty (představující naprostou většinu všech mužů s LUTS) s takzvanými nekomplikovanými LUTS, jež nepředstavují žádné ohrožení pro celkovou očekávanou délku života, od pacientů s méně obvyklou formou komplikovaných symptomů. Vhodnými kandidáty pro pozorné vyčkávání jsou muži s mírnými až středně závažnými nekomplikovanými LUTS, pro které nejsou jejich symptomy příliš obtěžující.
Pozorné vyčkávání obvykle zahrnuje následující postupy: poučení a uklidnění pacienta, poradenství v otázkách úpravy životního stylu a pravidelné sledování [9–12], které se zaměřuje na následující aspekty:
- Redukce příjmu tekutin v určitou dobu s cílem snížit frekvenci močení v nejméně vhodnou dobu (např. v noci nebo mimo soukromí domova).
- Vyhýbaní se nebo snížení přijmu kofeinu a alkoholu, které mohou mít diuretický a dráždivý účinek, čímž se zvyšuje výdej tekutin a frekvence, urgence a nykturie.
- Používaní relaxačních technik a technik dvojitého močení.
- Opakované stlačení močové trubice jako prevence odkapávaní moči po vymočení.
- Techniky rozptýlení pozornosti, jako jsou stisknutí penisu, dechová cvičení, perineální tlak a „duševní triky“ tak, aby pacient odvedl svou pozornost od močového měchýře a toalety, a mohl tak lépe kontrolovat jímací symptomy.
- Opakovaný trénink močového měchýře, při kterém se mužům doporučuje, aby zadrželi moč v okamžiku, kdy mají senzorickou urgenci, s cílem zvýšit kapacitu močového měchýře a prodloužit čas mezi močením.
- Kontrola medikace pacienta a optimalizace doby podávaní léků nebo náhrada léků za jiné, které mají méně účinků na močové symptomy, což se týká zejména diuretik.
- Poskytování potřebné pomoci pacientům se zhoršenou obratností, pohyblivostí nebo narušeným duševním stavem.
- Léčba zácpy.
3.2. Farmakoterapie
3.2.1. Antagonisté alfa-1 adrenoreceptoru (alfa-1 blokátory)
3.2.1.1. Mechanizmus účinku
Kontrakce prostaty u člověka je převážně, ne-li výlučně, vyvolávána alfa-1A adrenoreceptory [13]. Alfa-1 adrenoreceptory v cévách, jiných buňkách hladkého svalstva mimo prostatu a v centrálním nervovém systému jsou považovány za mediátory vedlejších účinků během léčby alfa blokátory a pravděpodobně jsou zapojeny všechny tři subtypy receptorů (alfa-1A, alfa-1B a alfa-1D). Tento koncept podpořil užívání alfa-1A selektivních blokátorů.
3.2.1.2. Dostupné preparáty
V současné době se běžně užívá pět následujících typů alfa-1 blokátorů: alfuzosin, doxazosin, silodosin, tamsulosin a terazosin (tab. 3). V několika státech jsou k dispozici také indoramin a naftopidil, naše guidelines se však těmito preparáty nezabývají.
3.2.1.3. Účinnost
Nepřímá srovnáni mezi jednotlivými alfa-1 blokátory a nečetné přímé komparativní studie ukazují, že všechny alfa-1 blokátory mají v odpovídajícím dávkovaní podobnou účinnost [14]. Ačkoli plný účinek se rozvine až po několika týdnech, ve srovnání s placebem byl prokázán významný efekt v rámci několika hodin až dnů. U pacientů s mírnými, středně závažnými i závažnými LUTS dosahují alfa-1 blokátory srovnatelné účinnosti (vyjádřeno jako procentuální zlepšení IPSS (International Prostate Symptom Score) [15]. Kontrolované studie ukázaly, že alfa-1 blokátory obvykle snižují IPSS (po zaváděcím období s placebem) o přibližně 30–40 % a zvyšují maximální rychlost průtoku moči (Qmax) o přibližně 20–25 %. V otevřených studiích (bez zaváděcího období) bylo zaznamenáno zlepšení IPSS až o 50 % a zvýšení Qmax až o 40 %. Aplikace alfa-1 blokátorů vede ke zmírnění jímacích i mikčních LUTS. Studie s ≤ 1 rokem sledování neprokázaly, že by velikost prostaty měla vliv na účinnost léčby alfa-1 blokátory. Studie zahrnující delší dobu sledování však ukazují lepší účinek u pacientů s menší prostatou (< 40 ml) [16–19]. Účinnost alfa-1 blokátorů je srovnatelná ve všech věkových skupinách [15]. Dlouhodobé studie prokazují, že aplikace alfa-1 blokátorů nevede ke zmenšení prostaty ani nezabraňuje vzniku akutní močové retence [16–18,20], někteří pacienti proto vyžadují operační léčbu. Benefit v podobě poklesu IPSS a zvýšení Qmax po léčbě alfa-1 blokátory však přetrvá minimálně po dobu 4 let (tab. 5).
Tab. 5. Rychlost nástupu léčby a její vliv na základní parametry: konzervativní léčba, farmakoterapie nebo operační léčba symptomů dolních cest močových u mužů*. 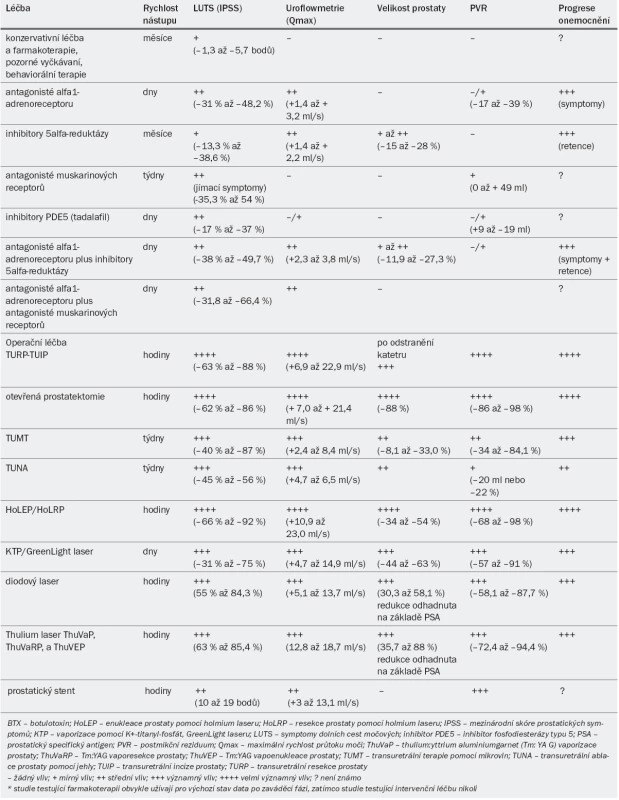
3.2.1.4. Tolerance a bezpečnost
Distribuce preparátu do tkání dolních cest močových, selektivita jednotlivých subtypů a rovněž farmakokinetický profil mohou přispívat ke snášenlivosti jednotlivých preparátů. Mezi nejčastější vedlejší účinky spojené s léčbou alfa-1 blokátory patří astenie, závratě a (ortostatická) hypotenze. Zejména u pacientů s kardiovaskulárními chorobami a/nebo pacientů užívajících vazoaktivní agens může v důsledku aplikace alfa-1 blokátorů docházet k vazodilataci [21]. Frekvence hypotenze při aplikaci alfa-1A selektivního blokátoru silodosinu je ovšem naopak srovnatelná s placebem. Peroperační syndrom plovoucí duhovky byl objeven v roce 2005 při operaci katarakty [22], nejvyšší riziko mají pacienti užívající tamsulosin. Systematický přehled studií prokázal, že aplikace alfa-1 blokátorů nemá negativní vliv na libido. Tato farmaka mohou mít mírně příznivý účinek na erektilní funkci, ale v některých případech mohou způsobovat abnormální ejakulaci (tj. pokles tvorby nebo absenci semenné tekutiny během orgazmu) [23]. Abnormální ejakulaci nejčastěji způsobuje aplikace silodosinu, u pacientů s abnormální ejakulací však byl zaznamenán lepší účinek [24].
3.2.1.5. Praktické úvahy
Alfa-1 blokátory jsou díky rychlému nástupu účinku, dobré účinnosti a nízké incidenci i stupni závažnosti vedlejších účinků často považovány za farmakoterapii první volby při léčbě LUTS u mužů. Před léčbou katarakty je nutné oftalmologa informovat o léčbě alfa-1 blokátory.
3.2.2. Inhibitory 5alfa-reduktázy
3.2.2.1. Mechanizmus účinku
Inhibitory 5alfa-reduktázy (5ARI) blokují přeměnu testosteronu na dihydrotestosteron v buňkách stromatu prostaty prostřednictvím blokády enzymu 5alfa-reduktázy a navozením apoptózy epiteliálních buněk v prostatě, což vede ke zmenšení velikosti prostaty o 18–28 % a přibližně 50% redukci hladiny cirkulujícího PSA po 6–12 měsících léčby [25,26].
3.2.2.2. Dostupné preparáty
Pro klinickou léčbu jsou v současné době k dispozici dva preparáty – dutasterid a finasterid (tab. 3). Finasterid inhibuje pouze 5alfa-reduktázu typu 2, zatímco dutasterid inhibuje 5alfa-reduktázu typu 1 i 2 stejnou měrou (duální 5ARI). Klinický benefit duální inhibice však není zatím znám.
3.2.2.3. Účinnost
Klinický účinek (ve srovnání s placebem) je pozorován po léčbě trvající minimálně po dobu ≥ 6–12 měsíců. Po 2–4 letech zmírňuje léčba pomocí 5ARI LUTS (IPSS) o 15–30 %, zmenšuje velikost prostaty o 18–28 % a zvyšuje Qmax o 1,5–2,0 ml/s u pacientů s LUTS v důsledku BPE. Nepřímé srovnání jednotlivých studií a jedna komparativní studie prokazují, že dutasterid i finasterid dosahují při léčbě LUTS stejné účinnosti [26,27].
Míra redukce symptomů závisí na počáteční velikosti prostaty. U pacientů s prostatou o objemu < 40 ml nemusí být redukce symptomů významnější než při placebo léčbě [28]. Komparativní studie testující alfa-1 blokátory a nejnovější metaanalýzy prokázaly, že 5ARI působí pomalejší redukci LUTS a že finasterid je méně účinný než doxazosin nebo terazosin, ovšem stejně účinný jako tamsulosin [20,29–31]. Dlouhodobá studie testující účinnost dutasteridu u symptomatických mužů s prostatou o objemu > 30 ml a vyšším rizikem progrese onemocnění prokázala, že dutasterid působí u těchto pacientů srovnatelnou (nebo dokonce významnější) redukci LUTS než alfa-1 blokátor tamsulosin [17,18,32]. Čím větší je počáteční objem prostaty (nebo koncentrace PSA v séru), tím rychlejší a výraznější je úleva symptomů při aplikaci dutasteridu. 5ARI (ovšem nikoli alfa-1 blokátory) snižují dlouhodobé (> 1 rok) riziko akutní močové retence i nutnosti operace [20,33,34]. Studie Proscar Long-Term Efficacy and Safety Study prokázala, že finasterid po čtyřech letech léčby snižuje ve srovnání s placebem relativní riziko akutní močové retence (AUR) o 57 % a riziko operace o 55 % [34]. Studie MOPS (Medical Therapy of Prostatic Symptoms) uvádí významný pokles rizika AUR a operace u pacientů užívajících finasterid ve srovnání s placebem (68 % a 64 %) [20]. Analýza randomizovaných studií zahrnující údaje po dvou letech sledování prokázala u pacientů s BPH se středně závažnými symptomy léčenými pomocí finasteridu významný pokles výskytu AUR o 57 % a operační intervence o 34 % (ve srovnání s placebem) [35].
Efekt snížení rizika AUR a nutnosti operace (kvůli BPH) byl prokázán rovněž při aplikaci dutasteridu. Studie 3 fáze prokázaly po dvou letech pokles relativního rizika AUR (57 %) a operační intervence (48 %) oproti placebu [36]. Tento pokles zůstal zachován během čtyř let během otevřené fáze této studie [37].
3.2.2.4. Tolerance a bezpečnost
Nejvýznamnější vedlejší účinky se týkají sexuální funkce a zahrnují pokles libida, erektilní dysfunkci a v méně častých případech i poruchy ejakulace [18,20]. Incidence sexuální dysfunkce a dalších nepříznivých účinků je nízká a s časem se dále snižuje. Gynekomastie (zvětšení prsou provázené citlivostí prsou nebo bradavek) se vyskytne u přibližně 1–2 % pacientů.
Údaje ze dvou významných studií zabývajících se chemoprevencí karcinomu prostaty (the Prostate Cancer Prevention Trial a Reduction by Dutasteride of Prostate Cancer Events trial) prokazují vyšší incidenci karcinomů vyššího grade u pacientů užívajících 5ARI než u pacientů užívajících placebo [38,39]. Ačkoli mezi užíváním 5ARI a karcinomem prostaty vyššího grade nebyla prokázána žádná příčinná souvislost, pacienti užívající 5ARI by měli podstupovat pravidelné kontrolní vyšetření s měřením hladiny PSA. Jakémukoli prokázanému zvýšení PSA během léčby 5ARI je třeba věnovat pozornost.
3.2.2.5. Praktické úvahy
Léčba pomocí 5ARI by měla být doporučována pouze mužům se středně závažnými až závažnými obtížnými LUTS a zvětšenou prostatou (objem prostaty > 40 ml) nebo vyšší koncentrací PSA (> 1,4 ng/ml). Vzhledem k pomalému nástupu účinku jsou 5ARI vhodné pouze pro dlouhodobou léčbu.
3.2.3. Antagonisté muskarinových receptorů
3.2.3.1. Mechanizmus účinku
Muskarinové receptory jsou exprimovány ve velkém množství na buňkách hladké svaloviny detruzoru, ale také na dalších typech buněk, např. na epiteliálních buňkách slinných žláz a prostaty, uroteliálních buňkách močového měchýře nebo nervových buňkách periferního nebo centrálního nervového systému. Inhibice muskarinových receptorů zmírňuje kontrakce buněk hladké svaloviny a senzorický práh močového měchýře.
Antimuskarinní účinek může být vyvolán nebo modulován urotelem a/nebo centrálním nervovým systémem.
3.2.3.2. Dostupné preparáty
Následující antagonisté muskarinových receptorů byly schváleny pro léčbu symptomů hyperaktivního močového měchýře/jímacích symptomů u pacientů obou pohlaví: darifenacin, fesoterodin, oxybutynin, propiverin, solifenacin, tolterodin a trospium chlorid (tab. 3).
3.2.3.3. Účinnost
Antagonisté muskarinových receptorů byly v minulosti testovány převážně na ženách, neboť se předpokládalo, že u žen jsou symptomy LUTS vyvolány močovým měchýřem, a proto musí být léčeny preparáty specificky cílícími tento orgán. Byly provedeny čtyři post hoc analýzy (dvě analýzy testující tolterodin s rozšířeným uvolňováním, jedna testující solifenacin v dávkování 5 mg a jedna testující fesoterodin v dávkování 4 a 8 mg) údajů z velkých randomizovaných studií zabývajících se léčbou OAB u žen i mužů, u nichž nebyla předpokládána přítomnost obstrukce výtoku z močového měchýře (BOO). Tyto analýzy však byly zaměřeny pouze na pacienty mužského pohlaví [40–43]. Bylo zjištěno, že aplikace tolterodinu může významně zmírňovat urgentní inkontinenci, frekvenci močení během dne i během 24 hodin a močení spojeného s urgencí. Ve srovnání s placebem pacienti vnímali větší benefit při aplikaci tolterodinu.
Aplikace solifenacinu vedla k významnému poklesu průměrného skóre dotazníku Patient Perception of Bladder Condition, průměrného skóre dotazníku OAB a k celkovému zlepšení vnímání potíží s močovým měchýřem pacienty. Pacienti užívající fesoterodin zaznamenali významně větší střední procentuální zlepšení frekvence mikce, epizod urgence i urgentní inkontinence (UUI) a významně vyšší podíl pacientů zaznamenal odpověď na léčbu ve srovnání s placebem. Otevřené studie testující léčbu tolterodinem uvádějí po 12–25 týdnech léčby signifikantní zmírnění frekvence močení během dne, nykturie, urgentní inkontinence a pokles IPSS (oproti počátečnímu stavu) [44,45].
Pouze minimum studií se zabývá účinností monoterapie s aplikací antimuskarinik u mužů se symptomy BOO a OAB a tyto studie navíc dospěly k neuspokojivým výsledkům. Ve studii Tolterodine and Tamsulosin in Men with LUTS including OAB: Evaluation of Efficacy and Safety Study došlo u pacientů užívajících tolterodin (jako monoterapii) k významnému zlepšení pouze v doméně urgentní inkontinence, pacienti však nevykazovali jakékoli významnější zlepšení urgence ani pokles IPSS (celkem ani subskóre jímacích symptomů). Rovněž nedošlo k významnému nárůstu počtu pacientů, kteří by uváděli benefit léčby ve srovnání s placebem [46].
Další analýza prokázala, že muži s hladinou PSA < 1,3 ng/ml (prostata menší velikosti) mohou mít z léčby antimuskariniky větší benefit [47]. Další dvě studie [44,48] prokázaly pozitivní účinek antimuskarinik u pacientů s OAB a současně se vyskytující BOO. V malé randomizované kontrolované studii bez placebo skupiny pacienti užívající propiverin hydrochlorid zaznamenali zmírnění frekvence močení i snížení počtu epizod urgence (oproti počátečnímu stavu) [48]. V otevřené studii bylo prokázáno, že aplikace tolterodinu snižuje průměrný počet mikcí během 24 hodin a zlepšuje nykturii, a rovněž zlepšení průměrného skóre AUAS indexu (American Urological Association Symptom Index) [44].
3.2.3.4. Tolerance a bezpečnost
Antagonisté muskarinových receptorů jsou pacienty obecně dobře snášeni. Ve srovnání s placebem byla zaznamenána vyšší frekvence těchto nepříznivých účinků: pocit suchosti v ústech (≤ 16 %), zácpa (≤ 4 %), obtíže při močení (≤ 2 %), nazofaryngitida (≤ 3 %) a závratě (≤ 5 %).
U mužů bez BOO dochází pouze k minimálnímu zvýšení postmikčního rezidua (PVR), což se významně neliší od placebo skupiny (0 až 5 ml vs –3,6 až 0 ml). Incidence močové retence u mužů bez BPO užívajících tolterodin byla srovnatelná s placebo skupinou (0 až 1,3 % vs 0 až 1,4 %). Krátkodobou léčbu pomocí antimuskarinik (tolterodin) u mužů s BOO lze považovat za bezpečnou [49].
3.2.3.5. Praktické úvahy
Ačkoli při léčbě starších mužů s LUTS a symptomy OAB nebyly dosud testovány všechny formy antimuskarinik, lze očekávat, že všechny preparáty pravděpodobně vykazují srovnatelnou účinnost a srovnatelný výskyt vedlejších účinků. Vzhledem k tomu, že dosud nemáme k dispozici dlouhodobé údaje o účinnosti antagonistů muskarinových receptorů u mužů s LUTS, je třeba tyto preparáty předepisovat opatrně a doporučuje se pravidelné hodnocení IPSS a PVR.
3.2.4. Inhibitory fosfodiesterázy typu 5
3.2.4.1. Mechanizmus účinku
Inhibitory PDE typu 5 (PDE5-I) zvyšují koncentraci cyklického guanosin monofosfátu v buňkách a prodlužují jeho účinnost, díky čemuž snižují tonus hladké svaloviny detruzoru, prostaty a močové trubice. V dolních cestách močových převládají izoenzymy PDE4 a PDE5 [50]. Oxid dusnatý a PDE se mohou podílet na mikčním cyklu rovněž prostřednictvím inhibice reflexních drah v míše a neurotransmise v močové trubici, prostatě nebo močovém měchýři [51].
Byla rovněž předložena hypotéza, že PDE5-I zvyšují krevní perfuzi a oxygenaci dolních cest močových, přesný mechanizmus účinku PDE5-I však není dosud znám.
3.2.4.2. Dostupné preparáty
Ačkoli v Evropě byly pro léčbu erektilní dysfunkce schváleny tři selektivní PDE5-I preparáty (sildenafil, tadalafil a vardenafil) a všechna tři farmaka byla testována v klinických studiích pro léčbu LUTS u mužů, pouze tadalafil (5 mg jednou denně) byl zatím v Evropě schválen pro léčbu LUTS u mužů (tab. 3).
3.2.4.3. Účinnost
Během několika uplynulých let byly publikovány randomizované kontrolované studie testující účinnost tří dostupných perorálních PDE5-I preparátů. V nedávné době provedená metaanalýza (3 214 mužů, střední doba sledování 12 týdnů) uvádí, že monoterapie s aplikací PDE5-I vede k významnému zlepšení skóre IIEF (International Index of Erectile Function) (+5,5) i IPSS (–2,8), ovšem ve srovnání s placebem nebylo zjištěno žádné signifikantní zlepšení Qmax (0,00) [52].
Bylo zjištěno, že aplikace 5 mg tadalafilu významně snižuje IPSS (po zaváděcí fázi) o 22–37 % (4,7–6,6 IPSS bodů; IPSS bodů ve srovnání s placebem: 2,1–4,4) [53,54]. Významné zmírnění LUTS (IPSS) bylo zaznamenáno při aplikaci tadalafilu již po jednom týdnu léčby.
Poslední RCT, nezahrnutá do poslední citované metaanalýzy, prokázala jako první statisticky významné zvýšení Qmax při aplikaci tadalafilu (oproti placebu + 2,4 ml/s) [54]. Tadalafil nemá žádný signifikantní vliv na PVR.
Byla hodnocena kombinovaná aplikace alfa blokátorů s PDE5-I. Metaanalýza pěti RCT s malým počtem pacientů a krátkou dobou sledování testující kombinaci alfa blokátorů s PDE5-I (20 mg tadalafilu ve dvou studiích, 25 mg sildenafilu ve dvou studiích a 20 mg vardenafilu v jedné studii) versus samotná aplikace alfa-adrenergních blokátorů prokázala, že kombinovaná léčba významně zlepšuje Qmax (+1,5 ml/s), IPSS (–1,8), a IIEF skóre (+3,6) ve srovnání se samotnými alfa blokátory [52].
Vzhledem k tomu, že v Evropě byla schválena pouze aplikace tadalafilu 5 mg, údaje týkající se kombinované léčby v podobě PDE5-I a dalších preparátů pro léčbu LUTS jsou považovány za nedostatečné.
3.2.4.4. Tolerance a bezpečnost
Aplikace PDE5-I nejčastěji způsobuje bolesti hlavy, bolesti zad, závratě a dyspepsii. PDE5-I jsou kontraindikovány u pacientů, kteří užívají nitráty, otvírače K-kanálu, nicorandil nebo alfa-1 blokátory doxazosin nebo terazosin. Dále jsou kontraindikovány u pacientů s nestabilní anginou pectoris, pacientů, kteří v nedávné době prodělali infarkt myokardu (< 3 měsíce) nebo cévní mozkovou příhodu (< 6 měsíců), pacientů s kardiální nedostatečností (stadium > 2 podle New York Heart Association), hypotenzí, špatně kontrolovaným krevním tlakem, závažnou jaterní nebo renální insuficiencí nebo v případě, že pacient trpí anteriorní ischemickou optickou neuropatií s náhlou ztrátou vidění (nebo tato porucha byla zaznamenána při předchozí aplikaci PDE5-I).
3.2.4.5. Praktické úvahy
V současné době je pro léčbu LUTS u mužů (s erektilní dysfunkcí i bez ní) schválena pouze aplikace tadalafilu 5 mg jednou denně. Z tohoto důvodu by měl být pro klinickou léčbu LUTS u mužů indikován pouze tadalafil.
Metaanalýza testující PDE5-I nasvědčuje tomu, že mladší muži s nižším BMI a závažnějšími LUTS mají z léčby pomocí PDE5-I největší benefit [52]. Dlouhodobější zkušenost s užíváním tadalafilu u mužů s LUTS uvádí pouze jediná studie, účinnost ani snášenlivost léčby trvající déle než jeden rok tedy prozatím není možné posoudit. V současné době nemáme dostatek informací o dopadu léčby na redukci velikosti prostaty a žádná data o jejím vlivu na zpomalení progrese onemocnění.
3.2.5. Rostlinné výtažky: fytoterapie
Rostlinné léčivé preparáty se vyrábějí z kořenů, semen, pylu, kůry nebo plodů jedné rostliny (monopreparáty), nebo se do jedné tablety kombinují extrakty ze dvou nebo více rostlin (kombinované preparáty). Pro přípravu extraktů se užívá řada různých rostlin. Mezi nejběžněji používané rostliny patří: Cucurbita pepo (semena dýně), Hypoxis rooperi (jihoafrická hvězdicová tráva), Pygeum africanum (kůra slivoně africké), Secale cereale (pyl žita setého), Serenoa repens (syn. Sabal serrulata; bobule americké trpasličí palmy, zvané též pilovitá palma) a Urtica dioica (kořeny kopřivy dvoudomé).
Různí výrobci používají různé extrakční techniky, distribuují účinné látky různých kvalitativních a kvantitativních vlastností nebo kombinují dvě nebo více rostlinných sloučenin do jedné tablety. Výtažky z téže rostliny vyrobené různými výrobci tedy nemusejí nezbytně mít tytéž biologické nebo klinické účinky, takže efekt jedné značky nelze zobecňovat na účinky léčiv jiných výrobců [55]. Aby to bylo ještě složitější, dokonce dvě různé šarže téhož výrobce mohou obsahovat různé koncentrace účinných látek a mít různé biologické účinky [56]. Farmakokinetické vlastnosti různých rostlinných extraktů se tedy mohou významně lišit.
Metaanalýzy dostupné v databázi Cochrane nasvědčují tomu, že (1) muži užívající výtažek z Pygeum africanum zaznamenali dvakrát častěji úlevu symptomů (ačkoli analyzované studie neužívaly validované dotazníky, např. IPSS), (2) muži léčení výtažkem ze Secale cereale měli dvakrát větší benefit z léčby než muži užívající placebo a (3) léčba pomocí extraktu ze Serenoa repens nedosahovala s ohledem na zlepšení IPSS lepších výsledků než placebo, finasterid nebo tamsulosin (podobné zlepšení IPSS při léčbě finasteridem nebo tamsulosinem lze interpretovat jako ekvivalentní účinek léčby) [57–59].
Členové komise pro tvorbu guidelines nejsou schopni poskytnout konkrétní doporučení tykající se fytoterapie při léčbě symptomů dolních cest močových u mužů z důvodu různorodosti jednotlivých výrobků, nedostatečné regulační koncepci a zásadním metodologickým nedostatkům publikovaných studií a metaanalýz.
3.2.6. Analog vazopresinu: desmopresin
3.2.6.1. Mechanizmus účinku
Antidiuretický hormon arginin vazopresin (AVP) hraje klíčovou úlohu v homeostáze tělesné vody a při kontrole produkce moči tím, že se váže na receptor V2 ve sběrných kanálcích ledvin. Hormon AVP zvyšuje zpětné vstřebávání vody a rovněž osmolalitu moči a redukuje vylučování vody i celkový objem moči. Hormon AVP by mohl být terapeuticky využíván k úpravě množství vylučované moči, avšak díky vazbě na receptor V1 má hormon AVP také vazokonstriktivní/hypertenzní účinky a dále pak velmi krátký poločas rozpadu v séru, a proto je nevhodný pro léčbu nykturie/noční polyurie.
3.2.6.2. Dostupné preparáty
Desmopresin je syntetický analog hormonu AVP s vysokou afinitou k receptoru V2 a antidiuretickými vlastnostmi, nevykazuje však žádnou významnou afinitu k receptoru V1 a nemá hypertenzní účinky. Desmopresin byl ve většině evropských států schválen pro léčbu nykturie vyvolané noční polyurií u dospělých pacientů (tab. 3).
Klinický efekt – co se týče snížení objemu moči a zvýšení osmolality moči – trvá po dobu přibližně 8–12 hodin [60].
4.2.6.3. Účinnost
V pilotních klinických studiích bylo zjištěno, že aplikace desmopresinu významně snižuje noční diurézu o přibližně 0,6–0,8 ml/min (-40 %), snižuje počet močení během noci o přibližně 0,8–1,3 (–40 %) a prodlužuje dobu do prvního nočního močení o přibližně 1,6–2,1 hodiny. Užívání desmopresinu rovněž významně snižuje noční objem moči i objem moči během noci vymočené [61–63]. Metaanalýza dostupných RCT prokázala, že desmopresin oproti placebu významně snížil celkový počet močení během noci a významně zvýšil počet hodin nerušeného spánku.
Tyto RCT však zahrnovaly extrémně heterogenní populaci pacientů, užívajících různé dávkování [64].
3.2.6.4. Tolerance a bezpečnost
Nejčastějšími nežádoucími účinky v krátkodobých studiích (do 3 týdnů) a v dlouhodobých studiích (12 měsíců) byly bolest hlavy, nevolnost, průjem, bolest břicha, závratě, sucho v ústech a hyponatrémie (koncentrace sodíku v séru < 130 mmol/l).
V dlouhodobé studii byly uváděny rovněž periferní edém (2 %) a hypertenze (5 %) [63]. Hyponatrémie všech stupňů, která není nezbytně spojena se symptomy, se objevuje přibližně u 5–7,6 % pacientů brzy po zahájení léčby [65,66]. Riziko vzniku hyponatrémie je významně nižší u mužů a významně se zvyšuje s věkem, nižší výchozí koncentrací sodíku v séru a s vyšším bazálním 24hodinovým objemem moči na tělesnou hmotnost [65]. Riziko hyponatrémie u pacientů ve věku < 65 let činí < 1 %, zatímco u starších pacientů se zvyšuje na 8 % u jedinců s normální koncentrací sodíku a až na 75 % u jedinců s nízkou počáteční koncentrací sodíku [65]. V nedávné době publikovaná subanalýza nasvědčuje tomu, že perorální aplikace 50–100 mg desmopresinu (Melt) u mužů je bezpečná [67].
3.2.6.5. Praktické úvahy
Desmopresin je indikován u pacientů trpících nykturií v důsledku noční polyurie, a měl by být aplikován jednou denně před spaním. Jelikož se optimální dávka u různých pacientů liší, léčba desmopresinem by měla být zahájena aplikací nízké dávky perorálně (0,1 mg/den), kterou lze postupně každý týden zvyšovat až do dosažení maximální účinnosti. Maximální doporučená denní dávka pro perorální léčbu je 0,4 mg/den. Pacienti by neměli alespoň hodinu před podáním desmopresinu a osm hodin poté přijímat žádné tekutiny. Koncentraci sodíku v séru je nutné monitorovat třetí a sedmý den po zahájení terapie a následně v pravidelných intervalech.
3.2.7. Kombinovaná léčba
3.2.7.1. Alfa-1 blokátory plus inhibitory 5alfa-reduktázy
Kombinovaná aplikace alfa-1 blokátorů s 5ARI spojuje různé účinky obou skupin léků s cílem zmírnit symptomy a působit preventivně proti progresi onemocnění. Byly publikovány výsledky analýzy MTOPS dat po čtyřech letech a výsledky studie CombAT (Combination of Avodart and Tamsulosin) po dvou a čtyřech letech [17,18,20]. Poslední zmiňovaná studie zahrnovala starší muže s větší prostatou a vyšším PSA v séru, tedy zřejmě muže s vyšším rizikem progrese onemocnění. Oproti dřívějším studiím s 6–12měsíčním intervalem sledování dlouhodobé údaje prokázaly, že kombinovaná léčba dosahuje s ohledem na redukci symptomů a zvýšení Qmax lepších výsledků než monoterapie [17,18,20].
Studie MTOPS prokázala, že kombinovaná léčba (vs placebo) snižuje riziko dlouhodobé klinické progrese (primárně v důsledku zvyšujícího se skóre IPSS) o 66 %, a to větší měrou než samotná aplikace finasteridu nebo doxazosinu (34 % a 39 %, v tomto pořadí) [20]. Finasterid, sám i v kombinované terapii (ovšem nikoli doxazosin), navíc v průběhu čtyř let trvání studie významně snižoval riziko AUR i nutnosti operace z důvodu BPH. CombAT studie prokázala, že kombinovaná terapie snižuje po 4 letech (oproti léčbě tamsulosinem) relativní riziko AUR o 67,8 %, riziko operace z důvodu BPH o 70,6 % a riziko, že dojde ke zhoršení symptomů, o 41,3 % [18].
RCT a otevřená multicentrická studie zkoumají efekt vysazení alfa-1 blokátoru po 6–9 měsících kombinované léčby [68,69]. Obě studie však trpí nedostatky v podobě krátkého trvání studie a krátké doby sledování pacienta po vysazení preparátu. Při kombinované léčbě se vyskytují nepříznivé účinky obou skupin preparátů [17,18,20].
Alfa-1 blokátory v kombinaci s 5ARI se doporučuje předepisovat zejména mužům s mírnými až závažnými LUTS s rizikem progrese onemocnění (např. větší objem prostaty, vyšší koncentrace PSA, vyšší věk) a pacientům akceptujícím déletrvající léčbu (> 12 měsíců).
3.2.7.2. Alfa-1 blokátory plus antagonisté muskarinového receptoru
Cílem kombinované terapie alfa-1 blokátorem společně s antagonistou muskarinového receptoru je antagonizovat jak alfa-1 adrenergní receptory, tak receptory M2 a M3 v dolních cestách močových, a tím využít účinnosti obou skupin léčiv k dosažení synergického účinku. Několik RCT [70–75] a prospektivních studií hodnotí účinnost kombinace alfa-1 blokátoru společně s antagonistou muskarinového receptoru, buď jako první terapii u mužů s OAB a předpokládanou BPO, nebo jako sekvenční léčbu u mužů s přetrvávajícími jímacími symptomy navzdory léčbě alfa-1 blokátorem. Kombinovaná léčba byla ve srovnání s aplikací alfa-1 blokátoru nebo placeba účinnější s ohledem na redukci frekvence mikce, nykturie i IPSS.
Kombinovaná léčba významně redukuje počet epizod UUI i urgence a významně zlepšuje kvalitu života pacientů (QoL) [75]. Přetrvávající LUTS během aplikace alfa-1 blokátoru lze účinně redukovat přidáním antagonisty muskarinového receptoru, zejména v případě, že byla prokázána hyperaktivita detruzoru.
Dva systematické přehledy (bez statistické analýzy) studií zabývajících se účinností a bezpečností antimuskarinik (tolterodin, oxybutynin, propiverin, solifenacin, trospium a fesoterodin) pro léčbu LUTS, včetně OAB u mužů, podporují názor, že tyto preparáty mohou přinášet u těchto mužů významný benefit [76,77].
Při kombinované léčbě pomocí alfa-1 blokátorů a antagonistů muskarinového receptoru se vyskytují nepříznivé účinky obou skupin léčiv. Některé vedlejší účinky (např. xerostomie nebo porucha ejakulace) se mohou vyskytovat častěji a není možné jejich příčinu vysvětlit prostým součtem frekvencí výskytu vedlejších účinků obou preparátů. Studie testující účinek kombinace alfa-1 blokátorů s antimuskariniky, jež hodnotí objem PVR, prokazují zvětšení (ačkoli ne klinicky signifikantní) PVR a nízké riziko AUR [76,77]. V nedávné době provedená RCT hodnotí bezpečnost kombinace solifenacinu (6 a 9 mg) a tamsulosinu u mužů s LUTS a BOO s ohledem na maximální tlak detruzoru a Qmax ve srovnání s placebem [78]. Na konci terapie nevykazovala kombinovaná terapie horší výsledek v doméně primárních urodynamických parametrů než placebo, Qmax byl vyšší než u pacientů užívajících placebo [78].
Účinky obou skupin léčiv jsou pravděpodobně zodpovědné za vyšší účinnost a lepší QoL u pacientů užívajících alfa-1 blokátory s antagonisty muskarinového receptoru. Studie užívaly jako cílové parametry zejména jímací symptomy, trvaly příliš krátkou dobu a zahrnovaly pouze muže s nízkým počátečním PVR. Během kombinované léčby se tedy doporučuje měřit PVR, aby bylo možné odhalit jeho případný nárůst nebo vznik močové retence.
3.3. Operační léčba
3.3.1. Transuretrální resekce a transuretrální incize prostaty
3.3.1.1. Mechanizmus účinku
Technika transuretrální resekce prostaty (TURP) spočívá v odstranění tkáně z přechodové zóny prostaty s cílem léčit LUTS vyvolané BPO. TURP je stále považována za standardní operační techniku pro léčbu LUTS v důsledku BPO u mužů s prostatou o objemu ≤ 80 ml.
Transuretrální incize prostaty (TUIP) umožňuje uvolnit BPO proříznutím výtoku z močového měchýře bez odstranění tkáně.
3.3.1.2. Účinnost
Metaanalýza 29 RCT z roku 1999 prokázala, že TURP vede ke zmírnění LUTS průměrně o 70,6 % a zvýšení Qmax průměrně o 125 % [79]. V nedávné době provedená analýza 20 současných RCT publikovaných v období 2005–2009 s maximální dobou sledování 5 let prokazuje, že TURP vede k podstatnému zvýšení průměrné hodnoty Qmax (+162 %), významnému poklesu IPSS skóre (–70 %), průměrného skóre QoL (–69 %) a průměrné hodnoty PVR (–77 %) [80]. TURP rovněž dosahuje trvalých klinických výsledků. Jedna studie s průměrnou dobou sledování 13 let uvádí po TURP významné a trvalé zlepšení většiny symptomů a zlepšení urodynamických parametrů, subjektivní i objektivní selhání léčby souviselo s hypoaktivitou detruzoru spíše než s recidivou BPO [81].
Metaanalýza krátkodobých i dlouhodobých údajů z 10 RCT srovnávajících TUIP a TURP ukazuje srovnatelné zlepšení LUTS a menší (ovšem nikoli signifikantní) zvýšení Qmax u pacientů s malou prostatou bez zvětšených středních laloků léčených pomocí TUIP [82].
Metaanalýza šesti studií prokázala, že opakovaná operace je častěji nutná po TUIP (18,4 %) než po TURP (7,2 %) (relativní riziko 2,40) [82].
3.3.1.3. Tolerance a bezpečnost
Peroperační komplikace zahrnují mortalitu během prvních 30 dnů (0,1 % po TURP), TUR syndrom (< 1,1 % po TURP a 0 % po TUIP), a transfuzi krve (8,6 % při TURP a zanedbatelné procento při TUIP) [79]. Podobné výsledky týkající se výskytu komplikací při TURP popisuje analýza současných RCT s TURP jako srovnávací metodou: krvácení vyžadující transfuzi 2 % (rozmezí 0–9 %), TUR syndrom 0,8 % (rozmezí 0–5 %), AUR 4,5 % (rozmezí 0–13,3 %), retence způsobená krevními koaguly 4,9 % (rozmezí 0–39 %), a infekce močových cest (UTI) 4,1 % (rozmezí 0–22 %) [80].
Dlouhodobé komplikace zahrnují močovou inkontinenci (1,8 % po TUIP a 2,2 % po TURP), retenci moči a UTIs, stenózu hrdla močového měchýře (4,7 % po TURP), uretrální strikturu (3,8 % po TURP a 4,1 % po TUIP), retrográdní ejakulaci (65,4 % po TURP a 18,2 % po TUIP) a erektilní dysfunkci (6,5 % po TURP) [79].
3.3.1.4. Praktické úvahy
TURP i TUIP jsou účinnými metodami pro primární léčbu mužů se středně závažnými až závažnými LUTS v důsledku BPO. Volba mezi TURP a TUIP by měla primárně vycházet z objemu prostaty, přičemž u prostat < 30 ml se upřednostňuje zejména TUIP a u prostat o objemu 30–80 ml naopak TURP. Případnou UTI je nutné vyléčit před výkonem (TUIP i TURP) [83].
Míra výskytu komplikací se zvyšuje spolu s velikostí prostaty, žádná studie však dosud neuvádí optimální hraniční hodnotu [84]. Horní hranice závisí na zkušenosti operatéra, obvykle se doporučuje 80 ml.
3.3.2. Modifikace transuretrální resekce prostaty: bipolární resekce
3.3.2.1. Mechanizmus účinku
Bipolární TURP (B-TURP) řeší zásadní nedostatek monopolární TURP (M-TURP) díky tomu, že užívá irigaci pomocí normálního fyziologického roztoku (NaCl 0,9 %). Na rozdíl od M-TURP systémů, energie v B-TURP systémech neprochází celým tělem, aby dosáhla podložky lokalizované na kůži pacienta. Bipolární oblouk vzniká v místě resekce mezi aktivní a pasivní elektrodou, jež se nacházejí na smyčce resektoskopu [85].
3.3.2.2. Účinnost a bezpečnost
B-TURP je nejvíce a nepodrobněji prozkoumanou alternativou k M-TURP. Metaanalýza vycházející ze 17 RCT [86] dospěla k závěru, že v krátkodobém horizontu (až do 12 měsíců) neexistují mezi oběma technikami žádné klinicky významné rozdíly s ohledem na účinnost, vznik uretrální striktury ani kontraktury hrdla močového měchýře, ovšem technika B-TURP je preferována vzhledem k příznivějšímu peroperačnímu bezpečnostnímu profilu (eliminace transuretrálního syndromu), méně rozsáhlému krvácení (tj. menší výskyt retence způsobené krevními koaguly a nižší míra krevní transfuze), kratší době irigace, katetrizace a případně i kratší hospitalizaci [86].
Tyto závěry podpořily další dvě metaanalýzy vycházející z RCT [80,87], které i navzdory nižší kvalitě studií představují spolehlivý zdroj informací, založený na nejlepších v současné době dostupných důkazech.
Nejnovější aktualizace [88] metaanalýz identifikovala dalších 16 RCT publikovaných v uplynulých 3 letech (33 RCT, 3 601 randomizovaných pacientů celkem). V současné době očekáváme souhrn výsledků, žádná z RCT však neuvádí benefit M-TURP v žádném z hodnocených aspektů [88].
Výskyt střednědobých, krátkodobých a peroperačních komplikací se mezi jednotlivými větvemi studie významně nelišil [89–91]. Celková sexuální funkce, účinnost i všechny ostatní sekundární výsledky byly během sledování srovnatelné [89–91].
Dosud publikovaných 7 RCT s intervalem sledování delším než 12 měsíců (rozmezí 18–60 měsíců) neprokázalo ve střednědobém horizontu mezi B-TURP a M-TURP žádný rozdíl s ohledem na IPSS ani Qmax [90,92–97].
3.3.2.3. Praktické úvahy
B-TURP nabízí lákavou alternativu k monopolární TURP u pacientů se středně závažnými až závažnými symptomy LUTS v důsledku BPO, která vykazuje srovnatelnou účinnost, ovšem při nižší morbiditě [86]. Trvalou povahu zlepšení, jež B-TURP poskytuje, popisuje řada RCT s délkou sledování > 12 měsíců. Střednědobé výsledky (až 5 let) týkající se bezpečnosti/účinnosti B-TURP jsou srovnatelné s M-TURP.
Volba techniky B-TURP by měla v současné době vycházet z dostupnosti nástrojů pro bipolární TURP, zkušenosti chirurga a preferencí pacienta.
3.3.3. Otevřená prostatektomie
3.3.3.1. Mechanizmus účinku
Otevřená prostatektomie je nejstarší operační metodou pro léčbu středně závažných až závažných symptomů LUTS v důsledku BPO. Odstranění prostatické tkáně vede k uvolnění BPO a následně tedy i zlepšení LUTS.
3.3.3.2. Účinnost
Otevřená prostatektomie vede ke zlepšení LUTS o 63–86 % (12,5–23,3 IPSS bodů), zlepšení skóre IPSS-QoL o 60–87 %, průměrnému zvýšení Qmax o 375 % (rozmezí: 88–677 %; v absolutních hodnotách: +16,5–20,2 ml/s), a redukci PVR o 86–98 % [98,99]. Účinek zůstal zachován i po sledování delším než 5 let.
3.3.3.3. Tolerance a bezpečnost
Peroperační komplikace zahrnovaly mortalitu (< 0,25 % v současných studiích) a krevní transfuzi (7–14 %) [98,99]. Mezi dlouhodobé komplikace patří močová inkontinence (≤ 10 %) a stenóza hrdla močového měchýře nebo uretrální striktura (přibližně 6 %) [98,100].
3.3.3.4. Praktické úvahy
Otevřená prostatektomie je nejinvazivnější, ale zároveň nejúčinnější a nejtrvanlivější metodou léčby symptomů LUTS v důsledku BPO. Obdobné výsledky, ovšem s nižší morbiditou, přináší pouze enukleace holmium laserem [98–100]. Pakliže nejsou k dispozici endourologické nástroje ani holmium laser, zdá se být otevřená prostatektomie léčebnou metodou volby pro muže s prostatou > 80 ml s absolutní indikací pro operační léčbu a pacienty se středně závažnými až závažnými LUTS v důsledku BPO, u nichž nemá medikamentózní léčba dostatečný efekt.
3.3.4. Transuretrální terapie pomocí mikrovln
3.3.4.1. Mechanizmus účinku
Základním principem mikrovlnné termoterapie prostaty je vysílaní mikrovlnného záření prostřednictvím intrauretrální antény, kterou se do prostaty přivádí teplo, což vede k destrukci tkáně, apoptóze a denervaci alfa receptorů, v důsledku čehož dochází k uvolnění BPO a zmírnění LUTS.
3.3.4.2. Účinnost
Ačkoli jedna randomizovaná kontrolovaná studie prokázala po pěti letech srovnatelné klinické výsledky po TUMT i TURP [101), systematický přehled studií nasvědčuje tomu, že TUMT je s ohledem na redukci LUTS méně účinná než TURP [102]. Po 12 měsících došlo u pacientů po TUMT k průměrnému poklesu symptom skóre o 65 % a u pacientů po TURP o 77 %. Vážený průměrný rozdíl tedy činí –1,0 ve prospěch TURP. TURP rovněž dosáhla významnějšího zlepšení Qmax (119 %) než TUMT (70 %), vážený průměrný rozdíl tedy činí 5,08 ml/s ve prospěch TURP [102]. TUMT byla navíc spojena s vyšším rizikem opakované léčby z důvodu symptomů BPH.
Ve studii srovnávající TUMT s aplikací alfa blokátorů vedla TUMT ke zlepšení symptom skóre IPSS (vážený průměrný rozdíl –4,20) a maximálního průtoku moči (vážený průměrný rozdíl 2,30 ml/s) [102].
3.3.4.3. Tolerance a bezpečnost
Léčba je pacienty dobře snášena, ačkoli většina pacientů pociťuje dyskomfort v perineální oblasti a močovou urgenci a před terapií nebo během ní je nutné aplikovat analgetika. Systematický přehled randomizovaných kontrolovaných studií z databáze Cochrane, jež srovnávají TURP a TUMT, prokázal, že doba katetrizace, incidence dysurie/urgence a močové retence byly významně nižší u pacientů podstupujících TURP, zatímco nutnost hospitalizace, incidence hematurie, retence krevních sraženin, transfuze, syndrom transuretrální resekce (TUR) a incidence uretrální striktury byly významně méně časté u pacientů podstupujících TUMT [102]. Incidence sexuální dysfunkce a míra opakování operace z důvodu striktury meatu, močové trubice nebo hrdla močového měchýře byly vyšší po TURP než po TUMT.
3.3.4.4. Praktické úvahy
Endoskopické vyšetření před TUMT je nezbytné, neboť je důležité určit přítomnost středního laloku prostaty nebo nedostatečnou délku prostatické uretry. Uváděná nízká per - i pooperační morbidita a absence nutnosti anestezie činí z techniky TUMT skutečně ambulantní výkon, který představuje alternativu pro starší pacienty s komorbiditami, a pacienty, pro něž anestezie představuje velké riziko a kteří nejsou vhodnými kandidáty pro invazivní léčbu [103].
Nezávislé výchozí parametry predikující nepříznivý výsledek zahrnují malý objem prostaty, mírně až středně závažnou obstrukci výtoku z močového měchýře a nízkou hladinu energie aplikované během léčby [104]. Prediktivní faktory pro konkrétní zařízení se nemusejí nezbytně vztahovat na systémy jiných výrobců.
3.3.5. Transuretrální ablace jehlou
3.3.5.1. Mechanizmus účinku
Transuretrální ablace prostaty pomocí jehly (TUNA) spočívá v aplikaci slabých radiofrekvenčních vln do parenchymu v prostatě prostřednictvím transuretrálně zavedených jehel. Tato energie způsobuje koagulační nekrózu v přechodové zóně prostaty, což vede ke zmenšení objemu prostaty a uvolnění/vymizení BPO.
3.3.5.2. Účinnost
Metaanalýza dvou randomizovaných studií a dvou nerandomizovaných protokolů a deseti studií s jedinou větví testujících TUNA prokázala, že po jednom roce léčby TUNA dosahuje 50% poklesu průměrného skóre IPSS a 70% zvýšení Qmax oproti počátečnímu stavu (105].
Poslední metaanalýza 35 studií (9 komparativních a 26 nekomparativních studií) tyto výsledky potvrzuje [106]. TUNA významně zlepšuje IPSS a Qmax (oproti počátečnímu stavu), ve srovnání s TURP po 12 měsících bylo toto zlepšení významně menší. Rozdíl průměrných hodnot mezi TURP a TUNA činil –4,72 pro IPSS a 5,9 ml/s pro Qmax [106]. TUNA je oproti TURP spojena s významně vyšší mírou opakování výkonu (poměr rizik [OR]: 7,44 [2,47–22,43]). Na základě 17 nekomparativních studií bylo spočítáno, že celková míra opakování výkonu v případě TUNA činila 19,1 % (95%CI 18,7–39,7) [106].
3.3.5.3. Tolerance a bezpečnost
U 13–42 % pacientů se po operaci vyskytuje močová retence, která přetrvá po dobu 1–3 dnů. Během jednoho týdne je katetr odstraněn u 90–95 % pacientů [107].
Během prvních 4–6 týdnů po operaci je běžný výskyt jímacích symptomů [108]. TUNA je oproti TURP spojena s méně vedlejšími účinky. Nežádoucí účinky mohou zahrnovat slabou hematurii, močovou infekci, strikturu, inkontinenci, erektilní dysfunkci a poruchy ejakulace (OR 0,14; 95% CI 0,05–0,41) [106].
3.3.5.4. Praktické úvahy
TUNA se provádí ambulantně v lokální anestezii nebo sedaci. TUNA není vhodná pro pacienty s objemem prostaty > 75 ml ani pro pacienty s izolovanou obstrukcí hrdla močového měchýře. Jelikož technikou TUNA nelze účinně léčit střední laloky prostaty, není jasné, zda budou mít muži se středními laloky větší velikosti z této léčby benefit.
3.3.6. Laserová léčba prostaty
3.3.6.1. Enukleace prostaty pomocí holmium laseru nebo resekce
3.3.6.1.1. Mechanizmus účinku
Holmium:yttrium-aluminium-garnet (Ho:YAG) laser o vlnové délce 2 140 nm je pulzní pevný laser, který je rychle absorbován vodou a vodu obsahujícími tkáněmi. Resekce prostaty pomocí holmium laseru (HoLRP) a enukleace prostaty pomocí holmium laseru (HoLEP) vede k uvolnění BPO a sekundárně k redukci LUTS.
3.3.6.1.2. Účinnost
Metaanalýza studií srovnávajících HoLRP a TURP neprokázala 6 ani 12 měsíců po operaci žádný rozdíl ve zlepšení symptomů, HoLRP však ve srovnání s TURP vedla k významnějšímu zvýšení Qmax (vážený průměrný rozdíl 4,8 ml/s) [109]. Randomizovaná kontrolovaná studie srovnávající TURP s HoLRP (s minimálně 4 lety sledování) neprokázala mezi oběma technikami 48 měsíců po operaci žádný rozdíl v urodynamických parametrech [110].
Tři metaanalýzy randomizovaných kontrolovaných studií srovnávajících HoLEP a TURP [111–113] uvádějí, že laserová operace trvá významně delší dobu. Zlepšení symptomů bylo srovnatelné, případně ve prospěch HoLEP. Při HoLEP byl rovněž zaznamenán významně vyšší Qmax po 12 měsících [111–113]. Jedna randomizovaná kontrolovaná studie srovnávající fotoselektivní vaporizaci prostaty (PVP) a HoLEP u pacientů s prostatou o objemu > 60 ml prokázala srovnatelné zlepšení symptomů ovšem významně vyšší rychlost průtoku moči a menší PVR po HoLEP [114].
Dostupné randomizované, kontrolované studie ukazují, že při léčbě velkých prostat dosahuje HoLEP s ohledem na zlepšení mikce stejného účinku jako otevřená prostatektomie [98,100], a je spojena se stejně nízkou mírou opakování operace po 5 letech (5 % vs 6,7 %) [98].
Jedna randomizovaná kontrolovaná studie srovnávající HoLEP s TURP u malého počtu pacientů, kteří dokončili sedm let sledování, prokázala, že funkční dlouhodobé výsledky HoLEP jsou srovnatelné s TURP, žádný pacient léčený pomocí HoLEP nevyžadoval opakovanou operaci z důvodu recidivy BPH [115]. Retrospektivní studie zahrnující 949 pacientů léčených pomocí HoLEP s dosud nejdelší dobou sledování (až 10 let, průměrná délka sledování 62 měsíců) uvádí trvalé funkční výsledky. Kontraktura hrdla močového měchýře se vyskytla u 0,8 % pacientů, uretrální striktura u 1,6 % pacientů a opakovaná operace z důvodu reziduálního adenomu byla nutná u 0,7 % pacientů [116].
3.3.6.1.3. Tolerance a bezpečnost
Nejsou popsány žádné významné peroperační komplikace. Metaaalýza neprokázala žádný významný rozdíl s ohledem na výskyt následujících komplikací mezi HoLEP a TURP: uretrální striktura (2,6 % vs 4,4 %), stresová inkontinence (1,5 % vs 1,5 %; p = 0,980), a opakovaná operace (4,3 % vs 8,8 %; p = 0,059) [112]. Data z velké studie (celkem 1 847 pacientů) ukazují nízkou míru výskytu komplikací: peroperační mortalita (0,05 %), transfuze (1 %), UTI (2,3 %), uretrální striktura/kontraktura hrdla močového měchýře (3,2 %), opakovaná operace (2,8 %) [117].
Tuto léčbu mohou bezpečně podstoupit rovněž pacienti užívající antikoagulancia i pacienti s močovou retencí [118,119]. Tři metaanalýzy prokázaly, že HoLEP je spojena s významně kratší dobou katetrizace a hospitalizace, menší krevní ztrátou [111–113] a menší potřebou krevní transfuze než TURP [112,113]. Podobně i dostupné randomizované kontrolované studie prokazují, že HoLEP dosahuje lepších výsledků než otevřená prostatektomie s ohledem na krevní ztrátu, délku katetrizace a délku hospitalizace [98,100].
3.3.6.1.4. Praktické úvahy
Operace s pomocí holmium laseru vyžadují značné zkušenosti a patřičnou endoskopickou zručnost. Zkušenost operatéra byla nejvýznamnějším faktorem ovlivňujícím celkovou incidenci komplikací [120,121].
3.3.6.2. Laserová vaporizace prostaty pomocí 532nm GreenLight laseru
3.3.6.2.1. Mechanizmus účinku
Kalium-titanyl-fosfátový (KTP) i litium-triborátový (LBO) laser jsou odvozeny od neodymium: YAG (Nd: YAG) laseru. Přidání KTP nebo LBO krystalu do rezonátoru laseru převádí vlnovou délku Nd: YAG z 1 064 nm na 532 nm, a laserová energie je v tkáni absorbována hemoglobinem (jenž účinkuje jako buněčný chromofór), a nikoli vodou.
Vaporizace vede k okamžitému odstranění prostatické tkáně, uvolnění BPO, a sekundárně rovněž ke zmírnění LUTS. V roce 2013 jsou k dispozici tři různé typy GreenLight laseru: 80W (KTP), 120W HPS (LBO) a 180W XPS (LBO) laserový systém. Liší se maximálním výkonem, designem vlákna a maximální aplikovanou energií.
3.3.6.2.2. Účinnost
V roce 2012 byla provedena metaanalýza 9 dostupných randomizovaných kontrolovaných studií srovnávajících PVP s užitím 80W a 120W laseru s TURP [122]. Mezi PVP a TURP nebyly zjištěny žádné rozdíly s ohledem na Qmax a IPSS, ovšem pouze tři studie [123–125] zahrnovaly adekvátní údaje pro metaanalýzu po 12 měsících sledování.
RCT s nejdelší dobou sledování testující 80W KTP laser zahrnuje sledovací interval pouze 12 měsíců [123]. Studie zahrnující 246 pacientů, kteří dokončili interval sledování 5 let, prokázala, že léčba pomocí 80W KTP laseru dosahuje trvalých funkčních výsledků. Po pěti letech činila celková míra opakování operace 8,9 %, 7,7 % pacientů vyžadovalo opakovanou léčbu z důvodu recidivujícího adenomu a 1,2 % pacientů kvůli kontraktuře hrdla močového měchýře [126].
V další studii zahrnující 500 pacientů léčených pomocí 80W laseru s průměrnou dobou sledování 30,6 měsíce (5,2–60,6 měsíce) vyžadovalo opakovanou léčbu 14,8 % pacientů: z důvodu recidivujícího nebo přetrvávajícího adenomu (6,8 %), striktury hrdla močového měchýře (3,6 %) nebo uretrální striktury (4,4 %) [127].
Nejdelší RCT srovnávající léčbu pomocí 120W HPS laseru s TURP se sledováním 36 měsíců prokázala srovnatelné zlepšení IPSS, Qmax a PVR, ačkoli u pacientů léčených pomocí TURP došlo k významnější procentuální redukci hladiny PSA a objemu prostaty. Míra opakování operace byla významně vyšší po PVP (11 % vs 1,8 %; p = 0,04) [128]. Podobné zlepšení IPSS, QoL, Qmax nebo urodynamických parametrů popisují další dvě RCT s maximální dobou sledování 24 měsíců [124,129].
Do ukončení vyhledávání článků pro tento dokument nebyla publikována žádná RCT testující léčbu pomocí 180W GreenLight laseru.
Multicentrická studie testující 180W laser prokázala srovnatelnou bezpečnost a zlepšení symptomů jako předchozí systémy užívající GreenLight laser [130].
Byla popsána transuretrální enukleace prostaty pomocí 120W 532nm HPS GreenLight laseru v kombinaci s 600Ķm vláknem s boční aplikací laseru [131].
3.3.6.2.3. Tolerance a bezpečnost
Metaanalýza RCT srovnávající 80W a 120W laser s TURP prokázala, že PVP je spojena s významně delším trváním výkonu, ovšem významně kratší katetrizací i kratší délkou hospitalizace [122].
PVP je rovněž spojena s menší potřebou krevní transfuze a méně častým vznikem retence z důvodu krevní sraženiny. S ohledem na výskyt močové retence po operaci, infekce, stenózy meatu, uretrální striktury ani kontraktury hrdla močového měchýře nebyl mezi oběma metodami zaznamenán žádný rozdíl [122]. Bezpečnost u pacientů užívajících perorální antikoagulancia, pacientů s močovou retencí nebo prostatou o velikosti > 80 ml byla prokázána v prospektivních nerandomizovaných studiích [131–137].
3.3.6.4 Praktické úvahy
Vývoj laserových systémů GreenLight laseru z 80W na 120W a poté na 180W systémy vedl k významným rozdílům ve stupni zdokonalení jednotlivých terapií. V současné době očekáváme dlouhodobé výsledky léčby pomocí 120W systému a RCT testujících 180W systémy.
3.3.6.3. Vaporizace prostaty pomocí diodového laseru
3.3.6.3.1. Mechanizmus účinku
V diodovém laseru je laserový paprsek generován pomocí polovodiče, na jehož materiálu závisí vlnová délka paprsku. Pro léčbu prostaty jsou k dispozici diodové lasery o vlnových délkách 940 nm, 980 nm, 1318 nm, a 1 470 nm, které jsou absorbovány vodou i hemoglobinem [138]. V závislosti na vlnové délce, výkonu laseru a designu vlákna lze diodové lasery užívat pro vaporizaci v nekontaktním i kontaktním módu a enukleaci.
3.3.6.3.2. Účinnost
Zásadní nedostatek všech studií testujících vaporizaci prostaty pomocí diodového laseru spočívá (oproti studiím zabývajícím se TURP nebo otevřenou prostatektomií) v absenci randomizovaného kontrolovaného designu a krátké době sledování (až 12 měsíců). K dispozici jsou dvě případové studie a dvě komparativní studie srovnávající 980nm diodový laser a 120W HPS laser [139–148].
Všechny studie testující léčbu pomocí diodového laseru prokázaly významné zlepšení IPSS, QoL, Qmax i PVR (ve srovnání s počáteční hodnotou). Zlepšení IPSS, QoL, Qmax i PVR bylo po 6 i 12 měsících srovnatelné se 120W HPS laserem [139,142].
Malá RCT srovnávající laserovou enukleaci pomocí 1 318nm diodového laseru s B-TURP zahrnující 6měsíční sledování uvádí srovnatelnou účinnost i bezpečnost obou metod (149]. Délka operace, krevní ztráta, délka katetrizace i hospitalizace hovoří ve prospěch laserové enukleace.
3.3.6.3.3. Tolerance a bezpečnost
Studie testující diodové lasery prokazují vysokou peroperační bezpečnost. Při užití 980nm diodového laseru nebyl zaznamenán žádný výskyt peroperačního krvácení, zatímco při aplikaci 120W HPS laseru se krvácení vyskytlo u 11 % a 13 % pacientů [139,142].
Je zajímavé, že v těchto dvou studiích užívalo ve skupině léčené pomocí diodového laseru 23,6 % pacientů antikoagulancia a 52 % pacientů inhibitory agregace trombocytů, zatímco ve skupině léčené pomocí 1 470nm diodového laseru užívalo odpovídající medikaci 25 % a 43 % pacientů [139,142].
Srovnatelné hemostatické vlastnosti byly zaznamenány rovněž při užití 1 470nm diodového laseru [145]. Po operaci s užitím 980nm diodového laseru byla zaznamenána významně vyšší míra výskytu dysurie v důsledku odlučující se tkáně než u pacientů po léčbě pomocí 120W HPS laseru [139,142]. Modifikace 980nm diodového laserového vlákna pomocí krystalu křemene vedla k významnému snížení incidence dysurie přetrvávající déle než 1 měsíc: ze 42 % na 17 % [146]. Opakovaná operace z důvodu striktury hrdla močového měchýře a obstrukční nekrotické tkáně (33 % vs 4 %) a přetrvávající močová inkontinence (9,1 % vs 0 %) byly významně častější po výkonu s užitím 980nm diodového laseru než při užití 120W HPS laseru [139,142].
Naopak dvě studie testující 980nm diodový laser nezaznamenaly žádný případ opakování operace, ovšem pouze po 3 a 6 měsících sledování [143,148]. Po léčbě pomocí 1 470nm diodového laseru byl opakovaný výkon nutný u 2 z 10 pacientů [145].
3.3.6.3.4. Praktické úvahy
Léčba pomocí diodového laseru vede k okamžitému zlepšení (subjektivnímu i objektivnímu) LUTS v důsledku BPO a díky svým hemostatickým vlastnostem je pravděpodobně bezpečná. Vzhledem ke krátkému intervalu sledování v jednotlivých studiích, absenci randomizovaných kontrolovaných studií srovnávajících tuto léčbu s TURP nebo otevřenou prostatektomií a rozporuplným údajům týkajícím se míry opakování operace, nelze léčbu pomocí diodového laseru doporučit jako standardní modalitu pro léčbu BPO.
3.3.6.4. Thulium:yttrium-aluminium-garnet laser
3.3.6.4.1 Mechanizmus účinku
Thulium:YAG (Tm:YAG) laser vyzařuje kontinuální paprsek o vlnové délce přibližně 2 000 nm. Cílovým chromoforem je voda. Tento laser se primárně užívá v aplikacích s předním vyzařováním, výkon kontinuálního paprsku Tm:YAG laseru umožňuje hladkou incizi tkáně [138]. Dosud byly popsány čtyři různé techniky: Tm:YAG vaporizace prostaty (ThuVaP), Tm:YAG vaporesekce (ThuVaRP), Tm:YAG vapoenukleace (ThuVEP), a Tm:YAG laserová enukleace prostaty (ThuLEP). ThuVEP navazuje na techniku HoLEP, ThuLEP spočívá zejména v tupé preparaci tkáně prostaty.
3.3.6.4.2. Účinnost
Zásadní nedostatek všech studií testujících léčbu pomocí thuliového laseru spočívá v absenci randomizovaných kontrolovaných studií, které by srovnávaly tuto metodu s TURP nebo otevřenou prostatektomií. V současné době nemáme k dispozici žádné informace o sledování delším než 18 měsíců.
Jedna RCT a jedna nerandomizovaná studie srovnávají ThuVaRP s M-TURP [150,151]; před nedávnem byla publikována studie srovnávající ThuVaRP a B-TURP [152]. Všechny tyto studie prokazují srovnatelné zlepšení symptomů i mikčních parametrů.
K dispozici je pouze několik studií testujících ThuVEP, které prokazují významné zlepšení IPSS, Qmax a PVR [153–156].
Zajímavým zjištěním je skutečnost, že komparativní studie prokázala, že 120W a 200W ThuVEP dosahuje po 12 měsících sledování srovnatelné účinnosti a bezpečnosti [155].
Jedna RCT zahrnující 18měsíční sledování srovnává ThuLEP a HoLEP [157]. Studie popisuje trvalé zlepšení symptomů, zvýšení Qmax i redukci PVR. Tyto výsledky byly srovnatelné po léčbě pomocí ThuLEP i HoLEP [157].
3.3.6.4.3. Tolerance a bezpečnost
Randomizované kontrolované studie [150,152,157] testující prostatektomii pomocí thuliového laseru a studie zahrnující pacienty s velkou prostatou [153] a pacienty užívající antikoagulancia a pacienty s poruchami krvácivosti [154] vykazují vysokou peroperační bezpečnost.
Délka katetrizace, hospitalizace a krevní ztráta byly významně příznivější oproti TURP [150–152].
Jedna RCT uvádí delší trvání operace při ThuLEP než při HoLEP, ThuLEP byla naopak spojena s menší krevní ztrátou [157]. Během 9–12měsíčního sledování pacientů po ThuVaRP činila míra vzniku uretrální striktury po výkonu 1,9 %, kontraktury hrdla močového měchýře 1,8 %, a míra opakování operace se uvádí v rozmezí 0–7,1 % [150,151,158]. Po léčbě pomocí ThuVEP se uretrální striktura vyskytla u 1,6 % pacientů a celková míra opakování operace po průměrně 16,5 měsících sledování činila 3,4 % [159]. Po ThuLEP nebyl v průběhu 18měsíčního sledování zaznamenán žádný případ uretrální striktury ani striktury hrdla močového měchýře [157].
3.3.6.4.4. Praktické úvahy
Malý počet RCT, které hodnotí využití thuliového laseru v rámci operační léčby BPO, a krátká doba sledování (do 18 měsíců) neumožňují vyvodit žádné definitivní závěry o dlouhodobé účinnosti prostatektomie pomocí thuliového laseru.
3.3.7. Prostatické stenty
3.3.7.1. Mechanizmus účinku
Stenty jsou tenké trubičky, které se zavádějí (přechodně i natrvalo) do prostatické močové trubice s cílem stlačit tkáň prostaty a otevřít výtok z močového měchýře. Bezprostředně po zavedení stentu dochází k uvolnění BPO. Pro zavedení prostatického stentu je nutný funkční detruzor.
3.3.7.2. Účinnost
Hlavním zástupcem permanentních stentů je endouretrální protéza UroLume. Systematický přehled identifikoval celkem 20 studií s celkem 990 pacienty, kterým byl zaveden stent UroLume (160]. Tyto studie s různou délkou sledování uvádějí relevantní zmírnění symptomů – byl zaznamenán pokles IPSS o 10–12,4 bodu [160]. Kromě toho se po zavedení stentu zvýšil průměrný Qmax o 4,2–13,1 ml/s.
Nejlepší údaje o neepitelizujících prostatických stentech poskytuje systematický přehled účinnosti stentu Memokath – samoexpandibilního kovového prostatického stentu [161]. Celkem bylo přezkoumáno 14 studií s 839 pacienty. Zavedení stentu Memokath je spojeno se snížením skóre IPSS o 11–19 bodů. Je však třeba poznamenat, že hodnocení bylo prováděno v různou dobu po zavedení stentu. Obdobně vedlo zavedení stentu ke zvýšení Qmax o 3–11 ml/s [161].
3.3.7.3. Tolerance a bezpečnost
Obecně je zaváděni stentů spojeno s rizikem špatného umístění, migrace a špatné snášenlivosti z důvodu zhoršení symptomů LUTS a inkrustace [162]. Mezi hlavní nežádoucí účinky, které se objevují bezprostředně po zavedení stentu, patří bolest v perineální oblasti a jímací symptomy.
V případě, že dojde k migraci stentu, inkrustaci nebo jeho zarůstání do epitelu, může být vyjmutí stentu obtížné a obvykle vyžaduje celkovou anestezii. Přechodný stent se odstraňuje zatažením za ligaturu sloužící k jeho odstranění až do jeho úplného vytažení, nebo pomocí grasperu pod endoskopickou navigací.
3.3.7.4. Praktické úvahy
Vzhledem k vedlejším účinkům a vysoké míře migrace stentu mají stenty při léčbě středně závažných až závažných LUTS v důsledku BPO pouze omezenou roli. Prostatické stenty zůstávají alternativou k transuretrální katetrizaci u mužů s recidivující močovou retencí a mužů, pro něž je operace vysoce riziková. Přechodné stenty mohou poskytovat krátkodobou úlevu LUTS v důsledku BPO u pacientů, kteří nejsou vhodnými kandidáty pro operační léčbu, a pacientů, kteří podstoupili minimálně invazivní léčbu [162].
3.3.8. Nové metody operační léčby
3.3.8.1. Injekce etanolu do prostaty
3.3.8.1.1. Mechanizmus účinku
Absolutní (bezvodý, 95–98%) etanol se injekčně aplikuje do parenchymu prostaty. Etanol vyvolává zánět, koagulační nekrózu s denaturací proteinů a lýzou buněčné membrány, a nakonec atrofii a ablaci prostatické tkáně vedoucí k tvorbě kavity a uvolnění BPO. Přesný mechanizmus účinku však není zatím znám.
3.3.8.1.2. Účinnost
Otevřené studie s průměrnou dobou sledování 3–54 měsíců prokazují významnou redukci symptomů (pokles IPSS o 40–71 %, nebo 6,7–16,5 bodu) a snížení PVR (až o 99 %, nebo 286 ml) a rovněž významné zvýšení Qmax (35–155 %, nebo 3,2–11 ml/s) a zlepšení QoL (IPSS-QoL) [163–165]. Nebyly však identifikovány žádné parametry predikující účinnost léčby ani souvislost mezi velikostí dávky a stupněm účinku. Několik studií prokázalo během prvního roku po léčbě poměrně vysoký počet případů opakování léčby, jedna studie uvádí po třech letech 41% míru opakování operace [166].
3.3.8.1.3. Tolerance a bezpečnost
Lze zvážit provedení lokální anestezie v kombinaci se sedací, většina pacientů však volí regionální či celkovou anestezii. Mezi nejčastější nežádoucí účinky patří dyskomfort/bolest v oblasti perinea nebo břicha, jímací symptomy (≤ 40 %), hematurie (≤ 40 %), UTI nebo epididymitida a močová retence. Byly popsány dva případy závažných komplikací – nekróza močového měchýře vyžadující cystektomii a derivaci moči [163].
3.3.8.1.4. Praktické úvahy
Injekční aplikace etanolu do prostaty je považována za minimálně invazivní léčebnou možnost pro pacienty s mírně závažnými až závažnými LUTS v důsledku BPO. Mechanizmus účinku, princip výběru pacientů a způsob aplikace etanolu (počet míst aplikace a objem) zatím nebyly dobře prostudovány. U některých pacientů se vyskytly závažné nežádoucí účinky [163] a je k dispozici jen velmi málo dlouhodobých údajů. Injekční aplikace etanolu do prostaty se tedy stále považuje za experimentální metodu, která by měla být užívána pouze v rámci studií.
Je třeba provést randomizované kontrolované studie s dlouhodobým sledováním, které by srovnávaly injekční aplikaci etanolu s technikou TURP, jinými minimálně invazivními postupy nebo medikamentózní léčbou, aby bylo možné odpovídajícím způsobem posoudit hodnotu této léčebné modality.
3.3.8.2. Injekce botulotoxinu do prostaty
3.3.8.2.1. Mechanizmus účinku
Botulotoxin (BTX) je nejsilnějším neurotoxinem známým u člověka. Botulotoxin A (BoNTA) přímo nebo nepřímo zmírňuje LUTS díky tomu, že vyvolává apoptózu prostatických (epiteliálních) buněk, což vede k atrofii a redukci velikosti prostaty, inhibici senzorických neuronů v prostatě a redukci aferentních signálů do centrálního nervového systému a/nebo relaxaci buněk hladké svaloviny v prostatickém parenchymu a uvolnění BPO [167].
Downregulace alfa-1 adrenergních receptorů v prostatě může přispívat k relaxaci buněk hladkého svalstva [167]. Poslední dva mechanizmy lze stručně popsat jako chemickou denervaci, která může mít negativní vliv na růst prostaty.
3.3.8.2.2. Účinnost
Přehled dostupných RCT nebo prospektivních pozorovacích studií (až do roku 2010) zabývajících se injekční aplikací BoNTA do prostaty při léčbě LUTS/BPH prokázal zlepšení IPSS ve 20 studiích – toto snížení bylo klinicky významné ve 13 studiích [168]. Všechny studie rovněž prokazují zvýšení Qmax, jež dosáhlo statistické významnosti ve 14 z nich.
Rozsah zmenšení objemu prostaty se mezi jednotlivými studiemi liší, statisticky významná redukce byla zaznamenána v 18 studiích. Rozdílné výsledky byly rovněž zaznamenány s ohledem na trvání účinku, uvádí se rozmezí od 3 do 30 měsíců [168]. Z populace pacientů, kteří trpěli před aplikací BoNTA močovou retencí, byla většina pacientů schopna spontánní mikce během jednoho měsíce [168]. Dvě nové RCT srovnávající různé dávkování BoNTA nezaznamenaly mezi jednotlivými skupinami žádný rozdíl s ohledem na účinnost léčby [169,170].
Byly publikovány výsledky největší placebem kontrolované studie testující účinnost BoNTA v různém dávkování (100 U, 200 U a 300 U) u mužů s LUTS/BPH [171].
S ohledem na IPSS, QoL a Qmax nebyly ve 12. týdnu zaznamenány mezi BoNTA a placebem žádné významné rozdíly [171].
3.3.8.2.3. Tolerance a bezpečnost
BoNTA byl ve všech studiích pacienty dobře snášen. Hlavní uváděné komplikace, vyskytující se u 35 % pacientů v těchto studiích, zahrnovaly dysurii, hematurii, epididymitidu, prostatitidu, a další příhody 2–3 grade (blíže nespecifikované) [168]. Pacienti mohou navíc krátce po operaci (1 týden až 1 měsíc) vyžadovat zavedení transuretrálního katetru nebo provádět čistou intermitentní katetrizaci [171,172]. Intraprostatická injekce BoNTA u pacientů s BPE zřejmě nemá žádný vliv na sexuální funkci [168,173].
3.3.8.2.4. Praktické úvahy
Injekční aplikace BoNTA do prostatického parenchymu je slibnou a rychlou minimálně invazivní modalitou pro léčbu pacientů s nízkou morbiditou, pacientů, kteří nereagují na medikamentózní léčbu a pacienty s močovou retencí.
Pro adekvátní hodnocení aplikace BoNTA do prostaty v kontextu s dalšími dostupnými modalitami medikamentózní terapie nebo operační léčby LUTS/BPO je nezbytné provedení studií s větším počtem pacientů, s randomizací oproti aplikaci fyziologického roztoku, medikamentózní terapii, TURP nebo dalším minimálně invazivním modalitám, systematické hodnocení dávkování/ředění a dlouhodobé sledování pacientů.
3.4. Výběr pacientů
Výběr pacientů záleží na výsledcích vyšetření, schopnosti léčby ovlivnit tyto výsledky, preferencích jednotlivých pacientů a jejich očekávání s ohledem na rychlost nástupu léčby, účinnost, výskyt vedlejších účinků, QoL a progresi onemocnění (tab. 5). Kombinace jednotlivých modalit může vést k různým výsledkům léčby.
Prvním krokem je obvykle behaviorální terapie s nebo bez medikamentózní léčby.
Schéma 2 zobrazuje algoritmus možností léčby na základě medicíny založené na důkazech a profilů pacientů.
Schéma 2. Algoritmus pro medikamentózní a/nebo konzervativní léčbu symptomů dolních cest močových u mužů. Volba léčby závisí na výsledcích počátečního vyšetření (♦). Absence (Ne) nebo přítomnost (Ano) onemocnění jsou vyznačeny v kroužku (●). Preference pacienta mohou vést k volbě odlišné terapeutické modality. PDE5-I – inhibitor fosfodiesterázy typu 5 
V případě recidivující nebo refrakterní močové retence, paradoxní ischurie, recidivující UTI, konkrementů v močovém měchýři nebo divertiklu, makroskopické hematurie rezistentní na léčbu v důsledku BPH/BPE nebo dilatace horních cest močových v důsledku BPO, s i bez renální insuficience (absolutní indikace pro operační léčbu, nutná operace). Operační léčba je obvykle rovněž nezbytná u pacientů, u nichž konzervativní nebo medikamentózní léčba nevedla k dostatečné úlevě LUTS nebo zmenšení PVR (relativní indikace pro operační léčbu). Volba operační techniky závisí na velikosti prostaty, komorbiditách, schopnosti pacienta podstoupit anestezii, preferencích pacienta, jeho ochotě snášet nežádoucí účinky spojené s výkonem, technické vybavenosti centra a zkušenostech operatéra s danou technikou. Algoritmus pro operační léčbu je uveden ve schématu 3.
Schéma 3. Algoritmus pro léčbu obtížných symptomů dolních cest močových (LUTS) refrakterních na konzervativní/medikamentózní léčbu a symptomů u pacientů s absolutní indikací pro operační léčbu (např. močová retence, recidivující infekce močových cest, konkrementy v močovém měchýři nebo divertikl, makroskopická hematurie rezistentní na léčbu nebo dilatace horních cest močových v důsledku benigní prostatické obstrukce s nebo bez renální insuficience). Tento diagram byl seřazen podle schopnosti pacienta podstoupit anestezii, jeho kardiovaskulárního rizika a velikosti prostaty. Volba operační techniky však rovněž závisí na preferencích pacienta, jeho ochotě snášet nežádoucí účinky spojené s operací, technické vybavenosti a zkušenosti operatéra s operační technikou. HoLEP – laserová enukleace prostaty pomocí holmium laseru; laserová vaporizace zahrnuje vaporizaci pomocí GreenLight laseru, thuliového a diodového laseru; laserová enukleace zahrnuje enukleaci pomocí holmium a thuliového laseru; TUIP – transuretrální incize prostaty; TUMT – transuretrální terapie pomocí mikrovln; TUNA – transuretrální ablace prostaty pomocí jehly; TURP – transuretrální resekce prostaty (monopolární nebo bipolární) 
3.5. Sledování
Pacienti, kteří jsou zařazeni do programu pozorného vyčkávání, by měli podstoupit kontrolní vyšetření po 6 měsících a následně jednou ročně, pakliže nedojde ke zhoršení symptomů ani ke vzniku absolutních indikací pro operační léčbu.
Pacienti užívající alfa-1 blokátory, antagonisty muskarinového receptoru nebo kombinaci alfa-1 blokátorů s 5ARI či antagonisty muskarinového receptoru by měli být vyšetřeni po 4–6 týdnech po zahájení léčby pro posouzení účinku léčby. Pokud dojde k úlevě symptomů bez výskytu obtížných nežádoucích účinků, je možné v léčbě pokračovat. Pacienti by měli podstoupit kontrolní vyšetření po 6 měsících a následně jednou ročně, pakliže nedojde ke zhoršení symptomů ani ke vzniku absolutních indikací pro operační léčbu.
Pacienti užívající 5ARI by měli být vyšetřeni po 12 týdnech a 6 měsících po zahájení léčby pro posouzení účinku léčby a výskytu nežádoucích účinků. U pacientů užívajících 5ARI s očekávanou délkou života > 10 let a v případě, že diagnóza karcinomu prostaty může ovlivnit léčbu, je třeba pravidelně provádět PSA test. Po 6 měsících je třeba stanovit novou výchozí hladinu PSA a jakýkoli potvrzený nárůst PSA během léčby je třeba přezkoumat.
U pacientů užívajících desmopresin se doporučuje třetí a sedmý den po zahájení léčby a následně po jednom měsíci měřit hladinu sodíku v séru. Pokud zůstane koncentrace sodíku v normě, stačí vyšetření opakovat jednou za tři měsíce. Tuto sekvenci je třeba opakovat po jakémkoli zvýšení dávky.
Pacienti podstupující operaci prostaty by měli být vyšetřeni po 4–6 týdnech po vyjmutí katetru pro posouzení účinnosti léčby a výskytu nežádoucích účinků. Pokud dojde k úlevě symptomů bez výskytu obtížných nežádoucích účinků, není nutné provádět žádná další kontrolní vyšetření.
4. ZÁVĚR
Tato guidelines zaměřená na léčbu symptomů poskytují praktické návody pro léčbu pacientů s LUTS. Kompletní verze je k dispozici online (www.uroweb.org/gls/pdf/12_Male_LUTS.pdf).
Zdroje
1. Michel M, de la Rosette J. Medical treatment of lower urinary tract symptoms suggestive of benign prostatic hyperplasia. Eur Urol Suppl 2009; 8 : 496–503.
2. Madersbacher S, Alivizatos G, Nordling J et al. EAU 2004 guidelines on assessment, therapy and follow-up of men with lower urinary tract symptoms suggestive of benign prostatic obstruction (BPH guidelines). Eur Urol 2004; 46(5): 547–554.
3. Stöhrer M, Blok B, Castro-Diaz D et al. EAU guidelines on neurogenic lower urinary tract dysfunction. Eur Urol 2009; 56(1): 81–88.
4. Lucas MG, Bosch RJ, Burkhard FC et al. EAU guidelines on assessment and nonsurgical management of urinary incontinence. Eur Urol 2012; 62(6): 1130–1142.
5. Naber KG, Bergman B, Bishop MC et al. EAU guidelines for the management of urinary and male genital tract infections. Urinary Tract Infection (UTI) Working Group of the Health Care Office (HCO) of the European Association of Urology (EAU). Eur Urol 2001; 40(5): 576–588.
6. Preminger GM, Tiselius HG, Assimos DG et al. 2007 guideline for the management of ureteral calculi. J Urol 2007; 178(6): 2418–2434.
7. Babjuk M, Oosterlinck W, Sylvester R et al. EAU guidelines on non-muscle-invasive urothelial carcinoma of the bladder, the 2011 update. Eur Urol 2011; 59(6): 997–1008.
8. Oxford Centre for Evidence-based Medicine levels of evidence (March 2009). Centre for Evidence-based Medicine Web site. http://www.cebm.net/index.aspx?o=1025. Accessed November 2011.
9. Flanigan RC, Reda DJ, Wasson JH et al. 5-year outcome of surgical resection and watchful waiting for men with moderately symptomatic benign prostatic hyperplasia: a Department of Veterans Affairs cooperative study. J Urol 1998; 160(1): 12–16.
10. Netto NR Jr, de Lima ML, Netto MR et al. Evaluation of patients with bladder outlet obstruction and mild international prostate symptom score followed up by watchful waiting. Urology 1999; 53(2): 314–316.
11. Brown CT, Yap T, Cromwell DA et al. Self management for men with lower urinary tract symptoms: a randomised controlled trial. BMJ 2007; 334(7583): 25.
12. Yap TL, Brown C, Cromwell DA et al. The impact of self-management of lower urinary tract symptoms on frequency-volume chart measures. BJU Int 2009; 104(8): 1104–1108.
13. Michel MC, Vrydag W. Alpha1-, alpha2 - and beta-adrenoreceptors in the urinary bladder, urethra and prostate. Br J Pharmacol 2006; 147 (Suppl 2): S88–S119.
14. Djavan B, Chapple C, Milani S et al. State of the art on the efficacy and tolerability of alpha1-adrenoceptor antagonists in patients with lower urinary tract symptoms suggestive of benign prostatic hyperplasia. Urology 2004; 64(6): 1081–1088.
15. Michel MC, Mehlburger L, Bressel HU et al. Comparison of tamsulosin efficacy in subgroups of patients with lower urinary tract symptoms. Prostate Cancer Prostatic Dis 1998; 1(6): 332–335.
16. Roehrborn CG. Three months’ treatment with the alpha1-blocker alfuzosin does not affect total or transition zone volume of the prostate. Prostate Cancer Prostatic Dis 2006; 9(2): 121–125.
17. Roehrborn CG, Siami P, Barkin J et al. The effects of dutasteride, tamsulosin and combination therapy on lower urinary tract symptoms in men with benign prostatic hyperplasia and prostatic enlargement: 2-year results from the CombAT study. J Urol 2008; 179(2): 616–621.
18. Roehrborn CG, Siami P, Barkin J et al. The effects of combination therapy with dutasteride and tamsulosin on clinical outcomes in men with symptomatic benign prostatic hyperplasia: 4-year results from the CombAT Study. Eur Urol 2010; 57(1): 123–131.
19. Boyle P, Robertson C, Manski R et al. Meta-analysis of randomized trials of terazosin in the treatment of benign prostatic hyperplasia. Urology 2001; 58(5): 717–722.
20. McConnell JD, Roehrborn CG, Bautista OM et al. The long-term effect of doxazosin, finasteride, and combination therapy on the clinical progression of benign prostatic hyperplasia. N Engl J Med 2003; 349(25): 2387–2398.
21. Barendrecht MM, Koopmans RP, de la Rosette JJ et al. Treatment of lower urinary tract symptoms suggestive of benign prostatic hyperplasia: the cardiovascular system. BJU Int 2005; 95 (Suppl 4): 19–28.
22. Chang DF, Campbell JR. Intraoperative floppy iris syndrome associated with tamsulosin. J Cataract Refract Surg 2005; 31(4): 664–673.
23. van Dijk MM, de la Rosette JJ, Michel MC. Effects of alpha(1)-adrenoceptor antagonists on male sexual function. Drugs 2006; 66(3): 287–301.
24. Roehrborn CG, Kaplan SA, Lepor H et al. Symptomatic and urodynamic responses in patients with reduced or no seminal emission during silodosin treatment for LUTS and BPH. Prostate Cancer Prostatic Dis 2011; 14(2): 143–148.
25. Rittmaster RS, Norman RW, Thomas LN et al. Evidence for atrophy and apoptosis in the prostates of men given finasteride. J Clin Endocrinol Metab 1996; 81(2): 814–819.
26. Naslund MJ, Miner M. A review of the clinical efficacy and safety of 5alpha-reductase inhibitors for the enlarged prostate. Clin Ther 2007; 29(1): 17–25.
27. Nickel JC, Gilling P, Tammela TL et al. Comparison of dutasteride and finasteride for treating benign prostatic hyperplasia: the Enlarged Prostate International Comparator Study (EPICS). BJU Int 2011; 108(3): 388–394.
28. Boyle P, Gould AL, Roehrborn CG. Prostate volume predicts outcome of treatment of benign prostatic hyperplasia with finasteride: meta-analysis of randomized clinical trials. Urology 1996; 48(3): 398–405.
29. Kirby RS, Roehrborn C, Boyle P et al. Efficacy and tolerability of doxazosin and finasteride, alone or in combination, in treatment of symptomatic benign prostatic hyperplasia: the Prospective European Doxazosin and Combination Therapy (PREDICT) trial. Urology 2003; 61(1): 119–126.
30. Debruyne FMJ, Jardin A, Colloi D et al. Sustained-release alfuzosin, finasteride and the combination of both in the treatment of benign prostatic hyperplasia. Eur Urol 1998; 34(3): 169–175.
31. Tacklind J, Fink HA, MacDonald R et al. Finasteride for benign prostatic hyperplasia. Cochrane Database Syst Rev 2010 : 10: CD006015.
32. Roehrborn CG, Boyle P, Nickel JC et al. Efficacy and safety of a dual inhibitor of 5-alpha-reductase types 1 and 2 (dutasteride) in men with benign prostatic hyperplasia. Urology 2002; 60(3): 434–441.
33. Roehrborn CG. BPH progression: concept and key learning from MTOPS, ALTESS, COMBAT, and ALF-ONE. BJU Int 2008; 101 (Suppl 3): 17–21.
34. McConnell JD, Bruskewitz R, Walsh P et al. The effect of finasteride on the risk of acute urinary retention and the need for surgical treatment among men with benign prostatic hyperplasia. N Engl J Med 1998; 338(9): 557–563.
35. Andersen JT, Nickel JC, Marshall VR et al. Finasteride significantly reduces acute urinary retention and need for surgery in patients with symptomatic benign prostatic hyperplasia. Urology 1997; 49(6): 839–845.
36. Roehrborn CG, Boyle P, Nickel JC et al. ARIA3001, ARIA3002 and ARIA3003 Study Investigators. Efficacy and safety of a dual inhibitor of 5-alpha-reductase types 1 and 2 (dutasteride) in men with benign prostatic hyperplasia. Urology 2002; 60(3): 434–441.
37. Roehrborn CG, Lukkarinen O, Mark S et al. Long-term sustained improvement in symptoms of benign prostatic hyperplasia with the dual 5alpha-reductase inhibitor dutasteride: results of 4-year studies. BJU Int 2005; 96(4): 572–577.
38. Thompson IM, Goodman PJ, Tangen CM et al. The influence of finasteride on the development of prostate cancer. N Engl J Med 2003; 349(3): 215–224.
39. Andriole GL, Bostwick DG, Brawley OW et al. Effect of dutasteride on the risk of prostate cancer. N Engl J Med 2010; 362(13): 1192–1202.
40. Kaplan SA, Roehrborn CG, Dmochowski R et al. Tolterodine extended release improves overactive bladder symptoms in men with overactive bladder and nocturia. Urology 2006; 68(2): 328–332.
41. Roehrborn CG, Abrams P, Rovner ES et al. Efficacy and tolerability of tolterodine extended-release in men with overactive bladder and urgency urinary incontinence. BJU Int 2006; 97(5): 1003–1006.
42. Kaplan SA, Goldfischer ER, Steers WD et al. Solifenacin treatment in men with overactive bladder: effects on symptoms and patient-reported outcomes. Aging Male 2010; 13(2): 100–107.
43. Herschorn S, Jones JS, Oelke M et al. Efficacy and tolerability of fesoterodine in men with overactive bladder: a pooled analysis of 2 phase III studies. Urology 2010; 75(5): 1149–1155.
44. Kaplan SA, Walmsley K, Te AE. Tolterodine extended release attenuates lower urinary tract symptoms in men with benign prostatic hyperplasia. J Urol 2005; 174(6): 2273–2275.
45. Höfner K, Burkart M, Jacob G et al. Safety and efficacy of tolterodine extended release in men with overactive bladder symptoms and presumed non-obstructive benign prostatic hyperplasia. World J Urol 2007; 25(6): 627–633.
46. Kaplan SA, Roehrborn CG, Rovner ES et al. Tolterodine and tamsulosin for treatment of men with lower urinary tract symptoms and overactive bladder. JAMA 2006; 296(19): 2319–2328.
47. Roehrborn CG, Kaplan SA, Kraus SR et al. Effects of serum PSA on efficacy of tolterodine extended release with or without tamsulosin in men with LUTS, including OAB. Urology 2008; 72(5): 1061–1067.
48. Yokoyama T, Uematsu K, Watanabe T et al; Okayama Urological Research Group. Naftopidil and propiverine hydrochloride for treatment of male lower urinary tract symptoms suggestive of benign prostatic hyperplasia and concomitant overactive bladder: a prospective randomized controlled study. Scand J Urol Nephrol 2009; 43 : 307–14.
49. Abrams P, Kaplan S, De Koning Gans HJ et al. Safety and tolerability of tolterodine for the treatment of overactive bladder in men with bladder outlet obstruction. J Urol 2006; 175(3 Pt 1): 999–1004.
50. Uckert S, Oelke M, Stief CG et al. Immuno-histochemical distribution of cAMP - and cGMP-phosphodiesterase (PDE) isoenzymes in the human prostate. Eur Urol 2006; 49(4): 740–745.
51. Andersson KE, Persson K. Nitric oxide synthase and the lower urinary tract: possible implications for physiology and pathophysiology. Scand J Urol Nephrol Suppl 1995; 175 : 43–53.
52. Gacci M, Corona G, Salvi M et al. A systematic review and meta - analysis on the use of phosphodiesterase 5 inhibitors alone or in combination with alfa-blockers for lower urinary tract symptoms owing to benign prostatic hyperplasia. Eur Urol 2012; 61(5): 994–1003.
53. Porst H, McVary KT, Montorsi F et al. Effects of once-daily tadalafil on erectile function in men with erectile dysfunction and signs and symptoms of benign prostatic hyperplasia. Eur Urol 2009; 56(4): 727–736.
54. Oelke M, Giuliano F, Mirone V et al. Monotherapy with tadalafil or tamsulosin similarly improved lower urinary tract symptoms suggestive of benign prostatic hyperplasia in an international, randomised, parallel, placebo-controlled clinical trial. Eur Urol 2012; 61(5): 917–925.
55. Habib FK, Wyllie MG. Not all brands are created equal: a comparison of selected compounds of different brands of Serenoa repens extract. Prostate Cancer Prostatic Dis 2004; 7(3): 195–200.
56. Scaglione F, Lucini V, Pannacci M et al. Comparison of the potency of different brands of Sereonoa repens extract on 5alpha-reductase types I and II in prostatic co-cultured epithelial and fibroblast cells. Pharmacology 2008; 82(4): 270–275.
57. Wilt T, Ishani A, Mac Donald R et al. Pygeum africanum for benign prostatic hyperplasia. Cochrane Database Syst Rev 2002; 1: CD001044.
58. Wilt T, Mac Donald R, Ishani A et al. Cernilton for benign prostatic hyperplasia. Cochrane Database Syst Rev 2000; 2: CD001042.
59. Tacklind J, Mac Donald R, Rutks I et al. Serenoa repens for benign prostatic hyperplasia. Cochrane Database Syst Rev 2012; 12: CD001423.
60. Rembratt A, Graugaard-Jensen C, Senderovitz T et al. Pharmacokinetics and pharmacodynamics of desmopressin administered orally versus intravenously at daytime versus night-time in healthy men aged 55–70 years. Eur J Clin Pharmacol 2004; 60(6): 397–402.
61. Mattiasson A, Abrams P, van Kerrebroeck P et al. Efficacy of desmopressin in the treatment of nocturia: a double-blind placebo-controlled study in men. BJU Int 2002; 89(9): 855–862.
62. van Kerrebroeck P, Rezapour M, Cortesse A et al. Desmopressin in the treatment of nocturia: a double-blind, placebo-controlled study. Eur Urol 2007; 52(1): 221–229.
63. Lose G, Mattiasson A, Walter S et al. Clinical experiences with desmopressin for long-term treatment of nocturia. J Urol 2004; 172(3): 1021–1025.
64. Cornu JN, Abrams P, Chapple CR et al. A contemporary assessment of nocturia: definition, epidemiology, pathophysiology, and management – a systematic review and meta-analysis. Eur Urol 2012; 62(5): 877–890.
65. Rembratt A, Riis A, Norgaard JP. Desmopressin treatment in nocturia; an analysis of risk factors for hyponatremia. Neurourol Urodyn 2006; 25 : 105–109.
66. Weatherall M. The risk of hyponatremia in older adults using desmopressin for nocturia: a systematic review and meta-analysis. Neurourol Urodyn 2004; 23 : 302–305.
67. Juul KV, Klein BM, Sandström R et al. Gender difference in antidiuretic response to desmopressin. Am J Physiol Renal Physiol 2011; 300(5): F1116–F1122.
68. Barkin J, Guimarčes M, Jacobi G et al. Alpha-blocker therapy can be withdrawn in the majority of men following initial combination therapy with the dual 5alpha-reductase inhibitor dutasteride. Eur Urol 2003; 44(4): 461–466.
69. Nickel JC, Barkin J, Koch C et al. Finasteride monotherapy maintains stable lower urinary tract symptoms in men with benign prostatic hyperplasia following cessation of alpha blockers. Can Urol Assoc J 2008; 2(1): 16–21.
70. MacDiarmid SA, Peters KM, Chen A et al. Efficacy and safety of extended-release oxybutynin in combination with tamsulosin for treatment of lower urinary tract symptoms in men: randomized, double-blind, placebo-controlled study. Mayo Clin Proc 2008; 83(9): 1002–1010.
71. Yokoyama T, Uematsu K, Watanabe T et al. Naftopidil and propiverine hydrochloride for treatment of male lower urinary tract symptoms suggestive of benign prostatic hyperplasia and concomitant overactive bladder: a prospective randomized controlled study. Scand J Urol Nephrol 2009; 43(4): 307–314.
72. Lee KS, Choo MS, Kim DY et al. Combination treatment with propiverine hydrochloride plus doxazosin controlled release gastrointestinal therapeutic system formulation for overactive bladder and coexisting benign prostatic obstruction: a prospective, randomized, controlled multicenter study. J Urol 2005; 174(4 Pt 1): 1334–1338.
73. Kaplan SA, McCammon K, Fincher R et al. Safety and tolerability of solifenacin add-on therapy to alpha-blocker treated men with residual urgency and frequency. J Urol 2009; 182(6): 2825–2830.
74. Chapple C, Herschorn S, Abrams P et al. Tolterodine treatment improves storage symptoms suggestive of overactive bladder in men treated with alpha-blockers. Eur Urol 2009; 56(3): 534–541.
75. Kaplan SA, Roehrborn CG, Rovner ES et al. Tolterodine and tamsulosin for treatment of men with lower urinary tract symptoms and overactive bladder: a randomized controlled trial. JAMA 2006; 296(19): 2319–2328.
76. Kaplan SA, Roehrborn CG, Abrams P et al. Antimuscarinics for treatment of storage lower urinary tract symptoms in men: a systematic review. Int J Clin Pract 2011; 65(4): 487–507.
77. Athanasopoulos A, Chapple C, Fowler C et al. The role of antimuscarinics in the management of men with symptoms of overactive bladder associated with concomitant bladder outlet obstruction: an update. Eur Urol 2011; 60(1): 94–105.
78. Kaplan SA, He W, Koltun WD et al. Solifenacin plus tamsulosin combination treatment in men with lower urinary tract symptoms and bladder outlet obstruction: a randomized controlled trial. Eur Urol 2013; 63(1): 158–165.
79. Madersbacher S, Marberger M. Is transurethral resection of the prostate still justified? BJU Int 1999; 83(3): 227–237.
80. Ahyai SA, Gilling P, Kaplan SA et al. Meta-analysis of functional outcomes and complications following transurethral procedures for lower urinary tract symptoms resulting from benign prostatic enlargement. Eur Urol 2010; 58(3): 384–397.
81. Thomas AW, Cannon A, Bartlett E et al. The natural history of lower urinary tract dysfunction in men: minimum 10-year urodynamic followup of transurethral resection of prostate for bladder outlet obstruction. J Urol 2005; 174(5): 1887–1891.
82. Lourenco T, Shaw M, Fraser C et al. The clinical effectiveness of transurethral incision of the prostate: a systematic review of randomised controlled trials. World J Urol 2010; 28(1): 23–32.
83. Bootsma AM, Laguna Pes MP, Geerlings SE et al. Antibiotic prophylaxis in urologic procedures: a systematic review. Eur Urol 2008; 54(6): 1270–1286.
84. Reich O, Gratzke C, Bachmann A et al. Morbidity, mortality and early outcome of transurethral resection of the prostate: a prospective multicenter evaluation of 10,654 patients. J Urol 2008; 180(1): 246–249.
85. Rassweiler J, Schulze M, Stock C et al. Bipolar transurethral resection of the prostate – technical modifications and early clinical experience. Minim Invasive Ther Allied Technol 2007; 16(1): 11–21.
86. Mamoulakis C, Ubbink DT, de la Rosette J. Bipolar versus monopolar transurethral resection of the prostate: a systematic review and meta-analysis of randomized controlled trials. Eur Urol 2009; 56(5): 798–809.
87. Burke N, Whelan JP, Goeree L et al. Systematic review and meta-analysis of transurethral resection of the prostate versus minimally invasive procedures for the treatment of benign prostatic obstruction. Urology 2010; 75(5): 1015–1022.
88. Mamoulakis C, de la Rosette J, Omar MI et al. Bipolar versus monopolar transurethral resection of the prostate for lower urinary tract symptoms secondary to benign prostatic obstruction. Cochrane Database Syst Rev 2012; CD009629.
89. Mamoulakis C, Skolarikos A, Schulze M et al. Results from an international multicentre double-blind randomized controlled trial on the perioperative efficacy and safety of bipolar vs monopolar transurethral resection of the prostate. BJU Int 2012; 109 : 240–248.
90. Mamoulakis C, Schulze M, Skolarikos A et al. Midterm results from an international multicentre randomised controlled trial comparing bipolar with monopolar transurethral resection of the prostate. Eur Urol 2013; 63(4): 667–676.
91. Mamoulakis C, Schulze M, Skolarikos A et al. Bipolar versus monopolar transurethral resection of the prostate: evaluation of the impact on overall sexual function in an international randomized controlled trial setting. BJU Int 2013; In press.
92. Autorino R, Damiano R, Di Lorenzo G et al. Four-year outcome of a prospective randomised trial comparing bipolar plasmakinetic and monopolar transurethral resection of the prostate. Eur Urol 2009; 55(4): 922–29.
93. Chen Q, Zhang L, Fan QL et al. Bipolar transurethral resection in saline vs traditional monopolar resection of the prostate: results of a randomized trial with a 2-year follow-up. BJU Int 2010;106(9): 1339–1343.
94. Michielsen DP, Coomans D. Urethral strictures and bipolar transurethral resection in saline of the prostate: fact or fiction? J Endourol 2010; 24(8): 1333–1337.
95. Fagerstrom T, Nyman CR, Hahn RG. Complications and clinical outcome 18 months after bipolar and monopolar transurethral resection of the prostate. J Endourol 2011; 25(6): 1043–1049.
96. Geavlete B, Georgescu D, Multescu R et al. Bipolar plasma vaporization vs monopolar and bipolar TURP-A prospective, randomized, long-term comparison. Urology 2011; 78(4): 930–935.
97. Xie CY, Zhu GB, Wang XH et al. Five-year follow-up results of a randomized controlled trial comparing bipolar plasmakinetic and monopolar transurethral resection of the prostate. Yonsei Med J 2012; 53(4): 734–741.
98. Kuntz RM, Lehrich K, Ahyai SA. Holmium laser enucleation of the prostate versus open prostatectomy for prostates greater than 100 grams: 5-year follow-up results of a randomised clinical trial. Eur Urol 2008; 53(1): 160–166.
99. Varkarakis I, Kyriakakis Z, Delis A et al. Long-term results of open transvesical prostatectomy from a contemporary series of patients. Urology 2004; 64(2): 306–310.
100. Naspro R, Suardi N, Salonia A et al. Holmium laser enucleation of the prostate versus open prostatectomy for prostates >70 g: 24-month follow-up. Eur Urol 2006; 50(3): 563–568.
101. Mattiasson A, Wagrell L, Schelin S et al. Five-year follow-up of feedback microwave thermotherapy versus TURP for clinical BPH: a prospective randomized multicenter study. Urology 2007; 69(1): 91–96.
102. Hoffman RM, Monga M, Elliott SP et al. Microwave thermotherapy for benign prostatic hyperplasia. Cochrane Database Syst Rev 2012; 9: CD004135.
103. D’Ancona FC, van der Bij AK, Francisca EA et al. Results of high-energy transurethral microwave thermotherapy in patients categorized according to the American Society of Anaesthiologists operative risk classification. Urology 1999; 53(2): 322–328.
104. D’Ancona FC, Francisca EA, Hendriks JC, Debruyne FM, de la Rosette J. High energy transurethral thermotherapy in the treat-ment of benign prostatic hyperplasia: criteria to predict treatment outcome. Prostate Cancer Prostatic Dis 1999; 2 : 98–105.
105. Boyle P, Robertson C, Vaughan ED, Fitzpatrick JM. A meta-analysis of trials of transurethral needle ablation for treating symptomatic benign prostatic obstruction. BJU Int 2004; 94 : 83–88.
106. Bouza C, López T, Magro A, Navalpotro L, Amate JM. Systematic review and meta-analysis of transurethral needle ablation in symptomatic benign prostatic hyperplasia. BMC Urol 2006; 6 : 14.
107. Chapple CR, Issa MM, Woo H. Transurethral needle ablation (TUNA). A critical review of radiofrequency thermal therapy in the management of benign prostatic hyperplasia. Eur Urol 1999; 35 : 119–28.
108. Schatzl G, Madersbacher S, Lang T, Marberger M. The early post-operative morbidity of transurethral resection of the prostate andof four minimally invasive treatment alternatives. J Urol 1997; 158 : 105–10.
109. Tooher R, Sutherland P, Costello A et al. A systematic review of holmium laser prostatectomy for benign prostatic hyperplasia. J Urol 2004; 171: 1773–1781.
110. Westenberg A, Gilling P, Kennett K, Frampton C, Fraundorfer M. Holmium laser resection of the prostate versus transurethral resection of the prostate: results of a randomized trial with 4-year minimum long-term followup. J Urol 2004; 172 : 616–619.
111. Lourenco T, Pickard R, Vale L, et al. Alternative approaches to endoscopic ablation for benign enlargement of the prostate: systematic review of randomised controlled trials. BMJ 2008; 337: a449.
112. Tan A, Liao C, Mo Z, Cao Y. Meta-analysis of holmium laser enucleation versus transurethral resection of the prostate for symptomatic prostatic obstruction. Br J Surg 2007; 94 : 1201–1208.
113. Yin L, Teng J-F, Huang C-J, Zhang X, Xu D. Holmium laser enucleation of the prostate versus transurethral resection of the prostate: a systematic review and meta-analysis of randomized controlled trials. J Endourol. In press.
114. Elmansy H, Baazeem A, Kotb A, et al. Holmium laser enucleation versus photoselective vaporization for prostatic adenoma greater than 60 ml: preliminary results of a prospective, randomized clinical trial. J Urol 2012; 188 : 216–221.
115. Gilling PJ, Wilson LC, King CJ et al. Long-term results of a randomized trial comparing holmium laser enucleation of the prostate and transurethral resection of the prostate: results at 7 years. BJU Int 2012; 109 : 408–411.
116. Elmansy HM, Kotb A, Elhilali MM. Holmium laser enucleation of the prostate: long-term durability of clinical outcomes and complication rates during 10 years of followup. J Urol 2011; 186 : 1972–1976.
117. Kuntz RM. Current role of lasers in the treatment of benign prostatic hyperplasia (BPH). Eur Urol 2006; 49 : 961–969.
118. Elzayat E, Habib E, Elhilali M. Holmium laser enucleation of the prostate in patients on anticoagulant therapy or with bleeding disorders. J Urol 2006;175 : 1428–1432.
119. Tyson MD, Lerner LB. Safety of holmium laser enucleation of the prostate in anticoagulated patients. J Endourol 2009; 23 : 1343–1346.
120. Elzayat EA, Elhilali MM. Holmium laser enucleation of the prostate (HoLEP): long-term results, reoperation rate, and possible impact of the learning curve. Eur Urol 2007; 52 : 1465–1472.
121. Du C, Jin X, Bai F, Qiu Y. Holmium laser enucleation of the prostate: the safety, efficacy, and learning experience in China. J Endourol 2008; 22 : 1031–1036.
122. Thangasamy IA, Chalasani V, Bachmann A, Woo HH. Photoselective vaporisation of the prostate using 80-W and 120-W laser versus transurethral resection of the prostate for benign prostatic hyperplasia: a systematic review with meta-analysis from 2002 to 2012. Eur Urol 2012; 62 : 315–323.
123. Bouchier-Hayes DM, Van Appledorn S, Bugeja P et al. A randomized trial of photoselective vaporization of the prostate using the 80-W potassiumtitanylphosphate laser vs transurethral prostatectomy, with 1-year follow up. BJU Int 2010; 105 : 964–969.
124. Capitán C, Blázquez C, Martin MD et al. GreenLight HPS 120-W laser vaporization versus transurethral resection of the prostate for the treatment of lower urinary tract symptoms due to benign prostatic hyperplasia: a randomized clinical trial with 2-year follow-up. Eur Urol 2011; 60 : 734–739.
125. Skolarikos A, Alivizatos G, Chalikopoulos D et al., 80W PVP versus TURP: results of a randomized prospective study at 12 months of follow-up. Abstract presented at: American Urological Association annual meeting; May 17–22, 2008; Orlando, FL, USA.
126. Hai MA. Photoselective vaporization of prostate: five-year out-comes entire clinic patient population. Urology 2009; 73 : 807–810.
127. Ruszat R, Seitz M, Wyler SF, et al. GreenLight laser vaporisation of the prostate: single-center experience and long-term results after 500 procedures. Eur Urol 2008; 54 : 893–901.
128. Al-Ansari A, Younes N, Sampige VP, et al. GreenLight HPS 120-W laser vaporization versus transurethral resection of the prostate for treatment of benign prostatic hyperplasia: a randomized clinical trial with midterm follow-up. Eur Urol 2010; 58 : 349–355.
129. Pereira-Correia JA, de Moraes Sousa KD, Santos JBP et al. Green - Light HPSTM 120-W laser vaporization vs transurethral resection of the prostate (<60 mL): a 2-year randomized double-blind prospective urodynamic investigation. BJU Int 2012; 110 : 1184–1189.
130. Bachmann A, Muir GH, Collins EJ, et al. 180-W XPS GreenLight laser therapy for benign prostate hyperplasia: early safety, efficacy, and perioperative outcome after 201 procedures. Eur Urol 2012; 61 : 600–607.
131. Brunken C, Seitz C, Tauber S, Schmidt R. Transurethral GreenLight laser enucleation of the prostate—a feasibility study. J Endourol 2011; 25 : 1199–1201.
132. Ruszat R, Wyler S, Seifert HH et al. Photoselective vaporization of the prostate: subgroup analysis of men with refractory urinary retention. Eur Urol 2006; 50 : 1040–1049.
133. Reich O, Bachmann A, Siebels M et al. High power (80W) potassium-titanyl-phosphate laser vaporization of the prostate in 66 high risk patients. J Urol 2005; 173 : 158–160.
134. Ruszat R, Wyler S, Forster T, et al. Safety and effectiveness of photoselective vaporization of the prostate (PVP) in patients on ongoing oral anticoagulation. Eur Urol 2007; 51 : 1031–1041.
135. Rajbabu K, Chandrasekara SK, Barber NJ, Walsh K, Muir GH. Photoselective vaporization of the prostate with the potassium-titanyl-phosphate laser in men with prostates of >100 mL. BJU Int 2007; 100 : 593–598.
136. Chung DE, Wysock JS, Lee RK et al. Outcomes and complications after 532 nm laser prostatectomy in anticoagulated patients with benign prostatic hyperplasia. J Urol 2011; 186 : 977–981.
137. Woo H, Reich O, Bachmann A, et al. Outcome of GreenLight HPS 120-W laser therapy in specific patient populations: those in retention, on anticoagulants, and with large prostates (>80 ml). Eur Urol Suppl 2008; 7 : 378–383.
138. Bach T, Muschter R, Sroka R et al. Laser treatment of benign prostatic obstruction: basics and physical differences. Eur Urol 2012; 61 : 317–325.
139. Ruszat R, Seitz M, Wyler SF et al. Prospective single-centre comparison of 120-W diode-pumped solid-state high-intensity system laser vaporization of the prostate and 200-W high-intensive diode-laser ablation of the prostate for treating benign prostatic hyperplasia. BJU Int 2009; 104 : 820–825.
140. Chen C-H, Chiang P-H, Chuang Y-C et al. Preliminary results of prostate vaporization in the treatment of benign prostatic hyperplasia by using a 200-W high-intensity diode laser. Urology 2010; 75 : 658–663.
141. Chen C-H, Chiang P-H, Lee W-C et al. High-intensity diode laser in combination with bipolar transurethral resection of the prostate: a new strategy for the treatment of large prostates (>80 ml). Lasers Surg Med 2012; 44 : 699–704.
142. Chiang PH, Chen CH, Kang CH, Chuang YC. GreenLight HPS laser 120-W versus diode laser 200-W vaporization of the prostate: comparative clinical experience. Lasers Surg Med 2010; 42 : 624–629.
143. Erol A, Cam K, Tekin A et al. High power diode laser vaporization of the prostate: preliminary results for benign prostatic hyperplasia. J Urol 2009; 182 : 1078–1082.
144. Leonardi R. Preliminary results on selective light vaporization with the side-firing 980 nm diode laser in benign prostatic hyperplasia: an ejaculation sparing technique. Prostate Cancer Prostatic Dis 2009; 12 : 277–280.
145. Seitz M, Sroka R, Gratzke C et al. The diode laser: a novel side-firing approach for laser vaporisation of the human prostate-immediate efficacy and 1-year follow-up. Eur Urol 2007; 52 : 1717–1722.
146. Shaker HS, Shoeb MS, Yassin MM, Shaker SH. Quartz head contact laser fiber: a novel fiber for laser ablation of the prostate using the 980 nm high power diode laser. J Urol 2012; 187 : 575–579.
147. Hruby S, Sieberer M, Schätz T et al. Eraser laser enucleation of the prostate: technique and results. Eur Urol 2013; 63 : 341–346.
148. Yang KS, Seong YK, Kim IG, Han BH, Kong GS. Initial experiences with a 980 nm diode laser for photoselective vaporization of the prostate for the treatment of benign prostatic hyperplasia. Korean J Urol 2011; 52 : 752–756.
149. Lusuardi L, Myatt A, Sieberer M et al. Safety and efficacy of eraser laser enucleation of the prostate: preliminary report. J Urol 2011; 186 : 1967–1971.
150. Xia S-J, Zhuo J, Sun X-W et al. Thulium laser versus standard transurethral resection of the prostate: a randomized prospective trial. Eur Urol 2008; 53 : 382–390.
151. Fu WJ, Zhang X, Yang Y et al. Comparison of 2-microm continuous wave laser vaporesection of the prostate and transurethral resection of the prostate: a prospective nonrandomized trial with 1-year follow-up. Urology 2010; 75 : 194–199.
152. Peng B, Wang G-C, Zheng J-H et al. A comparative study of thulium laser resection of the prostate and bipolar transurethral plasma kinetic prostatectomy for treating benign prostatic hyperplasia. BJU Int. In press. http://dx.doi.org/10.1111/j.1464-410X.2012.11610.x.
153. Bach T, Netsch C, Pohlmann L, Herrmann TRW, Gross AJ. Thulium: YAG vapoenucleation in large volume prostates. J Urol 2011; 186 : 2323–2327.
154. Hauser S, Rogenhofer S, Ellinger J et al. Thulium laser (Revolix) vapoenucleation of the prostate is a safe procedure in patients with an increased risk of hemorrhage. Urol Int 2012; 88 : 390–394.
155. Netsch C, Bach T, Pohlmann L, Herrmann T, Gross AJ. Comparison of 120–200 W 2 mm thulium:yttrium-aluminum-garnet vapoenucleation of the prostate. J Endourol 2012; 26 : 224–229.
156. Netsch C, Pohlmann L, Herrmann TR, Gross AJ, Bach T. 120-W 2-mm thulium:yttrium-aluminium-garnet vapoenucleation of the prostate: 12-month follow-up. BJU Int 2012; 110 : 96–101.
157. Zhang F, Shao Q, Herrmann TRW, Tian Y, Zhang Y. Thulium laser versus holmium laser transurethral enucleation of the prostate: 18-month follow-up data of a single center. Urology 2012; 79 : 869–874.
158. Szlauer R, Gotschl R, Razmaria A, Paras L, Schmeller NT. Endoscopic vaporesection of the prostate using the continuous-wave 2-mm thulium laser: outcome and demonstration of the surgical technique. Eur Urol 2009; 55 : 368–375.
159. Bach T, Netsch C, Haecker A et al. Thulium: YAG laser enucleation (VapoEnucleation) of the pros-tate: safety and durability during intermediate-term follow-up. World J Urol 2010; 28 : 39–43.
160. Armitage JN, Cathcart PJ, Rashidian A et al. Epithelializing stent for benign prostatic hyperplasia: a systematic review of the literature. J Urol 2007; 177 : 1619–1624.
161. Armitage JN, Rashidian A, Cathcart PJ, Emberton M, van der Meulen JH. The thermo-expandable metallic stent for managing benign prostatic hyperplasia: a systematic review. BJU Int 2006; 98 : 806–810.
162. van der Brink BA, Rastinehad AR, Badlani GH. Prostatic stents for the treatment of benign prostatic hyperplasia. Curr Opin Urol 2007; 17 : 1–6.
163. Grise P, Plante M, Palmer J et al. Evaluation of the transurethral ethanol ablation of the prostate (TEAP) for symptomatic benign prostatic hyperplasia (BPH): a European multi-center evaluation. Eur Urol 2004; 46 : 496–502.
164. Magno C, Mucciardi G, Gali A et al. Transurethral ethanol ablation of the prostate (TEAP) – an effective minimally invasive treatment alternative to traditional surgery for symptomatic benign prostatic hyperplasia (BPH) in high-risk comorbidity patients. Int Urol Nephrol 2008; 40 : 941–946.
165. El-Husseiny T, Buchholz N. Transurethral ethanol ablation of the prostate for symptomatic benign prostatic hyperplasia: long-term follow-up. J Endourol 2011; 25 : 477–480.
166. Goya N, Ishikawa N, Ito F et al. Transurethral ethanol injection therapy for prostatic hyperplasia: 3-year results. J Urol 2004; 172 : 1017–1020.
167. Chuang YC, Huang CC, Kang HY et al. Novel action of botulinum toxin on the stromal and epithelial components of the prostate gland. J Urol 2006; 175 : 1158–1163.
168. Marchal C, Perez JE, Herrera B, Machuca FJ, Redondo M. The use of botulinum toxin in benign prostatic hyperplasia. Neurourol Urodyn 2012; 31 : 86–92.
169. Crawford ED, Hirst K, Kusek JW et al. Effects of 100 and 300 units of onabotulinum toxin A on lower urinary tract symptoms of benign prostatic hyperplasia: a phase II randomized clinical trial. J Urol 2011; 186 : 965–970.
170. Arnouk R, Suzuki Bellucci CH, Stull RB et al. Botulinum neurotoxin type a for the treatment of benign prostatic hyperplasia: randomized study comparing two doses. Scientific World Journal 2012; 2012 : 463574.
171. Marberger M, Chartier-Kastler E, Egerdie B et al. A randomized double-blind placebo-controlled phase 2 dose-ranging study of onabotulinumtoxinA in men with benign prostatic hyperplasia. Eur Urol 2013; 63 : 496–503.
172. Oeconomou A, Madersbacher H, Kiss G, Berger TJ, Melekos M, Rehder P. Is botulinum neurotoxin type A (BoNT-A) a novel therapy for lower urinary tract symptoms due to benign prostatic enlargement? A review of the literature. Eur Urol 2008; 54 : 765–777.
173. Silva J, Pinto R, Carvalho T et al. Intraprostatic botulinum toxin type A administration: evaluation of the effects on sexual function. BJU Int 2011; 107 : 1950–1954.
Štítky
Detská urológia Urológia
Článok vyšiel v časopiseUrologické listy
Najčítanejšie tento týždeň
2013 Číslo 2- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- Farmakoterapie LUTS/BPH v každodenní klinické praxi. Jak vybrat optimální alternativu?
- Současná realita a budoucí možné výhledy méně invazivních technologií v léčbě BPH
- Úvodní slovo
- Možnosti léčby a profylaxe recidivujících infekcí dolních močových cest
- Litotrypse rázovou vlnou versus ureteroskopie při léčbě ureterolitiázy: prospektivní hodnocení výsledků uváděných pacienty
-
Zpráva z 28. výroční konference Evropské urologické asociace
Itálie, Milano, 15.–19. březen 2013 - Ze zahraničních periodik
- Guidelines EAU pro léčbu a sledování mužů se symptomy dolních cest močových jiného než neurogenního původu (včetně benigní prostatické obstrukce)
- Patofyziologie vzniku BPH – vývoj hypotéz a teorií, současnost a perspektivy
- Urologické listy
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Možnosti léčby a profylaxe recidivujících infekcí dolních močových cest
- Farmakoterapie LUTS/BPH v každodenní klinické praxi. Jak vybrat optimální alternativu?
- Litotrypse rázovou vlnou versus ureteroskopie při léčbě ureterolitiázy: prospektivní hodnocení výsledků uváděných pacienty
- Současná realita a budoucí možné výhledy méně invazivních technologií v léčbě BPH
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



