-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Fokální léčba lokalizovaného karcinomu prostaty
FOCAL THERAPY FOR LOCALIZED PROSTATE CANCER
The ubiquity of prostate specific antigen testing in certain parts of the world has led to significant stage migration of prostate cancer at presentation, apparently resulting in over-diagnosis and over-treatment. With radical definitive therapies such as radical prostatectomy and radiotherapy, patients have to endure treatment-related adverse effects. “Active surveillance with delayed intervention if necessary”, has gained popularity as a possible solution for the over-treatment problem, although this approach also has inherent limitations. Focal therapy is emerging as a viable management option for certain localized prostate cancers. Advancement in imaging technology coupled with the ability to safely and effectively deliver energy to ablate foci of localized prostate cancer has accelerated acceptance of this form of management. Level one evidence is still lacking, although a number of trials are now underway to define the role of focal therapy. Cryotherapy and high intensity focused ultrasound have an established track record as energy sources for whole gland prostate ablation. In this article we review the indications and technique of focal treatment for localized prostate cancer, as well as early published results using these two technologies.
Key Words:
prostate cancer focal therapy cryoablation high intensity focused ultrasound interstitial laser photodynamic therapy irreversible electroporation and focal brachytherapy
Autoři: K. M. Siddiqui; M. Billia; J. Izawa; J. L. Chin
Působiště autorů: Division of Surgical Oncology University of Western Ontario
Vyšlo v časopise: Urol List 2015; 13(3): 35-40
Souhrn
Rutinní testování prostatického specifického antigenu v některých částech světa vedlo k významné migraci stadia karcinomu prostaty v době diagnózy, což má často za následek zbytečnou diagnostiku (over-diagnosis) a zbytečnou léčbu (over-treatment) onemocnění. Při volbě radikálních definitivních možností léčby jako radikální prostatektomie a radioterapie jsou potom pacienti vystaveni nežádoucím účinkům souvisejícím s léčbou. Koncepce „aktivního sledování s indikací odložené intervence v případě potřeby“ získala popularitu jako možné řešení zbytečné léčby onemocnění, přestože tento přístup má svá omezení. Pro léčbu některých typů lokalizovaného karcinomu prostaty se tak nabízí jako vhodná alternativa fokální terapie. Pokrok v zobrazovacích technologiích a skutečnost, že jsme schopni bezpečně a účinně aplikovat energii potřebnou pro ablaci ložiska lokalizovaného karcinomu prostaty, umožnily rychlejší přijetí této formy léčby. Ačkoli v současné době nejsou k dispozici žádné údaje první úrovně, probíhá několik studií, které se pokoušejí definovat roli fokální terapie. Kryoterapie a fokusovaný ultrazvuk o vysoké intenzitě jsou zavedené modality užívané pro ablaci celé prostatické žlázy. V našem článku hodnotíme různé techniky fokální léčby lokalizovaného karcinomu prostaty a indikace pro tuto léčbu spolu s prvními publikovanými výsledky.
Klíčová slova:
karcinom prostaty fokální terapie kryoablace fokusovaný ultrazvuk o vysoké intenzitě intersticiální laserová terapie fotodynamická terapie ireverzibilní elektroporace a fokální brachyterapieÚvod
Rozšířené testování prostatického specifického antigenu (PSA) v rámci screeningu a časné detekce karcinomu prostaty (KP), které je běžnou praxí v některých částech světa, s sebou přineslo několik logických důsledků, jakým je např. migrace stadia onemocnění, kdy je diagnostikováno stále větší množství karcinomů v nižším stadiu a analogicky méně karcinomů ve vyšším stadiu. S tím souvisí trend zbytečné diagnostiky a zbytečné léčby některých karcinomů s nízkým rizikem. Vzhledem k posunu demografických trendů se mnoho pacientů potýká s nežádoucími účinky souvisejícími s léčbou, jako jsou např. erektilní dysfunkce a močová inkontinence. Jako jedna z novějších strategií se pro tyto pacienty nabízí aktivní sledování (active surveillance – AS) s odložením definitivní léčby pouze pro případ, že je nezbytná. AS je však na druhou stranu spojeno s potenciálními riziky under-stagingu, under-gradingu a zmeškání příležitosti onemocnění vyléčit. Dlouhodobé sledování navíc představuje zátěž ekonomickou (opakované provádění biopsie a krevních testů) a u některých pacientů rovněž zátěž psychickou.
Fokální terapie (FT) nebo také regionální terapie byla navržena (namísto ablace celé žlázy) jako možné řešení nebo jakýsi kompromis pro pacienty, kteří chtějí být léčeni, ale zdráhají se podstoupit riziko v podobě nežádoucích účinků souvisejících s radikální prostatektomií nebo radioterapií. Méně radikální terapie a FT teoreticky snižují toxicitu léčby díky tomu, že minimalizují poškození okolních struktur, ale přitom současně zabezpečují onkologickou kontrolu a poskytují psychickou úlevu pacientovi. Ačkoli při léčbě řady nádorů solidních orgánů (např. karcinom prsu, štítné žlázy, ledvin, slinivky břišní a jater) představuje operace se zachováním okolních tkání standardní postup, FT karcinomu prostaty má své odpůrce. Odpůrci FT poukazují na multifokální povahu KP a nemožnost přesně lokalizovat a cílit nádorové ložisko. Zastánci strategie AS se odkazují na teorii tzv. index léze, podle níž lze progresi a přirozený vývoj onemocnění odhadnout na základě biologické povahy a velikosti index léze (mezi sekundárními lézemi). Obhájci koncepce index léze se na základě retrospektivních histopatologických údajů získaných ze vzorků odebraných při radikální prostatektomii domnívají, že ablace pouze této index léze je dostačující. S ohledem na FT však máme k dispozici pouze minimum publikovaných údajů a neexistuje žádná standardizace kritérií pro výběr pacientů, léčbu ani monitorovací protokol.
Díky nejnovějším pokrokům v oblasti zobrazovacích modalit, technologií pro odběr biopsie s fúzí zobrazovacích vyšetření a systémům pro precizní aplikaci ablační energie (s minimálním nebo nulovým rozptylem energie) může FT potenciálně nabídnout srovnatelnou onkologickou kontrolu s významně nižší toxicitou.
Indikace pro fokální terapii
Vzhledem k tomu, že koncepce i techniky FT se neustále vyvíjejí, neexistuje žádný konsenzus s ohledem na kritéria pro indikaci FT u pacientů s KP. Panel odborníků v roce 2007 navrhoval možnost zvážit FT jako alternativu k AS a nabízet tuto modalitu pacientům s onemocněním s velmi nízkým rizikem. Autoři navrhovali následující kritéria: hladinu PSA < 10 ng/ml a absenci Gleasonova grade 4 nebo 5 ve vzorku rozšířené biopsie. Délka karcinomu v jakémkoli vzorku biopsie by neměla překročit 7 mm a maximální procentuální zasažení vzorku karcinomem by nemělo převyšovat 33 % [1]. Toto doporučení vychází z kritérií pro AS, která se neustále vyvíjejí. Kritéria pro indikaci FT by se tedy neměla omezovat pouze na karcinomy s nízkým a středním rizikem. V nedávné době provedený přehledový článek uvádí následující zastoupení pacientů podstupujících FT: 56 % s nízkým rizikem, 36 % se středním rizikem a 8 % s vysokým rizikem [2].
Technické předpoklady pro fokální terapii
Kromě údajů o lokalizaci a histologické povaze nádorové léze je třeba mít k dispozici informace o zbývající části prostatické tkáně (přítomnost nebo absence sekundárních změn). Mezi další předpoklady patří možnost relokace cílové léze na místo ablace a účinná ablativní technika. Neméně důležitým požadavkem je možnost opakovaného přístupu k místu léčby z důvodu provedení biopsie po výkonu.
Identifikace, lokalizace a stanovení objemu onemocnění
Podstata plánování i realizace FT spočívá v trojrozměrném hodnocení objemu KP. Pokrok v zobrazovacích technologiích usnadnil úspěšnou realizaci FT. Klasická biopsie naváděná pomocí transrektálního ultrazvukového vyšetření (TRUS) s odběrem 10–12 vzorků není pro tyto účely dostačující. Za nezbytný předpoklad pro FT se považuje saturační nebo rozšířená transrektální biopsie nebo transperineální mapující biopsie s užitím šablony (trans-perineal template mapping biopsy – TTMB). Pokud je tato modalita k dispozici, doporučuje se biopsii doplnit multiparametrickou magnetickou rezonancí (mpMR). Nejčastěji se užívají difuzně vážené obrazy, kontrastní harmonické zobrazení a zdánlivý difuzní koeficient (apparent diffusion coefficient). Cool et al prokázali, že mpMR umožňuje identifikovat i ty léze, které byly přehlédnuty při pouhém TRUS [3]. Některá centra dokonce využívají mpMR jako standardní zobrazovací modalitu u pacientů zařazených do programu AS. Toto doporučení lze aplikovat i pro FT. Tran at al ve studii využívající vzorky odebrané při radikální prostatektomii prokázali, že kombinace mpMR + TTMB umožňuje predikovat signifikantní karcinom s 97% senzitivitou. Co je však důležitější pro účely FT, tato kombinace umožňuje s vysokou negativní prediktivní hodnotou vyloučit přítomnost závažného bilaterálního onemocnění [4]. Zde je však na místě zdůraznit, že interpretace mpMR vyžaduje značné zkušenosti a kvalifikaci. Nejnovější studie ukazují, že při užití této techniky je velmi nepravděpodobné, že bude přehlédnuta nádorová léze > 0,5 ml s významným biologickým potenciálem. Většina center v současné době zahrnuje mpMR jako součást zobrazovacích vyšetření před zahájením léčby [5].
Trojrozměrné (3D) ultrazvukové vyšetření (UZ) a 3D lokalizace a navádění biopsie představují cenné pomocníky při FT. Dále lze doporučit fúzi MR a 3D UZ, protože dále zvyšují přesnost biopsie cílených lézí [6].
Typy fokální terapie
FT lze definovat jako využití jakéhokoli typu energie k ablaci části prostatické žlázy za účelem zachování většiny prostatické tkáně. Typ FT závisí na rozsahu a anatomické lokalizaci ablace, rozlišujeme „quadri-ablaci“, „hemi-ablaci“ a „subtotální“ ablaci se zachováním neurovaskulárního svazku.
Typy energie užívané při fokální terapii
Zdroje energie užívané pro FT zahrnují kryoablaci (CRYO), fokusované UZ o vysoké intenzitě (high intensity focused ultrasound – HIFU), brachyterapii s použitím radioaktivních zrn, intersticiální laser s fotodynamickou terapií, nebo bez ní a ireverzibilní elektroporaci.
CRYO a HIFU jsou zavedené modality pro ablaci celé prostatické žlázy. K dispozici je mnoho studií zabývajících se onkologickou kontrolou a nežádoucími účinky jak s ohledem na primární léčbu celé žlázy, tak i na záchrannou terapii [7–12]. Technologie CRYO i HIFU se využívají rovněž pro účely FT. Ostatní výše uvedené zdroje energie jsou považovány za experimentální a jejich bezpečnost, proveditelnost a účinnost bude teprve nutné prokázat. Další kapitoly se zaměřují pouze na FT na bázi CRYO a HIFU.
Kryoablace
Tato technologie byla do klinické praxe zavedena počátkem 60. let minulého století [13]. Zpočátku byl tekutý dusík aplikován přímo do operačně obnažené a vypreparované prostaty perineálním přístupem. Od této procedury však bylo z důvodu vysokého výskytu komplikací, zejména nekrózy tkání a vzniku píštělí, upuštěno.
Zdokonalení kryotechnologie, perkutánních přístupových technik a TRUS technologií obnovilo popularitu kryochirurgie při léčbě KP. Kryosondy se do prostaty zavádějí transperineálně pod TRUS kontrolou v reálném čase a celý proces je peroperačně monitorován. Bylo zjištěno, že pro buněčnou destrukci je nezbytné použití dvou cyklů zmrazení-rozmrazení namísto jednoho. Cytotoxický efekt spočívá v rychlém zmrazení (–180°) a postupném rozmrazování tkáně. Mechanizmus účinku spočívá mimo jiné v hypotermických, biochemických, metabolických, ischemických a strukturálních změnách a indukci apoptózy. Zařízení druhé a třetí generace využívají pro rychlé ochlazení tkáně argon a pro jejich znovuzahřátí helium na bázi Joule-Thomsonova jevu, při kterém je plyn protlačován malým otvorem na špičce kryosondy vysokou rychlostí, což má za následek prudký pokles teploty. Další zdokonalení instrumentária zahrnovalo použití jemnějších kryosond a tenčích jehel, kdy je větší množství menších ice-balls schopno lépe kopírovat skutečný tvar prostaty, díky čemuž mezi ice-balls zůstávají menší mezery, a minimalizuje se tak poškození okolních tkání (obr. 1). Nejnovější generace zařízení disponují ultratenkými jehlami (17G) Cryo needles™ (Oncura, Inc., Plymouth Meeting, PA).
Obr. 1. Srovnání velikosti ice-balls vytvořených s použitím kryosond (vlevo) a pomocí kryojehel (vpravo). 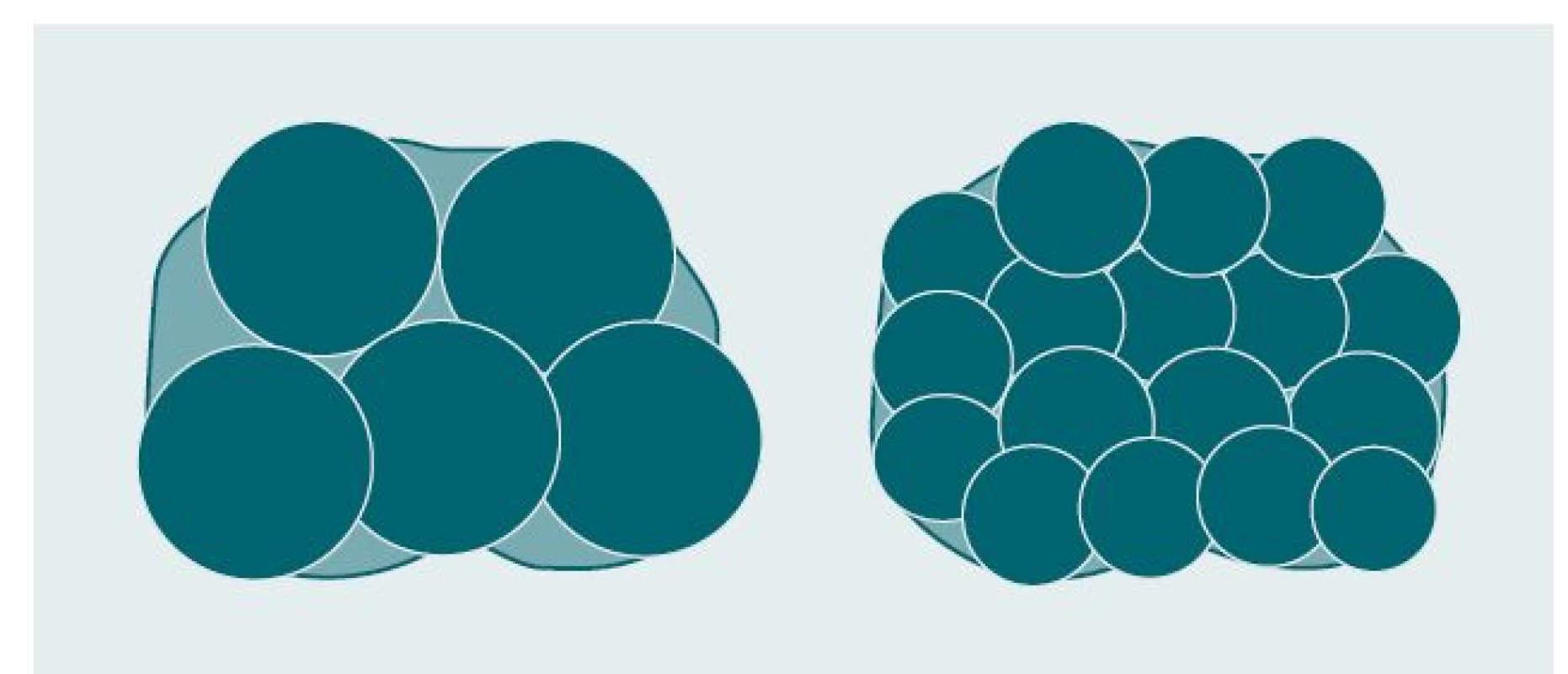
Kryochirurgické techniky
Pacient v celkové anestezii je uložen do extrémní litotomické polohy. Peroperačně je za cystoskopické kontroly zavedena epicystostomie a ponechána pro zabezpečení derivace moči po dobu tří týdnů.
K transperineální aplikaci kryosond užíváme 3D TRUS vyvinutý v našem centru [14,15]. K ablaci celé žlázy je zapotřebí 5–6 kryosond, pro účely FT postačuje menší počet sond v závislosti na velikosti a lokalizaci cílové léze. Sondy se aplikují transperineálně pod TRUS kontrolou. Do oblasti levého a pravého nervově cévního svazku a apexu ve střední čáře jsou umístěna tři tepelná čidla sloužící k monitorování dosažené teploty. Obvykle se provádějí dva cykly zmrazení-rozmrazení. UZ je v reálném čase kontinuálně monitorována tvorba ice-balls. Pro udržení teploty močové trubice v normálním rozmezí, a tedy prevenci vzniku nežádoucích účinků, se užívá zařízení pro ohřev močové trubice (Cook Urological, Spencer, IN). Tvorba ice-balls je monitorována v reálném čase (obr. 2).
Obr. 2a. Zavádění kryosond při 3D ultrazvukové navigaci, s ověřením správné polohy. 
Obr. 2b. Monitorování tvorby a zvětšování ice-ball v reálném čase. 
Ve srovnání s ostatními technologiemi má CRYO (v případě léčby celé žlázy i pouze „fokální“ léčby) nejdelší interval sledování. Namísto skutečně „fokální“ ablace zabezpečuje CRYO regionální ablaci. Tab. 1 ukazuje souhrn onkologických a funkčních výsledků fokální CRYO karcinomu prostaty ze současně publikovaných studií. Registr COLD (Cryo On-Line Database) je velká dobrovolná databáze soustřeďující data z mnoha center a od různých operatérů. Ačkoli se uvádí nízká míra pozitivní biopsie, je třeba poznamenat, že většina pacientů žádnou biopsii po CRYO nepodstoupila [21].
Tab. 1. Souhrn onkologických a funkčních výsledků fokální kryoablace karcinomu prostaty ze současně publikovaných případových studií. 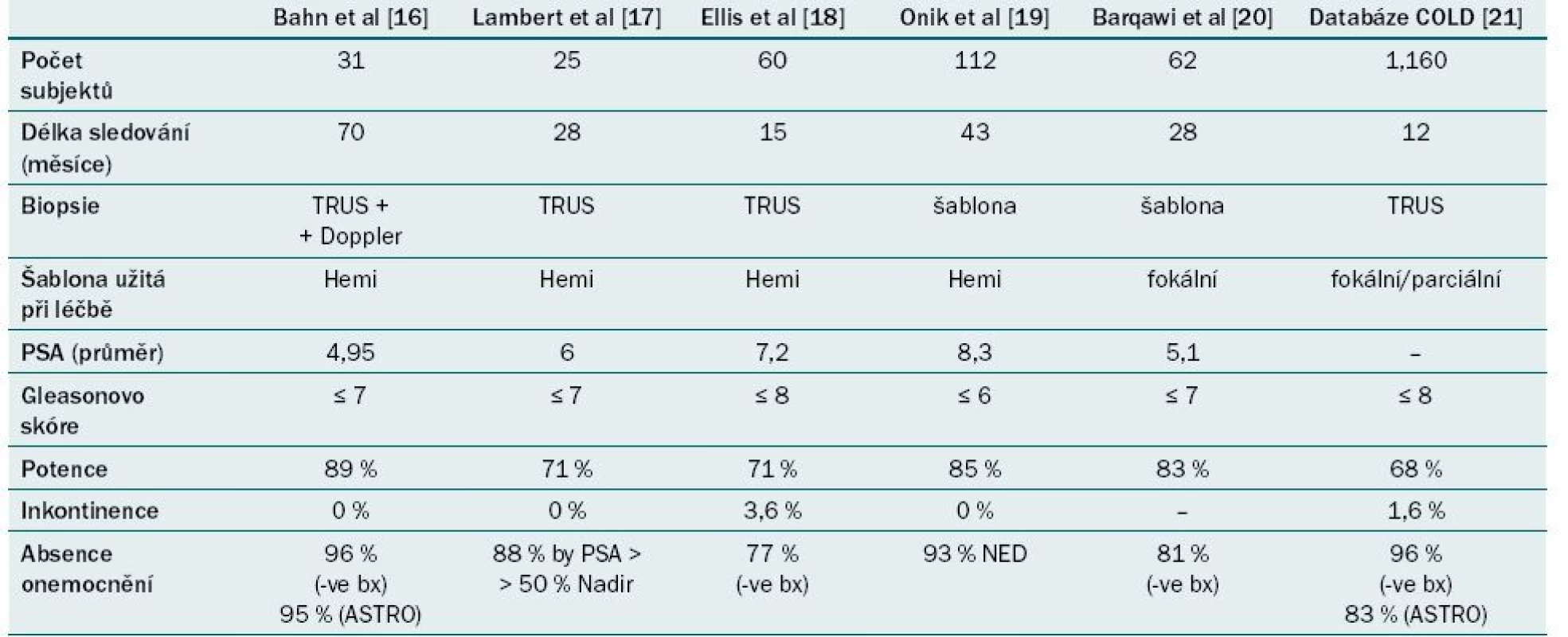
PSA – prostatický specifický antigen, TRUS – transrektální ultrazvukové vyšetření Fokusovaný ultrazvuk o vysoké intenzitě
HIFU byl poprvé využit v klinické praxi v roce 1956 při léčbě poruch centrálního nervového systému [22]. První pokusy využití této modality při léčbě onemocnění prostaty byly realizovány na psím modelu. Od 90. let minulého století se tato procedura užívá v Evropě i v řadě dalších států s výjimkou USA, kde nebyla dosud schválena.
HIFU vlny jsou generovány střídavým napětím přes piezoelektrický materiál. Tyto vlny přenášejí energii tkání při stejné frekvenci, aniž by způsobovaly jakékoli poškození. V důsledku konvergence zvukových vln v ohnisku dochází ke vzniku tepla a zvýšení teploty přesně v požadovaném místě, aniž by docházelo ke vzniku jakýchkoli tepelných změn v průběhu dráhy zvukové vlny. Při HIFU se užívají zvukové vlny o nižší frekvenci (0,8–3,5 MHz) než při diagnostickém UZ (1–20 MHz), přenášejí však energii o vyšší intenzitě (> 5 W/cm2). Konvergencí zvukových vln vzniká v ohnisku energie o intenzitě > 2 000 W/cm2, což vyvolá cytotoxický efekt [23]. Teplota tkáně v ohnisku dosahuje přibližně 100 °C, díky čemuž dochází k účinné destrukci cílové tkáně. Vzhledem k tomu, že se tepelná energie tvoří pouze v ohnisku, okolní tkáň zůstává intaktní, což minimalizuje riziko jejího poškození. Aplikovanou HIFU energii tak lze velmi precizně navigovat v malém prostoru (obr. 3), což je žádoucí pro účely FT. Při vypnutí zařízení dojde k téměř okamžitému zastavení dodávky energie. Tato okamžitá kontrola představuje důležitý bezpečnostní prvek zejména v případě, že dojde k neočekávanému pohybu pacienta nebo cílové tkáně.
Obr. 2. Graf vývoje teploty v čase ukazuje rozdílné teploty v ohnisku a v průběhu dráhy šíření energie. 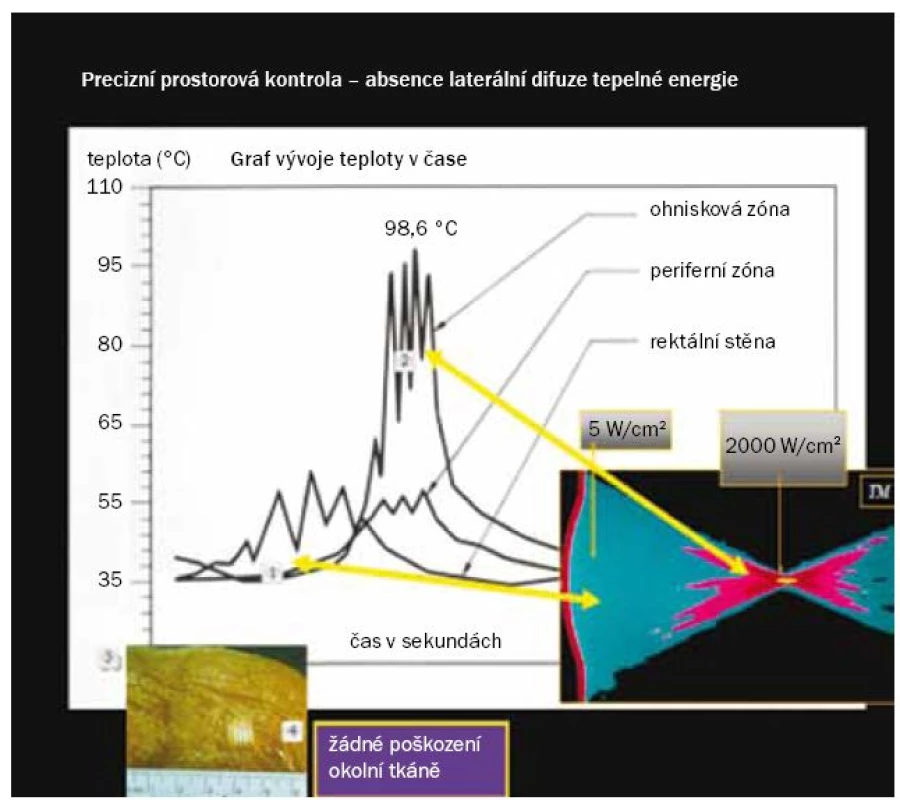
Změny vyvolané akustickou kavitací představují kombinaci koagulační nekrózy a mechanického poškození. Poté, co tkáň dosáhne bodu varu, dochází ke vzniku mechanického poškození, které se projevuje jako cystická imploze. Typické histologické změny vyvolané tepelným působením HIFU jsou popisovány jako tzv. ostrůvek s příkopem, kdy centrální ostrůvek vykazuje koagulační nekrózu vč. úplné destrukce krevního zásobení léze [24]. Výše zmiňovaný „příkop“ popisuje lem v rozsahu 6–10 vedle sebe ležících buněk s vyčerpaným glykogenem, které odumírají během 48 hod. Oblast nekrózy je infiltrována fibroblasty, což má za následek vznik granulační tkáně a v konečném důsledku jizevnaté tkáně.
HIFU systémy
Pro klinické účely existují dva typy HIFU zařízení: Ablatherm® HIFU (Ablatherm, EDAP-TMS) a Sonablate® 500 (SonaCare Medical, Charlotte, North Carolina). Zařízení Ablatherm je roboticky ovladatelné a jeho novější verze Focal-One® je zdokonalena o fúzi MR a UZ pro přesnou lokalizaci oblasti zájmu. Pacient je léčen v laterální dekubitální poloze. Limitací tohoto zařízení je krátká délka ohniska a z tohoto důvodu není optimální pro léčbu větších žláz (> 60 g). Jednou z možností jak obejít toto omezení je zmenšení velikosti prostaty pomocí neoadjuvantní hormonální léčby a transuretrální resekce před HIFU. Toto omezení není překážkou pro FT.
Zařízení Sonablate 500® je ovládáno manuálně a disponuje větší délkou ohniska a z tohoto důvodu je jeho užití vhodnější při léčbě prostatické žlázy větší velikosti. Při léčbě je pacient uložen v litotomické poloze. Zařízení je vybaveno automatickým vypínacím bezpečnostním mechanizmem, který se automaticky aktivuje, pokud rektální teplota přesáhne požadovanou hodnotu.
Techniky HIFU terapie
V našem centru užíváme zařízení Sonablate® 500 (SonaCare Medical, Charlotte, North Carolina). Plán léčby je stanoven na základě fúze již dříve provedených zobrazovacích vyšetření. Během léčby je kontinuálně zaznamenávána rektální teplota. Léčba je monitorována v reálném čase s využitím UZ a po celou dobu je sledována reflektivita a teplota stěny rekta. Obr. 4 ukazuje různé řezy prostatickou tkání a monitorování sledovaných parametrů během aktivní léčby. Tab. 2 ukazuje onkologické a funkční výsledky fokální léčby pomocí HIFU z nejnovějších publikací. Ve většině případů se jedná o malé nerandomizované soubory z jediného centra s krátkodobým sledováním, které však prokazují proveditelnost a bezpečnost této léčby s minimálním výskytem nežádoucích účinků.
Obr. 3. HIFU – kontrolní obrazovka ukazuje příčný řez prostatické žlázy (levá obrazovka) a sagitální řez (pravá obrazovka) s barevně označenou oblastí ablace. 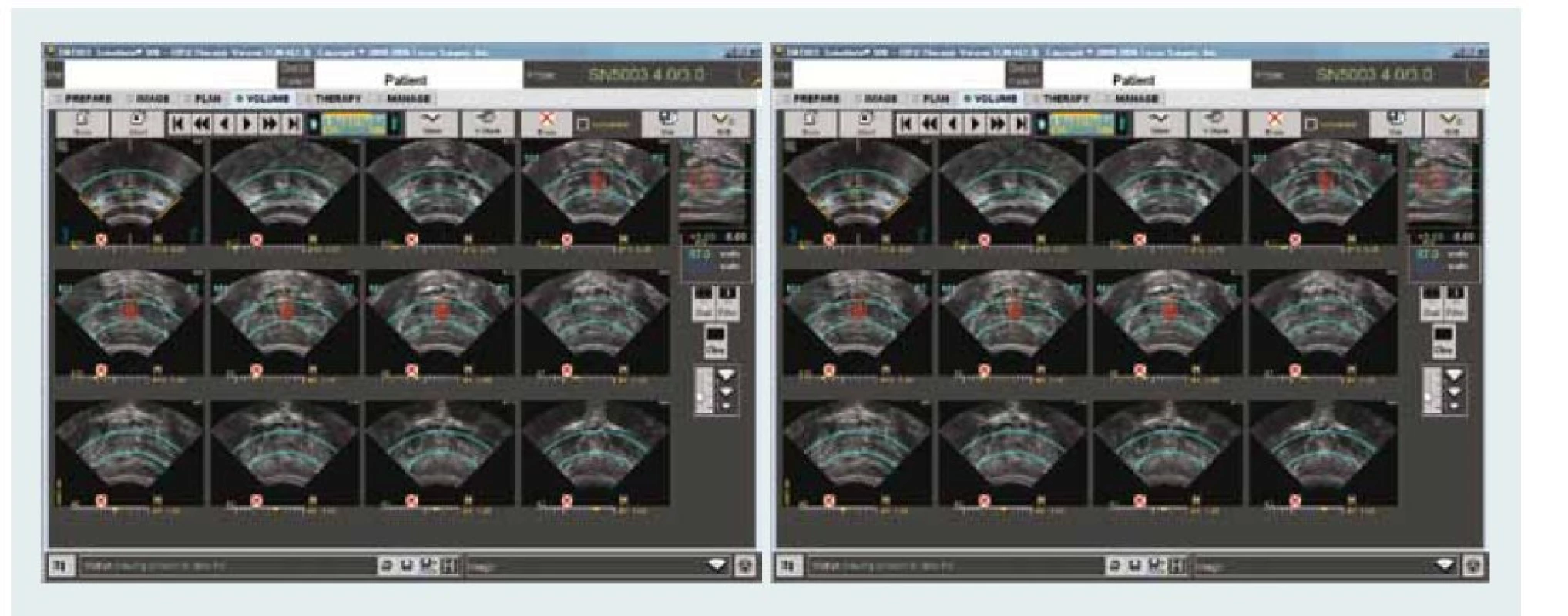
HIFU – fokusovaný UZ o vysoké intenzitě Tab. 2. Souhrn onkologických a funkčních výsledků fokální HI FU karcinomu prostaty ze současně publikovaných případových studií. 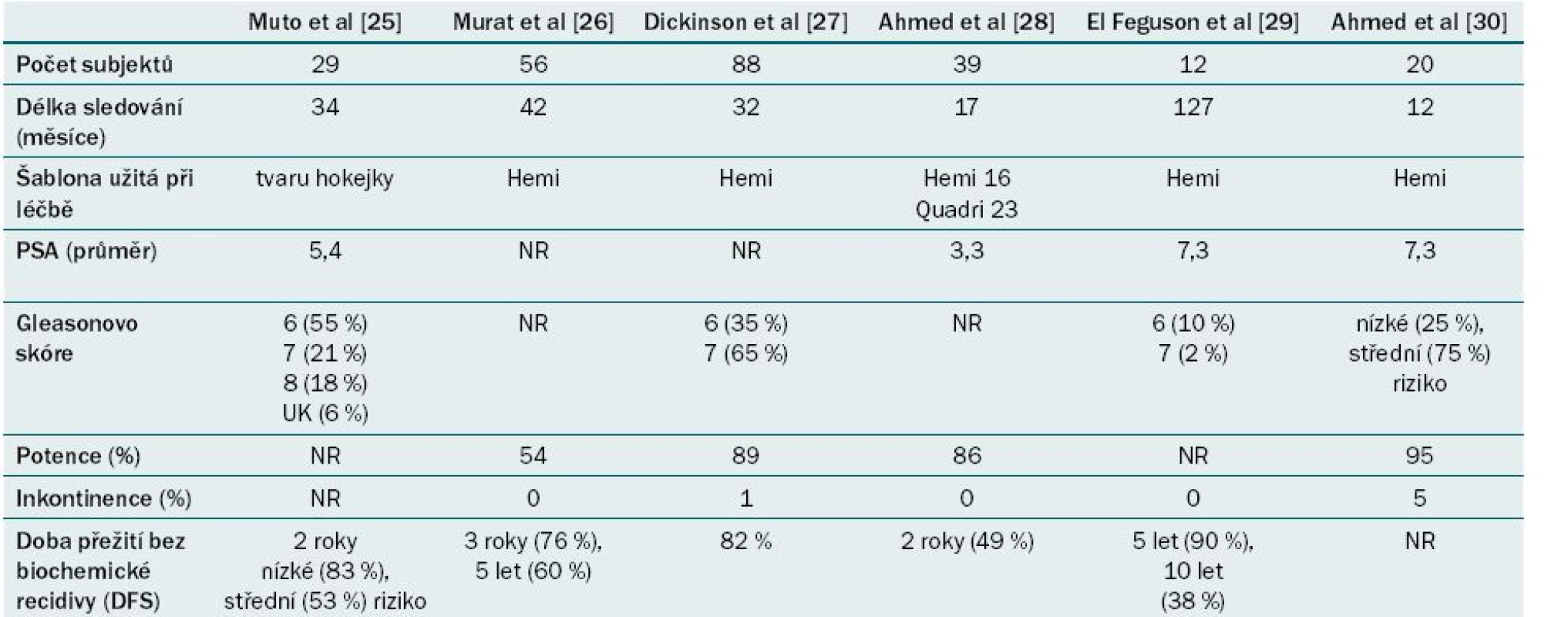
NR – není uvedeno Další modality fokální terapie
Mezi další modality fokální léčby, které jsou v současné době intenzivně zkoumány, patří cévní cílená terapie (např. fotodynamická léčba s použitím bakteriochlorofylového fotosenzitizéru „WST-11 TOOKAD“) s použitím intersticiálního laseru a brachyterapie s použitím intersticiálních radioaktivních zrn. Ireverzibilní elektroporace (technologie „Nano-knife“) spočívá v zavedení drátěných sond pod TRUS kontrolou do intersticia prostaty. Intenzivní výboj elektrické energie, který vytváří silné lokální elektrické pole, vyvolává buněčnou smrt.
Výhled do budoucna
Pro ověření role fokální léčby KP budou nezbytné multicentrické studie provedené podle jednotného schématu, které budou zahrnovat identická (nebo přinejmenším srovnatelná) kritéria pro zařazení/nezařazení pacientů do studie, sledovací protokoly (před i po léčbě) s dobře definovanými výslednými parametry, vyzrálejší data a dlouhodobější sledování. Tento proces usnadní další vývoj zobrazovacích modalit a technik biopsie, vč. multimodální fúze a zdokonalení vlastních typů energie užívaných k ablaci.
Závěr
Fokální nebo regionální terapie v kombinaci s nejmodernějšími zobrazovacími technikami a technikami biopsie a účinnými modalitami ablace mohou zajistit kompromis mezi dvěma extrémy terapeutických přístupů pro léčbu lokalizovaného KP s nízkým a středním rizikem (tj. radikální operace nebo radioterapie vs. AS). FT umožní eliminovat ložisko karcinomu při současné minimalizaci nežádoucích účinků této léčby. Navíc umožňuje pečlivé sledování reziduální tkáně a v případě potřeby i opakovanou léčbu. Klíčem k úspěchu je samozřejmě pečlivá volba pacientů.
prof. Joseph L. Chin, MD, FRCSC
Division of Surgical Oncology
University of Western Ontario
E2-650, 800 Commissioners Road East
London, Ontario N6A 5W9
Canada
joseph.chin@lhsc.on.ca
Zdroje
1. Eggener SE, Scardino PT, Carroll PR et al. International task force on prostate cancer and the focal lesion paradigm. Focal therapy for localized prostate cancer: a critical appraisal of rationale and modalities. J Urol 2007; 178(6): 2260–2267.
2. Valerio M, Ahmed HU, Emberton M et al. The role of focal therapy in the management of localized prostate cancer: a systematic review. Eur Urol 2014; 66(4): 732–751. doi: 10.1016/j.eururo.2013.05.048.
3. Cool DW, Zhang X, Romagnoli C et al. Evaluation of MRI-TRUS fusion versus cognitive registration accuracy for MRI-targeted, TRUS-guided prostate biopsy. AJR Am J Roentgenol 2015; 204(1): 83–91. doi: 10.2214/AJR.14.12681.
4. Tran M, Thompson J, Böhm M et al. Combination of multiparametric MRI and transperineal template-guided mapping biopsy of the prostate to identify candidates for hemi-ablative focal therapy. BJU Int 2015; 193(4): doi:10.1111/bju.13090.
5. Crawford ED, Rove KO, Barqawi AB et al. Clinical--pathologic correlation between transperineal mapping biopsies of the prostate and three-dimensional reconstruction of prostatectomy specimens. Prostate 2013; 73(7): 778–787. doi: 10.1002/pros.22622.
6. Cool DW, Connolly MJ, Sherebrin S et al. Repeat prostate biopsy accuracy: simulator-based comparison of two - and three-dimensional transrectal US modalities. Radiology 2010; 254(2): 587–594. doi: 10.1148/radiol.2542090674.
7. Kanthabalan A, Arya M, Punwani S et al. Role of focal salvage ablative therapy in localised radiorecurrent prostate cancer. World J Urol 2013; 31(6): 1361–1368.
8. Chin JL, Pautler SE, Mouraviev V et al. Results of salvage cryoablation of the prostate after radiation: identifying predictors of treatment failure and complications. J Urol 2001; 165 (6 Pt 1): 1937–1942.
9. Chalasani V, Martinez CH, Lim D et al. Salvage HIFU for recurrent prostate cancer after radiotherapy. Prostate Cancer Prostatic Dis 2009; 12(2): 124–129. doi: 10.1038/pcan.2008.53.
10. Ng CK, Moussa M, Downey DB et al. Salvage cryoablation of the prostate: followup and analysis of predictive factors for outcome. J Urol 2007 Oct; 178 (4 Pt 1): 1253–1257.
11. Williams AK, Martínez CH, Lu C et al. Disease--free survival following salvage cryotherapy for biopsy-proven radio-recurrent prostate cancer. Eur Urol 2011; 60(3): 405–410. doi: 10.1016/j.eururo.2010.12.012.
12. Uddin Ahmed H, Cathcart P, Chalasani V et al. Whole-gland salvage high-intensity focused ultrasound therapy for localized prostate cancer recurrence after external beam radiation therapy. Cancer 2012; 118(12): 3071–3078. doi: 10.1002/cncr.26631.
13. Soanes WA, Gander MJ, Shulman S. Apparatus and techniques for cryosurgery of the prostate. J Urol 1966; 96(4): 508–511.
14. Chin JL, Downey DB, Onik G et al. Three-dimensional prostate ultrasound and its application to cryosurgery. Tech Urol 1996; 2(4): 187–193.
15. Chin JL, Downey DB, Mulligan M et al. Three-dimensional transrectal ultrasound guided cryoablation for localized prostate cancer in nonsurgical candidates: a feasibility study and report of early results. J Urol 1998; 159(3): 910–914.
16. Bahn DK, Silverman P, Lee F Sr et al. Focal prostate cryoablation: initial results show cancer control and potency preservation. J Endourol 2006 Sep; 20(9): 688–692.
17. Lambert EH, Bolte K, Masson P et al. Focal cryosurgery: encouraging health outcomes for unifocal prostate cancer. Urology 2007; 69(6): 1117–1120.
18. Ellis DS, Manny TB Jr, Rewcastle JC. Focal cryosurgery followed by penile rehabilitation as primary treatment for localized prostate cancer: initial results. Urology 2007; 70 (Suppl 6): 9–15. doi: 10.1016/j.urology.2007.07.036.
19. Onik G, Vaughan D, Lotenfoe R et al. The “male lumpectomy”: focal therapy for prostate cancer using cryoablation results in 48 patients with at least 2-year follow-up. Urol Oncol 2008; 26(5): 500–505. doi: 10.1016/j.urolonc.2008.03.004.
20. Barqawi AB, Stoimenova D, Krughoff K et al. Targeted focal therapy for the management of organ confined prostate cancer. J Urol 2014; 192(3): 749–753. doi: 10.1016/j.juro.2014.03.033.
21. Ward JF, Jones JS. Focal cryotherapy for localized prostate cancer: a report from the national Cryo On-Line Database (COLD) Registry. BJU Int 2012; 109(11): 1648–1654. doi: 10.1111/j.1464-410X.2011.10578.x.
22. Ballantine Ht Jr, Hueter TF, Nauta WJ et al. Focal destruction of nervous tissue by focused ultrasound: biophysical factors influencing its application. J Exp Med 1956; 104(3): 337–360.
23. Clement GT. Perspectives in clinical uses of high-intensity focused ultrasound. Ultrasonics 2004; 42(10): 1087–1093.
24. Ter Haar GR, Robertson D. Tissue destruction with focused ultrasound in vivo. Eur Urol 1993; 23 (Suppl 1): 8–11.
25. Muto S, Yoshii T, Saito K et al. Focal therapy with high-intensity-focused ultrasound in the treatment of localized prostate cancer. Jpn J Clin Oncol 2008; 38(3): 192–199. doi: 10.1093/jjco/hym173.
26. Murat FJ, Cherasse A, Poissonnier L et al. Focal therapy of prostate cancer (PCa) with HIFU: influence on erectile dysfunction (ED). Eur Urol Suppl 2009; 8 : 334.
27. Dickinson L, Ahmed HU, McCartan N et al. Medium term outcomes following primary focal therapy using HIFU for localized prostate cancer. BJU Int 2012; 109(7): 6.
28. Ahmed HU, Cathcart P, McCartan N et al. Focal salvage therapy for localized prostate cancer recurrence after external beam radiotherapy: a pilot study. Cancer 2012; 118(17): 4148–4155. doi: 10.1002/cncr.27394.
29. El Fegoun AB, Barret E, Prapotnich D et al. Focal therapy with highintensity focused ultrasound for prostate cancer in the elderly. A feasibility study with 10 years follow-up. Int Braz J Urol 2011; 37(2): 213–219.
30. Ahmed HU, Freeman A, Kirkham A et al. Focal therapy for localized prostate cancer: a phase I/II trial. J Urol 2011; 185(4): 1246–1254. doi: 10.1016/j.juro.2010.11.079.
Štítky
Detská urológia Urológia
Článok vyšiel v časopiseUrologické listy
Najčítanejšie tento týždeň
2015 Číslo 3- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- Současné možnosti řešení neurogenního močového měchýře u dospělých pacientů – přehled
- Selektivní modulátory estrogenních receptorů a léčba mužského hypoandrogenizmu – systematická analýza
- Technologie „The Rezūm™ System“ v léčbě BPH – klinické výsledky střednědobého sledování
- Editorial
- Sexuální funkce po transuretrální resekci prostaty
- Fokální léčba lokalizovaného karcinomu prostaty
-
Pokroky v léčbě kastračně rezistentního karcinomu prostaty
Zpráva ze satelitního sympozia uspořádaného za podpory společnosti Astellas v rámci kongresu ČUS - Karcinom prostaty – diagnóza s multidisciplinárním přístupem k léčbě aneb bez spolupráce to nejde
-
BPH: Why? The real story…
Zpráva ze satelitního sympozia uspořádaného v roce 2015 za podpory společnosti Berlin-Chemie/Menarini -
Guidelines pro léčbu močové inkontinence
2. část - Léčba non-neurogenního hyperaktivního močového měchýře – přehled guidelines Americké urologické asociace a Society of Urodynamics, Female Pelvic Medicine & Urogenital Reconstruction
- Urologické listy
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Selektivní modulátory estrogenních receptorů a léčba mužského hypoandrogenizmu – systematická analýza
- Současné možnosti řešení neurogenního močového měchýře u dospělých pacientů – přehled
- Technologie „The Rezūm™ System“ v léčbě BPH – klinické výsledky střednědobého sledování
- Sexuální funkce po transuretrální resekci prostaty
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



