-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Guidelines pro léčbu renálního karcinomu
Autori: B. Ljungberg; K. Bensalah; A. Bex; S. Canfield; R. H. Giles; M. Hora; M. A. Kuczyk; T. Lam; A. S. Merseburger; T. Powles; M. Staehler; A. Volpe
Vyšlo v časopise: Urol List 2016; 14(1): 41-80
Kategória: Guidelines
*(Chair)
**(Vice-chair)
***(Patient Advocate)
Guidelines Associates: S. Dabestani, S. Fernández-Pello Montes, F. Hofmann, L. Marconi, R. Tahbaz
©European Association of Urology 2016Obsah
1. Úvod 45
- 1.1 Cíle a zaměření 45
- 1.2 Členové panelu 45
- 1.3 Dostupné publikace 45
- 1.4 Předchozí publikace a přehled změn 45
- 1.4.1. Předchozí publikace 45
- 1.4.2 Přehled změn 45
- 3.4 Souhrn důkazů a doporučení pro léčbu dalších typů nádorů ledvin 45
- 7.2.5.1 Souhrn důkazů a doporučení pro adjuvantní léčbu 45
- 7.3.2.5 Souhrn důkazů a doporučení pro lokální léčbu metastáz u pacientů s metastazujícím RCC 45
- 7.4.1.1 Souhrn důkazů a doporučení pro systémovou léčbu pokročilého/metastazujícího RCC 45
- 7.4.2.5 Souhrn důkazů a doporučení pro léčbu metastazujícího RCC pomocí imunoterapie 46
- 7.4.6.3 Souhrn důkazů a doporučení pro systémovou léčbu metastazujícího RCC 46
- 1.5 Literatura 46
2. Metody 46
- 2.1 Sběr důkazů 46
- 2.2 Přehled 46
- 2.3 Cíle do budoucna 46
- 2.4 Literatura 47
3. Epidemiologie, etiologie a patologie 47
- 3.1 Epidemiologie 47
- 3.1.1 Souhrn důkazů a doporučení 48
- 3.2 Histologická diagnóza 48
- 3.2.1 Světlobuněčný karcinom 48
- 3.2.2 Papilární karcinom 48
- 3.2.3 Chromofobní karcinom 48
- 3.3 Ostatní nádory ledvin 48
- 3.3.1 Karcinom související s ESKD, RCC spojený se získanou cystózou ledvin 48
- 3.3.2 Papilární adenom 50
- 3.3.3 Hereditární nádory ledviny 50
- 3.3.4 Angiomyolipom 50
- 3.3.4.1 Léčba 50
- 3.3.4.2 Souhrn 50
- 3.4 Souhrn důkazů a doporučení pro léčbu dalších typů nádorů ledvin 50
- 3.5 Literatura 51
4. Staging a klasifikační systémy 52
- 4.1 Staging 52
- 4.2 Anatomické klasifikační systémy 52
- 4.3 Literatura 52
5. Diagnostické vyšetření 53
- 5.1 Symptomy 53
- 5.1.1 Fyzikální vyšetření 53
- 5.1.2 Laboratorní nálezy 53
- 5.2 Zobrazovací vyšetření 53
- 5.2.1 Přítomnost sycení (enhancement) 53
- 5.2.2 CT nebo MR 53
- 5.2.3 Další diagnostická vyšetření 54
- 5.2.4 Radiografické vyšetření metastazujícího RCC 54
- 5.2.5 Bosniakova klasifikace cystických lézí ledviny 54
- 5.3 Biopsie nádoru ledviny 54
- 5.4 Doporučení pro diagnostické vyšetření RCC 55
- 5.5 Literatura 55
6. Prognostické faktory 56
- 6.1 Anatomické faktory 56
- 6.2 Histologické faktory 56
- 6.3 Klinické faktory 57
- 6.4 Molekulární faktory 57
- 6.5 Prognostické systémy a nomogramy 57
- 6.6 Souhrn důkazů a doporučení týkajících se prognostických faktorů 58
- 6.7 Literatura 58
7. Léčba onemocnění 59
- 7.1 Léčba lokalizovaného RCC 59
- 7.1.1 Úvod 59
- 7.1.2 Operační léčba 59
- 7.1.2.1 Nefron šetřící operace vs. RN 59
- 7.1.2.2 Související operace 60
- 7.1.2.2.1 Adrenalektomie 60
- 7.1.2.2.2 Lymfadenektomie indikovaná pro resekci klinicky negativních LN (cN0) 60
- 7.1.2.2.3 Embolizace 60
- 7.1.2.2.4 Souhrn důkazů a doporučení 60
- 7.1.3 Techniky RN a PN 60
- 7.1.3.1 Techniky RN 60
- 7.1.3.2 Techniky PN 61
- 7.1.3.3 Souhrn důkazů a doporučení 62
- 7.1.4 Alternativní terapeutické přístupy 62
- 7.1.4.1 Operační vs. neoperační léčba 62
- 7.1.4.2 Sledování 62
- 7.1.4.3 Ablativní terapie 62
- 7.1.4.3.1 Kryoablace 62
- 7.1.4.3.2 Kryoablace vs. parciální resekce ledviny 63
- 7.1.4.3.3 Radiofrekvenční ablace 63
- 7.1.4.3.4 Radiofrekvenční ablace vs. parciální resekce ledviny 63
- 7.1.4.3.5 Kryoablace vs. radiofrekvenční ablace 63
- 7.1.4.3.6 Další ablativní techniky 63
- 7.1.4.3.7 Souhrn důkazů a doporučení 63
- 7.2 Léčba lokálně pokročilého RCC 63
- 7.2.1 Úvod 63
- 7.2.2 Řešení klinicky pozitivních LN (cN+) 63
- 7.2.3 Řešení lokálně pokročilého neresekovatelného RCC 63
- 7.2.4 Řešení RCC s žilním nádorovým trombem 63
- 7.2.4.1 Důkazy podporující operační přístup u pacientů s žilním nádorovým trombem 64
- 7.2.4.2 Důkazy podporující různé operační strategie 64
- 7.2.4.3 Souhrn důkazů a doporučení 64
- 7.2.5 Adjuvantní terapie 64
- 7.2.5.1 Souhrn důkazů a doporučení pro adjuvantní léčbu 65
- 7.3 Pokročilý/metastazující RCC 65
- 7.3.1 Lokální léčba pokročilého/metastazujícího RCC 65
- 7.3.1.1 Cytoredukční nefrektomie 65
- 7.3.1.1.1 Embolizace primárního nádoru 65
- 7.3.1.1.2 Souhrn důkazů a doporučení pro lokální léčbu pokročilého/metastazujícího RCC 65
- 7.3.2 Lokální léčba metastáz u pacientů s metastazujícím RCC 65
- 7.3.2.1 Kompletní vs. žádná/nekompletní MTS 65
- 7.3.2.2 Lokální léčba kostních metastáz u pacientů s RCC 66
- 7.3.2.3 Lokální léčba metastáz do mozku u pacientů s RCC 66
- 7.3.2.4 Embolizace metastáz 66
- 7.3.2.5 Souhrn důkazů a doporučení pro lokální léčbu metastáz u pacientů s metastazujícím RCC 66
- 7.4 Systémová léčba pokročilého/metastazujícího RCC 66
- 7.4.1 Chemoterapie 66
- 7.4.1.1 Souhrn důkazů a doporučení pro systémovou léčbu pokročilého/metastazujícího RCC 66
- 7.4.2 Imunoterapie 66
- 7.4.2.1 IFN-α jako monoterapie a v kombinaci s bevacizumabem 66
- 7.4.2.2 Interleukin-2 67
- 7.4.2.3 Vakcíny a cílená imunoterapie 67
- 7.4.2.4 Blokáda kontrolních bodů imunitní reakce (immune checkpoint blockade) 67
- 7.4.2.5 Souhrn důkazů a doporučení pro léčbu metastazujícího RCC pomocí imunoterapie 67
- 7.4.3 Cílené terapie 67
- 7.4.3.1 Inhibitory tyrozinkinázy 68
- 7.4.3.1.1 Sorafenib 68
- 7.4.3.1.2 Sunitinib 68
- 7.4.3.1.3 Pazopanib 69
- 7.4.3.1.4 Axitinib 69
- 7.4.3.1.5 Cabozantinib 69
- 7.4.4 Monoklonální protilátky proti cirkulujícímu VEGF 69
- 7.4.4.1 Bevacizumab jako monoterapie a bevacizumab + IFN-α 69
- 7.4.5 Inhibitory mTOR 70
- 7.4.5.1 Temsirolimus 70
- 7.4.5.2 Everolimus 70
- 7.4.6 Terapeutické strategie a doporučení 70
- 7.4.6.1 Léčba pacientů s metastazujícím ccRCC, kteří ještě nepodstoupili žádnou léčbu 70
- 7.4.6.1.1 Sekvenční cílená terapie 70
- 7.4.6.1.1.1 Léčba po progresi onemocnění po jedné nebo více liniích cílené terapie zaměřené na VEGF 70
- 7.4.6.1.1.2 Léčba po progresi onemocnění po léčbě inhibitory mTOR 71
- 7.4.6.1.1.3 Léčba po progresi onemocnění po léčbě cytokiny 71
- 7.4.6.1.1.4 Léčba po cílené terapii druhé linie 71
- 7.4.6.1.1.4.1 Léčba po dvou liniích cílené terapie zaměřené na VEGF 71
- 7.4.6.1.1.4.2 Léčba po inhibici VEGFR a mTOR 71
- 7.4.6.1.1.5 Kombinace cílných preparátů 71
- 7.4.6.2 Nesvětlobuněčný RCC 71
- 7.4.6.3 Souhrn důkazů a doporučení pro systémovou léčbu metastazujícího RCC 72
- 7.5 Recidivující RCC 73
- 7.5.1 Úvod 73
- 7.5.2 Souhrn důkazů a doporučení pro léčbu pokročilého/metastazujícího RCC 73
- 7.6 Literatura 74
8. SLEDOVÁNÍ PO RN, PN NEBO ABLATIVNÍ LÉČBĚ RCC 78
- 8.1 Úvod 78
- 8.2 Jaká vyšetření indikovat u individuálních pacientů a kdy? 79
- 8.3 Souhrn důkazů a doporučení při sledování pacientů s RCC po RN, PN nebo ablativní léčbě 79
- 8.4 Priority pro další výzkum 80
- 8.5 Literatura 80
1. Úvod
1.1 Cíle a zaměření
Členové panelu pro tvorbu guidelines Evropské urologické asociace (The European Association of Urology – EAU) připravili tato guidelines pro řešení renálního karcinomu (renal cell carcinoma – RCC) s cílem poskytnout urologům informace založené na důkazech a doporučení pro léčbu RCC.
Je třeba zdůraznit, že ačkoli klinická guidelines prezentují v současné době nejlepší dostupné důkazy, dodržování uvedených doporučení nemusí nezbytně zajistit optimální výsledek. Guidelines nemohou při volbě vhodné léčby u individuálních pacientů v žádném případě nahradit klinickou zkušenost, spíše pomáhají lékařům zaměřit rozhodování správným směrem a rovněž zohlednit osobní hodnoty a preference a individuální parametry pacienta.
1.2 Členové panelu
Panel autorů těchto guidelines tvoří mezinárodní skupina lékařů sestávající z urologů, onkologa, metodologů, patologa a radiologa, se speciálním zaměřením na oblast urologické péče. Od roku 2015 členové panelu rozšířili své řady o zástupce pacientů, což umožní zohlednit rovněž jejich úhel pohledu.
Všichni odborníci, kteří se podíleli na tvorbě tohoto dokumentu, poskytli prohlášení o potenciálním střetu zájmů, která jsou k dispozici na následující webové stránce: http://uroweb.org/guideline/renal-cell-carcinoma/.
Autoři by chtěli poděkovat za metodologickou i odbornou pomoc v různých kapitolách guidelines těmto odborníkům:
- prof. dr. O. Hes, patolog, Plzeň (CZ), kapitola Ostatní nádory ledviny;
- dr. M. Lardas, Aberdeen (VB) a dr. F. Stewart, Aberdeen (VB), systematický přehled – nádorový trombus;
- dr. Ch. Vogel, Mnichov (DE) a prof. dr. A. Graser, radiolog, Mnichov (DE), systematický přehled – diagnostické zobrazovací metody RCC.
1.3 Dostupné publikace
K dispozici je rovněž zkrácená verze dokumentu (kapesní guidelines) v tiskové podobě i verze pro mobilní zařízení, která obsahuje nejdůležitější závěry guidelines pro řešení RCC. Studium zkrácené verze může být vhodné doplnit nahlédnutím do plného znění dokumentu. K dispozici je několik vědeckých publikací zabývajících se touto problematikou a rovněž překlady všech verzí EAU Guidelines pro řešení RCC do různých jazyků [1,2]. Všechny dokumenty jsou ke stažení na webové stránce EUA: http://uroweb.org/guideline/renal-cell-carcinoma/.
1.4 Předchozí publikace a přehled změn
1.4.1. Předchozí publikace
EUA Guidelines pro řešení RCC byly poprvé uveřejněny v roce 2000. Dokument z roku 2016 představuje aktualizaci předchozí verze z roku 2015.
1.4.2 Přehled změn
Všechny kapitoly stávající verze guidelines byly aktualizovány na základě předchozí verze z roku 2015.
Znění jednotlivých závěrů a doporučení bylo přeformulováno a doplněno v rámci celého dokumentu.
Klíčové změny v této verzi guidelines zahrnují:
- kapitola 3 – Epidemiologie, etiologie a patologie – zařazení nové vancouverské histologické klasifikace ISUP (International Society of Urological Pathology).
- kapitola 7.4.3.1 – Inhibitory tyrozinkinázy – zařazení nového schématu (schéma 7.1. Doporučení pro pacienty s metastazujícím světlobuněčným RCC (ccRCC), u nichž selhala jedna nebo více cílených terapií zaměřených na vaskulární endoteliální růstový faktor (VEGF).
Následující kapitoly těchto guidelines byly rozšířeny o nové informace a doporučení:
- 3.4 Souhrn důkazů a doporučení pro léčbu dalších typů nádorů ledvin (str. 50)
- 7.2.5.1 Souhrn důkazů a doporučení pro adjuvantní léčbu (str. 65)
- 7.3.2.4 Embolizace metastáz (str. 66)
- 7.3.2.5 Souhrn důkazů a doporučení (str. 66)
- 7.4.1.1 Souhrn důkazů a doporučení pro systémovou léčbu pokročilého/metastazujícího RCC (str. 66)
- 7.4.2.5 Souhrn důkazů a doporučení pro imunoterapii při léčbě metastazujícího RCC (str. 67)
- 7.4.6.3 Souhrn důkazů a doporučení pro systémovou léčbu metastazujícího RCC (str. 72)
Souhrn důkazů a doporučení k části 3.4 
AML – angiomyolipom, RCC – renální karcinom Souhrn důkazů a doporučení k části 7.2.5.1 
Souhrn důkazů k části 7.4.1.1 
RCC – renální karcinom Souhrn důkazů a doporučení k části 7.4.2.5 
IFN-α – interferon alfa, VEGF – vaskulární endoteliální růstový faktor, RCC – renální karcinom, mTOR – cíl pro rapamycin u savců Souhrn důkazů a doporučení k části 7.4.6.3 
VEGF – vaskulární endoteliální růstový faktor, RCC – renální karcinom, ccRCC – světlobuněčný karcinom 1.5 Literatura
- Ljungberg B, Hanbury DC, Kuczyk MA et al. Renal cell carcinoma guideline. Eur Urol 2007; 51(6): 1502–1510.
- Ljungberg, B, Bensalah K, Canfield S et al. EAU guidelines on renal cell carcinoma: 2014 update. Eur Urol 2015; 67(5): 913–924. doi: 10.1016/j.eururo.2015.01.005.
2. Metody
2.1 Sběr důkazů
Pro většinu kapitol v této verzi guidelines (tab. 1) byly nashromážděny a strukturovaným způsobem hodnoceny nové a důležité důkazy.
Tab. 1. Charakteristika aktualizovaných částí a přehled metodologických postupů užívaných při hodnocení literatury. 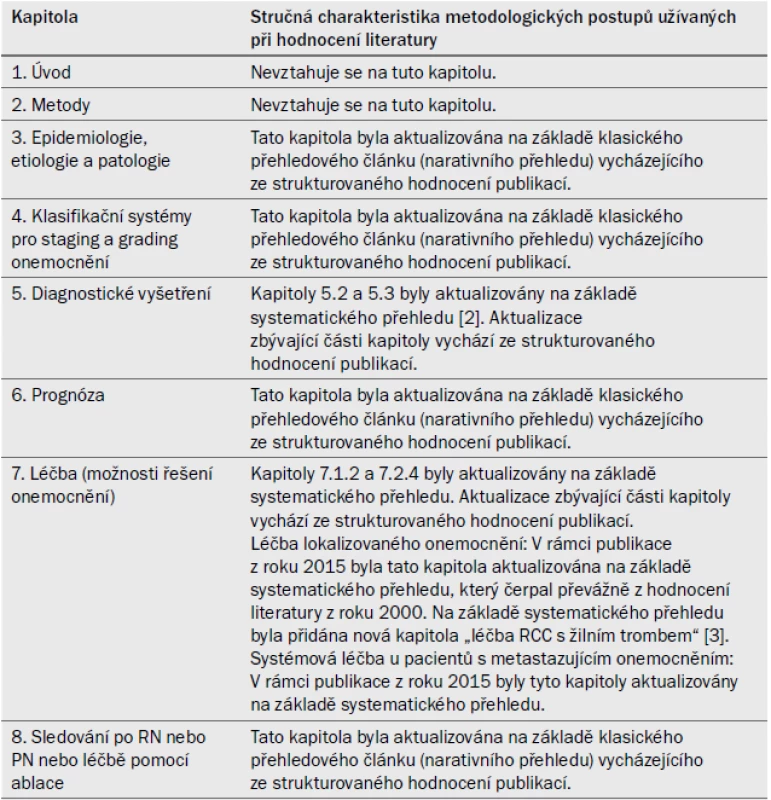
RCC – renální karcinom, RN – radikální nefrektomie, PN – parciální resekce ledviny Autoři provedli rozsáhlou a komplexní analýzu zahrnující všechny oblasti dokumentu. Vyhledávání bylo omezeno pouze na studie zahrnující důkazy vysoké úrovně (tj. systematické přehledy (systematic review – SR) s metaanalýzami, randomizované kontrolované studie (RCT) a prospektivní nerandomizované komparativní studie) publikované v angličtině. Interval vyhledávání zahrnoval období od 1. ledna 2013 do 30. července 2015. Autoři čerpali z databází Medline, EMBASE a Cochrane Library. Celkem bylo nashromážděno a analyzováno 1 602 jedinečných publikací. Vyhledávací strategii autoři uveřejnili na následující webové stránce: http://uroweb.org/guideline/renal-cell-carcinoma/?type=appendices-publications.
Konkrétní kapitoly byly aktualizovány na základě SR vytvořených členy panelu ve spolupráci s EAU Guidelines Office. Členové panelu stanovili prioritu jednotlivých témat a otázek. Při tvorbě přehledů byla užita standardizovaná metodologie Cochrane SR http://www.cochranelibrary.com/about/about-cochrane-systematic-reviews.html.
Citovaná literatura byla hodnocena podle úrovně důkazu (level of evidence – LE) a jednotlivé pokyny jsou klasifikovány na základě stupně doporučení (grade of recommendation – GR) v souladu s klasifikačním systémem upraveným podle oxfordského Centra medicíny založené na důkazech (Oxford Centre for Evidence-Based Medicine Levels of Evidence) [1]. Další informace týkající se metodologie zpracování dokumentu lze najít v kapitole Metodologie a na webové stránce EUA: http://uroweb.org/guidelines/.
Na stejné webové stránce je rovněž k dispozici seznam společností, které se řídí pokyny Guidelines EAU.
Aktualizovaná verze pro rok 2016 obsahuje závěry pro řadu témat, která byla předmětem SR:
- Jaká je nejvhodnější operační modalita pro léčbu nádorů ve stadiu ≥ T2 N0 M0? Jaký je nejvhodnější způsob provedení této operační procedury?
- Jaká je nejvhodnější terapeutická modalita pro léčbu pokročilého/metastazujícího nesvětlobuněčného RCC?
- Provedení CT při úvodním vyšetření v případě podezření na nádor ledviny.
2.2 Přehled
Před uveřejněním byl text následující kapitoly nezávisle recenzován:
- Kapitola 7 – Léčba onemocnění
Ostatní kapitoly guidelines byly nezávisle recenzovány před publikací v roce 2015.
2.3 Cíle do budoucna
V rámci budoucích aktualizací dokumentu se členové panelu zaměří na výsledky uváděné pacientem (neboli výsledky nazírané z pohledu pacienta – patient-reported outcomes – PRO).
Do oblasti zájmu autorů dále spadá možnost využití klinických indikátorů kvality. Pro tuto populaci pacientů bylo identifikováno několik klíčových indikátorů kvality:
- CT vyšetření hrudníku pro stanovení stadia plicních metastáz,
- podíl pacientů s nádory ve stadiu T1a N0 M0, kteří podstupují nefron šetřící operaci (nephron-sparing surgery – NSS) v rámci léčby první volby,
- podíl pacientů, kteří podstoupí léčbu během prvních šesti týdnů od diagnostikování onemocnění,
- podíl pacientů s metastazujícím RCC, kterým byla nabídnuta cílená léčba,
- podíl pacientů podstupujících minimálně invazivní nebo operační léčbu v rámci léčby první volby, kteří zemřou během 30 dnů,
- členové panelu založili databázi pro záznam současné praxe ve sledování pacientů s RCC v několika evropských centrech. Mezi primární cíle tohoto projektu patří hodnocení typů recidivy a využití zobrazovacích vyšetření.
Výsledky probíhajících/budoucích SR budou zařazeny do aktualizované verze guidelines pro rok 2017.
Probíhající SR:
- Jaká je nejvhodnější léčba nádorů ve stadiu T1a? (aktualizováno).
- Jaká je nejvhodnější léčba nádorů ve stadiu T1b–T2b? (aktualizováno).
- Jaké jsou indikace pro léčbu angiomyolipomu (AML)?
- SR a metaanalýza systémové léčby nádorů ledviny?
- Zobrazovací vyšetření po léčbě zahrnující tato dílčí témata:
a) pooperační sledování lokalizovaného/lokálně pokročilého onemocnění, b) sledování po systémové léčbě.
2.4 Literatura
- Phillips B, Ball C, Sackett D et al. Oxford centre for evidence-based medicine levels of evidence (March 2009). [online]. Available from: http://www.cebm.net/oxford-centre-evidence-based-medicine-levels-evidence-march-2009/.
- Marconi L, Dabestani S, Lam TB et al. Systematic review and meta-analysis of diagnostic accuracy of percutaneous renal tumour biopsy. Eur Urol 2016; 69(4): 660–673. doi: 10.1016/j.eururo.2015.07.072.
- Lardas M, Stewart F, Scrimgeour D et al. Systematic review of surgical management of nonmetastatic renal cell carcinoma with vena caval thrombus. Eur Urol 2015; S0302-2838(15)01205-1. doi: 10.1016/j.eururo.2015.11.034.
3. Epidemiologie, etiologie a patologie
3.1 Epidemiologie
RCC tvoří přibližně 2–3 % všech karcinomů [1]. Nejvyšší incidence RCC se uvádí v západních zemích. Celosvětový i evropský roční nárůst činí přibližně 2 %, ačkoli v Dánsku a Švédsku byl v uplynulých dvou desetiletích pozorován trvalý pokles incidence [2].
V roce 2012 byl v rámci EU RCC diagnostikován přibližně u 84 400 pacientů a 34 700 pacientů na toto onemocnění zemřelo [3]. Do počátku 90. let minulého století byl v Evropě pozorován celkový nárůst míry mortality na RCC, od této doby došlo k její stabilizaci nebo poklesu [4]. Ve skandinávských zemích úmrtnost klesá od roku 1980, od počátku 90. let 20. století byl podobný trend zaznamenán rovněž ve Francii, Německu, Rakousku, Nizozemí a Itálii. Nicméně v některých evropských zemích (Chorvatsko, Estonsko, Řecko, Irsko, Slovensko) mortalita vykazuje nadále vzestupnou tendenci [4].
RCC zahrnuje různé typy tumoru se specifickými histopatologickými a genetickými vlastnostmi [5]. Incidence RCC je více predominantní u mužů než u žen (v poměru 1,5 : 1), nejvyšší incidence byla zjištěna u pacientů ve věku 60–70 let. Na vzniku onemocnění se podílejí faktory jako kouření, obezita [6], hypertenze, užívání acetaminofenu a nesteroidních protizánětlivých léčiv bez obsahu aspirinu [7] a virová hepatitida [8–12].
Vyšší riziko RCC hrozí rovněž jedincům, u jejichž příbuzných prvního stupně se vyskytl RCC [13]. Mezi další faktory související s vyšším nebo nižším rizikem RCC patří speciální stravovací návyky a expozice karcinogenním látkám na pracovišti, publikované závěry jsou však neprůkazné [14,15]. Konzumace alkoholu v malých množstvích [16,17] a konzumace brukvovité zeleniny [18] vykazuje pravděpodobně z neznámých důvodů protektivní účinek. Nejúčinnější profylaxe je nekuřáctví a zdravá tělesná hmotnost.
V důsledku zvýšení míry detekce tumorů pomocí zobrazovacích vyšetření, jako je ultrazvuk a počítačová tomografie (CT), se zvyšuje procento náhodně detekovaných nádorů. Tyto nádory jsou obvykle menší velikosti a nižšího stadia [19–21].
3.1.1 Souhrn důkazů a doporučení
Souhrn důkazů a doporučení k části 3.1.1 
RCC – renální karcinom 3.2 Histologická diagnóza
RCC zahrnuje široké spektrum nejrůznějších histopatologických jednotek, jak je uvádí klasifikační systém Světové zdravotnické organizace (WHO) z roku 2004 [22] a modifikovaná vancouverská klasifikace ISUP [23]. Rozlišují se tři základní typy RCC: ccRCC, papilární (pRCC – typ I a II) a chromofobní (chRCC). Cytogenetická a genetická analýza potvrdila subklasifikaci jednotlivých typů RCC [24–26] (LE: 2b). Problematice karcinomu ze sběrných kanálků a dalších méně častých forem nádorů ledvin se věnuje kapitola 3.3.
Kromě podtypu RCC histologická diagnóza dále zahrnuje jaderný grade, přítomnost sarkomatoidních změn, vaskulární invazi, přítomnost nekróz a invazi vývodného systému a perirenální tukové tkáně. Jaderný grade podle Fuhrmanové představuje nejčastěji užívaný a akceptovaný histologický klasifikační systém RCC [27]. Na konferenci ISUP byla představena nová, zjednodušená verze klasifikačního systému, která vychází pouze z velikosti a tvaru jadérek. Tento systém nahradí stávající klasifikaci na základě jaderného grade podle Fuhrmanové [23].
3.2.1 Světlobuněčný karcinom
Obecně platí, že ccRCC je dobře ohraničený, kapsula obvykle chybí. Povrch řezu má žlutozlatý odstín, často je přítomno prokrvácení a nekrotické oblasti. Při klasifikaci se obvykle užívá jaderný grade podle Fuhrmanové [27]. Často je zjištěna delece chromozomu v oblasti 3p a mutace genu VHL (von Hippel-Lindau) na chromozomu 3p25. ccRCC má horší prognózu než pRCC a chRCC [28,29], dokonce po stratifikaci onemocnění na základě stadia a grade [30]. Míra přežití specifická pro karcinom (cancer specific survival – CSS) po dobu pěti let činila 91, 74, 67 a 32 % pro stadia TNM I, II, III a IV (ve stejném pořadí) u pacientů léčených v letech 1987–1998 [31]. Indolentní formou ccRCC je multicystický ccRCC, který tvoří přibližně 4 % všech ccRCC nádorů [23].
3.2.2 Papilární karcinom
Makroskopicky je pRCC velmi dobře ohraničen, s pseudokapsulou žluté nebo hnědé barvy a měkkou konzistencí. Z genetického hlediska vykazuje pRCC trizomie chromozomů 7 a 17 a deleci chromozomu Y. pRCC představuje heterogenní skupinu tumorů zahrnující tři různé podtypy: dva základní typy (1 a 2) a onkocytický typ. Ve srovnání s ccRCC je pRCC významně častěji ohraničen na orgán (pT1–pT2 N0 M0) a je spojen s vyšší mírou přežití bez karcinomu po dobu pěti let [32]. pRCC typu 2 má horší prognózu než typ 1 [33–35]. Mezi typické znaky pRCC typu 1 patří exofytický růst, pseudonekrotické změny a přítomnost pseudokapsuly. Pseudokapsuly a rozsáhlé nekrotické změny působí sférický tvar tumoru na extrarenálním řezu. Nádory s masivní nekrotickou tkání jsou velmi křehké a náchylné k samovolné ruptuře nebo ruptuře vyvolané i minimálním traumatem, ruptura následně způsobuje retroperitoneální krvácení. Dobře vyvinutá pseudokapsula u pRCC typu 1 pravděpodobně zabraňuje ruptuře nádoru i navzdory přítomnosti nekróz. Na CT skenu s použitím kontrastní látky koreluje nekróza s hypodenzní centrální oblastí tumoru. Tato oblast je obklopena vitální nádorovou tkání, která při CT zobrazení vykazuje charakter neostře ohraničeného okraje [36]. Někteří autoři rozlišují ještě třetí typ, onkocytický pRCC, který je charakterizován absencí pseudokapsuly i masivní nekrózy, vzácným výskytem extrarenálního růstu a nízkým maligním potenciálem [35], tento typ však není všeobecně uznáván [23].
3.2.3 Chromofobní karcinom
Obecně platí, že chRCC má světlehnědou barvu a poměrně homogenní a tuhou strukturu. Jedná se o dobře ohraničený útvar bez kapsuly. V roce 2010 byl namísto jaderného grade podle Fuhrmanové navržen speciální histopatologický systém autorů Panera et al [37,38]. Mezi typické genetické změny patří delece chromozomů 2, 10, 13, 17 a 21 [39]. Onemocnění má poměrně dobrou prognózu s vysokou mírou přežití bez recidivy po dobu pěti let, mírou CSS i CSS po dobu 10 let [40].
3.3 Ostatní nádory ledvin
Ostatní nádory ledvin představují zbývajících 10–15 % nádorů ledvinné kůry. Do této kategorie se řadí málo časté, sporadické a familiární karcinomy, nově popsané karcinomy a skupina neklasifikovaných karcinomů. Přehled výše uvedených nádorů je uveden v tab. 2, následující kapitoly se věnují některým klinicky relevantním nádorům a velmi ojedinělým útvarům.
Tab. 2. Ostatní tumory ledvinné kůry a doporučení pro léčbu (stupeň doporučení: C). 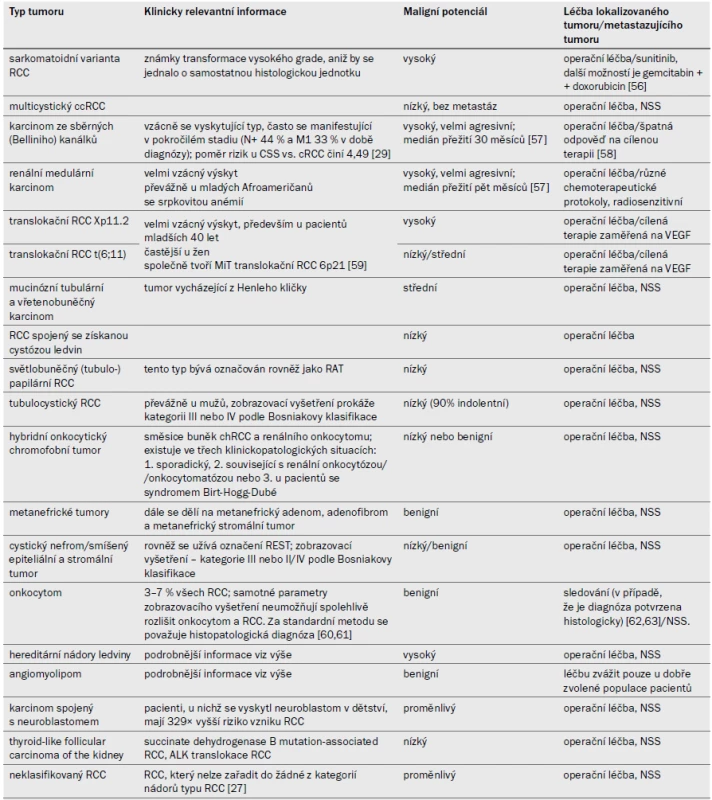
RCC – renální karcinom, CSS – doba přežití spefická pro karcinom, NSS – nefron šetřící operace, VEGF – vaskulární endoteliální růstový faktor, ccRCC – světlobuněčný karcinom, RAT – renální angiomyomatózní tumor, ALK – anaplastic lymphoma kinase, chRCC – chromofobní renální karcinom, REST – renální epiteliální a stromální tumor 3.3.1 Karcinom související s ESKD, RCC spojený se získanou cystózou ledvin
Mezi typické znaky terminálního stadia selhání ledvin (end-stage kidney disease – ESKD) patří degenerativní cystické změny (získaná cystóza ledvin (acquired cystic kidney disease – ACKD) a vyšší incidence RCC. RCC v nativní ledvině v ESKD je přítomen přibližně u 4 % pacientů. Tito pacienti mají minimálně 10× vyšší riziko, že u nich dojde v průběhu života ke vzniku RCC, než se uvádí v obecné populaci. Na rozdíl od sporadického RCC je získané cystické onemocnění ledvin obvykle multicentrické a bilaterální, postihuje mladší pacienty (převážně muže) a je méně agresivní [41,42]. Dosud nebylo jednoznačně prokázáno, zda je relativně indolentní průběh nádorů u ESKD způsobený metodou diagnózy a specifickou molekulární signální drahou ACKD [42]. Ačkoli histologické spektrum tumorů souvisejících s ACKD přibližně odpovídá sporadickému RCC, predominantní formu představuje pRCC. Zbývající část tvoří převážně ccRCC [41–43]. Specifický podtyp RCC, který se vyskytuje pouze u pacientů s ESKD, bývá označován jako ACD-RCC (Acquired Cystic Disease-associated RCC).
3.3.2 Papilární adenom
Tyto nádory mají papilární nebo tubulární strukturu, nízký jaderný grade a ≤ 5 mm v průměru [22]. Tyto nádory jsou detekovány incidentálně v preparátu získaném při nefrektomii.
3.3.3 Hereditární nádory ledviny
Hereditární nádory ledvin se mohou nalézat u následujících onemocnění: VHL syndrom, hereditární pRCC, syndrom Birt-Hogg-Dubé (viz hybridní onkocytický chRCC), syndrom hereditární leiomyomatózy a renálního karcinomu (HLRCC), komplex tuberózní sklerózy (TS), germline succinate dehydrogenase (SDH), non-polyposis colorectal cancer syndrome, hyperparathyroidism-jaw tumour syndrome, PTEN (homolog fosfatázy a tenzinu) hamartom syndrom (PHTS), konstituční translokace chromozomu 3 a familial non-syndromic ccRCC. Vzhledem k jeho souvislosti s hereditárními hemoglobinopatiemi lze do této skupiny zařadit rovněž medulární karcinom ledviny [22,23,33,44].
3.3.4 Angiomyolipom
AML je benigní mezenchymální tumor, který se může vyskytovat sporadicky a jeho výskyt je 4× častější u žen. AML se rovněž vyskytuje u pacientů s TS. Tento typ představuje přibližně 1 % všech chirurgicky odstraněných nádorů. AML je obvykle diagnostikován na základě přítomnosti tukové tkáně pomocí ultrazvukového vyšetření (UZ), CT a zobrazovacího vyšetření magnetickou rezonancí (MR). Biopsie nemá zpravidla žádný přínos. Předoperačně může být obtížné odlišit nádory z buněk hladké svaloviny a epiteliální tumory. AML se může vyskytovat v lymfatických uzlinách (lymph nodes – LN) pacientů s TS, nevytváří však metastázy a má multicentrický charakter. Ke vzniku AML může dojít v důsledku angiotropního růstu v renální žíle nebo dolní duté žíle. AML postihující LN a AML s nádorovým trombem je benigní. Jedinou potenciálně maligní variantu představuje epiteloidní AML [22,45]. AML vykazuje pomalý a konzistentní charakter růstu a je spojen s minimální morbiditou [46]. Mezi hlavní komplikace související s AML ledviny patří retroperitoneální krvácení nebo krvácení do vývodného systému ledviny, jež může ohrozit život pacienta [47]. Za tyto komplikace je zodpovědná angiogenní komponenta tumoru, která obsahuje nepravidelné a aneuryzmaticky změněné krevní cévy [47]. Hlavní rizikové faktory pro vznik krvácení zahrnují velikost tumoru, grade angiogenní komponenty a přítomnost TS [47,48]. Indikace pro intervenci zahrnují bolest, krvácení nebo podezření na maligní charakter.
3.3.4.1 Léčba
Za nejvhodnější řešení se u většiny pacientů s AML považuje aktivní sledování (active surveillance – AS) [47,49] (LE: 3). Rizikové faktory pro odloženou intervenci zahrnují velikost tumoru > 4 cm a přítomnost symptomů v době diagnostikování onemocnění [49]. Jako metoda první volby po aktivním sledování se nabízí selektivní arteriální embolizace (SAE) [49] (LE: 3). SAE představuje účinnou metodu devaskularizace AML, která však slouží pouze k redukci jeho objemu [50].
Ačkoli SAE poskytuje kontrolu akutního krvácení, v dlouhodobém horizontu má tato modalita pouze omezenou roli [51,52]. V případě, že je indikována operační léčba, lze ve většině případů AML řešit pomocí konzervativní NSS, ačkoli u některých pacientů může být nezbytné provedení kompletní nefrektomie [48] (LE: 3). Další volbou může být radiofrekvenční ablace (RFA) [46,47,53]. Objem AML lze redukovat aplikací inhibitoru mTOR everolimu [54]. Klinická studie fáze II s open-label rozšířením, která hodnotí medikamentózní léčbu AML pomocí inhibitoru mTOR everolimu u pacientů nevyžadujících operační léčbu, uvádí 81,6% míru (64,5 %) úspěšnosti léčby (≥ 50% nebo 30% redukce objemu tumoru) v 96. týdnu, což potvrzuje dlouhodobý bezpečnostní profil everolimu [54]. Léčbu pomocí sirolimu lze kombinovat s odloženou operací [55].
3.3.4.2 Souhrn
RCC se vyskytuje v nejrůznějších variantách, přičemž přibližně 15 % má benigní povahu. U všech nádorů ledvin je však nutné posoudit maligní potenciál.
3.4 Souhrn důkazů a doporučení pro léčbu dalších typů nádorů ledvin
Souhrn důkazů a doporučení k části 3.4 
RCC – renální karcinom, AML – angiomyolipom, SAE – selektivní arteriální embolizace, NSS – nefron šetřící operace. 3.5 Literatura
- Eurocim. European Network of Cancer Registries. Eurocim version 4.0. European incidence database V2.3, 730 entity dictionary. Lyon: IARC 2001.
- Lindblad P. Epidemiology of renal cell carcinoma. Scand J Surg 2004; 93(2): 88–96.
- Ferlay J, Steliarova-Foucher E, Lortet-Tieulent J et al. Cancer incidence and mortality patterns in Europe: estimates for 40 countries in 2012. Eur J Cancer 2013; 49(6): 1374–1403. doi: 10.1016/j.ejca.2012.12.027.
- Levi F, Ferlay J, Galeone C et al. The changing pattern of kidney cancer incidence and mortality in Europe. BJU Int 2008; 101(8): 949–958. doi: 10.1111/j.1464-410X.2008.07451.x.
- Kovacs G, Akhtar M, Beckwith BJ et al. The Heidelberg classification of renal cell tumours. J Pathol 1997; 183(2): 131–133.
- Sun M, Trinh VQ, Becker A et al. Management of localized kidney cancer: calculating cancer-specific mortality and compteing-risks of death tradeoffs between surgery and active surveillance. J Urol 2013; 189(4): e672. Abstract 1634.
- Masson-Lecomte A, Yates DR, Hupertan V et al. A prospective comparison of the pathologic and surgical outcomes obtained after elective treatment of renal cell carcinoma by open or robot-assisted partial nephrectomy. Urol Oncol 2013; 31(6): 924–929. doi: 10.1016/j.urolonc.2011.08.004.
- Choi JE, You JH, Kim DK et al. Comparison of perioperative outcomes between robotic and laparoscopic partial nephrectomy: a systematic review and meta-analysis. Eur Urol 2015; 67(5): 891–901. doi: 10.1016/j.eururo.2014.12.028.
- Lipworth L, Tarone RE, McLaughlin JK et al. The epidemiology of renal cell carcinoma. J Urol 2006; 176 (6 Pt 1): 2353–2358.
- Bergström A, Hsieh CC, Lindblad P et al. Obesity and renal cell cancer – a quantitative review. Br J Cancer 2001; 85(7): 984–990.
- World Health Organization, International Agency for Research on cancer. IARC monographs on the evaluation of carcinogenic risks to humans. Lyon 2004. [online]. Available from: http://monographs.iarc.fr/ENG/Monographs/vol83/index.php.
- Weikert S, Boeing H, Pschon T et al. Blood pressure and risk of renal cell carcinoma in the European prospective investigation into cancer and nutrition. Am J Epidemiol 2008; 167(4): 438–446.
- Clague J, Lin J, Cassidy A et al. Family history and risk of renal cell carcinoma: results from a case-control study and systematic meta-analysis. Cancer Epidemiol Biomarkers Prev 2009; 18(3): 801–807. doi: 10.1158/1055-9965.EPI-08-0601.
- Pierorazio PM, Johnson MH, Ball MW et al. Five-year analysis of a multi-institutional prospective clinical trial of delayed intervention and surveillance for small renal masses: the DISSRM registry. Eur Urol 2015; 68(3): 408–415. doi: 10.1016/j.eururo.2015.02.001.
- Daniel CR, Cross AJ, Graubard BI et al. Large prospective investigation of meat intake, related mutagens, and risk of renal cell carcinoma. Am J Clin Nutr 2012; 95(1): 155–162. doi: 10.3945/ajcn.111.019364.
- Bellocco R, Pasquali E, Rota M et al. Alcohol drinking and risk of renal cell carcinoma: results of a meta-analysis. Ann Oncol 2012; 23(9): 2235–2244. doi: 10.1093/annonc/mds022.
- Song DY, Song S, Song Y et al. Alcohol intake and renal cell cancer risk: a meta-analysis. Br J Cancer 2012; 106(11): 1881–1890. doi: 10.1038/bjc.2012.136.
- Wood C, Srivastava P, Bukowski R et al. An adjuvant autologous therapeutic vaccine (HSPPC-96; vitespen) versus observation alone for patients at high risk of recurrence after nephrectomy for renal cell carcinoma: a multicentre, open-label, randomised phase III trial. Lancet 2008; 372(9633): 145–154. doi: 10.1016/S0140-6736(08)60697-2.
- Patard JJ, Rodriguez A, Rioux-Leclercq N et al. Prognostic significance of the mode of detection in renal tumours. BJU Int 2002; 90(4): 358–363.
- Kato M, Suzuki T, Suzuki Y et al. Natural history of small renal cell carcinoma: evaluation of growth rate, histological grade, cell proliferation and apoptosis. J Urol 2004; 172(3): 863–866.
- Tsui KH, Shvarts O, Smith RB et al. Renal cell carcinoma: prognostic significance of incidentally detected tumors. J Urol 2000; 163(2): 426–430.
- Eble JN, Sauter G, Epstein JI et al (eds). In: Pathology and genetics of tumours of the urinary system and male genital organs. World Health Organization Classification of Tumours. Lyon: IARC Press 2004. [online]. Available from: http://www.iarc.fr/en/publications/pdfs-online/pat-gen/bb7/.
- Srigley JR, Delahunt B, Eble JN et al. The International Society of Urological Pathology (ISUP) Vancouver classification of renal neoplasia. Am J Surg Pathol 2013; 37(10): 1469–1489. doi: 10.1097/PAS.0b013e318299f2d1.
- Yang XJ, Tan MH, Kim HL et al. A molecular classification of papillary renal cell carcinoma. Cancer Res 2005; 65(13): 5628–5637.
- Linehan WM, Vasselli J, Srinivasan R et al. Genetic basis of cancer of the kidney: disease-specific approaches to therapy. Clin Cancer Res 2004; 10 (18 Pt 2): 6282S-9S.
- Furge KA, Tan MH, Dykema K et al. Identification of deregulated oncogenic pathways in renal cell carcinoma: an integrated oncogenomic approach based on gene expression profiling. Oncogene 2007; 26(9): 1346–1350.
- Fuhrman SA, Lasky LC, Lumas C et al. Prognostic significance of morphologic parameters in renal cell carcinoma. Am J Surg Pathol 1982; 6(7): 655–663.
- Capitanio U, Cloutier V, Zini L et al. A critical assessment of the prognostic value of clear cell, papillary and chromophobe histological subtypes in renal cell carcinoma: a population-based study. BJU Int 2009; 103(11): 1496–1500. doi: 10.1111/j.1464-410X.2008.08259.x.
- Keegan KA, Schupp CW, Chamie K et al. Histopathology of surgically treated renal cell carcinoma: survival differences by subtype and stage. J Urol 2012; 188(2): 391–397. doi: 10.1016/j.juro.2012.04.006.
- Beck SD, Patel MI, Snyder ME et al. Effect of papillary and chromophobe cell type on disease-free survival after nephrectomy for renal cell carcinoma. Ann Surg Oncol 2004; 11(1): 71–77.
- Tsui KH, Schvarts O, Smith RB et al. Prognostic indicators for renal cell carcinoma: a multivariate analysis of 643 patients using the revised 1997 TNM staging criteria. J Urol 2000; 163(4): 1090–1095.
- Steffens S, Janssen M, Roos FC et al. Incidence and long-term prognosis of papillary compared to clear cell renal cell carcinoma – a multicentre study. Eur J Cancer 2012; 48(15): 2347–2352. doi: 10.1016/j.ejca.2012.05.002.
- Pignot G, Elie C, Conquy S et al. Survival analysis of 130 patients with papillary renal cell carcinoma: prognostic utility of type 1 and type 2 subclassification. Urology 2007; 69(2): 230–235.
- Gontero P, Ceratti G, Guglielmetti S et al. Prognostic factors in a prospective series of papillary renal cell carcinoma. BJU Int 2008; 102(6): 697–702. doi: 10.1111/j.1464-410X.2008.07756.x.
- Sukov WR, Lohse CM, Leibovich BC et al. Clinical and pathological features associated with prognosis in patients with papillary renal cell carcinoma. J Urol 2012; 187(1): 54–59. doi: 10.1016/j.juro.2011.09.053.
- Urge T, Hes O, Ferda J et al. Typical signs of oncocytic papillary renal cell carcinoma in everyday clinical praxis. World J Urol 2010; 28(4): 513–517. doi: 10.1007/s00345-010-0563-1.
- Paner GP, Amin MB, Alvarado-cabrero I et al. A novel tumor grading scheme for chromophobe renal cell carcinoma: prognostic utility and comparison with Fuhrman nuclear grade. Am J Surg Pathol 2010; 34(9): 1233–1240. doi: 10.1097/PAS.0b013e3181e96f2a.
- Cheville JC, Lohse CM, Sukov WR et al. Chromophobe renal cell carcinoma: the impact of tumor grade on outcome. Am J Surg Pathol 2012; 36(6): 851–856. doi: 10.1097/PAS.0b013e3182496895.
- Vera-Badillo FE, Conde E, Duran I et al. Chromophobe renal cell carcinoma: a review of an uncommon entity. Int J Urol 2012; 19(10): 894–900. doi: 10.1111/j.1442-2042.2012.03079.x.
- Volpe A, Novara G, Antonelli A et al. Chromophobe renal cell carcinoma (RCC): oncological outcomes and prognostic factors in a large multicentre series. BJU Int 2012; 110(1): 76–83. doi: 10.1111/j.1464-410X.2011.10690.x.
- Hora M, Hes O, Reischig T et al. Tumours in end-stage kidney. Transplant Proc 2008; 40(10): 3354–3358. doi: 10.1016/j.transproceed.2008.08.135.
- Neuzillet Y, Tillou X, Mathieu R et al. Renal cell carcinoma (RCC) in patients with end-stage renal disease exhibits many favourable clinical, pathologic, and outcome features compared with RCC in the general population. Eur Urol 2011; 60(2): 366–373. doi: 10.1016/j.eururo.2011.02.035.
- Srigley JR, Delahunt B. Uncommon and recently described renal carcinomas. Mod Pathol 2009; 22 (Suppl 2): S2–S23. doi: 10.1038/modpathol.2009.70.
- Przybycin CG, Magi-Galluzzi C, McKenney JK et al. Hereditary syndromes with associated renal neoplasia: a practical guide to histologic recognition in renal tumor resection specimens. Adv Anat Pathol 2013; 20(4): 245–263. doi: 10.1097/PAP.0b013e318299b7c6.
- Nese N, Martignoni G, Fletcher CD et al. Pure epithelioid PEComas (so-called epithelioid angiomyolipoma) of the kidney: a clinicopathologic study of 41 cases: detailed assessment of morphology and risk stratification. Am J Surg Pathol 2011; 35(2): 161–176. doi: 10.1097/PAS.0b013e318206f2a9.
- Mues AC, Palacios JM, Haramis G et al. Contemporary experience in the management of angiomyolipoma. J Endourol 2010; 24(11): 1883–1886. doi: 10.1089/end.2010.0223.
- Ramon J, Rimon U, Garniek A et al. Renal angiomyolipoma: long-term results following selective arterial embolization. Eur Urol 2009; 55(5): 1155–1561. doi: 10.1016/j.eururo.2008.04.025.
- Nelson CP, Sanda MG et al. Contemporary diagnosis and management of renal angiomyolipoma. J Urol 2002; 168 (4 Pt 1): 1315-1325.
- Ouzaid I, Autorino R, Fatica R et al. Active surveillance for renal angiomyolipoma: outcomes and factors predictive of delayed intervention. BJU Int 2014; 114(3): 412–417. doi: 10.1111/bju.12604.
- Hocquelet A, Cornelis F, Le Bras Y et al. Long-term results of preventive embolization of renal angiomyolipomas: evaluation of predictive factors of volume decrease. Eur Radiol 2014; 24(8): 1785–1793. doi: 10.1007/s00330-014-3244-4.
- Choueiri TK, Escudier B, Powles T et al. Cabozantinib versus everolimus in advanced renal-cell carcinoma. N Engl J Med 2015; 373(19): 1814–1823. doi: 10.1056/NEJMoa1510016.
- Murray TE, Doyle F, Lee M et al. Transarterial embolization of angiomyolipoma: a systematic review. J Urol 2015; 194(3): 635–639. doi: 10.1016/j.juro.2015.04.081.
- Castle SM, Gorbatiy V, Ekwenna O et al. Radiofrequency ablation (RFA) therapy for renal angiomyolipoma (AML): an alternative to angio-embolization and nephron-sparing surgery. BJU Int 2012; 109(3): 384–387. doi: 10.1111/j.1464-410X.2011.10376.x.
- Bissler JJ, Kingswood JC, Radzikowska E et al. Everolimus for renal angiomyolipoma in patients with tuberous sclerosis complex or sporadic lymphangioleiomyomatosis: extension of a randomized controlled trial. Nephrol Dial Transplant 2016; 31(1): 111–119. doi: 10.1093/ndt/gfv249.
- Staehler M, Sauter M, Helck A et al. Nephron-sparing resection of angiomyolipoma after sirolimus pretreatment in patients with tuberous sclerosis. Int Urol Nephrol 2012; 44(6): 1657–1661. doi: 10.1007/s11255-012-0292-z.
- Roubaud G, Gross-Goupil M, Wallerand H et al. Combination of gemcitabine and doxorubicin in rapidly progressive metastatic renal cell carcinoma and/or sarcomatoid renal cell carcinoma. Oncology 2011; 80(3–4): 214–218. doi: 10.1159/000329078.
- Abern MR, Tsivian M, Polascik TJ et al. Characteristics and outcomes of tumors arising from the distal nephron. Urology 2012; 80(1): 140–146. doi: 10.1016/j.urology.2012.03.034.
- Husillos A, Herranz-Arno F, Subirá D et al. Collecting duct renal cell carcinoma. Actas Urol Esp 2011; 35(6): 368–371. doi: 10.1016/j.acuro.2011.01.012.
- Hora M, Urge T, Trávníček I et al. MiT translocation renal cell carcinomas: two subgroups of tumours with translocations involving 6p21 [t (6; 11)] and Xp11.2 [t (X; 1 or X or 17)]. Springerplus 2014; 3 : 245. doi: 10.1186/2193-1801-3-245.
- Choudhary S, Rajesh A, Mayer NJ et al. Renal oncocytoma: CT features cannot reliably distinguish oncocytoma from other renal neoplasms. Clin Radiol 2009; 64(5): 517–522. doi: 10.1016/j.crad.2008.12.011.
- Bird VG, Kanagarajah P, Morillo G et al. Differentiation of oncocytoma and renal cell carcinoma in small renal masses (< 4 cm): the role of 4-phase computerized tomography. World J Urol 2011; 29(6): 787–792. doi: 10.1007/s00345-010-0586-7.
- Kurup AN, Thompson RH, Leibovich BC et al. Renal oncocytoma growth rates before intervention. BJU Int 2012; 110(10): 1444–1448. doi: 10.1111/j.1464-410X.2012.011136.x.
- Kawaguchi S, Fernandes KA, Finelli A et al. Most renal oncocytomas appear to grow: observations of tumor kinetics with active surveillance. J Urol 2011; 186(4): 1218–1222. doi: 10.1016/j.juro.2011.05.080.
4. Staging a klasifikační systémy
4.1 Staging
Pro klinické i vědecké účely se obvykle doporučuje klasifikační stupnice TNM [1], která však vyžaduje kontinuální aktualizaci [2]. Poslední verze TNM klasifikace byla uveřejněna v roce 2009, s dodatkem z roku 2012 (tab. 3). Prognostickou hodnotu této klasifikace potvrzují multicentrické studie i studie z jediného centra [3,4]. TNM klasifikační systém zahrnuje následující proměnné: velikost nádoru, žilní invazi, invazi kapsuly ledviny, invazi nadledviny a postižení LN a přítomnost vzdálených metastáz (tab. 3). S ohledem na některé kategorie však přetrvávají nejasnosti:
- užívání hraniční hodnoty 4 cm v rámci subklasifikace T1 nádorů nemusí být optimální při volbě NSS u lokalizovaných nádorů;
- dále je zpochybňován význam stratifikace T2 nádorů podle velikosti [5];
- od uveřejnění verze z roku 2002 jsou nádory postihující tukovou tkáň renálního sinu zařazeny do kategorie pT3a;
- ačkoli může invaze tukové tkáně renálního sinu představovat horší prognózu než invaze perinefrického tuku, řadí se oba parametry do stejné kategorie pT3a [6–8] (LE: 3);
- podkategorie stadia T (pT2b, pT3a, pT3c a pT4) se mohou překrývat [4];
- pro adekvátní stanovení stadia M by mělo být provedeno předoperační zobrazovací vyšetření, kterým je v současné době CT hrudníku a břicha [9,10] (LE: 4).
Tab. 3. Klasifikační systém TNM z roku 2009 dle [1] a dodatek z roku 2012 dle [14]. ![Klasifikační systém TNM z roku 2009 dle [1] a dodatek z roku 2012 dle [14].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/bfc0154fa4a650c39224da6572e1f0c8.png)
LN – lymfatické uzliny Odpovědi na specifické otázky týkající se TNM klasifikace jsou k dispozici na webové stránce http://www.uicc.org/tnm. 4.2 Anatomické klasifikační systémy
V rámci standardizace metod popisu nádorů ledviny byly navrženy objektivní anatomické systémy PADUA (Preoperative Aspects and Dimensions Used for an Anatomical), nefrometrické skóre R.E.N.A.L. a C-index [11–13]. Tyto systémy spočívají v hodnocení velikosti nádoru, jeho exofytických/endofytických parametrů, vzdálenosti od vývodného systému a renálního sinu a anteriorní/posteriorní lokalizaci.
Pomocí těchto systémů lze objektivně predikovat potenciální morbiditu NSS a technik ablace nádoru. Pomocí těchto instrumentů lze získat informace pro plánování léčby, informování pacientů a srovnání technik parciální resekce ledviny (partial nephrectomy – PN) a ablace tumoru. Při volbě nejvhodnější léčby je však nutné anatomické skóre interpretovat v kontextu individuálních parametrů pacienta a zkušeností operatéra.
4.3 Literatura
- Sobin LH, Gospodariwicz M, Wittekind C (eds). TNM classification of malignant tumors. UICC International Union Against Cancer. 7th ed. New York: Wiley-Blackwell 2009 : 255.
- Gospodarowicz MK, Miller D, Groome PA et al. The process for continuous improvement of the TNM classification. Cancer 2004; 100(1): 1–5.
- Kim SP, Alt AL, Weight CJ et al. Independent validation of the 2010 American Joint Committee on Cancer TNM classification for renal cell carcinoma: results from a large, single institution cohort. J Urol 2011. 185(6): 2035–2039. doi: 10.1016/j.juro.2011.02.059.
- Novara G, Ficarra V, Antonelli A et al. Validation of the 2009 TNM version in a large multi-institutional cohort of patients treated for renal cell carcinoma: are further improvements needed? Eur Urol 2010; 58(4): 588–595. doi: 10.1016/j.eururo.2010.07.006.
- Waalkes S, Becker F, Schrader AJ et al. Is there a need to further subclassify pT2 renal cell cancers as implemented by the revised 7th TNM version? Eur Urol 2011; 59(2): 258–263. doi: 10.1016/j.eururo.2010.10.005.
- Bertini R, Roscigno M, Freschi M et al. Renal sinus fat invasion in pT3a clear cell renal cell carcinoma affects outcomes of patients without nodal involvement or distant metastases. J Urol 2009; 181(5): 2027–2032. doi: 10.1016/j.juro.2009.01.048.
- Poon SA, Gonzalez JR, Benson MC et al. Invasion of renal sinus fat is not an independent predictor of survival in pT3a renal cell carcinoma. BJU Int 2009; 103(12): 1622–1625. doi: 10.1111/j.1464-410X.2008.08239.x.
- Bedke J, Buse S, Pritsch M et al. Perinephric and renal sinus fat infiltration in pT3a renal cell carcinoma: possible prognostic differences. BJU Int 2009; 103(10): 1349–1354. doi: 10.1111/j.1464-410X.2008.08236.x.
- Heidenreich A, Ravery V, European Society of Oncological Urology. Preoperative imaging in renal cell cancer. World J Urol 2004; 22(5): 307–315.
- Sheth S, Scatarige JC, Horton KM et al. Current concepts in the diagnosis and management of renal cell carcinoma: role of multidetector ct and three-dimensional CT. Radiographics 2001; 21: S237.
- Ficarra V, Novara G, Secco S et al. Preoperative aspects and dimensions used for an anatomical (PADUA) classification of renal tumours in patients who are candidates for nephron-sparing surgery. Eur Urol 2009; 56(5): 786–793. doi: 10.1016/j.eururo.2009.07.040.
- Kutikov A, Uzzo RG et al. The R.E.N.A.L. nephrometry score: a comprehensive standardized system for quantitating renal tumor size, location and depth. J Urol 2009; 182(3): 844–853. doi: 10.1016/j.juro.2009.05.035.
- Simmons MN, Ching CB, Samplaski MK et al. Kidney tumor location measurement using the C index method. J Urol 2010; 183(5): 1708–1713. doi: 10.1016/j.juro.2010.01.005.
- Wittekind BJ, Compton CC, Sobin LH (eds). A Commentary on Uniform Use. UICC International Union against cancer. 4th edition. New York: Wiley-Blackwell 106.
5. Diagnostické vyšetření
5.1 Symptomy
Mnoho RCC je až do pozdního stadia onemocnění asymptomatických. Více než 50 % RCC je detekováno náhodně během neinvazivního zobrazovacího vyšetření z důvodu hodnocení nespecifických symptomů a jiných onemocnění v dutině břišní [1,2] (LE: 3). Klasická trojice symptomů: bolest v boku, makroskopická hematurie a hmatná abdominální rezistence se vyskytuje pouze výjimečně (6–10 %) a souvisí s agresivní histologickou povahou a pokročilým stadiem tumoru [3,4] (LE: 3).
U přibližně 30 % pacientů se symptomatickým RCC je detekován paraneoplastický syndrom (LE: 4). U některých symptomatických pacientů jsou přítomny symptomy vyvolané metastazujícím onemocněním, jako je např. bolest ve skeletu nebo přetrvávající kašel [5] (LE: 3).
5.1.1 Fyzikální vyšetření
Fyzikální vyšetření má při diagnostikování RCC pouze omezenou roli. Detekce následujících symptomů by měla být impulzem pro indikaci radiologického vyšetření:
- hmatná abdominální rezistence,
- hmatná cervikální lymfadenopatie,
- nezmenšující se varikokéla a bilaterální otok dolních končetin, který nasvědčuje zasažení žilního systému.
5.1.2 Laboratorní nálezy
Nejčastěji hodnocenými parametry jsou hladina kreatininu v séru, rychlost glomerulární filtrace (GFR), vyšetření krevního obrazu, rychlost sedimentace erytrocytů, jaterní funkce, hladina alkalické fosfatázy a laktátdehydrogenázy a korigovaná hladina kalcia v séru [6,7], koagulace a rozbor moči (LE: 4). U pacientů s centrálně lokalizovanými nádory ledviny, které přiléhají k vývodnému systému nebo jej přímo zasahují, lze zvážit provedení cytologického vyšetření moči a případně rovněž endoskopické vyšetření s cílem vyloučit přítomnost uroteliálního karcinomu (LE: 4).
V následujících případech se doporučuje provedení scintigrafie z důvodu vyšetření separované funkce ledvin [8,9] (LE: 2b):
- u pacientů s narušenou funkcí ledviny (na základě zvýšené hladiny kreatininu v séru nebo výrazně snížené GFR),
- u pacientů, u nichž má funkce ledviny klinický význam (např. u pacientů s nádorem v solitární ledvině a pacientů s vícečetnými nebo bilaterálními tumory).
U pacientů s důvodnými obavami z postižení renální funkce v budoucnosti v důsledku komorbidních stavů lze zvážit provedení renální scintigrafie.
5.2 Zobrazovací vyšetření
Většina nádorů ledviny je diagnostikována pomocí abdominálního UZ nebo CT, jež jsou indikovány z jiných důvodů [2] (LE: 3).
Na základě výsledku zobrazovacího vyšetření se nádory ledviny dělí na solidní nebo cystické.
5.2.1 Přítomnost sycení (enhancement)
V případě solidních nádorů ledvin představuje nejdůležitější kritérium pro rozlišení maligních lézí přítomnost tzv. enhancement (sycení) [10] (LE: 3). Pro detekci a identifikaci RCC se obvykle užívají UZ, CT a MR. Ve většině případů lze nádory ledvin přesně diagnostikovat pouze na základě samotného zobrazovacího vyšetření. Ve speciálních případech může být užitečné UZ s užitím kontrastní látky [11–13] (LE: 3).
5.2.2 CT nebo MR
CT i MR se užívají pro bližší ozřejmění nádoru ledviny. Zobrazovací vyšetření je nutné provádět před intravenózní aplikací kontrastní látky a po ní z důvodu průkazu sycení (enhancement). Při CT zobrazení se enhancement stanoví na základě srovnání Hounsfieldových jednotek (Hounsfield’s units – HU) před aplikací kontrastní látky a po ní. Změna o ≥ 15 HU potvrzuje enhancement [14] (LE: 3). Pro maximální výtěžnost diferenciální diagnózy a detekce by mělo vyšetření zahrnovat i zobrazení z nefrografické fáze, jež umožní nejlepší vykreslení RCC, které se nesytí do stejné míry jako renální parenchym. Ačkoli lze pomocí CT i MR přesně diagnostikovat RCC, není možné s pomocí těchto modalit spolehlivě odlišit onkocytom a AML (bez tukové tkáně) od maligních renálních neoplazmat [15–18] (LE: 3). Abdominální CT poskytuje informace týkající se:
- funkce a morfologie kontralaterální ledviny [19] (LE: 3),
- rozsahu šíření primárního nádoru,
- postižení žilního systému,
- zvětšení lokoregionálních LN,
- stavu nadledvin a ostatních solidních orgánů (LE: 3).
Ve vybraných případech může být užitečné provedení abdominální dvoufázové CT angiografie, která poskytne podrobné informace o cévním zásobení ledviny [20,21].
Pokud jsou výsledky CT nejednoznačné, může MR poskytnout doplňující informace týkající se:
- sycení (enhancement) lézí renálního parenchymu [22],
- přítomnosti lokálně pokročilé maligní léze [23–25],
- postižení žilního systému, pakliže je rozšíření nádorového trombu do vena cava inferior nedostatečně definováno pomocí CT vyšetření [23–26] (LE: 3); Dopplerovské UZ poskytuje méně přesnou informaci o rozsahu žilního nádorového trombu [25] (LE: 3).
Zobrazovací vyšetření MR je indikováno u pacientů s alergií na intravenózní kontrastní látku a u gravidních pacientek bez renálního selhání [24,27] (LE: 3). V současné době se pro vyšetření nádorů ledviny testují moderní MR techniky jako difuzně vážené obrazy a perfuzní zobrazování [28].
MR lze nabídnout rovněž pacientům s hereditárním RCC, kteří mají obavy z vystavení radiaci při časté indikaci CT.
5.2.3 Další diagnostická vyšetření
Renální arteriografie a venakavografie mají při diagnostickém vyšetření pacientů s RCC omezený význam, a to pouze u vybraných jedinců (LE: 3). U pacientů s jakýmikoli známkami poškození ledvin se doporučuje zvážit provedení izotopové nefrografie a hodnocení celkové funkce ledvin, což nám umožní zvolit nejvhodnější druh léčby [8,9] (LE: 2a).
Význam pozitronové emisní tomografie (PET) v rámci diagnostiky a sledování pacientů s RCC je nutné teprve posoudit, v současné době se vyšetření pomocí PET nedoporučuje [29] (LE: 3).
5.2.4 Radiografické vyšetření metastazujícího RCC
CT hrudníku umožňuje nejpřesnější stanovení stadia onemocnění zasahujícího do hrudníku [30–34] (LE: 3). Pro hodnocení metastazujícího onemocnění je nutné rutinní provedení radiografického vyšetření hrudníku, které představuje alternativu CT, ovšem s méně přesným výsledkem (LE: 3). Bylo dosaženo konsenzu, že ve většině případů jsou metastázy do skeletu a do mozku v době stanovení diagnózy symptomatické, běžný kostní sken ani CT mozku nejsou tedy rutinně indikovány [32,35,36] (LE: 3). V případě, že jsou pomocí laboratorního nebo klinického vyšetření detekovány speciální známky a symptomy onemocnění, je možné provést další diagnostická vyšetření, jako např. kostní sken, CT nebo MR mozku [35,37,38] (LE: 3).
5.2.5 Bosniakova klasifikace cystických lézí ledviny
Tento klasifikační systém dělí cystické renální léze na základě CT zobrazení do pěti kategorií, podle kterých se predikuje riziko maligního charakteru nádoru [39,40] (LE: 3). Pro každou kategorii existuje rovněž doporučený terapeutický postup (tab. 4).
Tab. 4. Bosniakova klasifikace cystických lézí ledviny dle [39]. ![Bosniakova klasifikace cystických lézí ledviny dle [39].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/14c057d9f63ecb4c66a20d52bbabb0a0.png)
5.3 Biopsie nádoru ledviny
Perkutánní biopsie umožňuje stanovit histologickou povahu nádorů, které se při radiologickém zobrazení jeví jako nejasné. Tato modalita by měla být zařazena do protokolu aktivního sledování u dobře vybrané populace pacientů s malými lézemi pro stanovení jejich histologické povahy před ablací a volbou nejvhodnější medikamentózní a operační léčby u pacientů s metastazujícím onemocněním [41–46] (LE: 3). Díky vysoké diagnostické přesnosti abdominálních zobrazovacích modalit není indikace biopsie nezbytná u pacientů s kontrastně sytícím se tumorem ledviny, u kterých je zamýšlena operace (LE: 4).
Perkutánní biopsii lze provádět v celkové anestezii pomocí core bioptické techniky a/nebo aspirace tenkou jehlou (fine-needle aspiration – FNA). Biopsii lze provádět pod sonografickou nebo CT kontrolou, obě metody mají srovnatelnou diagnostickou výtěžnost [43,45] (LE: 2b). Pro účely core biopsie je ideální 18G jehla, její použití je spojeno s nízkou morbiditou a zajišťuje dostatečné množství tkáně pro stanovení diagnózy [41–45,47] (LE: 2b). Abychom zabránili potenciálnímu rozsevu tumoru, je nezbytné užívat koaxiální techniku umožňující odběr několika vzorků pomocí koaxiální kanyly [41–45] (LE: 3).
Core biopsie představuje preferovanou metodu pro ozřejmění solidních nádorů ledviny (LE: 2a). Členové panelu provedli aktuální SR a metaanalýzu údajů týkajících se diagnostické role biopsie ledvinných nádorů a výskytu komplikací. Do analýzy bylo zařazeno 57 článků zahrnujících celkem 5 228 pacientů. Bylo prokázáno, že core biopsie umožňuje přesnější diagnostikování maligní léze než FNA [48]. Jiné studie ukazují, že solidní charakter nádoru a větší velikost jsou prediktory provedení diagnostické core biopsie [43,45] (LE: 2b).
Pokud je prováděna v centrech disponujících zkušenostmi s touto metodou, nabízí core biopsie přesnější diagnostický výsledek, lepší specificitu i senzitivitu při diagnostikování maligního onemocnění. Výše uvedená metaanalýza prokazuje následující parametry pro diagnostikování maligního onemocnění: 99,1% senzitivitu a 99,7% specificitu [48] (LE: 2b).
V 0–22,6 % případů však core biopsie neumožňuje diagnostikovat onemocnění (8 % v metaanalýze) [41–47,49] (LE: 2a). V případě, že biopsie neumožní stanovit diagnózu, přestože radiologický nález nasvědčuje přítomnosti maligního onemocnění, doporučuje se zvážit opakované provedení biopsie nebo operační revizi (LE: 4). Opakovaná biopsie umožňuje podle publikovaných údajů diagnostikování onemocnění ve vysokém procentu případů (83–100 %) [45,50–52].
Biopsie nádoru ledviny umožňuje poměrně přesně diagnostikovat histologický typ tumoru. Ve společné analýze činil medián shody mezi histologickým typem tumoru stanoveným na základě výsledku biopsie a vyšetřením vzorku odebraného při PN nebo radikální nefrektomii (RN) 90,3 % [48].
Stanovení grade tumoru ze vzorku odebraného pomocí core biopsie je náročný úkol. Celková přesnost stanovení jaderného grade ve společné analýze byla nízká (62,5 %), užití zjednodušeného dvojstupňového systému (vysoký vs. nízký grade) [48] významně zvyšuje přesnost (87 %) (LE: 2a).
Ideální počet vzorků odebíraných při core biopsii a jejich lokalizace nebyly dosud přesně definovány. Obecně však platí, že je nutné odebrat alespoň dva kvalitní vzorky. Pro maximální diagnostickou výtěžnost by neměl být vzorek odebrán z oblasti nekrotické tkáně [43,45,53,54] (LE: 4). U větších tumorů je vhodnější provedení biopsie z periferní oblasti, jež umožňuje vyhnout se oblastem centrální nekrózy [55]. (LE: 2b).
U cystických lézí ledviny má core biopsie nižší diagnostickou výtěžnost a méně přesný výsledek. Z tohoto důvodu nelze tuto metodu doporučit, pokud nejsou přítomny známky solidního nádoru (kategorie IV podle Bosniakovy klasifikace) [43,45,48] (LE: 2b).
Doplňující informace lze získat kombinací FNA a core biopsie, zejména u pacientů se složitými cystickými lézemi [44,49,50,56,57] (LE: 3).
Perkutánní biopsie je spojena s nízkou morbiditou [48]. Rozsev tumoru podél punkčního kanálu je ojedinělý. Společná analýza uvádí 4,3% incidenci spontánní resorpce subkapsulárního/perinefrického hematomu, výskyt klinicky signifikantního krvácení je však ojedinělý (0–1,4 %; 0,7 % ve společné analýze) a krvácení obvykle samo vymizí [48].
5.4 Doporučení pro diagnostické vyšetření RCC
Doporučení k části 5.4 
RCC – renální karcinom, CT – počítačová tomografie, MR – magnetická rezonance 5.5 Literatura
- Novara G, Ficarra V, Antonelli A et al. Validation of the 2009 TNM version in a large multi-institutional cohort of patients treated for renal cell carcinoma: are further improvements needed? Eur Urol 2010; 58(4): 588–595. doi: 10.1016/j.eururo.2010.07.006.
- Jayson M, Sanders H. Increased incidence of serendipitously discovered renal cell carcinoma. Urology 1998; 51(2): 203–205.
- Lee CT, Katz J, Fearn PA et al. Mode of presentation of renal cell carcinoma provides prognostic information. Urol Oncol 2002; 7(4): 135–140.
- Patard JJ, Leray E, Rodriguez A et al. Correlation between symptom graduation, tumor characteristics and survival in renal cell carcinoma. Eur Urol 2003; 44(2): 226–232.
- Kim HL, Belldegrun AS, Freitas DG et al. Paraneoplastic signs and symptoms of renal cell carcinoma: implications for prognosis. J Urol 2003; 170(5): 1742–1746.
- Motzer RJ, Bacik J, Murphy BA et al. Interferon-alfa as a comparative treatment for clinical trials of new therapies against advanced renal cell carcinoma. J Clin Oncol 2002; 20(1): 289–296.
- Sufrin G, Chasan S, Golio A et al. Paraneoplastic and serologic syndromes of renal adenocarcinoma. Semin Urol 1989; 7(3): 158–171.
- Uzzo RG, Novick AC. Nephron sparing surgery for renal tumors: indications, techniques and outcomes. J Urol 2001; 166(1): 6–18.
- Huang WC, Levey AS, Serio AM et al. Chronic kidney disease after nephrectomy in patients with renal cortical tumours: a retrospective cohort study. Lancet Oncol 2006; 7(9): 735–740.
- Israel GM, Bosniak MA. How I do it: evaluating renal masses. Radiology 2005; 236(2): 441–450.
- Fan L, Lianfang D, Jinfang X et al. Diagnostic efficacy of contrast-enhanced ultrasonography in solid renal parenchymal lesions with maximum diameters of 5 cm. J Ultrasound Med 2008; 27(6): 875–885.
- Correas JM, Tranquart F, Claudon M et al. Guidelines for contrast enhanced ultrasound (CEUS) – update 2008. J Radiol 2009; 90 (1 Pt 2): 123–138.
- Mitterberger M, Pelzer A, Colleselli D et al. Contrast-enhanced ultrasound for diagnosis of prostate cancer and kidney lesions. Eur J Radiol 2007; 64(2): 231–238.
- Israel GM, Bosniak MA. Pitfalls in renal mass evaluation and how to avoid them. Radiographics 2008; 28(5): 1325–1338. doi: 10.1148/rg.285075744.
- Choudhary S, Rajesh A, Mayer NJ et al. Renal oncocytoma: CT features cannot reliably distinguish oncocytoma from other renal neoplasms. Clin Radiol 2009; 64(5): 517–522. doi: 10.1016/j.crad.2008.12.011.
- Rosenkrantz AB, Hindman N, Fitzgerald EF et al. MRI features of renal oncocytoma and chromophobe renal cell carcinoma. AJR Am J Roentgenol 2010; 195(6): W421–W427. doi: 10.2214/AJR.10.4718.
- Hindman N, Ngo l, Genega EM et al. Angiomyolipoma with minimal fat: can it be differentiated from clear cell renal cell carcinoma by using standard MR techniques? Radiology 2012; 265(2): 468–477. doi: 10.1148/radiol.12112087.
- Pedrosa I, Sun MR, Spencer M et al. MR imaging of renal masses: correlation with findings at surgery and pathologic analysis. Radiographics 2008; 28(4): 985–1003. doi: 10.1148/rg.284065018.
- Gong IH, Hwang J, Choi DK et al. Relationship among total kidney volume, renal function and age. J Urol 2012; 187(1): 344–349. doi: 10.1016/j.juro.2011.09.005.
- Ferda J, Hora M, Hes O et al. Assessment of the kidney tumor vascular supply by two-phase MDCT-angiography. Eur J Radiol 2007; 62(2): 295–301.
- Shao P, Tang L, li P et al. Precise segmental renal artery clamping under the guidance of dual-source computed tomography angiography during laparoscopic partial nephrectomy. Eur Urol 2012; 62(6): 1001–1008. doi: 10.1016/j.eururo.2012.05.056.
- Adey GS, Pedrosa I, Rofsky NM et al. Lower limits of detection using magnetic resonance imaging for solid components in cystic renal neoplasms. Urology 2008; 71(1): 47–51. doi: 10.1016/j.urology.2007.09.016.
- Janus CL, Mendelson DS. Comparison of MRI and CT for study of renal and perirenal masses. Crit Rev Diagn Imaging 1991; 32(2): 69–118.
- Krestin GP, Gross-Fengels W, Marincek B et al. The importance of magnetic resonance tomography in the diagnosis and staging of renal cell carcinoma. Radiologe 1992; 32(3): 121–126.
- Mueller-Lisse UG, Mueller-Lisse UL. Imaging of advanced renal cell carcinoma. World J Urol 2010; 28(3): 253–261. doi: 10.1007/s00345-010-0557-z.
- Kabala JE, Gillatt DA, Persad RA et al. Magnetic resonance imaging in the staging of renal cell carcinoma. Br J Radiol 1991; 64(764): 683–689.
- Putra LG, Minor TX, Bolton DM et al. Improved assessment of renal lesions in pregnancy with magnetic resonance imaging. Urology 2009; 74(3): 535–539. doi: 10.1016/j.urology.2008.07.050.
- Giannarini G, Petralia G, Thoeny HC et al. Potential and limitations of diffusion-weighted magnetic resonance imaging in kidney, prostate, and bladder cancer including pelvic lymph node staging: a critical analysis of the literature. Eur Urol 2012; 61(2): 326–340. doi: 10.1016/j.eururo.2011.09.019.
- Park JW, Jo MK, Lee HM et al. Significance of 18F-fluorodeoxyglucose positron-emission tomography/computed tomography for the postoperative surveillance of advanced renal cell carcinoma. BJU Int 2009; 103(5): 615–619. doi: 10.1111/j.1464-410X.2008.08150.x.
- Heidenreich A, Ravery V, European Society of Oncological Urology. Preoperative imaging in renal cell cancer. World J Urol 2004; 22(5): 307–315.
- Sheth S, Scatarige JC, Horton KM et al. Current concepts in the diagnosis and management of renal cell carcinoma: role of multidetector CZ and three-dimensional CT. Radiographics 2001; 21: S237.
- Bechtold RE, Zagoria RJ et al. Imaging approach to staging of renal cell carcinoma. Urol Clin North Am 1997; 24(3): 507–522.
- Miles KA, London NJ, Lavelle JM et al. CT staging of renal carcinoma: a prospective comparison of three dynamic computed tomography techniques. Eur J Radiol 1991; 13(1): 37–42.
- Lim DJ, Carter MF et al. Computerized tomography in the preoperative staging for pulmonary metastases in patients with renal cell carcinoma. J Urol 1993; 150(4): 1112–1114.
- Marshall ME, Pearson T, Simpson W et al. Low incidence of asymptomatic brain metastases in patients with renal cell carcinoma. Urology 1990; 36(4): 300–302.
- Koga S, Tsuda S, Nishikido M et al. The diagnostic value of bone scan in patients with renal cell carcinoma. J Urol 2001; 166(6): 2126–2128.
- Henriksson C, Haraldsson G, Aldenborg F et al. Skeletal metastases in 102 patients evaluated before surgery for renal cell carcinoma. Scand J Urol Nephrol 1992; 26(4): 363–366.
- Seaman E, Goluboff ET, Ross S et al. Association of radionuclide bone scan and serum alkaline phosphatase in patients with metastatic renal cell carcinoma. Urology 1996; 48(5): 692–695.
- Warren KS, McFarlane J. The Bosniak classification of renal cystic masses. BJU Int 2005; 95(7): 939–942.
- Bosniak MA. The use of the Bosniak classification system for renal cysts and cystic tumors. J Urol 1997; 157(5): 1852–1853.
- Shannon BA, Cohen RJ, de Bruto H et al. The value of preoperative needle core biopsy for diagnosing benign lesions among small, incidentally detected renal masses. J Urol 2008; 180(4): 1257–1261. doi: 10.1016/j.juro.2008.06.030.
- Maturen KE, Nghiem HV, Caoili EM et al. Renal mass core biopsy: accuracy and impact on clinical management. AJR Am J Roentgenol 2007; 188(2): 563–570.
- Volpe A, Mattar K, Finelli A et al. Contemporary results of percutaneous biopsy of 100 small renal masses: a single center experience. J Urol 2008; 180(6): 2333–2337. doi: 10.1016/j.juro.2008.08.014.
- Veltri A, Garetto I, Tosetti I et al. Diagnostic accuracy and clinical impact of imaging-guided needle biopsy of renal masses. Retrospective analysis on 150 cases. Eur Radiol 2011; 21(2): 393–401. doi: 10.1007/s00330-010-1938-9.
- Leveridge MJ, Finelli A, Kachura JR et al. Outcomes of small renal mass needle core biopsy, nondiagnostic percutaneous biopsy, and the role of repeat biopsy. Eur Urol 2011; 60(3): 578–584. doi: 10.1016/j.eururo.2011.06.021.
- Abel EJ, Culp SH, Matin SF et al. Percutaneous biopsy of primary tumor in metastatic renal cell carcinoma to predict high risk pathological features: comparison with nephrectomy assessment. J Urol 2010; 184(5): 1877–1881. doi: 10.1016/j.juro.2010.06.105.
- Breda A, Treat EG, Haft-Candell L et al. Comparison of accuracy of 14-, 18 - and 20-G needles in ex-vivo renal mass biopsy: a prospective, blinded study. BJU Int 2010; 105(7): 940–945. doi: 10.1111/j.1464-410X.2009.08989.x.
- Marconi L, Dabestani S, Lam TB et al. Systematic review and meta-analysis of diagnostic accuracy of percutaneous renal tumour biopsy. Eur Urol 2016; 69(4): 660–673. doi: 10.1016/j.eururo.2015.07.072.
- Motzer RJ, Barrios CH, Kim TM et al. Phase II randomized trial comparing sequential first-line everolimus and secondline sunitinib versus first-line sunitinib and second-line everolimus in patients with metastatic renal cell carcinoma. J Clin Oncol 2014; 32(25): 2765–2772. doi: 10.1200/JCO.2013.54.6911.
- Wood BJ, Khan MA, McGovern F et al. Imaging guided biopsy of renal masses: indications, accuracy and impact on clinical management. J Urol 1999; 161(5): 1470–1474.
- Somani BK, Nabi G, Thorpe P et al. Image-guided biopsy-diagnosed renal cell carcinoma: critical appraisal of technique and long-term follow-up. Eur Urol 2007; 51(5): 1289–1295.
- Vasudevan A, Davies RJ, Shannon BA et al. Incidental renal tumours: the frequency of benign lesions and the role of preoperative core biopsy. BJU Int 2006; 97(5): 946–949.
- Neuzillet Y, Lechevallier E, Andre M et al. Accuracy and clinical role of fine needle percutaneous biopsy with computerized tomography guidance of small (less than 4.0 cm) renal masses. J Urol 2004; 171: 1802.
- Schmidbauer J, Remzi M, Memarsadeghi M et al. Diagnostic accuracy of computed tomography-guided percutaneous biopsy of renal masses. Eur Urol 2008; 53(5): 1003–1011.
- Wunderlich H, Hindermann W, Al Mustafa AM et al. The accuracy of 250 fine needle biopsies of renal tumors. J Urol 2005; 174(1): 44–46.
- Harisinghani MG, Mahwe MM, Gervais DA et al. Incidence of malignancy in complex cystic renal masses (Bosniak category III): should imaging-guided biopsy precede surgery? AJR Am J Roentgenol 2003; 180(3): 755–758.
- Lang EK, Macchia RJ, Gayle B et al. CT-guided biopsy of indeterminate renal cystic masses (Bosniak 3 and 2F): accuracy and impact on clinical management. Eur Radiol 2002; 12(10): 2518–2524.
6. Prognostické faktory
Prognostické faktory se dělí na anatomické, histologické, klinické a molekulární.
6.1 Anatomické faktory
TNM klasifikační systém zahrnuje následující faktory: velikost nádoru, žilní invazi, invazi kapsuly ledviny, invazi nadledviny a postižení LN a přítomnost vzdálených metastáz [1] (tab. 3).
6.2 Histologické faktory
Mezi histologické faktory patří grade podle Fuhrmanové, podtyp RCC, přítomnost sarkomatoidních změn, mikrovaskulární invaze, přítomnost nekróz v tumoru a invaze vývodného systému. Jaderný grade podle Fuhrmanové představuje nejčastěji užívaný a akceptovaný histologický klasifikační systém [2]. Ačkoli je ovlivněn intra - i interindividuálními rozdíly subjektivního hodnocení jednotlivých lékařů (intra/inter observer), představuje stále nezávislý prognostický faktor [3]. Pomocí zjednodušeného dvou-/třístupňového klasifikačního systému lze stanovit prognózu se stejnou přesností jako pomocí klasického čtyřstupňového systému [4,5] (LE: 3). Univariátní analýza prokázala nejlepší prognózu u pacientů s chRCC, následně pRCC a nakonec ccRCC [6,7]. Po stratifikaci tumorů podle stadia však prognostická informace stanovená na základě typu RCC ztrácí na významu [7,8] (LE: 3).
Tab. 5 uvádí rozdíly ve stadiu, grade a době CSS mezi jednotlivými typy RCC.
Tab. 5. Základní charakteristika tří hlavních typů RCC dle [8,10,40]. ![Základní charakteristika tří hlavních typů RCC dle [8,10,40].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/9c617db121af22b13890d25d63f5e961.png)
* Systém klasifikace jaderného grade podle Fuhrmanové byl schválen pro ccRCC, při klasifikaci chRCC však poskytuje nespolehlivé výsledky. Údaje vycházející z klasifikačního systému Panera et al nejsou prozatím k dispozici [2,41,42]. CSS – doba přežití specifická pro karcinom, HR – poměr rizik, RCC – renální karcinom, ccRCC – světlobuněčný RCC, pRCC – papilární RCC, chRCC – chromofobní RCC U všech typů RCC se prognóza zhoršuje spolu s vyšším stadiem a histopatologickým grade (tab. 6 a 7). Celková míra přežití (overall survival – OS) po pěti letech činí 49 % pro všechny typy RCC, což představuje zlepšení od roku 2006, pravděpodobně z důvodu nárůstu incidentálně detekovaných RCC a užívání inhibitorů tyrozinkinázy (TKI) [9]. Sarkomatoidní změny mohou být přítomny u všech typů RCC a signalizují velmi agresivní tumory vysokého grade.
Dlouhodobá míra přežití u pacientů s RCC, kteří podstoupili RN nebo PN v letech 1970–2003, je obsažena v tab. 7. Údaje pocházejí z kohortové studie a týkají se unilaterálního, sporadického ccRCC, pRCC nebo chRCC [10].
Tab. 6. Doba přežití specifická pro karcinom po stratifikaci na základě stadia a histopatologického grade – poměr rizik (95% CI) dle [40]. ![Doba přežití specifická pro karcinom po stratifikaci na základě stadia a histopatologického grade – poměr rizik (95% CI) dle [40].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/3567f9dc403db41b859d2c6cadb34e11.png)
CI – interval spolehlivosti Tab. 7. Doba přežití specifická pro karcinom u pacientů, kteří podstoupili operační léčbu, stratifikace podle typu RCC (odhadovaná míra přežití v %) (95% CI). 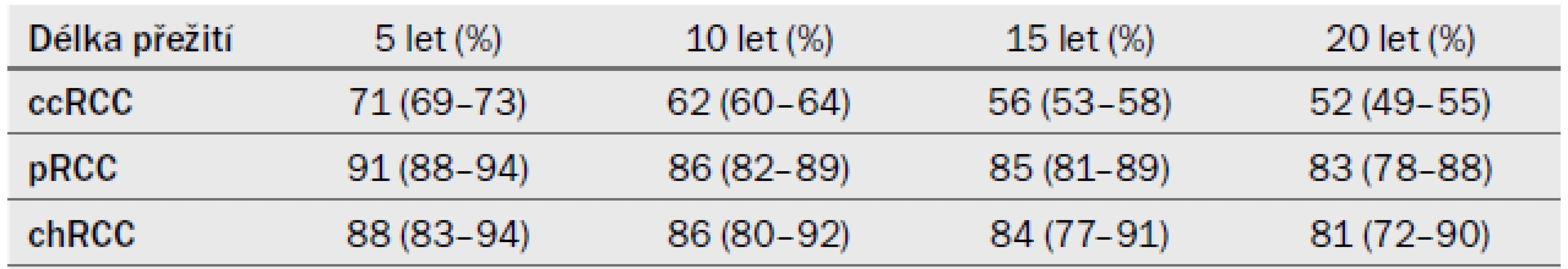
ccRCC – světlobuněčný renální karcinom, pRCC – papilární renální karcinom, chRCC – chromofobní renální karcinom Byly identifikovány dvě podskupiny pRCC s různými výsledky [11]: typ I zahrnuje tumory nízkého grade s chromofilní cytoplazmou a příznivou prognózou, typ II je tvořen převážně tumory vysokého grade s eozinofilní cytoplazmou a se sklonem k tvorbě metastáz (LE: 3).
RCC s translokací Xp 11,2 má nepříznivou prognózu [12]. Navzdory nízké incidenci je nutné tento typ systematicky hodnotit u mladších pacientů.
Cytogenetická a genetická analýza potvrdila klasifikaci jednotlivých typů RCC [13–15] (LE: 2b).
6.3 Klinické faktory
Klinické faktory zahrnují celkový stav pacienta (performance status – PS), lokální symptomy, kachexii, anémii, počet krevních destiček, počet neutrofilů a poměr neutrofilů k lymfocytům [16–20] (LE: 3).
6.4 Molekulární faktory
Probíhá výzkum různých molekulárních markerů, jako jsou např. karbonická anhydráza IX (CaIX), VEGF, hypoxií indukovaný faktor (HIF), Ki67 (proliferace), p53, p21 [21], PTEN (fosfatáza a homolog tenzinu) (buněčný cyklus), E-cadherin, C-reaktivní protein (CRP), osteopontin [22] a CD44 (buněčná adheze) [23,24], CXCR4 [25] a dalších markerů buněčného cyklu a proliferace [26,27] (LE: 3). U žádného z markerů však nebylo jednoznačně prokázáno, že by zvyšovaly přesnost predikce (predictive accuracy – PA) současných prognostických systémů, žádný z markerů nebyl externě validován a jejich užívání se v běžné praxi nedoporučuje. Stanovení profilu exprese genů přináší slibné výsledky, zatím však nebyly pomocí této metody identifikovány žádné nové prognostické faktory [28].
6.5 Prognostické systémy a nomogramy
Doposud byly vyvinuty a externě validovány různé pooperační prognostické systémy a nomogramy, které užívají nezávislé prognostické faktory [29–35]. Tyto systémy pravděpodobně umožní přesnější predikci doby přežití pacienta než samotná klasifikace TNM nebo stanovení grade podle Fuhrmanové (LE: 3). Podstatná výhoda nomogramů spočívá v tom, že umožňují hodnotit PA a díky tomu objektivně posoudit všechny nové prediktivní parametry. Před schválením jakékoli nové prognostické proměnné nebo systému je nezbytné prokázat, že disponuje vyšší PA než stávající pooperační histoprognostické systémy [36]. V nedávné době byl vyvinut nový předoperační nomogram s vynikající PA [37,38].
Tab. 8 uvádí přehled v současné době nejaktuálnějších prognostických systémů.
Tab. 8. Anatomické, histologické a klinické proměnné v nejužívanějších prognostických modelech pro lokalizovaný a metastazující RCC. 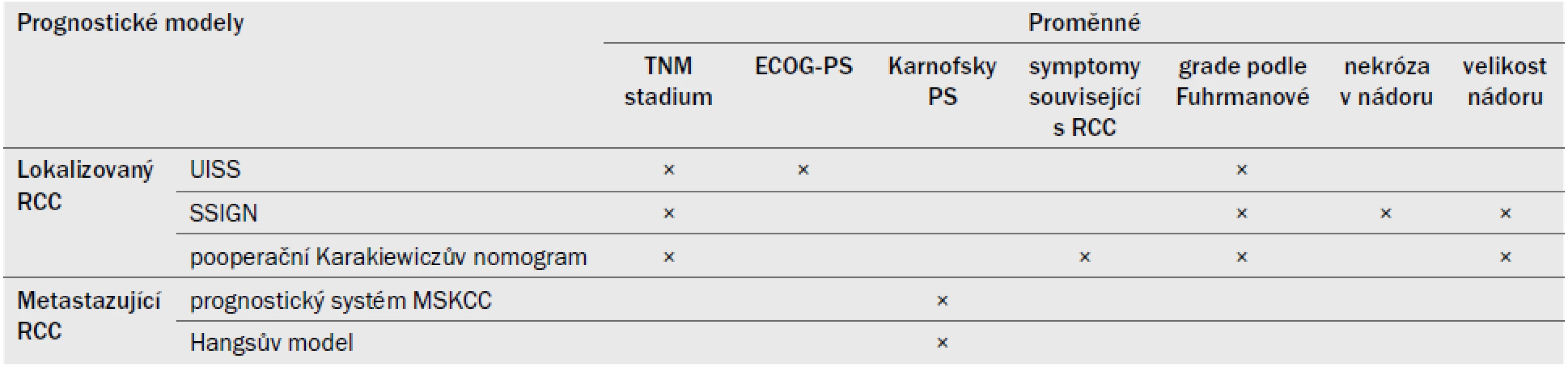
Tab. 8 – pokračování. Anatomické, histologické a klinické proměnné v nejužívanějších prognostických modelech pro lokalizovaný a metastazující RCC. 
TNM – klasifikace tumor, uzlina, metastáza (Tumour, Node, Metastasis), RCC – renální karcinom, ECOG-PS – Eastern Cooperative Oncology Group, LDH – laktátdehydrogenáza, MSKCC – Memorial Sloan Kettering Cancer Center, PS – performance status, SSIGN – Stage Size Grade Necrosis, UISS – Staging system University of California Los Angeles integrated 6.6 Souhrn důkazů a doporučení týkajících se prognostických faktorů
Souhrn důkazů a doporučení k části 6.6. 
TNM – klasifikace tumor, uzlina, metastáza (Tumour, Node, Metastasis), RCC – renální karcinom 6.7 Literatura
- Sobin LH, Gospodariwicz M, Wittekind C (eds). TNM classification of malignant tumors. UICC International Union Against Cancer. 7th ed. New York: Wiley-Blackwell 2009 : 255.
- Fuhrman SA, Lasky LC, Lumas C et al. Prognostic significance of morphologic parameters in renal cell carcinoma. Am J Surg Pathol 1982; 6(7): 655–663.
- Lang H, Lindner V, De Fromont M et al. Multicenter determination of optimal interobserver agreement using the Fuhrman grading system for renal cell carcinoma: assessment of 241 patients with > 15-year follow-up. Cancer 2005; 103(3): 625–629.
- Rioux-Leclercq N, Karakiewicz PI, Trinh QD et al. Prognostic ability of simplified nuclear grading of renal cell carcinoma. Cancer 2007; 109(5): 868–874.
- Sun M, Lughezzani G, Jeldres C et al. A proposal for reclassification of the Fuhrman grading system in patients with clear cell renal cell carcinoma. Eur Urol 2009; 56(5): 775–781. doi: 10.1016/j.eururo.2009.06.008.
- Cheville JC, Lohse CM, Zincke H et al. Comparisons of outcome and prognostic features among histologic subtypes of renal cell carcinoma. Am J Surg Pathol 2003; 27(5): 612–624.
- Patard JJ, Leray E, Rioux-Leclercq N et al. Prognostic value of histologic subtypes in renal cell carcinoma: a multicenter experience. J Clin Oncol 2005; 23(12): 2763–2771.
- Capitanio U, Cloutier V, Zini L et al. A critical assessment of the prognostic value of clear cell, papillary and chromophobe histological subtypes in renal cell carcinoma: a population-based study. BJU Int 2009; 103(11): 1496–1500. doi: 10.1111/j.1464-410X.2008.08259.x.
- Wahlgren T, Harmenberg U, Sandström P al. Treatment and overall survival in renal cell carcinoma: a Swedish populationbased study (2000–2008). Br J Cancer 2013; 108(7): 1541–1549. doi: 10.1038/bjc.2013.119.
- Leibovich BC, Lohse CM, Crispen PL et al. Histological subtype is an independent predictor of outcome for patients with renal cell carcinoma. J Urol 2010; 183(4): 1309–1315. doi: 10.1016/j.juro.2009.12.035.
- Delahunt B, Eble JN, McCredie MR et al. Morphologic typing of papillary renal cell carcinoma: comparison of growth kinetics and patient survival in 66 cases. Hum Pathol 2001; 32(6): 590–595.
- Klatte T, Streubel B, Wrba F et al. Renal cell carcinoma associated with transcription factor E3 expression and Xp11.2 translocation: incidence, characteristics, and prognosis. Am J Clin Pathol 2012; 137(5): 761–768. doi: 10.1309/AJCPQ6LLFMC4OXGC.
- Yang XJ, Tan MH, Kim HL et al. A molecular classification of papillary renal cell carcinoma. Cancer Res 2005; 65(13): 5628–5637.
- Linehan WM, Vasselli J, Srinivasan R et al. Genetic basis of cancer of the kidney: disease-specific approaches to therapy. Clin Cancer Res 2004; 10 (18 Pt 2): 6282S–6289S.
- Furge KA, Tan MH, Dykema K et al. Identification of deregulated oncogenic pathways in renal cell carcinoma: an integrated oncogenomic approach based on gene expression profiling. Oncogene 2007; 26(9): 1346–1350.
- Kim HL, Belldegrun AS, Freitas DG et al. Paraneoplastic signs and symptoms of renal cell carcinoma: implications for prognosis. J Urol 2003; 170(5): 1742–1746.
- Haas NB, Manola J, Uzzo RG et al. Initial results from ASSURE (E2805): adjuvant sorafenib or sunitinib for unfavorable renal carcinoma, an ECOG-ACRIN-led, NCTN phase III trial. J Clin Oncol 2015; 33 (Suppl 7). Abstract 403.
- Bensalah K, Leray E, Fergelot P et al. Prognostic value of thrombocytosis in renal cell carcinoma. J Urol 2006; 175 (3 Pt 1): 859–863.
- Kim HL, Han KR, Zisman A et al. Cachexia-like symptoms predict a worse prognosis in localized T1 renal cell carcinoma. J Urol 2004; 171(5): 1810–1813.
- Patard JJ, Leray E, Cindolo L et al. Multi-institutional validation of a symptom based classification for renal cell carcinoma. J Urol 2004; 172(3): 858–862.
- ClinicalTrials.gov. A Phase 3, randomized, open-label study of nivolumab combined with ipilimumab versus sunitinib monotherapy in subjects with previously untreated, advanced or metastatic renal cell carcinoma. 2015 p. NCT02231749. [online]. Available from: https://clinicaltrials.gov/show/NCT02231749.
- Sim SH, Messenger MP, Gregory WM et al. Prognostic utility of pre-operative circulating osteopontin, carbonic anhydrase IX and CRP in renal cell carcinoma. Br J Cancer 2012; 107(7): 1131–1137. doi: 10.1038/bjc.2012.360.
- Sabatino M, Kim-Schulze S, Panelli MC et al. Serum vascular endothelial growth factor and fibronectin predict clinical response to high-dose interleukin-2 therapy. J Clin Oncol 2009; 27(16): 2645–2652. doi: 10.1200/JCO.2008.19.1106.
- Li G, Feng G, Gentil-Perret A et al. Serum carbonic anhydrase 9 level is associated with postoperative recurrence of conventional renal cell cancer. J Urol 2008; 180(2): 510–513. doi: 10.1016/j.juro.2008.04.024.
- Choueiri TK, Pal SK, McDermott DF et al. A phase I study of cabozantinib (XL184) in patients with renal cell cancer. Ann Oncol 2014; 25(8): 1603–1608. doi: 10.1093/annonc/mdu184.
- Choueiri TK, Escudier B, Powles T et al. Cabozantinib versus everolimus in advanced renal-cell carcinoma. N Engl J Med 2015; 373(19): 1814–1823. doi: 10.1056/NEJMoa1510016.
- Motzer RJ, Escudier B, McDermott DF et al. Nivolumab versus everolimus in advanced renal cell carcinoma. N Engl J Med 2015; 373(19): 1803–1813. doi: 10.1056/NEJMoa1510665.
- Zhao H, Ljungberg B, Grankvist K et al. Gene expression profiling predicts survival in conventional renal cell carcinoma. PLoS Med 2006; 3(1): e13.
- Sorbellini M, Kattan MW, Snyder ME et al. A postoperative prognostic nomogram predicting recurrence for patients with conventional clear cell renal cell carcinoma. J Urol 2005; 173(1): 48–51.
- Zisman A, Pantuck AJ, Dorey F et al. Improved prognostication of renal cell carcinoma using an integrated staging system. J Clin Oncol 2001; 19(6): 1649–1657.
- Frank I, Blute ML, Cheville JC et al. An outcome prediction model for patients with clear cell renal cell carcinoma treated with radical nephrectomy based on tumor stage, size, grade and necrosis: the SSIGN score. J Urol 2002; 168(6): 2395–2400.
- Leibovich BC, Blute ML, Cheville JC et al. Prediction of progression after radical nephrectomy for patients with clear cell renal cell carcinoma: a stratification tool for prospective clinical trials. Cancer 2003; 97(7): 1663–1671.
- Patard JJ, Kim HL, Lam JS et al. Use of the University of California Los Angeles integrated staging system to predict survival in renal cell carcinoma: an international multicenter study. J Clin Oncol 2004; 22(16): 3316–3322.
- Karakiewicz PI, Briganti A, Chun FK et al. Multi-institutional validation of a new renal cancer-specific survival nomogram. J Clin Oncol 2007; 25(11): 1316–1322.
- Zigeuner R, Hutterer G, Chromecki T et al. External validation of the Mayo Clinic stage, size, grade, and necrosis (SSIGN) score for clear-cell renal cell carcinoma in a single European centre applying routine pathology. Eur Urol 2010; 57(1): 102–109. doi: 10.1016/j.eururo.2008.11.033.
- Isbarn H, Karakiewicz PI. Predicting cancer-control outcomes in patients with renal cell carcinoma. Curr Opin Urol 2009; 19(3): 247–257. doi: 10.1097/MOU.0b013e32832a0814.
- Raj GV, Thompson RH, Leibovich BC et al. Preoperative nomogram predicting 12-year probability of metastatic renal cancer. J Urol 2008; 179(6): 2146–2151. doi: 10.1016/j.juro.2008.01.101.
- Karakiewicz PI, Suardi N, Capitanio U et al. A preoperative prognostic model for patients treated with nephrectomy for renal cell carcinoma. Eur Urol 2009; 55(2): 287–295. doi: 10.1016/j.eururo.2008.07.037.
- Wittekind BJ, Compton CC, Sobin LH (eds). A Commentary on Uniform Use. UICC International Union against cancer. 4th edition. New York: Wiley-Blackwell 106.
- Keegan KA, Schupp CW, Chamie K et al. Histopathology of surgically treated renal cell carcinoma: survival differences by subtype and stage. J Urol 2012; 188(2): 391–397. doi: 10.1016/j.juro.2012.04.006.
- Paner GP, Amin MB, Alvarado-cabrero I et al. A novel tumor grading scheme for chromophobe renal cell carcinoma: prognostic utility and comparison with Fuhrman nuclear grade. Am J Surg Pathol 2010; 34(9): 1233–1240. doi: 10.1097/PAS.0b013e3181e96f2a.
- Cheville JC, Lohse CM, Sukov WR et al. Chromophobe renal cell carcinoma: the impact of tumor grade on outcome. Am J Surg Pathol 2012; 36(6): 851–856. doi: 10.1097/PAS.0b013e3182496895.
7. Léčba onemocnění
7.1 Léčba lokalizovaného RCC
7.1.1 Úvod
Informace obsažené v kapitolách 7.1.2 až 7.2.4.2 lze podpořit závěry ze systematického přehledu. Tento přehled zahrnoval všechny důležité publikace zabývající se srovnáním modalit operační léčby lokalizovaného RCC (T1–T2 N0 M0) [1,2]. Přehled zahrnuje i RCT nebo kvazi-RCT. Vzhledem k velmi malému počtu těchto studií však systematický přehled čerpal rovněž z nerandomizovaných studií, prospektivních pozorovacích studií s kontrolní skupinou, retrospektivních srovnávacích studií a komparativních studií z kvalitních databází. V rámci této verze guidelines bylo provedeno aktualizované vyhledávání (kapitola 2.1. Metodologie).
7.1.2 Operační léčba
7.1.2.1 Nefron šetřící operace vs. RN
Na základě v současné době dostupných onkologických výsledků a výsledků týkajících se kvality života (quality of life – QoL) pacienta představuje NSS vhodnější přístup pro léčbu lokalizovaných RCC než RN, a to bez ohledu na zvolený operační přístup.
Obě operační techniky dosahují srovnatelné míry CSS po pěti letech [3–7]. Tento závěr před nedávnem potvrdila studie zahrnující pacienty se solitárními RCC ve stadiu T1–T2 N0 M0 o velikosti ≤ 5 cm s normální funkční kontralaterální ledvinou a WHO PS 0–2. Po 9,3letém sledování přežívalo 198 pacientů po RN a 173 po PN. Míra CSS činila 98,5 vs. 97 % (ve stejném pořadí). K lokální recidivě došlo u jednoho pacienta po RN a u šesti pacientů po PN [8].
Několik studií srovnává PN vs. RN (pomocí otevřeného nebo laparoskopického přístupu) při léčbě RCC (≤ 4 cm) [8–12]. Po zohlednění parametrů jednotlivých pacientů souvisela RN s vyšší mírou mortality na jakoukoli příčinu. V předčasně uzavřené randomizované studii, která srovnávala PN a RN při léčbě RCC o velikosti ≤ 5 cm, nebyl v cílové populaci zaznamenán žádný rozdíl v OS [7]. Ve studii, která srovnávala PN a RN při léčbě RCC o velikosti 4–7 cm, nebyl zaznamenán žádný rozdíl v CSS [11,13–21]. Srovnání laparoskopické PN a laparoskopické RN při léčbě RCC o velikosti > 4 cm neprokázalo žádný rozdíl v míře OS, CSS ani době přežití bez recidivy (recurrence-free survival – RFS) [21]. Retrospektivní analýza zahrnující starší pacienty [22] uvádí 98% míru CSS u pacientů podstupujících PN a 95% míru CSS u pacientů podstupujících RN. I další studie srovnávají nejrůznější aspekty QoL a bezpečnostní parametry otevřené PN a RN [3,4,5,18,20,23].
Nebyl zjištěn žádný rozdíl v délce hospitalizace [4,5,24], potřebě krevní transfuze [4,24,25] ani průměrné hodnotě krevní ztráty [4,24]. Výskyt komplikací byl zaznamenáván nekonzistentním způsobem a žádná technika nebyla preferována [26]. Jedna ze studií uvádí delší trvání průměrné délky operace v případě otevřené PN [26], ostatní autoři však neshledali žádný rozdíl [27]. Tři studie shodně zaznamenaly horší renální funkci po RN než po PN [3,6]. Po zohlednění parametrů, jako jsou diabetes, hypertenze a věk pacienta, bylo zhoršení renální funkce po operaci zaznamenáno častěji u pacientů podstupujících RN [6].
Jeden z přehledů údajů z databáze srovnává otevřenou PN s laparoskopickou RN při léčbě RCC o velikosti 4–7 cm. Byl prokázán významně menší průměrný nárůst pooperační hladiny kreatininu v séru [14]. Jiná studie srovnávající laparoskopickou PN a RN uvádí menší pokles eGFR u pacientů podstupujících PN, zatímco u pacientů po RN byl zaznamenán významně častější výskyt ACKD [21]. Jiný přehled údajů z databáze [28] srovnává bezpečnost a účinnost laparoskopické PN při léčbě RCC > 2 cm (2–4 vs. > 4 cm). U této populace pacientů byl zaznamenán výraznější pooperační pokles eGFR než u pacientů s menšími RCC.
Dvě studie hodnotí QoL po operační léčbě RCC. Pacienti léčení pomocí PN uváděli lepší skóre v řadě domén QoL [23]. Pacienti, kteří podstoupili RN, uváděli větší obavy související se životem pouze s jednou ledvinou. Nejvyšší QoL skóre uváděli pacienti s RCC < 4 cm a normální funkcí kontralaterální ledviny (bez ohledu na zvolený typ intervence), což odpovídá i skóre stanoveným před diagnostikováním onemocnění. Pacienti s větším výskytem komplikací uváděli nižší QoL skóre [4].
Nebyla nalezena žádná prospektivní komparativní studie, která by srovnávala onkologické výsledky minimálně invazivních ablativních technik s RN. Jedna studie srovnávající RFA vs. RN nebo PN při léčbě RCC ve stadiu T1a uvádí 100% míru CSS pro všechny tři modality [29].
Nejnovější důkazy týkající se onkologických výsledků nasvědčují tomu, že nejvhodnější léčbu lokalizovaného RCC (pakliže to umožňují parametry pacienta i tumoru) představuje PN a nikoli RN (bez ohledu na zvolený operační přístup). V případě, že je nezbytná otevřená operace, jsou onkologické výsledky otevřené PN přinejmenším srovnatelné s otevřenou RN. Pokud to okolnosti umožňují, měla by být PN preferovanou volbou.
U některých pacientů s lokalizovaným RCC je indikace PN nevhodná z následujících důvodů:
- lokálně pokročilého nádoru,
- nevhodné lokalizace nádoru (znemožňující parciální resekci),
- výrazného zhoršení zdravotního stavu pacienta.
V těchto případech je kurativním terapeutickým řešením RN. Kompletní resekce primárního tumoru pomocí otevřené nebo laparoskopické operace poskytuje solidní šanci na vyléčení onemocnění.
7.1.2.2 Související operace
7.1.2.2.1 Adrenalektomie
Jedna prospektivní nerandomizovaná studie srovnává výsledky RN nebo PN s ipsilaterální adrenalektomií nebo bez ní [30]. Multivariátní analýza ukázala, že lokalizace tumoru v horním pólu ledviny neumožňuje na rozdíl od velikosti tumoru předvídat zasažení nadledvin. Bez ohledu na provedení adrenalektomie nebyl zaznamenán žádný rozdíl v OS po pěti ani 10 letech. Adrenalektomie byla indikována na základě radiografických a peroperačních nálezů. Pouze 48 z celkem 2 065 pacientů podstoupilo současnou ipsilaterální adrenalektomii, ve 42 případech z důvodu odstranění benigní léze.
7.1.2.2.2 Lymfadenektomie indikovaná pro resekci klinicky negativních LN (cN0)
Indikace lymfadenektomie (LND) u pacientů s RCC představuje rozporuplné téma [31]. Klinické vyšetření LN spočívá v hodnocení zvětšených uzlin pomocí CT/MR vyšetření a peroperační vyšetření probíhá pohmatovou kontrolou. V méně než 20 % případů klinicky pozitivních LN (cN+) potvrdí patologické vyšetření přítomnost metastáz (pN+) [32]. CT ani MR neumožňují detekovat malé metastázy v LN normální velikosti [33] a jediný možný způsob, jak zhodnotit stav LN, představuje rozšířená LND (e-LND) s histopatologickým vyšetřením. Klinicky pozitivním LN (cN+) se věnuje kapitola 7.2. Léčba lokálně pokročilého RCC.
Problematikou klinicky negativních LN (cN0) se zabývá šest klinických studií [31], jedna RCT [32] a pět komparativních studií [34–38].
Retrospektivní studie podporují hypotézu, že u pacientů s onemocněním s vysokým rizikem může být provedení LND přínosné [33,39]. Ve studii EORTC (European Organization for Research and Treatment of Cancer) však konečné patologické vyšetření prokázalo pozitivní LN pouze u 4 % pacientů s onemocněním cN0, což svědčí o tom, že u většiny pacientů je provedení LND zbytečné (tzv. over-treatment) [32].
Jak ukazují retrospektivní studie, eLND by měla zahrnovat LN v okolí ipsilaterálních velkých cév a interaortokavální oblasti od crura bránice ke společné iliacké arterii. Zasažení interaortokaválních LN bez postižení LN v oblasti hilu se uvádí až v 35–45 % případů [33,34,40].
Při výkonu je nezbytné odstranit alespoň 15 LN [41,42]. Sentinelová LND se stále považuje za experimentální techniku [43,44]. U pacientů s malým počtem pozitivních LN (< 4), u nichž se nádor nešíří mimo LN, byla zaznamenána lepší míra přežití [45,46]. Byl navržen předoperační nomogram pro predikci stadia pN+ u LN [47].
7.1.2.2.3 Embolizace
Provedení embolizace před rutinní nefrektomií nepřináší žádný benefit [48,49]. U pacientů, u nichž není možné přistoupit k operačnímu výkonu, a pacientů s neresekovatelným nádorem lze pomocí embolizace kontrolovat symptomy, jako je makroskopická hematurie nebo bolest v boku [50–52]. Tyto indikace uvádějí rovněž kapitoly 7.2 a 7.3, které odkazují na níže uvedený přehled důkazů a doporučení.
7.1.2.2.4 Souhrn důkazů a doporučení
Souhrn důkazů a doporučení k části 7.1.2.2.4 
PN – parciální resekce ledviny, RN – radikální nefrektomie, LND – lymfadenektomie, RCC – renální karcinom, LN – lymfatické uzliny 7.1.3 Techniky RN a PN
7.1.3.1 Techniky RN
Žádná RCT studie nesrovnává onkologické výsledky laparoskopické a otevřené RN. Touto tematikou se zabývá kohortová studie [53] a retrospektivní přehledy údajů z databází, které mají obvykle nízkou kvalitu metodologického zpracování [4,54,55]. Publikace uvádějí srovnatelné onkologické výsledky při laparoskopické i otevřené RN. Data z jedné RCT [56] a dvou nerandomizovaných studií [4,53] ukazují výrazně kratší délku hospitalizace a menší požadavky na aplikaci analgetik u pacientů podstupujících laparoskopickou RN (vs. otevřená RN). V této skupině pacientů byla zaznamenána rovněž významně kratší délka rekonvalescence [53]. Mezi oběma přístupy nebyl zaznamenán žádný rozdíl v počtu pacientů vyžadujících transfuzi, všechny tři studie však shodně uvádějí významně menší peroperační ztrátu krve při laparoskopickém přístupu. Míra výskytu operačních komplikací je nízká, uvádí se velmi široké rozpětí intervalu spolehlivosti. Nebyl zaznamenán žádný rozdíl v míře výskytu komplikací, otevřená nefrektomie však trvala výrazně kratší dobu. Pacienti uváděli srovnatelná pooperační skóre QoL [4].
Některé komparativní studie hodnotí peroperační výsledky laparoskopické vs. otevřené RN při léčbě nádorů ledviny ≥ T2. Celkově byla u pacientů podstupujících laparoskopickou RN zaznamenána menší odhadovaná krevní ztráta, menší bolestivost po výkonu a kratší délka hospitalizace i rekonvalescence než u pacientů, kteří podstoupili otevřenou RN [53,57–59]. Výskyt peroperačních i pooperačních komplikací byl v obou skupinách srovnatelný [53,57–60]. Dále nebyly zaznamenány žádné významné rozdíly v míře CSS, přežití bez progrese (progression-free survival – PFS) ani OS [42,53,58,60,61] (LE 2b).
Za nejvhodnější techniku pro RN byl považován retroperitoneální nebo transperitoneální přístup; dvě RCT [62,63] a jedna kvazi-RCT [64] uvádějí srovnatelné onkologické výsledky. Při obou přístupech byla zaznamenána srovnatelná QoL.
Jedna RCT [64] a jeden přehled údajů z databází [26] srovnávají ručně asistovanou RN se standardní laparoskopickou RN. Při obou přístupech byla zaznamenána srovnatelná odhadovaná míra OS, CSS i RFS po pěti letech. Operace trvala významně kratší dobu při užití ručně asistovaného přístupu, zatímco při užití standardní laparoskopické techniky se uvádí kratší délka hospitalizace i rekonvalescence [26,64]. Přístupy však byly srovnávány na malém vzorku pacientů.
Jiná menší studie srovnává roboticky asistovanou laparoskopickou RN s laparoskopickou RN [65]. Nebyl zaznamenán žádný případ lokální recidivy, vzniku metastáz v místě portu ani vzdálených metastáz, nevýhodou studie však je malá velikost vzorku a krátká doba sledování. Podobné výsledky uvádí observační kohortová studie srovnávající laparoskopickou RN bez užití portu a s užitím tří portů [66,67]. Při obou přístupech byly zaznamenány srovnatelné peroperační výsledky.
7.1.3.2 Techniky PN
Studie srovnávající laparoskopickou a otevřenou PN (publikované v centrech disponujících zkušenostmi s laparoskopickou operativou) neuvádějí žádný rozdíl v míře PFS [68–71] ani OS [70,71]. Průměrná odhadovaná krevní ztráta je menší při užití laparoskopického přístupu [68,70,72], výskyt pooperační mortality, trombózy hlubokých žil a plicní embolie je však srovnatelný při užití obou přístupů [68,70]. Laparoskopická operace obvykle trvá déle [69–71], doba trvání teplé ischemie je kratší při otevřeném přístupu [68,70,72,73]. Srovnání odpovídajících subjektů uvádí bezprostředně po laparoskopické PN výraznější pokles GFR [71], po sledování 3,6 let se však tento rozdíl ztrácí. Podle výsledků jiné komparativní studie nepředstavuje zvolený operační přístup nezávislý prediktor pro vznik chronického selhání ledvin po operaci [73]. Při užití retroperitoneálního i transperitoneálního laparoskopického přístupu (PN) byly zaznamenány srovnatelné peroperační výsledky [74]. Podle výsledků velké studie dosahuje prostá enukleace nádoru (vs. standardní PN a RN) srovnatelné míry PFS a CSS [75,76].
U vybrané populace pacientů byla prokázána proveditelnost laparoskopické PN bez užití svorek a laparoskopické PN s užitím jediného portu. Bezpečnost a klinickou roli těchto technik je však nezbytné potvrdit ve větších studiích [77,78].
Žádná studie dosud nesrovnávala onkologické výsledky roboticky asistované PN s laparoskopickou nebo otevřenou PN. Jedna v nedávné době publikovaná studie prospektivně srovnává peroperační výsledky cyklu výkonů roboticky asistované a otevřené PN, které prováděl stejný operatér. S ohledem na krevní ztrátu a délku hospitalizace měla roboticky asistovaná PN lepší výsledky než otevřená PN. Délka trvání teplé ischemie, délka operace, výskyt okamžitých, časných a krátkodobých komplikací, změna hladiny kreatininu i stav patologických okrajů se mezi oběma skupinami nelišily [79].
V nedávné době provedená metaanalýza zahrnující několik nerandomizovaných klinických studií rozdílné metodologické kvality srovnává peroperační výsledky roboticky asistované a laparoskopické PN. Robotický přístup byl spojen s výrazně nižší mírou konverze na otevřenou/radikální operaci, kratší délkou trvání teplé ischemie, menší změnou eGFR po výkonu a kratší délkou hospitalizace. S ohledem na výskyt komplikací, změnu hladiny kreatininu v séru po operaci, délku operace, odhadovanou krevní ztrátu a pozitivní chirurgické okraje nebyly mezi oběma skupinami pozorovány žádné signifikantní rozdíly [80].
7.1.3.3 Souhrn důkazů a doporučení
Souhrn důkazů a doporučení k části 7.1.3.3 
PN – parciální resekce ledviny, RN – radikální nefrektomie 7.1.4 Alternativní terapeutické přístupy
7.1.4.1 Operační vs. neoperační léčba
Populační studie srovnávají onkologické výsledky operační (RN nebo PN) a neoperační léčby nádorů < 4 cm. Analýza prokazuje významně nižší míru mortality specifické pro karcinom u pacientů podstupujících operační léčbu [81,82]. Pacienti zařazení do programu sledování však byli starší, v celkově horším zdravotním stavu a představovali méně vhodné kandidáty pro operaci. Míra mortality na ostatní příčiny u pacientů nepodstupujících operační léčbu byla významně vyšší než u pacientů léčených operačně [81]. Analýza zahrnující starší pacienty (> 75 let) neprokázala stejný benefit v míře mortality specifické pro karcinom u pacientů podstupujících operační léčbu [83–85].
7.1.4.2 Sledování
Starší pacienti a pacienti s komorbiditami s náhodně detekovanými malými renálními lézemi mají nízkou míru mortality specifickou pro RCC a signifikantní míru mortality na ostatní příčiny [86,87]. Aktivní sledování je definováno jako monitorování velikosti nádoru pomocí série zobrazovacích vyšetření břicha (UZ, CT nebo MR) s indikací odložené intervence u pacientů, u nichž nádor během sledování vykazuje známky klinické progrese [88].
Největší soubor dat u pacientů zařazených do programu aktivního sledování uvádí pomalý růst renálních nádorů. Progrese do vzniku metastáz byla zaznamenána pouze u malého počtu pacientů [89,90].
Komparativní studie z jediného centra, která zahrnuje pacienty ve věku ≥ 75 let, ukazuje nižší OS u pacientů, kteří podstoupili aktivní sledování a nefrektomii (vs. NSS) pro léčbu renálních nádorů T1. Pacienti zařazení do programu aktivního sledování však byli celkově starší a trpěli větším počtem komorbidit. Multivariátní analýza zohledňující věk, komorbidity a další parametry neprokázala souvislost mezi typem léčby a mírou OS [86]. Jiná studie srovnávající RN vs. PN vs. aktivní sledování u pacientů s renálními lézemi T1a neprokázala při 34měsíčním sledování žádný statisticky signifikantní rozdíl v OS ani CSS [91].
Před nedávnem byly uveřejněny předběžné údaje z multicentrické databáze DISSRMl (Delayed Intervention and Surveillance for Small Renal Masses). Do této prospektivní nerandomizované studie bylo zařazeno 497 pacientů se solidními renálními lézemi velikosti < 4 cm, kteří si zvolili aktivní sledování nebo primární aktivní intervenci. Pacienti, kteří si zvolili program aktivního sledování, byli starší, měli horší skóre ECOG (Eastern Cooperative Oncology Group), větší počet komorbidit, menší nádory a častěji u nich byly přítomny vícečetné a bilaterální léze. Celková míra přežití po primární intervenci a aktivním sledování činila (ve stejném pořadí): 98 a 96 % po dvou letech a 92 a 75 % po pěti letech (p = 0,06). Po pěti letech činila míra CSS 99 a 100 %, ve stejném pořadí (p = 0,3). V regresním modelu s poměrně krátkou dobou sledování nepředstavovalo aktivní sledování prediktor celkové doby přežití ani CSS [92].
Krátkodobé i střednědobé onkologické výsledky nasvědčují tomu, že u dobře vybraných starších pacientů a/nebo pacientů s komorbiditami představuje aktivní sledování vhodnou alternativu pro úvodní monitorování malých renálních lézí, která je v případě progrese nahrazena intervencí [88–90,93–96].
Multicentrická studie srovnává QoL u pacientů podstupujících okamžitou intervenci nebo aktivní sledování. Pacienti podstupující okamžitou intervenci uváděli vyšší počáteční skóre QoL, zejména v doméně zdravotního stavu. Tento benefit přetrval po dobu minimálně jednoho roku po intervenci. Aktivní sledování nemělo negativní dopad na kategorii duševního zdraví, která zahrnuje domény jako deprese a úzkost [97].
7.1.4.3 Ablativní terapie
7.1.4.3.1 Kryoablace
Kryoablace se provádí pomocí perkutánního nebo laparoskopicky asistovaného přístupu. Komparativní studie neprokázaly mezi laparoskopickou a perkutánní kryoablací žádný signifikantní rozdíl v celkové míře výskytu komplikací [98–100]. Komparativní studie uvádí po delší době sledování srovnatelnou míru OS, CSS a RFS u 172 pacientů léčených pomocí laparoskopické kryoablace a 123 pacientů, kteří byli léčeni pomocí perkutánní kryoablace a sledováni po kratší dobu [99]. Perkutánní technika byla spojena s průměrně kratší dobou hospitalizace [99,100]. Žádná studie dosud nesrovnávala strategii aktivního sledování s kryoablací.
7.1.4.3.2 Kryoablace vs. parciální resekce ledviny
Otevřená, laparoskopická nebo robotická PN byla srovnávána s perkutánní nebo laparoskopickou kryoablací. Onkologické výsledky jsou různorodé, zatímco některé studie neprokázaly žádný rozdíl v OS, CSS, RFS, době přežití bez onemocnění (disease-free survival – DFS), lokální recidivě ani vzniku metastazujícího onemocnění [101,102], jiné studie ukazují výrazný benefit ve prospěch PN (u některých nebo všech výše uvedených parametrů) [103–106]. Ne všechny studie uvádějí všechny zmiňované výsledné parametry, některé studie byly příliš malé a zahrnovaly pacienty s benigními nádory. Žádná ze studií neprokázala, že by kryoablace dosahovala s ohledem na onkologické parametry lepších výsledků než PN.
Studie uvádějí různorodé výsledky rovněž s ohledem na peroperační parametry, výskyt komplikací a parametry QoL.
Některé studie uvádějí kratší délku hospitalizace a menší krevní ztrátu při kryoablaci [101–103] bez rozdílů v ostatních peroperačních parametrech: délce rekonvalescence, míře výskytu komplikací i pooperační hladině kreatininu v séru. Dvě studie [105,106] uvádějí speciální Clavienův grade, obvykle bez signifikantních rozdílů (peroperační vs. pooperační komplikace).
Hodnota eGFR se ve dvou studiích signifikantně nelišila, třetí studie však uvádí výsledky ve prospěch kryoablace [104–106]. Studie uváděly různé výsledky týkající se odhadu vzniku nové CKD, jedna ze studií ve prospěch kryoablace [104], druhá výrazně ve prospěch PN [105], třetí studie neprokázala žádný rozdíl mezi oběma přístupy [106]. Jedna ze studií, která srovnává PN s ablativní terapií (kryoablací nebo RFA) [107], prokázala významně lepší dobu přežití specifickou pro onemocnění po pěti i 10 letech u pacientů podstupujících PN.
7.1.4.3.3 Radiofrekvenční ablace
Radiofrekvenční ablace se provádí laparoskopicky nebo perkutánně. Tři studie srovnávají laparoskopickou a perkutánní RFA při léčbě nádorů T1a [108–110]. Až u 29 % pacientů se vyskytly komplikace, obvykle však mírné povahy. Míra výskytu komplikací byla v obou skupinách srovnatelná. Malá studie [110] uvádí vysokou míru neúplné ablace u pacientů léčených pomocí perkutánní RFA. Tři komparativní studie však neprokázaly žádný rozdíl v míře recidivy onemocnění ani v míře CSS.
7.1.4.3.4 Radiofrekvenční ablace vs. parciální resekce ledviny
Většina publikací, které hodnotí výsledky RFA, jsou retrospektivní kohortové studie zahrnující malý počet pacientů a krátkou dobu sledování. Tři studie retrospektivně srovnávají RFA a operační léčbu u pacientů s nádory T1a [29,111,112].
Studie [111] srovnávající RFA (perkutánní nebo laparoskopickou) a PN při léčbě onemocnění ve stadiu T1a neprokázala žádný rozdíl v míře OS ani CSS. Jiná studie retrospektivně srovnává 105 pacientů s nádory T1a, kteří podstoupili perkutánní RFA nebo RN. Míra CSS činila 100 % v obou skupinách. U pacientů léčených pomocí RFA byla zaznamenána nižší míra OS, pacienti podstupující operační léčbu však byli celkově mladší [29].
Studie z jediného centra, která srovnává 34 pacientů po RFA a 16 pacientů po otevřené PN, uvádí vyšší míru komplikací a požadavků na krevní transfuzi u pacientů léčených pomocí PN. Navzdory větší velikosti nádorů u pacientů podstupujících PN byla míra progrese v obou skupinách srovnatelná (0 %) [112].
7.1.4.3.5 Kryoablace vs. radiofrekvenční ablace
Dvě studie srovnávají RFA a kryoablaci [113,114]. Žádná studie nezaznamenala signifikantní rozdíly v míře OS, CSS ani RFS. Jedna ze studií [113] uvádí lepší míru lokální RFS po pěti letech u pacientů léčených pomocí RFA, zatímco druhá studie [114] uvádí lepší výsledek u pacientů podstupujících kryoablaci. Jedna ze studií [113] neuvádí mezi oběma přístupy žádný rozdíl ve výskytu komplikací podle Clavienova systému.
7.1.4.3.6 Další ablativní techniky
Některé studie potvrzují proveditelnost dalších ablativních technik, jako jsou mikrovlnná ablace, laserová ablace nebo ablace pomocí fokusovaného ultrazvuku o vysoké intenzitě. Tyto techniky je však nutné prozatím považovat za experimentální.
7.1.4.3.7 Souhrn důkazů a doporučení
Souhrn důkazů a doporučení k části 7.1.4.3.7 
RFA – radiofrekvenční ablace, PN – parciální resekce ledviny 7.2 Léčba lokálně pokročilého RCC
7.2.1 Úvod
Kromě informací uváděných v přehledu důkazů a doporučení pro léčbu lokalizovaného RCC v rámci kapitoly 7.1 lze za určitých specifických okolností zvolit při léčbě lokálně pokročilého onemocnění speciální terapeutické strategie.
7.2.2 Řešení klinicky pozitivních LN (cN+)
U pacientů s klinicky pozitivními LN (cN+) je indikace LND vždy oprávněná [115]. Rozsah LND je však diskutabilní [33].
7.2.3 Řešení lokálně pokročilého neresekovatelného RCC
U pacientů s neresekovatelným nádorem lze pomocí embolizace kontrolovat symptomy, jako je makroskopická hematurie nebo bolest v boku [50–52]. Užívání neoadjuvantní cílené terapie ke zmenšení velikosti nádoru představuje experimentální metodu a nelze ji doporučit mimo rámec kontrolovaných klinických studií.
7.2.4 Řešení RCC s žilním nádorovým trombem
Vznik nádorového trombu v IVC (inferior vena cava) u pacientů s RCC představuje významný nepříznivý prognostický faktor. Nádorový trombus se obvykle odstraňuje operačně spolu s celou ledvinou. Za standardní modalitu pro odstranění žilního nádorového trombu se považuje agresivní operační resekce [116–124]. Dosud však nebylo dosaženo konsenzu s ohledem na nejvhodnější operační přístup.
7.2.4.1 Důkazy podporující operační přístup u pacientů s žilním nádorovým trombem
Důkazy pro podporu operační léčby u pacientů s žilním nádorovým trombem pocházejí z případových studií. V jedné z největších publikovaných studií [121] nesouviselo vysoké uložení nádorového trombu s větším rozsevem nádoru do LN, perinefrické tukové tkáně ani se vznikem vzdálených metastáz. U všech pacientů s nemetastazujícím onemocněním a žilním nádorovým trombem a přijatelným PS se tedy doporučuje zvážit operační intervenci bez ohledu na rozsah nádorového trombu při diagnóze onemocnění (LE: 3). Vhodnou operační techniku a přístup je nutné zvolit individuálně na základě rozsahu nádorového trombu (LE: 3).
7.2.4.2 Důkazy podporující různé operační strategie
Byl proveden systematický přehled komparativních studií, které se zabývají řešením žilního nádorového trombu u pacientů s nemetastazujícím RCC [125,126]. Pouze pět studií splňovalo požadovaná kritéria. Ve všech studiích hrozí vysoké riziko zkreslení.
Minimálně invazivní přístupové techniky trvají ve srovnání s tradiční sternotomií významně kratší dobu [127,128]. Předoperační provedení embolizace [129] vedlo u pacientů s RCC T3 ke zkrácení délky operace i hospitalizace, menší krevní ztrátě a snížení peroperační mortality.
Mezi operací s použitím kardiopulmonálního bypassu s hlubokou hypotermií a zástavou srdeční, s použitím částečného bypassu za normální teploty nebo prostým uzavřením duté žíly bez mimotělního oběhu nebyl zaznamenán žádný významný rozdíl s ohledem na onkologické výsledky [130].
Nebylo prokázáno, že by konkrétní operační technika excize žilního nádorového trombu dosahovala lepšího výsledku než ostatní. Volba operační techniky závisela na úrovni lokalizace trombu a stupni uzávěru IVC [125,128,129]. Relativní benefit a rizika související s ostatními strategiemi a přístupy k IVC a role použití filtru do IVC a provedení bypassu nejsou známa.
7.2.4.3 Souhrn důkazů a doporučení
Souhrn důkazů a doporučení k části 7.2.4.3 
LND – lymfadenektomie, RCC – renální karcinom, LN – lymfatické uzliny 7.2.5 Adjuvantní terapie
Žádné důkazy z randomizovaných studií fáze III v současné době neprokazují, že by adjuvantní terapie poskytovala benefit s ohledem na dobu přežití. Vliv adjuvantní vakcinace na OS u vybraných pacientů podstupujících nefrektomii pro léčbu nádoru ledviny T3 nebyl potvrzen [131–135] (LE: 1b). Komplex peptidů a proteinů teplotního šoku-96 (vitespen) [136] může přinášet benefit u vybrané skupiny pacientů, celková data ze studií fáze III jsou však negativní. Podobné výsledky byly zaznamenány při adjuvantní aplikaci girentuximabu, monoklonální protilátky proti karboanhydráze IX (CAIX) (ARISER) [137]. Celková analýza neprokázala žádný rozdíl v míře DFS, hodnocení podskupiny pacientů s vysokou expresí CAIX však nasvědčuje tomu, že u této populace pacientů může léčba girentuximabem přinášet potenciální benefit. V současné době probíhá několik RCT studií, které testují preparáty sunitinib, sorafenib, pazopanib, axitinib a everolimus v rámci adjuvantní léčby. V současné době nemáme k dispozici žádné údaje o adjuvantní aplikaci VEGF-R nebo inhibitorů mTOR.
Jedna z největších studií, která srovnává adjuvantní aplikaci sunitinibu vs. sorafenibu vs. placebo, byla publikována v roce 2015 (ASSURE). Mezi experimentální léčbou a placebem nebyl prokázán žádný významný rozdíl v míře DFS ani OS. Studie dospěla k závěru, že adjuvantní podávání sunitinibu ani sorafenibu nelze doporučit [138].
7.2.5.1 Souhrn důkazů a doporučení pro adjuvantní léčbu
Souhrn důkazů a doporučení k části 7.2.5.1 
7.3 Pokročilý/metastazující RCC
7.3.1 Lokální léčba pokročilého/metastazujícího RCC
7.3.1.1 Cytoredukční nefrektomie
Resekce nádoru může vést k vyléčení onemocnění pouze v případě, že jsou odstraněna všechna ložiska nádoru. To se týká pouze pacientů s primárním nádorem a onemocněním s jednou resekovatelnou metastázou nebo oligometastatickým resekovatelným postižením. U většiny pacientů s metastazujícím onemocněním má cytoredukční nefrektomie (CN) paliativní efekt a je nezbytná indikace systémové léčby. Metaanalýza srovnávající CN + imunoterapii se samotnou imunoterapií prokázala lepší míru dlouhodobého přežití u pacientů podstupujících CN [139]. Kombinaci CN s cílenou léčbou (sunitinib, sorafenib a další) hodnotí pouze retrospektivní nekomparativní studie. CN se v současné době doporučuje pacientům s metastazujícím RCC s dobrým PS, velkými primárními nádory a malým objemem metastáz. U pacientů se špatným PS nebo rizikem IMDC (metastatic renal cancer database consortium), malými primárními nádory a velkým objemem metastáz a/nebo sarkomatoidními nádory nelze CN doporučit.
7.3.1.1.1 Embolizace primárního nádoru
U pacientů, u nichž není možné přistoupit k operačnímu výkonu, a pacientů s neresekovatelným nádorem lze pomocí embolizace kontrolovat symptomy, jako je makroskopická hematurie nebo bolest v boku [50–52] (viz doporučení v kapitole 7.1.2.2.4).
7.3.1.1.2 Souhrn důkazů a doporučení pro lokální léčbu pokročilého/metastazujícího RCC
Souhrn důkazů a doporučení k části 7.3.1.1.2 
IFN-α – interferon alfa, RCC – renální karcinom, PS – performance status 7.3.2 Lokální léčba metastáz u pacientů s metastazujícím RCC
Byl proveden systémový přehled možností lokální léčby metastatického šíření RCC do nejrůznějších orgánů [140]. Přehled zahrnuje modality jako metastasektomii (MTS), nejrůznější radioterapeutické techniky i žádnou lokální léčbu. Výsledné parametry zahrnovaly míru OS, CSS a PFS, lokální kontrolu symptomů a výskyt nežádoucích účinků. Autoři hodnotili riziko zkreslení [141]. Z celkem 2 235 studií bylo do přehledu zařazeno pouze 16 nerandomizovaných komparativních studií.
Osm studií se zabývá lokální léčbou metastáz v nejrůznějších orgánech [142–149] – metastáz zasahujících do jediného orgánu i do více orgánů současně. Tři studie hodnotí lokální léčbu metastáz do skeletu vč. páteře u pacientů s RCC [150–152], dvě studie hodnotí léčbu metastáz do mozku [153,154] a po jedné studii hodnotí metastázy do jater [155], plic [156] a slinivky [157]. Tři studie [146,148,156] byly k dispozici pouze ve formě abstrakt. Nesourodá povaha údajů znemožňuje provedení metaanalýzy. Typ a distribuce systémové terapie (cytokiny a inhibitory VEGF) se v jednotlivých studiích významně lišily, stejně jako způsob záznamu výsledků.
7.3.2.1 Kompletní vs. žádná/nekompletní MTS
Všech osm studií [142–149] zahrnujících pacienty s RCC metastázami v nejrůznějších orgánech srovnává kompletní vs. žádnou a/nebo nekompletní MTS. V jedné ze studií [145] bylo kompletní resekce dosaženo pouze u 45 % pacientů (ve srovnání MTS vs. žádná MTS). Nebyly indikovány jiné než operační přístupy. Šest studií [142,144–146,148,149] uvádí signifikantně delší medián OS nebo CSS po kompletní MTS (medián hodnoty pro medián OS nebo CSS činil 40,75 měsíce, rozmezí 23–122 měsíců) ve srovnání s nekompletní a/nebo žádnou MTS (medián hodnoty pro medián OS nebo CSS činil 14,8 měsíce, rozmezí 8,4–55,5 měsíce). Ze dvou zbývajících studií jedna [143] neprokázala žádný signifikantní rozdíl v CSS mezi kompletní a žádnou MTS, zatímco druhá [147] uvádí delší medián OS u pacientů podstupujících MTS, ačkoli nebyla zaznamenána hodnota p.
Tři studie uvádí výsledky týkající se léčby metastáz u pacientů s RCC postihujících plíce [156], játra [155] a slinivku [157]. Studie hodnotící RCC s plicními metastázami uvádí signifikantně vyšší medián OS u pacientů podstupujících MTS vs. samotnou farmakoterapii (platí pro cílenou terapii a imunoterapii). Rovněž další dvě studie uvádí významně vyšší medián OS a OS po dobu pěti let u pacientů podstupujících MTS vs. žádnou MTS.
7.3.2.2 Lokální léčba kostních metastáz u pacientů s RCC
Jedna ze tří identifikovaných studií [152] srovnává obrazem řízenou radioterapii (image-guided radiotherapy – IGRT) s aplikací jediné dávky s hypofrakcionovanou IGRT u pacientů s RCC a kostními metastázami. IGRT s aplikací jediné dávky (≥ 24 Gray) dosahuje významně lepší lokální míry PFS po třech letech, což dokazuje rovněž Coxova regresní analýza. Jiná studie [150] srovnává pacienty s RCC se solitární kostní metastázou, kteří podstoupili MTS/kyretáž a lokální stabilizaci vs. žádnou operační léčbu. U pacientů podstupujících intervenci byla prokázána významně vyšší míra CSS po dobu pěti let.
Po zohlednění předchozí nefrektomie, pohlaví a věku pacienta uvádí multivariátní analýza stále benefit MTS/kyretáže a stabilizace. Třetí studie [151] srovnává vliv na úlevu bolesti a délku tohoto účinku při stereotaktické radioterapii (stereotactic body radiotherapy – SBRT) s aplikací jedné dávky a konvenční radioterapii (CRT) u pacientů s RCC a metastázami do páteře. Bolestivost, objektivní léčebná odpověď (objective response rate – ORR) ani délka intervalu do úlevy bolesti se nelišily.
7.3.2.3 Lokální léčba metastáz do mozku u pacientů s RCC
Dvě studie hodnotí metastázy do mozku u pacientů s RCC. Studie zahrnující tři větve [153] srovnává stereotaktickou radiochirurgii (SRS), ozařování celého mozku (whole brain radiotherapy – WBRT) a SRS + WBRT. Všechny skupiny byly dále rozděleny do RPA (recursive partitioning analysis) podskupin I–III (I příznivý, II střední a III nepříznivý status pacienta). U pacientů podstupujících samotnou SRS i SRS + WBRT byla zaznamenána srovnatelná OS po dvou letech a intracerebrální kontrola. Obě techniky dosahovaly lepších výsledků než samotná WBRT v celkové populaci pacientů i RPA analýze podskupin. Analýza RPA podskupiny I srovnávající SRS vs. SRS + WBRT prokázala významně lepší OS po dvou letech a lepší intracerebrální kontrolu u pacientů podstupujících SRS + WBRT (analýza zahrnovala pouze tři subjekty). Druhá studie [154] srovnává frakcionovanou stereotaktickou radioterapii (FSRT) a MTS + CRT nebo samotnou CRT. Několik pacientů ve všech skupinách podstoupilo po úvodní terapii alternativní operační i neoperační léčbu. Míra přežití po jeden, dva i tři roky byla nevýznamně vyšší u pacientů podstupujících FSRT než u pacientů po MTS + CRT nebo samotné CRT. FSRT nebyla spojena s významně lepší lokální kontrolou po dvou letech než kombinace MTS + CRT.
7.3.2.4 Embolizace metastáz
Provedení embolizace před resekcí hypervaskulárních metastáz do skeletu nebo páteře může pomoci redukovat peroperační krevní ztrátu [158]. U některých pacientů s bolestivými kostními nebo paravertebrálními metastázami může vést embolizace k úlevě symptomů [159] (viz doporučení v kapitole 7.1.2.2.4)
7.3.2.5 Souhrn důkazů a doporučení pro lokální léčbu metastáz u pacientů s metastazujícím RCC
Souhrn důkazů a doporučení k části 7.3.2.5 
RCC – renální karcinom, MTS – metastasektomie, PS – performance status 7.4 Systémová léčba pokročilého/metastazujícího RCC
7.4.1 Chemoterapie
Chemoterapie poskytuje skromný účinek pouze v případě kombinace 5-FU (5-fluorouracilu) s imunoterapií [160]. Jedna ze studií však uvádí srovnatelný účinek léčby pomocí interferonu alfa (IFN-α) a kombinace IFN-α + IL-2 (interleukin-2) + 5-FU [161].
7.4.1.1 Souhrn důkazů a doporučení pro systémovou léčbu pokročilého//metastazujícího RCC
Souhrn důkazů a doporučení k části 7.4.1.1 
5-FU – fluorouracil, IFN-α – interferon alfa, RCC – renální karcinom, ccRCC – světlobuněčný renální karcinom 7.4.2 Imunoterapie
7.4.2.1 IFN-α jako monoterapie a v kombinaci s bevacizumabem
S ohledem na využití IFN-α při léčbě metastazujícího ccRCC existují protichůdné údaje. Několik studií prokázalo, že léčba pomocí IFN-α poskytuje u pacientů s metastazujícím RCC benefit v době přežití srovnatelný s hormonální terapií [162]. Léčba pomocí IFN-α byla spojena s 6–15% mírou odpovědi, 25% poklesem rizika progrese a skromným benefitem v době přežití (vs. placebo) [163,164]. U pacientů s onemocněním se středním rizikem se však tento benefit neprokázal [165].
Léčba pomocí IFN-α může být účinná pouze u některých podskupin pacientů: pacientů s ccRCC, příznivými rizikovými kritérii (podle Memorial Sloan-Kettering Cancer Center) a pouze plicními metastázami [162]. Mírný účinek imunoterapie potvrzuje rovněž Cochrane metaanalýza [164]. Kombinace bevacizumabu + IFN-α v rámci léčby první linie zvyšuje ve srovnání s aplikací IFN-α jako monoterapie odpověď na léčbu i PFS [166]. Všechny studie, které srovnávají cílenou léčbou s monoterapií IFN-α, prokázaly superioritu pro léčbu sunitinibem, bevacizumabem + IFN-α a temsirolimem [166–169]. U pacientů s metastazujícím ccRCC dosahuje cílená léčba lepších výsledků než IFN-α.
7.4.2.2 Interleukin-2
IL-2 se užívá při léčbě metastazujícího RCC již od roku 1985, míra odpovědi se pohybuje v rozmezí 7–27 % [169–171]. Úplné a trvalé odpovědi lze dosáhnout aplikací bolusu vysoké dávky IL-2 [172]. IL-2 je výrazně toxičtější než IFN-α [164].
7.4.2.3 Vakcíny a cílená imunoterapie
Nebyl prokázán žádný benefit v době přežití mezi kombinací vakcíny s antigenem 5T4 se standardní terapií první linie (tj. sunitinib, IL-2 nebo IFN-α) a placebem a standardní terapií první linie [173]. V současné době probíhá několik studií testujících různé typy vakcín. V rámci studií fáze III jsou v současné době testovány monoklonální protilátky proti PD-1 (protein programované buněčné smrti) nebo jeho ligandu PD-1L, u nichž byla prokázána účinnost a přijatelná toxicita při léčbě RCC [174].
7.4.2.4 Blokáda kontrolních bodů imunitní reakce (immune checkpoint blockade)
Imunitní blokáda kontrolních bodů prostřednictvím monoklonálních protilátek cílí a blokuje receptor PD-1 nebo cytotoxický T lymfocytární antigen-4 (CTLA-4), díky čemuž dochází k obnově specifické nádorové imunity T buněk [175]. Zatímco pembrolizumab a nivolumab cílí receptor PD-1, atezolizumab a durvalumab blokují jeho ligand PD-L1. Ipilumimab cílí antigen CTLA-4. Randomizovaná studie fáze II testující různé dávkování nivolumabu při léčbě metastazujícího RCC prokázala vysokou míru ORR a rychlou a trvalou odpověď u významně předléčených pacientů [176]. Studie fáze III v současné době hodnotí kombinaci nivolumabu a ipilumimabu vs. sunitinib v rámci léčby první linie (CheckMate 214, NCT 02231749) [177]. Studie fáze III testující nivolumab vs. everolimus po několika liniích cílené terapie zaměřené na VEGF (CheckMate 025, NCT01668784) prokázala delší OS, lepší QoL a menší výskyt nežádoucích účinků 3. nebo 4. stupně při léčbě nivolumabem než při podávání everolimu [178–180]. Léčba nivolumabem nabízí větší benefit v OS než léčba pomocí everolimu (poměr rizik (hazard ratio – HR) 0,73; 95% CI 0,57–0,93; p < 0,002) u RCC refrakterního na VEGF (medián OS činil 25 měsíců při léčbě nivolumabem a 19,6 měsíců při léčbě everolimem (LE: 1b)). Do studie byli zařazeni pacienti, u nichž selhalo několik linií terapie cílené proti VEGF, díky čemuž lze výsledky zobecnit na širokou populaci pacientů. Celkem 15 % pacientů mělo vysoké riziko podle MSKCC (Memorial Sloan-Kettering Cancer Center). Navzdory benefitu v OS nebyla při léčbě nivolumabem prokázána žádná výhoda v míře PFS.
7.4.2.5 Souhrn důkazů a doporučení pro léčbu metastazujícího RCC pomocí imunoterapie
Souhrn důkazů a doporučení k části 7.4.2.5 
HD – vysoká dávka, IL – interleukin, IFN-α – interferon alfa, RCC – renální karcinom, ccRCC – světlobuněčný renální karcinom, OS – celková míra přežití, PFS – přežití bez progrese, PS – performance status, VEGF – vaskulární endoteliální růstový faktor 7.4.3 Cílené terapie
Akumulace HIF vyvolaná deaktivací VHL způsobuje u sporadického ccRCC nadměrnou expresi VEGF a růstového faktoru odvozeného z trombocytů (platelet-derived growth factor – PDGF), což podporuje neoangiogenezi [181–183]. Tento proces se významně podílí na vzniku a progresi RCC. V USA i v Evropě bylo schváleno několik cílených preparátů pro léčbu metastazujícího RCC:
- sorafenib (Nexavar®),
- sunitinib (Sutent®),
- bevacizumab (Avastin®) + IFN-α,
- pazopanib (Votrient®),
- temsirolimus (Torisel®),
- everolimus (Afinitor®),
- axitinib (Inlyta®).
Vzhledem k tomu, že většina publikovaných studií zahrnuje pouze pacienty se ccRCC, nelze stanovit žádná důkazy podpořená doporučení pro ostatní podtypy RCC.
V hlavních studiích vedoucích k registraci schválených cílených preparátů byli pacienti stratifikováni podle rizikového modelu MSKCC [162] (tab. 9). Vzhledem k tomu, že MSKCC (Motzerova) kritéria byla vytvořena v době, kdy se pro léčbu RCC užívaly cytokiny, byl vytvořen a validován rizikový model IMDC, který umožňuje stanovit přesnou prognózu u pacientů léčených pomocí cílené terapie. Na seznam MSKCC rizikových faktorů byla přidána neutrofilie a trombocytóza, naopak byla odebrána laktátdehydrogenáza [184].
Tab. 9. Kritéria MSKCC (Motzer) [163]1. ![Kritéria MSKCC (Motzer) [163]<sup>1</sup>.](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/533bcd05733753b5d44e4f59518d5e85.png)
1V tomto kontextu se rovněž běžně užívá rizikový model IMDC (Metastatic Renal Cancer Database Consortium) [184]. 2přijatelné (nízké) riziko – žádné rizikové faktory, střední riziko – jeden nebo dva rizikové faktory, nepřijatelné (vysoké) riziko – tři nebo více rizikových faktorů LDH – laktátdehydrogenáza, PS – performance status, MSKCC – Memorial Sloan-Kettering Cancer Center Data publikovaná podle IMDC týkající se doby přežití lze užívat při informování pacientů [185]. Rizikový model IMDC byl validován a srovnáván s modelem CCF (Cleveland Clinic Foundation), francouzským modelem, MSKCC modelem i modelem IKCWG (International Kidney Cancer Working Group). Model IMDC se neliší od ostatních modelů, což svědčí o tom, že bylo dosaženo horní hranice predikce prognózy výhradně na základě klinických faktorů (tab. 10) [186].
Tab. 10. Medián OS a pacienti přežívající dva roky po léčbě pomocí cílené terapie podle rizikového modelu IMDC (vytvořeno dle důkazů [184,186]). ![Medián OS a pacienti přežívající dva roky po léčbě pomocí cílené terapie podle rizikového modelu IMDC (vytvořeno dle důkazů [184,186]).](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/277565c555e099d7923706f59544b494.png)
OS – celková míra přežití, IMDC – Metastatic Renal Cancer Database Consortium, CI – interval spolehlivosti 1dle [184], 2dle [186] 7.4.3.1 Inhibitory tyrozinkinázy
7.4.3.1.1 Sorafenib
Sorafenib je multikinázový inhibitor. Studie srovnává sorafenib a placebo u pacientů po selhání předchozí systémové imunoterapie nebo pacientů, kteří nejsou vhodnými kandidáty pro imunoterapii. Léčba pomocí sorafenibu vedla ke zlepšení PFS [187] (HR 0,44; 95% CI 0,35–0,55; p < 0,01). U pacientů, kteří užívali zpočátku placebo, došlo po konverzi na účinnou léčbu ke zlepšení doby přežití (na rozdíl od pacientů, kteří užívali nadále placebo) [188]. U pacientů, kteří dosud nepodstoupili žádnou léčbu metastazujícího RCC, nedosahoval sorafenib lepších výsledků než IFN-α (studie fáze II). Několik studií využívá sorafenib v kontrolní skupině u pacientů s onemocněním refrakterním na sunitinib vs. axitinib, dovitinib a temsirolimus. U žádného z preparátů nebyl prokázán benefit v době přežití oproti sorafenibu.
7.4.3.1.2 Sunitinib
Sunitinib je perorální TKI, který vykazuje protinádorový a antiangiogenní účinek. Sunitinib jako monoterapie druhé linie (po cytokinech) u pacientů s metastazujícím RCC zajišťoval částečnou odpověď u 34–40 % pacientů a stabilizaci onemocnění déle než tři měsíce u 27–29 % pacientů [189]). V rámci monoterapie první volby dosahoval sunitinib významně delší PFS než IFN-α. Celková délka přežití byla lepší při léčbě sunitinibem (26,4 a 21,8 měsíce) [190].
Studie EFFECT srovnává léčbu sunitinibem v dávce 50 mg/den (čtyři týdny léčba, dva týdny pauza) s nepřerušovanou léčbou sunitinibem v dávce 37,5 mg/den u pacientů s metastazujícím ccRCC [191]. Medián intervalu do progrese (time to progression – TTP) při léčbě sunitinibem 50 mg byl delší než při léčbě pomocí 37,5 mg (9,9 vs. 7,1 měsíce). Nebyl zaznamenán žádný rozdíl v OS (23,1 vs. 23,5 měsíce; p = 0,615). Toxicita byla srovnatelná v obou větvích studie. Vzhledem k nesignifikantnímu, ale početně delšímu TTP při aplikaci standardní dávky 50 mg doporučují autoři standardní protokol. S cílem redukovat toxicitu léčby se užívá alternativní protokol (dva týdny léčby, jeden týden pauza), pro podporu tohoto protokolu však chybí kvalitní důkazy.
7.4.3.1.3 Pazopanib
Pazopanib je perorální inhibitor angiogeneze. Studie srovnávající pazopanib vs. placebo při léčbě pacientů, kteří nepodstoupili žádnou léčbu metastazujícího RCC, a pacientů, kteří podstoupili léčbu cytokiny, uvádějí významné zlepšení míry PFS a odpovědi na léčbu [192]. Medián PFS při léčbě pazopanibem ve srovnání s placebem činil:
- 9,2 vs. 4,2 měsíce v celkové studované populaci;
- 11,1 vs. 2,8 měsíce u pacientů, kteří nepodstoupili žádnou léčbu;
- 7,4 vs. 4,2 měsíce u pacientů, kteří podstoupili předchozí léčbu cytokiny.
Studie srovnávající pazopanib se sunitinibem (COMPARZ) doporučuje pazopanib jako další modalitu pro léčbu první linie. Bylo prokázáno, že léčba pazopanibem není spojena s horší PFS ani OS než léčba sunitinibem. Oba preparáty mají odlišný profil toxicity [193], pacienti léčení pazopanibem uvádějí lepší QoL. V jiné studii, která hodnotí preference pacientů (PISCES), pacienti upřednostňovali pazopanib před sunitinibem (70 vs. 22 %; p < 0,05) z důvodu toxicity spojené s výskytem symptomů [194]. Obě studie jsou limitovány skutečností, že srovnávají přerušovanou terapii (sunitinib) s kontinuální terapií (pazopanib).
7.4.3.1.4 Axitinib
Axitinib je perorální selektivní inhibitor VEGFR-1, -2 a -3 druhé generace. Axitinib byl nejprve testován v rámci léčby druhé linie. Studie AXIS srovnává axitinib a sorafenib u pacientů, u nichž selhala předchozí léčba cytokiny nebo cílenými preparáty (zejména pomocí sunitinibu) [195].
Při léčbě axitinibem byl zaznamenán vyšší celkový medián PFS než při léčbě sorafenibem. Největší rozdíl v PFS byl pozorován u pacientů, u kterých selhala předchozí léčba cytokiny. U pacientů, u nichž selhala léčba pomocí sunitinibu, byla léčba pomocí axitinibu spojena s vyšší mírou PFS než léčba pomocí sorafenibu (4,8 vs. 3,4 měsíce). Při léčbě axitinibem byl zaznamenán výskyt průjmu > 3. stupně u 11 % pacientů, hypertenze u 16 % pacientů a únavy u 11 % pacientů. Nevolnost (různého stupně závažnosti) se vyskytla u 32 % pacientů, zvracení u 24 % a astenie u 21 % pacientů. Ve studii, v níž nebyla umožněna změna léčby (crossover), byla za primární cílový parametr stanovena OS. Konečná analýza OS neprokázala žádný signifikantní rozdíl mezi léčbou axitinibem a sorafenibem [196,197].
Dvě studie testují axitinib v rámci léčby první linie [198,199]. Jedna studie hodnotí účinnost a bezpečnost titrace dávky axitinibu u pacientů s metastazujícím RCC, kteří nepodstoupili žádnou předchozí léčbu. Ačkoli míra objektivní léčebné odpovědi byla vyšší u pacientů léčených až do vzniku toxicity, medián PFS činil 14,5 měsíce u pacientů léčených pomocí axitinibu s titrací dávky, 15,7 měsíce v placebo skupině a 16,6 měsíce v nerandomizované skupině [198]. Tyto výsledky podporují hypotézu, že eskalace dávky souvisí s vyšší mírou léčebné odpovědi.
Randomizovaná studie fáze III srovnávající axitinib vs. sorafenib v rámci léčby první linie u pacientů s metastazujícím ccRCC (kteří nepodstoupili žádnou léčbu) neprokázala významný rozdíl v mediánu PFS mezi jednotlivými skupinami [199]. Vzhledem k výsledku této studie nebyl axitinib schválen pro léčbu první linie.
7.4.3.1.5 Cabozantinib
Cabozantinib je perorální TKI, vč. MET, VEGF a AXL. Studie fáze I testující cabozantinib u pacientů, u nichž selhala léčba pomocí VEGFR a inhibitorů mTOR, prokázala objektivní léčebnou odpověď a kontrolu onemocnění [200]. Na základě těchto výsledků srovnává randomizovaná studie fáze III cabozantinib s everolimem u pacientů se ccRCC, u nichž selhala jedna nebo více linií cílené terapie zaměřené na VEGF (METEOR) [201]. U pacientů s onemocněním refrakterním na cílenou terapii zaměřenou na VEGF vedla léčba pomocí cabozantinibu (vs. everolim) k prodloužení PFS o 42 % (HR 0,58; 95% CI 0,45–0,75) [201] (LE: 1b). Medián PFS při léčbě cabozantinibem činil 7,4 (95% CI 5,6–9,1) měsíce vs. 3,8 (95% CI 3,7–5,4) měsíce při léčbě everolimem. Do studie bylo zařazeno 658 pacientů, ačkoli PFS byla hodnocena pouze u prvních 375 subjektů. Výsledky interim analýzy týkající se OS ukazují výrazný trend ve prospěch cabozantinibu (HR 0,67; 95% CI 0,51–0,89; p = 0,005), tento výsledek však nebyl signifikantní v době interim analýzy. Finální analýza OS se očekává v roce 2016. Výskyt nežádoucích účinků 3. nebo 4. stupně byl zaznamenán u 74 % pacientů léčených pomocí cabozantinibu a 65 % pacientů léčených pomocí everolimu. V případě výskytu nežádoucích účinků bylo sníženo dávkování, u pacientů léčených cabozantinibem o 60 %. Míra ukončení léčby kvůli toxicitě se mezi oběma skupinami významně nelišila. Celkem 16 % pacientů zařazených do této studie mělo nepříznivé riziko podle MSKCC.
7.4.4 Monoklonální protilátky proti cirkulujícímu VEGF
7.4.4.1 Bevacizumab jako monoterapie a bevacizumab + IFN-α
Bevacizumab je humánní monoklonální protilátka. Studie AVOREN srovnává bevacizumab + IFN-α s IFN-α v rámci monoterapie při léčbě metastazujícího RCC [166]. Ve skupině pacientů léčených pomocí bevacizumabu + IFN-α byla zaznamenána vyšší míra celkové odpovědi. Medián PFS se prodloužil z 5,4 měsíce při léčbě IFN-α na 10,2 měsíce při léčbě bevacizumabem + IFN-α. U pacientů s nepříznivým rizikovým profilem podle MSKCC nebyl zaznamenán žádný benefit. U pacientů léčených pomocí bevacizumabu/IFN-α nebyl v této studii (umožňující změnu léčby v případě progrese) zaznamenán vyšší medián OS (23,3 vs. 21,3) [202].
Studie s podobným designem (CALGB 90206) [203,204] testující bevacizumab + IFN-α vs. IFN-α uvádí vyšší medián PFS u pacientů podstupujících kombinovanou léčbu. Rovněž míra objektivní léčebné odpovědi byla vyšší u pacientů podstupujících kombinovanou léčbu. Výskyt celkové toxicity byl závažnější při léčbě pomocí bevacizumabu + IFN-α se signifikantně častějším výskytem hypertenze 3. stupně, anorexie, únavy a proteinurie.
7.4.5 Inhibitory mTOR
7.4.5.1 Temsirolimus
Temsirolimus je specifický inhibitor mTOR [205]. Pacienti s metastazujícím RCC s modifikovaným vysokým rizikem podstoupili ve studii NCT00065468 léčbu první linie pomocí temsirolimu nebo IFN-α nebo kombinaci obou terapií [168]. Medián OS byl vyšší u pacientů léčených pomocí temsirolimu. Kombinace temsirolimu + IFN-α však nepřinesla oproti monoterapii IFN-α signifikantní benefit v OS [168]. Podávání IFN-α bylo spojeno s významnou toxicitou, částečně z důvodu aplikace vysoké dávky. Studie INTORSECT srovnává léčbu pomocí temsirolimu vs. sorafenibu u pacientů, u nichž selhala předchozí léčba sunitinibem. Ačkoli nebyl zaznamenán žádný benefit v PFS, léčba pomocí sorafenibu byla spojena se signifikantně lepší OS [206]. Na základě těchto výsledků nelze temsirolimus doporučit pro léčbu pacientů s onemocněním refrakterním na VEFG TKI.
7.4.5.2 Everolimus
Everolimus je perorální inhibitor mTOR, který je považován za obecně uznávanou léčebnou modalitu u pacientů s onemocněním refrakterním na léčbu cílenou na VEGF. Studie RECORD-1 srovnává everolimus + nejlepší podpůrnou péči (best supportive care – BSC) vs. placebo + BSC u pacientů, u nichž selhala anti-VEGFR léčba (nebo nesnesli cílenou terapii zaměřenou na VEGF) [207]. Předběžné výsledky prokazují medián PFS čtyři měsíce při léčbě everolimem a 1,9 měsíce při léčbě placebem [207]. Závěrečná analýza uvádí 4,9měsíční PFS (HR 0,33) [208]. V analýze podskupiny pacientů, kteří podstoupili pouze jednu linii léčby pomocí VEGF TKI, činila PFS 5,4 měsíce [209]. Tato skupina zahrnuje i pacienty, kteří léčbu nesnesli, ale nedošlo u nich k progresi (PFS rovněž činila 5,4 měsíce) [210]. Do studie RECORD-1 byli zařazeni pacienti, u nichž selhalo několik linií cílené terapie zaměřené na VEGF, kteří byli léčeni pomocí everolimu v rámci terapie třetí a čtvrté linie [207].
Randomizovaná studie fáze II RECORD-3 testující sekvenční terapii pomocí sunitinibu v rámci první linie a everolimu v rámci druhé linie vs. opačnou sekvenci everolimus v rámci první linie a sunitinib v rámci druhé linie při léčbě pacientů s metastazujícím RCC, kteří nepodstoupili žádnou předchozí léčbu, uvádí vyšší medián PFS u pacientů léčených pomocí sunitinibu v rámci první linie [211]. Primární výsledný parametr spočíval v hodnocení noninferiority v PFS při podávání everolimu v rámci první linie ve srovnání se sunitinibem v rámci první linie. Velký podíl pacientů, kteří měli podstoupit změnu léčby, následnou plánovanou terapii nepodstoupilo, v důsledku čehož je následná analýza složitá a nemá dostatečnou statistickou sílu.
7.4.6 Terapeutické strategie a doporučení
7.4.6.1 Léčba pacientů s metastazujícím ccRCC, kteří ještě nepodstoupili žádnou léčbu
Na základě výsledků klíčových studií byl sunitinib a bevacizumab + IFN-α doporučen jako modalita pro léčbu první linie u pacientů s metastazujícím ccRCC s příznivým až středně příznivým rizikovým skóre, kteří dosud nepodstoupili žádnou léčbu. Studie COMPARZ prokázala, že pazopanib a sunitinib vykazují srovnatelnou účinnost, ovšem rozdílný profil toxicity. Na základě výsledků této studie byl pazopanib doporučen jako další modalita pro léčbu první linie [193].
7.4.6.1.1 Sekvenční cílená terapie
7.4.6.1.1.1 Léčba po progresi onemocnění po jedné nebo více liniích cílené terapie zaměřené na VEGF
Několik studií hodnotí možnosti léčby u pacientů, u nichž došlo k progresi po cílené terapii zaměřené na VEGF v první linii, některé ze studií zahrnují i pacienty po jedné nebo více liniích cílené terapie zaměřené na VEGF. Studie RECORD-1 doporučuje u pacientů s metastazujícím RCC jako jednu z možností léčbu pomocí VEGF TKI do progrese onemocnění s následným podáváním everolimu [207]. Studie podobného designu však prokázala lepší výsledek při léčbě pomocí nivolumabu a cabozantinibu než pomocí everolimu [179]. Oba preparáty lze považovat za nový terapeutický standard při léčbě pacientů ve všech rizikových kategoriích, u nichž selhala jedna nebo více linií cílené léčby zaměřené na VEGF (schéma 1).
Vzhledem k významnému benefitu v OS (vs. everolimus) a dobré snášenlivosti se doporučuje zvážit léčbu nivolumabem u všech pacientů refrakterních na léčbu cílenou na VEGF, u nichž není kontraindikována. Cabozantinib je prvním TKI, u něhož byla prokázána lepší PFS než u everolimu. Trend benefitu v OS při léčbě cabozantinibem v interim analýze (HR 0,67; 95% CI 0,51–0,89; p = 0,005) dále podporuje jeho využití v tomto klinickém scénáři. Pokud finální analýza prokáže statisticky signifikantní benefit, budou pro tento preparát platit stejná doporučení jako pro nivolumab.
U pacientů s ccRCC refrakterním na sunitinib dosahuje léčba axitinibem lepší PFS než léčba sorafenibem [194]. Nivolumab ani cabozantinib nebyly přímo srovnávány s axitinibem v rámci léčby druhé linie. Vzhledem k benefitu v době OS a dobré snášenlivosti nivolumabu (vs. everolimus) v tomto klinickém scénáři se tato modalita zdá vhodnější než axitinib. Vynikající PFS při léčbě cabozantinibem, zejména u pacientů, u nichž selhala léčba sunitinibem, činí z tohoto přípravku lákavou alternativu axitinibu.
Profil snášenlivosti představuje důležitý faktor, pokud nelze stanovit doporučení pouze na základě samotné účinnosti léčby. Ostatní přípravky předčí při léčbě VEGF refrakterního onemocnění účinek everolimu i sorafenibu. Tyto agens tedy nelze považovat za standard při léčbě VEGF refrakterního onemocnění v případě, že jsou k dispozici lepší alternativy. V současné době není možné pro žádný z výše uvedených preparátů určit jeho postavení při léčbě na základě základních charakteristik nebo exprese biomarkerů.
Přímé srovnání dat ze studií RECORD-1, Checkmate-25 a METEOR s údaji AXIS nelze vzhledem k rozdílné populaci pacientů doporučit [195–197,207].
Studie INTORSECT srovnává temsirolimus vs. sorafenib u pacientů, u nichž došlo k progresi po léčbě sunitinibem [206]. U pacientů léčených pomocí temsirolimu byl zaznamenán (nesignifikantně) vyšší medián PFS. Dále byl zaznamenán signifikantní rozdíl v OS ve prospěch sorafenibu. Žádný z těchto preparátů nelze doporučit ani není běžně užíván v tomto klinickém scénáři. Tyto údaje však nejsou nutně relevantní pro ostatní inhibitory mTOR, jako např. everolimus.
Vzhledem k rozdílu v OS lze v současné době stanovit doporučení pro nejvhodnější sekvenci cílené léčby (schéma 1). Dvě zásadní studie testující nivolumab a cabozantinib změnily terapeutické paradigma při léčbě RCC refrakterního na léčbu cílenou na VEGF (LE: 1a). Existují pádné důkazy pro podporu sekvenčního podávání obou preparátů v rámci léčby druhé a třetí linie po cílené léčbě zaměřené na VEGF, díky čemuž byl vytvořen nový standard léčby pro většinu pacientů. Nivolumab byl v roce 2015 schválen pro tuto indikaci v USA. Zatím není známo, kdy budou tyto preparáty schváleny v dalších státech.
7.4.6.1.1.2 Léčba po progresi onemocnění po léčbě inhibitory mTOR
K dispozici jsou pouze omezené údaje zabývající se touto problematikou. S ohledem na účinnost cílené terapie zaměřené na VEGF při léčbě RCC se doporučuje přejít na tuto terapii (názor odborníků a [212]).
7.4.6.1.1.3 Léčba po progresi onemocnění po léčbě cytokiny
Studie prokazují následující medián PFS při léčbě pomocí těchto preparátů v této indikaci: 5,5 měsíce při léčbě sorafenibem, 12,1 měsíce při léčbě axitinibem a 7,4 měsíce při léčbě pazopanibem. Výsledky studií ukazují, že axitinib dosahuje při léčbě pacientů, kteří podstoupili předchozí léčbu cytokiny, lepších výsledků než sorafenib [195–197].
7.4.6.1.1.4 Léčba po cílené terapii druhé linie
7.4.6.1.1.4.1 Léčba po dvou liniích cílené terapie zaměřené na VEGF
Studie RECORD-1 prokazuje účinek léčby pomocí everolimu u pacientů, kteří podstoupili více než jednu linii cílené léčby. Celkem 26 % pacientů podstoupilo dvě nebo více linií cílené terapie zaměřené proti VEGF, léčba přinesla signifikantní benefit. Výsledky důležitých studií testujících nivolumab a cabozantinib podporují přednostní indikaci obou preparátů v rámci léčby třetí linie po selhání dvou linií cílené terapie zaměřené proti VEGF [201,179] (schéma 1).
Schéma 1. Doporučení pro pacienty s metastazujícím ccRCC, u nichž selhala jedna nebo více linií cílených terapií zaměřených na VEGF. 
ccRCC – světlobuněčný renální karcinom, VEGF – vaskulární endoteliální růstový faktor, OS – celková míra přežití 7.4.6.1.1.4.2 Léčba po inhibici VEGFR a mTOR
Ačkoli studie GOLD neprokázala větší účinek dovitinibu oproti sorafenibu při léčbě metastazujícího RCC u pacientů, u kterých došlo k progresi po předchozí terapii zaměřené na VEGF a mTOR, výsledky ukazují účinek a bezpečnost podávání sorafenibu v rámci terapie třetí linie [212]. Tato sekvence se nedoporučuje v případě, že je k dispozici jiná účinnější léčba.
7.4.6.1.1.5 Kombinace cílných preparátů
Řada studií testuje cílenou terapii zaměřenou na VEFG a inhibitory mTOR [213–217]. Všechny studie uvádějí negativní výsledky. V současné době nelze doporučit žádnou kombinaci cílených preparátů.
7.4.6.2 Nesvětlobuněčný RCC
Nebyly publikovány žádné studie fáze III s pacienty s nesvětlobuněčným RCC. Analýzy podskupin ze studií zahrnujících pacienty s RCC nasvědčují tomu, že u této populace pacientů vykazuje cílená terapie horší výsledky než u pacientů s ccRCC. U pacientů s nesvětlobuněčným RCC se cílená léčba zaměřuje na temsirolimus, everolimus, sorafenib a sunitinib [168,218–220].
Mezi nejčastější typy nesvětlobuněčných RCC patří papilární RCC typu 1 a papilární RCC jiného než 1. typu. Existují omezené údaje z jediné větve studie týkající se léčby pomocí sunitinibu a everolimu [220–223]. Studie zahrnující pacienty s oběma typy papilárního RCC, kteří podstoupili léčbu pomocí everolimu (RAPTOR) [223], uvádí medián PFS 3,7 měsíce v populaci „intention-to-treat“ s mediánem OS 21,0 měsíce.
Jiná studie testuje léčbu pomocí foretenibu (duální inhibitor MET/VEGFR2) při léčbě pacientů s papilárním RCC. U pacientů se zárodečnými mutacemi v MET byla zaznamenána přijatelná toxicita a vysoká míra léčebné odpovědi [224]. Randomizovaná studie fáze II testující everolimus vs. sunitinib (ESPN) se zkřížením u pacientů s nesvětlobuněčným metastazujícím RCC zahrnující 73 subjektů (27 s papilárním RCC) byla ukončena po analýze hodnotící PFS a OS [225]. Finální výsledky prezentované na výročním zasedání Americké společnosti pro klinickou onkologii v roce 2014 ukazují nesignifikantní trend ve prospěch sunitinibu (6,1 vs. 4,1 měsíce). Podle SR, který zahrnuje analýzu podskupin ze studií ESPN, RECORD-3 a další studie fáze II (ASPEN), představují sunitinib a everolimus možnost volby u této populace pacientů (preference pro sunitinib) [226,227]. Pacienti s metastazujícím nesvětlobuněčným RCC by měli být v případě možnosti zařazeni do klinické studie.
Karcinom ze sběrných kanálků je rezistentní na systémovou léčbu. Pro podporu konkrétní léčby u pacientů s tímto typem karcinomu nemáme k dispozici dostatek údajů. Pro podporu cílené léčby u pacientů s jinými histologickými podtypy jako např. chromofobní nádory jsou k dispozici omezené údaje (tab. 11) [168,218].
7.4.6.3 Souhrn důkazů a doporučení pro systémovou léčbu metastazujícího RCC
Souhrn důkazů a doporučení k části 7.4.6.3 
VEGF – vaskulární endoteliální růstový faktor, ccRCC – světlobuněčný renální karcinom, PFS – přežití bez progrese, OS – celková míra přežití, IFN-α – interferon alfa Tab. 11. Doporučení Evropské urologické asociace z roku 2015 založená na důkazech pro systémovou léčbu u pacientů s metastazujícím RCC . 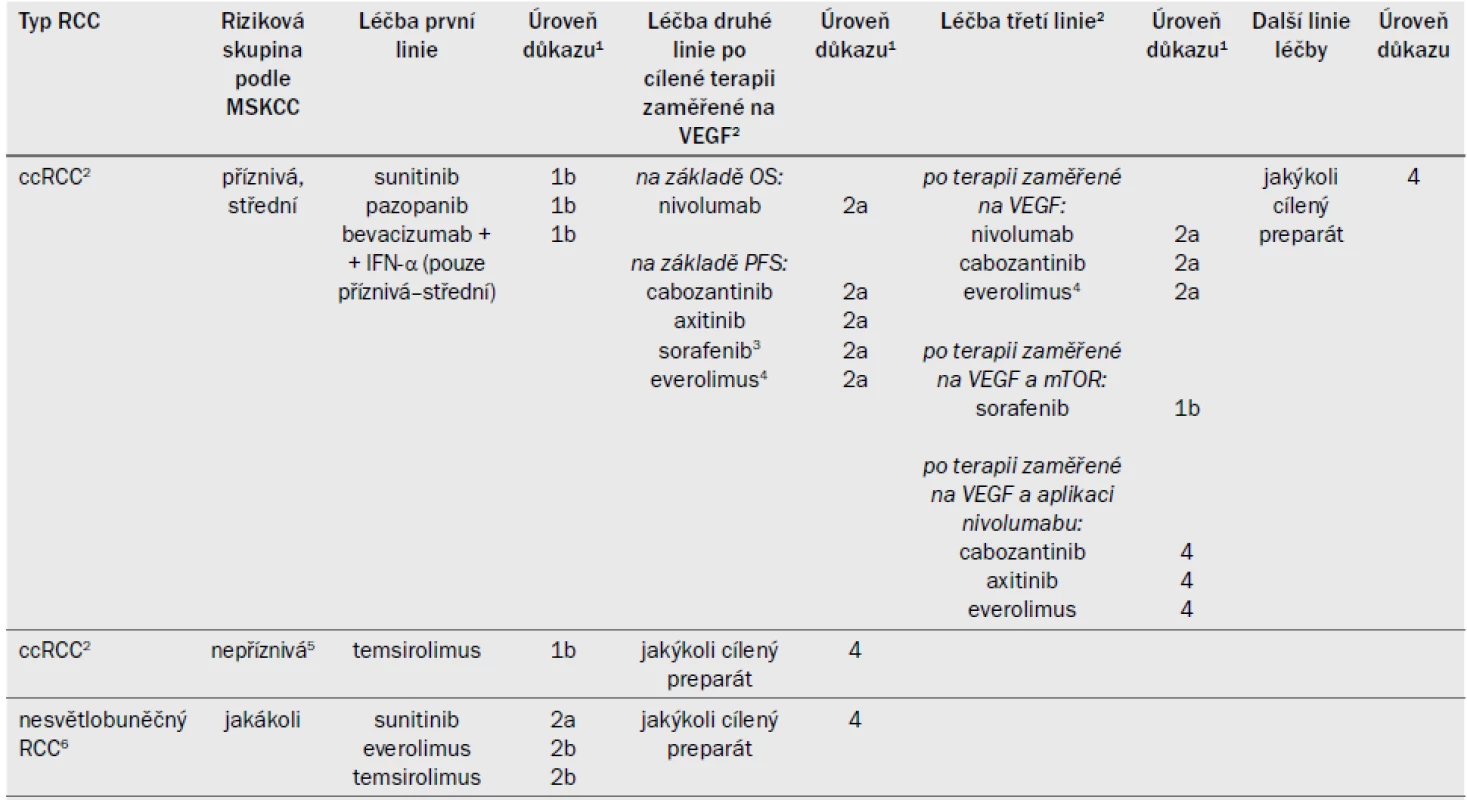
IFN-α – interferon alfa, MSKCC – Memorial Sloan-Kettering Cancer Center, RCC – renální karcinom, TKI – inhibitor tyrozinkinázy, PFS – přežití bez progrese, RCT – randomizovaná kontrolovaná studie, OS – celková míra přežití 1 V případě, že údaje pocházejí z analýzy podskupin v rámci RCT, byla úroveň důkazu snížena. 2 Dávkování: IFN-α 9 MU 3× týdně subkutánně; bevacizumab 10 mg/kg i.v. 1× za dva týdny; sunitinib 50 mg perorálně 1× denně po dobu čtyř týdnů, s dvoutýdenní pauzou (při kontinuálním podávání dávky 37,5 mg nebyl zaznamenán signifikantní rozdíl); temsirolimus 25 mg i.v. 1× týdně; pazopanib 800 mg perorálně 1× denně; axitinib 5 mg 2× denně, zvýšit na 7 mg 2× denně, dokud nedojde k výskytu toxicity > 2. stupně, zvýšení krevního tlaku nad 150/90 mm Hg nebo dokud pacient nezačne užívat medikaci na léčbu hypertenze; everolimus 10 mg perorálně 1× denně. 3 Sorafenib vykazoval v RCT horší výsledky než axitinib s ohledem na PFS, ale nikoli OS [197]. 4 S ohledem na OS vykazoval everolimus horší výsledek než nivolumab a horší výsledek než cabozantinib s ohledem na PFS; rutinní podávání tohoto preparátu se nedoporučuje, pokud je k dispozici lepší léčba. 5 Nepříznivá riziková kritéria ve studii NCT00065468 zahrnovala riziko podle MSKCC [162] a výskyt metastáz ve více orgánech. Důkazy pro volbu další léčby nejsou jednoznačné, což z této modality činí méně atraktivní volbu. 6 K dispozici není žádná standardní léčba; pacienti by měli být léčeni v rámci klinických studií, případně lze léčbu konzultovat s pacientem. 7.5 Recidivující RCC
7.5.1 Úvod
K lokální recidivě onemocnění může dojít po RN, PN i termální ablaci. Po NSS může být recidiva intrarenální a/nebo regionální, např. v podobě žilního nádorového trombu nebo metastáz do retroperitoneálních LN. Oba výskyty jsou často klasifikovány jako lokoregionální recidiva. Při léčbě nádorů ve stadiu pT1 se po PN uvádí 2,2% míra recidivy, kterou lze obvykle řešit operačně v závislosti na rozsahu lokoregionální recidivy [228]. Po léčbě pomocí tepelné ablace se uvádí až 12% míra lokoregionální recidivy (intrarenální i regionální) [229]. V případě intrarenální recidivy po tepelné ablaci se často doporučovala opakovaná ablace. V případě lokoregionální recidivy je nezbytná operační resekce, užívá se i při léčbě izolované lokální recidivy po nefrektomii.
Lokální recidiva po nefrektomii je definována jako onemocnění recidivující v lůžku ledviny nebo zbývající ledvině. Přítomnost metastáz v neodstraněné ipsilaterální nadledvině nebo LN však znesnadňuje interpretaci skutečné incidence izolované recidivy v lůžku ledviny. Léčba metastáz v nadledvinách nebo LN se často uvádí ve studiích, které se zabývají MTS (viz kapitola 7.3). Výskyt izolované lokální recidivy je však velmi ojedinělý.
Největší studie zabývající se léčbou izolované recidivy byla uveřejněna v roce 2009 [230]. Z celkem 2 945 pacientů, kteří podstoupili nefrektomii, autoři identifikovali 54 případů izolované lokální recidivy v lůžku ledviny. Skupina však zahrnovala i případy recidivy do ipsilaterální nadledviny a LN. Údaje z výhradně retrospektivní nekomparativní studie nasvědčují tomu, že agresivní lokální resekce poskytuje trvalou lokální kontrolu tumoru a zlepšuje dobu přežití. Nežádoucí prognostické faktory zahrnovaly pozitivní chirurgické okraje po resekci, velikost recidivujícího nádoru a sarkomatoidní histologické změny [230]. V případě, kdy není možná kompletní chirurgická resekce z důvodu pokročilého nádoru a bolesti, lze zvážit paliativní léčbu (např. ozařování).
7.5.2 Souhrn důkazů a doporučení pro léčbu pokročilého/metastazujícího RCC
Souhrn důkazů a doporučení k části 7.5.2 
7.6 Literatura
- MacLennan S, Imamura M, Lapitan MC et al. Systematic review of perioperative and quality-of-life outcomes following surgical management of localised renal cancer. Eur Urol 2012; 62(6): 1097–1117. doi: 10.1016/j.eururo.2012.07.028.
- MacLennan S, Imamura M, Lapitan MC et al. Systematic review of oncological outcomes following surgical management of localised renal cancer. Eur Urol 2012; 61(5): 972–993. doi: 10.1016/j.eururo.2012.02.039.
- Butler BP, Novick AC, Miller DP et al. Management of small unilateral renal cell carcinomas: radical versus nephronsparing surgery. Urology 1995; 45(1): 34–40.
- Gratzke C, Seitz M, Bayrle F et al. Quality of life and perioperative outcomes after retroperitoneoscopic radical nephrectomy (RN), open RN and nephron-sparing surgery in patients with renal cell carcinoma. BJU Int 2009; 104(4): 470–475. doi: 10.1111/j.1464-410X.2009.08439.x.
- D’Armiento M, Damiano R, Feleppa B et al. Elective conservative surgery for renal carcinoma versus radical nephrectomy: a prospective study. Br J Urol 1997; 79(1): 1519.
- Lee JH, You CH, Min GE et al. Comparison of the surgical outcome and renal function between radical and nephron-sparing surgery for renal cell carcinomas. Korean J Urol 2007; 48 : 671–676.
- Van Poppel H, Da Pozzo L, Albrecht W et al. A prospective, randomised EORTC intergroup phase 3 study comparing the oncologic outcome of elective nephron-sparing surgery and radical nephrectomy for low-stage renal cell carcinoma. Eur Urol 2011; 59(4): 543–552. doi: 10.1016/j.eururo.2010.12.013.
- Huang WC, Elkin EB, Levey AS et al. Partial nephrectomy versus radical nephrectomy in patients with small renal tumors-is there a difference in mortality and cardiovascular outcomes? J Urol 2009; 181(1): 55–61. doi: 10.1016/j.juro.2008.09.017.
- Zini L, Perrotte P, Capitanio U et al. Radical versus partial nephrectomy: effect on overall and noncancer mortality. Cancer 2009; 115 : 1465.
- Thompson RH, Boorjian SA, Lohse CM et al. Radical nephrectomy for pT1a renal masses may be associated with decreased overall survival compared with partial nephrectomy. J Urol 2008; 179(2): 468–471.
- Patard JJ, Bensalah KC, Pantuck AJ et al. Radical nephrectomy is not superior to nephron sparing surgery in PT1B-PT2N0M0 renal tumours: A matched comparison analysis in 546 cases. Eur Urol 2008; 7 (Suppl): 194.
- Jang HA, Kim JW, Byun SS et al. Oncologic and functional outcomes after partial nephrectomy versus radical nephrectomy in T1b renal cell carcinoma: a multicentre, matched case-control study in Korean patients. Cancer Res Treat 2016; 48(2): 612–620 doi: 10.4143/crt.2014.122.
- Thompson RH, Kaag M, Vickers A et al. Contemporary use of partial nephrectomy at a tertiary care center in the United States. J Urol 2009; 181(3): 993–997. doi: 10.1016/j.juro.2008.11.017.
- Dash A, Vickers AJ, Schachter LR et al. Comparison of outcomes in elective partial vs radical nephrectomy for clear cell renal cell carcinoma of 4-7 cm. BJU Int 2006; 97(5): 939–945.
- Weight CJ, Larson BT, Fergany AF et al. Nephrectomy induced chronic renal insufficiency is associated with increased risk of cardiovascular death and death from any cause in patients with localized cT1b renal masses. J Urol 2010; 183(4): 1317–1323. doi: 10.1016/j.juro.2009.12.030.
- Crépel M, Jeldres C, Perrotte P et al. Nephron--sparing surgery is equally effective to radical nephrectomy for T1BN0M0 renal cell carcinoma: a population-based assessment. Urology 2010; 75(2): 271–275. doi: 10.1016/j.urology.2009.04.098.
- Patard JJ, Shvarts O, Lam JS et al. Safety and efficacy of partial nephrectomy for all T1 tumors based on an international multicenter experience. J Urol 2004; 171 (6 Pt 1): 2181–2185.
- Antonelli A, Ficarra V, Bertini R et al. Elective partial nephrectomy is equivalent to radical nephrectomy in patients with clinical T1 renal cell carcinoma: results of a retrospective, comparative, multi-institutional study. BJU Int 2012; 109(7): 1013–118. doi: 10.1111/j.1464-410X.2011.10431.x.
- Iizuka J, Kondo T, Hashimoto Y et al. Similar functional outcomes after partial nephrectomy for clinical T1b and T1a renal cell carcinoma. Int J Urol 2012; 19(11): 980–986. doi: 10.1111/j.1442-2042.2012.03085.x.
- Badalato GM, Kates M, Wisnivesky JP et al. Survival after partial and radical nephrectomy for the treatment of stage T1bN0M0 renal cell carcinoma (RCC) in the USA: a propensity scoring approach. BJU Int 2012; 109(10): 1457–1462.
- Simmons MN, Weight CJ, Gill IS. Laparoscopic radical versus partial nephrectomy for tumors > 4 cm: intermediate-term oncologic and functional outcomes. Urology 2009; 73(5): 1077–1082. doi: 10.1016/j.urology.2008.11.059.
- Tan HJ, Norton EC, Ye Z et al. Long-term survival following partial vs radical nephrectomy among older patients with early-stage kidney cancer. JAMA 2012; 307(15): 1629–1635. doi: 10.1001/jama.2012.475.
- Poulakis V, Witzsch U, de Vries R et al. Quality of life after surgery for localized renal cell carcinoma: comparison between radical nephrectomy and nephron-sparing surgery. Urology 2003; 62(5): 814–820.
- Shekarriz B, Upadhyay J, Shekarriz H et al. Comparison of costs and complications of radical and partial nephrectomy for treatment of localized renal cell carcinoma. Urology 2002; 59(2): 211–215.
- Van Poppel H, Da Pozzo L, Albrecht W et al. A prospective randomized EORTC intergroup phase 3 study comparing the complications of elective nephron-sparing surgery and radical nephrectomy for low-stage renal cell carcinoma. Eur Urol 2007; 51(6): 1606–1615.
- Gabr AH, Gdor Y, Strope SA et al. Approach and specimen handling do not influence oncological perioperative and long-term outcomes after laparoscopic radical nephrectomy. J Urol 2009; 182(3): 874–880. doi: 10.1016/j.juro.2009.05.034.
- Imamura M, MacLennan S, Lapitan MC et al. Systematic review of the clinical effectiveness of surgical management for localised renal cell carcinoma. University of Aberdeen, Academic Urology Unit 2011. Aberdeen 2011. [online]. Available from: http://www.uroweb.org/?id=217&tyid=1&oid=4.
- Simmons MN, Chung BI, Gill IS. Perioperative efficacy of laparoscopic partial nephrectomy for tumors larger than 4 cm. Eur Urol 2009; 55(1): 199–207. doi: 10.1016/j.eururo.2008.07.039.
- Takaki H, Yamakado K, Soga N et al. Midterm results of radiofrequency ablation versus nephrectomy for T1a renal cell carcinoma. Jpn J Radiol 2010; 28(6): 460–468. doi: 10.1007/s11604-010-0451-z.
- Lane BR, Tiong HY, Campbell SC et al. Management of the adrenal gland during partial nephrectomy. J Urol 2009; 181(1): 2430–2346. doi: 10.1016/j.juro.2009.02.027.
- Bekema HJ, MacLennan S, Imamura M et al. Systematic review of adrenalectomy and lymph node dissection in locally advanced renal cell carcinoma. Eur Urol 2013; 64(5): 799–810. doi: 10.1016/j.eururo.2013.04.033.
- Blom JH, van Poppel H, Maréchal JM et al. Radical nephrectomy with and without lymph-node dissection: final results of European Organization for Research and Treatment of Cancer (EORTC) randomized phase 3 trial 30881. Eur Urol 2009; 55(1): 28–34. doi: 10.1016/j.eururo.2008.09.052.
- Capitanio U, Becker F, Blute ML et al. Lymph node dissection in renal cell carcinoma. Eur Urol 2011; 60(6): 1212–1220. doi: 10.1016/j.eururo.2011.09.003.
- Herrlinger A, Schrott KM, Schott G et al. What are the benefits of extended dissection of the regional renal lymph nodes in the therapy of renal cell carcinoma. J Urol 1991; 146(5): 1224–1227.
- Peters PC, Brown GL. The role of lymphadenectomy in the management of renal cell carcinoma. Urol Clin North Am 1980; 7(3): 705–709.
- Yamashita Y AA, Sakamoto K. The therapeutic value of lymph node dissection for renal cell carcinoma. Nishinihon J Urol 1989; 51 : 777–781.
- Sullivan LD, Westmore DD, McLoughlin MG et al. Surgical management of renal cell carcinoma at the Vancouver General Hospital: 20-year review. Can J Surg 1979; 22(5): 427–431.
- Siminovitch JP, Montie JE, Straffon RA et al. Lymphadenectomy in renal adenocarcinoma. J Urol 1982; 127(6): 1090–1091.
- Kim S, Thompson RH, Weight C et al. The relationship of lymph node dissection with recurrence and survival for patients treated with nephrectomy for high-risk renal cell carcinoma. [online]. Available from: https://www.auanet.org/university/abstract_detail.cfm?id=573&meetingID=12ATL.
- Chapin BF, Delacroix SE Jr, Wood CG et al. The role of lymph node dissection in renal cell carcinoma. Int J Clin Oncol 2011; 16(3): 186–194. doi: 10.1007/s10147-011-0241-3.
- Capitanio U, Abdollah F, Matloob R et al. When to perform lymph node dissection in patients with renal cell carcinoma: a novel approach to the preoperative assessment of risk of lymph node invasion at surgery and of lymph node progression during follow-up. BJU Int 2013; 112(2): E59–E66. doi: 10.1111/bju.12125.
- Kwon T, Song C, Hong JH et al. Reassessment of renal cell carcinoma lymph node staging: analysis of patterns of progression. Urology 2011; 77(2): 373–378. doi: 10.1016/j.urology.2010.06.015.
- Bex A, Vermeeren L, Meinhardt W et al. Intraoperative sentinel node identification and sampling in clinically node-negative renal cell carcinoma: initial experience in 20 patients. World J Urol 2011; 29(6): 793–799. doi: 10.1007/s00345-010-0615-6.
- Sherif AM, Eriksson E, Thörn M et al. Sentinel node detection in renal cell carcinoma. A feasibility study for detection of tumour-draining lymph nodes. BJU Int 2012; 109(8): 1134–1139. doi: 10.1111/j.1464-410X.2011.10444.x.
- Dimashkieh HH, Lohse CM, Blute ML et al. Extranodal extension in regional lymph nodes is associated with outcome in patients with renal cell carcinoma. J Urol 2006; 176(5): 1978–1982.
- Terrone C, Cracco C, Porpiglia F et al. Reassessing the current TNM lymph node staging for renal cell carcinoma. Eur Urol 2006; 49(2): 324–331.
- Hutterer GC, Patard JJ, Perrotte P et al. Patients with renal cell carcinoma nodal metastases can be accurately identified: external validation of a new nomogram. Int J Cancer 2007; 121(11): 2556–2561.
- May M, Brookman-Amissah S, Pflanz S et al. Pre-operative renal arterial embolisation does not provide survival benefit in patients with radical nephrectomy for renal cell carcinoma. Br J Radiol 2009; 82(981): 724–731. doi: 10.1259/bjr/17514226.
- Subramanian VS, Stephenson AJ, Goldfarb DA et al. Utility of preoperative renal artery embolization for management of renal tumors with inferior vena caval thrombi. Urology 2009; 74(1): 154–159. doi: 10.1016/j.urology.2008.12.084.
- Maxwell NJ, Saleem Amer N, Rogers E et al. Renal artery embolisation in the palliative treatment of renal carcinoma. Br J Radiol 2007; 80(950): 96–102.
- Hallscheidt P, Besharati S, Noeldge G et al. Preoperative and palliative embolization of renal cell carcinomas: follow-up of 49 patients. Rofo 2006; 178(4): 391–399.
- Lamb GW, Bromwich EJ, Vasey P et al. Management of renal masses in patients medically unsuitable for nephrectomy – natural history, complications, and outcome. Urology 2004; 64(5): 909–913.
- Hemal AK, Kumar A, Kumar R et al. Laparoscopic versus open radical nephrectomy for large renal tumors: a longterm prospective comparison. J Urol 2007; 177(3): 862–866.
- Brewer K, O‘Malley RL, Hayn M et al. Perioperative and renal function outcomes of minimally invasive partial nephrectomy for T1b and T2a kidney tumors. J Endourol 2012; 26(3): 244–248. doi: 10.1089/end.2011.0384.
- Sprenkle PC, Power N, Ghoneim T et al. Comparison of open and minimally invasive partial nephrectomy for renal tumors 4-7 centimeters. Eur Urol 2012; 61(3): 593–599. doi: 10.1016/j.eururo.2011.11.040
- Peng B, Zheng J-H, Xu D-F et al. Retroperitoneal laparoscopic nephrectomy and open nephrectomy for radical treatment of renal cell carcinoma: A comparison of clinical outcomes. Acad J of Second Mil Med Univ 2006; 27 : 1167–1169.
- Ebbing J, Wiebach T, Kempkensteffen C et al. Evaluation of perioperative complications in open and laparoscopic surgery for renal cell cancer with tumor thrombus involvement using the Clavien-Dindo classification. Eur J Surg Oncol 2015; 41(7): 941–952. doi: 10.1016/j.ejso.2015.02.009.
- Laird A, Choy KC, Delaney H et al. Matched pair analysis of laparoscopic versus open radical nephrectomy for the treatment of T3 renal cell carcinoma. World J Urol 2015; 33(1): 25–32. doi: 10.1007/s00345-014-1280-y.
- Steinberg AP, Finelli A, Desai MM et al. Laparoscopic radical nephrectomy for large (greater than 7 cm, T2) renal tumors. J Urol 2004; 172 (6 Pt 1): 2172–2176.
- Jeon SH, Kwon TG, Rha KH et al. Comparison of laparoscopic versus open radical nephrectomy for large renal tumors: a retrospective analysis of multi-center results. BJU Int 2011; 107(5): 817–224. doi: 10.1111/j.1464-410X.2010.09688.x.
- Hattori R, Osamu K, Yoshino Y et al. Laparoscopic radical nephrectomy for large renal-cell carcinomas. J Endourol 2009; 23(9): 1523–1526. doi: 10.1089/end.2009.0393.
- Desai MM, Strzempkowski B, Matin SF et al. Prospective randomized comparison of transperitoneal versus retroperitoneal laparoscopic radical nephrectomy. J Urol 2005; 173(1): 38–41.
- Nambirajan T, Jeschke S, Al-Zahrani H et al. Prospective, randomized controlled study: transperitoneal laparoscopic versus retroperitoneoscopic radical nephrectomy. Urology 2004; 64(5): 919–924.
- Nadler RB, Loeb S, Clemens JQ et al. A prospective study of laparoscopic radical nephrectomy for T1 tumors – is transperitoneal, retroperitoneal or hand assisted the best approach? J Urol 2006; 175(4): 1230–1233.
- Hemal AK, Kumar A. A prospective comparison of laparoscopic and robotic radical nephrectomy for T1-2N0M0 renal cell carcinoma. World J Urol 2009; 27(1): 89–94. doi: 10.1007/s00345-008-0321-9.
- Soga N, Kato M, Masui S et al. Comparison of radical nephrectomy techniques in one center: minimal incision portless endoscopic surgery versus laparoscopic surgery. Int J Urol 2008; 15(11): 1018–1021. doi: 10.1111/j.1442-2042.2008.02157.x.
- Park Y, Kim KT, Ko K et al. Laparoendoscopic single-site radical nephrectomy for localized renal cell carcinoma: comparison with conventional laparoscopic surgery. J Endourol 2009; 23 (Suppl): A19.
- Gill IS, Kavoussi LR, Lane BR et al. Comparison of 1,800 laparoscopic and open partial nephrectomies for single renal tumors. J Urol 2007; 178(1): 41–46.
- Lane BR, Gill IS. 7-year oncological outcomes after laparoscopic and open partial nephrectomy. J Urol 2010; 183(2): 473–479. doi: 10.1016/j.juro.2009.10.023.
- Gong EM, Orvieto MA, Zorn KC et al. Comparison of laparoscopic and open partial nephrectomy in clinical T1a renal tumors. J Endourol 2008; 22(5): 953–957. doi: 10.1089/end.2007.0300.
- Marszalek M, Meixl H, Polajnar M et al. Laparoscopic and open partial nephrectomy: a matched-pair comparison of 200 patients. Eur Urol 2009; 55(5): 1171–1178. doi: 10.1016/j.eururo.2009.01.042.
- Kaneko G, Miyajima A, Kikuchi E et al. The benefit of laparoscopic partial nephrectomy in high body mass index patients. Jpn J Clin Oncol 2012; 42(7): 619–624. doi: 10.1093/jjco/hys061.
- Muramaki M, Miyake H, Sakai I et al. Prognostic factors influencing postoperative development of chronic kidney disease in patients with small renal tumors who underwent partial nephrectomy. Curr Urol 2013; 6(3): 129–135. doi: 10.1159/000343526.
- Tugcu V, Bitkin A, Sonmezay E et al. Transperitoneal versus retroperitoneal laparoscopic partial nephrectomy: initial experience. Arch Ital Urol Androl 2011; 83(4): 175–180.
- Minervini A, Serni S, Tuccio A et al. Simple enucleation versus radical nephrectomy in the treatment of pT1a and pT1b renal cell carcinoma. Ann Surg Oncol 2012; 19(2): 694–700. doi: 10.1245/s10434-011-2003-x.
- Minervini A, Ficarra V, Rocco F et al. Simple enucleation is equivalent to traditional partial nephrectomy for renal cell carcinoma: results of a nonrandomized, retrospective, comparative study. J Urol 2011; 185(5): 1604–1610. doi: 10.1016/j.juro.2010.12.048.
- Rais-Bahrami S, George AK, Herati AS et al. Off-clamp versus complete hilar control laparoscopic partial nephrectomy: comparison by clinical stage. BJU Int 2012; 109(9): 1376–1381. doi: 10.1111/j.1464-410X.2011.10592.x.
- Bazzi WM, Stroup SP, Kopp RP et al. Comparison of laparoendoscopic single-site and multiport laparoscopic radical and partial nephrectomy: a prospective, nonrandomized study. Urology 2012; 80(5): 1039–1045. doi: 10.1016/j.urology.2012.07.018.
- Masson-Lecomte A, Yates DR, Hupertan V et al. A prospective comparison of the pathologic and surgical outcomes obtained after elective treatment of renal cell carcinoma by open or robot-assisted partial nephrectomy. Urol Oncol 2013; 31(6): 924–929. doi: 10.1016/j.urolonc.2011.08.004.
- Choi JE, You JH, Kim DK et al. Comparison of perioperative outcomes between robotic and laparoscopic partial nephrectomy: a systematic review and meta-analysis. Eur Urol 2015; 67(5): 891–901. doi: 10.1016/j.eururo.2014.12.028.
- Zini L, Perrotte P, Jeldres C et al. A population-based comparison of survival after nephrectomy vs nonsurgical management for small renal masses. BJU Int 2009; 103(7): 899–904. doi: 10.1111/j.1464-410X.2008.08247.x.
- Sun M, Bianchi M, Trinh QD et al. Comparison of partial vs radical nephrectomy with regard to other-cause mortality in T1 renal cell carcinoma among patients aged >/=75 years with multiple comorbidities. BJU Int 2013; 111(1): 67–73. doi: 10.1111/j.1464-410X.2012.11254.x.
- Sun M, Trinh VQ, Becker A et al. Management of localized kidney cancer: calculating cancer-specific mortality and compteing-risks of death tradeoffs between surgery and active surveillance. J Urol 2013; 189(4): 672. Abstract 1634.
- Huang WC, Pinheiro LC, Lowrance WT et al. Surveillance for the management of small renal masses: outcomes in a population-based cohort. J Urol 2013; 189 (Suppl 4): e483.
- Hyams ES, Pierorazio PM, Mullins JP et al. Partial nephrectomy vs. non-surgical management for small renal massess: a population-based comparison of disease-specific and overall survival. J Urol 2012; 187 (Suppl 4): e678. doi: 10.1016/j.juro.2012.02.1552.
- Lane BR, Abouassaly R, Gao T et al. Active treatment of localized renal tumors may not impact overall survival in patients aged 75 years or older. Cancer 2010; 116(13): 3119–3126. doi: 10.1002/cncr.25184.
- Hollingsworth JM, Miller DC, Daignault S et al. Five-year survival after surgical treatment for kidney cancer: a populationbased competing risk analysis. Cancer 2007; 109(9): 1763–1768.
- Volpe A, Panzarella T, Rendon RA et al. The natural history of incidentally detected small renal masses. Cancer 2004; 100(4): 738–745.
- Jewett MA, Mattar K, Basiuk Jet al. Active surveillance of small renal masses: progression patterns of early stage kidney cancer. Eur Urol 2011; 60(1): 39–44. doi: 10.1016/j.eururo.2011.03.030
- Smaldone MC, Kutikov A, Egleston BL et al. Small renal masses progressing to metastases under active surveillance: a systematic review and pooled analysis. Cancer 2012; 118(4): 997–1006. doi: 10.1002/cncr.26369.
- Patel N, Cranston D, Akhtar MZ et al. Active surveillance of small renal masses offers short-term oncological efficacy equivalent to radical and partial nephrectomy. BJU Int 2012; 110(9): 1270–1275. doi: 10.1111/j.1464-410X.2012.11130.x.
- Pierorazio PM, Johnson MH, Ball MW et al. Five--year analysis of a multi-institutional prospective clinical trial of delayed intervention and surveillance for small renal masses: the DISSRM registry. Eur Urol 2015; 68(3): 408–415. doi: 10.1016/j.eururo.2015.02.001.
- Abou Youssif T, Kassouf W, Steinberg J et al. Active surveillance for selected patients with renal masses: updated results with long-term follow-up. Cancer 2007; 110(5): 1010–1014.
- Abouassaly R, Lane BR, Novick AC. Active surveillance of renal masses in elderly patients. J Urol 2008; 180(2): 505–508. doi: 10.1016/j.juro.2008.04.033.
- Crispen PL, Viterbo R, Boorjian SA et al. Natural history, growth kinetics, and outcomes of untreated clinically localized renal tumors under active surveillance. Cancer 2009; 115(13): 2844–2452. doi: 10.1002/cncr.24338.
- Rosales JC, Haramis G, Moreno J et al. Active surveillance for renal cortical neoplasms. J Urol 2010; 183(5): 1698–1702. doi: 10.1016/j.juro.2010.01.024.
- Pierorazio P, McKiernan J, Allaf M et al. Quality of life on active surveillance for small masses versus immediate intervention: interim analysis of the DISSRM (delayed intervention and surveillance for small renal masses) registry. J Urol 2013; 189 (Suppl 3): e259. doi: 10.1016/j.juro.2013.02.185.
- Sisul DM, Liss MA, Palazzi KL et al. Renal nephrometry score is associated with complications after renal cryoablation: a multicenter analysis. Urology 2013; 81(4): 775–780. doi: 10.1016/j.urology.2012.11.037.
- Kim EH, Tanagho YS, Bhayani SB et al. Outcomes of laparoscopic and percutaneous cryoablation for renal masses. J Urol 2013; 189 (Suppl 4) : e492.
- Goyal J, Verma P, Sidana A et al. Single-center comparative oncologic outcomes of surgical and percutaneous cryoablation for treatment of renal tumors. J Endourol 2012; 26(11): 1413–1419. doi: 10.1089/end.2012.0244.
- O‘Malley RL, Berger AD, Kanofsky JA et al. A matched-cohort comparison of laparoscopic cryoablation and laparoscopic partial nephrectomy for treating renal masses. BJU Int 2007; 99(2): 395–398.
- Ko YH, Park HS, Moon du G et al. A matched-cohort comparison of laparoscopic renal cryoablation using ultra-thin cryoprobes with open partial nephrectomy for the treatment of small renal cell carcinoma. Cancer Res Treat 2008; 40(4): 184–189. doi: 10.4143/crt.2008.40.4.184.
- Desai MM, Aron M, Gill IS et al. Laparoscopic partial nephrectomy versus laparoscopic cryoablation for the small renal tumor. Urology 2005; 66 (Suppl 5): 23–28.
- Haber GP, Lee MC, Crouzet S et al. Tumour in solitary kidney: laparoscopic partial nephrectomy vs laparoscopic cryoablation. BJU Int 2012; 109(1): 118–124. doi: 10.1111/j.1464-410X.2011.10287.x.
- Guillotreau J, Haber GP, Autorino R et al. Robotic partial nephrectomy versus laparoscopic cryoablation for the small renal mass. Eur Urol 2012; 61(5): 899–904. doi: 10.1016/j.eururo.2012.01.007.
- Klatte T, Mauermann J, Heinz-Peer G et al. Perioperative, oncologic, and functional outcomes of laparoscopic renal cryoablation and open partial nephrectomy: a matched pair analysis. J Endourol 2011; 25(6): 991–997. doi: 10.1089/end.2010.0615.
- Whitson JM, Harris CR, Meng MV. Population-based comparative effectiveness of nephron-sparing surgery vs ablation for small renal masses. BJU Int 2012; 110(10): 1438–1443. doi: 10.1111/j.1464-410X.2012.11113.x.
- Lian H, Guo H, Zhang G et al. Single-center comparison of complications in laparoscopic and percutaneous radiofrequency ablation with ultrasound guidance for renal tumors. Urology 2012; 80(1): 119–124. doi: 10.1016/j.urology.2012.01.085.
- Young EE, Castle SM, Gorbatiy V et al. Comparison of safety, renal function outcomes and efficacy of laparoscopic and percutaneous radio frequency ablation of renal masses. J Urol 2012; 187(4): 1177–1182. doi: 10.1016/j.juro.2011.11.099.
- Kim SD, Yoon SG, Sung GT et al. Radiofrequency ablation of renal tumors: four-year follow-up results in 47 patients. Korean J Radiol 2012; 13(5): 625–633. doi: 10.3348/kjr.2012.13.5.625.
- Olweny EO, Park SK, Tan YK et al. Radiofrequency ablation versus partial nephrectomy in patients with solitary clinical T1a renal cell carcinoma: comparable oncologic outcomes at a minimum of 5 years of follow-up. Eur Urol 2012; 61(6): 1156–1161. doi: 10.1016/j.eururo.2012.01.001.
- Arnoux V, Descotes JL, Sengel C et al. Perioperative outcomes and mid-term results of radiofrequency ablation and partial nephrectomy in indications of renal tumor treatment and imperative nephron-sparing procedure. Prog Urol 2013; 23(2): 99–104. doi: 10.1016/j.purol.2012.08.269.
- Atwell TD, Schmit GD, Boorjian SA et al. Percutaneous ablation of renal masses measuring 3.0 cm and smaller: comparative local control and complications after radiofrequency ablation and cryoablation. AJR Am J Roentgenol 2013; 200(2): 461–466. doi: 10.2214/AJR.12.8618.
- Samarasekera D, Khalifeh A, Autorino R et al. Percutaneous radiofrequency ablation versus percutaneous cryoablation: long-term outcomes following ablation for renal cell carcinoma. J Urol 2013; 189 (Suppl 4): e737–e738.
- Tsui KH, Schvarts O, Smith RB et al. Prognostic indicators for renal cell carcinoma: a multivariate analysis of 643 patients using the revised 1997 TNM staging criteria. J Urol 2000; 163(4): 1090–1095.
- Nesbitt JC, Soltero ER, Dinney CP et al. Surgical management of renal cell carcinoma with inferior vena cava tumor thrombus. Ann Thorac Surg 1997; 63(6): 1592–1600.
- Hatcher PA, Anderson EE, Paulson DF et al. Surgical management and prognosis of renal cell carcinoma invading the vena cava. J Urol 1991; 145(1): 20–23.
- Neves RJ, Zincke H. Surgical treatment of renal cancer with vena cava extension. Br J Urol 1987; 59(5): 390–395.
- Haferkamp A, Bastian PJ, Jakobi H et al. Renal cell carcinoma with tumor thrombus extension into the vena cava: prospective long-term followup. J Urol 2007; 177(5): 1703–1708.
- Kirkali Z, Van Poppel H. A critical analysis of surgery for kidney cancer with vena cava invasion. Eur Urol 2007; 52(3): 658–662.
- Moinzadeh A, Libertino JA. Prognostic significance of tumor thrombus level in patients with renal cell carcinoma and venous tumor thrombus extension. Is all T3b the same? J Urol 2004; 171 (2 Pt 1): 598–601.
- Kaplan S, Ekici S, Dog~an R et al. Surgical management of renal cell carcinoma with inferior vena cava tumor thrombus. Am J Surg 2002; 183(3): 292–299.
- Bissada NK, Yakout HH, Babanouri A et al. Long-term experience with management of renal cell carcinoma involving the inferior vena cava. Urology 2003; 61(1): 89–92.
- Skinner DG, Pritchett TR, Lieskovsky G et al. Vena caval involvement by renal cell carcinoma. Surgical resection provides meaningful long-term survival. Ann Surg 1989; 210(3): 387–932.
- Lardas M, Stewart F, Scrimgeour D et al. Systematic review of surgical management of nonmetastatic renal cell carcinoma with vena caval thrombus. Eur Urol 2015; S0302-2838(15)01205-1. doi: 10.1016/j.eururo.2015.11.034.
- Ljungberg B et al. Systematic Review Methodology for the European Association of Urology Guidelines for Renal Cell Carcinoma (2014 update). [online]. Available from: http://uroweb.org/guidelines/.
- Wotkowicz C, Libertino JA, Sorcini A et al. Management of renal cell carcinoma with vena cava and atrial thrombus: minimal access vs median sternotomy with circulatory arrest. BJU Int 2006; 98(2): 289–297.
- Faust W, Ruthazer R, Topjian L et al. Minimal access versus median sternotomy for cardiopulmonary bypass in the management of renal cell carcinoma with vena caval and atrial involvement. J Urol 2013; 189 (Suppl): e255.
- Chan AA, Abel J, Carrasco A et al. Impact of preoperative renal artery embolization on surgical outcomes and overall survival in patients with renal cell carcinoma and inferior vena cava thrombus. J Urol 2011; 185 (Suppl): e707–e708. Abstract 1764.
- Orihashi K, Sueda T, Usui T et al. Deep hypothermic circulatory arrest for resection of renal tumor in the inferior vena cava: beneficial or deleterious? Circ J 2008; 72(7): 1175–1177.
- Galligioni E, Quaia M, Merlo A et al. Adjuvant immunotherapy treatment of renal carcinoma patients with autologous tumor cells and bacillus Calmette-Guerin: five-year results of a prospective randomized study. Cancer 1996; 77(12): 2560–2566.
- Figlin RA, Thompson JA, Bukowski RM et al. Multicenter, randomized, phase III trial of CD8(+) tumor-infiltrating lymphocytes in combination with recombinant interleukin-2 in metastatic renal cell carcinoma. J Clin Oncol 1999; 17(8): 2521–2529.
- Clark JI, Atkins MB, Urba WJ et al. Adjuvant high-dose bolus interleukin-2 for patients with high-risk renal cell carcinoma: a cytokine working group randomized trial. J Clin Oncol 2003; 21(16): 3133–3140.
- Atzpodien J, Schmitt E, Gertenbach U et al. Adjuvant treatment with interleukin-2 - and interferon-alpha2a-based chemoimmunotherapy in renal cell carcinoma post tumour nephrectomy: results of a prospectively randomised trial of the German Cooperative Renal Carcinoma Chemoimmunotherapy Group (DGCIN). Br J Cancer 2005; 92(5): 843–846.
- Jocham D, Richter A, Hoffmann L et al. Adjuvant autologous renal tumour cell vaccine and risk of tumour progression in patients with renal-cell carcinoma after radical nephrectomy: phase III, randomised controlled trial. Lancet 2004; 363(9409): 594–599.
- Wood C, Srivastava P, Bukowski R et al. An adjuvant autologous therapeutic vaccine (HSPPC-96; vitespen) versus observation alone for patients at high risk of recurrence after nephrectomy for renal cell carcinoma: a multicentre, open-label, randomised phase III trial. Lancet 2008; 372(9633): 145–154. doi: 10.1016/S0140-6736(08)60697-2.
- Chamie K, Klöpfer P, Bevan P et al. Carbonic anhydrase-IX score is a novel biomarker that predicts recurrence and survival for high-risk, nonmetastatic renal cell carcinoma: Data from the phase III ARISER clinical trial. Urol Oncol 2015; 33(5): 204.e25–e33. doi: 10.1016/j.urolonc.2015.02.013.
- Haas NB, Manola J, Uzzo RG et al. Initial results from ASSURE (E2805): Adjuvant sorafenib or sunitinib for unfavorable renal carcinoma, an ECOG-ACRIN-led, NCTN phase III trial. J Clin Oncol 2015; 33 (Suppl 7). Abstract 403.
- Flanigan RC, Mickisch G, Sylvester R et al. Cytoreductive nephrectomy in patients with metastatic renal cancer: a combined analysis. J Urol 2004; 171(3): 1071–1076.
- Dabestani S, Marconi L, Hofmann F et al. Local treatments for metastases of renal cell carcinoma: a systematic review. Lancet Oncol 2014; 15(12): e549–e561. doi: 10.1016/S1470-2045(14)70235-9.
- Dabestani S, Hofmann F, Marconi L et al. EAU renal cell carcinoma guideline panel. Systematic review methodology for the EAU RCC Guideline 2013 update 2013. [online] Available from: http://uroweb.org/guidelines/.
- Alt AL, Boorjian SA, Lohse CM et al. Survival after complete surgical resection of multiple metastases from renal cell carcinoma. Cancer 2011; 117(13): 2873–2882. doi: 10.1002/cncr.25836.
- Brinkmann OA, Semik M, Gosherger G et al. The role of residual tumor resection in patients with metastatic renal cell carcinoma and partial remission following immunotherapy. Eur Urol 2007; 6 : 641–645.
- Kwak C, Park YH, Jeong CW et al. Metastasectomy without systemic therapy in metastatic renal cell carcinoma: comparison with conservative treatment. Urol Int 2007; 79(2): 145–151.
- Lee SE, Kwak C, Byun SS et al. Metastatectomy prior to immunochemotherapy for metastatic renal cell carcinoma. Urol Int 2006; 76(3): 256–263.
- Petralia G, Roscigno M, Zigeuner R et al. Complete metastasectomy is an independent predictor of cancer-specific survival in patients with clinically metastatic renal cell carcinoma. Eur Urol Suppl 2010; 9 : 162.
- Russo P, Synder M, Vickers A et al. Cytoreductive nephrectomy and nephrectomy/complete metastasectomy for metastatic renal cancer. Scientific World Journal 2007; 7 : 768–778.
- Staehler M, Kruse J, Haseke N et al. Metastasectomy significantly prolongs survival in patients with metastatic renal cancer. Eur Urol Suppl 2009; 8 : 181.
- Eggener SE, Yossepowitch O, Kundu S et al. Risk score and metastasectomy independently impact prognosis of patients with recurrent renal cell carcinoma. J Urol 2008; 180(3): 873–878. doi: 10.1016/j.juro.2008.05.006.
- Fuchs B, Trousdale RT, Rock MG. Solitary bony metastasis from renal cell carcinoma: significance of surgical treatment. Clin Orthop Relat Res 2005; 431 : 187–192.
- Hunter GK, Balagamwala EH, Koyfman SA et al. The efficacy of external beam radiotherapy and stereotactic body radiotherapy for painful spinal metastases from renal cell carcinoma. Pract Radiat Oncol 2012; 2(4): e95–e100. doi: 10.1016/j.prro.2012.01.005.
- Zelefsky MJ, Greco C, Motzer R et al. Tumor control outcomes after hypofractionated and single-dose stereotactic image-guided intensity-modulated radiotherapy for extracranial metastases from renal cell carcinoma. Int J Radiat Oncol Biol Phys 2012; 82(5): 1744–1748. doi: 10.1016/j.ijrobp.2011.02.040.
- Fokas E, Henzel M, Hamm K et al. Radiotherapy for brain metastases from renal cell cancer: should whole-brain radiotherapy be added to stereotactic radiosurgery?: analysis of 88 patients. Strahlenther Onkol 2010; 186(4): 210–217. doi: 10.1007/s00066-010-2055-z.
- Ikushima H, Tokuuye K, Sumi M et al. Fractionated stereotactic radiotherapy of brain metastases from renal cell carcinoma. Int J Radiat Oncol Biol Phys 2000; 48(5): 1389–1993.
- Staehler MD, Kruse J, Haseke N et al. Liver resection for metastatic disease prolongs survival in renal cell carcinoma: 12-year results from a retrospective comparative analysis. World J Urol 2010; 28(4): 543–547. doi: 10.1007/s00345-010-0560-4.
- Amiraliev A, Pikin O, Alekseev B et al. Treatment strategy in patients with pulmonary metastases of renal cell cancer. Int Cardio Thor Surgery 2012; 15 (Suppl): S20.
- Zerbi A, Ortolano E, Balzano G et al. Pancreatic metastasis from renal cell carcinoma: which patients benefit from surgical resection? Ann Surg Oncol 2008; 15(4): 1161–1168. doi: 10.1245/s10434-007-9782-0.
- Kickuth R, Waldherr C, Hoppe H et al. Interventional management of hypervascular osseous metastasis: role of embolotherapy before orthopedic tumor resection and bone stabilization. AJR Am J Roentgenol 2008; 191(6): W240–W247. doi: 10.2214/AJR.07.4037.
- Forauer AR, Kent E, Cwikiel W et al. Selective palliative transcatheter embolization of bony metastases from renal cell carcinoma. Acta Oncol 2007; 46(7): 1012–1118.
- Stadler WM, Huo D, George C et al. Prognostic factors for survival with gemcitabine plus 5-fluorouracil based regimens for metastatic renal cancer. J Urol 2003; 170 (4 Pt 1): 1141–1145.
- Gore ME, Griffin CL, Hancock B et al. Interferon alfa-2a versus combination therapy with interferon alfa-2a, interleukin-2, and fluorouracil in patients with untreated metastatic renal cell carcinoma (MRC RE04/EORTC GU 30012): an open-label randomised trial. Lancet 2010; 375(9715): 641–648. doi: 10.1016/S0140-6736(09)61921-8.
- Interferon-alpha and survival in metastatic renal carcinoma: early results of a randomised controlled trial. Medical Research Council Renal Cancer Collaborators. Lancet 1999; 353(9146): 14–17.
- Motzer RJ, Bacik J, Murphy BA et al. Interferon--alfa as a comparative treatment for clinical trials of new therapies against advanced renal cell carcinoma. J Clin Oncol 2002; 20(1): 289–296.
- Coppin C, Porzsolt F, Awa A et al. Immunotherapy for advanced renal cell cancer. Cochrane Database Syst Rev 2005; 1: CD001425.
- Negrier S, Perol D, Ravaud A et al. Medroxyprogesterone, interferon alfa-2a, interleukin 2, or combination of both cytokines in patients with metastatic renal carcinoma of intermediate prognosis: results of a randomized controlled trial. Cancer 2007; 110(11): 2468–2477.
- Escudier B, Pluzanska A, Koralewski P et al. Bevacizumab plus interferon alfa-2a for treatment of metastatic renal cell carcinoma: a randomised, double-blind phase III trial. Lancet 2007; 370(9605): 2103–2111.
- Motzer RJ, Hutson TE, Tomczak P et al. Sunitinib versus interferon alfa in metastatic renal-cell carcinoma. N Engl J Med 2007; 356(2): 115–124.
- Hudes G, Carducci M, Tomczak P et al. Temsirolimus, interferon alfa, or both for advanced renal-cell carcinoma. N Engl J Med 2007; 356(22): 2271–2281.
- Rosenberg SA, Lotze MT, Yang JC et al. Prospective randomized trial of high-dose interleukin-2 alone or in conjunction with lymphokine-activated killer cells for the treatment of patients with advanced cancer. J Natl Cancer Inst 1993; 85(8): 622–632.
- Fyfe G, Fisher RI, Rosenberg SA et al. Results of treatment of 255 patients with metastatic renal cell carcinoma who received high-dose recombinant interleukin-2 therapy. J Clin Oncol 1995; 13(3): 688–696.
- McDermott DF, Regan MM, Clark JI et al. Randomized phase III trial of high-dose interleukin-2 versus subcutaneous interleukin-2 and interferon in patients with metastatic renal cell carcinoma. J Clin Oncol 2005; 23(1): 133–141.
- Yang JC, Sherry RM, Steinberg SM et al. Randomized study of high-dose and low-dose interleukin-2 in patients with metastatic renal cancer. J Clin Oncol 2003; 21(16): 3127–3132.
- Amato RJ, Hawkins RE, Kaufman HL et al. Vaccination of metastatic renal cancer patients with MVA-5T4: a randomized, double-blind, placebo-controlled phase III study. Clin Cancer Res 2010; 16(22): 5539–5547. doi: 10.1158/1078-0432.CCR-10-2082.
- Brahmer JR, Tykodi SS, Chow LQ et al. Safety and activity of anti-PD-L1 antibody in patients with advanced cancer. N Engl J Med 2012; 366(26): 2455–2465. doi: 10.1056/NEJMoa1200694.
- Ribas A. Tumor immunotherapy directed at PD-1. N Engl J Med 2012; 366(26): 2517–2519. doi: 10.1056/NEJMe1205943.
- Motzer RJ, Rini BI, McDermott DF et al. Nivolumab for metastatic renal cell carcinoma: results of a randomized phase ii trial. J Clin Oncol 2015; 33(13): 1430–1437. doi: 10.1200/JCO.2014.59.0703.
- Isbarn H, Karakiewicz PI. Predicting cancer-control outcomes in patients with renal cell carcinoma. Curr Opin Urol 2009; 19(3): 247–257. doi: 10.1097/MOU.0b013e32832a0814.
- Motzer RJ, Escudier B, McDermott DF et al. Nivolumab versus Everolimus in Advanced Renal Cell Carcinoma. N Engl J Med 2015; 373(19): 1803–1813. doi: 10.1056/NEJMoa1510665.
- Nivolumab combined with ipilimumab versus sunitinib in previously untreated advanced or metastatic renal cell carcinoma (CheckMate 214). 2015. [online]. Available from: https://clinicaltrials.gov/ct2/show/NCT02231749.
- Study of nivolumab (BMS-936558) vs. everolimus in pre-treated advanced or metastatic clear-cell renal cell carcinoma (CheckMate 025). 2015. [online]. Available from: https://clinicaltrials.gov/ct2/show/NCT01668784.
- Patel PH, Chadalavada RS, Chaganti RS et al. Targeting von Hippel-Lindau pathway in renal cell carcinoma. Clin Cancer Res 2006; 12(24): 7215–7220.
- Yang JC, Haworth L, Sherry RM et al. A randomized trial of bevacizumab, an anti-vascular endothelial growth factor antibody, for metastatic renal cancer. N Engl J Med 2003; 349(5): 427–434.
- Patard JJ, Rioux-Leclercq N, Fergelot P. Understanding the importance of smart drugs in renal cell carcinoma. Eur Urol 2006; 49(4): 633–643.
- Heng DY, Xie W, Regan MM et al. Prognostic factors for overall survival in patients with metastatic renal cell carcinoma treated with vascular endothelial growth factor-targeted agents: results from a large, multicenter study. J Clin Oncol 2009; 27(34): 5794–5799.
- Harshman LC, Xie W, Bjarnason GA et al. Conditional survival of patients with metastatic renal-cell carcinoma treated with VEGF-targeted therapy: a population-based study. Lancet Oncol 2012; 13(9): 927–935. doi: 10.1016/S1470-2045(12)70285-1.
- Heng DY, Xie W, Regan MM et al. External validation and comparison with other models of the International Metastatic Renal-Cell Carcinoma Database Consortium prognostic model: a population-based study. Lancet Oncol 2013; 14(2): 141–148. doi: 10.1016/S1470-2045(12)70559-4.
- Escudier B, Eisen T, Stadler WM et al. Sorafenib in advanced clear-cell renal-cell carcinoma. N Engl J Med 2007; 356(2): 125–134.
- Bellmunt J, Négrier S, Escudier B et al. The medical treatment of metastatic renal cell cancer in the elderly: position paper of a SIOG Taskforce. Crit Rev Oncol Hematol 2009; 69(1): 64–72. doi: 10.1016/j.critrevonc.2008.08.002.
- Motzer RJ, Michaelson MD, Redman BG et al. Activity of SU11248, a multitargeted inhibitor of vascular endothelial growth factor receptor and platelet-derived growth factor receptor, in patients with metastatic renal cell carcinoma. J Clin Oncol 2006; 24(1): 16–24.
- Figlin RA, Hutson TE, Tomczac P et al. Overall survival with sunitinib versus interferon alfa as first-line treatment in metastatic renal-cell carcinoma. ASCO Annual Meeting Proceedings 2008. J Clin Oncol 2008; 26 (Suppl). Abstract 5024.
- Motzer RJ, Hutson TE, Olsen MR et al. Randomized phase II trial of sunitinib on an intermittent versus continuous dosing schedule as first-line therapy for advanced renal cell carcinoma. J Clin Oncol 2012; 30(12): 1371–1377. doi: 10.1200/JCO.2011.36.4133.
- Sternberg CN, Davis ID, Mardiak J et al. Pazopanib in locally advanced or metastatic renal cell carcinoma: results of a randomized phase III trial. J Clin Oncol 2010; 28(6): 1061–1068. doi: 10.1200/JCO.2009.23.9764.
- Motzer RJ, Hutson TE, Cella D et al. Pazopanib versus sunitinib in metastatic renal-cell carcinoma. N Engl J Med 2013; 369(8): 722–731. doi: 10.1056/NEJMoa1303989.
- Escudier BJ, Porta C, Bono P et al. Patient preference between pazopanib (Paz) and sunitinib (Sun): Results of a randomized double-blind, placebo-controlled, cross-over study in patients with metastatic renal cell carcinoma (mRCC)—PISCES study, NCT 01064310. J Clin Oncol 2012; 30. Abstract 4502.
- Rini BI, Escudier B, Tomczak P et al. Comparative effectiveness of axitinib versus sorafenib in advanced renal cell carcinoma (AXIS): a randomised phase 3 trial. Lancet 2011; 378(9807): 1931–1939. doi: 10.1016/S0140-6736(11)61613-9.
- Dror Michaelson M, Rini BI, Escudier BJ et al. Phase III AXIS trial of axitinib versus sorafenib in metastatic renal cell carcinoma: Updated results among cytokine-treated patients. J Clin Oncol 2012; J Clin Oncol 2012; 30: (Suppl). Abstract 4546.
- Motzer RJ, Escudier B, Tomczak P et al. Axitinib versus sorafenib as second-line treatment for advanced renal cell carcinoma: overall survival analysis and updated results from a randomised phase 3 trial. Lancet Oncol 2013; 14(6): 552–562. doi: 10.1016/S1470-2045(13)70093-7.
- Rini BI, Melichar B, Ueda T et al. Axitinib with or without dose titration for first-line metastatic renal-cell carcinoma: a randomised double-blind phase 2 trial. Lancet Oncol 2013; 14(12): 1233–1242. doi: 10.1016/S1470-2045(13)70464-9.
- Hutson TE, Lesovoy V, Al-Shukri S et al. Axitinib versus sorafenib as first-line therapy in patients with metastatic renal-cell carcinoma: a randomised open-label phase 3 trial. Lancet Oncol 2013; 14(13): 1287–1294. doi: 10.1016/S1470-2045(13)70465-0.
- Choueiri TK, Pal SK, McDermott DF et al. A phase I study of cabozantinib (XL184) in patients with renal cell cancer. Ann Oncol 2014; 25(8): 1603–1608. doi: 10.1093/annonc/mdu184.
- Choueiri TK, Escudier B, Powles T et al. Cabozantinib versus everolimus in advanced renal-cell carcinoma. N Engl J Med 2015; 373(19): 1814–1823. doi: 10.1056/NEJMoa1510016.
- Escudier B, Bellmunt J, Négrier S et al. Phase III trial of bevacizumab plus interferon alfa-2a in patients with metastatic renal cell carcinoma (AVOREN): final analysis of overall survival. J Clin Oncol 2010; 28(13): 2144–2450. doi: 10.1200/JCO.2009.26.7849.
- Rini BI, Halabi S, Rosenberg JE et al. Phase III trial of bevacizumab plus interferon alfa versus interferon alfa monotherapy in patients with metastatic renal cell carcinoma: final results of CALGB 90206. J Clin Oncol 2010; 28(13): 2137–2143. doi: 10.1200/JCO.2009.26.5561.
- Rini BI, Halabi S, Rosenberg JE et al. Bevacizumab plus interferon alfa compared with interferon alfa monotherapy in patients with metastatic renal cell carcinoma: CALGB 90206. J Clin Oncol 2008; 26(33): 5422–5428. doi: 10.1200/JCO.2008.16.9847.
- Larkin JM, Eisen T. Kinase inhibitors in the treatment of renal cell carcinoma. Crit Rev Oncol Hematol 2006; 60(3): 216–226.
- Hutson TE, Escudier B, Esteban E et al. Randomized phase III trial of temsirolimus versus sorafenib as second-line therapy after sunitinib in patients with metastatic renal cell carcinoma. J Clin Oncol 2014; 32(8): 760–767. doi: 10.1200/JCO.2013.50.3961.
- Motzer RJ, Escudier B, Oudard S et al. Efficacy of everolimus in advanced renal cell carcinoma: a double-blind, randomised, placebo-controlled phase III trial. Lancet 2008; 372(9637): 449–456. doi: 10.1016/S0140-6736(08)61039-9.
- Motzer RJ, Escudier B, Oudard S et al. Phase 3 trial of everolimus for metastatic renal cell carcinoma: final results and analysis of prognostic factors. Cancer 2010; 116(18): 4256–4265. doi: 10.1002/cncr.25219.
- Calvo E, Escudier B, Motzer RJ et al. Everolimus in metastatic renal cell carcinoma: Subgroup analysis of patients with 1 or 2 previous vascular endothelial growth factor receptor-tyrosine kinase inhibitor therapies enrolled in the phase III RECORD-1 study. Eur J Cancer 2012; 48(3): 333–339. doi: 10.1016/j.ejca.2011.11.027.
- Bracarda S, Hutson TE, Porta C et al. Everolimus in metastatic renal cell carcinoma patients intolerant to previous VEGFr-TKI therapy: a RECORD-1 subgroup analysis. Br J Cancer 2012; 106(9): 1475–1480. doi: 10.1038/bjc.2012.89.
- Motzer RJ, Barrios CH, Kim TM et al. Record-3: Phase II randomized trial comparing sequential first-line everolimus (EVE) and second-line sunitinib (SUN) versus first-line SUN and second-line EVE in patients with metastatic renal cell carcinoma (mRCC). J Clin Oncol 2013; 31 (Suppl 15). Abstract 4504.
- Motzer R, Szcylik C, Vogelzang NJ et al. Phase 3 trial of dovitinib vs sorafenib in patients with metastatic renal cell carcinoma after 1 prior VEGF pathway–targeted and 1 prior mTOR inhibitor therapy. Eur J Cancer 2013; 49. Abstract 34.
- Bukowski RM, Kabbinavar FF, Figlin RA et al. Randomized phase II study of erlotinib combined with bevacizumab compared with bevacizumab alone in metastatic renal cell cancer. J Clin Oncol 2007; 25(29): 4536–4541.
- Négrier S, Gravis G, Pérol D et al. Temsirolimus and bevacizumab, or sunitinib, or interferon alfa and bevacizumab for patients with advanced renal cell carcinoma (TORAVA): a randomised phase 2 trial. Lancet Oncol 2011; 12(7): 673–680. doi: 10.1016/S1470-2045(11)70124-3.
- McDermott DF, Manola J, Pins M et al. The BEST trial (E2804): A randomized phase II study of VEGF, RAF kinase, and mTOR combination targeted therapy (CTT) with bevacizumab (bev), sorafenib (sor), and temsirolimus (tem) in advanced renal cell carcinoma (RCC). J Clin Oncol 2013; 31 (Suppl 6). Abstract 345.
- Rini BI, Bellmunt J, Clancy J et al. Randomized phase III trial of temsirolimus and bevacizumab versus interferon alfa and bevacizumab in metastatic renal cell carcinoma: INTORACT trial. J Clin Oncol 2014; 32 : 752.
- Ravaud A, Barrios C, Anak O et al. Randomized phase II study of first-line everolimus (EVE) + bevacizumab (BEV) versus interferon alfa-2A (IFN) + BEV in patients (pts) with metastatic renal cell carcinoma (MRCC): RECORD-2, in The Annual Meeting of the European Society for Medical Oncology 2012; Vienna: ESMO 2012.
- Gore ME, Szczylik C, Porta C et al. Safety and efficacy of sunitinib for metastatic renal-cell carcinoma: an expanded access trial. Lancet Oncol 2009; 10(8): 757–763.
- Sánchez P, Calvo E, Durán I. Non-clear cell advanced kidney cancer: is there a gold standard? Anticancer Drugs 2011; 22 (Suppl 1): S9–S14. doi: 10.1097/01.cad.0000390767.85658.83.
- Koh Y, Lim HY, Ahn JH et al. Phase II trial of everolimus for the treatment of nonclear-cell renal cell carcinoma. Ann Oncol 2013; 24(4): 1026–1031. doi: 10.1093/annonc/mds582.
- Tannir NM, Plimack E, Ng C et al. A phase 2 trial of sunitinib in patients with advanced non-clear cell renal cell carcinoma. Eur Urol 2012; 62(6): 1013–1019. doi: 10.1016/j.eururo.2012.06.043.
- Ravaud A, Oudard S, Gravis-Mescam G et al. First-line sunitinib in type I and II papillary renal cell carcinoma (PRCC): SUPAP, a phase II study of the French Genito-Urinary Group (GETUG) and the Group of Early Phase trials (GEP). J Clin Oncol 2009; 27 (Suppl 15). Abstact 5146.
- Escudier BJ, Bracarda S, Maroto JP et al. Open-label phase II trial of first-line everolimus monotherapy in patients with papillary metastatic renal cell carcinoma: RAPTOR final analysis. Eur J Cancer; 49 (Suppl 2): 49.
- Choueiri TK, Vaishampayan U, Rosenberg JE et al. Phase II and biomarker study of the dual MET/VEGFR2 inhibitor foretinib in patients with papillary renal cell carcinoma. J Clin Oncol 2013; 31(2): 181–186. doi: 10.1200/JCO.2012.43.3383.
- Tannir NM, Jonasch E, Altinmakas E et al. Everolimus versus sunitinib prospective evaluation in metastatic non-clear cell renal cell carcinoma (The ESPN Trial): A multicenter randomized phase 2 trial. J Clin Oncol 2014; 32 (Suppl): 5. Abstract 4505.
- Motzer RJ, Barrios CH, Kim TM et al. Phase II randomized trial comparing sequential first-line everolimus and secondline sunitinib versus first-line sunitinib and second-line everolimus in patients with metastatic renal cell carcinoma. J Clin Oncol 2014; 32(25): 2765–2772. doi: 10.1200/JCO.2013.54.6911.
- Armstrong AJ, Broderick S, Eisen T et al. Final clinical results of a randomized phase II international trial of everolimus vs. sunitinib in patients with metastatic non-clear cell renal cell carcinoma (ASPEN). J Clin Oncol 2015; 33 (Suppl): Abstract 4507.
- Kreshover JE, Richstone L, Kavoussi LR. Renal cell recurrence for T1 tumors after laparoscopic partial nephrectomy. J Endourol 2013; 27(12): 1468–1470. doi: 10.1089/end.2013.0197.
- Wah TM, Irving HC, Gregory W et al. Radiofrequency ablation (RFA) of renal cell carcinoma (RCC): experience in 200 tumours. BJU Int 2014; 113(3): 416–428. doi: 10.1111/bju.12349.
- Margulis V, McDonald M, Tamboli P et al. Predictors of oncological outcome after resection of locally recurrent renal cell carcinoma. J Urol 2009; 181(5): 2044–2051. doi: 10.1016/j.juro.2009.01.043.
8. SLEDOVÁNÍ PO RN, PN NEBO ABLATIVNÍ LÉČBĚ RCC
8.1 Úvod
Díky sledování pacienta po léčbě RCC může urolog monitorovat nebo detekovat následující parametry:
- pooperační komplikace,
- funkci ledviny,
- lokální recidivu,
- recidivu onemocnění v kontralaterální ledvině,
- vznik metastáz.
S ohledem na monitorovací protokol po léčbě RCC nebylo dosaženo konsenzu a neexistují žádné důkazy o tom, že by časná vs. pozdější diagnostika recidivujícího onemocnění zlepšovala dobu přežití. Sledování pacienta je však důležité pro zajištění více informací o RCC. Z tohoto důvodu by měl urolog monitorovat, za jak dlouho dojde ke vzniku recidivy nebo metastáz. Renální funkce je hodnocena na základě měření hladiny kreatininu v séru a eGFR. Dlouhodobé monitorování eGFR je indikováno v případě, že před výkonem nebo po něm dojde k narušení funkce ledviny. U pacientů s nádory T1 a T2 lze funkci ledviny [1,2] i dobu přežití (nesouvisející s karcinomem) [3–5] podpořit indikací NSS [6] (LE: 3). Po PN dochází ke vzniku recidivy pouze ojediněle, časná diagnostika je užitečná, protože nejefektivnější léčba je operační [7,8]. K recidivě v kontralaterální ledvině dochází rovněž ve výjimečných případech, v tomto případě může souviset s pozitivními chirurgickými okraji, multifokální povahou nádoru a jeho grade [9] (LE: 3). Díky sledování pacienta lze lokální recidivu nebo vznik metastáz odhalit v časném stadiu. Rozsáhlá invaze metastazujícího onemocnění může limitovat možnost chirurgické resekce, která se považuje za standardní přístup u pacientů s resekovatelnými a ideálně solitárními lézemi. Časná diagnostika recidivujícího onemocnění může navíc zvýšit účinnost systémové léčby (v případě nádoru o malém objemu).
8.2 Jaká vyšetření indikovat u individuálních pacientů a kdy?
Neexistují žádné důkazy vyšší úrovně, které by podporovaly konkrétní monitorovací protokol. Intenzivní provádění radiologického vyšetření u všech pacientů však není nezbytné. U pacientů s nádory T1a nízkého grade má operační léčba téměř vždy vynikající výsledek. Při sledování je tedy vhodné zohlednit riziko vzniku recidivy nebo metastáz. Ačkoli nemáme k dispozici žádné randomizované studie, několik velkých studií zkoumá prognostické faktory v rámci dlouhodobého sledování [10–12] (LE: 4):
- Radiologické a ultrazvukové vyšetření hrudníku vykazuje nízkou senzitivitu při detekci malých metastáz. Při indikaci těchto zobrazovacích modalit v rámci sledování je nutné vést v patrnosti jejich limitace [13]. U pacientů s nádory s nízkým rizikem je nutné při stanovení intervalu mezi kontrolními vyšetřeními zohlednit expozici ozáření a benefit vyšetření. Abychom omezili riziko expozice ozáření, lze užít MR.
- U pacientů se středně vysokým nebo vysokým rizikem recidivy se doporučuje provedení CT hrudníku a břicha. Je však nutné zohlednit signifikantní morbiditu související s vystavením pacientů ozáření při opakovaném CT skenu [14].
- Monitorovací protokol by měl zahrnovat rovněž hodnocení renální funkce a kardiovaskulárních rizikových faktorů.
- Pozitronová emisní tomografie (PET), PET-CT ani kostní scintigrafie se v rámci sledování pacientů po léčbě RCC vzhledem k nízké senzitivitě i specificitě nedoporučují.
S ohledem na optimální délku sledování existují kontroverzní názory. Někteří autoři se domnívají, že déle než pět let po výkonu není indikace zobrazovacích vyšetření ekonomicky výhodná, pozdní metastázy jsou však častěji solitární a zasluhují agresivnější kurativní léčbu. Nádory v kontralaterální ledvině, pokud jsou detekovány časně, lze navíc léčit pomocí NSS. Při léčbě nádorů o velikosti < 4 cm nebyl s ohledem na vznik recidivy během sledování prokázán žádný rozdíl mezi PN a RN [15] (LE: 3).
Různí autoři [16–19] vytvořili bodovací škály a nomogramy, které umožňují kvantifikovat pravděpodobnost vzniku recidivy, metastáz a následného úmrtí pacienta. Jednotlivé systémy byly vzájemně srovnávány a validovány [20] (LE: 2). Na základě prognostických parametrů byly navrženy různé monitorovací protokoly zohledňující stadium nádoru [21,22], tyto se však nevztahují na ablativní léčbu. Jeden z pooperačních nomogramů umožňuje odhadnout pravděpodobnost, že po pěti letech po výkonu nedojde k recidivě [23]. V nedávné době byl uveřejněn a validován předoperační prognostický model zohledňující parametry jako věk, symptomy a TNM stadium [24] (LE: 3). Pro monitorování pacientů, kteří podstoupili léčbu RCC, je však třeba vyvinout algoritmus, který bude kromě rizikového profilu zohledňovat rovněž účinnost absolvované léčby (tab. 12). Tyto prognostické systémy by umožnily přizpůsobit monitorovací program předpokládanému riziku recidivy.
Tab. 12. Doporučovaný monitorovací protokol po léčbě RCC zohledňující rizikový profil pacienta a účinnost léčby. 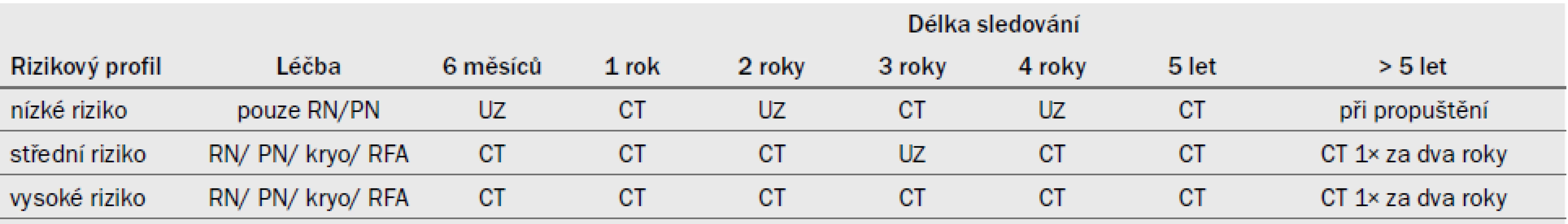
kryo – kryoterapie, CT – počítačová tomografie hrudníku a břicha, MR – zobrazovací vyšetření magnetickou rezonancí, PN – parciální resekce ledviny, RFA – radiofrekvenční ablace, RN – radikální nefrektomie, UZ – ultrazvukové vyšetření břicha, ledvin a ledvinného lůžka, RCC – renální karcinom 8.3 Souhrn důkazů a doporučení při sledování pacientů s RCC po RN, PN nebo ablativní léčbě
Souhrn důkazů a doporučení k části 8.3 
NSS – nefron šetřící operace, RCC – renální karcinom, CT – počítačová tomografie, MR – zobrazovací vyšetření magnetickou rezonancí, UISS – University of California Los Angeles integrated staging system 8.4 Priority pro další výzkum
Další výzkum je nutné zaměřit na otázku, zda monitorovací program může vést ke zlepšení doby přežití, nebo nikoli. Dále je nutné zajistit nové informace o tom, kdy má opakované vyšetření největší šanci na detekci recidivy.
Rovněž je nutné se zaměřit na prognostické markery v době operace, na základě kterých by bylo možné určit riziko recidivy onemocnění v budoucnosti.
8.5 Literatura
- Pettus JA, Jang TL, Thompson RH et al. Effect of baseline glomerular filtration rate on survival in patients undergoing partial or radical nephrectomy for renal cortical tumors. Mayo Clin Proc 2008; 83(10): 1101–1106. doi: 10.4065/83.10.1101.
- Snow DC, Bhayani SB. Rapid communication: chronic renal insufficiency after laparoscopic partial nephrectomy and radical nephrectomy for pathologic t1a lesions. J Endourol 2008; 22(2): 337–341. doi: 10.1089/end.2007.0240.
- Huang WC, Elkin EB, Levey AS et al. Partial nephrectomy versus radical nephrectomy in patients with small renal tumors-is there a difference in mortality and cardiovascular outcomes? J Urol 2009; 181(1): 55–61. doi: 10.1016/j.juro.2008.09.017.
- Zini L, Perotte P, Capitanio U et al. Radical versus partial nephrectomy: effect on overall and noncancer mortality. Cancer 2009; 115 (7): 1465–1471.
- Thompson RH, Boorjian SA, Lohse CM et al. Radical nephrectomy for pT1a renal masses may be associated with decreased overall survival compared with partial nephrectomy. J Urol 2008; 179(2): 468–471.
- Jeldres C, Patard JJ, Capitano U et al. Partial versus radical nephrectomy in patients with adverse clinical or pathologic characteristics. Urology 2009; 73(6): 1300–1305.
- Bruno JJ, Snyder ME, Motzer RJ. 2nd et al. Renal cell carcinoma local recurrences: impact of surgical treatment and concomitant metastasis on survival. BJU Int 2006; 97(5): 933–938.
- Sandhu SS, Symes A, A’Hern R et al. Surgical excision of isolated renal-bed recurrence after radical nephrectomy for renal cell carcinoma. BJU Int 2005; 95(4): 522–525.
- Bani-Hani AH, Leibovich BC, Lohse CM et al. Associations with contralateral recurrence following nephrectomy for renal cell carcinoma using a cohort of 2,352 patients. J Urol 2005; 17(2): 391–394.
- Capitanio U, Cloutier V, Zini L et al. A critical assessment of the prognostic value of clear cell, papillary and chromophobe histological subtypes in renal cell carcinoma: a population-based study. BJU Int 2009; 103(11): 1496–1500. doi: 10.1111/j.1464-410X.2008.08259.x.
- Lam JS, Shvarts O, Leppert JT et al. Renal cell carcinoma 2005: new frontiers in staging, prognostication and targeted molecular therapy. J Urol 2005; 173(6): 1853–1862.
- Scoll BJ, Wong YN, Egleston BL et al. Age, tumor size and relative survival of patients with localized renal cell carcinoma: a surveillance, epidemiology and end results analysis. J Urol 2009; 181(2): 506–511.
- Doornweerd BH, de Jong IJ, Bergman LM et al. Chest X-ray in the follow-up of renal cell carcinoma. World J Urol 2014; 32(4): 1015–1019. doi: 10.1007/s00345-013-1176-2.
- Legislation gov. uk. The ionising Radiation (Medical Exposures) Regulations 2000. [online]. Available from: http://www.legislation.gov.uk/uksi/2000/1059/contents/made.
- Patard JJ, Shvarts O, Lam JS et al. Safety and efficacy of partial nephrectomy for all T1 tumors based on an international multicenter experience. J Urol 2004; 171 (6 Pt 1): 2181–2185.
- Leibovich BC, Blute ML, Cheville JC et al. Prediction of progression after radical nephrectomy for patients with clear cell renal cell carcinoma: a stratification tool for prospective clinical trials. Cancer 2003; 97(7): 1663–1671.
- Karakiewicz PI, Briganti A, Chun FK et al. Multi-institutional validation of a new renal cancer-specific survival nomogram. J Clin Oncol 2007; 25(11): 1316–1322.
- Kattan MW, Reuter V, Motzer RJ et al. A postoperative prognostic nomogram for renal cell carcinoma. J Urol 2001; 166(1): 63–67.
- Lam JS, Shvarts O, Leppert JT et al. Postoperative surveillance protocol for patients with localized and locally advanced renal cell carcinoma based on a validated prognostic nomogram and risk group stratification system. J Urol 2005; 174(2): 466–472.
- Cindolo L, Patard JJ, Chiodini P et al. Comparison of predictive accuracy of four prognostic models for nonmetastatic renal cell carcinoma after nephrectomy: a multicenter European study. Cancer 2005; 104(7): 1362–1371.
- Skolarikos A, Alivizatos G, Laguna P et al. A review on follow-up strategies for renal cell carcinoma after nephrectomy. Eur Urol 2007; 51(6): 1490–1500.
- Chin AI, Lam JS, Figlin RA et al. Surveillance strategies for renal cell carcinoma patients following nephrectomy. Rev Urol 2006; 8(1): 1–7.
- Sorbellini M, Kattan MW, Snyder ME et al. A postoperative prognostic nomogram predicting recurrence for patients with conventional clear cell renal cell carcinoma. J Urol 2005; 173(1): 48–51.
- Karakiewicz PI, Suardi N, Capitanio U et al. A preoperative prognostic model for patients treated with nephrectomy for renal cell carcinoma. Eur Urol 2009; 55(2): 287–295. doi: 10.1016/j.eururo.2008.07.037.
- Raj GV, Thompson RH, Leibovich BC et al. Preoperative nomogram predicting 12-year probability of metastatic renal cancer. J Urol 2008; 179(6): 2146–2151. doi: 10.1016/j.juro.2008.01.101.
Štítky
Detská urológia Urológia
Článek Editorial
Článok vyšiel v časopiseUrologické listy
Najčítanejšie tento týždeň
2016 Číslo 1- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- Dopplerovské ultrazvukové vyšetření cévního řečiště penisu v klinické praxi – základní principy pro urology
- Karcinom penisu a operace šetřící tkáň penisu – současné trendy
- Divertikl močové trubice u žen – obtížná diagnostika a komplikovaná operační léčba
- Využití robotické technologie při rekonstrukci pánevního dna u žen
- Editorial
- Karcinom močového měchýře a kouření – přehledový článek
- Léčba středně těžkých až těžkých jímacích a mikčních symptomů spojených s benigní hyperplazií prostaty
- Guidelines pro léčbu renálního karcinomu
- Parciální resekce ledviny – aktuální přehled indikací, rizik a novinky v operačním přístupu
- Tvorba kostní tkáně v tumorech ledvin – objasnění záhady
- Urologické listy
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Divertikl močové trubice u žen – obtížná diagnostika a komplikovaná operační léčba
- Dopplerovské ultrazvukové vyšetření cévního řečiště penisu v klinické praxi – základní principy pro urology
- Guidelines pro léčbu renálního karcinomu
- Karcinom penisu a operace šetřící tkáň penisu – současné trendy
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




