-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Vliv dlouhodobé substituční terapie růstovým hormonem na tělesné složení, kostní tkáň a některé metabolické parametry u dospělých osob s deficitem růstového hormonu
Autoři: V. Olšovská 1; H. Šiprová 1; M. Beránek 2; V. Soška 3
Působiště autorů: II. interní klinika Lékařské fakulty MU a FN u sv. Anny, Brno, přednosta doc. MUDr. Miroslav Souček, CSc. 1; Ústav patologické fyziologie Lékařské fakulty MU, Brno, přednosta prof. MUDr. Anna Vašků, CSc. 2; Oddělení klinického komplementu FN u sv. Anny, Brno, přednosta doc. MUDr. Vladimír Soška, CSc. 3
Vyšlo v časopise: Vnitř Lék 2005; 51(12): 1356-1364
Kategorie: Původní práce
Souhrn
Syndrom deficitu růstového hormonu u dospělých (GHDA) je syndrom charakterizovaný metabolickými odchylkami, abnormitami tělesného složení, únavností, sníženou kvalitou života a některými kardiovaskulárními změnami. Cílem práce bylo posouzení vlivu substituční léčby růstovým hormonem (GH) na tělesné složení, kostní změny, hladiny sérových lipidů a některé parametry sacharidového metabolizmu v průběhu sedmiletého sledování. Sledovali jsme 34 osob průměrného věku 41,73 ± 2,49 let (průměr ± SE). Těžký deficit GH byl prokázán provedením stimulačního inzulinového tolerančního testu. Délka léčby byla 4,13 ± 0,36 let (průměr ± SE). Pacienti byli vyšetřeni před zavedením substituční léčby, za 6 měsíců a dále v ročních intervalech. Pro zjištění statistické hladiny významnosti u jednotlivých parametrů jsme porovnávali výchozí počáteční stav (před podáním léku) se stavem v jednotlivých časových odstupech. Tělesné složení bylo vyšetřováno antropometrickými metodami, bioelektrickou impedancí a denzitometricky, kostní změny pomocí DEXA. V průběhu léčby nedocházelo ke statisticky významným změnám hmotnosti, ale signifikantně klesal obvod pasu (p < 0,05) i součet tloušťky kožní řasy (p < 0,05). Procento tělesného tuku měřeného metodou BIA se signifikantně měnilo po dobu 3 let (p < 0,05). Při měření tělesného složení denzitometricky docházelo k signifikantnímu poklesu v kilogramech tělesného tuku (FM) v prvním roce léčby (p < 0,05) a nárůstu lean body mass (LBM) v kilogramech během celého našeho sledování (p < 0,05). U celotělové BMD a BMC byl zachycen statisticky významný nárůst kostní denzity po prvním roce léčby. Při vyšetření periferních kostních změn docházelo k statisticky významnému nárůstu BMD (vyjádřené jako Z skóre) v oblasti proximálního femoru po prvním roce a krčku femoru až po třech letech (p < 0,05), u BMD bederní páteře byl významný nárůst již po roce léčby (p < 0,05) a změny byly významné i v dalších čtyřech letech. V oblasti sacharidového metabolizmu nebyly pozorovány žádné statisticky významné změny. V oblasti lipidového metabolizmu docházelo k poklesu celkového a LDL cholesterolu již po půl roce léčby (p < 0,05), změny byly významné i v dalších 4 letech. Hladiny HDL cholesterolu měly vzestupnou tendenci, avšak nebyly statisticky významné. V průběhu substituční léčby růstovým hormonem byly prokázány pozitivní změny tělesného složení, nárůst kostní denzity a pokles celkového a LDL cholesterolu.
Klíčová slova:
růstový hormon - deficit růstového hormonu dospělých - tělesné složení - kostní hmota - metabolizmus lipidůÚvod
Již od začátku minulého století je známo, že růstový hormon (GH) má zásadní vliv na normální růst a vývoj dítěte do dospělosti. Mnohem později byl popsán syndrom deficitu růstového hormonu u dospělých (GHDA) a s ním spojená rizika [1]. Byl definován začátkem 90. let minulého století jako klinický syndrom zahrnující abnormální tělesné složení s nadbytkem tělesného tuku (fat mass, FM) a snížením beztukové tělesné hmoty (lean body mass, LBM), redukovanou kostní hmotou a sníženou svalovou výkonností, některými kardiovaskulárními změnami, psychickými změnami a zhoršenou kvalitou života. Součástí tohoto převážně metabolického syndromu jsou nepříznivé změny lipidového spektra, snížená inzulinová senzitivita a prokoagulační stav, spojené s předčasnou aterosklerózou [1,23,26]. GHDA tak představuje závažný endokrinní deficit, který se může podílet na zvýšené morbiditě a mortalitě postižených osob [21,26,27]. V řadě studií, zatím většinou krátkodobých, byl prokázán vliv léčby růstovým hormonem na tělesné složení [3,7,9,22], změny kardiovaskulárního aparátu [21,27], kostní změny [9,10,12], kvalitu života a další, hlavně metabolické parametry [13,18,21]. V naší práci jsme se zaměřili na dlouhodobé sledování osob s těžkým deficitem růstového hormonu, prokázaným stimulačním inzulinovým tolerančním testem a přítomnými klinickými známkami syndromu deficitu růstového hormonu. V průběhu substituční terapie růstovým hormonem jsme chtěli prokázat dlouhodobý příznivý vliv této zatím velmi nákladné léčby na změny tělesného složení, zlepšení osteopenie a změny lipidového metabolizmu. Sledovali jsme i výskyt případných nežádoucích účinků.
Soubor nemocných a metodika
Vyšetřili jsme 34 osob průměrného věku 41,73 ± 2,49 let (průměr ± SE), 20 mužů a 14 žen. U 18 osob vznikl deficit GH v dětství (CO, childhood-onset), u dalších 16 v dospělosti (AO, adulthood-onset). U skupiny CO byla průměrná délka léčby růstovým hormonem v dětství 6,11 ± 1,04 let, průměrná doba přerušení léčby růstovým hormonem po ukončení růstu a před nasazením v dospělosti byla 9,3 ± 3,12 let. Z této skupiny nebyly 3 osoby v dětství léčeny růstovým hormonem vůbec, 2 osoby byly léčeny kontinuálně s přechodem na dávky GH obvyklé v dospělosti. Diagnóza těžkého deficitu GH byla potvrzena u všech osob provedením stimulačního inzulinového tolerančního testu, kdy při dosažené hypoglykemii pod 2,2 mmol/l byl vzestup koncentrace GH < 3 µg/l. Délka léčby růstovým hormonem byla v dospělosti 4,13 ± 0,36 let (průměr ± SE). Průměrná dávka růstového hormonu po titraci byla 1,032 ± 0,08 IU (průměr ± SE). Růstový hormon byl podáván v jedné denní dávce subkutánně, dávka byla titrována tak, aby hladina IGF-I byla v normě (obr. 1). IGF-I byl vyšetřován metodou RIA (přístroj Stratec, výrobce Diagnostic, Německo, kity IRMA, Assay Sandwich, Imunotech Francie). Ostatní deficity hypofyzárních hormonů byly adekvátně substituovány periferními hormony a adiuretinem nejméně 6 měsíců před zahájením léčby růstovým hormonem. Deficit TSH byl přítomen u 97 %, FSH/LH u 97 %, ACTH u 88 % a ADH u 21 % sledovaných osob. Základní ukazatele charakterizující soubor jsou zobrazeny v tab. 1. Nemocní byli vyšetřeni před zavedením substituční léčby, za 6 měsíců a dále v ročních intervalech. Tělesné složení bylo vyšetřováno antropometrickými metodami, bioelektrickou impedancí (BIA, přístroj BODYSTAT 500, verze 5.51, výrobce VB) a dále celotělovou denzitometrií metodou dvouenergiové rentgenové absorpciometrie (DEXA, přístroj Hologic QDR-2000, chyba měření do 0,5 %). Bylo tak stanoveno celkové množství tělesného tuku (fat mass, FM), lean body mass (LBM), obsah kostního minerálu (BMC) a celotělová kostní denzita (BMD total). Periferní kostní změny byly vyšetřovány také pomocí DEXA (přístroj Hologic QDR-2000, chyba měření na periferii do 1 %, stabilita sledována krátkodobými kontrolami kvality). V uvedených intervalech byly měřeny i hladiny sérových lipidů (celkový cholesterol, HDL a LDL cholesterol) a některé parametry sacharidového metabolizmu (glykemie nalačno, HbA1C, při patologických hodnotách byl proveden oGTT - orální glukózový toleranční test). Glukóza, celkový cholesterol a HDL cholesterol byly stanoveny fotometrickými enzymovými metodami, reagencie Pliva-Lachema Diagnostika s.r.o., na analyzátoru Advia 1650. Koncentrace LDL cholesterolu byla stanovena výpočtem podle Friedewalda. Výpočet nebyl proveden při hladině triglyceridů nad 4,5 mmol/l. Glykovaný hemoglobin byl stanoven metodou vysokotlaké kapalinové chromatografie (analyzátor TOSOHA1C 2,2, firma Bayer). Ze souboru byli vyřazeni pacienti užívající hypolipidemika a léky ovlivňující osteopenii. Pro zjištění statistické hladiny významnosti u jednotlivých parametrů jsme vždy porovnávali výchozí počáteční stav (před podáním léku) se stavem v různých časových odstupech (po podání léku). Ve všech grafech jsou označeny statisticky významné výsledky (p < 0,05) hvězdičkou. Pro hodnocení byl použit statistický test respektující charakter dat a jejich rozložení - neparametrický Wilcoxnův test. Výsledky statistického hodnocení jsou částečně ovlivněny relativně malým počtem osob sledovaných v průběhu studie (v pátém a šestém roce sledování: n < 10), proto uvádíme v tabulkách hodnoty od 6. měsíce do 4. roku sledování. Data byla hodnocena na hladině významnosti α = 5 %. Pro hodnocení výsledků byl použit software Statistica for Windows (StatSoft, ČR).
Tab. 1. Základní charakteristika souboru pacientů. Hodnoty jsou zobrazeny jako průměr ± SE (minimum - maximum), popřípadě jako procento případů. 
Výsledky
V průběhu substituce růstovým hormonem docházelo ke změnám v tělesném složení. Při antropometrickém vyšetření sice nedocházelo ke statisticky signifikantním změnám hmotnosti, ale po celou dobu sledování klesal obvod pasu i součet tloušťky kožní řasy - tyto změny v jednotlivých časových intervalech byly oproti výchozímu stavu statisticky významné po celou dobu sledování (p < 0,05). Procento tělesného tuku měřeného metodou BIA signifikantně klesalo po dobu 3 let (p < 0,05), dále byly změny nesignifikantní (obr. 2). Základní ukazatele tělesného složení pacientů jsou zobrazeny v tab. 2. Při měření tělesného složení denzitometricky (obr. 3) docházelo jednak ke statisticky signifikantnímu poklesu tělesného tuku (FM) v kilogramech během prvního roku léčby (p < 0,05), dále byly změny statisticky nevýznamné, a jednak k nárůstu netukové tělesné hmoty (LMB) během celého našeho sledování (p < 0,05). U celotělového měření denzity kostního minerálu (BMD) a obsahu kostního minerálu (BMC) byl zachycen statisticky významný nárůst kostní denzity po roce léčby; tyto změny byly signifikantní i po 3 letech léčby (p < 0,05) u BMD, u hodnot BMC trvaly statisticky významné změny po dobu 4 let (p < 0,05), v dalším průběhu byly změny již nesignifikantní. Ukazatele tělesného složení měřené denzitometricky jsou uvedeny v tab. 3. Periferní kostní změny byly vyšetřovány metodou DEXA (obr. 4). U sledovaných osob docházelo ke zvýšení BMD, při vyjádření pomocí Z skóre (udává počet SD od průměrné hodnoty osob stejného věku a pohlaví) v oblasti proximálního femoru a krčku (hip BMD, neck BMD) jsme zjistili statisticky významné změny až po 3 a 4 letech léčby (p < 0,05). Při sledování BMD v oblasti bederní páteře byl statisticky významný nárůst již po roce léčby a přetrvával po dobu 4 let (p < 0,05), dále byly změny nesignifikantní. Kostní změny před léčbou, po 1. a 4. roce léčby jsou zobrazeny v tab. 4 (hodnoty po šesti měsících nebyly měřeny). V oblasti lipidového metabolizmu docházelo ke statisticky významnému poklesu celkového cholesterolu a LDL cholesterolu již po půl roce léčby růstovým hormonem (p < 0,05), tyto změny byly významné i v dalších 4 letech (obr. 5). Hladina HDL cholesterolu měla vzestupnou tendenci po celou dobu sledování, avšak změny nebyly statisticky významné. Hladina glykemie nalačno a glykovaného hemoglobinu se v průběhu léčby statisticky významně neměnila. Základní ukazatele lipidového a sacharidového metabolizmu před léčbou, po 6 měsících a po 4. roce jsou uvedeny v tab. 5. Pokud se týká výskytu nežádoucích účinků substituční terapie, byly pozorovány jen ojediněle. U jednoho nemocného došlo ke zhoršení poruchy glukózové tolerance, která byla diagnostikována před zahájením léčby GH pomocí oGTT, do diabetes mellitus 2. typu, 1krát se vyskytl přechodně sklon k otokům, které v dalším období vymizely. V našem souboru prodělala v průběhu sledováni jedna osoba frakturu krčku femoru, jedenkrát se vyskytl nekomplikovaný infarkt myokardu, u jednoho nemocného byla diagnostikována primární hyperparatyreóza, která byla řešena operací. Tyto nemoci se substituční terapií GH pravděpodobně nesouvisely.
Tab. 2. Základní ukazatele tělesného složení pacientů - antropometrie před léčbou, po šesti měsících a po čtvrtém roce léčby. Hodnoty jsou zobrazeny jako průměr ± SE; data po šestém měsíci a po čtvrtém roce léčby byla porovnána s hodnotami před léčbou. 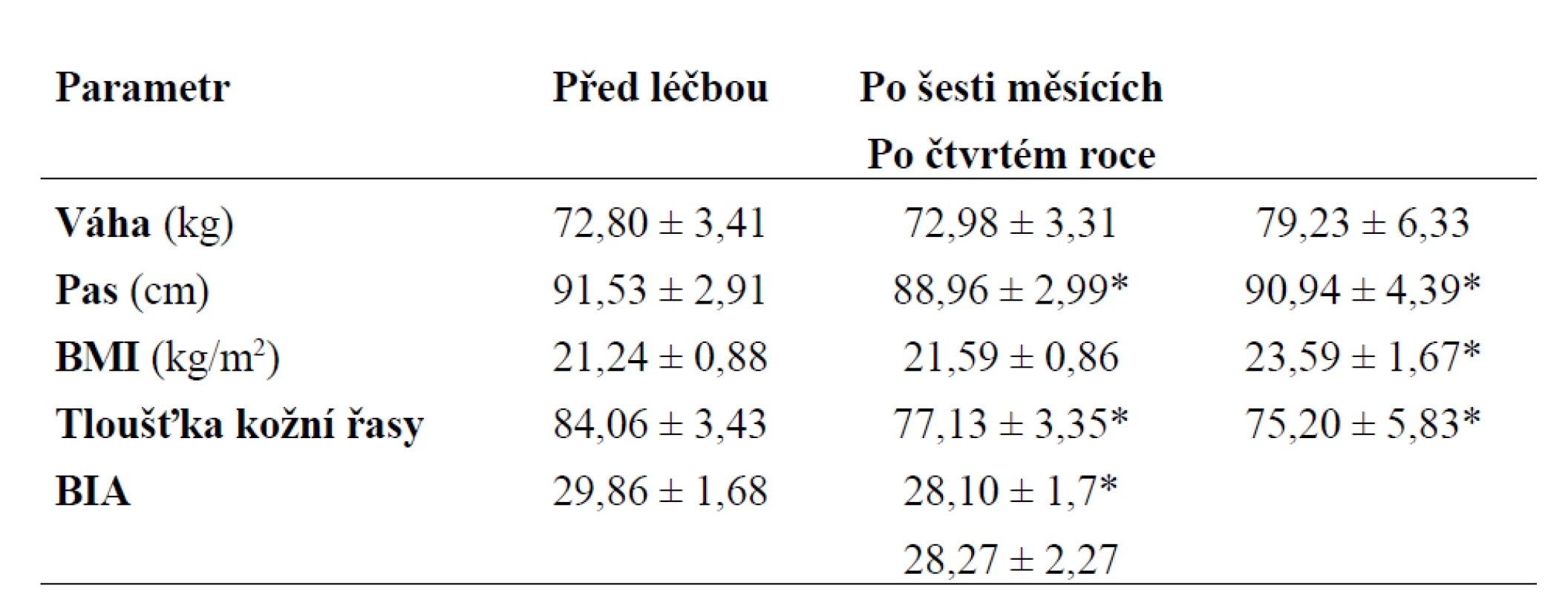
*p < 0,05 - Wilcoxnův test Tab. 3. Základní ukazatele tělesného složení pacientů - denzitometrie před léčbou, po šesti měsících, po dvou letech a po čtvrtém roce léčby. Hodnoty jsou zobrazeny jako průměr ± SE; data po šestém měsíci, po dvou letech a po čtvrtém roce léčby byla porovnána s hodnotami před léčbou. 
*p < 0,05 - Wilcoxnův test Tab. 4. Denzitometrie - kostní změny před léčbou, po prvním a čtvrtém roce léčby. Absolutní hodnoty BMD a Z skóre získané z jednotlivých měření jsou zobrazeny jako průměr ± SE; data po prvním a čtvrtém roce léčby byla porovnána s hodnotami před léčbou. 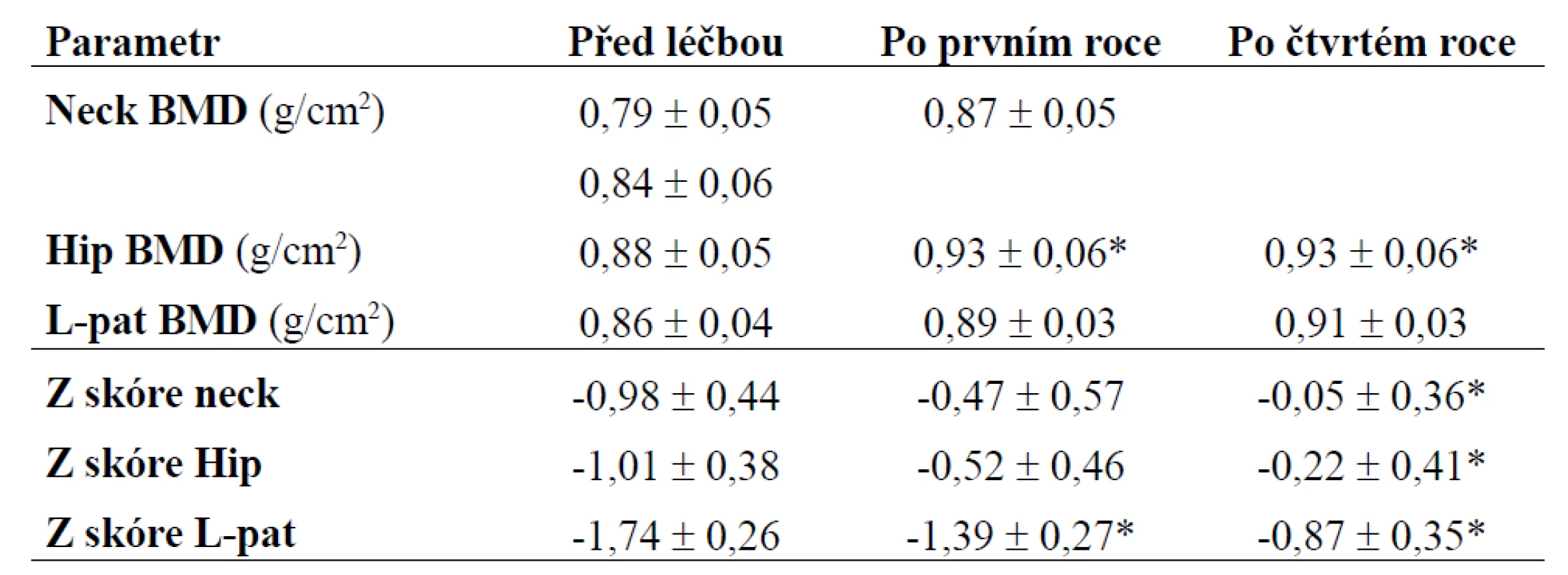
*p < 0,05 - Wilcoxnův test Tab. 5. Základní ukazatele lipidového a sacharidového metabolizmu pacientů před léčbou, po šesti měsících a po čtvrtém roce léčby. Hodnoty jsou zobrazeny jako průměr ± SE; data po šestém měsíci a po čtvrtém roce léčby byla porovnána s hodnotami před léčbou. 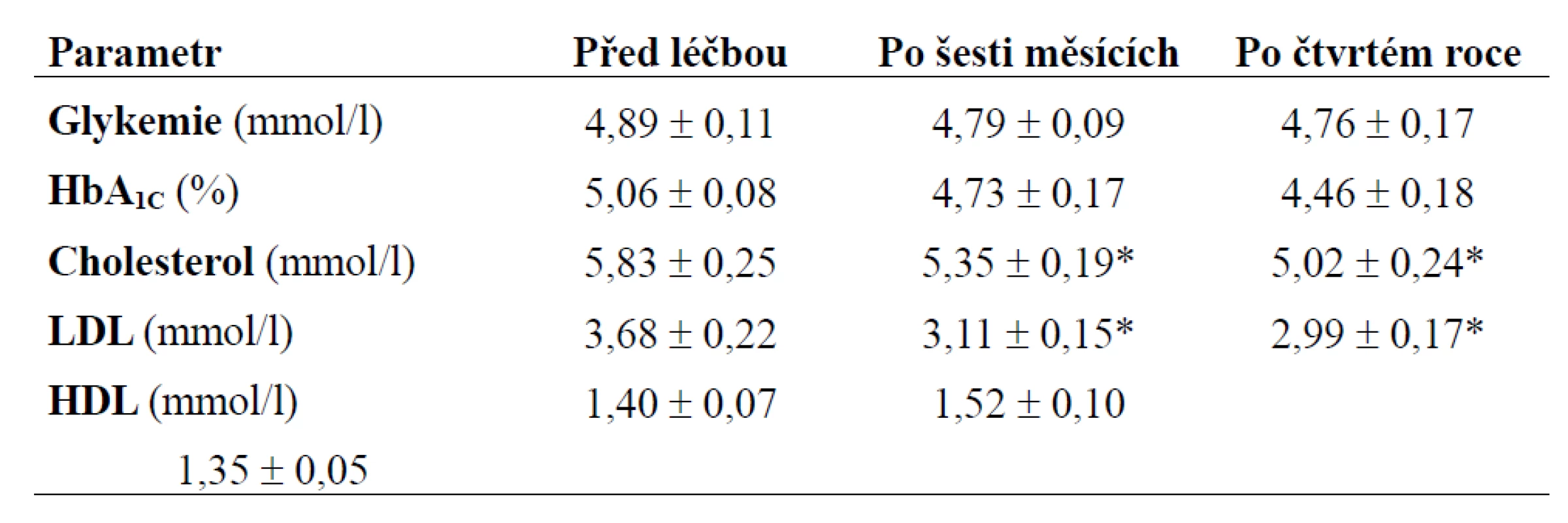
*p < 0,05 - Wilcoxnův test Diskuse
První studie o účincích substituce GH u dospělých začaly před více než 10 lety. Je známo, že růstový hormon je účinný anabolický a lipolytický hormon, s řadou metabolických funkcí. Jeho nedostatek je spojen s abnormálním tělesným složením, se zmnožením tukové tkáně, snížením celkové tělesné tekutiny a úbytkem svalové hmoty [1,23]. U neléčených osob s GHDA bylo prokázáno množství tuku o 7 % vyšší než u zdravých osob a tomu odpovídalo i snížení netukové tělesné hmoty [7,8,9]. V některých studiích bylo prokázáno, že změny jsou výraznější u osob, u kterých deficit GH vznikl v dětství, oproti skupině se začátkem deficitu v dospělosti, kdy jsou výraznější hlavně metabolické změny spojené s hyperlipoproteinemií, inzulinovou rezistencí a abdominální obezitou [2,3,4]. Byla pozorována lepší odpověď hladiny IGF-I na léčbu GH u mužů než u žen [2]. Vhodná je proto individuální titrace dávky v závislosti na věku, pohlaví nemocného a klinickém stavu tak, aby bylo dosaženo co nejlepšího efektu léčby [15]. Podle literatury dlouhodobá substituční léčba normalizuje tělesné složení [7,8,13,22]. V naší skupině docházelo v průběhu 7letého sledování k pozitivním změnám tělesného složení, a to jak při použití antropometrických metod, tak bioelektrické impedance i denzitometrie. Nejvýraznější byly změny v nárůstu LBM měřené denzitometricky, kdy došlo ke statisticky významnému zlepšení již po půl roce a nárůst přetrvával po celou dobu sledování. Úbytek tukové tělesné hmoty (FM kg) byl významný při denzitometrickém měření pouze po prvním roce léčby, v dalším období byly změny statisticky nevýznamné, ale s tendencí k nárůstu k původním hodnotám již mezi 2. a 4. rokem. Podobně při měření tělesného tuku metodou BIA došlo k poklesu tělesného tuku po 6 měsících a prvním roce léčby, tento pozitivní trend se udržel po dobu prvních 2 let léčby a v průběhu dalšího sledování byla také tendence k nárůstu k původním hodnotám. Tyto změny mohly souviset s nárůstem hmotnosti a BMI v průběhu sledování, které mohly být způsobeny větší chutí k jídlu nebo zvýšeným energetickým příjmem při větší tělesné aktivitě po substituční terapii GH. Z výsledků antropometrických vyšetření lze však usuzovat na redukci abdominální obezity.
Studie prokázaly, že dospělí s deficitem růstového hormonu mají sníženou kostní hmotu a vyšší riziko fraktur. Osoby s deficitem růstového hormonu vzniklým v dětství (CO) mají osteopenii především vzhledem k nízkým dosaženým hodnotám vrcholové kostní hmoty (peak bone mass). Hodnoty BMD jsou u 33 % pacientů pod -2SD proti zdravým vrstevníkům [1,12]. U osob, u kterých vznikl deficit GH až v dospělosti (AO), bývá sice osteopenie častým nálezem, vyskytuje se asi u 19 % dospělých této skupiny, ale tento stav je komplikován jednak heterogenitou nemocných, častějšími vícečetnými endokrinními deficity a přidruženými nemocemi. Zdá se, že u této skupiny se jedná především o stav sníženého kostního obratu [10,11]. Důležitá je adekvátní substituce glukokortikoidy, pohlavními steroidy a hormony štítné žlázy. Tato terapie má vliv nejen na kostní obrat, ale i na další metabolické parametry. Podle některých studií se udává nárůst kostní denzity po zavedení substituční terapie průměrně o 2 % ročně. Významnější je tento efekt u pacientů s COGHDA [10,11]. V našem souboru docházelo u celotělového měření k nárůstu kostní denzity a obsahu kostního minerálu statisticky významně po 1 roce a tyto změny přetrvávaly po dobu 3 let (BMD) a 4 let (BMC), dále byly statisticky nevýznamné, pravděpodobně vlivem malého počtu pacientů v souboru. Po prvních 6 měsících léčby došlo u celotělového vyšetření BMC a BMD k přechodnému mírnému poklesu, což lze vysvětlit aktivací kostní resorpce po zavedené substituční terapii GH, jak se uvádí v literatuře. Při periferním měření kostní denzity jsme hodnotili naměřené hodnoty BMD jak v absolutních číslech, tak vyjádřené pomocí Z skóre s ohledem na poměrně velký věkový rozptyl sledovaného souboru. Docházelo ke zvýšení BMD v oblasti proximálního femoru a krčku již po roce, statisticky významné byly tyto změny v porovnání se stavem před léčbou až po 3. roce léčby (při hodnocení Z skóre), při hodnocení BMD v absolutních číslech byl signifikantní nárůst v oblasti proximálního femoru již po 1 roce. U vyšetření kostní denzity v oblasti bederní páteře byl statisticky významný nárůst již po 1 roce léčby a trval po dobu 4 let, dále byly změny nesignifikantní, výsledky byly zřejmě ovlivněny malým počet pacientů v souboru ke konci sledování.
Nepříznivé změny hladin lipidů se vyskytují u více než 50 % osob s GHDA a mohou se podílet na jejich zvýšené kardiovaskulární morbiditě a mortalitě. Více jsou ohroženi pacienti s deficitem vzniklým v dospělosti (AO), a to zvláště ženy [2,19,24]. Typické jsou změny hladin celkového a LDL cholesterolu se snížením hladiny HDL, vysoké hladiny triacylglycerolů (až u 68 % osob) a apolipoproteinu B [2,17,20]. Jedním z faktorů, který může modifikovat metabolizmus lipidů, je viscerální akumulace tuku, který je metabolicky aktivnější. Podle některých studií vykazují pozitivní korelaci s oxidací tuků právě ukazatele abdominální obezity (obvod pasu). Substituční terapie u osob s GHDA vede ke zlepšení lipidogramu, hlavně hladin celkového a LDL cholesterolu [2,18,19]. V naší skupině ve shodě s literaturou docházelo k poklesu hladin celkového a LDL cholesterolu již po 6 měsících a v dalším období pokles přetrvával, po 5 letech nebyly již změny statisticky významné. Hladiny HDL sice narůstaly, ale nebyly signifikantní. U deficitu GH v dospělosti je v literatuře popisována snížená inzulinová senzitivita (častěji u skupiny AO). V této práci jsme sledovali hladiny lačné glykemie a hodnoty glykovaného hemoglobinu, kde jsme nezaznamenali statisticky významné změny. Substituční léčba GH u pacientů s GHDA by neměla zvyšovat riziko porušené glukózové tolerance a diabetu.
Závěr
Substituční léčba růstovým hormonem vedla u našeho souboru dospělých osob s prokázaným těžkým deficitem růstového hormonu a přítomnou klinickou symptomatologií deficitu GH ke zlepšení tělesného složení, nárůstu kostní hmoty a pozitivním změnám lipidového spektra. Výskyt nežádoucích účinků byl ojedinělý a přechodný. Terapie růstovým hormonem může ovlivnit morbiditu a mortalitu u těchto nemocných především ovlivněním kardiovaskulárních rizikových faktorů.
Práce vznikla za podpory grantu IGA MŠMT č. MSM0021622402 a postdoktorandského grantu č. 303/05/P523, poskytnutého Grantovou agenturou České republiky.
MUDr.Věra Olšovská
www.fnusa.cz
e-mail: vera.olsovska@fnusa.cz
Doručeno do redakce: 10. 6. 2005
Přijato po recenzi: 22. 8. 2005
Zdroje
1. Cuneo RC, Salomon F, McGauley GA et al. The growth hormone deficiency syndrome in adults. Clin Endocrinol 1992; 37 : 387-397.
2. Attanasio AF, Lamberts SWJ, Matranga AMC et al. Adult growth hormone (GH)-deficient patients demonstrate heterogeneity between childhood onset and adult onset before and during human GH treatment. J Clin Endocrinol Metab 1997; 82 : 82-88.
3. Hansen TB, Jorgensen JOL, Christiansen JS. Body composition and circulating levels of insulin, insulin-like growth factor-binding protein-1 and GH in adults independently on age. J Clin Endocrinol Metab 2002; 87 : 2185-2193.
4. Cuneo RC, Judd S, Walace JD et al. The Australian multicenter trial of growth hormone (GH) treatment in GH deficient adults. J Clin Endocrinol Metab 1998; 83 : 107-116.
5. Vance ML, Mauras N. Growth hormone therapy in adults and children. N Engl J Med 1999; 341 : 1206-1216.
6. Cummings SR, Merriam GR. Growth hormone therapy in adults. Annu Rev Med 2003; 54 : 513-533.
7. De Boer H, Blok GJ, Voerman HJ et al. Body composition in adults growth hormone deficient men, assessed by anthropometry and bioimpendance analysis. J Clin Endocrinol Metab 1992; 75 : 883-837.
8. Jorgensen JOL, Thuesen L, Ovesen P et al. Three years of growth hormone treatment in growth hormon-deficient adults: near normalization of body composition and physical performance. Eur J Endocrinol 1994; 130 : 224-228.
9. Fernholm R, Bramnert M, Haag E et al. Growth hormone replacement therapy improves body composition and increases bone metabolism in elderly patients with pituitary disease. J Clin Endorinol Metab 2000; 85 : 4104-4112.
10. Vandeweghe M, Taelman P, Kaufman JM. Short an long-term effects of growth hormone treatment on bone turnover and bone mineral content in adult growth hormone-deficient males. Clin Endocrinol 1993; 39 : 409-415.
11. Nilsson AG. Effects of growth hormone replacement therapy on bone markers and bone mineral density in growth hormone-deficient adults. Horm Res 2000; 54 : 52-57.
12. Ohlsson C, Bengtsson BA, Isaksson OG et al. Growth hormone and bone. Endocr Rev 1998; 19 : 55-79.
13. Baum HBA, Biller BMK, Finkelstein JS et al. Effects of physiologic growth hormone therapy on bone density and body composition in patient with adult-onset growth hormone deficiency. Ann Intern Med 1996; 125 : 883-890.
14. Kotzmann H, Riedel M, Bernecker P et al. Effect of long-term growth hormone substitution therapy on bone mineral density and parameters of bone metabolism in adult patients with growth hormon deficiency. Calcif Tissue Int 1998; 62 : 40-46.
15. Drake WM, Howell SJ, Monson JP et al. Optimising GH therapy in adults and children. Endocrin Rev 2001; 22 : 425-450.
16. Shalet SM, Shavrikova E, Cromer M. Effects of GH treatment on bone in postpubertal GH-deficient patients: a 2-year randomized, controlled, dose-ranging study. J Clin Endocrinol Metab 2003; 88 : 4124-4129.
17. Laron Z, Wang XL. Growth hormone, lipoprotein(a) and cardiovascular disease. Eur Heart J 1998; 19 : 204-206.
18. Al-Shoumer KAS, Gray R, Anyaoku V et al. Effects of four years treatment with biosynthetic human growth hormone (GH) on glucose homeostasis, insulin secretion and lipid metabolism in GH-deficient adults. Clin Endocrinol 1998; 48 : 795-802.
19. De Boer H, Blok GJ, Voerman HJ et al. Serum lipid levels in growth hormon deficient men. Metabolism 1994; 43 : 199-203.
20. Angelin B, Rudling M. Growth hormone and hepatic lipoprotein metabolism. Current Opinion in Lipidology 1994; 5 : 160-165.
21. Colao A, di Somma C, Pivinello R et al. The cardiovascular risk of adult GH deficiency improved after GH replacement therapy and worsened in untreated GHD, a 12-month prospective study. J Clin Endocrinol Metab 2002; 87 : 1088-1093.
22. Weis V, Kršek M, Marek J et al. Celkové tělesné složení dospělých pacientů s deficitem růstového hormonu před a po jeho podání. Vnitř Lék 2003; 49 : 655.
23. Jenšovský J, Lebl J, Christiansen JS et al. Růstový hormon. Praha: Galén 2000 : 173-244.
24. Cuneo RC, Salomon F, Watts GF et al. Growth hormone improves serum lipids and lipoproteins in adults with growth hormone deficiency. Metabolism 1993; 42 : 1519-1523.
25. Bulow B, Erfurt EM. A low individualized GH dose in young patient with childhood onset GH deficiency normalized serum IGF-I without significant deterioration in glucose tolerance. Clin Endocrinol 1999; 50 : 45-55.
26. Johansson JO, Fowelin J, Landin K et al. Growth hormone deficient adults are insulin resistent. Metabolism 1995; 44 : 1126-1129.
27. Rosén T, Eden S, Larson G et al. Cardiovascular risk factors in adult patients with growth hormone deficiency. Acta Endocrinol 1993; 129 : 195-200.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2005 Číslo 12- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Co dělat při intoleranci statinů?
-
Všetky články tohto čísla
- Studie ASCOT: konec léčby hypertenze beta-blokátory? – editorial
- Vztah refluxní choroby jícnu k astmatu bronchiale a horním cestám dýchacím
- Obsah bakterií v probioticích dostupných na českém trhu
- Vliv dlouhodobé substituční terapie růstovým hormonem na tělesné složení, kostní tkáň a některé metabolické parametry u dospělých osob s deficitem růstového hormonu
- Vplyv rekombinantného ľudského prokalcitonínu na fagocytovú a kandidacídnu schopnosť polymorfonukleárnych leukocytov a na cídne mechanizmy séra a krvi voči baktériám Staphylococcus aureus a Escherichia coli
- Možnosti ultrasonografické diferenciace krčních a axilárních lymfadenopatií
- Idiopatická plicní fibróza
- Idiopatický hypereozinofilní syndrom a chronická eozinofilní leukemie (diferenciální diagnóza a terapie ve světle nových poznatků)
- Prevence kardiovaskulárních příhod antihypertenzní léčbou amlodipinem a perindoprilem ve srovnání s atenololem a bendroflumetiazidem. Výsledky studie ASCOT (Anglo-Scandinavian Outcomes Trial: blood pressure lowering arm) - multicentrická, randomizovaná, kontrolovaná studie. Mezník ve vývoji názorů na kombinační léčbu hypertenze? (komentář)
- Atypická lokalizace pyoderma gangraenosum u nemocného s ulcerózní kolitidou
- Diagnostika a léčba hepatocelulárního karcinomu
- Nesnášenlivost potravin - příčina či následek trávicích poruch?
-
Dopis redakci
Přínos pioglitazonu u pacientů s diabetes mellitus 2. typu a kardiovaskulárními komplikacemi - 75 let prof. MUDr. Karla Trnavského, DrSc.
- 200 let od narození Josefa Škody (10. 12. 1805 - 13. 6. 1881)
- XII. výroční kongres České internistické společnosti ČLS J. E. Purkyně Praha 23. - 25. 10. 2005
- Z odborné literatury
-
Jmenný rejstřík
Původní práce, editorialy, přehledné referáty, doškolování, popisy případů a krátká sdělení - Věcný rejstřík
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Idiopatický hypereozinofilní syndrom a chronická eozinofilní leukemie (diferenciální diagnóza a terapie ve světle nových poznatků)
- Možnosti ultrasonografické diferenciace krčních a axilárních lymfadenopatií
- Vztah refluxní choroby jícnu k astmatu bronchiale a horním cestám dýchacím
- Idiopatická plicní fibróza
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy








