-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Diagnostické a terapeutické postupy u feochromocytomu: současné trendy
Diagnostic and therapeutic procedures in pheochromacytoma: current trends
Pheochromacytoma is a relatively rare cause of arterial hypertension. Untreated pheochromacytoma may however lead to a fatal hypertensive crisis during anaesthesia or another form of stress. It is therefore important to correctly diagnose this disease. 24-hour monitoring of blood pressure (BP) can already contribute to the diagnosis of pheochromacytoma based on the frequent occurrence of BP variability and the absence of a night-time fall in BP. 5 gene mutations have so far been identified that may be responsible for the familial form of pheochromacytoma: mutation of the von Hippel-Lindau (VHL) gene, leading to the onset of VHL syndrome, mutation of the RET-proto-oncogene in multiple endocrine adenomatosis type 2, mutation of the type 1 gene for neurofibromatosis, which is associated with von Recklinghausen’s disease and finally mutation of the genes encoding the B and D subunits of succinate dhydrogenase (SDHB, SDHD), which are associated with familial paragangliomas and pheochromacytoma. Genetic analysis should therefore be carried out for all confirmed cases of pheochromacytoma, especially for young people under 50 years of age. Biochemical diagnostics relies mainly on measurements of free metanephrines in plasma or urine, which usually has greater diagnostic weight than plasma, or catecholamines in urine. The diagnosis of extraadrenal or multiple forms can use not only CT/MR but also imaging using the radiopharmaceutical 123I-Metaiodobenzylguanidine (MIBG) or 18F-fluorodopamine PET (only available in the USA). Pharmacological treatment using alpha or beta receptor blockers with subsequent laparoscopic excision of the tumor is usually successful in benign forms of pheochromocytoma. Unfortunately, there are still no convincingly effective therapeutic procedures available for malign forms.
Key words:
pheochromacytoma – blood pressure – genetic analysis – diagnostics – treatment
Autori: J. Widimský Jr 1; T. Zelinka 1; O. Petrák 1; B. Štrauch 1; L. Šafařík 2; M. Kasalický 3; A. Vranková 1; R. Holaj 1
Pôsobisko autorov: Centrum pro hypertenzi III. interní kliniky 1. lékařské fakulty UK a VFN Praha, přednosta prof. MUDr. Štěpán Svačina, DrSc., MBA 1; Urologická klinika 1. lékařské fakulty UK a VFN Praha, přednosta prof. MUDr. Jan Dvořáček, DrSc. 2; I. chirurgická klinika 1. lékařské fakulty UK a VFN Praha, přednosta doc. MUDr. Jan Šváb, CSc. 3
Vyšlo v časopise: Vnitř Lék 2007; 53(4): 428-433
Kategória: Přehledné referáty
Súhrn
Feochromocytom je relativně vzácná příčina arteriální hypertenze. Neléčený feochromocytom může však vést až k fatální hypertenzní krizi v průběhu anestezie či jiných forem stresu. Je proto důležitá náležitá diagnostika tohoto onemocnění. Již 24hodinové monitorování krevního tlaku (TK) může přispět k diagnostice feochromocytomu s ohledem na často se vyskytující zvýšenou variabilitu TK a absenci nočního poklesu TK. Dosud byly identifikovány mutace 5 genů, zodpovědných za vznik familiárních forem feochromocytomu: mutace genu von Hippel-Lindau (VHL), vedoucí ke vzniku VHL-syndromu, mutace RET-protoonkogenu u mnohočetné endokrinní adenomatózy 2. typu, mutace typu 1 genu pro neurofibromatózu, který je asociován s von Recklinghausenovým onemocněním a konečně mutace genů kódujících B - a D-subjednotky mitochondriální sukcinát-dehydrogenázy (SDHB, SDHD), které se vyskytují u familiární paragangliomatózy a feochromocytomu. Genetická analýza by se proto měla provádět u všech potvrzených případů feochromocytomu, zejména u mladších osob do 50 let věku. Biochemická diagnostika se opírá zejména o stanovení plazmatických volných metanefrinů nebo močových frakcionovaných metanefrinů, které mají obvykle vyšší diagnostickou výtěžnost ve srovnání s plazmatickými, popřípadě močovými katecholaminy. V diagnostice extraadrenálních či mnohočetných forem se kromě CT/MRI uplatňuje zobrazení pomocí radiofarmaka 123I-metaiodobenzylguanidinu (MIBG) nebo pomocí 18F-fluorodopaminu PET (dostupné jen v USA). Farmakologická léčba pomocí blokátorů alfa-, popřípadě i beta-receptorů s následnou laparoskopickou exstirpací tumoru bývá u benigních forem feochromocytomu obvykle úspěšná. Bohužel u maligních forem nejsou stále k dispozici přesvědčivě účinné léčebné přístupy.
Klíčová slova:
feochromocytom - krevní tlak - genetická analýza - diagnostika - léčbaÚvod
Feochromocytom je považován za vzácnou formu arteriální hypertenze. Nálezy z velkých autoptických studií v Austrálii a na Novém Zélandě svědčí pro velmi nízký výskyt tohoto tumoru [1]. Odhady prevalence feochromocytomu u hypertenzní populace se pohybují mezi 0,01 % až 0,1 %. Ve specializovaných centrech jsou pochopitelně tato čísla vyšší [2].
Ačkoliv je feochromocytom relativně vzácným onemocněním, je jeho správná diagnostika a léčba mimořádně důležitá. Nerozpoznané a neléčené případy feochromocytomu mohou vést v průběhu anestezie či jiné formy stresu až k fatální hypertenzní krizi [3]. Důležitá je i skutečnost, že přibližně 10 % všech feochromocytomů je nacházeno zcela náhodně (incidentalomy) a asi 5 % všech incidentalomů jsou ve skutečnosti feochromocytom [4].
Změny krevního tlaku
Trvalá (fixovaná) hypertenze bývá častější než paroxyzmální. Nemocní s fixovanou hypertenzí mívají však navíc epizody výrazně zvýšeného krevního tlaku, které mohou být vyvolány různými podněty (fyzická námaha, anestezie, kouření, močení, defekace nebo tlakové podněty na abdominální oblast).
V klinické praxi je vžitá představa, že nemocní s feochromocytomem mívají často sklon k hypertenzi, rezistentní na farmakologickou léčbu. Epizody zvýšené produkce/uvolňování katecholaminů sice mohou někdy vést ke krátkodobým vzestupům krevního tlaku (TK) s TK až přes 250/150 mm Hg, avšak průměrný 24hodinový TK bývá obvykle nižší ve srovnání s jinými formami endokrinní hypertenze typu primárního hyperaldosteronizmu nebo Cushingova syndromu anebo ve srovnání s esenciální hypertenzí [5]. U většiny feochromocytomů je rezistence na farmakologickou léčbu vzácná.
Cirkadiánní rytmus TK je u feochromocytomu vymizelý díky absenci nočního poklesu TK, či dokonce v některých případech díky zvýšenému TK v nočních hodinách oproti denní době [5]. Tato 24hodinová charakteristika TK pomocí 24hodinového ambulantního monitorování krevního tlaku (AMTK) může být považována za nepřímý diagnostický marker feochromocytomu, neboť podobné změny 24hodinového profilu TK nejsou pozorovány u dalších forem endokrinní hypertenze [5]. Normotenze se u feochromocytomu může vyskytovat u asymptomatických nemocných [6], absence zvýšeného TK bývá vysvětlována desenzitizací adrenergních receptorů díky dlouhodobě zvýšeným hladinám katecholaminů v cirkulaci. Je zajímavé, že normotenzní případy feochromocytomu mají rovněž vymizelý pokles TK v nočních hodinách [6].
Katecholaminy jsou u hypertoniků spolu s některými dalšími faktory zodpovědné jak za krátkodobé, tak i dlouhodobé zvýšení krevního tlaku. Stanovení variability TK může být u hypertenzních pacientů užitečné v odhadu kardiovaskulárního rizika, protože se ukazuje, že zvýšená variabilita TK je samostatným rizikovým faktorem kardiovaskulární mortality a morbidity [7]. Nadprodukce katecholaminů je u pacientů s feochromocytomem často spojena s vyšší dlouhodobou variabilitou TK ve srovnání s esenciální hypertenzí. Tato skutečnost je nejmarkantnější u osob s invertovaným cirkadiánním rytmem TK [8]. Úspěšné odstranění nádoru vede k normalizaci zvýšené variability TK [8].
Vyšetření pomocí AMTK může tak být u feochromocytomu diagnosticky přínosné s ohledem na popsané změny 24hodinového rytmu TK a zvýšenou variabilitu TK.
Familiární syndromy
Dříve se odhadovalo, že familiární formy feochromocytomu se vyskytují relativně zřídka, maximálně do 10 % všech případů. Nedávná studie provedená převážně ve střední Evropě na velkém vzorku zdánlivě sporadických forem feochromocytomu nalezla však relativně vysokou prevalenci (24 %) mutací jednoho ze 4 genů známých pro výskyt familiárních forem feochromocytomu [9]. Celkově do dnešního dne jsou popsány mutace 5 genů, které mají přímý vztah ke vzniku familiárních feochromocytomu (tab. 1): von Hippel-Lindau genu (VHL), vedoucí ke vzniku von Hippel-Lindau syndromu, RET-protoonkogenu vedoucí ke vzniku mnohočetné endokrinní neoplazie/adenomatózy typu 2 (MEN 2), genu pro neurofibromatózu typu 1 (NF1), asociovaného s von Recklinghausenovou chorobou a mutace genů kódujících B - a D-subjednotky mitochondriální sukcinát-dehydrogenázy (SDHB, SDHD), zodpovědných za vznik familiárních paragangliomů a feochromocytomu [10,11]. Feochromocytomy nemusí být u těchto familiárních syndromů vždy přítomné a nebývají obvykle ani první klinickou manifestací těchto onemocnění (tab. 1) [10].
Zdá se tak užitečné, aby se genetické analýzy prováděly u všech nemocných s potvrzeným feochromocytomem, zejména u mladších osob pod 50 let věku [10]. Všechny pozitivní případy by pak měly být celoživotně sledovány.
Syndrom von Hippelův-Lindauův
Tento syndrom se rozděluje do tří základních typů (typ 1, 2 a 3). Klinické projevy bývají velmi rozmanité. Feochromocytom bývá přítomen jen u VHL syndromu typu 2, který se dále rozděluje na formu 2A, prezentující se hemangioblastomy CNS, feochromocytomy, endolymfatickými tumory a epididymálními cystadenomy. VHL syndrom typu 2B kromě feochromocytomu zahrnuje cysty ledvin, karcinom ledvin, hemangioblastomy CNS, cysty a tumory pankreatu, endolymfatické tumory a epididymální cystadenomy. Třetí typ (2C) syndromu VHL se projevuje pouze přítomností feochromocytomu [10].
Mnohočetná endokrinní neoplazie typu 2 (MEN 2)
Tento syndrom (mutace genu RET) se obvykle rozděluje na 2 hlavní formy. Forma/typ A kromě feochromocytomu zahrnuje také medulární karcinom štítné žlázy, hyperparatyreózu, nebo jen familiární medulární karcinom štítné žlázy (FMTC). Typ B se projevuje přítomností medulárního karcinomu tyreoidey, feochromocytomu, mnohočetnými neuromy a marfanoidními rysy [10].
Syndromy projevující se přítomností paragangliomů
Klasifikace těchto syndromů v literatuře bývá značně heterogenní. Tyto syndromy mají velmi různorodé klinické rysy projevující se přítomností tumorů hlavy a krku (tumory glomus caroticum, vagové a jugulární paragangliomy a paragangliomy středního ucha, feochromocytom) nebo přítomností abdominálních či torakálních paragangliomů. Paragangliomy hlavy a krku mají často popisovanou mutaci genu SDHD a bývají obvykle benigní. Naopak přítomnost mutace genu SDHB bývá spojena s velmi vysokým rizikem maligních forem (80 %!) [11].
Syndrom neurofibromatózy typu 1
Tento syndrom se projevuje mnohočetnými kožními a slizničními změnami, kožními ložisky typu „cafe au lait“ a potenciálně i přítomností feochromocytomu. Feochromocytomy jsou však u tohoto syndromu velmi vzácné (< 5 %), diagnostický screening není nezbytně nutný.
Biochemická diagnostika
V posledních 10 letech došlo k významnému technickému pokroku. Eisenhofer et al [12] popsali vyšší diagnostickou senzitivitu a specificitu stanovení plazmatických metanefrinů, která může být vysvětlena rozdílnou afinitou katecholaminů ke katechol-O-metyltransferáze (COMT) membrány adrenálních chromafinních buněk. Tato afinita je mnohem vyšší oproti COMT v jiných tkáních. Všechny tumory metabolizují katecholaminy na volné metanefriny, avšak ne všechny tumory vedou k hypersekreci katecholaminů [4,12]. Zatímco hladiny katecholaminů v plazmě jsou zvýšeny po minimálních podnětech, jako je úzkost a stres, koncentrace metanefrinů jsou těmi vlivy méně ovlivněny.
Multicentrická kohortová studie provedená ve čtyřech centrech u 214 pacientů s potvrzeným feochromocytomem vedla k závěru, že stanovení volných metanefrinů v plazmě je nejvhodnějším testem v diagnostice feochromocytomu [13]. Nedávný přehledný článek stejných autorů doporučoval měření plazmatických volných metanefrinů anebo močových frakcionovaných metanefrinů (oddělené stanovení normetanefrinu a metanefrinu v moči) jako test s nejvyšší diagnostickou citlivostí [10]. Tab. 2 uvádí srovnání senzitivity a specificity různých biochemických testů používaných v diagnostice feochromocytomu dle Lenderse [13].
Navzdory velmi vysoké senzitivitě plazmatických/močových metanefrinů je určitým problémem jejich relativně nižší specificita, a proto pozitivní výsledky neznamenají vždy potvrzení diagnózy feochromocytomu [4,10]. Některé látky navíc mohou interferovat s biochemickými testy feoochromocytomu a vést tak k falešné pozitivitě výsledků. Nejčastěji se jedná o interferující medikaci typu fenoxybenzaminu, paracetamolu nebo tricyklická antidepresiva [14]. Falešně pozitivní výsledky mohou rovněž být vyvolány dietními vlivy a nedodržením odpovídajících podmínek odběrů krve krve/moče, což může být problémem zejména v ambulantních podmínkách.
Někteří další autoři [15] doporučují pro diagnostiku feochromocytomu provádět více testů s ohledem na komplexní metabolizmus katecholaminů. Kombinace stanovení plazmatického norepinefrinu (NE) a epinefrinu (E) se součtem koncentrací obou těchto látek nad 2,000 pg/ml a současně měření močových metanefrinů - metanefrin (MNM) + normetanefrin (NM) - s výslednou hladinou nad 1,8 mg/24 hod mělo diagnostickou přesnost 98 % u sporadických i familiárních feochromocytomů [15]. Pochopitelně, provádění kombinace více diagnostických testů je pracnější a ekonomicky nákladnější.
Pracovníci Mayo kliniky doporučují volit diagnostický postup v závislosti na pravděpodobnosti přítomnosti feochromocytomu [16]. Za účelem minimalizace počtu falešně pozitivních případů doporučují provádět stanovení metanefrinů a katecholaminů ve 24hodinovém sběru moči. V případě důvodného podezření na feochromocytom (charakteristické příznaky, rodinná anamnéza feochromocytomu, familiární syndromy, zvětšení nadledviny) doporučují použít testy s vyšší senzitivitou typu frakcionovaných volných plazmatických metanefrinů [16].
Stanovení kyseliny vanilmandlové (VMA) je v klinické praxi stále velmi rozšířeno. Měření VMA je však zatíženo nižší senzitivitou, protože asi 80 % VMA vzniká z metabolitů NE ze sympatických nervových vláken. Proto zvýšení exkrece VMA močí nemusí znamenat přítomnost feochromocytomu [4].
Ačkoliv panuje určitá nejasnost, který laboratorní test je pro diagnostiku feochromocytomu nejlepší [4], zdá se, že stanovení plazmatických volných metanefrinů nebo močových frakcionovaných metanefrinů bude nejvhodnější volbou [10,13].
Farmakologické testy
Klonidinový test je nejpoužívanějším farmakologickým přístupem odlišujícím zvýšené uvolňování katecholaminů díky zvýšené aktivitě sympatiku od nadprodukce a hypersekrece katecholaminů tkání feochromocytomu [17]. V případě pozitivity tohoto testu je jeho prediktivní hodnota pro diagnostiku feochromocytomu 97 %. Negativní prediktivní hodnota je však relativně nízká (75 %). Výzkumný tým z Bethesdy doporučuje proto provádět klonidinový supresní test a namísto plazmatického NE měřit koncentrace plazmatického normetanefrinu [18]. Tato modifikace vedla ke zlepšení pozitivní a negativní prediktivní hodnoty klonidinového tesu na 100 % a 96 % [18]. Tento test se tak zdá být nejpřesnější metodou laboratorní diagnostiky feochromocytomu a měl by být používán ve sporných a nejasných případech.
Stimulační testy s použitím histaminu nebo glukagonu jsou náročné a potenciálně rizikové. Díky dostupnosti dalších laboratorních testů je jejich diagnostický přínos problematický [4].
Morfologická diagnostika
Abdominální počítačová tomografie (CT) se stále často používá k lokalizaci tumoru. Zdá se, že aplikace iohexolu pro zlepšení kontrastu nevede k ovlivnění koncentrací plazmatických katecholaminů [19]. Na obr. 1 je znázorněna diagnostika paragangliomu pomocí CT v oblasti pravého glomus caroticum. Magnetická rezonance (T2-weighted MRI) s podáním gadolinia má srovnatelnou diagnostickou přesnost s CT vyšetřením [4,10], avšak MRI je preferována v diagnostice extraadrenálních feochromocytomů, u těhotných osob, dětí, alergií na kontrastní látku anebo v případě renální insuficience. V případě realizace CT či MRI není nutná současná blokáda adrenergních receptorů.
Obr. 1. Feochromocytom/paragangliom oblasti pravého glomus caroticum (značeno šipkou) zobrazený pomocí CT. 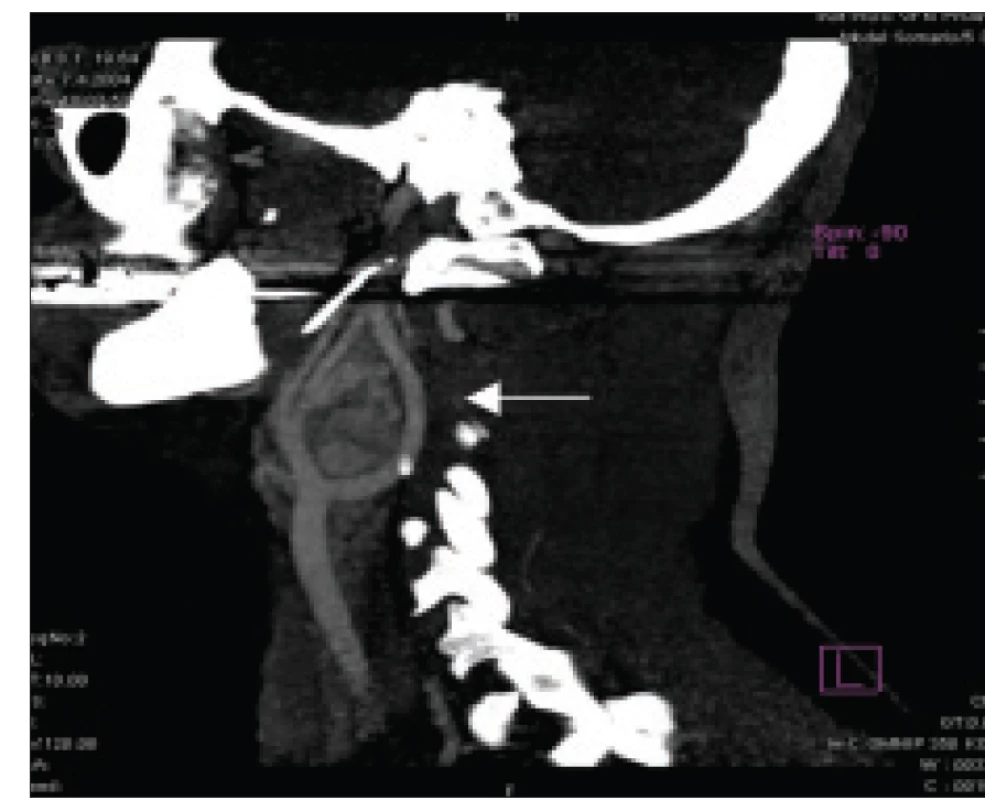
U nemocných s podezřením na extraadrenální lokalizaci feochromocytomu, u větších tumorů nad 5 cm anebo v případě podezření na vícečetné či metastatické feochromocytomy je indikováno vyšetření pomocí i.v. aplikace radiofarmaka 123I-metaiodobenzylguanidin (MIBG) spíše než 131I-MIBG, které má horší technickou kvalitu [10]. Některé látky (labetalol, tricyklická antidepresiva, kalciové blokátory) mohou interferovat s vychytáváním nebo retencí 123I-MIBG. V případě negativity 123I-MIBG vyšetření se doporučuje provést oktreotidový scan značený 111In anebo PET značený 18F-fluorodeoxyglukózou. Oba dva tyto posledně uváděné testy mají však nižší specificitu pro feochromocytom a nejsou proto doporučovány pro základní vyšetření. PET vyšetření pomocí 18F-fluorodopaminu má oproti MIBG scintigrafii (zejména v případě metastatických feochromocytomů) vyšší diagnostickou výtěžnost [19]. 18F-fluorodopamin (a podobné látky jako je 18F-fluorodopa či 11C-hydroxyefedrin) není však široce dostupný pro klinické využití.
Léčba
Benigní formy
Předoperační farmakologická léčba je nezbytná pro snížení rizika a komplikací operačního odstranění tumoru, protože emergentní resekce feochromocytomu má vysokou letalitu [10]. Farmakologická léčba se opírá o podávání selektivních blokátorů alfa1-receptorů (doxazosin, terazosin nebo prazosin). Prazosin má nevýhodu krátkého trvání biologického účinku. Fenoxybenzamin je neselektivní, nekompetitivní blokátor alfa-receptorů, avšak v současnosti není v ČR dostupný. Nejsou k dispozici žádné randomizované klinické studie, srovnávající fenoxybenzamin s prazosinem nebo doxazosinem.
Labetalol je kombinovaný beta - a alfa-blokátor, avšak u feochromocytomu je méně vhodný k předoperační farmakologické přípravě díky převažující blokádě beta-receptorů.
Betablokátory se podávají ke kontrole tachykardie a arytmií nejméně 24 hod po podání alfa-blokátorů. Podání betablokátorů v monoterapii může vést u feochromocytomu k presorické reakci až plicnímu edému díky neoponované alfa-receptory zprostředkované vazokonstrikci [4].
Blokátory kalciových kanálů (BKK) se mohou rovněž použít k inhibici katecholaminy zprostředkovaného uvolnění intracelulárního kalcia buď samotné (zejména u normotenzních forem feochromocytomu) anebo v kombinaci s alfa-blokátory [4,10]. Podání samotných BKK sice nevede k ortostatické hypotenzi, avšak je méně výhodné, protože nezabraňuje vzestupům TK u feochromocytomu [10].
Předoperační léčba pomocí alfa - (a potenciálně i beta-) blokátorů by měla být zahájena nejméně týden, lépe 10 - 14 dní před plánovaným chirurgickým řešením.
Zdá se, že typ použitého anestetika má pro kontrolu TK v průběhu operace až druhořadý význam [21]. Pro kontrolu hypertenzních špiček v průběhu operačního výkonu se používá izosorbiddinitrát, sodium nitroprussid anebo krátkodobě působící BKK. Pro kontrolu tachyarytmií je výhodný krátkodobě působící betablokátor esmolol.
Riziko pooperační hypotenze může být sníženo zvýšeným přísunem soli a tekutin. V pooperačním průběhu se může vyskytovat i hypoglykemie způsobená náhlou hyperinzulinemií.
Chirurgická léčba
V současné době se díky technickým pokrokům a přesné morfologické lokalizaci tumoru široce používá laparoskopické odstranění tumoru [22]. Laparoskopický přístup vede ve srovnání s konvenční operací k nižší pooperační morbiditě, k časnější rehabilitaci se zkrácením doby hospitalizace a ušetřením ekonomických nákladů [22,23]. V případě bilaterálních feochromocytomů se doporučuje provádět „nadledvinovou kůru šetřící“ (adrenal-cortex sparing) laparoskopickou operaci k prevenci nutnosti celoživotního podávání glukokortikoidů.
Prognóza nemocných po operaci je velmi dobrá, avšak u části nemocných může přetrvávat hypertenze, obvykle však již méně závažná ve srovnání s předoperačním obdobím [24]. Po operaci feochromocytomu se doporučuje provádět dlouhodobé sledování v pravidelných intervalech, neboť recidivy feochromocytomu se nacházejí u 17 % případů. Tyto recidivy jsou častější u extraadrenálních nebo familiárních forem.
Maligní formy
Feochromocytom je považován za maligní v případě přítomnosti metastáz chromafinní tkáně v jiných (neobvyklých) lokalizacích. Vyšší riziko malignity je u velkých nádorů, extraadrenálních či familiárních forem. Klinický průběh maligních forem bývá variabilní s 5letým přežíváním u 50 % osob.
Bohužel zatím neexistuje jednoznačně úspěšný způsob léčby maligních feochromocytomů. Nejvíce se osvědčuje chirurgické odstranění nádorové tkáně včetně metastáz. Konzervativní léčba pomocí alfablokátorů vede ke kontrole krevního tlaku a symptomů. Bylo popsáno zmenšení tumorózní tkáně po podání metyrozinu, inhibitoru syntézy katecholaminů. Léčba pomocí 131I-MIBG anebo chemoterapie pomocí cyklofosfamidu, vinkristinu a dakarbazinu zhoršuje kvalitu života a vede ke kompletní remisi jen u menšiny nemocných [10]. Podle některých pramenů mohou vysoké dávky 131I-MIBG prodloužit přežívání [25], bohužel nám však chybí kontrolní studie díky nízkému výskytu maligních forem feochromocytomu. Kostní metastázy mohou podle některých názorů příznivě reagovat na iradiaci nebo radiofrekventní ablaci [4,10].
Tato práce byla podpořena vědeckým záměrem MSM číslo 0021620817, 21620808 a 21620807.
prof. MUDr. Jiří Widimský, CSc., jr.
www.vfn.cz
e-mail: jwidi@lf1.cuni.cz
Doručeno do redakce: 27. 3. 2007
Zdroje
1. McNeil AR, Blok BH, Koelmeyer TD et al. Phaeochromocytoma discovered during coronial autopsies in Sydney, Melbourne and Auckland. Aust NZ J Med 2000; 30 : 648-652.
2. Strauch B, Zelinka T, Hampf M et al. Prevalence of primary hyperaldosteronism in moderate to severe hypertension in the Central Europe region. J Hum Hypertension 2003; 17 : 349-352.
3. Manger WM, Eisenhofer G. Pheochromocytoma: diagnosis and management update. Curr Hypertens Rep 2004; 6 : 477-484.
4. Kaplan NM. Clinical hypertension. Philadelphia: Lippincott, Williams&Wilkins 2006 : 1-518.
5. Zelinka T, Štrauch B, Pecen L et al. Diurnal blood pressure variation in pheochromocytoma, primary aldosteronism and Cushing’s syndrome. J Human Hypertension 2004; 18 : 107-111.
6. Zelinka T, Widimský J jr, Weisserová J. Diminished circadian blood pressure rhytm in patients with asymptomatic normotensive pheochromocytoma. Physiol Res 2001; 50 : 631-634.
7. Kikuya M, Hozawa T, Ohkubo T et al. Prognostic significance of blood pressure and heart rate variabilities. The Ohasama study. Hypertension 2000; 36 : 901-906.
8. Zelinka T, Štrauch B, Petrák O et al. Increased blood pressure variability in pheochromocytoma compared to essential hypertension patients. J Hypertens 2005; 23 : 2033-2039.
9. Neumann HP, Bausch B, Mc-Whinney SR et al. for the Freiburg-Warshaw-Columbus Pheochromocytoma Study Group. Germ-line mutations in nonsyndromic pheochromocytoma. N Engl J Med 2002; 346 : 1459-1466.
10. Lenders JWM, Eisenhofer G, Mannelli M et al. Pheochromocytoma. Lancet 2005; 366 : 665-675.
11. Amar L, Bertherat J, Baudin E et al. Genetic testing in pheochromocytoma or functional paraganglioma. J Clin Oncol 2005; 23 : 8812-8818.
11. Eisenhofer G, Bornstein SR, Brouwers FM et al. Malignant pheochromocytoma. Current status and initiatives for future progress. Endocr Rel Cancer 2004; 11 : 423-436.
12. Eisenhofer G, Keiser H, Friberg P et al. Plasma metanephrines are markers of pheochromocytoma produced by catechol-O-methyltransferase within tumors. J Clin Endocrinol Metab 1998; 83 : 2175-2185.
13. Lenders JW, Pacak K, Walther MM et al. Biochemical diagnosis of pheochromocytoma: which test is best? JAMA 2002; 287 : 1427-1434.
14. Goldstein DS, Eisenhofer G, Flynn JA et al. Diagnosis and localisation of pheochromocytoma. Hypertension 2004; 43 : 907-910.
15. Bravo EL, Tagle R Pheochromocytoma: state of the art and future prospects. Endocr Rev 2003; 24 : 539-553.
16. Kudva YC, Sawka AM, Young WF jr et al. The laboratory diagnosis of adrenal pheochromocytoma: the Mayo Clinic experience. J Clin Endocrinol Metab 2003; 88 : 4533-4539.
17. Bravo EL, Tarazi RC, Fouad FM et al. Clonidine-suppression test: a useful aid in the diagnosis of pheochromocytoma. N Engl J Med 1981; 305 : 623-626.
18. Eisenhofer G, Goldstein DS, Walther MM et al. Biochemical diagnosis of pheochromocytoma: how to distinquish true-from false positive results. J Clin Endocrinol Metab 2003; 88 : 2656-2666.
19. Mukherjee JJ, Peppercorn PD, Reznek RH et al. Pheochromocytoma: effect of nonionic contrast medium in CT on circulating catecholamine levels. Radiology 1997; 202 : 227-231.
19. Pacak K, Eisenhofer G, Carrasquillo JA et al. 6-(18F)fluorodopamine positron emission tomographic (PET) scanning for diagnostic localisation of pheochromocytoma. Hypertension 2001; 38 : 6-8.
20. Ilias I, Pacak K Current approaches and recommended algorithm for the diagnostic localisation of pheochromocytoma. J Clin Endocrinol Metab 2004; 89 : 479-491.
21. Prys-Roberts C Pheochromocytoma - recent progress in its management. Br J Anaesth 2000; 85 : 44-57.
22. Janetschek G, Finkenstdt G, Gasser R et al. Laparoscopic surgery for pheochromocytoma: adrenalectomy, partial resection, excision of paragangliomas. J Urol 1998; 160 : 330-334.
23. Sprung J, O’Hara JF jr, Gill IS et al. Anesthetic aspects of laparoscopic and open adrenalectomy for pheochromocytoma. Urology 2000; 55 : 339-343.
24. Plouin PF, Chatellier G, Fofol I et al. Tumour recurrence and hypertension persistance after successful pheochromocytoma operation. Hypertension 1997; 29 : 1133-1139.
25. Rose B, Matthay KK, Price D et al. High-dose 131I-MIBG therapy for 12 patients with malignant pheochromocytoma. Cancer 2003; 98 : 239-248.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2007 Číslo 4- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Předseda České internistické společnosti Richard Češka padesátníkem
- Prevalencia abdominálnej obezity na Slovensku. Štúdia IDEA Slovakia
- Dlouhodobé zkušenosti s infuzní léčbou treprostinilem u nemocných s plicní arteriální hypertenzí v České republice
- Vliv léčby fenofibrátem na rizikový profil nemocných s metabolickým syndromem a smíšenou dyslipidemií léčených ambulantně
- Molekulární genetika infarktu myokardu
- Chronická pankreatitida - etiologická klasifikace a diagnostická kritéria
- Adiponektin a ateroskleróza
- Představuje inhibitor reninu aliskiren nové výhledové možnosti v léčbě kardiovaskulárních onemocnění?
- Genetika dyslipidemií včera, dnes a zítra
- Smykové napětí v karotickém povodí a jeho role v rozvoji aterosklerózy
- Tyreopatie, dyslipidemie a kardiovaskulární rizika
- Jak ovlivňují kortikoidy, růstový hormon a estrogeny lipidy a aterosklerózu
- CRP - marker proinflamačního stavu a kardiovaskulárního rizika
- Sekundární dyslipidemie a jejich léčba
- Může být snížení klidové srdeční frekvence pro pacienty přínosné?
- Pravidelná aerobní pohybová aktivita zlepšuje lipidový profil u osob s vyšší než normální tělesnou hmotností
- Vedlejší účinky farmakoterapie na hladinu lipidů
- Intravenózní léčba akutního srdečního selhání
- Duální inhibice cholesterolu prostřednictvím přípravku ezetimib/simavastatin (Inegy®) - nejsnadnější cesta k dosažení cílových hodnot LDL-cholesterolu?
- Diagnostické a terapeutické postupy u feochromocytomu: současné trendy
- Lipoprotein (a)
- Obezita a metabolický syndrom - více otázek než odpovědí?
- Interna - co ji spojuje a co ji naopak rozděluje
- K osmdesátinám prof. MUDr. Ladislava Chrobáka, CSc.
- Šeberová Ester: Alergická rýma.
- Petrů V, Krčmová I.: Anafylaktická reakce.
- Beran J, Havlík J.: Pneumokokové nákazy a možnosti očkování proti nim.
- Štolfa J, Štork J et al.: Psoritická artritida a psoriáza.
- Keil R et al.: Gastroskopie.
- Astl J.: Chirurgická léčba nemocí štítné žlázy.
-
Chrobák L et al.: Propedeutika vnitřního lékařství.
Nové, zcela přepracované vydání doplněné testy. - Špinar J, Vítovec J et al.: Jak dobře žít s nemocným srdcem.
-
Šobrův den, XXIII. konference o hyperlipoproteinemiích
Praha, 7. června 2006
Abstrakta
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Lipoprotein (a)
- Jak ovlivňují kortikoidy, růstový hormon a estrogeny lipidy a aterosklerózu
- Vedlejší účinky farmakoterapie na hladinu lipidů
-
Chrobák L et al.: Propedeutika vnitřního lékařství.
Nové, zcela přepracované vydání doplněné testy.
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy





