-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Radiofrekvenční katetrová ablace paroxyzmální fibrilace síní konvenční metodou, bezprostřední a dlouhodobé výsledky
Immediate and long‑term results of conventionally performed radiofrequency catheter ablations of paroxysmal atrial fibrillation
Introduction:
Atrial fibrillation is the most frequent cardiac arrhythmia. Epidemiological studies show sharp increase of incidence and prevalence of atrial fibrillation all over the world. Atrial fibrillation is becoming to be a serious problem, not only clinical, but even social and economical. Aim of the paper was to evaluate immediate and long‑term results of radiofrequency catheter ablation of paroxysmal atrial fibrillation at Dpt. of Internal Medicine – Cardiology, University Hospital Brno.Methods:
The patients were indicated for ablation, when the anti‑arrhythmic therapy was ineffective. End-point of the ablation was disconnection of myocardial sleeves between left atrium and pulmonary veins and complete electrical isolation of pulmonary veins.Group of the patients, results:
There were 67 catheter ablations of paroxysmal atrial fibrillation performed within the years 9/2004 to 12/2006 at our department, out of the whole amount of 1,285 ablations of supraventricular tachyarrhythmias from 1995 to 2006. There were 27 women (40%) and 40 men (60%) in our group of patients, with the mean age 56.9 ± 9.5 years. The average ejection fraction of left ventricle was 62 ± 5%, left atrial dimension 42.8 ± 6 mm. The mean follow‑up period was 16.9 ± 10.9 months. The patients were treated before and after the ablation by 1 anti‑arrhythmic drug in 44.8 vs 50%, by 2 drugs in 40.3 vs 14.9% and by 3 drugs in 10.4 vs 9%, respectively. The percentage of patients without any anti‑arrhythmic drug increased after successful ablation from 2.9 to 25.4%, the percentage of patients using amiodarone decreased from 29.8 to 16.4%, propafenon from 29.8 to 16.4% and sotalol from 26.8 to 10.4% respectively. The median of RF application duration was 43.8 min, fluoroscopy time 43.8 min and procedure duration 240 min. The success rates were 87.5% in year 2004, 77.4% in 2005 and 79.2% in 2006.Conclusion:
Catheter ablation of paroxysmal atrial fibrillation has become a routine curative method in symptomatic patients without major structural heart disease, with ineffective anti‑arrhythmic treatment. Ablation was associated with significant reduction of anti‑arrhythmic and anticoagulation therapy.Key words:
atrial fibrillation – paroxysmal atrial fibrillation – radiofrequency catheter ablation – electrical isolation of pulmonary veins
Autori: R. Lábrová; M. Fiala; O. Toman; J. Špinar
Pôsobisko autorov: Interní kardiologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jindřich Špinar, CSc., FESC
Vyšlo v časopise: Vnitř Lék 2008; 54(10): 953-960
Kategória: Původní práce
Súhrn
Úvod:
Fibrilace síní je nejčastější srdeční arytmií. Epidemiologické studie ukazují vzestup incidence a prevalence fibrilace síní v celosvětové populaci, a tím se fibrilace síní stává velmi naléhavým problémem nejen klinickým, ale i sociálním a ekonomickým. Cílem práce bylo zhodnocení bezprostředních a dlouhodobých výsledků katetrové ablace paroxyzmální fibrilace síní na Interní kardiologické klinice LF MU a FN Brno‑Bohunice.Metodika:
K ablaci byli indikováni pacienti, u kterých selhala antiarytmická terapie. Cílovým momentem ablace je přerušení vedení myokardiálních snopců mezi levou síní a plicními žilami, a tím dosažení úplné elektrické izolace všech 4 plicních žil.Soubor pacientů a výsledky:
Z celkového počtu 1 285 ablací supraventrikulárních tachyarytmií z let 1995–2006 jsme na naší klinice provedli v období od září roku 2004 do prosince roku 2006 67 katetrových ablací paroxyzmálních fibrilací síní. V našem souboru bylo 27 žen (40 %) a 40 mužů (60 %), o průměrném věku 56,9 ± 9,5 let. Průměrná ejekční frakce levé komory byla 62 % ± 5, příčný rozměr levé síně 42,8 mm ± 6. Pacienti byli sledováni po dobu 16,9 ± 10,9 měsíců. Před a po ablaci medikovali jedno antiarytmikum 44,8 vs 50,7 %, dva léky 40,3 vs 4,9 %, tři léky 10,4 vs 9 %. Po úspěšné ablaci se zvýšil počet pacientů bez léků z 2,9 % na 25,4 %, snížil se počet pacientů, kteří medikovali amiodaron z 38,8 % před na 20,9 % po ablaci, propafenon z 29,8 % na 16,4 % a sotalol z 26,8 % na 10,4 %. Medián délky aplikací radiofrekvenční energie byl 48 min, délky radiačního času 43,8 min, délky výkonu 240 min. V roce 2004 jsme měli úspěšnost 87,5 %, v roce 2005 77,4 %, v roce 2006 79,2 %.Závěr:
Katetrová ablace paroxyzmální fibrilace síní se stává již rutinní léčebnou metodou u symptomatických pacientů bez významného strukturálního onemocnění srdce a rezistentních na antiarytmickou terapii. Po ablaci došlo ke statisticky významné redukci podávání antiarytmické a antikoagulační terapie.Klíčová slova:
fibrilace síní – paroxyzmální fibrilace síní – radiofrekvenční katetrová ablace – elektrická izolace plicních žilÚvod
Rostoucí epidemie fibrilace síní (FS) je spojena se zvýšenou morbiditou a mortalitou. Na vzniku FS se podílí řada rizikových faktorů včetně stárnutí populace, tromboembolizmu, městnavého srdečního selhání, hypertenze, diabetu mellitu, chlopenních vad, ischemické choroby srdeční. Mezi nové rizikové faktory patří systémový zánět, obezita a metabolický syndrom, obstrukční spánková apnoe, diastolická dysfunkce levé komory a arteriální rigidita. Který z těchto faktorů má největší význam, není zatím zcela jasné [7, 11,24,29]. Fibrilace síní zhoršuje srdeční selhání u již existujícího strukturálního postižení srdce. Ale FS samotná může být příčinou srdečního selhání z důvodu elektrické, strukturální a mechanické remodelace myokardu. Mortalita u pacientů s FS je asi 2krát vyšší než u pacientů bez arytmie, se sinusovým rytmem. Hlavní příčinou mortality jsou kardioembolické mozkové příhody [5,20,28].
Antiarytmická terapie ke snížení rekurence fibrilace síní je málo účinná, často je nutná až dvoj - či trojkombinace farmakologické terapie, což s sebou nese riziko proarytmického efektu. Někdy kombinovaná antiarytmická terapie působí pouze dočasně. Proto při neúčinnosti nebo při nemožnosti podání antiarytmik z důvodu nežádoucích účinků volíme u symptomatické paroxyzmální nebo perzistentní fibrilace síní invazivní terapii – radiofrekvenční katetrovou ablaci (RFA) [12].
Při úspěšné radiofrekvenční katetrové ablaci paroxyzmální FS dochází ke kompletní elektrické izolaci ektopické elektrické aktivity ve všech 4 plicních žilách od myokardu levé síně. Elektrická aktivita – spouštěcí ektopie – zůstane izolovaná v plicní žíle a nemůže přejít na myokard levé síně a tím se nespustí fibrilace síní. Ablace se stává již rutinní léčebnou metodou u pacientů většinou bez organického postižení srdce.
Cílem práce bylo vyhodnocení bezprostředního a dlouhodobého sledování pacientů po radiofrekvenční katetrové ablaci paroxyzmální fibrilací síní v období od září roku 2004 do prosince roku 2006 na Interní kardiologické klinice LF MU a FN Brno, pracoviště Bohunice.
Soubor nemocných a metodika
Od roku 1995 do prosince roku 2006bylo provedeno na Interní kardiologické klinice FN Brno celkem 1 285 RFA supraventrikulárních tachyarytmií. V roce 2006 tvořily ablace FS 13 % všech ablací SV tachyarytmií, v roce 2007 již 24 %.
Od září roku 2004 do prosince roku 2006 podstoupilo katetrovou ablaci paroxyzmální FS celkem 67 pacientů, z toho bylo 27 žen (40 %) a 40 mužů (60 %) (tab. 1). Průměrný věk byl 56,9 ± 9,5 let. Průměrná doba s atakami paroxyzmů fibrilace síní byla 5,9 ± 5,1 let. Většina pacientů s paroxyzmální FS byla bez organického postižení srdce, pouze u 3 pacientů byla tachykardická kardiomyopatie s lehce sníženou ejekční frakcí levé komory (tab. 2). Z nejčastějších rizikových faktorů se vyskytovala arteriální hypertenze u 72 % pacientů.
Tab. 1. Zastoupení pohlaví v souboru pacientů. 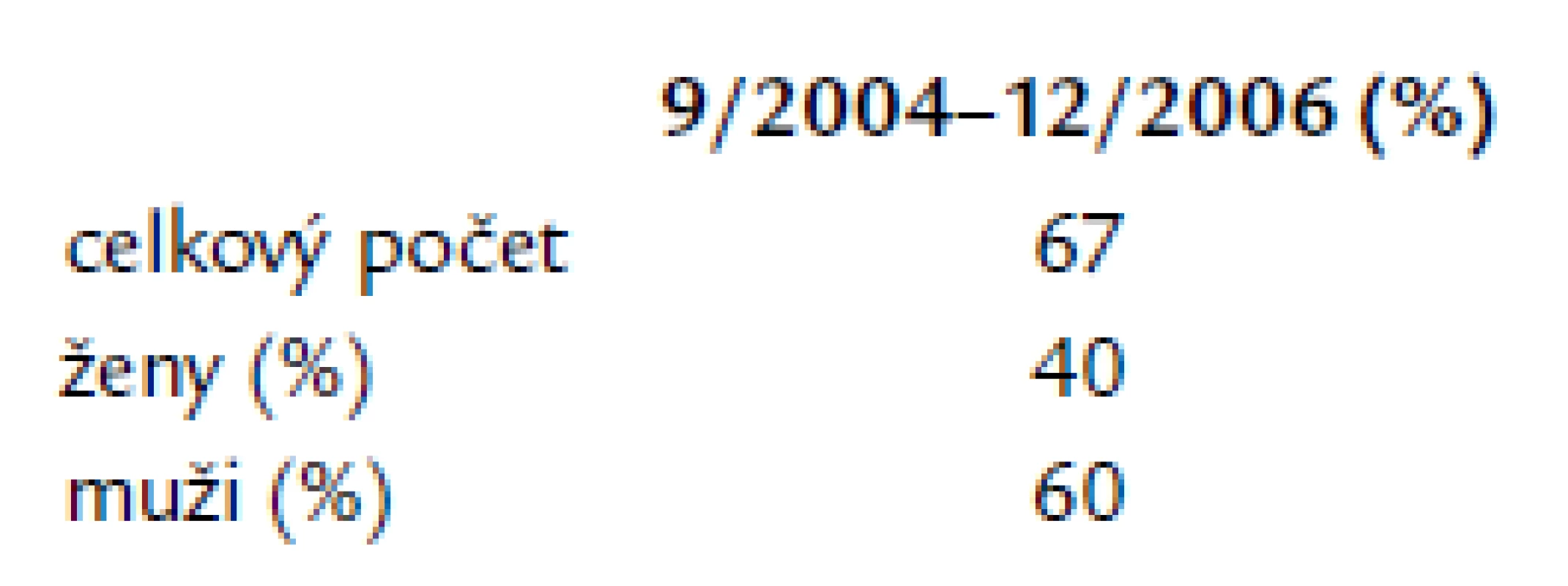
Předablační příprava
Pacienti byli nejméně 4 týdny před ablací účinně antikoagulováni (INR bylo v rozmezí 2–3). Pět dnů před výkonem byl warfarin vysazen a následující den se aplikoval nízkomolekulární he-pa-rin v plné terapeutické dávce. V den výkonu bylo INR pod 1,5. Po transseptální punkci se aplikoval bolus he-pa-rinu v dávce 80 IU/kg váhy pacienta a následně byl he-pa-rin podáván v kontinuální infuzi během celého výkonu, kdy se aktivovaná doba srážení (ACT) držela v rozmezí 300–400 s.
Všichni pacienti byli seznámeni s charakterem ablačního výkonu v levé síni, včetně možných komplikací. Před zákrokem nemocní podepisovali informovaný souhlas s výkonem.
Jícnové echokardiografické vyšetření srdce (TEE)
TEE se provádělo den před zákrokem k vyloučení trombů v levé síni, ke zhodnocení funkce levé komory, velikosti levé síně a přineslo informace o uložení a velikosti plicních žil. Kontrolní TEE jsme prováděli 4.–5. týden po zákroku – ke zhodnocení přítomnosti či nepřítomnosti trombů v levé síni a vyloučení stenózy plicních žil.
Transtorakální echokardiografické vyšetření
Transtorakální echokardiografické vyšetření jsme prováděli po zákroku se zaměřením na přítomnost či nepřítomnost perikardiálního výpotku.
Elektrofyziologické vyšetření (EFV)
K EFV jsme zaváděli desetipolární vyšetřovací katétr (Daig, St. Jude) do koronárního sinu. Po dvojnásobné transseptální punkci jsme zaváděli do levé síně a plicních žil mapovací cirkulární katétr a ablační katétr (obr. 1). Před zahájením ablace byla provedena angiografie plicních žil ke stanovení anatomie a velikosti průměru plicních žil a k upřesnění lokalizace přechodu ústí plicních žil do síňového myokardu. Podle angiografie jsme potom optimálně umístili mapovací cirkulární katétr (obr. 2).
Obr. 1. RTG snímek srdce v levé šikmé projekci. 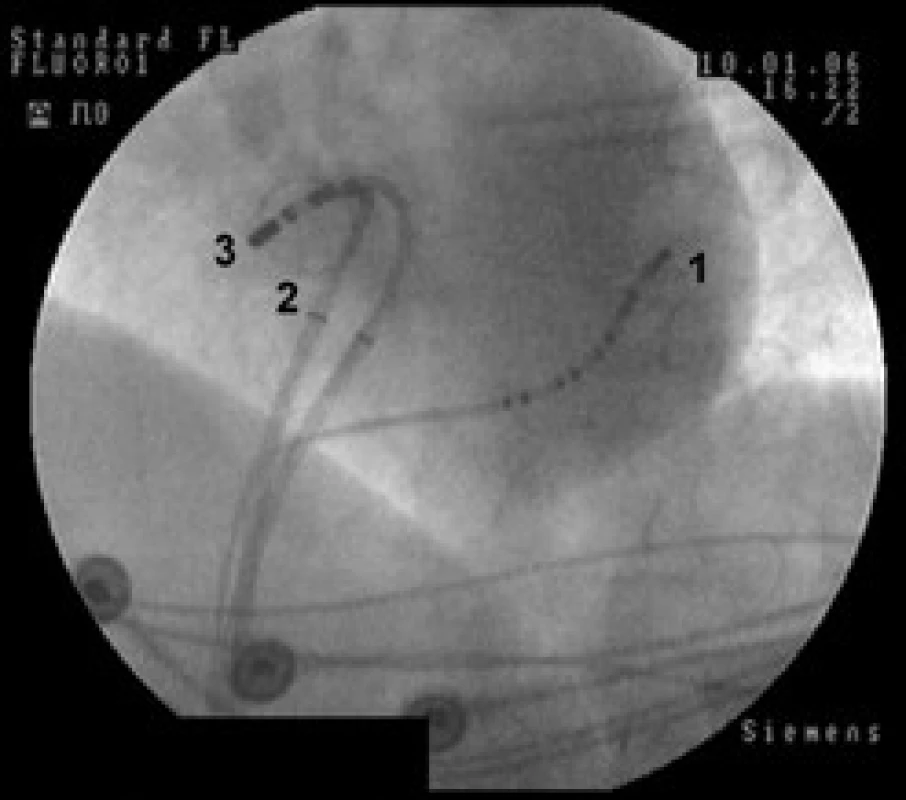
1 – vyšetřovací katétr v koronárním sinu, 2 – mapovací Lasso katétr v ústí pravé dolní plicní žíly, 3 – ablační katétr v ústí pravé dolní plicní žíly Obr. 2. RTG snímek srdce v levé šikmé projekci znázorňuje průběh levé horní a dolní plicní žíly. 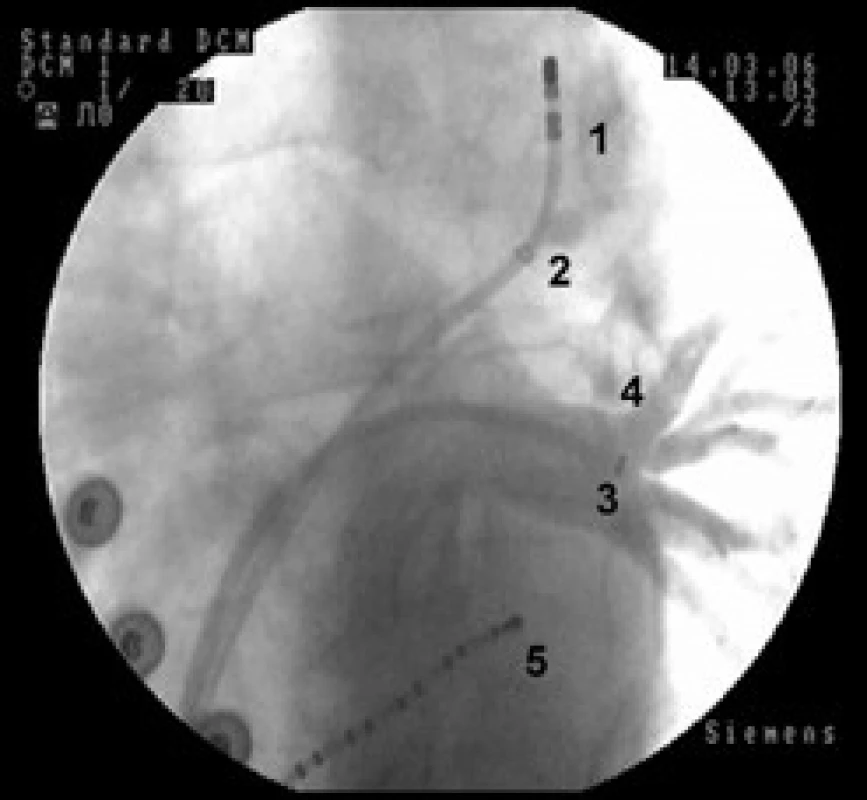
1 – ablační katétr zasunutý hluboko do levé horní plicní žíly, 2 – sheat zasunutý do levé horní plicní žíly, 3 – sheat zasunutý do ústí levé dolní plicní žíly, 4 – angiogram levé dolní plicní žíly, 5 – vyšetřovací katétr v koronárním sinu RFA flutteru síní I. typu
Pokud byl sinusový rytmus v době výkonu, prováděli jsme ještě před izolací plicních žil radiofrekvenční ablaci kavotrikuspidálního istmu s cílovým momentem obousměrného bloku. Pokud se výkon prováděl za běžící fibrilace síní, potom jsme prováděli ablaci istmu až po nastolení sinusového rytmu po elektrické izolaci všech plicních žil.
RFA izolace plicních žil
Použili jsme konvenční metodu podle pracoviště v Bordeaux, přičemž se neměnila strategie ani technika výkonu. Cirkulární mapovací katétr Lasso firmy Biosense Webster nebo balónkový Mesh katétr firmy Bard jsme zaváděli postupně do ústí všech plicních žil, kde se snímala elektrická aktivita. Vlastní ablaci jsme prováděli 7 F katétrem s chlazenou 4mm koncovou elektrodou firmy Biosense Webster. Rychlost průtoku fyziologického roztoku v katétru jsme nastavovali na 17–25, resp. až maximálně 30–35 ml/min. Průtok chlazení jsme řídili tak, aby teplota nepřesáhla 43 °C a výkon se pohyboval od 15 do 30 W. Používali jsme ablační přístroj Stockert firmy Biosense Webster a stimulátor UHS 20 firmy Biotronik.
RFA se prováděla za běžící fibrilace síní nebo při sinusovém rytmu či za stimulace síní. Během RFA se přerušovalo elektrické vedení myokardiálních snopců, které spojují svalovinu levé síně a plicní žíly, a tím došlo k elektrické izolaci plicní žíly.
Na konci každého ablačního výkonu se kontrolovaly postupně izolace jednotlivých plicních žil mapovacím katétrem. Pokud se ještě určitá elektrická aktivita plicní žíly objevila, aplikovali jsme další RF energii do oblasti ústí plicní žíly k dokončení elektrické izolace.
Cílový moment RFA
Během aplikace RF energie dochází postupně k vymizení elektrické aktivity snímané v plicní žíle (obr. 3, 4 a 5). Jednalo se o segmentální ablaci v oblasti ústí plicních žil, kdy jsme nemuseli aplikovat radiofrekvenční energii kolem celého obvodu [2,8,9]. Pokud běžela paroxyzmální fibrilace síní, izolací arytmogenní plicní žíly se většinou arytmie ukončila a nastolil se sinusový rytmus. Cílovým momentem výkonu byla elektrická izolace všech čtyř plicních žil.
Obr. 3. Intrakardiální EKG záznam před RF ablací paroxyzmální FS – za stimulace z koronárního sinu. V Lasso katétru jsou téměř splynulé signály z levé síně (A) a plicní žíly (PŽ). 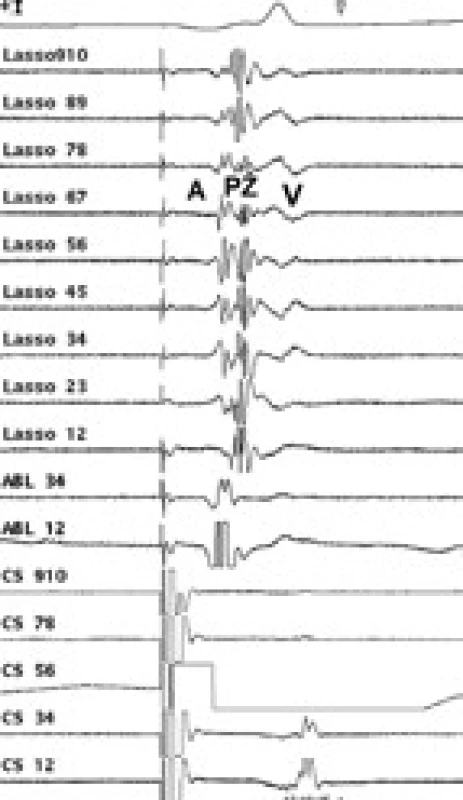
Obr. 4. Intrakardiální EKG záznam za stimulace z koronárního sinu během aplikace radiofrekvenční energie. 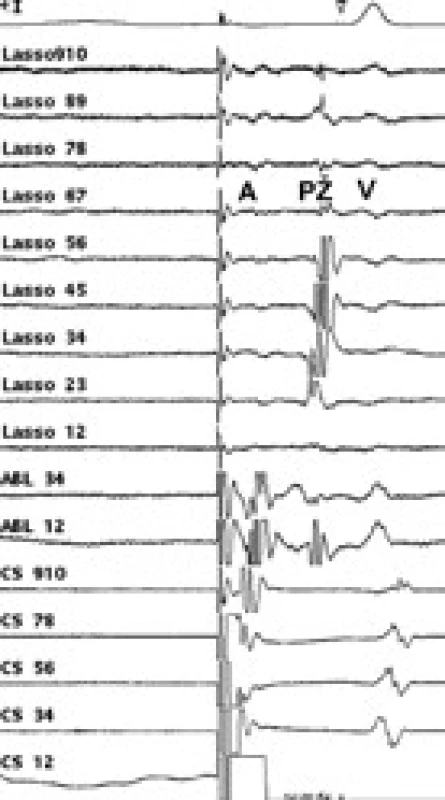
V Lasso katétru dochází k částečné elektrické izolaci plicní žíly, kdy dochází na intrakardiálním EKG záznamu k oddálení elektrického signálu z plicní žíly (PŽ) od elektrického signálu ze síně (A). Obr. 5. A: V Lasso katétru vidíme ještě další oddálení elektrické aktivity z plicní žíly (PŽ), kdy se aktivita z plicní žíly dostává až za elektrický signál komory (V). B: Elektrická izolace plicní žíly, kdy v Lasso katétru jso u signály ze síně (A) a komory (V) a již chybí elektrický signál z plicní žíly. 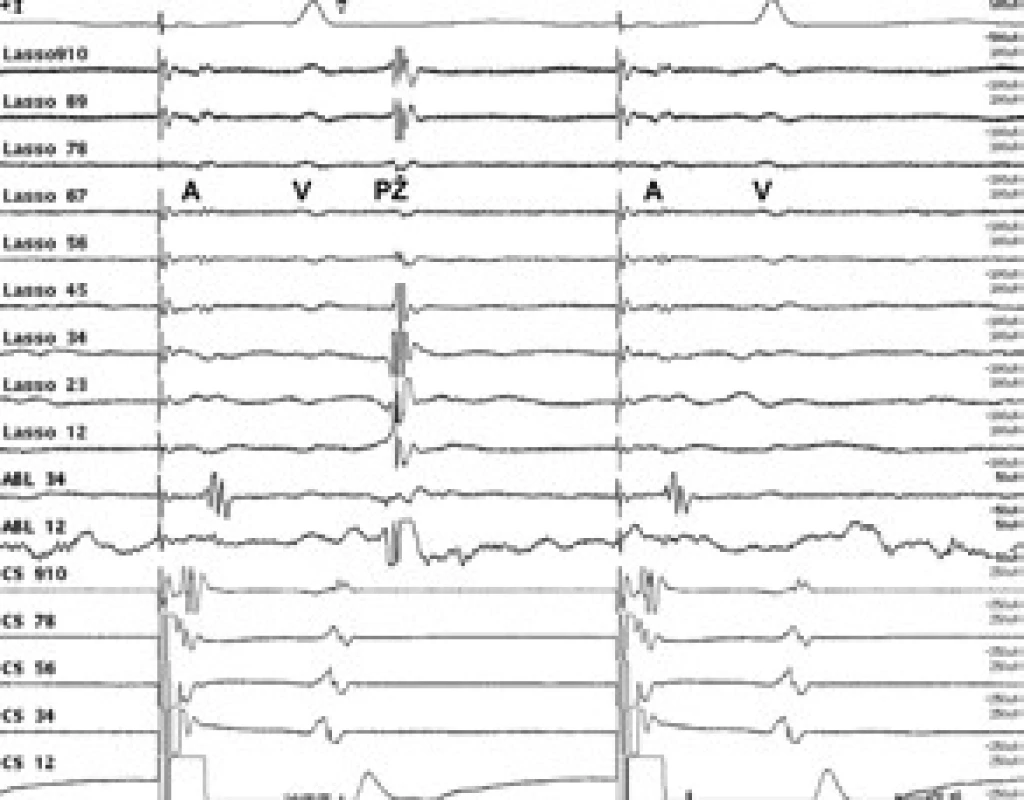
Vysvětlivky pro obr. 3, 4 a 5: A – elektrický potenciál síně, PŽ – elektrický potenciál plicní žíly, V – elektrický potenciál komory, Lasso – elektrické potenciály z cirkulárního katétru, umístěného v ústí plicní žíly, ABL – záznam elektrických signálů z ablačního katétru, CS – záznam elektrických signálů z levé síně, snímané vyšetřovacím katétrem zavedeným do koronárního sinu Ambulantní sledování
Ambulantní sledování se provádělo v 1. roce po zákroku 1., 3., 6., 9. a 12. měsíc, v dalších letech potom po 1/2 roce nebo při potížích. Hodnotila se anamnéza recidivujících FS, dokumentace od sektorových kardiologů, EKG, EKG Holterovo či jiné EKG monitorování. FS v délce nad 30 s byla považována za recidivu.
Terapeutická strategie po výkonu
Po výkonu se začal aplikovat nízkomolekulární heparin až do účinné antikoagulace warfarinem. Antikoagulaci jsme ponechali většinou do 3. měsíce po zákroku, a pokud po ablaci paroxyzmy FS nebyly přítomné, potom jsme warfarin vysadili. Pokud paroxyzmy FS přetrvávaly nebo před zákrokem nebyly zjevné symptomy při běžící arytmii, bylo nutné zvážit vysazení či ponechání warfarinu. Pokud se jednalo o rizikové pacienty z hlediska tromboembolie, antikoagulaci jsme nevysazovali.
Následujících 6–12 týdnů po výkonu jsme ponechali redukovanou antiarytmickou terapii. Pokud byl pacient bez symptomatických paroxyzmů FS a během EKG Holterova monitorování nebyly zaznamenány významné FS, potom jsme antiarytmickou terapii vysadili. Jestliže se v dalším klinickém sledování FS objevila, nasazovali jsme méně agresivní antiarytmickou terapii, a to i tu, která byla před ablací neúčinná. Pokud byli pacienti na této antiarytmické terapii bez recidiv FS, nasazenou léčbu jsme ponechali. Jestliže se v poablačním období objevily klinicky významné recidivy FS, které bylo nutné řešit nasazením dvoj - až trojkombinace antiarytmické terapie, a přesto se recidivy FS objevovaly, navrhovali jsme katetrovou ablaci opakovat.
Statistické hodnocení
Číselné hodnoty jsou vyjádřeny jako průměr ± směrodatná odchylka nebo jako medián. Ke statistickému zhodnocení byl použit χ2, ev. Fischer exact test.
Výsledky
Výsledky sledovaných parametrů byly hodnoceny k prosinci roku 2007. Průměrná doba sledování pacientů po konvenční ablaci byla 16,9 ± 10,9 (12–39) měsíců. Nejkratší doba sledování – 12 měsíců – byla u pacientů, kteří podstoupili zákrok v prosinci roku 2006.
Přítomnost rizikových faktorů vzniku fibrilace síní
Nejčastějším rizikovým faktorem vzniku paroxyzmální FS je v našem souboru hypertenze, která se vyskytuje u pacientů, kteří podstoupili invazivní řešení arytmie u 72 % (tab. 3).
Tab. 2. Přítomnost rizikových faktorů vzniku fibrilace síní. 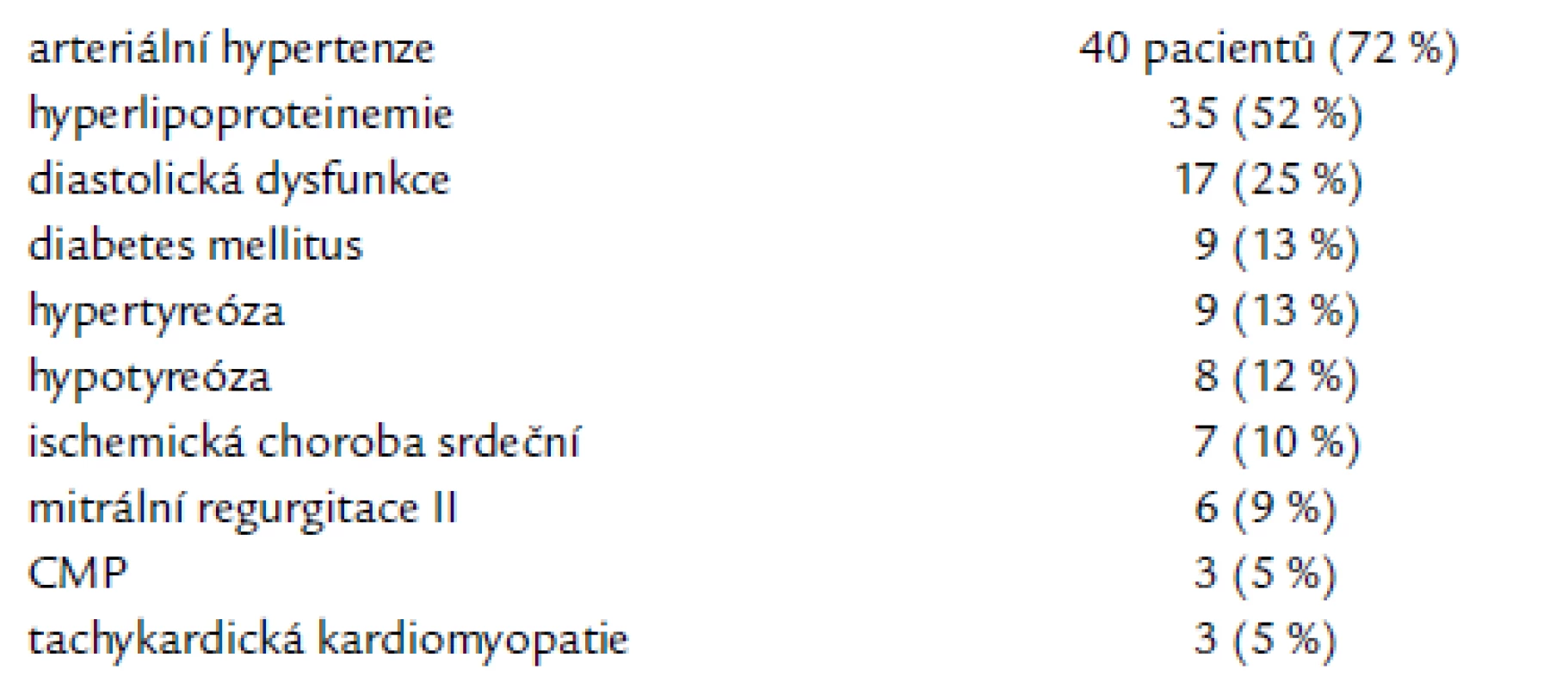
Antiarytmická léčba před katetrovou ablací paroxyzmální fibrilace síní
Bez antiarytmické terapie před invazivním zákrokem byli pacienti, kteří medikaci netolerovali z důvodu amiodaronové tyreopatie, fotosenzitivity či ukládání depozit v rohovce nebo u nichž byla přítomna významná bradykardie (tab. 4). Nejčastěji pacienti medikovali beta‑blokátory a amiodaron (tab. 5), ev. kombinaci amiodaronu a beta‑blokátorů.
Tab. 3. Antiarytmická léčba před katetrovou ablací. 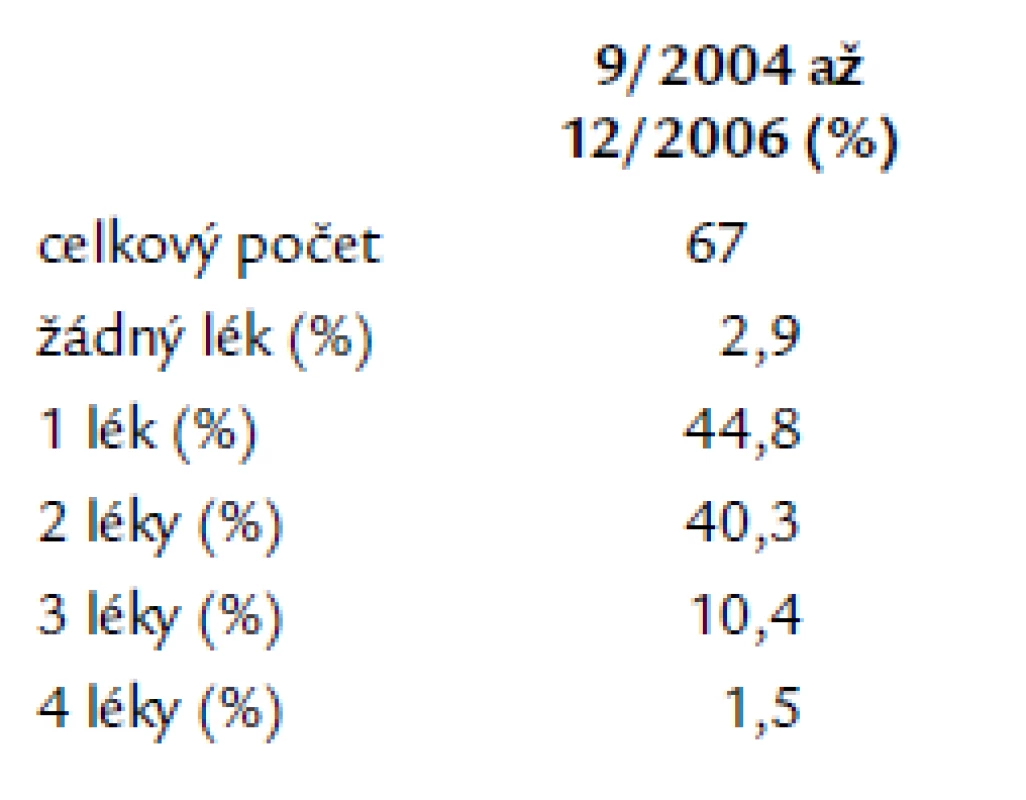
Tab. 4. Nejčastější antiarytmika před ablací. 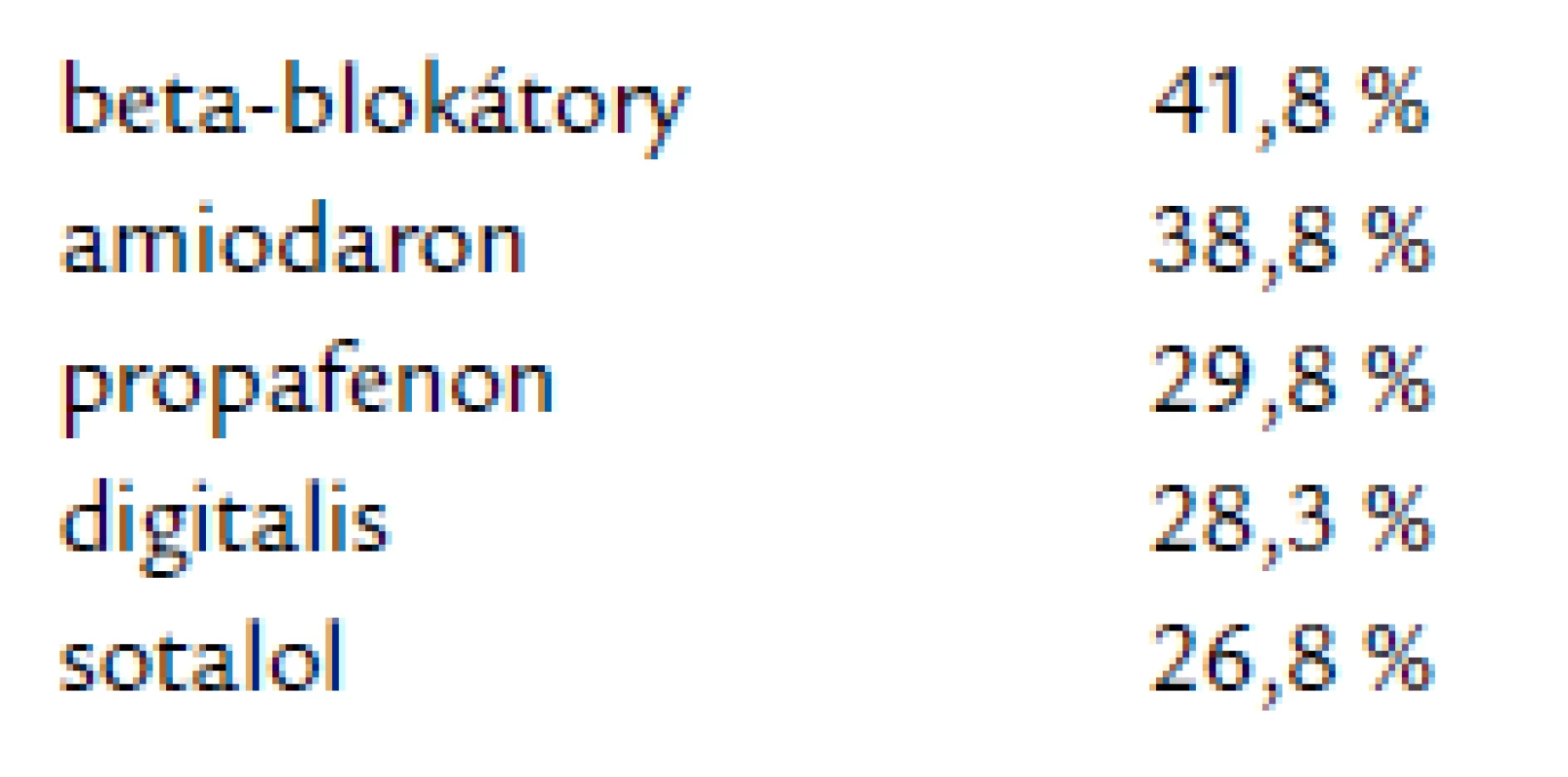
Antiarytmická léčba po katetrové ablaci paroxyzmální fibrilace síní
Po RF ablaci paroxyzmální fibrilace síní došlo ke zvýšení počtu pacientů, kteří nemedikovali žádné antiarytmikum z 2,9 na 25,4 %, tedy 1/4 pacientů byla již hned po zákroku bez antiarytmické terapie. Polovina pacientů medikovala pouze jedno antiarytmikum a o 25,4 % se snížil počet pacientů, kteří užívali dvě antiarytmika (tab. 6). Po invazivním řešení paroxyzmální FS pacienti nejčastěji medikovali beta‑blokátory v 35,8 %. Užívání amiodaronu se snížilo téměř na 1/2, z 38,8 % na 20,9 % (tab. 7).
Tab. 5. Antiarytmická léčba po katetrové ablaci. 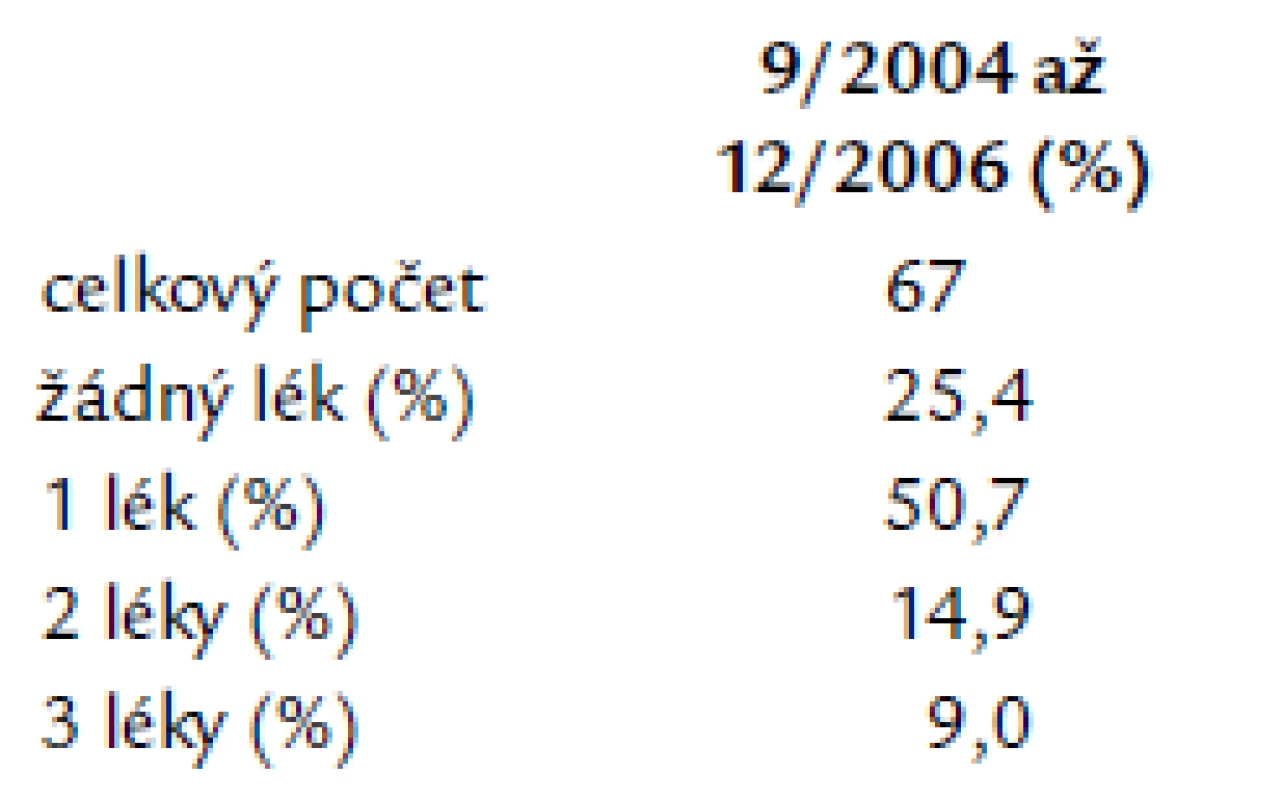
Tab. 6. Nejčastější antiarytmika po ablaci. 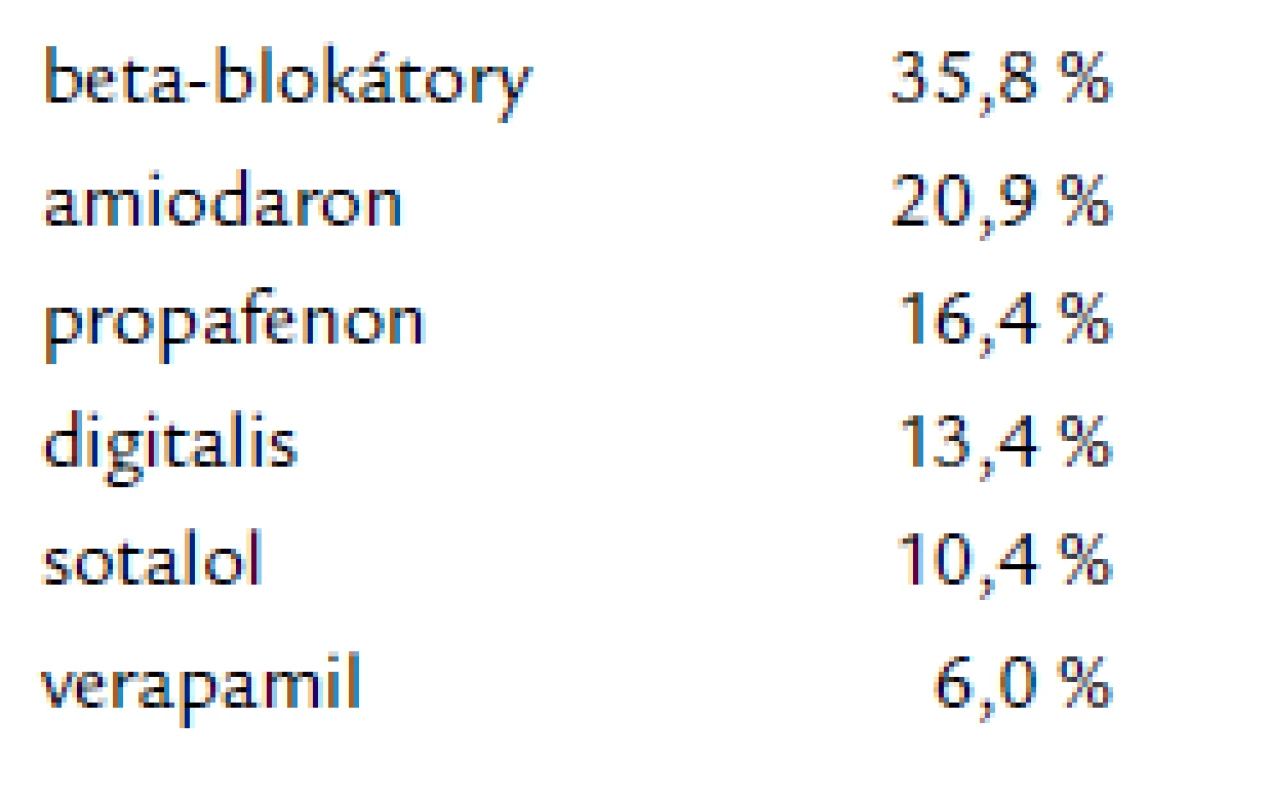
Srovnání počtu antiarytmik před a po ablaci paroxyzmální FS
Po katetrové ablaci je statisticky významně (p < 0,05) více pacientů bez antiarytmické terapie (tab. 8). Není statisticky významný rozdíl v užívání jednoho léku po ablaci, ale většinou vysazujeme antiarytmika III. třídy a nasazujeme méně agresivní antiarytmikum. Po katetrové ablaci medikuje statisticky významně méně (p < 0,05) pacientů dvojkombinaci antiarytmické terapie. Není rozdíl v podávání tří léků u pacientů před a po katetrové ablaci. Trojkombinaci antiarytmik medikují někteří pacienti po neúspěšném zákroku.
Tab. 7. Srovnání počtu antiarytmik před a po katetrové ablaci. 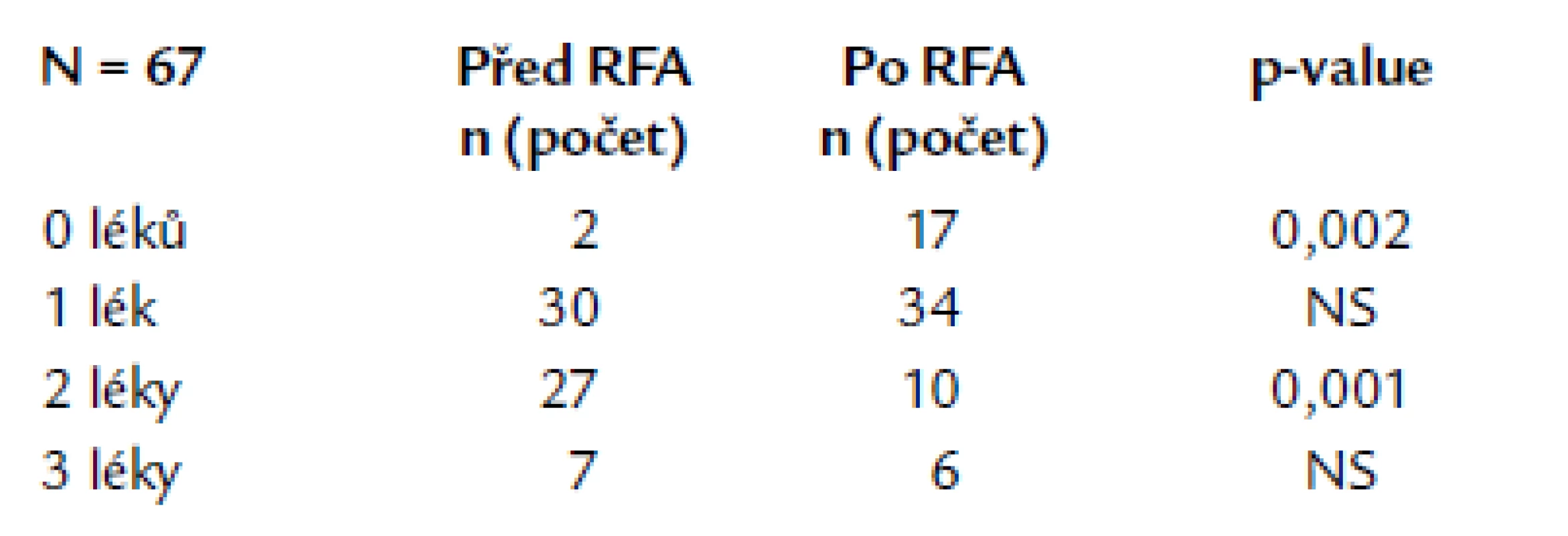
Srovnání typů antiarytmik před a po ablaci paroxyzmální FS
Po segmentální elektrické izolaci plicních žil se nemění pouze užívání beta‑blokátorů (tab. 9), ale pacienti statisticky významně (p < 0,05) méně medikují antiarytmika III. třídy – amiodaron a sotalol, ale i digitalis a propafenon.
Tab. 8. Srovnání antiarytmik před a po katetrové ablaci. 
Antikoagulační terapie před a po katetrové ablaci
U pacientů se symptomatickou paroxyzmální fibrilací síní, kteří podstupují katetrovou ablaci, jsou většinou paroxyzmy velmi časté a dlouhé, takže je u nich nutná trvalá antikoagulační terapie. Po katetrové ablaci užívalo warfarin 42 % pacientů, kyselinu acetylsalicylovou 46 % a bez antiagregační a antikoagulační terapie bylo 12 % pacientů.
Bezprostřední a dlouhodobá úspěšnost RF ablace
Bezprostřední úspěšnost po ablačním výkonu byla 96 %.
Dlouhodobá úspěšnost RF ablace konvenční metodou se v našem souboru pohybovala mezi 77 a 88 % (tab. 10). Opakovaným zákrokem se úspěšnost ještě zvyšuje.
Tab. 9. Úspěšnost katetrové ablace paroxyzmální fibrilace síní. 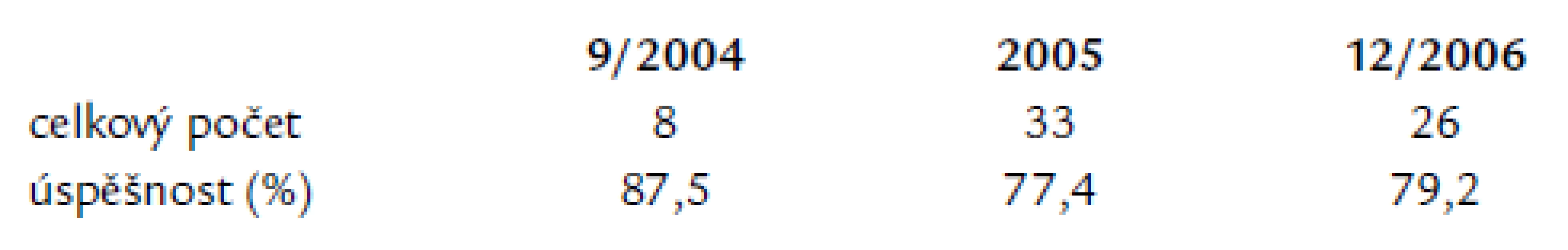
Pokud se po třech měsících po zákroku objevovaly paroxyzmy FS i přes nasazenou kombinovanou antiarytmickou terapii, doporučili jsme reablaci. Re RFA podstoupilo 5 pacientů, což je 7,5 %.
Délka výkonu, radiačního času a počtu aplikací radiofrekvenční energie
Medián délky výkonu byl 240 min, medián délky radiačního času 44 min a medián délky aplikací RF energie byl 48 min.
Komplikace
Vážnější komplikace jsme měli u 2 pacientů, ale byly zvládnuty bez trvalých následků. U jedné pacientky vznikla embolizace do mozečku s nutnou přechodnou drenáží pro edém mozku. U jedné pacientky vznikl do 48 hod od zákroku hemoperikard, který byl řešen chirurgicky bez nutnosti sutury myokardu.
U 2 pacientů byla embolizace do centrálního nervového systému charakteru tranzitorní ischemické ataky. U 2 pacientů jsme zaznamenali přechodné elevace ST‑T úseků, v jednom případě ve svodech II, III, aVF, v druhém případě v hrudních svodech V1–5. Elevace ustoupily do 10, resp. 15 min. U těchto pacientů byla transtorakální echokardiogragie i selektivní koronarografie negativní. U 2 pacientů byla zjištěna nevýznamná stenóza jedné plicní žíly do 35 %, nedošlo k rozvoji plicní hypertenze a pacienti byli bez subjektivních potíží.
Diskuze
V našem souboru byli pacienti s paroxyzmální FS, bez přítomného organického postižení srdce. U těchto symptomatických pacientů nebyla nalezena účinná antiarytmická terapie k udržení sinusového rytmu, a proto byli léčeni invazivně. Byla použita konvenční katetrová ablace podle pracoviště v Bordeaux s cílovým momentem elektrické izolace všech 4 plicních žil. Touto metodou se izolují ektopické elektrické aktivity v plicních žilách, proto po úspěšné ablaci se elektrická aktivita z plicních žil nešíří do levé síně a nedochází ke spuštění paroxyzmů FS. Pacienti s paroxyzmální FS mají většinou normální nebo lehce dilatovanou levou síň, kdy ještě nedochází k významné elektrické a funkční remodelaci levé síně, kdy se nevyskytují, nebo se vyskytují pouze ojediněle, reentry okruhy ve volné stěně levé síně, které slouží k udržení fibrilace síní.
Pokud nenajdeme u paroxyzmální FS účinnou antiarytmickou terapii, volíme invazivní terapeutický přístup. To znamená, že FS by se měla léčit již ve stadiu paroxyzmální formy, kdy ještě není přítomná významná remodelace síní. Úspěšná elektrická izolace plicních žil v tomto časném období nám dává větší pravděpodobnost, že udržíme sinusový rytmus. Pokud zabráníme recidivám paroxyzmální FS, zabráníme tím vzniku elektrické a funkční remodelaci síní. Zabráníme vzniku bludného kruhu fibrilace síní. Remodelovaná síň nám prodlužuje trvání fibrilace síní a u déle trvající fibrilace síní – u perzistentní či permanentní formy fibrilace síní – se zase prohlubuje remodelace síní.
Mezi nejčastější příčiny dilatace síní s následnou fibrotizací její stěny je hypertenze, dále chlopenní srdeční vady a ischemická choroba srdeční [15,17,22]. V našem souboru měly téměř 3/4 pacientů, 72 %, hypertenzi, více než polovina, 52 %, mělo hyperlipoproteinemii, 10 % ischemickou chorobu srdeční a 9 % mitrální regurgitaci II. stupně.
Diastolická dysfunkce je běžným projevem stárnutí a je většinou spojena s hypertenzí, obezitou, diabetem a ischemickou chorobou srdeční. Ve studii u pacientů ve věku ≥ 65 let s těžkou diastolickou dysfunkcí byl zjištěn vznik FS u 20 % pacientů v 5letém sledování [19,23]. V našem souboru měla dia-stolickou dysfunkci jedna čtvrtina, 25 %, pacientů a 13 % pacientů mělo diabetes mellitus. Zvětšení objemu levé síně bývá spojeno se zhoršováním diastolické dysfunkce a poskytuje další prediktivní informaci o vývoji vzniku FS a mozkové příhody [19,23]. Zvýšené napětí síně a její dilatace zvyšuje náchylnost síně ke vzniku FS.
Velmi častým rizikovým faktorem vzniku FS je porucha funkce štítné žlázy. Dysfunkce štítné žlázy může být navozena i chronickým užíváním amiodaronu, který podáváme jako velmi účinné antiarytmikum v léčbě FS. Ně-kte-ré studie ukazují, že i subklinická hypertyreóza výrazně zvyšuje riziko vzniku FS [6]. V našem souboru byla čtvrtina, 25 %, pacientů s poruchou funkce štítné žlázy, 13 % pacientů s hypertyreózou a 12 % s hypotyreózou na substituční hormonální terapii.
V našem souboru převažovala FS více u mužů než u žen podobně jako v souboru pacientů s FS ve studii z Velké Británie [21]. V našem souboru představovali muži 60 %. Proč se vyskytuje FS častěji u mužů, není přesně známo.
Všechny výkony jsme prováděli ablačním katétrem s chlazenou koncovou elektrodou. Při protékání fyziologického roztoku ablačním katétrem je menší riziko vzniku trombu a výkon je méně bolestivý [14,27]. Výhodou použití tohoto katétru bylo dosažení hlubší ablační léze za kratší dobu a během aplikace RF energie nedocházelo ke karbonizaci na konci ablačního katétru.
Pokud nedošlo k přerušení fibrilace síní po elektrické izolaci všech 4 plicních žil, pak se většinou jednalo o komplexní arytmogenní substrát v levé síni s možným podílem i v pravé síni. Proto v druhé době bylo nutné provést rozsáhlejší ablační výkon za pomocí trojrozměrného elektroanatomického mapování systémem CARTO, kdy se nejdříve provedla elektroanatomická rekonstrukce levé síně a plicních žil a kromě širších obkružujících lézí plicních žil jsme provedli další lineární léze, které přerušují reentry okruhy v levé síni, které slouží k udržení arytmie [25].
U pacientů s paroxyzmální FS, řešenou konvenční invazivní léčebnou metodou, je podle dostupné literatury riziko vzniku významné stenózy plicních žil 0,5–2 %, kdy za významnou je považována stenóza, která dosahuje zúžení původního průměru plicní žíly 50 % a podle některých autorů 70 % a více [13,18]. V našem souboru byla u všech 67 pacientů provedena kontrolní TEE za 4–6 týdnů po katetrové ablaci. U dvou pacientů byla zjištěna stenóza jedné plicní žíly, která byla 30–35%, tedy podle anatomické definice nevýznamná. Klinicky byli pacienti asymptomatičtí, podle transtorakálního echokardiografického vyšetření se nerozvinula plicní hypertenze.
U dvou pacientů došlo během výkonu k přechodným elevacím ST‑T úseků, ale bez průkazu akutní koronární léze. Etiologicky se jedná zřejmě o drobný trombus, který vzniká během invazivního výkonu. Vzhledem k tomu, že se výkon provádí za kontinuálního podávání heparinu, dochází k rychlému rozpuštění tohoto drobného trombu. S malou pravděpodobností by se mohlo etiologicky jednat o spazmus koronární tepny nebo ev. o vzduchovou mikroembolii.
Vzhledem k většímu riziku embolizačních příhod jak do koronárních tepen, tak do centrálního nervového systému se snažíme toto embolizační riziko zminimalizovat tím, že při kontinuálním podávání he-pa-rinu držíme ACT během výkonu vyšší, kolem 300–400 s. Zvláště pokud je při TEE před výkonem zobrazen spontánní echokontrast, který je důsledkem obleněného proudění v levé síni při FS. Při tomto nálezu existuje zvýšené riziko tvorby trombu a větší riziko kardioembolické komplikace, a proto držíme ACT během výkonu kolem 350–400 s.
Pokud je při TEE před výkonem zjištěn v levé síni nebo oušku levé síně trombus, je tento nález kontraindikací ablačního výkonu. V takovém případě je u pacienta nutné pokračovat v antikoagulační terapii a zákrok je možný až po rozpuštění trombu.
Výskyt nejvážnějších komplikací máme podobný jako v dostupné literatuře. U jedné pacientky (1,5 %) se vyvinul do 48 hod po katetrové izolaci plicních žil hemoperikard až srdeční tamponáda, k úmrtí během výkonu nedošlo.
Podle registru komplikací z let 1995 až2002 ze 181 kardiologických center byl u 8 745 pacientů s FS léčených katetrovou ablací celkový počet komplikací 6 %. Ze závažnějších komplikací se vyskytla cévní mozková příhoda u 0,28 % pacientů, transitorní ischemická ataka u 0,66 %, z nejzávažnějších komplikací se vyskytla srdeční tamponáda u 1,2 % pacientů a k úmrtí došlo u 0,05 % pacientů [1].
Dlouhodobou úspěšnost RF ablace paroxyzmální FS konvenční metodou máme shodnou s dostupnou literaturou, kde se uvádí úspěšnost této metody 70–85 % [9,13,16]. V našem souboru se dlouhodobá úspěšnost pohybovala od 77,4 do 87,5 %. Až do 3 měsíců po zákroku se mohou objevit recidivy FS, které většinou souvisejí se vznikem zánětu a hojení lézí, které vznikly aplikací RF energie. Pokud vzniká recidiva FS až po vysazení antiarytmické terapie, dochází pravděpodobně k částečnému zotavení myokardu v oblasti aplikace RF energie a fokální elektrická aktivita z plicní žíly se opět šíří do myokardu síní. U těchto pacientů dokázalo vysazené antiarytmikum, které bylo před zákrokem neúčinné, po katetrové ablaci zabránit vzniku FS [10]. Pokud dochází k recidivě FS i během podávání antiarytmické terapie, došlo k zotavení myokardu v ústí arytmogenní plicní žíly a v tomto případě je indikovaná reablace, elektrická reizolace plicních žil. Pokud vzniká recidiva FS za delší dobu, potom vznik FS většinou souvisí s rozvojem elektrické a funkční remodelace levé síně.
V našem souboru podstoupilo 2. ablační výkon 5 pacientů (7,5 %). Úspěšnost zákroku a vznik recidiv FS po konvenční katetrové ablaci paroxyzmální FS se na našem pracovišti neliší od výsledků popisovaných v literatuře. Po katetrové ablaci paroxyzmální FS došlo ke statisticky významnému poklesu medikace antiarytmik I. i III. třídy a také antikoagulační terapie. Také se statisticky významně snížil počet pacientů, kteří užívali dvojkombinaci antiarytmik. Statisticky významně se zvýšil počet pacientů, kteří nemedikovali žádné antiarytmikum. Došli jsme tedy k podobným výsledkům, jaké jsou v dostupné literatuře [3,4,9,13,16].
Závěr
RF katetrová ablace paroxyzmální fibrilace síní se stává s postupným nabýváním zkušeností katetrizujících dostupnou a účinnou terapií u symptomatických pacientů, u kterých nebyla nalezena účinná antiarytmická terapie k udržení sinusového rytmu.
Po ablaci došlo u pacientů ke statisticky významné redukci podávání antiarytmické i antikoagulační terapie.
Práce je podpořena VVZ MŠMT 0021 622 402, grantem IGA MZ NR 9337-3.
MUDr. Růžena Lábrová, Ph.D.
www.fnbrno.cz
e‑mail: labrova@seznam.cz
Doručeno do redakce: 22. 4. 2008
Přijato po recenzi: 24. 5. 2008
Zdroje
1. Cappato R, Calkins H, Chen SA et al. Worldwide survey on the methods, efficacy and safety of catheter ablation for human atrial fibrillation. Circulation 2005; 111 : 1100–1105.
2. Fiala M, Chovančík J, Heinz P et al. Léčba symptomatické intermitentní fibrilace síní katetrovou ablací v levé srdeční síni: bezprostřední a dlouhodobé výsledky u 150 pacientů. Vnitř Lék 2005; 51 : 971–983.
3. Fiala M, Chovančík J, Moravec R et al. Recidivující arytmie po katetrové ablaci původně paroxysmální fibrilace síní a výsledky opakované ablace. Vnitř Lék 2007; 53 : 1248–1254.
4. Fiala M, Chovančík J, Nevřalová R et al. Pulmonary vein isolation using segmental versus electroanatomical circumferential ablation for paroxysmal atrial fibrillation: over 3-year results of a prospective randomized study. J Interv Card Electrophysiol 2008; přijato k publikaci.
5. Fuster V, Ryden LE, Cannom DS et al. ACC/AHA/ESC 2006 guidelines for the management of patients with atrial fibrillation: executive summary. Circulation 2006; 114 : 700–752.
6. Gammage MD, Parle JV, Holder RL et al. Association between serum free thyrosine concentration and atrial fibrillation. Arch Intern Med 2007; 167 : 928–934.
7. Gersh BJ, Tsang TSM, Seward JB. The changing epidemiology and natural history of nonvalvular atrial fibrillation: clinical implications. Trans Am Clin Climatol Assoc 2004; 114 : 149–160.
8. Haissaguerre M, Jais P, Shah DC et al. Right and left atrial radiofrequency catheter therapy of paroxysmal atrial fibrillation. J Cardiovasc Electrophysiol 1996; 7 : 1132–1144.
9. Haissaguerre M, Shah DC, Jais P et al. Electrophysiological break--throughs from the left atrium to the pulmonary veins. Circulation 2000; 101 : 1409–1417.
10. Kumaraswamy H, Plumb VJ, Epstein AE et al. Resumption of electrical conduction in previously isolated pulmonary veins: rationale for a different strategy. Circulation 2004, 111 : 546–554.
11. Lábrová R. Epidemilogie fibrilace síní. KF 2007; 5 : 6–10.
12. Lábrová R. Léčba fibrilace síní v době katetrové ablace. Vnitř Lék 2007; 53 : 923–924.
13. Marrouche NF, Dresing T, Cole C et al. Circular mapping and ablation of the pulmonary vein for treatment of atrial fibrillation. J Am Coll Cardiol 2002; 40 : 464–474.
14. Matsumoto N, Ryoji K, Kasugai H et al. Experimental study on the effectiveness and safety of radiofrequency catheter ablation with the cooled ablation system. Circ J 2003; 67 : 154–158.
15. McGovern PG, Jacobs DR Jr, Shahar E et al. Trends in acute coronary heart disease mortality, morbidity, and medical care from 1985 through 1997: the Minnesota Heart Survey. Circulation 2001; 104 : 19–24.
16. Oral H, Scharf C, Chugh A et al. Catheter ablation for paroxysmal atrial fibrillation: segmental pulmonary vein ostial ablation versus left atrial ablation. Circulation 2003; 108 : 2355–2360.
17. Pedersen OD, Kober L, Torp-Pedersen C. Atrial fibrillation and atrial cardiomyo-pathy: two sides of the same coin? Am Heart J 2004; 147 : 953–955.
18. Pürerfellner H, Cihal R, Aichinger J et al. Pulmonary vein stenosis by ostial irrigated-tip ablation: Incidence, time course, and prediction. J Cardiovasc Elec-trophysiol 2003; 14 : 158–164.
19. Redfield MM, Jacobsen SJ, Burnett JC Jr et al. Burden of systolic and diastolic ventricular dysfunction in the community: appreciating the scope of the heart failure epidemic. JAMA 2003; 289 : 194–202.
20. Risk factors for stroke and efficacy of antithrombotic therapy in atrial fibrillation. Analysis of pooled data from five randomized, controlled trials. Arch Intern Med 1994; 154 : 1449–1457.
21. Stewart S, Murphy N, Walker A et al. Cost of an emerging epidemic: an economic analysis of atrial fibrillation in the UK. Heart 2004; 90 : 286–292.
22. Špinar J, Vítovec J. Losartan – víc než pokles krevního tlaku. Kardiol Rev 2006; 8 : 115–120.
23. Tsang TS, Gersh BJ, Appleton CP. Left ventricular diastolic dysfunction as a predictor of the first diagnosed nonvalvular atrial fibrillation in 840 elderly men and women. J Am Coll Cardiol 2002; 40 : 1636–1644.
24. Tsang TS, Petty GW, Barnes ME et al. The prevalence of atrial fibrillation in incident stroke cases and matched population controls in Rochester, Minnesota: changes over three decades. J Am Coll Cardiol 2003; 42 : 93–100.
25. Verma A, Wazni OM, Marrouche NF et al. Pre‑existing left atrial scaring in patients undergoing pulmonary vein antrum isolation. An independent predictor of procedural failure. J Am Coll Cardiol 2005; 45 : 285–292.
26. Wang TJ, Larson MG, Levy D et al. Temporal relations of atrial fibrillation and congestive heart failure and their joint influence on mortality: the Framingham Heart Study. Circulation 2003; 107 : 2920–2925.
27. Watanabe I, Masaki R, Min N et al. Cooled tip ablation results in increased radiofrequency power delivery and lesion size in the canine heart. Importance of catheter-tip temperature monitoring for prevention of popping and impedance rise. J Int Cardiac Electrophysiol 2002; 6 : 9–16.
28. Wolf PA, Abbott RD, Kannel WB. Atrial fibrillation as an independent risk factor for stroke: the Framingham Study. Stroke 1991; 22 : 983–988.
29. Wolf PA, Benjamin EJ, Belanger AJ et al. Secular trends in the prevalence of atrial fibrillation: the Framingham Study.Am Heart J 1996; 131 : 790–795.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2008 Číslo 10- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Hemoeliminační metody v léčbě sepse: současný stav
- Srdeční arytmie při obstruktivní spánkové apnoe
- Izolovaná forma srdeční amyloidózy v podobě počínající infiltrativní kardiomyopatie bez restriktivní fyziologie
- Myopatie a smíšená hyperlipoproteinemie jako první projev systémové AL‑amyloidózy
- XIV. medzinárodný kongres pre výživu a metabolizmus pri chorobách obličiek, 11.–15. júna 2008, Marseille (Francúzsko)
- Z odborné literatury
- Zahajovací zdravice XV. kongresu České internistické společnosti České lékařské společnosti J. E. Purkyně, Brno, 24. 9. 2008
- Internistická moudrost – matka celé klinické medicíny. Metamorfózy internistova myšlení a praktického konání
- Komentář k novým Doporučením o diagnostice a léčbě plicní embolie Evropské kardiologické společnosti (EKS)(Torbicki et al 2008) ve světle Doporučení diagnostiky,léčby a prevence plicní embolie České kardiologické společnosti – verze 2007
- Stanovení LDL‑cholesterolu – stále nevyřešený problém: vypočíst, nebo změřit? – editorial
- Nukleární kardiologie: postradatelná, či nepostradatelná? – editorial
- Srdeční amyloidóza – editorial
- Srdeční amyloidóza – podceňovaná hrozba? – editorial
- Radiofrekvenční katetrová ablace paroxyzmální fibrilace síní konvenční metodou, bezprostřední a dlouhodobé výsledky
- Zhodnotenie alternatívnych metód pre výpočet LDL cholesterolu
- Biomarkery ischemie a nekrózy myokardu v roce 2008
-
Zobrazovací metody v diagnostice viability myokardu.
Část 1. Interpretace nálezů při zobrazování viability myokardu pomocí SPECT a PET - Kolorektální karcinom a diabetes mellitus
- Duální protidestičková léčba
- Hemofilie
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Duální protidestičková léčba
- Srdeční arytmie při obstruktivní spánkové apnoe
- Stanovení LDL‑cholesterolu – stále nevyřešený problém: vypočíst, nebo změřit? – editorial
- Hemoeliminační metody v léčbě sepse: současný stav
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



