-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Sarkom z interdigitujících dendritických buněk dolní končetiny rezistentní k vysokodávkované chemoterapii BEAM s autologní transplantací kmenových krvetvorných buněk – popis případu a přehled literatury
Interdigitating dendritic cell sarcoma of low extremitis resistant to high dose chemotherapy BEAM with peripheral blood stem cell transplantation
Interdigitating dendritic cell sarcoma is a rare neoplasm forming part of the group of malignancies derived from histocytic cell line. This nosological unit can be detected only by special immunohistochemical exams. A young man aged 25 found a tumorous swelling in the proximal part of his left crus. The pathological process affected proximal tibi al epiphysis and adjacent soft tissues. The first FDG-PET examination performed in the process of determining the clinical stage of the disease showed a high activity in thesite of primary tumour (SUV 7.71) and in the site of regional inguinal node (SUV 4.25). Histological examination of a diagnostic excision specimen of the tumour in the tibia and the extirpated enlarged regional nodes in the left groin led to the diagnosis of interdigitating dendritic cell sarcoma. The diagnosis was confirmed pathologically by another two centres in the Czech Republic and, due to the unusual nature of the diagnosis, also in Regensburg, Germany. Treatment started with chemotherapy, applied to patients with aggressive lymphomas in the framework of clinical studies, i.e. a combination of MegaCHOP. After 4 cycles, however, there was no visible response on the site of primary tumour. MegaCHOP therapy was therefore discontinued after the 4 cycles. Subsequently, we referred the patient for a high-dose chemotherapy with autologous bone marrow transplantation, similarly to aggressive lymphomas. The collection of blood producing stem cells from peripheral blood was successfully performed after ESHAP chemotherapy. A verificato in FDG-PET examination was performed before high-dose chemotherapy. Increased activity was detected only in left proximal crus, with an SUV of 4.6. One month after ESHAP chemotherapy, BEAM high-dose chemotherapy with autologous transplantation of blood forming tissue was performed. High-dose chemotherapy was followed up by radiotherapy targeted on the primary tumour in the crus (70 Gy). The third verificati on FDG-PET examination was performed 3 months after radiotherapy. The examination showed a continuing higher activity in the region of the primary tumour (SUV 2.69) and a new centre of activity was detected in the left inguinal nodes region (SUV 4.09). The activity corresponded to the presence of viable tumour tissue in the primary nidus and new metastases in inguinal nodes, without proofs of further proliferation at the time. Nodes of the left groin were removed. Histological examination showed affection of the node by the same type of tumour, i.e. a continuing activity of the disease despite chemotherapy. Due to suspected continuati on of viable tumour in the crus judging by the intensity of accumulation of FDG-PET and the proof of a new affection of regional nodes, surgical treatment was preferred after the failure of chemotherapy. After the removal of inguinal nodes, left knee joint exarticulati on was performed. This was followed by regional inguinal node region radiotherapy (56 Gy). The last fo urth PET - CT examination carried out 4 months after the radiation therapy of the inguinal region showed massive dissemination into the region of ileac and paraaortic nodes (lymphadenopathy up to 6 cm in diameter) with an activity of 5.9 to 6.73 SUV units. Currently, we test the sensitiveness of the disease to 2 - chlorde oxyadenosin and look for additional therapeutic options. To our knowledge, the above description is the first documented case of interdigitating dendritic cell sarcoma located in the tibia and crussfot tissue. We have not fo und any description of high-dose therapy supported by autologous transplantation of blood – forming tissue for this type of tumour in relevant literature. In this case, we record chemoresistance to high-dose chemotherapy and certain radiosensitivty of the tumour at the same time.
Key words:
interdigitating dendritic cell sarcoma – high dose chemotherapy with perifepheral stem cell transplantation – FDG-PET imagination
Autori: Z. Adam 1; K. Veselý 2; M. Krejčí 1; L. Pour 1; F. Fakan 3; R. Soumarová 4; J. Neubauer 5; J. Vaníček 6; J. Černý 7; L. Křen 8; K. Bolčák 9; L. Šmardová 1; R. Hájek 1; J. Mayer 1
Pôsobisko autorov: Interní hematoonkologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jiří Vorlíček, CSc. 1; I. patologicko‑anatomický ústav Lékařské fakulty MU a FN u sv. Anny Brno, přednostka doc. MUDr. Markéta Hermanová, Ph. D. 2; Šiklův patologicko‑anatomický ústav Lékařské fakulty UK a FN Plzeň, přednosta prof. MUDr. Michal Michal 3; Komplexní onkologické centrum J. G. Mendela Nový Jičín, přednostka doc. MUDr. Renata Soumarová, Ph. D. 4; Radiologická klinika Lékařské fakulty MU a FN Brno, přednosta prof. MUDr. Vlastimil A. Válek, CSc. 5; Klinika zobrazovacích metod Lékařské fakulty MU a FN u sv. Anny Brno, přednosta doc. MUDr. Petr Krupa, CSc. 6; I. ortopedická klinika Lékařské fakulty MU a FN u sv. Anny Brno, přednosta doc. MUDr. Pavel Janíček, CSc. 7; Ústav patologické anatomie Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jirka Mačák, CSc. 8; Oddělení nukleární medicíny a pozitronové emisní tomografie Masarykova onkologického ústavu Brno, vedoucí lékař oddělení prim. MUDr. Karol Bolčák 9
Vyšlo v časopise: Vnitř Lék 2009; 55(2): 147-157
Kategória: Kazuistiky
Súhrn
Sarkom z interdigitujících dendritických buněk je velmi vzácnou jednotkou ze skupiny malignit odvozených z buněk histiocytární linie. Identifikovat tuto nosologickou jednotku je možné pouze na základě speciálních imunohistochemických vyšetření. Mladý muž zpozoroval ve věku 25 let tumorózní zduření v proximální části levého bérce. Patologický proces postihoval proximální epifýzu tibie a přilehlé měkké tkáně. První FDG‑PET vyšetření, provedené v rámci stanovení klinického stadia nemoci, prokázalo vysokou aktivitu v oblasti primárního tumoru (SUV 7,71) a v oblasti regionální tříselné uzliny (SUV 4,25). Histologické vyšetření diagnostické exscise z tumoru v tibii a exstirpované zvětšené regionální uzliny v levém třísle bylo uzavřeno jako sarkom interdigitujících dendritických buněk. Tato diagnóza byla potvrzena patology z dalších dvou ústavů v ČR a vzhledem k neobvyklosti diagnózy také patology v Regensburgu (Německo). Léčbu jsme zahájili chemoterapií, podávanou v rámci klinických studií pacientům s agresivními lymfomy, kombinací MegaCHOP. Po 4 cyklech však nebyla zřetelná léčebná odpověď v místě primárního tumoru. Proto po těchto 4 cyklech byla léčba MegaCHOP ukončena. Dále jsme pacienta směřovali k vysokodávkované chemoterapii s autologní transplantací kostní dřeně, podobně jako u agresivních lymfomů. Sběr kmenových krvetvorných buněk z periferní krve byl úspěšně proveden po chemoterapii ESHAP. Před vysokodávkovanou chemoterapií bylo provedeno kontrolní FDG‑PET vyšetření. Byla nalezena pouze zvýšená aktivita v oblasti proximální části bérce vlevo o aktivitě SUV 4,6. V měsíčním intervalu od chemoterapie ESHAP následovala vysokodávkovaná chemoterapie BEAM s autologní transplantací krvetvorné tkáně. Na vysokodávkovanou chemoterapii navázala radioterapie cílená na primární tumor bérce (70 Gy). Třetí kontrolní FDG‑PET vyšetření bylo provedeno 3 měsíce po ukončení radioterapie. Prokázalo přetrvávající zvýšenou aktivitu v oblasti primárního tumoru (SUV 2,69) a nově se objevilo ložisko aktivity v oblasti inguinálních uzlin vlevo (SUV 4,09). Aktivita odpovídala přítomnosti viabilní nádorové tkáně v primárním ložisku a novým metastázám v tříselných uzlinách, další šíření nebylo v té době prokázáno. Provedeno odstranění tříselních uzlin vlevo. Histologické vyšetření potvrdilo postižení uzliny stejným typem tumoru, čili aktivitu nemoci i přes intenzivní chemoterapii. Pro podezření na přetrvávání viabilního tumoru v bérci dle intenzity kumulace FDG‑PET a průkazu nového postižení regionálních uzlin byla upřednostněna nyní, po selhání chemoterapie, chirurgická léčba. Po odstranění tříselních uzlin byla provedena exartikulace v kolením kloubu vlevo. Následovala radioterapie na oblast regionálních inguinálních uzlin (56 Gy). Poslední čtvrté PET-CT vyšetření, provedené 4 měsíce po ukončení ozáření inguinální oblasti, prokázalo masivní diseminaci do oblasti ilických a paraaortálních uzlin (lymfadenopatie až 6 cm v průměru) o aktivitě 5,9–6,73 jednotek SUV. V současnosti testujeme citlivost nemoci na 2-chlordeoxyadenosin a hledáme další léčebné možnosti. Uvedený popis je dle našich vědomostí prvním dokumentovaným případem lokalizace sarkomu z intedigitujících dendritických buněk v tibii a měkkých tkáních bérce. V literatuře jsme nenalezli zkušenosti s vysokodávkovanou chemoterapií s podporou autologní transplantace krvetvorné tkáně u tohoto typu tumoru. V našem případě dokumentujeme chemorezistenci k vysokodávkované chemoterapii, ale zároveň dokumentujeme určitou radiosenzitivitu tumoru.
Klíčová slova:
sarkom z interdigitujících dendritických buněk – vysokodávkovaná chemoterapie s autologní transplantací – FDG-PET zobrazeníÚvod
Neoplazie z dendritických buněk se vyskytují velmi vzácně. WHO klasifikace krevních chorob je rozčleňuje do 5 skupin:
- histiocytózy z Langerhansových buněk
- sarkom z Langerhansových buněk
- sarkom z interdigitujících dendritických buněk
- sarkom z folikulárních dendritických buněk
- sarkom z dendritických buněk, blíže nespecifikovaný
Interdigitující dendritické buňky patří do skupiny antigen prezentujících buněk a jsou charakterizovány četnými intercelulárními junkcemi. Zpracovávají antigen na peptidové fragmenty. Interdigitující dendritické buňky se fyziologicky nacházejí v T-buněčných oblastech lymfatických uzlin a vůbec lymfatické tkáně obecně (slezina i lymfatická tkáň asociovaná s mukózou). Podobně jako Langerhansovy buňky exprimují interdigitující buňky protein S-100, ale na rozdíl od Langerhansových buněk neexprimují Birbeckova granula a CD1 antigen. Interdigitující dendritické buňky exprimují četné makrofágové receptory, ale ne komplement. Sarkomy odvozené z interdigitujících buněk jsou ve světové literatuře popisovány zcela výjimečně a primárně kostní tumor z interdigitujících buněk zatím v literatuře popsán nebyl.
Zásadní pro léčebný úspěch je možnost provedení totální resekce. Pokud to není možné, používají se stejné chemoterapeutické režimy jako pro léčbu nehodgkinských lymfomů. Uvádí se, že efekt samotné chemoterapie není tak dobrý, jako je u maligních lymfomů, i když je svou manifestací připomínají [1–3].
Popis případu
Mladý muž, narozený v roce 1981, byl až do vzniku tohoto onemocnění do svých 25 let bez vážnějších zdravotních potíží. První příznaky nemoci, bolesti v oblasti kolenního kloubu vlevo, začal pociťovat v červnu roku 2006. Později se objevilo zduření proximální části bérce. Na Ortopedickou kliniku FN u sv. Anny v Brně byl přijat v únoru roku 2007. Důvodem k přijetí byla diagnostika bolestivého zduření měkkých tkání v proximální části bérce (tibie), které nebylo pohyblivé proti spodině.
Na běžném RTG snímku byla zřetelná dvě ložiska osteolýzy na mediální straně metafýzy tibie o velikosti 20 × 20 mm. CT znázornilo v této oblasti polylobulární cystické ložisko velikosti 50 × 22 × 18 mm septované, bez rozrušení kortiky (obr. 1–6). Při klasické scintigrafii skeletu bylo zřetelné ložisko aktivity právě jen v proximálním úseku tibie. Na MR zobrazení byl popsán excentricky uložený defekt proximální tibie vlevo ventromediálně hypointenzivní proti signálu kosti, laločnatých ostrých kontur, bez známek periostální reakce a zduření měkkých tkání na proximální tibii.
Obr. 1. RTG proximální části bérce, AP projekce. 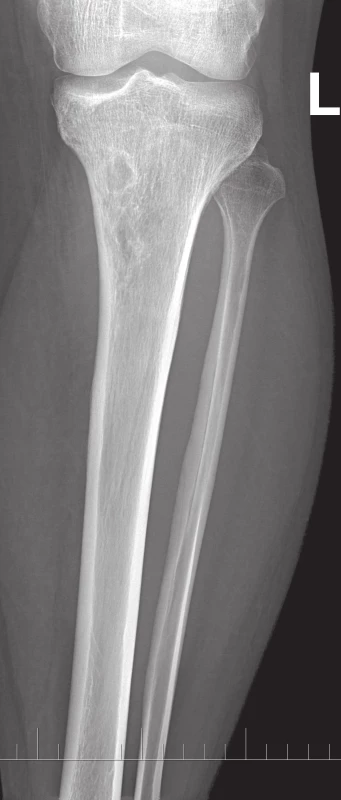
Obr. 2. RTG proximální části bérce, boční projekce. Vlevo v proximální metadiafýze tibie je polylobulární cystické ložisko septované – mediálně ostře ohraničené, laterokaudálně neostře ohraničené, bez rozrušení kortiky. 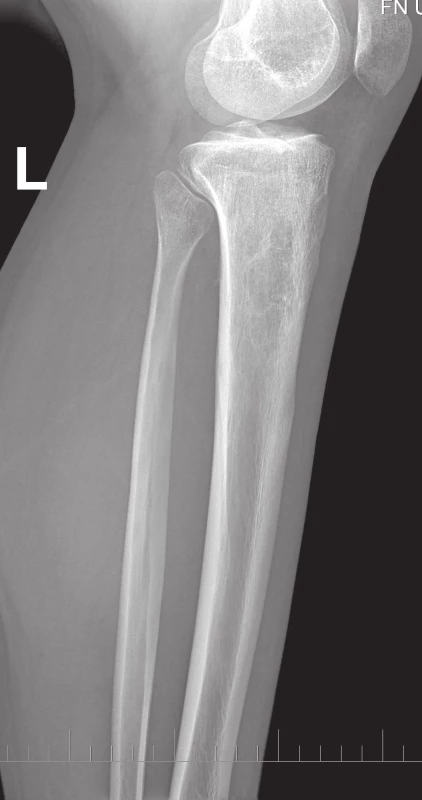
Obr. 3. CT břicha, pánve, třísel: patologická lymfatická uzlina levého třísla. 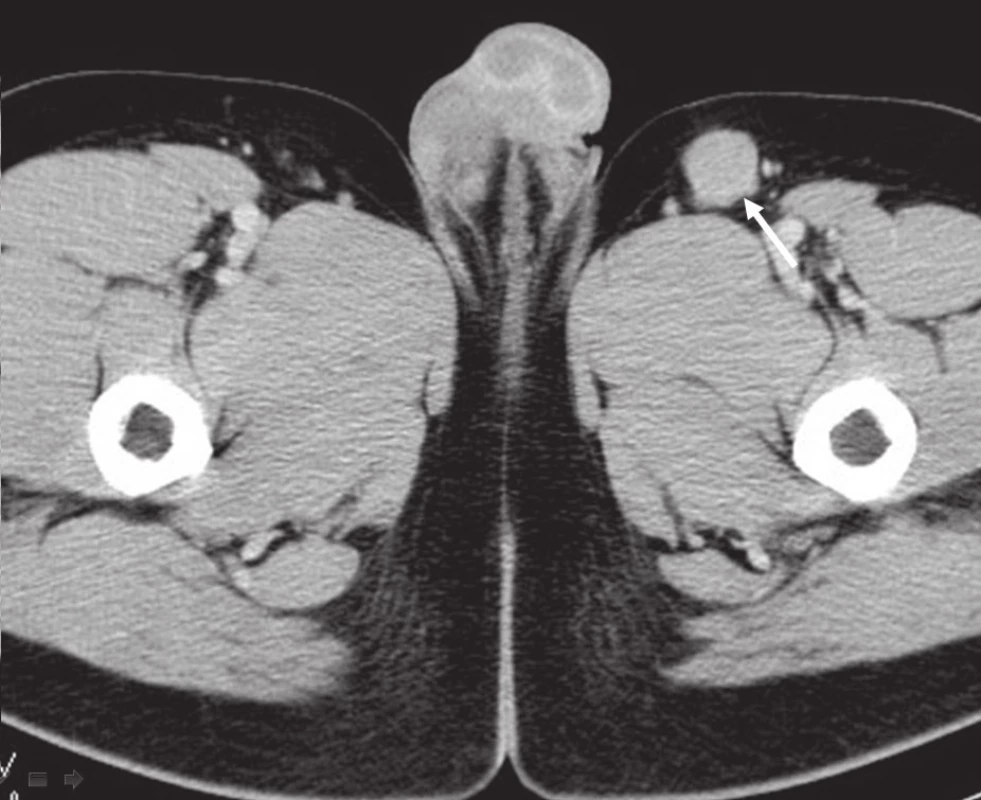
Obr. 4. CT břicha, pánve, třísel: patologická lymfatická uzlina zevní ilická vlevo. 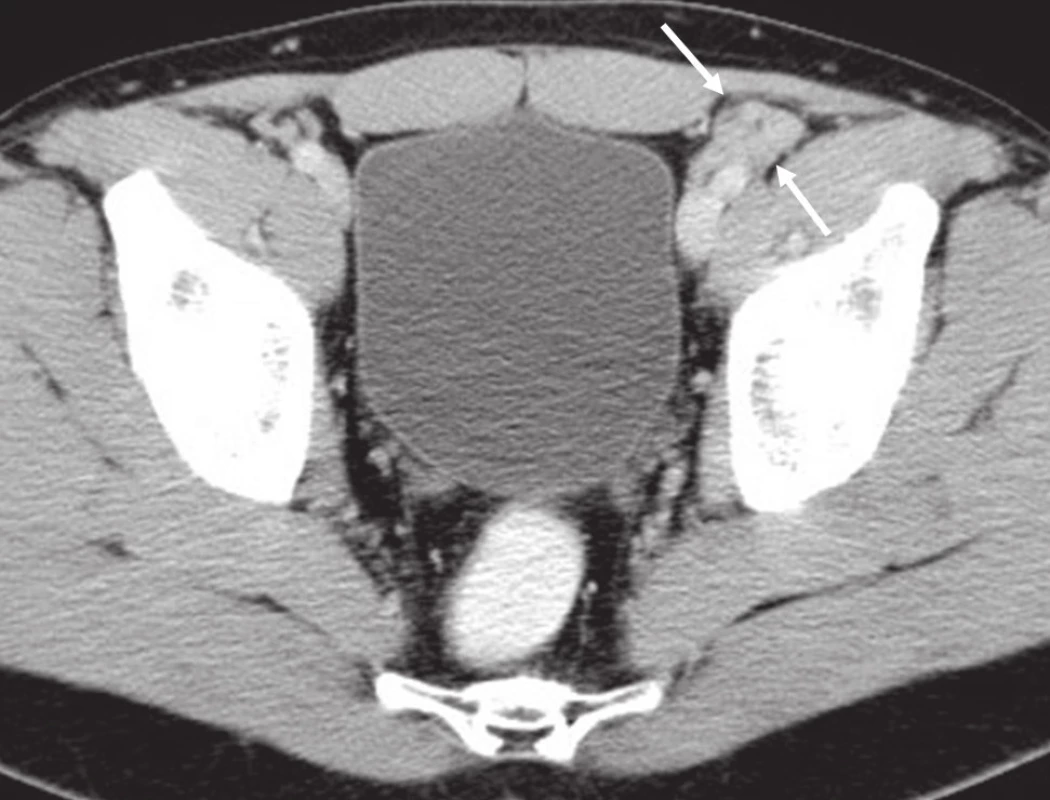
Obr. 5. MR bérců, vyšetřovací sekvence STIR. 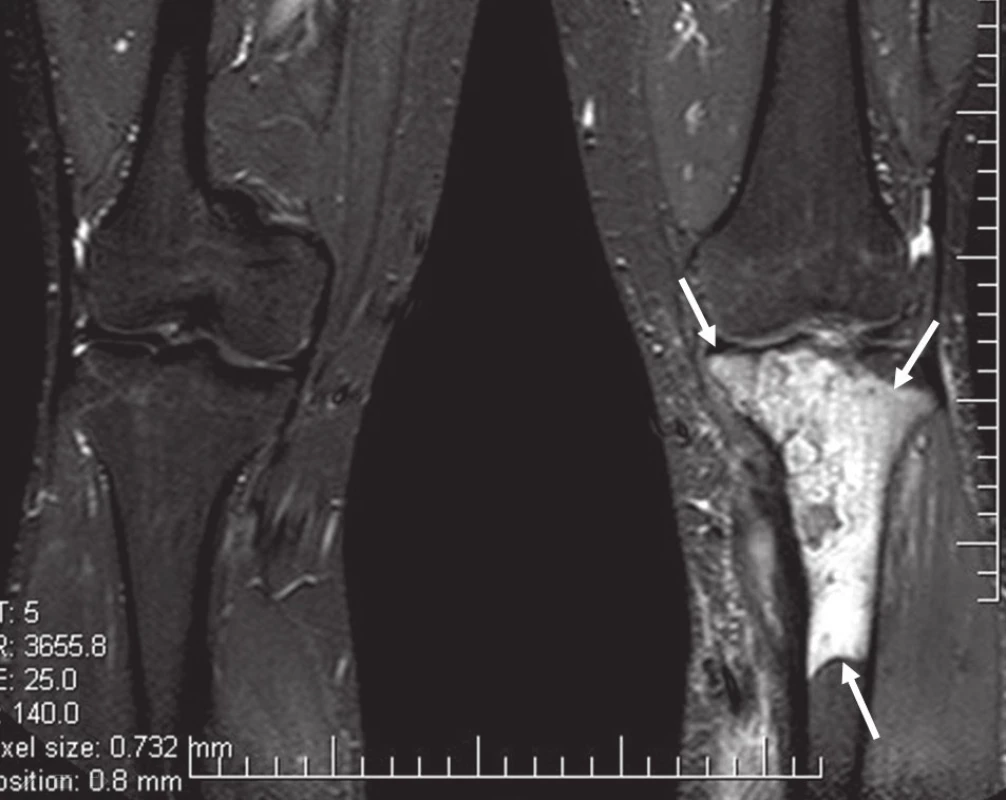
Obr. 6. MR bérců, vyšetřovací sekvence T1TSE. Excentricky uložený defekt proximální tibie vlevo ventromediálně, hypointenzní proti normálu kosti, laločnatých ostrých kontur velikosti asi 40 × 30 × 72 mm s infiltrací spongiózy. 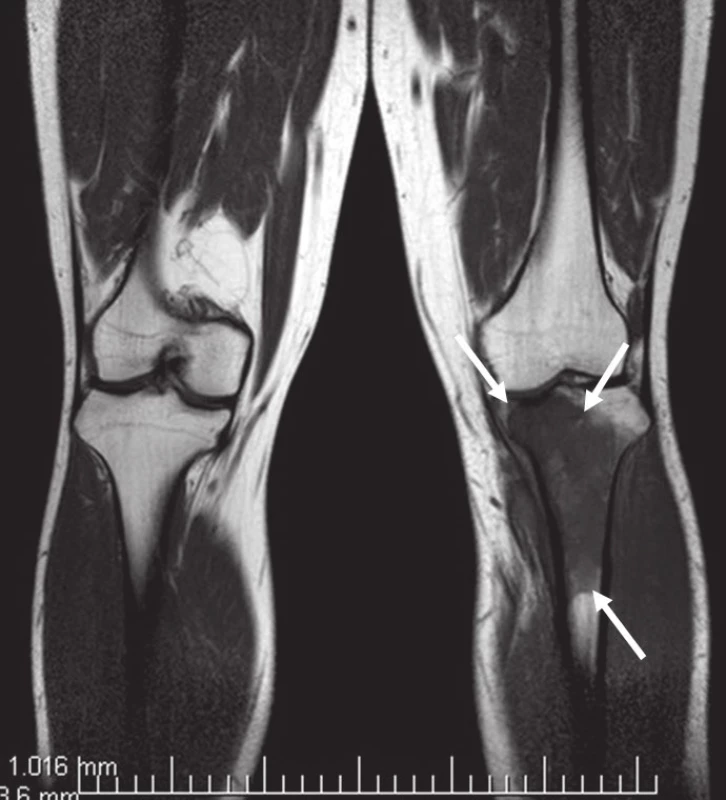
Zobrazovací metody tedy jednoznačně identifikovaly maligní proces nejasného charakteru. Ke stanovení přesné histologické diagnózy provedli ortopedové exscize z tohoto tumoru koncem února roku 2007.
Do histopatologické laboratoře I. patologicko‑anatomického ústavu FN u sv. Anny v Brně byly zaslány 4 fragmenty o maximálním rozměru 40 mm, žlutobělavé barvy, zčásti s přítomností tvrdých kostních tkání. Tkáně byly zablokovány a zpracovány rutinní formol-parafinovou technikou, tvrdé části byly před zpracováním dekalcifikovány pomocí 8% roztoku kyseliny chlorovodíkové. Byly zhotoveny rutinní řezy barvené hematoxylin‑eozinem, dále provedena speciální barvení dle Gömöriho a Goldnerovy modifikace zeleného trichromu. Imunohistologie byla provedena polymerovou imunoperoxidázovou metodou. Pro elektronovou mikroskopii byla užita formalinem fixovaná tkáň z parafinového bloku, postfixovaná v glutaraldehydu.
Histologické nálezy v rutinním barvení zahrnovaly tumor tvořený krátce vřetenitými a polygonálními buňkami, s málo patrným až objemným dvorcem eozinofilní cytoplazmy bez zřetelných hranic, okrouhlými až protaženými jádry se světlejším chromatinem, drobnými, ale dobře patrnými jadérky. Jádra měla místy nepravidelnou konturu a příležitostně longitudinální zářezy. Celkově buňky rostly solidně, ve fascikulárním nebo vírovitém řazení. Fokálně byla příměs malých lymfocytů a plazmocytů, eozinofilní leukocyty nebyly přítomny. V nádoru byly dobře patrné mitotické figury, některé zřetelně abnormální, indikující maligní tumor. Mitotická aktivita byla 15 mitotických figur na 10 polí velkého zvětšení. Vaskulatura byla v nádorovém infiltrátu poměrně chudá, s přítomností drobných tenkostěnných i silnostěnných cév. V barvení dle Gömöriho byla dobře patrná retikulinová síť kolem jednotlivých buněk i jejich skupin, speciální barvení dle Goldnera demonstrovalo slabou kolagenizaci extracelulární matrix.
Byly provedeny imunohistologické reakce s panelem protilátek s těmito výsledky: difuzně pozitivní byly reakce s protilátkou proti S-100 proteinu, vimentinu, CD68 a lysozymu. Ložiskově pozitivní byla rovněž reakce s protilátkou proti LCA (leukocytární společný antigen). Negativní byly reakce s protilátkami proti CD1a, CD21, CD23, CD35, CD34, HMB45, širokospektrým cytokeratinům, EMA (epiteliální membránový antigen), desminu, hladkosvalovému aktinu a h-caldesmonu. Ki-67 proliferační index (procento Ki-67 pozitivních nádorových jader z celkového počtu nádorových jader) byl odhadem 40–50 %. Populace přimísených malých lymfocytů byla převážně CD3+, ojediněle CD20 pozitivní. Ultrastrukturální nálezy zahrnovaly elongované nádorové buňky s prominentními širokými interdigitujícími výběžky. Jádra byla nepravidelného tvaru, indentovaná. Výbava cytoplazmatickými organelami byla poměrně chudá, s hrubým endoplazmatickým retikulem, Golgiho aparátem, lyzosomy. Nebyly identifikovány melanosomy nebo Birbeckova granula. Světelně mikroskopické, imunohistologické i ultrastrukturální nálezy byly konzistentní s diagnózou sarkomu z dendritických interdigitujících buněk (obr. 7–11).
Obr. 7. Přehledný snímek solidně rostoucího nádorového infiltrátu krátce vřetenitých buněk. Hematoxylin-eozin, původní zvětšení 100krát. 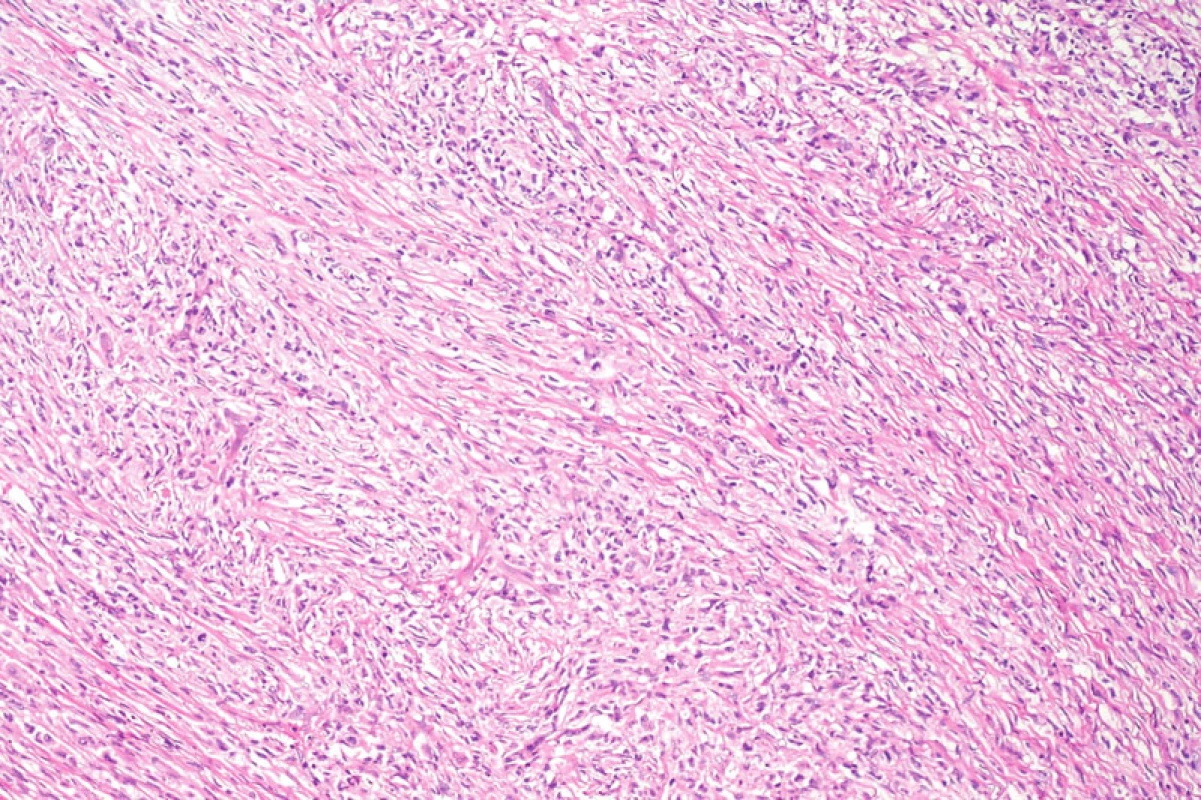
Obr. 8. Při větším zvětšení je patrný fascikulární a vágně vírovitý charakter růstu nádorových buněk. Hematoxylin-eozin, původní zvětšení 200krát. 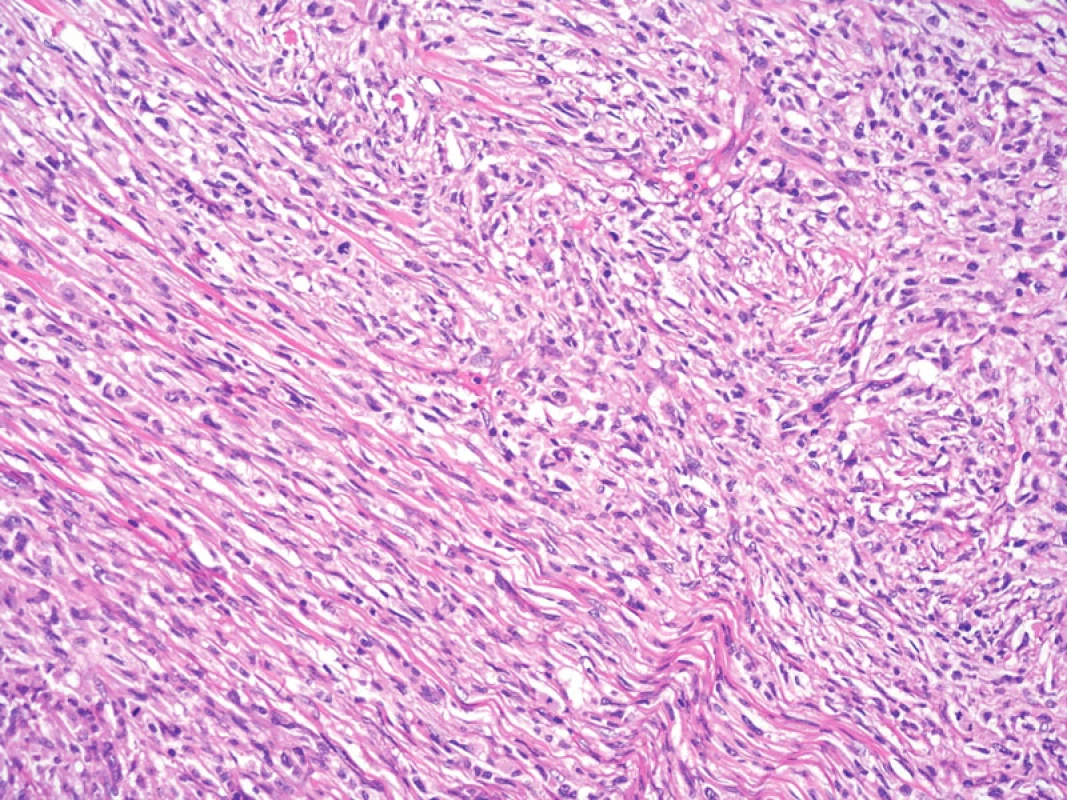
Obr. 9. Velké zvětšení umožňující již hodnocení cytologických detailů, nepravidelné kontury jader, eozinofilní cytoplazma. Vlevo od centra zastižena drobná céva (šipka) se silnější stěnou, s perivaskulárním vírovitým růstem nádorových buněk. Hematoxylin-eozin, původní zvětšení 400krát. 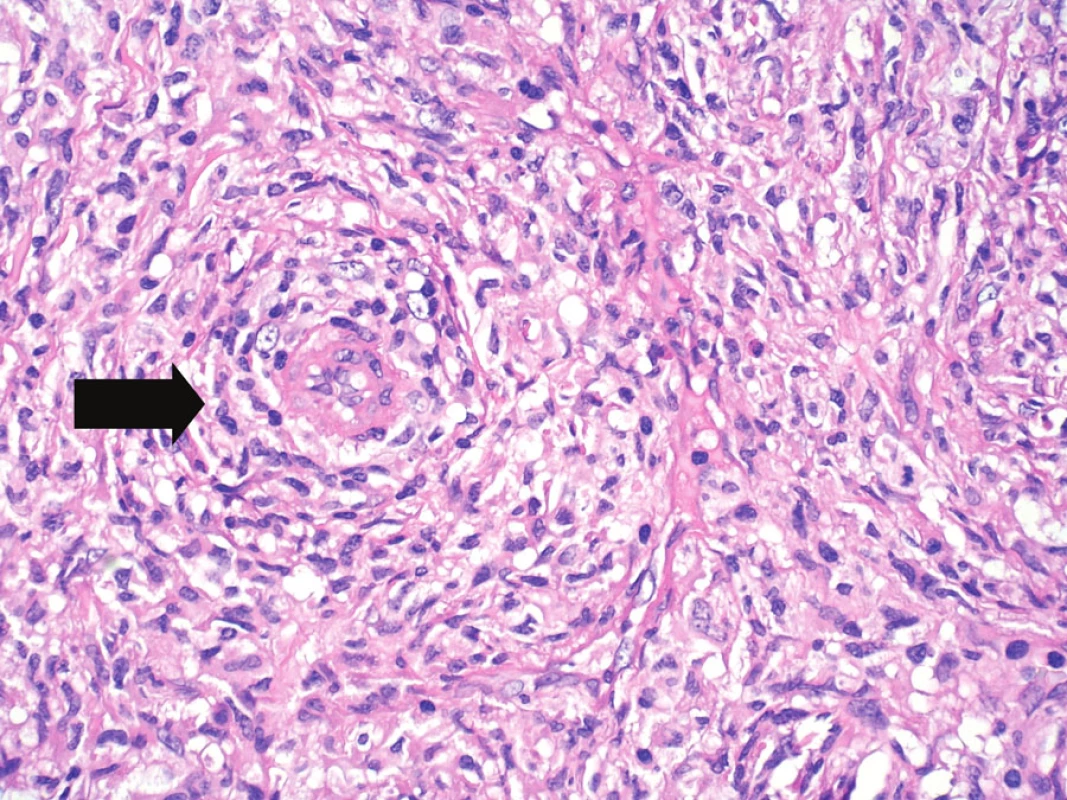
Obr. 10. V horní části obrázku je kostní trámec lamelární kosti s infiltrací interdigitujícím dendritickým sarkomem (šipka). Hematoxylin-eozin, původní zvětšení 200krát. 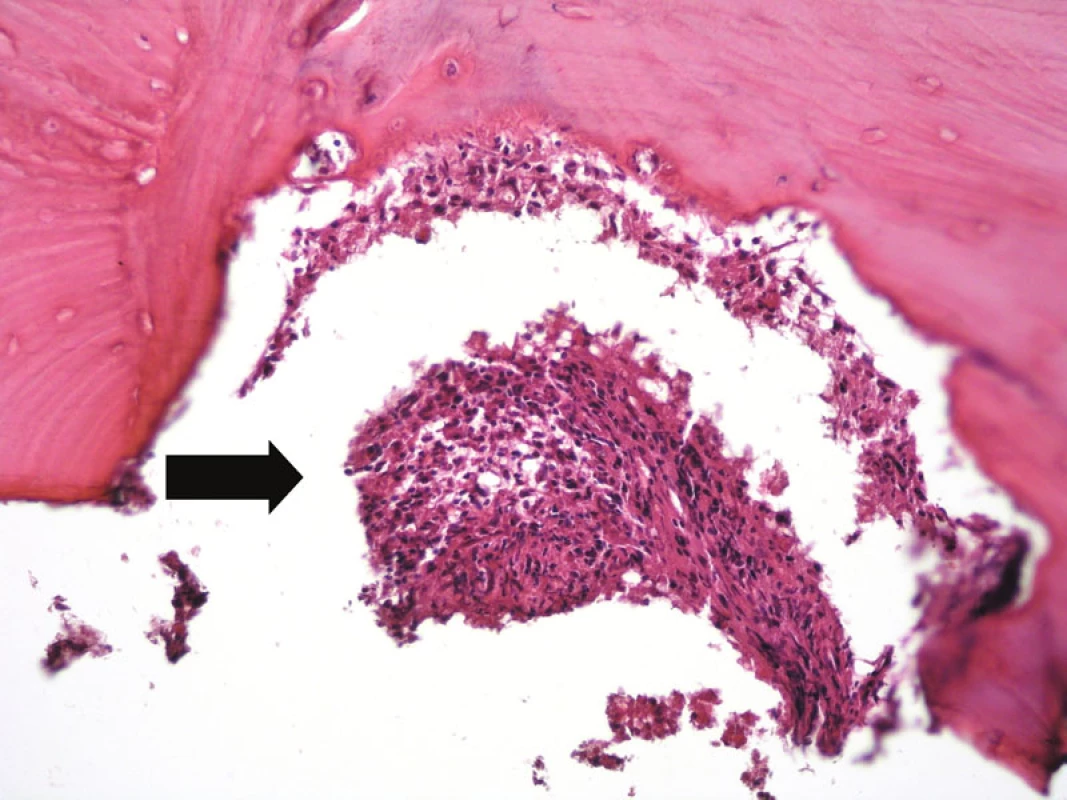
Obr. 11. Elektron- mikroskopický obraz buněk sarkomu z dendritických interdigitujících buněk, s širokými interdigitujícími cytoplazmatickými výběžky (šipka). 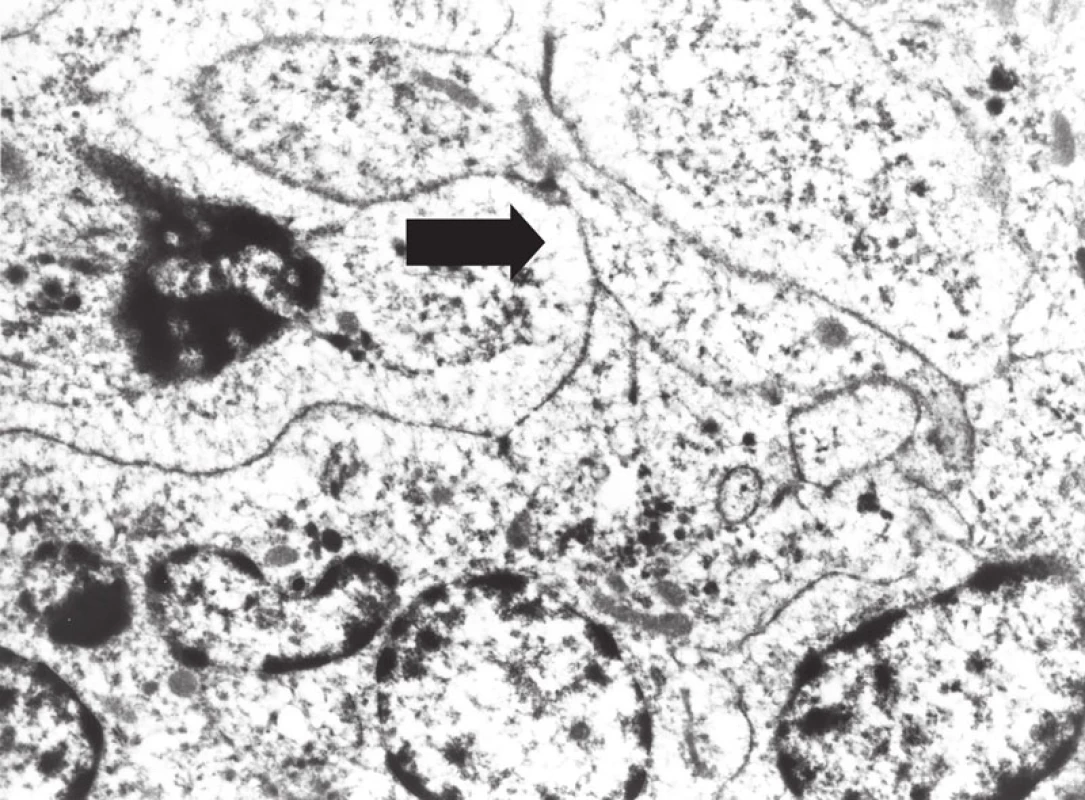
Ke stejnému závěru došli i patologové ve FN Brno-Bohunice.
Vzhledem k tomu, že primárně kostní manifestace je pro tuto diagnózu zcela neobvyklá, byly histologické vzorky konzultovány v Šiklově patologicko‑anatomickém ústavu v Plzni, kde dospěli ke stejnému závěru, neboť imunohistologické reakce vycházely stejně jako v Brně, a tak prof. MUDr. František Fakan, CSc., potvrdil diagnózu sarkomu z intedigitujících dendritických buněk, tedy stejný výsledek, k jakému došla nezávisle na sobě dvě pracoviště v Brně.
O třetí názor na exscidovaný materiál jsme požádali Institut pro patologii Lékařské fakulty Regensburg v Německu (Institut für Pathologie, Direktor Univ. Prof. Dr. Med. F. Hofstädter, Medizinische Fakultät der Universität Regensburg). Prof. Hofstäter popsal velmi celulární, převážně vřetenobuněčný tumor s atypickými mitózami. Nádorové buňky vykazovaly pozitivitu CD68, negativitu CD117, negativitu CD23, negativitu CD1a, negativitu CD5, CD20 a CD21 negativní, rovněž pancytokeratin byl negativní. Vyšetření proteinu S-100 bylo v nádorových buňkách pozitivní. Vyšetření s protilátkou MIB 1 (Ki-67) svědčilo pro vysokou proliferační aktivitu, pozitivních bylo 80 % všech nádorových jader. Patologové z Regensburgu klasifikovali nádor shodně jako sarkom z interdigitujících dendritických buněk.
Vzhledem k tomu, že sarkomy z dendritických buněk patří do skupiny maligních krevních nemocí, byl pacient po stanovení diagnózy přeložen na Interní hematoonkologickou kliniku LF MU a FN Brno, pracoviště Bohunice.
Při přijetí na toto pracoviště byla při klinickém vyšetření zjištěna hmatná, zvětšená uzlina v levém třísle.
Provedené FDG‑PET vyšetření v březnu roku 2007 prokázalo ložisko zvýšené aktivity svědčící pro tumor proximální části tibie vlevo a postižení popliteálních, femorálních a inguinálních uzlin. Aktivita akumulace fluorodeoxyglukózy byla v oblasti proximálního bérce SUV 7,71 a v oblasti inguinálních uzlin SUV 4,28. Proto byla patologická uzlina z třísla exscidována a podrobena histologickému vyšetření, a to opět jak na brněnském pracovišti, tak morfology v Regensburgu. Byla potvrzena infiltrace stejným typem nádoru, jako byl popsán v bérci. V preparátu popsali patologové zřetelné prorůstání nádorových buněk do cév.
V rámci vyšetření rozsahu nemoci bylo provedeno CT vyšetření malé pánve, břicha a hrudníku. Žádné známky diseminace tumor nad oblast třísla nebyly zjištěny. V dutině břišní bylo popsáno zmnožení nezvětšených lymfatických uzlin.
Měli jsme tedy před sebou pacienta s velkým tumorem v oblasti bérce a s prokázaným postižením regionálních uzlin v třísle s prokázanou angioinvazivitou. Vzhledem k tomuto nálezu se nám jevily vzdálené mikrometastázy za velmi pravděpodobné, byť je žádné vyšetření nezachytilo. Proto jsme upřednostnili medikamentózní léčbu před léčbou operační.
Léčba byla zahájena počátkem dubna roku 2007 cytostatickým režimem MegaCHOP ve složení cyklofosfamid 2 000 mg/m2, adriamycin 50 mg/m2, vinkristin 1,4 mg/m2, vše jednorázově 1. den cyklu a prednison 100 mg (celková dávka) 1.–5. den cyklu. Intervaly mezi cykly byly 21 dní. Od 7. dne cyklu si pacient aplikoval leukocytární růstové faktory (Neupogen). Po 4 cyklech této léčby zůstávalo zduření v oblasti tibie beze změny, bez známek zmenšování. Vzhledem k nepřítomnosti zřetelné léčebné odpovědi jsme v této chemoterapii MegaCHOP dále nepokračovali, ale přistoupili jsme k podání chemoterapie ESHAP (červenec roku 2007) a k následnému sběru kmenových krvetvorných buněk (červenec roku 2007). Chemoterapie ESHAP byla podána ve složení: cisplatina 25 mg/m2 1.–4. den cyklu, etoposid 60 mg/m2 den 1.–4. den cyklu, cytosinarabinosid 2 000 mg/m2 den 4. Sběr kmenových krvetvorných buněk z periferní krve byl úspěšný.
Počátkem září roku 2007 byla provedena vysokodávkovaná chemoterapie režimem BEAM s podporou transplantace kmenových krvetvorných buněk, získaných z periferní krve. Předtransplantační chemoterapie BEAM byla podána v následujícím dávkování BCNU 310 mg/m2 den –7, cytosinarabinosid 120 mg/m2 2krát denně ve dnech –6 až –3, etoposid 240 mg/m2 1krát denně ve dnech –6 až –3, melfalan 140 mg/m2 v den –2. Vysokodávkovaná chemoterapie proběhla bez komplikací.
Několik dní před podáním vysokodávkované chemoterapie s autologní transplantací proběhlo v pořadí druhé FDG‑PET vyšetření. Toto vyšetření znázornilo pouze ložisko hypermetabolizmu glukózy v proximální tibii o aktivitě SUV 4,6 svědčící pro perzistenci vitální nádorové tkáně. Další ložiska patologického hypermetabolizmu glukózy nebyla nalezena, a to ani v inguinách nebo v parenchymatózních orgánech.
Proto po ukončení vysokodávkované chemoterapie s autologní transplantací následovala ve dnech 30. 10. 2007 až 17. 12. 2007 radikální radioterapieproximální části tibie vlevo. Na lineárním urychlovači byla aplikovaná dávka do ICRU bodu 70 Gy v 35 frakcích technikou 2 lateroleterálních polí (2 LL pole) s postupným zmenšováním polí (po 50 Gy zmenšení bezpečnostního lemu). Použitá energie brzdného záření byla 6 MV. Při ukončení radioterapie byla hodnocena akutní toxicita stupněm 1 dle RTOG kritérií.
Za 3 měsíce po ukončení ozařování bylo v plánu provést kontrolní třetí FDG‑PET vyšetření. Na ambulantní kontrolu se dostavil pacient v únoru roku 2008. V té době již měl novou hmatnou zvětšenou uzlinu v levém třísle. Třetí kontrolní FDG‑PET vyšetření, provedené počátkem měsíce března roku 2008, prokázalo perzistenci viabilní nádorové tkáně v proximální tibii vlevo (SUV 2,69) a v regionální uzlině v levém třísle (SUV 4,09). Drobné ložisko vyšší konzumpce glukózy v břiše vpravo bylo hodnoceno jako nespecifické. Sonograficky byla v třísle zřetelná patologická uzlina velikosti 38 × 14 × 20 mm.
Takže po intenzivní chemoterapii zakončené vysokodávkovanou chemoterapií s autologní transplantací krvetvorných buněk a po ozáření primárního tumoru proximální části bérce (tibie) jsme za 4 měsíce po ukončení léčby měli průkaz metastatického postižení regionálních lymfatických uzlin v třísle a dle intenzity konzumpce glukózy viabilní nádor v tibii.
Tento vývoj signalizuje značnou chemorezistenci tumoru. S pacientem jsme probrali další možnosti: léčbu vysokodávkovanou chemoterapií s alogenní transplantací, anebo provedení možné chirurgické léčby: exartikulace v kolením kloubu a odstranění všech tříselních uzlin. Pacient souhlasil s upřednostněním radikální chirurgické léčby.
Pacient tuto operaci podstoupil v dubnu roku 2008 na I. ortopedické klinice LF MU a FN u sv. Anny v Brně, kde byla provedena exartikulace v kloubu kolením vlevo a odstranění tříselných uzlin vlevo. Stav byl komplikován sekundárním hojením.
Při histologickém vyšetření materiálu odebraného z třísla byla prokázána infiltrace dvou lymfatických uzlin sarkomem z interdigitujících dendritických buněk. Z resekované nohy byly odebrány vzorky z primárního tumoru k vyšetření, v nich však nebyla viabilní neoplastická tkáň zachycena ani při velmi pečlivém vyšetření.
Vzhledem k negativnímu histologickému nálezu z oblasti primárního tumoru po provedené radioterapii (což signalizovalo určitou radiosenzitivitu) jsme se rozhodli k radioterapii na oblast levého třísla. Plánovaná dávka 56 Gy ve 28 frakcích, použili jsme konformní radioterapii, techniku dvou protilehlých polí (AP/PA) s bolusem a kombinací svazků brzdného záření s energií 6 a 18 MV (s akutní toxicitou stupně 1–2).
Další kontrolní PET-CT vyšetření bylo provedeno v říjnu roku 2008, CT zobrazení prokázalo pakety zvětšených lymfatických uzlin v oblasti ilických a paraaortálních uzlin až velikosti 6 cm, jejichž aktivita při PET zobrazení dosahuje SUV 5,9–6,73.
Takže další progrese nemoci, zřejmě v oblasti s dříve okultními mikrometastázami došlo k proliferaci do relativně značných rozměrů, oblasti nad bránicí jsou dle PET zobrazení bez postižení.
Otázka je, jak reagovat na progresi nemoci, nereagující na MegaCHOP a vysokodávkovanou chemoterapii BEAM s autologní transplantací krvetvorné tkáně.
T.č. jsme zahájili paliativní chemoterapii 2-chlordeoxyadenosin a další postup bude dle citlivosti nemoci na tento lék. Průběh nemoci shrnuje tab. 1.
Diskuze
Sarkomy z interdigitujících dendritických buněk anebo folikulárních dendritických buněk jsou extrémně vzácné. Jejich výskyt je tak nízký, že v literatuře nelze nalézt informace o jejich incidenci. Informace o těchto typech nádoru lze čerpat pouze z popisů jednotlivých případů nebo z popisů nevelkých skupin nemocných. Z přehledu publikací o dendritických sarkomech je zřejmé, že sarkomy z interdigitujících dendritických buněk jsou mnohem vzácnější než sarkomy z folikulárních dendritických buněk. Odborná literatura popisuje jak nodální, tak extranodální místa vzniku primárního tumoru.
Poměrně četné jsou popisy případů, kdy primární lokalizace byla v periferních uzlinách krku, podpaží a třísel [4–17]. Relativně četné jsou také popisy primární nodální či extranodální lokalizace těchto sarkomů v ORL oblasti [18–36] a v orgánech a tkáních dutiny břišní [37–48], zatímco v dutině hrudní se vyskytují méně často [49–53]. Zcela raritní jsou pak popisy dendritického sarkomu v prsu [54], víčku [55], močovém měchýři [56], varleti [57]. Současná přítomnost buněk dvou maligních linií v uzlině byla také popsána: sarkom z interdigitujících buněk a maligní lymfom [7]. O postižení kostní dřeně mluví pouze jedna práce [49]. Popis primárního vzniku tumoru v končetině jsme literatuře nenašli.
Stanovení diagnózy sarkomu z interdigitujících dendritických buněk není možné pouze na podkladě klinických nebo světelně mikroskopických nálezů, k potvrzení jsou nutná imunohistochemická a také ultrastrukturální vyšetření. Vzhledem ke vzácnosti tohoto typu tumorů je vhodné tuto diagnózu nechat potvrdit i na dalších morfologických pracovištích [58–66].
Při morfologickém vyšetření je nutné diferenciálně diagnosticky vyloučit především sarkomy z jiných typů dendritických buněk, které mají podobnou morfologii, diferencující jsou tedy jejich imunohistologické profily. Sarkom z folikulárních dendritických buněk může mít podobný vzhled, zvláště vírovitý růst vřetenitých buněk, které jsou nicméně CD21, CD23 a CD35 pozitivní [1–3]. CD21, CD23 a CD35 jsou markery folikulárních dendritických buněk a buňky sarkomu z interdigitujících dendritických buněk jsou při vyšetření na tyto markery negativní.
Z tumorů z Langerhansových buněk se může sarkomu z interdigitujících dendritických buněk podobat zvláště sarkom z Langerhansových buněk, tento typ tumoru je nicméně charakteristický svou CD1a pozitivitou při imunohistologickém vyšetření a jejich imunoprofil umožňuje snadné odlišení. Ultrastrukturálně lze u nádorů z Langerhansových buněk nalézt Bierbeckova granula, která u tumorů z interdigitujících dendritických buněk chybí. Rovněž sarkom z intermediárních dendritických buněk by byl CD1a pozitivní. Další možností v diferenciální diagnóze je pravý histiocytární sarkom, i když je nutné myslet na to, že většina případů dříve takto klasifikovaných byla přehodnocena na velkobuněčné anaplastické lymfomy nebo periferní T‑lymfomy při užití molekulárně genetických metodik. Při uplatnění striktních diagnostických kritérií je histiocytární sarkom velmi vzácný [58,59]. Úvodní morfologický dojem u histiocytárního sarkomu je velkobuněčný difuzní lymfom nebo anaplastický lymfom, tedy poněkud odlišný od vřetenobuněčného nádoru, jakým je sarkom z interdigitujících dendritických buněk. Imunohistologicky S-100 protein exprimují v nižším počtu případů, asi v 1/3, zatímco u sarkomu z interdigitujících dendritických buněk je exprese S-100 konzistentní. Při elektronově mikroskopickém vyšetření chybí atributy tumoru z interdigitujících dendritických buněk, interdigitující junkce. Inflamatorní myofibroblastický tumor nebo sarkom, který byl popsán v nejrůznějších anatomických lokalizacích, může mít obdobnou morfologii, ale je S-100 protein negativní, a oproti tumoru z interdigitujících dendritických buněk je pozitivní při vyšetření s protilátkami proti svalovým markerům, tedy hladkosvalovému aktinu a často desminu, a v 1/3 případů je rovněž cytokeratin pozitivní.
Vždy je nutné myslet na možnost metastatického melanomu, který je rovněž S-100 protein pozitivní, ale jsou pozitivní i melanocytární markery, HMB45, popřípadě Melan A. Dále vstupuje do diferenciální diagnózy řada dalších jednotek, nejčastěji z oblasti mezenchymálních malignit, jako je gastrointestinální stromální tumor v určitých lokalizacích, maligní fibrózní histiocytom, fibrosarkom či leiomyosarkom. Všechny lze odlišit na základě poněkud rozdílných morfologických znaků a imunofenotypu.
Léčebné postupy se ve většině případů sarkomů z interdigitujících buněk omezily na radikální operaci. Pouze v jedné práci je popsán výborný účinek chemoterapie ABVD u sarkomu z dendritických buněk [68]. Další literární odkaz, popisující chemosenzitivitu sarkomu z interdigitujících buněk, jsme od roku 2001 (kdy se začala používat WHO definice tohoto specifického typu tumor) nenašli.
Zatímco informace o chemosenzitivitě sarkomu z interdigitujících dendritických buněk jsou zcela ojedinělé, více informací je o léčebné účinnosti chemoterapeutických režimů u podobného tumoru – sarkomu z folikulárních dendritických buněk. U sarkomu z folikulárních dendritických buněk se uvádí, že chemoterapeutické kombinace s akronymy CHOP, ABVD, DHAP, EPOCH, ICE a kombinace cisplatiny epirurbicinu měly velmi limitovaný přínos [2,5,13,15,57].
Zcela výjimečným případem je dosažení kompletní remise u pacienta s diseminovaným sarkomem z folikulárních dendritických buněk kombinovanou terapií imatinibem (Glivec), gemcitabinem a cisplatinou. Imunohistochemické vyšetření u tohoto pacienta prokázalo pozitivitu c-kit proteinu/CD117 antigenu [67], což však u našeho nemocného nebylo při vyšetření v Regensburgu.
Vzhledem k raritnosti této diagnózy (sarkomu z interdigitujících dendritických buněk) neexistují tedy žádné standardní doporučené léčebné postupy pro tuto nosologickou jednotku.
V našem případně jsme diagnostikovali nemoc v lokálně pokročilém stadiu, postihující kost i měkké tkáně a s přítomností histologicky prokázané metastázy v tříselné lymfatické uzlině a s postižením lymfatických cest mezi bércem a tříselnými uzlinami dle FDG‑PET vyšetření.
Při prokázané metastáze v tříselné uzlině je možné postižení i vyšších etáží, ale nemusí být vždy přítomno. Proto jsme pro iniciální léčebný postup zvolili chemoterapii. Vzhledem k popisované malé léčebné odpovědi podobného typu tumoru – sarkomu z folikulárních dendritických buněk – jsme pro iniciální léčbu zvolili intenzivní chemoterapii MegaCHOP. Při neměnném klinickém nálezu tumorózně zduřených měkkých tkání proximální části bérce jsme po 4 cyklech tuto léčbu ukončili, provedli sběr kmenových krvetvorných buněk a provedli vysokodávkovanou chemoterapii s autologní transplantací režimem BEAM, který je jinak standardně používán u lymfomů. Vzhledem k tomu, že postižené tříselné uzliny byly před zahájením chemoterapie exstirpovány, následovala po ukončení chemoterapie radioterapie cílená pouze na tumor bérce.
Velmi nepříjemným překvapením však byla recidiva v oblasti třísla a jednoznačně patologický nález při FDG‑PET zobrazení v oblasti primárního tumoru a regionálních inguinálních uzlin v třísle 3 měsíce po ukončení radioterapie. Tříměsíční interval od ukončení radioterapie je přitom standardním intervalem pro vyhodnocování léčebné odpovědi po radioterapii metodou FDG‑PET. V průběhu tří měsíců by v případě léčebné odpovědi měla vymizet aktivita způsobená zánětlivou reakcí po ukončené radioterapii.
V tomto případně šlo o velmi časnou recidivu nemoci, což signalizuje nepříznivý průběh. Proto jsme po domluvě s pacientem volili operační řešení. Vzhledem k tomu, že CT ani PET vyšetření v té době neprokázalo postižení uzlin nad tříselním vazem či další diseminaci nemoci, byla provedena exartikulace v koleni a odstranění lymfatických uzlin ve třísle. Histologické vyšetření několika míst z oblasti bérce však neprokázalo jednoznačnou přítomnost maligní tkáně v ozářené části bérce, zatímco inguinální uzliny byly jednoznačně postižené sarkomem z interdigitujících dendritických buněk. Místo předchozího nádoru v tibii bylo histologicky vyšetřováno velmi extenzivně (18 tkáňových bloků) a pravděpodobnost, že reziduální tumor byl přítomen, ale nezastižen při vyšetření, je dle slov patologa, velmi nízká. Spíše lze soudit na kompletní odpověď na terapii v této lokalizaci a pozitivní PET lze přičítat reparativně zánětlivým procesům, které přetrvávaly po delší dobu, než je standardně doporučovaný tříměsíční interval mezi ukončením záření a PET hodnocení efektu radioterapie na nádorovou masu. Míra kumulace glukózy v bérci před exartikulací byla dle PET vyšetření jednoznačně v pásmu malignity. Alternativním vysvětlením této vysoké aktivity při PET zobrazení a negativního histologického vyšetření by bylo nezastižení viabilní nádorové tkáně ve vyšetřovaném resekovaném bérci.
Nepřítomnosti viabilní tkáně v ozáření oblasti by svědčilo pro určitou radiosenzitivitu tohoto typu tumoru, zatím časné metastazování svědčí o rezistenci této nemoci na použitou klasickou chemoterapii a vysokodávkovanou chemoterapii s autologní transplantací.
Vzhledem k tomu, že v listopadu roku 2008 byla prokázána progrese nemoci v uzlinách dutiny břišní, ne však výše, je nutno zvažovat další postup. V současnosti testujeme citlivost na 2-chlordeoxyadenosin a dále je zvažována resekce postižených uzlin a případně jiné experimentální postupy.
Závěr
Citovaná literatura popisuje sarkomz interdigitujících dendritických buněk, nejčastěji v lymfatické tkáni, méně často v orgánech. Popis vznik tohoto tumoru v končetině nebyl dle našich vědomostí zatím nikdy dříve publikován, toto je první popis tohoto typu tumoru primárně lokalizovaného v končetině.
Zkušenosti s chemoterapií jsou u tohoto typu tumoru velmi limitované, nalezli jsme pouze jeden popis případu léčeného chemoterapií, kde se uvádí citlivost k neagresivní chemoterapii ABVD.
Použití vysokodávkované chemoterapie s autologní transplantací, byť s nedostatečným efektem, nebylo zatím v literatuře u interdigitujícího dendritického sarkomu popsáno. Naším popisem případu dokumentujeme chemorezistenci jak k intenzivní chemoterapii, tak vysokodávkované chemoterapii s podporou autologní transplantace. Námi popsaný tumor byl však senzitivní na vyšší dávky záření, protože v ozářeném, následně amputovaném a histologicky vyšetřeném bérci nebyla histologicky prokázána maligní tkáň.
Za konzultaci histologických preparátů děkujeme:
We thank to Prof. Dr. Med. F. Hofstätdter, Institut für Pathologie, Medizinische Fakultät der Universität Regensburg, Franz Josef Strauss Allee 93063 Regensburg for histologic consulation of tissue specimen.
Práce vznikla v rámci VZ MSM 0021622434a grantu LC06027 Masarykovy univerzity, Česká republika.
Doručeno do redakce: 1. 10. 2008
Přijato po recenzi: 10. 11. 2008
prof. MUDr. Zdeněk Adam, CSc.
www.fnbrno.cz
e‑mail: z.adam@fnbrno.cz
Zdroje
1. De Pas T, Spitaleri G, Pruneri G et al. Dendritic cell sarcoma: an analytic overview of the literature and presentation of original five cases. Crit Rev Oncol Hematol 2008; 65 : 1–7.
2. Kairouz S, Hashash J, Kabbara W et al. Dendritic cell neoplasms: an overview. Am J Hematol 2007; 82 : 924–928.
3. Fonseca R, Tefferi A, Strickler JG. Follicular dedritic cell sarcoma mimicking diffuse large cell lymphoma. Am J Hematol 1997, 55 : 148–149.
4. Fonseca R, Yamakawa M, Nakamura S et al. Follicular dendritic cell sarcoma and interdigitating reticulum cell sarcoma: a review. Am J Hematol 1998; 59 : 161–167.
5. Gaertner EM, Tsokos M, Derringer GA et al. Interdigitating dendritic cell sarcoma: A report of four cases and review of the literature. Amer J Pathol 2001; 115 : 589–597.
6. Barwell N, Howatson R, Jackson R et al. Interdititating dendritic cell sarcoma of solivary gland associated lymphoid tissue not associated with HHV-8 or EBV infection. J Clin Pathol 2004; 57 : 87–89.
7. Cossu A, Deiana A, Lissia A et al. Synchronous interdigitating dendritic cell sarcoma and B-cell small lymphocytic lymphoma in a lymph node. Arch Pathol Lab Med 2006; 130 : 544–547.
8. Feldman AL, Arber DA, Pittaluga S et al. Clonally related follicular lymphomas and histiocytic/dendritic cell sarcomas: evidence for transdifferentiation of the follicular lymphoma clone. Blood 2008; 111 : 5433–5439.
9. Hangai K, Nonaka S, Iwakiri H et al. Follicular dendritic cell tumor of the cervical lymph node. ORL J Otorhinolaryngol Relat Spec 2002; 64 : 229–232.
10. Jo S, Babb M, Hilsinger R. Interdigitating dendritic cell sarcoma of the cervical lymph nodes. Arch Otolaryngol Head and Neck Surg 2006; 132 : 1257–1259.
11. Moz U, Pignatelli U, Forner P et al. Follicular dendritic cell tumour of the cervical lymph node: case report and brief review of literature. Acta Otorhinolaryngol Ital 2004; 24 : 223–225.
12. Nakamura S, Koshikawa T, Kitoh K et al. Interdigitating cell sarcoma. A morphologic and immunohistologic study of lymph node lesions in four cases. Pathol Int 1994; 44 : 374–386.
13. Rousselet MC, Francois S, Croue A et al. A lymph node reticulum cell sarcoma. Arch Path Lab Med 1994; 118 : 183–184.
14. Togashi K, Shinohara H, Isoda M. Primary mediastinal lymph node malignancy with features suggestive of dendritic cell sarcoma. Jpn J Thorac Cardiovasc Surg 2005; 53 : 377–381.
15. Uluoglu O, Akyurek N, Uner A et al. Interdigitating dendritic cell tumor with breast and cervical lymph-node involvement. A case report and review of the literature. Virchows Arch 2005; 446 : 545–554.
16. Ylagan LD, Barlett NL, Kraus M. Interdigitating dendritic cell tumor of lymph nodes. Case report with differential diagnostic consideration. Diagn Cytopahol 2003; 28 : 278–281.
17. Zivkovic V, Basic M, Gligorijevic J et al. Follicular dendritic cell sarcoma in the lymph nodes of the neck. Bratisl Lek Listy 2007; 108 : 368–370.
18. Sharma M, Ahsan F, See A et al. Interdigitating dendritic cell sarcoma of the parotid gland. J Laryngoly Otology 2006; 120 : 244–246.
19. Androulaki A, Giaslakiotis K, Lazaris AC. Interdigitating dendritic cell sarcoma/tumour of the tonsil. Br J Haematol 2005; 131 : 415.
20. Clement P, Saint-Blancard P, Minvielle Fet al. Follicular dendritic cell sarcoma of the tonsil: a case report. Am J Otolaryngol 2006; 27 : 207–210.
21. Ludwig A. Extranodal follicular dendritic cell sarcoma of the tonsils. HNO 2006; 54 : 701–704.
22. McDuffie C, Lian TS, Thibodeaux J. Follicular dendritic cell sarcoma of the tonsil: a case report and literature review. Ear Nose Throat J 2007; 86 : 234–235.
23. Tisch M, Hengstermann F, Kraft K et al. Follicular dendritic cell sarcoma of the tonsil: report of a rare case. Ear Nose Throat J 2003; 82 : 507–509.
24. Kawachi K, Nakatani Y, Inayama Y et al. Interdigitating dendritic cell sarcoma of the spleen: report of a case with a review of the literature. Am J Surg Pathol 2002; 26 : 530–537.
25. Araújo VC, Martins MT, Salmen FS et al. Extranodal follicular dendritic cell sarcoma of the palate. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1999; 87 : 209–214.
26. Biddle DA, Ro JY, Yoon GS et al. Extranodal follicular dendritic cell sarcoma of the head and neck region: three new cases, with a review of the literature. Mod Pathol 2002; 15 : 50–58.
27. Domínguez-Malagón H, Cano-Valdez AM, Mosqueda-Taylor A et al. Follicular dendritic cell sarcoma of the pharyngeal region: histologic, cytologic, immunohistochemical, and ultrastructural study of three cases. Ann Diagn Pathol 2004; 8 : 325–332.
28. Encabo RS, McHugh J, Carrau RL et al. Follicular dendritic cell sarcoma of the nasopharynx. Am J Otolaryngol 2008; 29 : 262–264.
29. Ferringer T, Banks PM, Metcalf JS. Langerhans cell sarcoma. Am J Dermatopathol 2006; 28 : 36–39.
30. Georgalas C, Kanagalingam J, Gallimore A et al. Follicular dendritic cell sarcoma arising from the hypopharynx. J Laryngol Otol 2004; 118 : 317–318.
31. Gordon MK, Kraus M, van Besien K. Interdigitating dendritic cell tumors in two patients exposed to topical calcineurin inhibitors. Leuk Lymphoma 2007; 48 : 816–818.
32. Pisani F, Marino M, Sentinelli S et al. Follicular dendritic cell sarcoma of the neck: report of a case treated by surgical excision and COP plus (PEG)‑liposomal doxorubicin. J Exp Clin Cancer Res 2008; 27 : 33.
33. Chera BS, Orlando C, Villaret DB et al. Follicular dendritic cell sarcoma of the head and neck: case report and literature review. Laryngoscope 2008; 118 : 1607–1612.
34. Ryley NG. Follicular dendritic cell sarcoma of lymph node. Cytopathology 2000; 11 : 135.
35. Sahadevan K, Banerjee A, Wight R. Follicular dendritic cell sarcoma of a cervical lymph node: case report and review of the literature. Ear Nose Throat J 2004; 83 : 848–849.
36. Martins MT, Witzel AL, Sugaya NN et al. Dendritic cell sarcoma of the oral cavity. Oral Oncol 2004; 40 : 341–347.
37. Kanaan H, Al-Maghrabi J, Linjawi Aet al. Interdigitating dendritic sarcoma of the duodenum with rapidly fatal course. Arch Patol Lab Med 2006; 130 : 205–208.
38. Banner B, Beachamp ML, Liepman M et al. Interdigitating reticulum cell sarcoma of the intestine. A case report. Diagn Cytopahtol 1997; 17 : 216–222.
39. Devi S, Sunila, Siddesh G. Follicular dendritic cell tumor of mesentery – a case report. Indian J Pathol Microbiol 2004; 47 : 399–401.
40. Díaz de Liaño A, Garde C et al. Intra-abdominal follicular dendritic cell sarcoma. Clin Transl Oncol 2006; 8 : 837–838.
41. Yamakawa M, Andoh A, Masuda A et al. Follicular dendritic cell sarcoma of the omentum. Virchows Arch 2002; 440 : 660–663.
42. Schwarz RE, Chu P, Arber DA. Extranodal follicular dendritic cell tumor of the abdominal wall. J Clin Oncol 1999; 17 : 2290–2292.
43. Loo CK, Henderson C, Rogan K. Intraabdominal follicular dendritic cell sarcoma: report of a case with fine needle aspiration findings. Acta Cytol 2001; 45 : 999–1004.
44. Low SE, Menasce LP, Manson CM. Follicular dendritic cell sarcoma: a rare tumor presenting as an abdominal mass. Int J Surg Pathol 2007; 15 : 315–317.
45. Geerts A, Lagae E, Dhaene K et al. Metastatic follicular dendritic cell sarcoma of the stomach: a case report and review of the literature. Acta Gastroenterol Belg 2004; 67 : 223–227.
46. Han JH, Kim SH, Noh SH et al. Follicular dendritic cell sarcoma presenting as a submucosal tumor of the stomach. Arch Pathol Lab Med 2000; 124 : 1693–1696.
47. Chang KC, Jin YT, Chen FF et al. Follicular dendritic cell sarcoma of the colon mimicking stromal tumour. Histopathology 2001; 38 : 25–29.
48. Sander B, Middel P, Gunawan B et al. Follicular dendritic cell sarcoma of the spleen. Hum Pathol 2007; 38 : 668–672.
49. Jiang L, Admirand JH, Moran C et al. Mediastinal follicular dendritic cell sarcoma involving bone marrow: a case report and review of the literature. Ann Diagn Pathol 2006; 10 : 357–362.
50. Kröber SM, Marx A, Aebert H et al. Sarcoma of follicular dendritic cells in the dorsal mediastinum. Hum Pathol 2004; 35 : 259–263.
51. Leipsic JA, McAdams HP, Sporn TA. Follicular dendritic cell sarcoma of the mediastinum. AJR Am J Roentgenol 2007; 188: W554–W556.
52. Grogg KL, Lae ME, Kurtin PJ et al. Clusterin expression distinguishes follicular dendritic cell sarcoma from other dendritic cell neoplasm. Amer J Surg Pathol 2004; 28 : 988–998.
53. Voigt LP, Hmidi A, Pastores SM et al. Management dilemmas due to a paratracheal follicular dendritic cell tumor. Ann Thorac Surg 2006; 82 : 1898–1900.
54. Pruneri G, Masullo M, Renne G et al. Follicular dendritic cell sarcoma of the breast. Virchows Arch 2002; 441 : 194–199.
55. Boldin I, Brix-Grünwald G, Scarpatetti MM et al. Interdigitating dendritic cell sarcoma of the eyelid with a rapidly fatal course. Arch Ophthalmol 2008; 126 : 738–740.
56. Rupar C, Beham Schmid C, Galle G et al. Interdigitating dendritic cell sarcoma of urinary bladder mimicking large intravesical calculus. Urology 2005; 566 : 1109.e1–1109.e3.
57. Luk I, Shek T, Tang V. Interdigitating dendritic cell tumor of the testis. A novel testicular spindle cell neoplasm. Amer J Surg Pathol 1999; 23 : 1141–1148.
58. Pileri SA, Grogan TM, Harris NL et al. Tumours of histiocytes and accessory dendritic cells: an immunohistochemical approach to classification from the International Lymphoma Study Group based on 61 cases. Histopathology 2002; 41 : 1–29.
59. Pillay K, Salomon R, Daubenton JD et al. Interdigitating dendritic cell sarcoma. A report of four pediatric cases. Histopathology 2004; 44 : 283–291.
60. Soriano AO, Thompson MA, Admirand JH et al. Follicular dendritic cell sarcoma: a report of 14 cases and a review of the literature. Am J Hematol 2007; 82 : 725–728.
61. Torres U, Hawkins WG, Antonescu CR et al. Hepatic follicular dendritic cell sarcoma without Epstein‑Barr virus expression. Arch Pathol Lab Med 2005; 129 : 1480–1483.
62. Krokowski M, Merz H, Thorns C et al. Sarcoma of follicular dendritic cells with features of sinus lining cells – a new subtype of reticulum cell sarcoma? Virchows Arch 2008; 452 : 565–570.
63. Nayer H, Murphy KM, Hawkins AL et al. Clonal cytogenetic abnormalities and BCL2 rearrangement in interdigitating dendritic cell sarcoma. Leuk Lymphoma 2006; 47 : 2651–2654.
64. Meijs M, Mekkes J, van Noesel C et al. Paraneoplastic pemphigus associated with follicular dendritic cell sarcoma without Castleman’s disease; treatment with rituximab. Int J Dermatol 2008; 47 : 632–634.
65. Zhu X, Zhang B. Paraneoplastic pemphigus. J Dermatol 2007; 34 : 503–511.
66. Diaz-Sarrio C, Salvatella–Danés N, Castro‑Forns M et al. Langerhans cell sarcoma in a patient who underwent transplantation. J Eur Acad Dermatol Venereol 2007; 21 : 973–976.
67. Azim HA, Elsedewy E, Azim HA Jr. Imatinib in the treatment of follicular dendritic sarcoma: a case report and review of literature. Onkologie 2007; 30 : 381–384.
68. Olnes MJ, Nicol T, Duncan M et al. Interdigitating dendritic cell sarcoma: a rare malignancy responsive to ABVD chemotherapy. Leuk Lymphoma 2002; 43 : 817–821.
69. Choi JW, Lee JH, Kim A et al. Follicular dendritic cell sarcoma arising in the dura mater of the spine. Arch Pathol Lab Med 2006; 130 : 1718–1721.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2009 Číslo 2- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Nech brouka žít… Ať žije astma!
- Intermitentní hladovění v prevenci a léčbě chorob
- Statinová intolerance
-
Všetky články tohto čísla
- Vplyv telesnej hmotnosti na riziko venózneho tromboembolizmu
- Diurnální variabilita krevního tlaku u pacientů s hypertenzí a revmatoidní artritidou
- Záchovné operace a plastiky aortální chlopně – od anatomie chlopně až k dlouhodobým výsledkům
- Kombinace inhibitoru ACE a blokátoru kalciových kanálů je optimální dvojkombinací léčby hypertenze
- Povrchová tromboflebitída – diagnostika a liečba
- Doporučení pro duplexní ultrazvukové vyšetření končetinových žil
- Sarkom z interdigitujících dendritických buněk dolní končetiny rezistentní k vysokodávkované chemoterapii BEAM s autologní transplantací kmenových krvetvorných buněk – popis případu a přehled literatury
- Za docentom MUDr. Tomášom Hildebrandom, CSc.
- XVI. česko-slovenská konference o hemostáze a trombóze s mezinárodní účastí
- Recenze
- Metabolický syndrom, tělesná hmotnost a žilní trombóza – editorial
- Střednědobé výsledky implantací aortálního alograftu
- Patofyziologie vzniku metabolické acidózy u pacientů se sníženou glomerulární filtrací z hlediska Stewartovy-Fenclovy teorie
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Povrchová tromboflebitída – diagnostika a liečba
- Doporučení pro duplexní ultrazvukové vyšetření končetinových žil
- Záchovné operace a plastiky aortální chlopně – od anatomie chlopně až k dlouhodobým výsledkům
- Kombinace inhibitoru ACE a blokátoru kalciových kanálů je optimální dvojkombinací léčby hypertenze
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




