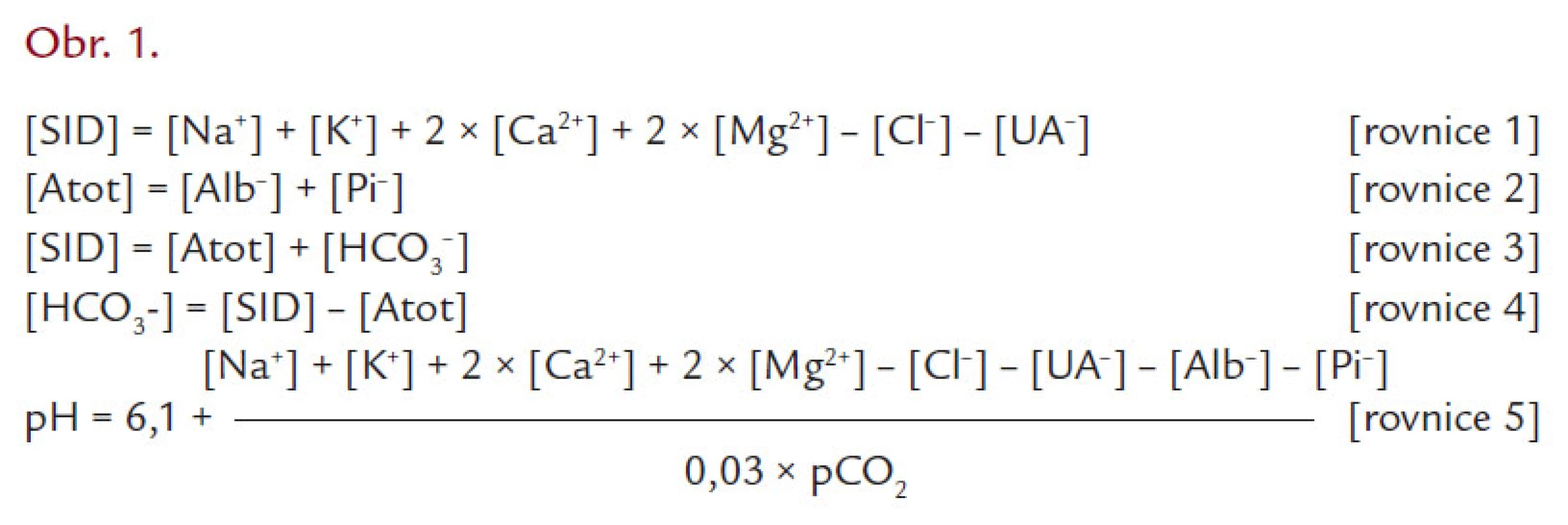-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Patofyziologie vzniku metabolické acidózy u pacientů se sníženou glomerulární filtrací z hlediska Stewartovy-Fenclovy teorie
Pathophysiology of metabolic acidosis in patients with reduced glomerular filtration rate according to Stewart-Fencl theory
Aim:
Metabolic acidosis is a regular sign of renal insufficiency. Conventional assessment of acid-base balance using Henderson-Hasselbalch equation does not make identification of the cause of metabolic disorders possible as the serum HCO3– concentration might only reflect changes to the overall plasma ion spectrum. Therefore, we used the Stewart-Fencl approach that is based on a more detailed physical and chemical analysis and that showed that changes to serum HCO3– concentration are closely related to parameters not usually monitored in connection to acid-base balance.Patient group and methodology:
We performed a single measurement of arterial or capillary blood pH and pCO2 in 69 non-dialysed patients with glomerular filtration rate ranging from 0.04 to 0.88 ml/s/1.73 m2 according to MDRD, standard calculation of serum HCO3– concentration using Henderson-Hasselbalch equation was carried out, and serum albumin and ion concentrations (Na+, K+, Cl, Pi) plus creatinine and urea concentrations were determined from venous blood.Results:
Metabolic acidosis was present in 47 patients ([S-HCO3–] < 22 mmol/l) with the mean [S-HCO3–] value of 19.6 mmol/l for the entire group. We proved a statistically significant correlation between [S-HCO3–] and [SID] (p < 0.001), and between [S-HCO3–] and the individual [SID] determining factors: [Na+-Cl–], [UA–], [Pi–], [K+] (p < 0.01). Conclusion: Reduction in [S-HCO3–] in non-dialysed patients with reduced glomerular filtration is predominantly associated with a decrease in [Na+-Cl–] difference, the quantitative contribution of which to metabolic acidosis is more significant than the strong acids retention. In addition to [S-Cl–] increase, [S-Na+] reduction too has a major role in reducing the [Na+-Cl–] difference.Key words:
renal insufficiency – metabolic acidosis – Stewart theory - strong ion difference - unidentified anions - [Na+-Cl–] difference
Autoři: J. Havlín 1; K. Matoušovic 1; O. Schück 1; M. Horáčková 1; J. Charvát 1; K. Kotaška 2
; D. Králová 1
Působiště autorů: Interní klinika 2. lékařské fakulty UK a FN Motol Praha, přednosta prof. MUDr. Milan Kvapil, CSc., MBA 1; Ústav klinické biochemie a patobiochemie 2. lékařské fakulty UK a FN Motol Praha, přednosta prof. MUDr. Richard Průša, CSc. 2
Vyšlo v časopise: Vnitř Lék 2009; 55(2): 97-104
Kategorie: Původní práce
Souhrn
Cíl:
Metabolická acidóza je téměř konstantním projevem renální insuficience. Při konvenčním hodnocení acidobazické rovnováhy na základě Hendersonovy-Hasselbalchovy rovnice nejsme schopni definovat příčinu metabolických poruch, neboť sérová koncentrace HCO3– může být pouze odrazem změn celkového spektra plazmatických iontů. Použili jsme proto Stewartovu-Fenclovu teorii, vycházející z podrobnější fyzikálně‑chemické analýzy, ze které je patrné, že změna sérové koncentrace HCO3– úzce souvisí s veličinami, ve spojitosti s acidobazickou rovnováhou běžně nesledovanými.Soubor pacientů a metodika:
U 69 nedialyzovaných nemocných s glomerulární filtrací pohybující se mezi 0,04 a 0,88 ml/s/1,73m2 dle MDRD jsme jednorázově změřili pH a pCO2 arteriální či kapilární krve, sérovou koncentraci HCO3– jsme standardně dopočítali z Hendersonovy-Hasselbalchovy rovnice, z venózní krve jsme určili sérové koncentrace albuminu a iontů: Na+, K+, Cl–, Pi, dále sérové koncentrace kreatininu a urey.Výsledky:
U 47 nemocných byla přítomna metabolická acidóza ([S-HCO3–] < 22 mmol/l), s průměrnou hodnotou [S-HCO3–] celého souboru 19,6 mmol/l. Prokázali jsme statisticky signifikantní korelaci mezi [S-HCO3–] a [SID] (p < 0,001), dále mezi [S-HCO3–] a jednotlivými faktory determinujícími [SID]: [Na+-Cl–], [UA–], [Pi–], [K+] (p < 0,01).Závěr:
U nedialyzovaných pacientů s poklesem glomerulární filtrace je snížení [S-HCO3–] asociováno majoritně s poklesem [Na+-Cl–] diference, jejíž kvantitativní příspěvek k metabolické acidóze je významnější než retence silných kyselin. Na snížení [Na+-Cl–] diference se kromě zvýšení [S-Cl–] významně uplatňuje i pokles [S-Na+].Klíčová slova:
renální isuficience – metabolická acidóza – Stewartova teorie – strong ion difference – unidentified anions – [Na+-Cl–] diferenceÚvod
K hodnocení acidobazické rovnováhy (ABR) používáme Hendersonovu-Hasselbalchovu rovnici. Ta nám umožňuje posoudit, jak dalece se na změně pH vnitřního prostředí podílí složka respirační a složka nerespirační, resp. metabolická. Metabolické poruchy ABR hodnotíme dle [S-HCO3–], jejíž snížení svědčí pro metabolickou acidózu.
Metabolickou acidózu považujeme za součást renální insuficience. Se snižující se glomerulární filtrací (GFR) klesá [S-HCO3–]. Nejedná se o vztah lineární, k poklesu dochází při 20–25 % normální GFR [1].
Současná interpretace metabolické acidózy u nemocných se sníženou GFR, vycházející z Hendersonova-Hasselbalchova pojetí ABR, vysvětluje pokles [S-HCO3–] vzestupem koncentrace chloridů (hyperchloremická acidóza s normální aniontovou mezerou), který s postupující redukcí GFR prohlubují nahromaděné kyselé metabolity (metabolická acidóza se zvýšenou aniontovou mezerou) [2]. Vznik hyperchloremické metabolické acidózy je vysvětlován ztrátou renálního parenchymu, v jejímž důsledku je omezena tvorba HCO3– v tubulárních buňkách. Pokles [S-HCO3–] je v tomto případě kvantitativně vyvážen vzestupem [S-Cl-]. Metabolická acidóza se zvýšenou aniontovou mezerou je spojována s další progresí destrukce parenchymu, kdy je GFR již tak nízká, že je omezeno vylučování aniontů silných kyselin, jejichž retence vede ke zvýšení aniontové mezery [3].
Novější přístup k hodnocení acidobazického stavu dle Stewarta a Fencla vychází z podrobnější fyzikálně‑chemické analýzy, založené na principu elektroneutrality (schéma 1) – součet koncentrací plazmatických kationtů je vždy roven součtu plazmatických aniontů [4–9].
Schéma 1. Princip elektroneutrality. 
Koncepce vychází z předpokladu, že primární změny některých iontů vyvolají následné změny acidobazických parametrů [10–12].
Stewart rozlišuje 3 nezávislé proměnné určující plazmatické pH:
- pCO2 – reprezentuje respirační komponentu stejně jako u Hendersonovy-Hasselbalchovy rovnice
- [SID] „strong ion difference“ – rozdíl součtu kladných a záporných nábojů na plně disociovaných kationtech a aniontech [rovnice 1]. Plně disociované jsou všechny kationty (Na+, K+, Ca2+, Mg2+), z aniontů se jedná o chloridy a [UA-] (unidentified anions – běžně nestanovované anionty, mezi které počítáme laktát, sulfáty, ketolátky a řadu dalších kyselých metabolitů)
- [Atot] – koncentrace neprchavých slabých kyselin, tj. součet koncentrací negativních nábojů nesených albuminem a anorganickým fosforem [rovnice 2] (pokračování viz obr. 1)
Fencl později navrhl výpočet [SID] nikoli jako diferenci silných plazmatických iontů, ale jako součet koncentrací aniontů slabých neprchavých kyselin, jejichž molární koncentrace je závislá na pH. Ze schématu 1 je patrné, že namísto odečtení silných aniontů od silných kationtů sečetl zbývající parametry, tedy anionty slabých neprchavých kyselin, [S-HCO3–] a [Atot] [rovnice 3]. Z této rovnice si snadno vyjádříme vztah pro [S-HCO3–] [rovnice 4] a dosadíme‑li ho do klasické Hendersonovy-Hasselbalchovy rovnice, vidíme názorně celé iontové spektrum určující [S-HCO3–] [rovnice 5].
Na schématu 2 jsou znázorněny klinicky významné faktory determinující [S-HCO3–], rozdělené do 2 skupin. [SID], jako první skupina, je ovlivněna všemi silnými ionty, majoritní úlohu však hraje [UA-] a ionty [Na+] a [Cl-], u kterých je z hlediska ABR podstatnější jejich rozdíl než absolutní hodnota (tzv. natrio-chloridová diference). Dojde‑li k identickému vychýlení obou iontů ve stejném směru, [Na+-Cl-] zůstává nezměněna (změní se pouze tonicita), tím pádem se nezmění ani [S-HCO3–] a ABR zůstává zachována. V rámci zjednodušení se, vzhledem k jejich malému významu, nezabýváme podílem iontů Ca2+ a Mg2+ (při výpočtu [UA-] dosazujeme za Ca2+ hodnotu 2 a za Mg2+ hodnotu 1).
Schéma 2. Klinicky významné faktory ovlivňující [S-HCO<sub>3</sub><sup>–</sup>]. SID je determinována rozdílem silných iontů (v rámci zjednodušení zanedbáváme ionty Ca<sup>2+</sup> a Mg<sup>2+</sup>). [Atot] je součtem aniontů slabých neprchavých kyselin, tj. nábojem neseným albuminem a anorganickým fosfátem. ![Schéma 2. Klinicky významné faktory ovlivňující [S-HCO<sub>3</sub><sup>–</sup>]. SID je determinována rozdílem silných iontů (v rámci zjednodušení zanedbáváme ionty Ca<sup>2+</sup> a Mg<sup>2+</sup>). [Atot] je součtem aniontů slabých neprchavých kyselin, tj. nábojem neseným albuminem a anorganickým fosfátem.](https://pl-master.mdcdn.cz/media/image/f6253cefccbb34fd1943e84e1f528e14.jpeg?version=1537790293)
Druhou skupinou, označovanou [Atot], je náboj nesený anionty slabých neprchavých kyselin, albuminem a anorganickým fosfátem.
Cílem této studie bylo u pacientů se sníženou GFR určit vztah mezi [S-HCO3–] a jednotlivými faktory ovlivňujícími jeho koncentraci: [Na+-Cl-], [UA-], [K+], [Alb–], [Pi–] a dále kvantifikovat jejich podíl na změně [S-HCO3–].
Soubor nemocných a metodika
Soubor tvořilo 69 jedinců s renální insuficiencí, jejichž GFR se pohybovala mezi 0,04 a 0,88 ml/s/1,73m2 dle MDRD, v průměru 0,39, SD ± 0,2 ml/s/1,73m2. Z celkového počtu bylo 32 žen a 37 mužů, věkový průměr 67 let, věkové rozmezí 20–95 let. U 60 pacientů se jednalo o chronickou ledvinnou nedostatečnost, u 9 pacientů o nedostatečnost akutní. Příčinou onemocnění u chronické insuficience byla diabetická nefropatie (15 nemocných), vaskulární nefropatie (17 nemocných), kombinace vaskulární a diabetické nefropatie (17 nemocných), chronická glomerulonefritida (5 nemocných), polycystická choroba ledvin (2 nemocní), chronická tubulointersticiální nefritida (2 nemocní), obstrukční uropatie (2 nemocní). Příčinou akutní renální insuficience byl ve 4 případech septický stav, v dalších 4 případech těžká dehydratace, u 1 nemocného byla příčinou akutní tubulointersticiální nefritida. U 7 nemocných byl přítomen diabetes mellitus 1. typu, u 25 nemocných diabetes mellitus 2. typu. Žádný z nemocných nebyl chronicky dialyzován, v případě indikace akutní hemodialýzy byl náběr proveden před zahájením očišťovací metody.
U každého jedince jsme jednorázově změřili pH a pCO2 arteriální či kapilární krve, sérovou koncentraci HCO3– jsme standardně dopočítali z Hendersonovy-Hasselbalchovy rovnice. Z venózní krve jsme určili sérové koncentrace albuminu a iontů: Na+, K+, Cl-, Pi, nezbytné ke kvantitativnímu stanovení metabolické poruchy, dále sérové koncentrace kreatininu a urey. Běžné biochemické parametry byly stanoveny rutinními klinicko‑biochemickými metodami.
GFR jsme vypočítali dle zkrácené MDRD formule, která odhaduje GFR se stejnou přesností jako MDRD formule zohledňující sérovou koncentraci urey a albuminu [13]:
GFR = 3,1 × (Skr × 0,0113) –1,154 ×× věk –0,203 × –0,742 (u žen)
Stav vnitřního prostředí jsme interpretovali na základě konvenční Hendersonovy-Hasselbalchovy rovnice s detailnější analýzou metabolické komponenty pomocí Stewartovy-Fenclovy teorie. Dle [S-HCO3–] jsme posuzovali přítomnost metabolické acidózy či metabolické alkalózy.
Pro detailnější analýzu metabolické komponenty, tedy výpočet jednotlivých parametrů ovlivňujících [S-HCO3–], je nezbytné nejprve přepočítat koncentrace albuminu ( g/l) a Pi (mmol/l) na jejich náboj v mmol/l dle rovnic [4]:
Náboj nesený albuminem:
[Alb–] = [Alb–] × (0,123pH – 0,631)
Náboj nesený anorganickým fosfátem: [Pi–] = Pi × (0,309pH – 0,469)
Celkový náboj nesený slabými neprchavými kyselinami:
[Atot] = [Alb–] + [Pi–]
Poté jsme vypočítali hodnoty [SID] dle Fenclovy rovnice:
[SID] = [Alb–] + [Pi–] + [HCO3–]
[UA-] jsme vyjádřili ze Stewartovy rovnice: [UA-] = [Na+] + [K+] + 2 ×× [Ca2+] + 2 × [Mg2+] – [Cl-] – [SID] (místo Ca2+ dosazujeme hodnotu 2, místo Mg2+ hodnotu 1).
Ze zjištěných výsledků jsme u obou skupin na základě regresní analýzy určili korelační koeficienty mezi [S-HCO3–] a ostatními plazmatickými ionty: [Na+], [Cl-], [K+], [UA-], [Alb–], [Pi–].
S použitím rovnice regresní přímky jsme na základě regresního koeficientu, tj. sklonu regresní přímky, schopni vyjádřit pokles či vzestup hodnoceného faktoru v mmol/l spojený s vychýlením [S-HCO3–] o 1 mmol/l. Jedná se však o jednodimenzionální regresi, zatímco studovaný problém je multidimenzionální – [S-HCO3–] souvisí s iontovou rovnováhou všech ostatních plazmatických aniontů a kationtů. Na základě této regrese tedy nelze percentuálně vyjádřit podíl jednotlivých faktorů na poklesu [S-HCO3–]. Výjimkou je regresní analýza [Na+-Cl-] a sérové koncentrace Na+ a Cl-, kde [Na+-Cl-] diference není hodnota změřená, ale vypočítaná, je tedy determinována výhradně ionty Na+ a Cl-. Proto změna [Na+-Cl-] percentuálně odpovídá poměru regresních koeficientů jednodimenzionální regrese. V ostatních případech je nutné použít multifaktoriální analýzu s využitím parciálních korelačních koeficientů.
Výsledky
V tab. 1 a 2 je znázorněn přehled průměrných hodnot, mediánů, směrodatných odchylek, minimálních, maximálních hodnot a referenční rozmezí jednotlivých faktorů determinujících metabolickou komponentu ABR a renálních parametrů. V tab. 3 je zobrazen přehled korelačních a regresních koeficientů jednotlivých regresních analýz.
U 69 nedialyzovaných nemocných se sníženou GFR, s průměrnou hodnotou [S-HCO3–] 19,6 mmol/l, jsme potvrdili předpokládanou korelaci mezi [S‑HCO3–] a GFR vypočtenou dle MDRD a velmi významnou negativní korelaci mezi [S‑HCO3–] a S-kreatininem (tab. 3).
U 47 nemocných byla přítomna metabolická acidóza ([S-HCO3–] << 22 mmol/l), u 5 nemocných metabolická alkalóza ([S-HCO3–] > 26 mmol/l), 17 pacientů mělo [S-HCO3–] ve fyziologickém rozmezí. U 22 pacientů s metabolickou acidózou byla přítomna hyperchloremie, u 20 zvýšená retence silných kyselin – [UA-].
Prokázali jsme výraznou statisticky signifikantní korelaci (p < 0,001) mezi [S-HCO3–] a [SID], ve statistickém smyslu byl pokles [S-HCO3–] o 1 mmol/l spojen s poklesem [SID] o 0,98 mmol/l (graf 1). Metabolická acidóza je tedy doprovázena poklesem [SID].
Graf 1. Korelace mezi [S-HCO<sub>3</sub><sup>–</sup>] a [SID]. ![Korelace mezi [S-HCO<sub>3</sub><sup>–</sup>] a [SID].](https://pl-master.mdcdn.cz/media/image/3f13a6966ecb6f143fc2da262850d38e.jpeg?version=1537790293)
Velmi významné statisticky signifikantní korelace (p < 0,01) jsou i mezi [S-HCO3–] a jednotlivými faktory determinujícími [SID]: [Na+‑Cl-], [UA-], [K+].
Nejvýznamnější korelace je mezi [S-HCO3–] a [Na+‑Cl-] diferencí (graf 2). Regresní koeficient závislosti [S‑HCO3–] a [Na+‑Cl-] diference je 0,64, tzn., že pokles [S‑HCO3–] o 1 mmol/l je spojen s poklesem [Na+‑Cl-] diference o 0,64 mmol/l.
Graf 2. Korelace mezi [S-HCO<sub>3</sub><sup>–</sup>] a [Na<sup>+</sup>-Cl<sup>–</sup>]. ![Korelace mezi [S-HCO<sub>3</sub><sup>–</sup>] a [Na<sup>+</sup>-Cl<sup>–</sup>].](https://pl-master.mdcdn.cz/media/image/95fc005f484ad6d746a873c2f80241a6.jpeg?version=1537790293)
Jak se na snížení [Na+-Cl-] diference podílí [Na+] a [Cl-], je znázorněno na grafu 3 a 4. Snížení [Na+‑Cl-] diference o 1 mmol/l je spojeno s poklesem [S‑Na+] o 0,29 mmol/l a vzestupem [S‑Cl-] o 0,71 mmol/l.
Graf 3. Korelace mezi [Na<sup>+</sup>-Cl<sup>–</sup>] a [S-Na<sup>+</sup>]. ![Korelace mezi [Na<sup>+</sup>-Cl<sup>–</sup>] a [S-Na<sup>+</sup>].](https://pl-master.mdcdn.cz/media/image/ee3c8277203e1fa6a494264c030de1ae.jpeg?version=1537790293)
Graf 4. Korelace mezi [Na<sup>+</sup>-Cl<sup>–</sup>] a [S-Cl<sup>–</sup>]. ![Korelace mezi [Na<sup>+</sup>-Cl<sup>–</sup>] a [S-Cl<sup>–</sup>].](https://pl-master.mdcdn.cz/media/image/757cef0f2eccda749e2be69f49e0c664.jpeg?version=1537790293)
Signifikantní korelace je i mezi [S‑HCO3–] a [UA-] (graf 5). Regresní koeficient závislosti [S‑HCO3–] a [UA-] je –0,44, ve statistickém smyslu je pokles [S‑HCO3–] o 1 mmol/l spojen se vzestupem [UA-] o 0,44 mmol/l.
Graf 5. Korelace mezi [S-HCO<sub>3</sub><sup>–</sup>] a [UA<sup>–</sup>]. ![Korelace mezi [S-HCO<sub>3</sub><sup>–</sup>] a [UA<sup>–</sup>].](https://pl-master.mdcdn.cz/media/image/e939ca2826a356e2488cd0ffe802dfb1.jpeg?version=1537790293)
Posledním měřeným faktorem determinujícím [SID] je sérová koncentrace kalia. Pokles [S‑HCO3–] o 1 mmol/l je spojen se vzestupem [S‑K+] o 0,11 mmol/l.
Mezi [S‑HCO3–] a [Atot] jsme korelaci neprokázali. Faktory determinující [Atot] jsou [Alb–] a [Pi–]. Mezi [S‑HCO3–] a [Alb–] jsme zjistili korelaci na hranici významnosti, kdy s poklesem [S‑HCO3–] klesá i [Alb–].
Statisticky významnou negativní korelaci jsme prokázali mezi [S‑HCO3–] a [Pi–]. S poklesem [S‑HCO3–] o 1 mmol/l je spojen vzestup [Pi–] o 0,11 mmol/l.
Diskuze
Současný pohled na metabolickou acidózu u pacientů se sníženou GFR, založený na Hendersonově‑Hasselbalchově rovnici, vysvětluje pokles [S‑HCO3–] vzestupem koncentrace chloridů a retencí aniontů silných kyselin. [S‑HCO3–] klesá na základě redukce renálního parenchymu, ať již v důsledku omezené tvorby či resorpce HCO3– tubulárními buňkami – v případě hyperchloremické acidózy s normální aniontovou mezerou, anebo v důsledku snížené GFR a následné retence aniontů silných kyselin – metabolická acidóza se zvýšenou aniontovou mezerou. Jinými slovy, snížení [S-HCO3–] je, v rámci zachování elektroneutrality, doprovázeno zvýšením jiného aniontu.
Přínosem Stewartovy-Fenclovy kvantitativní analýzy při interpretaci [S-HCO3–] je oproti konvenčnímu přístupu zohlednění celého spektra plazmatických iontů, tzn. rozšíření spektra o [Alb–] a [Pi–], co se týče aniontů, ale především i nezbytná kalkulace se všemi kationty. Na základě této představy jsme schopni vysvětlit pokles [S‑HCO3–] (aniontu kyseliny uhličité, jediné kyseliny, kterou je organizmus schopen rychle a efektivně eliminovat či retinovat plícemi ve formě pCO2) nejen zvýšením jiného aniontu, ale také snížením sumární koncentrace kationtů, jejichž nejvýznamnějším zástupcem je [S‑Na+]. To je i důvodem zavedení nového parametru [Na+‑Cl-] diference, rozdílu nejvýznamnějšího kationtu a aniontu, jež má pro hodnocení ABR větší význam než koncentrace obou iontů posuzovaných izolovaně (viz níže).
Dále nám Stewartův-Fenclův přístup umožňuje přesněji kvantifikovat [UA-] (běžně nestanovované anionty silných kyselin), standardně vyjadřované aniontovou mezerou. Hodnota aniontové mezery je dána vztahem:
Na+ + K+ – Cl- – HCO3–. Dle schématu 1 je zřejmé, že aniontová mezera v sobě Skrývá i náboj nesený albuminem a anorganickým fosfátem, což v určitých situacích, jako je např. hypalbuminemie, vede k dezinterpretaci aniontové mezery, která díky poklesu albuminu vykazuje nižší hodnoty, než by odpovídalo retinovaným aniontům silných kyselin [14–18]. Naopak při hyperfosfatemii je aniontová mezera zvýšena i bez retence aniontů silných kyselin.
Z grafu 1 je patrné, že pokles [S-HCO3–] výrazně koreluje se snížením [SID]. I přes skutečnost, že takřka u 1/2 pacientů s metabolickou acidózou byla zvýšena sérová koncentrace chloridů, jsme nepotvrdili očekávanou negativní korelaci mezi [S-HCO3–] a [S-Cl-]. Naopak jsme prokázali korelaci mezi [S-Na+] a [S-HCO3–]. Signifikantnější korelace však je mezi [S-HCO3–] a [Na+-Cl-] diferencí. Fakt, že [S-Cl-] s [S-HCO3–] nekoreluje, si vysvětlujeme skutečností, že při zvýšené koncentraci [UA-] dochází k signifikantnímu poklesu [S‑Cl-]. Přesto se na snížení [Na+‑Cl-] diferenci více uplatňuje zvýšení [S‑Cl-] než snížení [S‑Na+], jak je patrné z grafů 3 a 4 a z průměrných naměřených hodnot [S‑Na+] a [S‑Cl-], které jsou pro [S‑Na+] 140 mmol/l, pro [S‑Cl-] 106,3 mmol/l. Průměrná hladina chloridů se pohybuje na horní hranicí normy, zatímco průměrná hladina [S‑Na+] je totožná se střední referenční hodnotou.
S poklesem [S‑HCO3–] je tedy nejvýrazněji asociován pokles [Na+‑Cl-] diference, který je v našich měřeních determinován zvýšením [S‑Cl-] a snížením [S‑Na+]. Snížení [Na+‑Cl-] diference o 1 mmol/l je ze statistického hlediska spojeno s poklesem [S-Na+] o 0,29 mmol/l a vzestupem [S-Cl-] o 0,71 mmol/l. Zásadní roli hraje rozdíl sérových koncentrací obou iontů. Fyziologické rozmezí pro [S-Na+] je 135–145 mmol/l, pro [S-Cl-] 97–108 mmol/l. V případě, že se koncentrace obou iontů pohybují na hranici svého fyziologického rozmezí, byť v referenčních hodnotách (v případě natria 135 mmol/l, v případě chloridů 108 mmol/l), činí [Na+-Cl-] diference 27 mmol/l. To znamená, že i při normonatremii a normochloremii může dojít k poklesu [Na+-Cl-] diference až o 11 mmol/l, čímž klesne [SID] ze své normální hodnoty 38 mmol/l na 27 mmol/l. Z pohledu Stewartovy-Fenclovy teorie dojde, v rámci zachování elektroneutrality, k poklesu [S-HCO3–] z 24 mmol/l na 13 mmol/l, čímž vzniká středně těžká metabolická acidóza.
Spolu s [Na+-Cl-] diferencí je s poklesem [S‑HCO3–] významně asociována zvýšená koncentrace [UA-]. V porovnání s poklesem [Na+-Cl-] diference se retence kyselin uplatňuje třetinově.
Posledním sledovaným faktorem v rámci [SID] je sérová koncentrace K+, která stoupá s prohlubující se metabolickou acidózou. Příčinou je pravděpodobně omezené vylučování kalia ledvinami při snížené GFR a jeho přesun z ICT do ECT v důsledku acidemie.
Mezi [Atot] a [S-HCO3–] jsme korelaci neprokázali. Jednotlivé složky [Atot], [Alb–] i [Pi–], s [S‑HCO3–] korelují, [Alb–] na hranici významnosti, [Pi–] významně. Pokles [S‑HCO3–] koreluje s poklesem [Alb–]. Hypalbuminemie má alkalizační efekt, průměrně snížení albuminu o 10 g/l vede ke zvýšení [S‑HCO3–] o 3,3 mmol/l [19]. U pacientů s renální insuficiencí můžeme překvapivou korelaci poklesu [Alb–] s poklesem [S‑HCO3–] vysvětlit často přítomnou proteinurií u nemocných s ledvinným selháním. Prokázali jsme korelaci mezi GFR a [Alb–]. Proto, i přes alkalizační efekt hypalbuminemie, pozorujeme signifikantní pokles [Alb–] v souvislosti s poklesem [S‑HCO3–].
Vzestup koncentrace [Pi–] je spojen s poklesem [S‑HCO3–]. Hyperfosfatemie, konstantně vyjádřená při renální insuficienci, má z pohledu Stewartovy teorie acidifikační vliv.
Cílem této práce není analyzovat příčiny jednotlivých metabolických poruch ABR, pouze konstatuje iontové změny s těmito poruchami související a poukazuje na jejich případnou kauzalitu při vzniku metabolické acidózy. Konvenční pohled rozděluje metabolickou acidózu na hyperchloremickou a metabolickou acidózu se zvýšenou aniontovou mezerou. Důvod tohoto rozdělení je diferenciálně diagnostický, pomáhá nám přiblížit se k etiologii metabolické acidózy. V případě renálních onemocnění jsou však často přítomny oba typy současně, jak již bylo zmíněno výše. Stewartova-Fenclova teorie obohacuje pohled založený na iontových dysbalancích, který běžně při výpočtu aniontové mezery užíváme, o další sérové kationty a anionty. Na základě našich dat jsme zjistili, že kromě hyperchloremie a zvýšení [UA-] je s metabolickou acidózou významně spojena hyponatremie a hyperfosfatemie. Dále jsme zjistili, že s poklesem [S-HCO3–] koreluje lépe než hyperchloremie či hyponatremie, pokles [Na+-Cl-] diference.
Stewartova teorie nabízí alternativní pohled na patofyziologii vzniku metabolických poruch ABR založený na principu elektroneutrality a teorie závislých a nezávislých veličin. Na rozdíl od Stewarta, který definuje 3 nezávislé veličiny (pCO2, [SID] a [Atot]) determinující veličiny závislé ([S-HCO3–] a pH), se však domníváme, že u některých onemocnění dochází při vzniku metabolické acidózy k poklesu [S‑HCO3–] primárně a až sekundárně k výchylce [SID] či [Atot]. Příkladem je proximální renální tubulární acidóza, u které je porušena resorpce bikarbonátu v proximálním tubulu, dochází k primárnímu poklesu [S‑HCO3–] a hyperchloremie vzniká teprve druhotně. Stejný princip se může uplatnit u průjmových onemocnění: se ztrátou bikarbonátu dochází sekundárně k hyperchloremii.
Naše studie neodpovídá na otázku, je‑li pokles [Na+-Cl-] diference u nemocných s renální insuficiencí příčinou poklesu [S-HCO3–], či je tomu naopak. Velmi pravděpodobně se odpověď bude lišit s typem ledvinného onemocnění. Zodpovězení této otázky bude cílem další práce, ve které se neobejdeme bez bližších dat, jakými jsou: monitorace vodní bilance, koncentrace jednotlivých iontů v moči a jejich odpadů za 24 hod, diuretické terapie, substituce bikarbonátem atd.
Vyřešení kauzality iontových dysbalancí je nezbytné také pro volbu terapie. Jedním ze základních režimových opatření u nedialyzovaných pacientů s chronickou renální insuficiencí je restrikce bílkovin a fosfátů. Potvrdíme‑li, že pokles [Na+-Cl-] diference je u některých onemocnění příčinou snížené koncentrace bikarbonátu, resp. metabolické acidózy, a nikoli jejím důsledkem, domníváme se, že tato opatření bude třeba rozšířit i o omezení perorálního příjmu kuchyňské soli, u které je [Na+-Cl-] diference rovna nule, tudíž pacienta acidifikuje. Vycházíme‑li ze Stewartovy-Fenclovy teorie, je třeba zajistit příjem Na+ v takové formě, aby odpovídal fyziologickému rozdílu [Na+-Cl-]. V praxi se tomu snažíme přiblížit přidáním NaHCO3 do diety, což má z pohledu Stewartovy teorie alkalizační účinek, nikoli však v důsledku příjmu HCO3–, nýbrž díky příjmu Na+. Ze stejného důvodu musíme [Na+‑Cl-] diferenci vzít v úvahu i při volbě infuzní terapie, neboť většina běžně užívaných roztoků (fyziologický roztok, Ringerův roztok, glukózový roztok) působí vzhledem k nízké [Na+‑Cl-] diferenci acidifikačně.
Při interpretaci jednotlivých faktorů participujících na vzniku metabolické acidózy je také třeba zdůraznit, že všechny prokázané korelace jsou hodnoceny metodou univariantní statistické analýzy, ze které nejsme schopni určit vzájemnou závislost či nezávislost jednotlivých faktorů. V tomto ohledu se neobejdeme bez multivariantní analýzy, ke které je však nezbytné rozšíření souboru pacientů.
Závěr
Z výsledků této studie vyplývá, že metabolická acidóza u pacientů se sníženou GFR je kromě hyperchloremie a retence aniontů silných kyselin významně asociována i s hyponatremií a hyperfosfatemií. Nejvýznamnějším sledovaným faktorem ve spojitosti s poklesem [S-HCO3–] je pokles [Na+‑Cl-] diference, kde podíl hyperchloremie je nesporný a je v souladu s běžně popisovanou hyperchloremickou metabolickou acidózou. Na rozdíl od konvenční interpretace jsme s pomocí Stewartovy-Fenclovy kvantitativní analýzy potvrdili i významný podíl hyponatremie, jak byl popsán v práci Story et al [20]. Z kvantitativního hlediska je druhým nejvýznamnějším faktorem zvýšení [UA-]. Pokles [S‑HCO3–] významně koreluje s retencí aniontů silných kyselin. Na rozdíl od aniontové mezery, kterou běžně užíváme při jejich interpretaci, s použitím Stewartovy-Fenclovy analýzy není [UA-] zkresleno odchylkami sérových koncentrací aniontů albuminu a anorganického fosfátu.
Poděkování
Práce byla podpořena výzkumným záměrem MSMT 0021620819.
Doručeno do redakce: 29. 4. 2008
Přijato po recenzi: 20. 11. 2008
MUDr. Jan Havlín
wwww.fnmotol.cz
e-mail: havlin.jan@post.cz
Zdroje
1. Kraut JA, Kurtz I. Metabolic acidosis of CKD: diagnosis, clinical characteristics and treatment. Am J Kidney Dis 2005; 45 : 978–993.
2. Wallia R, Greenberg A, Piraino B et al. Serum electrolyte patterns in end‑stage renal disease. Am J Kidney Dis 1986; 8 : 98–104.
3. Hakim RM, Lazarus JM. Biochemical parameters in chronic renal failure. Am J Kidney Dis 1988; 11 : 238–247.
4. Stewart PA. Modern quantitative acid-base chemistry. Can J Physiol Pharmacol 1983; 61 : 1444–1461.
5. Fencl V, Leith DE. Stewart’s quantitative acid-base chemistry: Applications in biology and medicine. Respir Physiol 1993; 91 : 1–16.
6. Jones NL. A quantitative physicochemical approach to acid-base physiology. Clin Biochem 1990; 23 : 89–95.
7. Corey HE. Stewart and beyond: New models of acid-base balance. Kidney Int 2003; 64 : 777–787.
8. Boyle M, Baldwin I. Introduction to an alternative view of acid-base balance: the strong ion difference or Stewart approach. Aust Crit Care 2002; 15 : 14–20.
9. Matoušovic K, Martínek V, Kvapil M. Acidobazická rovnováha tělesných tekutin a její kvantitaivní fyzikálně‑chemické hodnocení. Aktuality v nefrologii 2002; 4 : 150–156.
10. Schück O, Matoušovic K. Vztah mezi pH a diferencí silných iontů (SID) ve vnitřním prostředí. Klin Biochem Metab 2005; 34 : 32–35.
11. Matoušovic K, Martínek V. Analýza a korekce poruch acidobazické rovnováhy na základě Stewartova-Fenclova principu. Vnitř Lék 2004; 7 : 526–530.
12. Rosival V. Explanation of the Stewart-Fencl views on the acid-base equilibrium. Vnitř Lék 2004; 11 : 877.
13. Schück O, Teplan V, Marečková O. MDRD formulas for GFR estimation. Is there any difference among them in prediction of renal inulin clearance? Clin Nephrol 2005; 64 : 326–327.
14. Figge J, Jabor A, Kazda A et al. Anion gap and hypoalbuminemia. Crit Care Med 1998; 26 : 1807–1810.
15. Wilkes P. Hypoproteinemia, strong ion difference, and acid-base status in critically ill patients. J Appl Physiol 1998; 5 : 1740–1748.
16. Figge J, Mydosh T, Fencl V. Serum proteins and acid-base equilibria a follow up. J Lab Clin Med 1992; 120 : 713–719.
17. Figge J, Rossing TH, Fencl V. The role of serum proteins in acid-base equilibria. J Lab Clin Med 1991; 117 : 453–467.
18. Corey HE. The anion gap (AG): studies in the nephrotic syndrome and diabetic ketoacidosis (DKA). J Lab Clin Med 2006; 147 : 121–125.
19. McAuliffe JJ, Lind LJ, Leith DE et al. Hypoproteinemic alkalosis. Am J Med 1986; 81 : 86–90.
20. Story DA, Tosolini A, Bellmo R et al. Plasma acid-base changes in chronic renal failure: A Stewart analysis. Int J Art Org 2005; 28 : 961–965.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2009 Číslo 2- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Statinová intolerance
- Genetický podklad a screening familiární hypercholesterolémie
- Metabolit živočišné stravy produkovaný střevní mikroflórou zvyšuje riziko závažných kardiovaskulárních příhod
- DESATORO PRE PRAX: Aktuálne odporúčanie ESPEN pre nutričný manažment u pacientov s COVID-19
-
Všetky články tohto čísla
- Vplyv telesnej hmotnosti na riziko venózneho tromboembolizmu
- Diurnální variabilita krevního tlaku u pacientů s hypertenzí a revmatoidní artritidou
- Záchovné operace a plastiky aortální chlopně – od anatomie chlopně až k dlouhodobým výsledkům
- Kombinace inhibitoru ACE a blokátoru kalciových kanálů je optimální dvojkombinací léčby hypertenze
- Povrchová tromboflebitída – diagnostika a liečba
- Doporučení pro duplexní ultrazvukové vyšetření končetinových žil
- Sarkom z interdigitujících dendritických buněk dolní končetiny rezistentní k vysokodávkované chemoterapii BEAM s autologní transplantací kmenových krvetvorných buněk – popis případu a přehled literatury
- Za docentom MUDr. Tomášom Hildebrandom, CSc.
- XVI. česko-slovenská konference o hemostáze a trombóze s mezinárodní účastí
- Recenze
- Metabolický syndrom, tělesná hmotnost a žilní trombóza – editorial
- Střednědobé výsledky implantací aortálního alograftu
- Patofyziologie vzniku metabolické acidózy u pacientů se sníženou glomerulární filtrací z hlediska Stewartovy-Fenclovy teorie
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Povrchová tromboflebitída – diagnostika a liečba
- Doporučení pro duplexní ultrazvukové vyšetření končetinových žil
- Záchovné operace a plastiky aortální chlopně – od anatomie chlopně až k dlouhodobým výsledkům
- Kombinace inhibitoru ACE a blokátoru kalciových kanálů je optimální dvojkombinací léčby hypertenze
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy