-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Keratinové fragmenty jako sérologický ukazatel u nemocných s jaterní chorobou
Keratin fragments as a serological indicator in patients with a liver disease
Introduction:
Determination of M30 antigen appears to be a sensitive method for evaluation of hepatocyte apoptosis. The aim of the present project was to implement this technique, compare M30 values in patients with a liver disease and healthy controls and to identify potential relationships between M30 values and other parameters.Methods:
M30 antigen was assessed in 25 patients with a liver disease and 30 healthy controls. These results were compared between patients with a liver disease and the controls and correlated to a range of clinical and laboratory values, including tissue polypeptide-specific antigen (TPS), in patients with a liver disease.Results:
We found significant differences in M30 values between controls and patients with a liver disease. The only significant correlations were the correlation between M30 and ALT, highly significant correlation between M30 and AST and highly significant correlation between M30 and TPS.Conclusion:
The M30 antigen is a sensitive indicator of liver damage. Considering the highly significant correlation with TPS, it can be assumed that in some liver diseases, TPS could serve as a clinically useful indicator of apoptosis.Key words:
liver disease – M30 antigen – tissue polypeptide-specific antigen (TPS) – keratin fragments – hepatocyte apoptosis
Autoři: J. Lata 1; H. Mrlianová 2; O. Stibůrek 2; J. Nožička 3; Z. Čermáková 4; J. Gottwaldová 4; P. Drozd 5
Působiště autorů: Interní klinika Lékařské fakulty Ostravské Univerzity a FN Ostrava, přednosta doc. MUDr. Arnošt Martínek, CSc. 1; Interní gastroenterologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Aleš Hep, CSc. 2; Histologická laboratoř Ústí nad Orlicí, přednosta primář MUDr. Jan Nožička, Ph. D. 3; Oddělení klinické biochemie FN Brno, pracoviště Bohunice, přednosta doc. MUDr. Milan Dastych, CSc., MBA 4; Katedra biologie a ekologie Přírodovědecké fakulty Ostravské univerzity v Ostravě, vedoucí katedry Mgr. Pavel Drozd, Ph. D. 5
Vyšlo v časopise: Vnitř Lék 2011; 57(12): 1025-1028
Kategorie: 70. narozeniny prof. MUDr. Petra Dítě, DrSc.
Souhrn
Úvod:
Stanovení antigenu M 30 se zdá být citlivou metodou k hodnocení apoptózy hepatocytů. Cílem naší práce bylo zavedení této metodiky, porovnání hodnot M 30 u nemocných s jaterními chorobami a zdravými kontrolami a nalezení případných vztahů hodnot M 30 s dalšími parametry.Metodika:
Antigen M 30 byl vyšetřen u 25 nemocných s jaterní chorobou a 30 zdravých kontrol. Tyto výsledky byly porovnány, u nemocných s jaterními chorobami byly korelovány s řadou klinických i laboratorních hodnot včetně tissue polypeptide-specific antigenu (TPS) a statisticky zhodnoceny.Výsledky:
Nalezli jsme průkazné rozdíly mezi hodnotami M 30 pro kontrolní skupinu a skupinu nemocných s jaterní chorobou. Zhodnocením korelací mezi M 30 a všemi sledovanými parametry byla zjištěna jen průkazná korelace mezi M 30 a ALT, vysoce signifikantní korelace mezi M 30 a AST a vysoce signifikantní korelace mezi M 30 a TPS.Závěr:
Antigen M 30 je citlivý ukazatel jaterního poškození. Vzhledem k vysoce signifikantní korelaci s TPS lze předpokládat, že TPS by mohl být u některých jaterních chorob klinicky použitelným ukazatelem apoptózy.Klíčová slova:
jaterní onemocnění – M 30 antigen – tissue polypeptide-specific antigen (TPS) – keratinové fragmenty – apoptóza hepatocytůÚvod
Jednoduchý neinvazivní ukazatel jaterní fibrózy stále neexistuje a byl by v klinické praxi velkým přínosem. Jednou z nadějných možností je vyšetření hladiny antigenu M 30, což je neoepitop cytokeratinu 18. Cytokeratin 18 je nalézán při apoptóze hepatocytů a je velmi specifický. Cílem naší práce bylo v českých podmínkách prioritně zavést do praxe možnost vyšetření tohoto antigenu, porovnat hladiny u nemocných s jaterní chorobou a zdravými kontrolami, pokusit se nalézt korelace s některou z laboratorních i klinických vyšetření a zhodnotit korelace s vyšetřeními jiných cytokeratinů, které jsou produkovány tkáněmi některých typů maligních nádorů a které jsou využívány v onkologii.
Soubor a metodika
Po podepsání informovaného souhlasu bylo do studie zařazeno 25 nemocných s jaterní chorobou (tab. 1) a 30 zdravých kontrol. Nemocní byli komplexně vyšetřeni (tab. 2); mimo obvyklého laboratorního a klinického vyšetření, sonografického vyšetření a zhodnocení jaterní biopsie byly vyšetřeny i hodnoty tissue polypeptide-specific antigenu (TPS) a cytokeratin fragmentu (CYFRA) a stanovena hladina antigenu M 30.
Tab. 1. Charakteristika souboru. 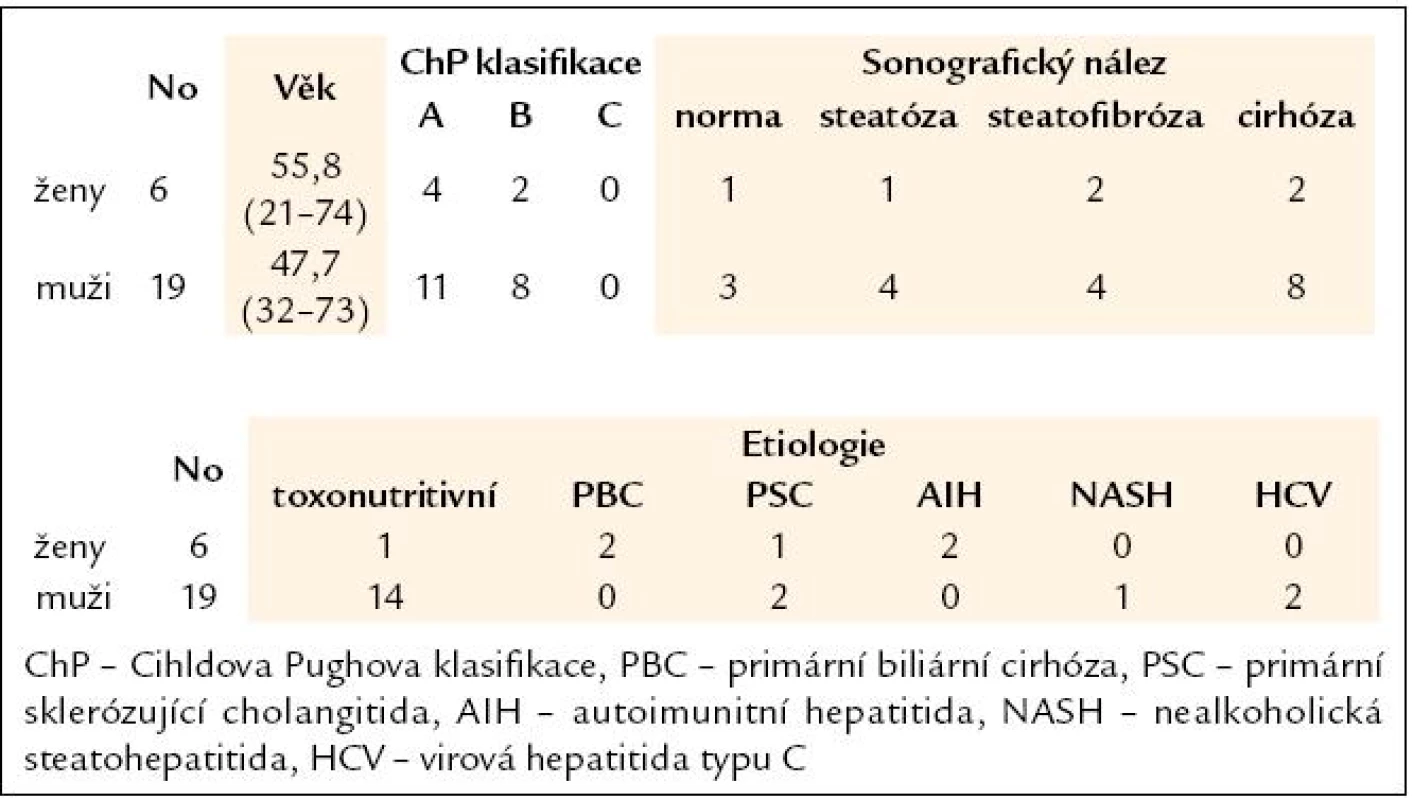
Pro stanovení antigenu M 30 byla použita ELISA souprava firmy PEVIVA AB (Sweden) – M30-Apoptosense. Stanovení bylo provedeno na ELISA readeru EXPERT PLUS výrobce ASYS Hitech GmbH (Austria). Bylo použito sendvičové imunoanalýzy: antigen ze vzorku reagoval s první protilátkou „M5“ proti CK 18 (protein cytokeratin 18), která byla navázána na stěnu jamky mikrotitrační destičky. Po inkubaci byla přidána druhá protilátka proti CK 18 Asp 396 epitopu, která je značená enzymem – křenovou peroxidázou. Vzniká sendvičový komplex: první protilátka (vázaná na stěně jamky) – antigen ze vzorku – druhá protilátka (značená enzymem). Nenavázaný konjugát byl z reakční směsi odstraněn promytím. Po přidání substrátu (tetrametylbenzidin) dochází k barevné reakci, která je zastavena přidáním stop činidla (1M kyselina sírová). Absorbance vzorku se měří při 450 nm, zbarvení je přímo úměrné koncentraci analyzátu ve vzorku.
V první části studie byla porovnána data hladin antigenu M 30 v kontrolní skupině a skupině nemocných. Vzhledem k tomu, že šlo o neparametrická data, byl ke statistickému hodnocení použit Mann-Whitney test (Wicoxonův test) a data byla pro rozdílný rozptyl (heteroskedasticitu) logaritmována.
Poté bylo provedeno porovnání výsledků M 30 s ostatními laboratorními hodnotami včetně TPS a CYFRA, s výsledky zobrazovacích vyšetření, histologických vyšetření jaterní biopsie, klinickým nálezem (ascites, encefalopatie, body mass index) a stanovenou diagnózou. Pro všechny kombinace parametrů byl spočítán Pearsonův korelační koeficient (r) a proveden korelační test. Data byla zpracována pomocí softwaru R [1].
Výsledky
Nalezli jsme průkazné rozdíly mezi hodnotami M 30 pro kontrolní skupinu a skupinu nemocných s jaterní chorobou (W = 27, n = 45, p < 0,0001) (graf 1). Zhodnocením korelací mezi M 30 a všemi sledovanými parametry byla zjištěna jen průkazná korelace mezi M 30 a ALT (t = 2,73, df = 23, p = 0,012) (graf 2), vysoce signifikantní korelace mezi M 30 a AST (t = 3,5, df = 23, p = 0,0019) (graf 3) a vysoce signifikantní korelace mezi M 30 a TPS (t = 5,73, df = 22, p < 0,0001) (graf 4).
Graf 1. Hodnoty M 30 nemocní a kontrolní skupina. Průkazné rozdíly mezi hodnotami M 30 mezi kontrolní skupinou a skupinou nemocných (W = 27, n = 45, p < 0,0001). 
Graf 2. M 30 a ALT. Průkazná korelace mezi M 30 a ALT (t = 2,73, df = 23, p = 0,012). 
Graf 3. M 30 a AST. Vysoce signifikantní korelace mezi M 30 a AST (t = 3,5, df = 23, p = 0,0019). 
Graf 4. M 30 a TPS. Vysoce signifikantní korelace mezi M 30 a TPS (t = 5,73, df = 22, p < 0,0001). 
Diskuze
Zobrazovací metody spolehlivě diagnostikují steatózu, odlišení od steatohepatitidy není sonograficky ani CT či MR jater možné [2]. Lepší volbou je vyšetření elasticity jaterní, tzv. FibroScan, ale ani toto není mnohdy validní.
Zlatým standardem diagnostiky NASH a jejího odlišení od prosté steatózy je jaterní biopsie [3]. Její indikace je však mnohdy obtížná; jde o invazivní zákrok s možnými komplikacemi, navíc u nemocných, kteří nemají doposud výrazné obtíže. Nevýhodou je i poměrně značná variabilita interpretací nálezu a cena.
Proto se stále hledají neinvazivní markery jaterní fibrózy. Optimální neinvazivní marker by měl být pro játra specifický, neměl by být ovlivňován poškozením jaterních či renálních funkcí a měl by měřit aktivitu ukládání, či naopak degradace extracelulární matrix. Důležitá je pochopitelně i cena.
Doposud se v klinice užívají především tzv. nepřímé testy, které ukazují více poruchu jaterních funkcí a při přímém hodnocení fibrózy nejsou příliš přesné; přímé testy, které odrážejí přímo produkty extracelulární matrix, jsou podstatně komplikovanější a doposud méně klinicky využitelné. V této oblasti jsou využívány především více či méně komplikované kombinace různých ukazatelů. Mezi poměrně jednoduché patří APR Index (ALT ku trombocytům), další jsou kombinace řady laboratorních i klinických markerů (Fib-3, Hepascore, FibroMeter). Validním a v mnoha případech řazeným na roveň jaterní biopsie je FibroTest, který poměrně komplikovaným vzorcem hodnotí mimo bilirubinu, ALT a γ-glutamyltranspeptidázy i α2-makroglobulin, haptoglobin a apolipoprotein A1 [4].
Stále však chybí jednoduchý ukazatel. Do budoucna jsou nadějné pokroky v oblasti molekulární biologie, především možnost stanovování exprese proteinů a jejich interakcí. Z ukazatelů zvýšeného ukládání extracelulární matrix tak jsou kandidátními produkty např. prokolagen IC, prokolagen III N, tenascin či tkáňový inhibitor metaloproteinázy TGF β. Z ukazatelů zvýšeného odstraňování matrix jde potom o prokolagen IV C, prokola-gen IV N, kolagen IV či undulin [5].
Zajímavou novou možností, která se v oblasti neinvazivního stanovení fibrogeneze v poslední době nabízí, je vyšetření keratinů a keratinových fragmentů. U lidí je známo více než 50 keratinových bílkovin, dělených podle izoelektrického bodu do 2 hlavních podskupin: acidické (typ I) a bazické (typ II) [6]. Cytokeratiny patří do skupiny proteinů tvořících intermediální filamenta, která jsou hlavní složkou cytoskeletonu buněk, a jsou exprimovány epiteliálními buňkami. Exprese jednotlivých cytokeratinů je závislá na typu tkáně a stupni diferenciace a rychlosti růstu [7]. Čtyři typy cytokeratinů charakterizují jednoduchý epitel, dva acidické (číslo 18 a 19) a dva bazické (číslo 7 a 8). Pomocí imunohistochemického vyšetření je lze prokázat v cytoplazmě jak nádorových buněk epiteliálního původu, tak i normálních epiteliálních buněk. Přestože jsou cytokeratiny za fyziologických podmínek nerozpustné v séru a tkáňových tekutinách, v tělesných tekutinách prokazujeme jejich ve vodném prostředí solubilní fragmenty vzniklé proteolýzou [8].
Z hepatologického hlediska je důležité, že v hepatocytech je výjimečně jednoduchá keratinová síť, která sestává jen z keratinu K8/K18. Vzhledem k této své lokalizaci a buněčné specificitě jsou především K8/K18 slibnými sérologickými ukazateli jaterního poškození. V průběhu apoptózy jsou fragmenty cytokeratinů uvolněny do krve a jsou štěpeny kaspázami za vzniku neoepitopů cytokeratinu 18 (K18-Asp396), nazývanými M 30 antigen. Tento je považován za marker buněčné apoptózy. Monoklonální protilátka M 30 je schopna specificky tento antigen detekovat. Je velmi důležité, že tento antigen je specifický pro apoptózu a není detekovatelný ve vitálních či nekrotických buňkách [9].
V poslední době bylo publikováno několik prací s těmito protilátkami specificky rozeznávajícími apoptotické K8//K18 fragmenty (M 30 a Asp237 protilátky). CK 18 fragmenty byly prokazatelné u nemocných s nealkoholickou steatohepatitidou a fibrotickými změnami již v časné fázi choroby. V podobné skupině nemocných měly hladiny protilátek M 30 vysokou senzitivitu v rozlišení mezi počínající a pokročilou fibrózou, tj. mezi steatózou a NASH [10–12]. V našem souboru jsme potvrdili významné rozdíly mezi hodnotou M 30 u zdravých kontrol a u nemocných s jaterními chorobami a signifikantní korelace mezi hodnotou M 30 a aminotransferázami, což svědčí o významu tohoto vyšetření u jaterních chorob.
Významným nálezem je signifikantní korelace mezi M 30 a TPS. TPS, fragment keratinu 18, je rutinně užíván jako tumormarker u nemocných s epiteliálními tumory [13]. Stanovení sérového TPS poskytuje užitečné informace o proliferaci nádorových buněk a TPS je užíván jako prognostický parametr u pokročilých tumorů prsu [14], gastrointestinálního [15] i urogenitálního [16] traktu.
Byť se původně uvádělo, že se hladiny TPS u chronických jaterních chorob výrazněji nemění [17], bylo zjištěno, že jaterní cirhóza může být příčinou falešně pozitivní hodnoty (stejně jako např. chronické selhání ledvin). Recentně se ovšem objevily práce, které nalezly korelaci mezi TPS a apoptózou hepatocytů stanovenou vyšetřením M 30 u alkoholické hepatitidy [18] a hepatitidy C [19]. Výsledky naší práce tyto nálezy potvrzují. Vyšetření TPS, které detekuje epitop v intaktním keratinu 18, bude patrně pro apoptózu méně citlivé než vyšetření M 30, které detekuje neo-epitop po proběhlém štěpení kaspázami. Nicméně vyšetření TPS je již rutinním vyšetřením s možností automatického stanovení, tj. výrazně jednodušší a levnější než stanovení M 30. Pokud i další práce prokážou silnou korelaci mezi TPS a M 30, bylo by vyšetření TPS možné, s vědomím určité chyby, využít ke stanovení apoptózy u některých jaterních chorob. Dalším důležitým výstupem těchto výsledků je limitace využití TPS jako tumormarkeru u nádorů jater.
Závěr
Prokázali jsme signifikantní rozdíly M 30 u zdravých kontrol a nemocných s jaterními chorobami a signifikantní korelaci mezi M 30 a aminotransferázami ve skupině pacientů s jaterními chorobami. M 30 je validním ukazatelem jaterního poškození a apoptózy hepatocytů. Vysoce signifikantní korelace M 30 a TPS svědčí o tom, že by vyšetření TPS u nemocných s jaterní chorobou mohlo být jednodušším a levnějším ukazatelem apoptózy, a současně ukazuje na limitaci použití TPS jako tumormarkeru u nádorů jater.
Práce byla podpořena Interní grantovou agenturou ministerstva zdravotnictví ČR (grant č. NS/9868-4).
prof. MUDr. Jan Lata, CSc.
www.osu.cz
e-mail: Jan.Lata@osu.cz
Doručeno do redakce: 10. 10. 2011
Zdroje
1. R Development Core Team (2011). R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna: Austria 2011. www.R-project.org.
2. Hůlek P, Dresslerová I. Steatóza a steatohepatitida u diabetika. Vnitř Lék 2011; 57 : 364–367.
3. Brůha R. Nealkoholová steatóza a steatohepatitida. Vnitř Lék 2010; 56 : 173–175.
4. Naveau S, Gaudé G, Asnacios A et al. Diagnostic and prognostic values of non-invasive biomarkers of fibrosis in patients with alcoholic liver disease. Hepatology 2009; 49 : 97–105.
5. Tajmer P. Fibróza jater. In: Špičák J (ed.). Novinky v gastroenterologii a hepatologii. 1. vyd. Praha: Grada 2008 : 35–46.
6. Moll R, Franke WW, Schiller DL et al. The catalog of human cytokeratins: patterns of expression in normal epithelia, tumors and cultured cells. Cell 1982; 31 : 11–24.
7. Fuchs E, Tyner AL, Guidice G et al. The human keratin genes and their differential expression. In: Sawyer RH (ed.). The Molecular and Developmental Biology of Keratins. New York: Academic Press 1987 : 5–34.
8. Sundström BE, D’Amico Y, Brundell J. Development of a new Profiligen TPA IRMA assay using monoclonal anti-cytokeratin antibodies. Int J Biol Markers 1995; 10 : 166–173.
9. Ueno T, Toi M, Linder S. Detection of epithelial cell death in the body by cytokeratin 18 measurement. Biomed Pharmacother 2005; 59 (Suppl 2): S359–S362.
10. Feldstein AE, Wieckowska A, Lopez AR et al. Cytokeratin-18 fragment levels as noninvasive biomarkers for nonalcoholic steatohepatitis: a multicenter validation study. Hepatology 2009; 50 : 1072–1078.
11. Yilmaz Y, Dolar E, Ulukaya E et al. Soluble forms of extracellular cytokeratin 18 may differentiate simple steatosis from nonalcoholic steatohepatitis. World J Gastroenterol 2007; 13 : 837–844.
12. Younossi ZM, Jarrar M, Nugent C et al. A Novel Diagnostic Biomarker Panel for Obesity-related Nonalcoholic Steatohepatitis (NASH). Obes Surg 2008; 11 : 1430–1437.
13. Zetterberg A, Skern T, Schoberl E et al. Molecular characterization of TPS (Abstract). 22nd Meeting. Groningen: ISOBM 1994 : 354.
14. Bremer K, Eklund G, Björklund B. Notable relationship between the level of tumor marker TPS in serum and survival in breast cancer. Anticancer Res 1996; 16 : 905–909.
15. Glimelius B, Hoffman K, Einarsson R et al. Monitoring palliative chemotherapy in advanced gastrointestinal cancer using tissue polypeptide specific antigen (TPS) measurements. Acta Oncol 1996; 35 : 141–148.
16. Klečka J, Pikner R, Toufarová P et al. Cytpkeratiny TPA, TPS, CYFRA 21-1 a UBC v séru a moči jako možné nádorové markery karcinomu močového měchýře. Ces Urol 2001; 1 : 32–36.
17. http://www.cskb.cz/res/file/doporuceni/TM/TM_tab3.pdf.
18. Gonzalez-Quintela A, Abdulkader I, Campos J et al. Serum Levels of Keratin-18 Fragments (Tissue Polypeptide-Specific Antigen TPS) Are Correlated with Hepatocyte Apoptosis in Alcoholic Hepatitis. Dig Dis Sci 2009; 54 : 648–653.
19. Gonzalez-Quintela A, Abdulkader I, Otero E et al. Relationship between serum concentrations of keratin-18 and apoptosis in chronic hepatitis C. Clin Chem Lab Med 2010; 48 : 897–899.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2011 Číslo 12- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Screening celiakie u pacientů s osteoporózou a osteopenií
- Očekávaná zátěž nádory jícnu, žaludku a kolorekta ve světě
- Aldosteron jako endogenní kardiovaskulární toxin a možnosti jeho terapeutického ovlivnění
- Neuroendokrinné nádory horného tráviaceho traktu, charakteristika a porovnanie efektivity lokalizačnej diagnostiky
- Keratinové fragmenty jako sérologický ukazatel u nemocných s jaterní chorobou
- Existuje racionální terapie Crohnovy nemoci a ulcerózní kolitidy?
- Ablatívna liečba rektosigmoideálnych prekanceróz a včasných karcinómov
- Přežívání nemocných po TIPS ve Fakultní nemocnici Hradec Králové
- Souběžný výskyt alkoholické jaterní cirhózy a chronické pankreatitidy
- Komplikácie endoskopickej retrográdnej cholangiopankreatikografie alebo ako ich znížiť na najmenšiu možnú mieru
- Nedostatečný screening a malá informovanost o rizikových faktorech u příbuzných I. stupně nemocných s kolorektálním karcinomem
- K jubileu prof. MUDr. Petra Dítě, DrSc.
- Potrebujeme ešte endoskopickú skleroterapiu pažerákových varixov alebo posledný nech zhasne svetlo
- Epidemiologie Helicobacter pylori
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Neuroendokrinné nádory horného tráviaceho traktu, charakteristika a porovnanie efektivity lokalizačnej diagnostiky
- Komplikácie endoskopickej retrográdnej cholangiopankreatikografie alebo ako ich znížiť na najmenšiu možnú mieru
- Aldosteron jako endogenní kardiovaskulární toxin a možnosti jeho terapeutického ovlivnění
- Potrebujeme ešte endoskopickú skleroterapiu pažerákových varixov alebo posledný nech zhasne svetlo
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




