-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Sorafenib v léčbě hepatocelulárního karcinomu
Sorafenib in the treatment of hepatocellular carcinoma
Hepatocellular carcinoma (HCC) is the 5th most frequent tumour disease and, at the same time, the 3rd most frequent cause of death from cancer worldwide. More than 600 000 new patients are diagnosed every year and more than 80% are diagnosed at an advance stage where surgical treatment is not indicated and systemic chemotherapy does not provide longer survival time. Sorafenib is the first substance that provides proven significant prolongation of survival time of HCC patients. This is a multikinase inhibitor with anti-proliferative and anti-angiogenic properties. Its efficacy was shown in the SHARP study that enabled licensing of sorafenib for the therapy of inoperable, metastasizing hepatocellular carcinoma, including patients with liver cirrhosis, functional class Child-Pugh A or B, in more than 60 countries worldwide, including the Czech Republic. The aim of this paper is to provide a comprehensive summary of the current treatment of HCC and, at the same time, to point out some new therapeutic approaches that, in the near future, shall certainly play a major role in the treatment of HCC.
Key words:
hepatocellular carcinoma – SHARP study – sorafenib – biological treatment
Autori: G. Suchánková; J. Špičák
Pôsobisko autorov: Klinika hepatogastroenterologie IKEM Praha, přednosta prof. MUDr. Julius Špičák, CSc.
Vyšlo v časopise: Vnitř Lék 2011; 57(5): 485-490
Kategória: Přehledné referáty
Súhrn
Hepatocelulární karcinom (HCC) je celosvětově 5. nejčastější nádorové onemocnění a současně 3. nejčastější příčina úmrtí na nádorové onemocnění. Každoročně je diagnostikováno více než 600 000 nových případů onemocnění, přičemž více než 80 % je diagnostikováno v pokročilém stadiu, kdy již není chirurgická terapie indikována a systémová chemoterapie nevede k prodloužení doby přežití. První přelomovou látkou, která prokázala signifikantní prodloužení doby přežití u pacientů s HCC, je sorafenib. Jedná se o multikinázový inhibitor, který má antiproliferační a antiangiogenní vlastnosti a jehož účinnost byla prokázána ve studii SHARP. Na základě zmíněné studie bylo užívání sorafenibu schváleno ve více než 60 zemích světa včetně České republiky, a to pro terapii inoperabilního a metastazujícího hepatocelulárního karcinomu včetně pacientů s jaterní cirhózou funkční třídy Child-Pugh A nebo B. Cílem tohoto článku je poskytnout ucelený pohled na aktuální situaci v terapii HCC, ale současně poukázat i na další potenciální terapeutické postupy, které budou jistě hrát významnou roli v budoucnu.
Klíčová slova:
hepatocelulární karcinom – studie SHARP – sorafenib – biologická terapieÚvod
Etiologie
V naprosté většině případů (90 %) vzniká hepatocelulární karcinom (HCC) na podkladě jaterní cirhózy, z toho v 75–80 % na podkladě cirhózy C nebo B. Prevalence kolísá dle geografického rozložení – v USA, Evropě a Japonsku dominuje cirhóza C, v Asii a Africe cirhóza B. V 10–20 % se na vzniku cirhózy podílí alkohol, zbylých asi 10 % představují ostatní příčiny. Cirhóza C a B patří mezi onemocnění s vysokou incidencí vzniku HCC (tj. přes 15 %), přičemž riziko se zvyšuje při souběžném abúzu alkoholu. Mezi onemocnění s vysokou incidencí HCC patří i hemochromatóza a porfyria cutanea tarda. Samotnou etylickou cirhózu řadíme mezi onemocnění se střední incidencí HCC, nízkou incidenci pak zaujímá autoimunitní hepatitida, Wilsonova choroba či primární biliární cirhóza.
Diagnostika
Vzhledem k tomu, že většina HCC vzniká na podkladě chronického jaterního onemocnění a šance na přežití je nepřímo úměrná pokročilosti choroby, doporučují se screeningové programy, jejichž cílem je včasné odhalení HCC, a tím i snížení mortality. Screeningové vyšetření by měli podstupovat nejen pacienti s již diagnostikovanou cirhózou, ale i pacienti s chronickou hepatitidou B a C, protože i oni jsou zatíženi zvýšeným rizikem vzniku HCC a přechod do cirhózy nelze vždy přesně určit. Screeningová vyšetření zahrnují stanovení nádorového markeru α-fetoproteinu (AFP) a vyšetření ultrazvukem, nejčastěji v 6měsíčních intervalech [1–4].
V případě nálezu ložiska závisí další postup na jeho velikosti. Při velikosti ložiska nad 2 cm s arteriální hypervaskularizací, které je shodné nejméně na 2 zobrazovacích metodách, je pozitivní predilekční hodnota HCC 95 %. Pokud je nález pouze na jedné zobrazovací metodě, je k diagnóze HCC zároveň nutná elevace AFP nad 200 ng/ ml. V případě atypické léze či nálezu ložiska v necirhotických játrech je nutno provést cílenou biopsii k verifikaci. Tento postup se doporučuje i u ložisek o velikosti 1–2 cm. Vzhledem k tomu, že je výtěžná jen pozitivní biopsie, dochází v poslední době k odklonu od histologické verifikace a k diagnóze HCC slouží zobrazovací metody (jejich kombinace) a stanovení hladiny AFP. Při nálezu léze menší než 1 cm je pravděpodobnost, že se jedná o HCC, malá. U těchto pacientů bychom měli aplikovat i další zobrazovací metody k vyloučení sonograficky nezobrazeného jaterního postižení. Při vyloučení rozsáhlejšího postižení je indikováno pravidelné sonografické sledování v intervalu 3 měsíců se souběžným stanovením AFP. Pakliže se ložisko během 2 let nezvětšuje, pokračuje se ve standardním screeningovém programu jako u ostatních pacientů.
Stadia HCC
Ke stanovení dalšího léčebného postupu se užívají různá klasifikační schémata. Jedním z nich je i tzv. Barcelonská klasifikace [5], která byla užita ve studii SHARP a řídí se jí i další diagnostický a terapeutický postup. Dle této klasifikace dělíme HCC do 5 stadií (tab. 1).
Terapie HCC
Léčba velmi časného a časného stadia
Metodou první volby je chirurgická léčba (schéma 1). Resekce je indikována u pacientů se solitárním ložiskem s dobrou jaterní funkcí a bez přítomnosti portální hypertenze. Nutno podotknout, že resekce je v době stanovení diagnózy schopno jen asi 15–30 % pacientů. Výsledky resekční léčby jsou celkem uspokojivé. Perioperační mortalita nepřesahuje 3 % a 5leté přežití dosahuje minimálně 50 % [6]. Transplantaci jater (OLT) zvažujeme u pacientů splňujících tzv. Milánská kritéria, tj. u pacientů s cirhózou s jedním ložiskem do 5 cm nebo maximálně 3 ložisky do 3 cm. V některých transplantačních centrech se používají i extendovaná UCSF kritéria (University of California, San Francisco), která jsou charakterizována buď jedním uzlem do 6,5 cm, nebo maximálně 3 uzly do 4,5 cm, přičemž jejich celkový součet nesmí překročit 8 cm. Tato kritéria se používají i na našem pracovišti, přičemž platí nutnost provést biopsii nádoru. V případě nedostatečné diferenciace tumoru není pacient k transplantaci indikován. Doba přežití po transplantaci jater je delší než po resekčních výkonech (5leté přežití se pohybuje kolem 70 %). Transplantace jater je u HCC považována za jedinou kurativní metodu, i když i zde dochází k rekurenci.
Schéma 1. Skórovací systém BCLC. 
Perkutánní radiofrekvenční ablace (RFA) je vhodná pro léze o velikosti do 5 cm, kde není operace z jiných důvodů možná. Cílem je ablace minimálně 75 % tkáně tumorózního ložiska, jinak je výkon nedostatečný. Optimální je ablace veškeré patologické tkáně s přesahem 1 cm do zdravého parenchymu. Metodou nejčastěji srovnávanou s RFA je perkutánní ethanolizace (PEI). Ve 4 randomizovaných studiích byla prokázána lepší odpověď na RFA (90–96 % RFA vs 80–88 % u PEI, navíc RFA prodlužuje dobu celkového přežití) [7]. Limitací výkonu je vedle velikosti ložiska jeho lokalizace (nebezpečí tepelného poranění sousedících struktur, např. žlučníku).
Léčba středně pokročilého HCC
Zde je indikována transarteriální chemoembolizace (TACE), která sice prodlužuje dobu přežití, ale její dlouhodobé výsledky jsou neuspokojivé. Kontraindikací je extrahepatální šíření nádoru a makroskopická vaskulární invaze. Používá se buď samostatně, nebo v kombinaci s chemoterapií (doxorubicin, cisplatina). TACE může být také použita u pacientů přesahujících Milánská kritéria k „downstagingu“ a následné transplantaci jater.
Léčba pokročilého stadia HCC
Donedávna byla indikována pouze systémová terapie, nejčastěji s doxorubicinem. V monoterapii byla její účinnost jen 10 %, v kombinační terapii s 5-fluorouracylem (5-FU) se pohybovala kolem 24 %. Ostatní látky jako např. cisplatina, epirubicin, interferon, irinotekan, paklitaxel, octreotid a gemcitabin vykazovaly minimální statisticky nevýznamnou odpověď (do 15 %). Nejlepších výsledků bylo dosaženo ve studii s mitoxantronem (27 %), která je kritizována kvůli nízkému počtu zařazených pacientů. Chemoterapie vykazuje u HCC velmi špatnou léčebnou odpověď a nikdy neprokázala prodloužení celkového přežití [8].
Sorafenib
Mechanizmus účinku
Sorafenib je multikinázový inhibitor, který má antiproliferační a antiangiogenní vlastnosti (obr. 1). Proliferace nádorových buněk je z velké části zajišťována mitogenní signální cestou prostřednictvím proteinkináz aktivovaných mitogeny (MAPK). Klíčovým a také prvním prvkem této cesty, která vede k nádorovému růstu, je Raf serin/threonin kináza. Sorafenib inhibuje kinázovou aktivitu RAF-1, ale i B-Raf („wild type“ a V600E mutaci), stejně tak jako MEK a ERK fosforylaci. Za primární mediátor angiogeneze je považován vaskulární endoteliální růstový faktor (VEGF), který účinkuje prostřednictvím VEGF receptorů na povrchu endoteliálních buněk. Zvyšuje mikrovaskulární permeabilitu, indukuje dělení a migraci endoteliálních buněk a současně je ochraňuje před apoptózou a stárnutím. Sorafenib inhibuje aktivaci jednak kináz v celé MAPK signální dráze, ale také tyrozinkinázy receptorů pro endoteliální růstový faktor 1, 2 a 3. Kromě toho inhibuje destičkový růstový faktor (PDGF) a fibroblastový růstový faktor (FGF), c-Kit, Flt-3 a p38α [9,10]. Díky těmto mechanizmům působí sorafenib inhibičně na nádorové buňky jak prostřednictvím ovlivnění nádorové angiogeneze, tak svým přímým antiproliferačním efektem. Předpovědním markerem pozitivní klinické odpovědi na sorafenib je fosforylovaná forma extracelulární kinázy (p-ERK), která hraje důležitou roli v RAF/MEK/ERK signální dráze, která je cílem sorafenibu. Aktivace této signální cesty zvyšuje hladinu p-ERK, což značí, že proliferace nádorových buněk, a tím i možnost pozitivní klinické odpovědi, je závislá na této signální dráze, a tedy i na terapii sorafenibem [11].
Obr. 1. Mechanizmus účinku sorafenibu. 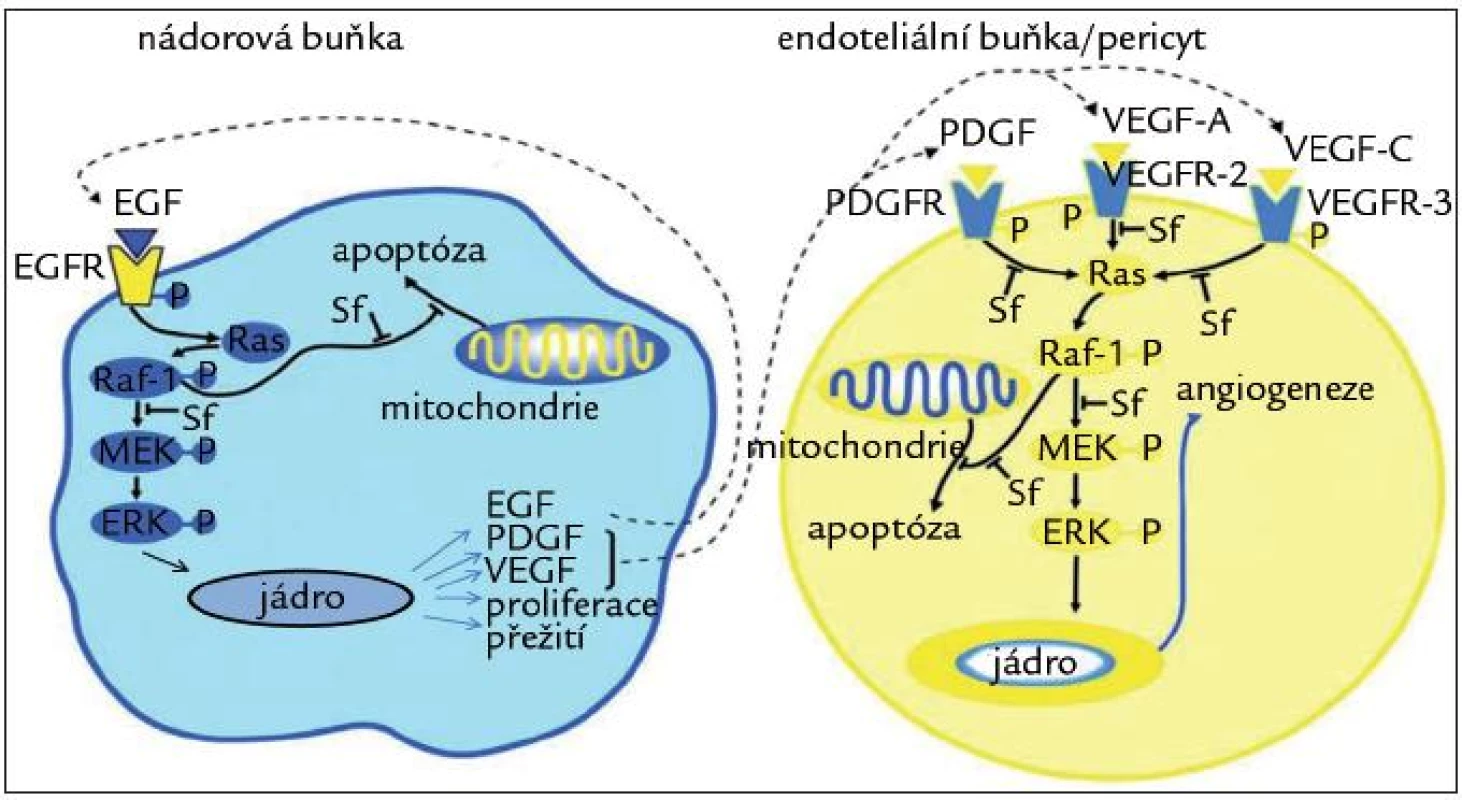
Nežádoucí účinky
Jedním z nejčastějších nežádoucích účinků léčby sorafenibem je hypertenze. Přesný mechanizmus tohoto efektu není znám, ale předpokládá se, že jeho podstatou je přímý vliv na svalovinu cévní stěny. Dalším nežádoucím účinkem je kožní reakce na dlaních a chodidlech, tzv. hand-foot syndrom. Vyskytuje se až v 21 % případů, přičemž změny kolísají od minimálních kožních změn (erytému) až po těžké, velmi bolestivé změny se ztrátou funkce kůže. V prvním případě není nutné měnit dávkování sorafenibu. Aplikují se podpůrná opatření (hydratační krémy, event. krémy s kortikoidy, vyloučení přímého slunečního svitu). V těžších případech je nutné přerušit podávání preparátu a po zlepšení pokračovat, nejprve v redukované dávce. Mezi další nežádoucí účinky patří průjem, alopecie, změny hlasu, hypofosfatemie a trombocytopenie. Celkový bezpečnostní profil sorafenibu se nicméně jeví jako výhodný a nejčastěji výše uvedené nežádoucí účinky jako přijatelné, takže prospěch z terapie převyšuje rizika s ní spojená.
Klinické studie
Účinnost sorafenibu byla potvrzena v několika studiích. Přelomovou byla studie SHARP [12]. Jednalo se o multicentrickou, dvojitě zaslepenou, randomizovanou a placebem kontrolovanou studii fáze III (Sorafenib Hepatocellular Carcinoma Assessment Randomized Protocol). Byla hodnocena účinnost kontinuálního podávání sorafenibu v dávce 400 mg 2krát denně u pacientů s pokročilým, neresekabilním hepatocelulárním karcinomem bez předchozí systémové léčby. Na základě výsledků studie SHARP byl sorafenib schválen v léčbě v monoterapii u pokročilého hepatocelulárního karcinomu v Evropě i USA. Studie se účastnilo 602 pacientů (sorafenib: 299, placebo: 303). Jednalo se o pacienty s cirhózou funkční klasifikace Child-Pugh A, ECOG (Eastern Cooperative Oncology Group) PS 0–2 a s předpokládanou dobou přežití alespoň 12 týdnů. Pacienti neprodělali žádnou předchozí systémovou terapii a jen asi 1/2 podstoupila lokoregionální léčbu. Primárním cílem této studie bylo hodnocení doby přežití a doby do symptomatické progrese. Sekundárním cílem byla doba do radiologické progrese, kontrola onemocnění (kompletní či parciální odpověď) a bezpečnost. Studie SHARP byla předčasně ukončena pro výrazně lepší přežití v „sorafenibové“ skupině. Medián přežití se prodloužil ze 7,9 měsíce v placebové skupině na 10,7 měsíce ve skupině se sorafenibem. Jednoroční přežití činilo 44 % v sorafenibové vs 33 % v placebové skupině (graf 1). Další primární cíl, tj. porovnání doby do symptomatické progrese, sice nepřinesl signifikantní rozdíly, ale byly splněny výše uvedené sekundární cíle – porovnání doby do radiologické progrese (5,5 vs 2,8 měsíce) a kontrola onemocnění (43 % vs 32 %). Přestože pozitivních výsledků bylo dosaženo na účet zejména pacientů Child-Pugh A, v dalších studiích fáze II a III prokázal sorafenib srovnatelnou klinickou účinnost a bezpečnost i u pacientů Child--Pugh B. Výsledky studie SHARP byly potvrzeny i ve studii Asia-Pacific (multicentrická, mezinárodní, dvojitě zaslepená a placebem kontrolovaná studie fáze III u asijsko-pacifické populace) [13]. Bylo tedy prokázáno, že sorafenib prodloužil dobu celkového přežití bez ohledu na klasifikaci Child--Pugh A nebo B, skóre ECOG PS (0–2), přítomnost či nepřítomnost makrovaskulární invaze či extrahepatálního šíření a bez ohledu na rasu, pohlaví, etiologii či předchozí terapii.
Rekurence HCC po OLT
Samostatnou kapitolou je rekurence HCC po OLT. Při dodržování tzv. Milánských kritérií kolísá mezi 8–20 % [14] a 5leté přežití pacientů po OLT pro HCC je dnes prakticky na stejné úrovni jako u pacientů po OLT s jinou diagnózou. Samozřejmě záleží na velikosti primárního tumoru, počtu ložisek, přítomnosti či nepřítomnosti mikroangioinvaze a stupni diferenciace nádoru. Rekurence má pochopitelně výrazný negativní dopad na přežití, medián do rekurence je asi 24 měsíců. Může dojít k rekurenci v játrech, případně v kombinaci se vzdálenými metastázami (70 %). Nejčastěji postiženým extrahepatickým orgánem jsou plíce a poté skelet.
U pacientů s izolovanou intrahepatální rekurencí by se měla na prvním místě zvažovat resekce. Po resekci R0 bylo prokázáno signifikantně delší 5leté přežití než u pacientů neoperovaných (27 % vs 0 %) [14]. I po resekci je bez dalších opatření dlouhodobé riziko rekurence 50 %. Z těchto výsledků vyplývá, že pacienti po OLT pro HCC s rekurencí tumoru by měli být léčeni i systémově. Pokud jde o imunosupresi, měli by být všichni pacienti po transplantaci jater pro HCC okamžitě převedeni z kalcineurinových inhibitorů na mTOR inhibitory, a to pro jejich antiproliferační efekt [15]. U pacientů s rekurencí HCC ve štěpu bylo prokázáno, že souběžné podávání sorafenibu a mTOR inhibitorů prodlužuje jejich přežití. Tato terapie by měla být určena jak pro pacienty podstupující resekci, tak pro pacienty neoperabilní. Zdá se, že efekt sorafenibu potencuje souběžné podávání erlotinibu, ale k validaci těchto údajů jsou zapotřebí další studie.
Nové postupy
V současné době probíhají i další klinické studie fáze I–III, které směřují nejen k indikačnímu rozšíření sorafenibu, ale zkoumají i nové možnosti biologické terapie, ať již izolovaně či v kombinaci.
Jednou z nich je studie SPACE (Sorafenib or Placebo in Combination with TACE for intermediate stage HCC) [16]. Jedná se o randomizovanou, dvojitě zaslepenou a placebem kontrolovanou studii fáze II, která zkoumá sorafenib v kombinaci s TACE (provedené pomocí DC Bead techniky s doxorubicinem) u středně pokročilého HCC. Jsou indikováni pacienti s neresekabilním, multinodulárním HCC, Child-Pugh A a ECOG PS 0. Primárním cílem je čas do progrese, sekundárním doba přežití, doba do vaskulární invaze a do extrahepatického šíření. Ukončení je plánováno na květen roku 2011. Studie STORM (Sorafenib as adjuvant Treatment in the preventiv Of Recurence of hepatocellular carcinoMa) [16], mezinárodní, dvojitě zaslepená a placebem kontrolovaná studie fáze III hodnotí adjuvantní podávání sorafenibu u pacientů po předchozí resekci, radiofrekvenční ablaci a ethanolizaci s cílem posoudit vliv na jinak vysokou rekurenci (po RFA dosahuje až 85 %) [17].
Studie GIDEON (Global Investigation of Therapeutic DEcisions in Hepatocellular Carcinoma and Of its Treatment with SorafenNib) je právě probíhající mezinárodní multicentrická otevřená studie fáze IV, hodnotící bezpečnost a účinnost sorafenibu v různých podskupinách nemocných [18]. Vzhledem k tomu, že většina dat o příznivé účinnosti sorafenibu pochází od pacientů Child-Pugh A, je tentokrát cílem sledovat bezpečnost u pokročilejší jaterní dysfunkce. Recentně byla zahájena studie STEP (Sorafenib Long Term Extension Program) zaměřená na dlouhodobou bezpečnost.
Podáváním s jinými preparáty se zabývá studie fáze II s kombinací sorafenibu a tegafur/uracilu [19]. Zdá se, že tato kombinace zvyšuje efekt sorafenibu. Ten je také zkoumán v kombinovaném podání s doxorubicinem v randomizované studii fáze II. Předběžné výsledky jsou povzbudivé. Medián doby do progrese je podle této studie 8,5 měsíce a medián celkového přežití 14 měsíců.
Na povrchu buněk HCC jsou exprimovány EGF receptory a právě možnost jejich zablokování je jedním z dalších možných léčebných přístupů. Patří sem jednak monoklonální protilátky, blokující extracelulární doménu, jako cetuximab (v izolovaném podávání nebyl prokázán žádný efekt, nicméně v kombinaci s gemcitabinem a oxaliplatinou může být přínosný) nebo látky, které inhibují intracelulární tyrozinkinázovou doménu, např. erlotinib. Erlotinib se užívá v terapii nemalobuněčného plicního karcinomu. Jedná se o derivát chinazolinu, který se reverzibilně váže na intracelulární doménu receptoru pro epidermální růstový faktor [20]. Studie SEARCH zkoumá kombinované podávání sorafenibu s erlotinibem vs izolované podávání sorafenibu [16].
Další léčebnou možností je bevacizumab, což je rekombinantní monoklonální protilátka proti VEGF. V monoterapii neprokázala větší benefit, ale v kombinaci s erlotinibem byl medián přežití 19 měsíců a medián doby do symptomatické progrese 9 měsíců [21,22]. Tyto slibné výsledky musí být potvrzeny i v dalších randomizovaných kontrolovaných studiích. Data z aktuálně probíhající studie fáze I, zkoumající současné podávání sorafenibu s bevacizumabem, jsou sice prozatím velice slibná (až 59% odpověď), ale za cenu vysoké toxicity [23].
Novou studií zahájenou v březnu roku 2010 je studie BRISK FL [16]. Jedná se mezinárodní, randomizovanou dvojitě zaslepenou studii fáze III, která porovnává účinek sorafenibu a nové látky – brivanibu (inhibitor tyrozinkinázy).
Další zajímavou látkou je sunitinib. Je to perorální multikinázový inhibitor, který se užívá v terapii karcinomu ledviny a gastrointestinálních stromálních tumorů. Nyní byl zkoumán i ve studii fáze II u pokročilého HCC. Účinek byl povzbudivý, nicméně byla popsána i vysoká toxicita. Po redukci dávky byl bezpečnostní profil již únosný a další posun je očekáván od randomizované studie fáze III, která porovnává klinický efekt sunitinibu a sorafenibu [24]. Bylo zjištěno, že vyšší hladiny prozánětlivých markerů jako IL-6 predikují horší výsledek terapie [23].
Terapie HCC se ale ubírá i dalšími směry. Jedním z nich je lokoregionální terapie s užitím radioaktivního 90Yttria, tzv. SIRT (selective internal radiotherapy) [25,26]. Je to v podstatě radioembolizační metoda, jejímž cílem je aplikace nebiodegradabilních mikročástic potažených 90Yttriem (SIR – spheres) cestou hepatické artérie do nádorové tkáně. Ty jsou pak zachyceny v kapilárním řečišti, a dochází tak selektivně k vyššímu ozáření tumoru, zatímco normální jaterní parenchym je šetřen. Tato metoda je vhodná pro pacienty s neresekabilním HCC a dobrou jaterní funkcí. Tolerance této metody je vcelku dobrá, ale i zde byly samozřejmě pozorovány nežádoucí účinky, nejčastěji jako důsledek toxického radioaktivního poškození okolních orgánů, např. cholecystitida nebo gastrointestinální ulcerace. Dle studií fáze I a II byl prokázán signifikantní efekt na velikost tumoru, ale i prodloužení mediánu přežití oproti kontrolní skupině [27]. Při užití SIRT docházelo, ve srovnání s ostatními lokoregionálními metodami, i k význačnějšímu poklesu AFP, které bylo současně i markerem lepší klinické odpovědi na terapii a značilo výraznější prodloužení přežití.
Shrnutí
V systémové terapii pokročilého HCC je sorafenib pro pacienty velkým přínosem. Předchozí systémová chemoterapie neprokázala prodloužení celkového přežití. Na základě výsledků studie SHARP byl sorafenib schválen ve více než 60 zemích světa a je indikován jako terapie první volby v léčbě inoperabilního nebo metastazujícího hepatocelulárního karcinomu u pacientů s funkční třídou Child-Pugh A nebo B [28].
V budoucnu se jistě rozroste jeho užití i v terapii méně pokročilého HCC v kombinaci s chirurgickou terapií ve snaze snížit rekurenci.
Jak vypovídají výše uvedené studie, hlavní roli bude hrát kombinovaná biologická terapie využívající principy individuální farmakogenetiky – ať již ve formě „horizontální“ blokády s užitím látek účinkujících pomocí rozdílných signálních cest, nebo formou „vertikální“, jejímž cílem bude víceúrovňové zablokování té samé signální cesty. Takto personalizované kombinace látek „šité na míru“, které budou účinkovat pomocí různých buněčných mechanizmů, zvýší klinickou odpověď a současně sníží vedlejší nežádoucí účinky.
Seznam zkratek
- AFP – α-fetoprotein
- BCLC – Barcelona Clinic Liver Cancer
- ECOG – Eastern Cooperative Oncology Group
- EGF – endoteliální růstový faktor
- EGFR – receptor pro endoteliální růstový faktor
- FGFR – receptor pro fibroblastový růstový faktor
- HCC – hepatocelulární karcinom
- MAPK – mitogeny aktivovaná proteinkináza
- OLT – orthotopic liver transplantation
- p-ERK – fosforylovaná forma extracelulární kinázy
- PEI – perkutánní etanolizace
- PDGF – destičkový růstový faktor
- PS – performance status
- Raf-1, B-raf, Ras, C-kit, Flt-3, MEK, p38α (SAPK2) – serin/treonin kinázy patřící do skupiny proteinkináz aktivovaných mitogeny
- RFA – radiofrekvenční ablace
- Sf – sorafenib
- SIRT – selective internal radiotherapy
- TACE – transarteriální chemoembolizace
- TGF-α – transformující růstový faktor
- VEGF – vaskulární endoteliální růstový faktor
- VEGFR – receptor pro vaskulární endoteliální růstový faktor
MUDr. Gabriela Suchánková
www.ikem.cz
e-mail: gabriela.suchankova@ikem.czDoručeno do redakce: 20. 10. 2010
Přijato po recenzi: 29. 11. 2010
Zdroje
1. Bruix J, Sherman M. Practice Guidelines Committee, American Association for the Study of Liver Diseases. Management of hepatocellular carcinoma. Hepatology 2005; 42 : 1208–1236.
2. Jelic S. ESMO Guidelines Working Group. Hepatocellular carcinoma: ESMO Clinical Recommendations for diagnosis, treatment and follow-up. Ann Oncol 2009; 20 (Suppl 4): 41–45.
3. Gish RG, Marrero JA, Benson AB. A multidisciplinary approach to the management of hepatocellular carcinoma. Gastroenterol Hepatol (NY) 2010; 6 (3 Suppl 6): 1–16.
4. Brůha R, Drastich P, Hůlek P. Diagnostika a léčba hepatocelulárního karcinomu. Vnitř Lék 2005; 12 : 1406–1408.
5. Llovet JM, Brú C, Bruix J. Prognosis of hepatocellular carcinoma: the BCLC staging classification. Semin Liver Dis 1999; 19 : 329–338.
6. Asmis T, Balaa F, Scully L et al. Diagnosis and management of hepatocellular carcinoma: results of a consensus meeting of The Ottawa Hospital Cancer Centre. Curr Oncol 2010; 17 : 6–12.
7. Marrero JA. Applications and Limitations of Surgical and Regional Therapeutic Techniques. Clinical Roundtable Monograph 2010.
8. Furuse J. Sorafenib for the treatment of unresectable hepatocellular carcinoma. Biologics 2008; 2 : 779–788.
9. Bartoš J. Sorafenib. Remedia 2008; 4 : 273–282.
10. Spangenberg H, Thimme R, Blum H. Evolving therapies in the treatment of hepatocellular carcinoma. Biologics 2008; 2 : 453–462.
11. Benson AB. Systemic Therapy for Advanced Stage Hepatocellular carcinoma. Clinical Roundtable Monograph 2010.
12. Llovet JM, Ricci S, Mazzaferro V et al. SHARP Investigators Study Group. Sorafenib in advanced hepatocellular carcinoma. N Engl J Med 2008; 359 : 378–390.
13. Cheng AL, Kang YK, Chen Z et al. Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma: a phase III randomised, double-blind, placebo-controlled trial. Lancet Oncol 2009; 10 : 25–34.
14. Valdivieso A, Bustamante J, Gastaca M et al. Management of Hepatocellular Carcinoma Recurrence After Liver Transplantation. Transplant Proc 2010; 42 : 660–662.
15. Yuan R, Kay A, Berg WJ et al. Targeting tumorigenesis: development and use of mTOR inhibitors in cancer therapy. J Hematol Oncol 2009; 2 : 45.
16. Clinical Trials.gov. http://www.clinicaltrials.gov.
17. Kudo M. Early detection and curative treatment of early-stage hepatocellular carcinoma. Clin Gastroenterol Hepatol 2005; 3 (10 Suppl 2): 144–148.
18. Lencioni R, Marrero J, Venook A et al. Design and rationale for the on-interventional Global investigation of Therapeutic DEcisions in Hepatocellular carcinoma and Of its Treatment with Sorafenib (GIDEON study). Int Clin Pract 2010; 64 : 1034–1041.
19. Hsu CH, Shen YC, Lin ZZ et al. Phase II study of combining sorafenib with metronomic tegafur/uracil for advanced hepatocellular carcinoma. J Hepatol 2010; 53 : 126–131.
20. Fínek J. Erlotinib. Farmakoterapie 2005; 3 : 206–207.
21. Thomas MB, Morris JS, Chadha R et al. Phase II trial of the combination of bevacizumab and erlotinib in patients who have advanced hepatocellular carcinoma. J Clin Oncol 2009; 27 : 843–850.
22. Skelton MR, O’Neil B. Targeted therapies for hepatocellular carcinoma. Clin Adv Hematol Oncol 2008; 6 : 209–218.
23. Siegel AB, Olsen SK, Magun A et al. Sorafenib: Where Do We Go From Here? Hepatology 2010; 52 : 360–369.
24. Koeberle D, Montemurro M, Samaras P et al. Continuous Sunitinib treatment in patients with advanced hepatocellular carcinoma: a Swiss Group for Clinical Cancer Research (SAKK) and Swiss Association for the Study of the Liver (SASL) multicenter phase II trial (SAKK 77/06). Oncologist 2010; 15 : 285–292.
25. Van De Wiele C, Defreyne L, Peeters M et al. Yttrium-90 labelled resin microspheres for treatment of primary and secondary malignant liver tumors. Q J Nucl Med Mol Imaging 2009; 53 : 317–324.
26. Hilgard P, Müller S, Hamami M et al. Selective internal radiotherapy (radioembolization) and radiation therapy for HCC – current status and perspectives. Z Gastroenterol 2009; 47 : 37–54.
27. Sangro B, Bilbao JI, Iñarrairaegui M et al. Treatment of hepatocellular carcinoma by radioembolization using 90Y microspheres. Dig Dis 2009; 27 : 164–169.
28. Česká onkologická společnost ČLS JEP. www.linkos.cz.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2011 Číslo 5- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Co přináší našim pacientům katetrizační ablace u fibrilace síní? – editorial
- Co způsobuje pokles úmrtnosti na ischemickou chorobu srdeční? – editorial
- Co způsobuje pokles úmrtnosti na ischemickou chorobu srdeční? – editorial
- Idiopatická retroperitoneální fibróza – editorial
- Porucha syntézy cholesterolu a jeho prekurzorů u klinicky závažných stavů
- Terapie kritické končetinové ischemie u pacientů se syndromem diabetické nohy pomocí autologních kmenových buněk
- Zlepšení kvality života po ablaci dlouhodobě perzistentní versus paroxysmální fibrilace síní: výsledky dvouletého sledování
- Změny krevních lipidů při dlouhodobé antiretrovirové léčbě
- Kardiotoxicita onkologické léčby
- Sorafenib v léčbě hepatocelulárního karcinomu
- Infekční komplikace u pacientů po srdeční zástavě při terapeutické hypotermii
- Snížení morbidity a mortality nemocných s chronickými formami ischemické choroby srdeční je výsledkem konzervativní léčby
- Faktory ovlivňující vznik a průběh kognitivních poruch u seniorů
- Sulodexid a nefrotický syndróm pri diabetickej nefropatii
- Ormondova choroba (idiopatická retroperitoneálna fibróza)
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Ormondova choroba (idiopatická retroperitoneálna fibróza)
- Kardiotoxicita onkologické léčby
- Faktory ovlivňující vznik a průběh kognitivních poruch u seniorů
- Porucha syntézy cholesterolu a jeho prekurzorů u klinicky závažných stavů
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy





