Terapie kritické končetinové ischemie u pacientů se syndromem diabetické nohy pomocí autologních kmenových buněk
Treatment of critical limb ischemia and diabetic foot disease by the use of autologous stem cells
Aim:
The aim of our study was to assess safety and efectiveness of therapy of critical limb ischaemia by autologous stem cells and evaluation of potential adverse events.
Methods:
Fourteen patients were included into the study (11 men, 3 women, mean age 61.9 ± 9.6 years, mean diabetes duration 23.5 ± 11.1 years, mean glycated hemoglobin 6 ± 1 %). Eight patients were treated by bone marrow stromal cells, 6 patients by peripheral blood progenitor cells after stimulation by filgrastim. The suspension of stem cells was then applied into the muscles of ischemic limbs. We evaluated transcutaneous oxygen tension (TcPO2), subjective pain sensation assessed by Visual Analog Scale (VAS) and wound healing.
Results:
TcPO2 significantly increased in all patients from 10 ± 8.7 mm Hg before the treatment to 39.4 ± 9.5 mm Hg after 6 months (p = 0.0005) after stem cell therapy. We also observed significant area defect reduction and pain decrease during the follow-up period. Median of area defect was reduced from 4.3 (0.7 – 31.7) before the treatment to 0.06 (0 – 0.5) cm2 after 6 months from the treatment (p = 0.0078). Decrease in rest pain was observed in all patients, mean VAS decreased from 5.3 ± 1.8 to 1.1 ± 1.3 after 6 months (p = 0.002).
Conclusion:
Our study suggests that stem cell therapy of diabetic foot disease is an effective therapeutic option with no adverse events for patients with severe peripehral arterial disease. This treatment leads to increase of transcutanous oxygen tension, improves wound healing and decreases the rest pain.
Key words:
stem cells – diabetic foot – peripheral arterial disease – revascularization
Autoři:
M. Dubský 1; A. Jirkovská 1; R. Bém 1; L. Pagáčová 2; V. Fejfarová 1; M. Varga 3; J. Skibová 5; Š. Langkramer 4; E. Syková 4
Působiště autorů:
Centrum diabetologie IKEM Praha, přednostka prof. MUDr. Terezie Pelikánová, DrSc.
1; Pracoviště laboratorních metod IKEM Praha, přednosta prof. MUDr. Antonín Jabor, CSc.
2; Klinika transplantační chirurgie IKEM Praha, přednosta prof. MUDr. Miloš Adamec, CSc.
3; Ústav experimentální medicíny AV ČR, v. v. i., ředitelka prof. MUDr. Eva Syková, DrSc.
4; Oddělení statistiky IKEM Praha
5
Vyšlo v časopise:
Vnitř Lék 2011; 57(5): 451-455
Kategorie:
Původní práce
Souhrn
Cíl:
Cílem naší práce bylo ověření bezpečnosti a účinnosti terapie kritické končetinové ischemie autologními kmenovými buňkami a posouzení případných nežádoucích účinků.
Metody:
Do studie bylo zařazeno 14 pacientů (11 mužů, 3 ženy, průměrný věk 61,9 ± 9,6 roku, průměrné trvání diabetu 23,5 ± 11,1 roku, průměrný glykovaný hemoglobin 6 ± 1 %). Osm pacientů bylo léčeno buňkami z kostní dřeně, 6 pacientů buňkami z periferní krve po stimulaci filgrastimem. Získaná suspenze kmenových buněk byla pak aplikována do svalů postižené dolní končetiny. Byl hodnocen vzestup hodnot transkutánní tenze kyslíku (TcPO2), subjektivní vnímání bolesti podle Visual Analog Scale (VAS) a hojení defektů.
Výsledky:
U všech pacientů došlo k signifikantnímu vzestupu TcPO2 z 10 ± 8,7 mm Hg před léčbou na 39,4 ± 9,5 mm Hg po 6 měsících (p = 0,0005) od aplikace. Dále byla pozorována signifikantní redukce plochy defektů a snížení bolesti, hodnocené VAS během sledovaného období: medián plochy defektu se snížil ze 4,3 (0,7–31,7) cm2 před léčbou na 0,06 (0–0,5) cm2 po 6 měsících od léčby (p = 0,0078). Snížení klidových bolestí bylo pozorováno u všech pacientů, průměrná hodnota VAS se snížila z 5,3 ± 1,8 před léčbou na 1,1 ± 1,3 po 6 měsících po aplikaci (p = 0,002).
Závěr:
Léčba syndromu diabetické nohy pomocí kmenových buněk je dle našich pilotních zkušeností u pacientů s těžkou ischemií dolních končetin účinnou metodou bez závažných nežádoucích účinků, která zvyšuje transkutánní tenzi kyslíku, zlepšuje hojení defektů a vede ke zmírnění klidových bolestí.
Klíčová slova:
kmenové buňky – diabetická noha – ischemie dolních končetin – revaskularizace
Úvod
Ischemická choroba dolních končetin (ICHDK) je jedním z nejvýznamnějších prognostických faktorů ovlivňujících hojení syndromu diabetické nohy a vede často k amputacím [1]. Diabetická makroangiopatie postihuje tepny dolních končetin multietážově, typicky vynechává proximální ileofemorální oblast a koncentruje se do oblasti tepen podkolenních. Diagnostika i terapie ICHDK u diabetu je velmi obtížná vzhledem k časté periferní polyneuropatii zmírňující nebo i eliminující typickou symptomatologii ICHDK. Mezi standardní léčebné metody ICHDK patří perkutánní transluminální angioplastika (PTA) a cévní bypassy, jejichž efekt je v některých případech pouze dočasný a dochází k recidivám klinických příznaků. Až 1/3 pacientů s ischemií dolních končetin není vhodná ke standardní revaskularizaci a může profitovat např. z terapie autologními kmenovými buňkami [2].
K terapeutické revaskularizaci ICHDK pomocí autologních kmenových buněk lze využít 2 základní zdroje, které obsahují subpopulaci cévních progenitorových buněk – mononukleární frakci stromálních buněk kostní dřeně získanou trepanobiopsií – bone marrow stromal cells (BMSC) a frakci jaderných buněk získanou separací z periferní krve po předchozí aplikaci faktoru stimulujícího kolonie granulocytů (G-CSF, filgrastim, NeupogenTM) – peripheral blood progenitor cells – PBPC. Dalším potenciálním zdrojem jsou mezenchymální buňky z tukové tkáně – mesenchymal adipose derived cells (MADC), s nimiž jsou zatím v klinické praxi léčby ICHDK velmi malé zkušenosti.
Mezi povrchové znaky buněk, které se podílejí na novotvorbě cév, se řadí povrchový glykoprotein CD34 [3], receptor pro endoteliální růstový faktor VEGFR2 [4] a povrchový znak CD133. Další povrchové znaky jsou stále předmětem výzkumu [5]. Cirkulující angiogenní prekurzory monocytární řady (CD14+) hrají důležitou roli v angiogenezi u pacientů s diabetem, u kterých často dochází k supresi CD34+ buněk [3].
Jak BMSC, tak PBPC byly opakovaně využity k revaskularizaci ischemických končetin v klinických studiích. Dosavadní zkušenosti s terapií ICHDK pomocí kmenových buněk jsou pozitivní [6–9].
Při novotvorbě cév se uplatňují 3 hlavní mechanizmy [10]. Prvním je angiogeneze, fyziologický děj, který je indukován hypoxií a vede k tvorbě nových kapilár z preexistujících cév. Podstatou tohoto procesu je proliferace a migrace endotelových buněk spojená s inhibicí apoptózy. Druhým mechanismem je arteriogeneze – proces remodelace preexistujících arterioarteriálních anastomóz v maturované arterii stimulovaný hydrostatickým tlakem při cévní obliteraci a zvýšení průtoku kolaterálami. Třetím procesem je de-novo formace cév, která je zatím nejméně prozkoumaným dějem; jedná se o tvorbu vnitřních endoteliálních vrstev s následným zráním arteriol vrstvou svalových buněk. Není zatím jasné, jakou roli hraje diferenciace a exprese jednotlivých růstových faktorů produkovaných autologními kmenovými buňkami při jejich intramuskulární aplikaci ani které typy dřeňových nebo periferních kmenových buněk jsou v procesu revaskularizace nejefektivnější.
Cílem naší práce bylo ověření bezpečnosti a účinnosti terapie kritické končetinové ischemie autologními kmenovými buňkami 2 různými metodami jejich izolace a posouzení případných nežádoucích účinků v případech individuálně indikované léčby pacientů se syndromem diabetické nohy a závažnou ICHDK, neřešitelnou standardní revaskularizací.
Metodika
Do hodnocení byli zařazeni pacienti s klinickými projevy ICHDK u syndromu diabetické nohy (bolesti končetin a/nebo defekty nebo stav po nízké amputaci) a s nedostatečným efektem nebo nemožností provést standardní revaskularizaci. Nedostatečný efekt byl definován jako přetrvávající ischemie stanovená transkutánní tenzí kyslíku pod 30 mm Hg nebo hodnotou indexů kotníkového tlaku pod 0,6 – tj. stupeň ischemie PEDIS 3 dle mezinárodní klasifikace [11]. Pacienti s recentní hlubokou žilní trombózou, těžkým otokem končetiny, závažnou neléčenou retinopatií nebo s diagnostikovaným neoplastickým postižením jakéhokoli orgánu nebyli k této léčby indikováni.
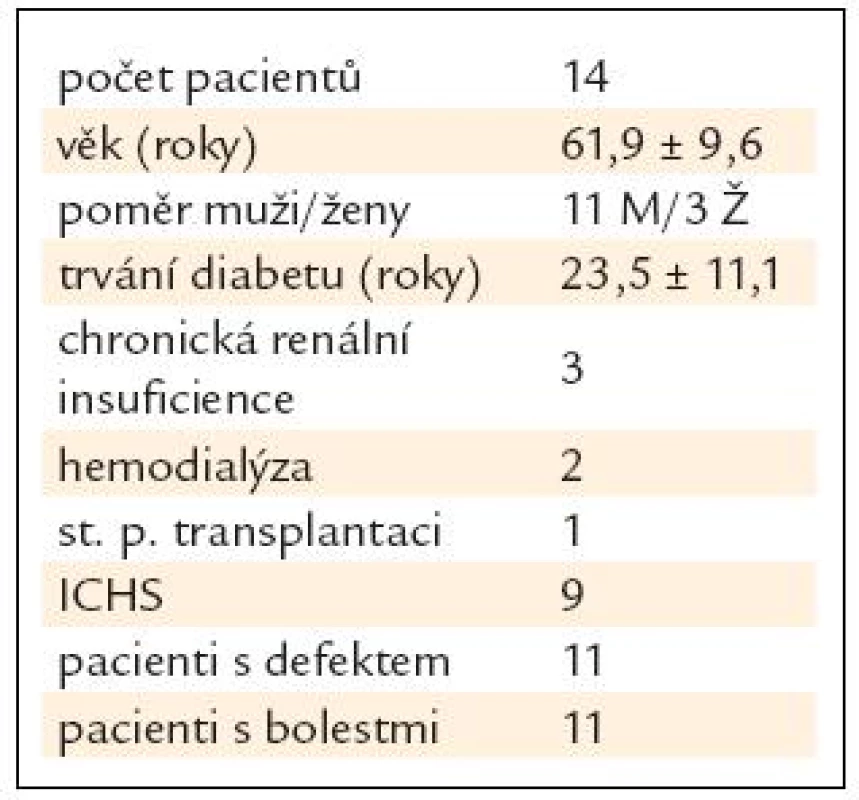
Celkem bylo zhodnoceno 14 pacientů léčených v podiatrické ambulanci IKEM od ledna roku 2008 do března roku 2010 (11 mužů, 3 ženy, průměrný věk 61,9 ± 9,6 roku, průměrné trvání diabetu 23,5 ± 11,1 roku, průměrný glykovaný hemoglobin 6 ± 1 %) (tab. 1). Všichni pacienti byli podrobně vyšetřeni z hlediska virologie a genetických poruch srážlivosti. Byl proveden onkologický screening, včetně mammografického a gynekologického vyšetření u žen.
Osm pacientů bylo léčeno pomocí BMSC; odběr kostní dřeně byl proveden na operačním sále ve svodné nebo celkové anestezii. Technika odběru byla provedena standardní metodou dle Jamshidiho – odběr se prováděl z obou lopat kostí kyčelních několika vpichy na každé straně. Odebraná kostní dřeň byla transportována do laminárního boxu, kde byla provedena urychlená sedimentace pomocí gelofusinu a centrifugace.
Šest pacientů bylo léčeno PBPC – pacientům byl po dobu 3–6 dnů podáván G-CSF (filgrastim, NeupogenTM) pro vyplavení buněk kostní dřeně do periferní krve. Po dosažení dostatečné koncentrace CD34 pozitivních buněk v periferní krvi byla provedena leukaferéza na autotransfuzní jednotce s použitím přístroje Haemonetics MCS+ v intermitentním režimu s opakovanými recirkulacemi a s končeným objemem buněčné suspenze 40–90 ml.
Získaná suspenze kmenových buněk byla pak v epidurální nebo celkové anestezii aplikována do svalů postižené dolní končetiny, nejčastěji do m. gastrocnemius v celém rozsahu, dále do svalů na dorzu a plantě postižené dolní končetiny. Po aplikaci byla provedena šetrná bandáž končetiny a zajištěna prevence flebotrombózy.
Následné sledování pacientů probíhalo v podiatrické ambulanci IKEM. V intervalech po 1 měsíci, 3 měsících a 6 měsících po aplikaci byla hodnocena transkutánní tenze kyslíku (TcPO2) a subjektivní vnímání bolesti s využitím Visual Analog Scale (VAS, stupnice bolesti 0–10). Hojení defektů bylo hodnoceno zkušenou podiatrickou sestrou. U prvních 6 pacientů byla provedena digitální subtrakční angiografie (DSA) s odstupem 2 měsíců od aplikace.
Výsledky
Během sledovaného období po 6 měsících od aplikace kmenových buněk došlo k signifikantnímu zlepšení ischemie dolních končetin hodnocené měřením TcPO2 na dorzu postižené dolní končetiny (graf 1). U všech pacientů došlo k vzestupu hodnot TcPO2 z 10 ± 8,7 mm Hg na 30,2 ± 16,5 mm Hg po 1 měsíci (p = 0,0004); 34,3 ± 9,1 mm Hg po 3 měsících (p = 0,0002) a 39,4 ± 9,5 mm Hg po 6 měsících (p = 0,0005) od aplikace.

Dále byla pozorována signifikantní redukce plochy defektů a snížení bolesti hodnocené VAS během sledovaného období. Medián plochy defektu byl 4,3 (0,7–31,7) cm2 před léčbou; 2,4 (0,2–23,4) cm2 po 1 měsíci (p = 0,002); 0,27 (0–13,2) cm2 po 3 měsících od léčby (p = 0,0039) a 0,06 (0–0,5) cm2 po 6 měsících od léčby (p = 0,0078) (graf 2). Snížení klidových bolestí bylo pozorováno u všech pacientů, průměrná hodnota VAS před léčbou, 5,3 ± 1,8, byla snížena na 3,9 ± 1,7 po 1 měsíci (p = 0,02); 1,9 ± 1,8 po 3 měsících (p = 0,002) a 1,1 ± 1,3 po 6 měsících (p = 0,002) (graf 3).


U 13 ze 14 pacientů došlo ke zlepšení lokálního nálezu na dolní končetině, u 1 pacienta bylo nutné 2 měsíce po aplikaci vzhledem k progresi infekce provést amputaci v bérci. Jeden pacient zemřel 3 měsíce po aplikaci na srdeční selhání bez souvislosti s léčbou kmenovými buňkami. Až na přechodný edém končetiny v 1. týdnu po aplikaci jsme dosud nezaznamenali závažnější vedlejší účinky.
Nález na DSA, hodnocený po aplikaci stejného množství kontrastní látky stejnou rychlostí zkušeným intervenčním radiologem, byl zlepšen u 1 pacienta, u ostatních 5 pacientů byl beze změny nebo nehodnotitelný, dále jsme v provádění kontrolních DSA nepokračovali z důvodů rizika, které bylo vyšší než potenciální přínos tohoto vyšetření z hlediska hodnocení kolaterál.
Diskuze
Výsledky našeho hodnocení individuální léčby závažné ischemie ukazují, že autologní kmenové buňky z kostní dřeně získané trepanobiopsií nebo separované z periferní krve po stimulaci mohou zlepšit ischemii končetin i hojení ulcerací a snížit bolest u pacientů se syndromem diabetické nohy.
V posledních letech bylo publikováno několik metaanalýz shrnujících výsledky klinických studií zabývajících se buněčnou terapií končetinové ischemie [9,10], z nichž vyplynulo, že léčba ischemie končetin kmenovými buňkami je účinnější než léčba samotným G-CSF, který ale může napomáhat léčbě infekce u pacientů se syndromem diabetické nohy [12].
Jedna z prvních randomizovaných studií publikovaná v Lancetu [6] hodnotila efekt terapie BMSC na ICHDK. 49 pacientů s ICHDK, definovanou jako index paže/kotník (ABI) < 0,6, s klidovými bolestmi nebo ulceracemi, bez možnosti další revaskularizace, bylo randomizováno do 2 skupin. Ve skupině A bylo 25 pacientů s převažující unilaterální ischemií; do ischemické končetiny byly aplikovány BMSC, do druhé (kontrolní) končetiny fyziologický roztok. Ve skupině B s bilaterální ischemií byly nohy pacientů randomizovány, do jedné nohy byly aplikovány BMSC, do druhé mononukleární frakce periferní krve. Následně bylo sledováno zlepšení klinického stavu, ABI, transkutánní tenze kyslíku (TcPO2) a nálezu na angiografii. Byla prováděna digitální subtrakční angiografie (DSA) se striktně fixovanou pozicí katetru a stejným množstvím kontrastní látky. Po 24 týdnech došlo k signifikantně vyššímu vzestupu ABI a TcPO2 u končetin léčených BSMC v porovnání s končetinami léčenými periferními mononukleárními buňkami (p < 0,0001). Angiografie byla zaslepeně hodnocena 2 radiology a jedním cévním chirurgem. Ke zlepšení angiografického nálezu došlo u 60 % ze 45 pacientů. Ke zmírnění klidové bolesti došlo u 80 % z 20 pacientů.
Jiná studie publikovaná v Diabetes Care [7] hodnotila účinek intramuskulární aplikace PBPC separovaných z periferní krve po stimulaci G-CSF. 28 pacientů s diabetem a kritickou končetinovou ischemií, definovanou jako klidové bolesti vyžadující analgetika, kotníkovým systolickým tlakem 50 mm Hg nebo palcovým tlakem 30 mm Hg s ulcerací nebo gangrénou, klasifikace dle Fontaina III nebo IV, bylo randomizováno na pacienty léčené PBPC a kontrolní skupinu (léčená Prostagalandinem E1 i.v.). Po 3 měsících došlo k signifikantnímu zvýšení průtoku měřenému laser dopplerem a k signifikantnímu zvýšení ABI u pacientů léčených PBPC. 78 % pacientů s ulcerací bylo zhojeno (vs 39 % u kontrolní skupiny). U pacientů léčených PBPC nedošlo po dobu 3měsíčního sledování k žádné amputaci, zatímco u kontrolní skupiny došlo k amputaci u 5 pacientů. Angiografický nález byl v porovnání s kontrolní skupinou signifikantně zlepšen.
Recentní metaanalýza z března roku 2010 [2] shrnula klinické studie zabývající se léčbou ICHDK kmenovými buňkami do ledna roku 2009 – bylo pozorováno zlepšení parametrů ischemie po 6 měsících od terapie kmenovými buňkami, a to jak transkutánní tenze kyslíku, tak dopplerovských indexů, snížení bolesti i zlepšení hojení ulcerací a snížení počtu amputací. Autoři dosud publikovaných prací se ale shodují v tom, že je nutné provádět další studie a pacienty sledovat dlouhodoběji [9]. Hypotetické nežádoucí účinky jako zhoršení diabetické retinopatie nebo akcelerace růstu tumorů nebyly pozorovány v žádné z dosud publikovaných klinických studií [10]. V České republice je v současné době léčba ICHDK pomocí autologních kmenových buněk v počátcích, byla aplikována pouze na několika pracovištích a zkušenosti s ní jsou na úrovni pilotních studií [13,14].
Nejnovější metaanalýza [15] shrnuje všechny preklinické a klinické zkušenosti s léčbou ICHDK pomocí kmenových buněk. Ve všech publikovaných randomizovaných a kontrolovaných studiích došlo ke zlepšení jak parametrů ischemie (ABI, TcPO2), tak ke zmírnění klidových bolestí, prodloužení klaudikačního intervalu a snížení incidence amputací dolních končetin. Několik multicentrických randomizovaných studií zabývajících se touto problematikou nyní probíhá.
Hlavní limitací naší studie je nízký počet pacientů v souboru, shrnujeme tedy pouze pilotní zkušenosti s touto novou léčebnou metodou ICHDK. Studie nebyla randomizována, jednalo se o individuální terapii pacientů bez možnosti standardní revaskularizační léčby. Mezi další limitace studií zabývajících se problematikou terapie ICHDK kmenovými buňkami patří obtížná objektivizace účinku pomocí zobrazovacích metod a dosud nejasný mechanizmus účinku autologních kmenových buněk.
Závěr
Léčba syndromu diabetické nohy pomocí kmenových buněk je dle našich zkušeností u pacientů s těžkou ischemií účinnou metodou bez závažných nežádoucích účinků, která zvyšuje transkutánní tenzi kyslíku, zlepšuje hojení defektů a vede ke zmírnění klidových bolestí. Nebyl zjištěn významný rozdíl mezi buňkami z kostní dřeně a periferní krve po stimulaci Optimální způsob klinické aplikace této metody i objektivní hodnocení účinku vyžaduje další studie.
Práce byla podpořena grantem MZO 00023001.
MUDr. Michal Dubský
www.ikem.cz
e-mail: michal.dubsky@ikem.cz
Doručeno do redakce: 6. 10. 2010
Přijato po recenzi: 3. 12. 2010
Zdroje
1. Jirkovská A. Ischemická choroba dolních končetin u pacientů s diabetem: Konzervativní terapie. In: Jirkovská A (ed.). Syndrom diabetické nohy. Praha: Maxdorf 2006; 161-165.
2. Fadini GP, Agostini C, Avogaro A. Autologous stem cell therapy for peripheral arterial disease: Meta-analysis and systematic review of the literature. Atherosclerosis 2010; 209 : 10-17.
3. Awad O, Dedkov EI, Jiao C et al. Differential healing activities of CD34+ and CD14+ endothelial cell progenitors. Arterioscler Thromb Vasc Biol 2006; 26 : 758-764.
4. Timmermans F, Van Hauwermeiren F, De Smedt M et al. Endothelial outgrowth cells are not derived from CD133+ cells or CD45+ hematopoietic precursors. Arterioscler Thromb Vasc Biol 2007; 27 : 1572-1579.
5. Matoba S, Matsubara H. Therapeutic Angiogenesis using Cell Transplantation (TACT) Study Investigators. Therapeutic angiogenesis for peripheral artery diseases by autologous bone marrow cell transplantation. Curr Pharm Des 2009; 15 : 2769-2777.
6. Tateishi-Yuayama E, Matsubara H, Murohara T et al. Therapeutic angiogenesis for patients with limb ischaemia by autologous transplantation of bone-marrow cells: a pilot study and a randomized controlled trial. Lancet 2002; 360 : 427-435.
7. Huang P, Li S, Han M et al. Autologous transplantation of granulocyte colony-stimulating factor-mobilized peripheral blood mononuclear cells improves critical limb ischemia in diabetes. Diabetes Care 2005; 28 : 2155-2160.
8. Al Mheid I, Quyyumi AA. Cell therapy in peripheral arterial disease. Angiology 2009; 59 : 705-716.
9. Attanasio S, Snell J. Therapeutic angiogenesis in the management of critical limb ischemia: current concepts and review. Cardiol Rev 2009; 17 : 115-120.
10. Wahlberg E. Angiogenesis and arteriogenesis in limb ischemia. J Vasc Surg 2003; 38 : 198-203.
11. Schaper NC. Diabetic foot ulcer classification system for research purposes: a progress report on criteria for including patients in research studies. Diabetes Metab Res Rev 2004; 20: S90-S95.
12. Gough A, Clapperton M, Rolando N et al. Randomised placebo-controlled trial of granulocyte-colony stimulating factor in diabetic foot infection. Lancet 1997; 350 : 855-859.
13. Procházka V, Gumulec J, Chmelová J et al. Autologous bone marrow stem cell transplantation in patients with end-stage chronical critical limb ischemia and diabetic foot. Vnitř Lék 2009; 55 : 173-178.
14. Dubský M, Jirkovská A, Bém R et al. Možnosti buněčné terapie v léčbě ischemické choroby dolních končetin u syndromu diabetické nohy. DMEV 2009; 12 : 128-132.
15. Lawall H, Bramlage P, Amann B. Stem cell and progenitor cell therapy in peripheral artery disease. A critical appraisal. Thromb Haemost 2010; 103 : 696-709.
Štítky
Diabetológia Endokrinológia Interné lekárstvoČlánok vyšiel v časopise
Vnitřní lékařství

2011 Číslo 5
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Hydroresponzivní krytí v epitelizační fázi hojení rány
- Co dělat při intoleranci statinů?
- Projekt MedPed
- Statiny indukovaná myopatie: Jak na diferenciální diagnostiku?
Najčítanejšie v tomto čísle
- Ormondova choroba (idiopatická retroperitoneálna fibróza)
- Kardiotoxicita onkologické léčby
- Faktory ovlivňující vznik a průběh kognitivních poruch u seniorů
- Porucha syntézy cholesterolu a jeho prekurzorů u klinicky závažných stavů
